RBSE Solutions for Class 11 Chemistry Chapter 5 द्रव्य की अवस्थाएँ
Rajasthan Board RBSE Solutions for Class 11 Chemistry Chapter 5 द्रव्य की अवस्थाएँ Textbook Exercise Questions and Answers.
Rajasthan Board RBSE Solutions for Class 11 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 11. Students can also read RBSE Class 11 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 11 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 11 Chemistry Solutions Chapter 5 द्रव्य की अवस्थाएँ
RBSE Class 11 Chemistry द्रव्य की अवस्थाएँ Textbook Questions and Answers
प्रश्न 5.1.
30° से. तथा 1 bar दाब पर वायु के 500 dm3 आयतन को 200 dm3 तक संपीडित करने के लिए कितने न्यूनतम दाब की आवश्यकता होगी?
उत्तर:
P1V1 = P2V2 (बॉयल के नियम के अनुसार )
P1 = 1 bar
P2 = ?
V1 = 500dm3
P2 = P1V1/V2
V2 = 200dm3
P2 = \(\frac{1(\text { bar }) \times 500\left(\mathrm{dm}^3\right)}{200 \mathrm{dm}^3}\)
= 2.5 bar.

प्रश्न 5.2.
35° से. ताप तथा 12 bar दाब पर 120 ImL धारिता वाले पात्र में गैस की निश्चित मात्रा भरी है। यदि 35° से. पर गैस 180 mL धारिता वाले फ्लास्क में स्थानांतरित किया जाता है, तो गैस का दाब क्या होगा?
उत्तर:
P1V1 = P2V2
P1 = 1.2 bar
P2 = ?
V = 120 mL,
V2 = 180mL
P2 = \(\frac{1.2(\mathrm{bar}) \times 120(\mathrm{~mL})}{180(\mathrm{~mL})}\)
0.8 bar.
प्रश्न 5.3.
अवस्था - समीकरण का उपयोग करते हुए स्पष्ट कीजिए कि दिए गए ताप पर गैस का घनत्व गैस के दाब के समानुपाती होता है।
उत्तर:
PV = nRT/v (आदर्श गैस समीकरण )
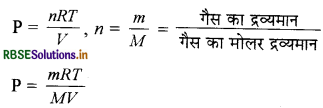
चूँकि d = m/V
अतः P = dRT/M या गैस का मोलर द्रव्यमान M = dRT/P
अतः d α P (R, T M स्थिर है ।) इससे सिद्ध होता है कि दिए गए ताप पर गैस का घनत्व, गैस के दाब के समानुपाती होता है।
प्रश्न 5.4
0°C पर तथा 2 bar दाब पर किसी गैस के ऑक्साइड का घनत्व 5 bar दाब पर डाइनाइट्रोजन के घनत्व के समान है, तो ऑक्साइड का अणु-भार क्या है?
उत्तर:
5 bar दाब पर गैस का घनत्व,
d1 = \(\frac{P_1 M_1}{R T}\)
P1 = 5 bar, M1 (N2) = 28 g mol-1
\(d_1=\frac{5(\mathrm{bar}) \times 28\left(\mathrm{~g} \mathrm{~mol}^{-1}\right)}{R T}\)
2 bar दाब पर गैस का घनत्व,
\(d_2=\frac{P_2 M_2}{R T}\)
P2 = 2 bar, M2 = ?
\(d_2=\frac{2(\mathrm{bar}) \times M_2\left(\mathrm{~g} \mathrm{~mol}^{-1}\right)}{R T}\)
प्रश्नानुसार d1 = d2
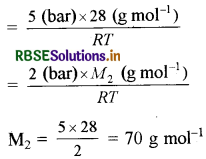

प्रश्न 5.5.
27° से. पर एक ग्राम आदर्श गैस का दाब 2 bar है जब समान ताप एवं दाब पर इसमें दो ग्राम आदर्श गैस मिलाई जाती है, तो दाब 3 bar हो जाता है। इन गैसों के अणु भार में संबंध स्थापित कीजिए।
उत्तर:
PV = nRT (आदर्श गैस समीकरण)
\(\begin{aligned} & \mathrm{P}=\frac{n R T}{V}, n=\frac{m}{M} \\ & \mathrm{P}=\frac{m R T}{M V} \end{aligned}\)
प्रथम स्थिति में MA = 1 ग्राम PA = 2 bar
\(\mathrm{P}_{\mathrm{A}}=\frac{m_{\mathrm{A}} \mathrm{RT}}{\mathrm{M}_{\mathrm{A}} \mathrm{V}}, 2=\frac{\mathrm{IRT}}{\mathrm{M}_{\mathrm{A}} \mathrm{V}}\) ....... (1)
द्वितीय स्थिति में:
\(\mathrm{P}_{\mathrm{B}}=\frac{m_{\mathrm{B}} \mathrm{RT}}{\mathrm{M}_{\mathrm{B}} \mathrm{V}}\) ......... (2)
PB = 3 - 2 = 1 bar, mB = 2 ग्राम
\(\mathrm{l}=\frac{2 \mathrm{RT}}{\mathrm{M}_{\mathrm{B}} \mathrm{V}}\)
समीकरण (1) व (2) की तुलना करने पर MB = 4MA
प्रश्न 5.6.
नाली साफ करने वाले ड्रेनेक्स में सूक्ष्म मात्रा में ऐलुमिनियम होता है। यह कास्टिक सोडा से क्रिया पर डाइहाइड्रोजन गैस देता है। यदि 1 bar तथा 20°C ताप पर 0.15 ग्राम ऐलुमिनियम अभिक्रिया करेगा, तो निर्गमित डाइहाइड्रोजन का आयतन क्या होगा?
उत्तर:
उपरोक्त प्रक्रम में निम्न अभिक्रिया होगी:
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
2 x 27 (2 मोल) 3 मोल
= 54 g
सन्तुलित समीकरण के अनुसार
54 g Al से उत्पन्न H2 = 3 मोल
0.15 g Al से उत्पन्न H2 = 3/24 × 0.15 = 8.33 × 10-3 mol
हाइड्रोजन गैस का आयतन
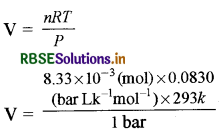
V = 0.20257 L = 202.5 mL
R = 0.0830bar Lk-1 mol-1
प्रश्न 5.7.
यदि 27°C पर 9dm धारिता वाले फ्लास्क में 3.2 ग्राम मेथेन तथा 4.4 ग्राम कार्बन डाइऑक्साइड का मिश्रण हो, तो इसका दाब क्या होगा?
उत्तर:
CH4 के मोल (n1) =

= 0.2 mol
CO2 के मोल (n2) = \(\frac{4.4(\mathrm{~g})}{44\left(\mathrm{~g} \mathrm{~mol}^{-1}\right)}\) = 0.1 mol
कुल मोल n = n1 + n2 = 0.2 + 0.1 = 0.3 mol
गैस समीकरण PV = nRT
T = 27°C + 273 = 300 k
\(\mathrm{P}=\frac{n R T}{V}\)
R = 8.314 Patm3 k-1 mol-1
\(=\frac{0.3(\mathrm{~mol}) \times 8.314\left(\mathrm{Patm}^3 \mathrm{k}^{-1} \mathrm{~mol}^{-1}\right) \times 300(\mathrm{k})}{9 \times 10^{-3}\left(\mathrm{~m}^3\right)}\)
V = 9dm3
= 9 × 10-3 m3
= 8.314 × 104 Pa

प्रश्न 5.8
27°C ताप पर जब 1 लीटर के फ्लास्क में 0.7 bar पर 2.0 लीटर डाइऑक्सीजन तथा 0.8 bar पर 0.5 L डाइहाइड्रोजन को भरा जाता है, तो गैसीय मिश्रण का दाब "क्या होगा?
उत्तर:
बॉयल के नियम के अनुसार PV = P2V2 (T = स्थिर)
O2 का आंशिक दाब, P2 = \(\frac{P_1 V_1}{V_2}=\frac{0.7 \mathrm{bar} \times 2.0 \mathrm{~L}}{1}\) = 1.4 bar
H2 का आंशिक दाब, P2 = \(\frac{P_1 V_1}{V_2}=\frac{0.8 \mathrm{bar} \times 0.5 \mathrm{~L}}{1}\) = 0.4 bar
कुल दाब, P = PO2 + PH2 = 1.4 + 0.4 = 1.8 bar.
प्रश्न 5.9.
यदि 27°C ताप तथा 2 bar दाब पर एक गैस का घनत्व 5.46 gdm3 है, तो STP पर इसका घनत्व क्या होगा?
उत्तर:
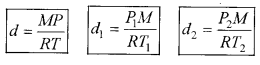
अतः
\(\frac{d_1 T_1}{P_1}=\frac{d_2 T_2}{P_2}\)
T1 = 273 + 27 = 300K, d = 5.46g dm3,
T2 (STP) = 0°C + 273 = 273 K
P1 = 2 bar, P2 = 1 bar
\(d_2=\frac{d_1 T_1 P_2}{P_1 T_2}=\frac{5.46 \mathrm{~g} \mathrm{dm}^3 \times 300 \mathrm{~K} \times 1 \mathrm{bar}}{2 \mathrm{bar} \times 273 \mathrm{~K}}\)
d2 = 3 g dm3
प्रश्न 5.10
यदि 546°C तथा 0.1bar दाब पर 34.05 ml फॉस्फोरस वाष्प का भार 0.0625g है, तो फॉस्फोरस का मोलर द्रव्यमान क्या होगा?
उत्तर:
PV= nRT (आदर्श गैस समीकरण)
n = m/M
PV = mRT/M
m = पदार्थ का द्रव्यमान 0.0625g
T = 546 + 273 = 819K
V = 34.05 mL = 34.05 × 10-3 L
M = MRT/PV
\(=\frac{0.0625(\mathrm{~g}) \times 0.083\left(\mathrm{bar} \mathrm{LK}^{-1} \mathrm{~mol}^{-1}\right) \times 819(\mathrm{k})}{0.1 \mathrm{bar} \times 34.05 \times 10^{-3} \mathrm{~L}}\)
M = 1247.7 g mol-1
प्रश्न 5.11.
एक विद्यार्थी 27°C पर गोल पेंदे के फ्लास्क में अभिक्रिया - मिश्रण डालना भूल गया तथा उस फ्लास्क को ज्वाला पर रख दिया। कुछ समय पश्चात् उसे अपनी भूल का एहसास हुआ। उसने उत्तापमापी ( Pyrometer) की सहायता से फ्लास्क का ताप 477°C पाया। आप बताइए कि वायु का कितना भाग फ्लास्क से बाहर निकला?
उत्तर:
T1 = 27 + 273 = 300K
T2 = 477 + 273 = 750K
माना फ्लास्क का आयतन = VmL
चूंकि दाब स्थिर है अतः
\(\frac{V_1}{T_1}=\frac{V_2}{T_2}\)
(चार्ल्स के नियम के अनुसार)
\(\mathrm{V}_2=\frac{V_1 T_2}{T_1}=\frac{\mathrm{V}(\mathrm{ml}) \times 750(\mathrm{k})}{300 \mathrm{k}}\)
= 2.5 V
750 K पर फ्लास्क से निकला वायु का आयतन = 2.5 V - V
= 1.5 V
अतः वायुं का अंश भाग जो फ्लास्क से निकला
\(\frac{1.5 \mathrm{~V}}{2.5 \mathrm{~V}}=\frac{3}{5}\)
प्रश्न 5.12.
3.32 bar पर 5 dm आयतन घेरने वाली 4.0 mol गैस के ताप की गणना कीजिए।
(R = 0.083bar dm3 K-1 mol-1)
उत्तर:
PV= nRT (आदर्श गैस समीकरण)
P = 3.32 bar V = 5 dm
n = 4.0mol
R = 0.083 bar dm3 k-1 mol-1
\(\mathrm{T}=\frac{3.32 \mathrm{bar} \times 5\left(\mathrm{dm}^3\right)}{4(\mathrm{~mol}) \times 0.083\left(\mathrm{bar} \mathrm{dm}^3 \mathrm{k}^{-1} \mathrm{~mol}^{-1}\right)}\)
= 50K
प्रश्न 5.13.
1.4 g डाइनाइट्रोजन गैस में उपस्थित कुल इलेक्ट्रॉनों की संख्या की गणना कीजिए।
उत्तर:
N2 के मोल = 1.4/28
= 28
(N2 का मोलर द्रव्यमान 28gmol-1 )
N2 के अणुओं की संख्या = 14/28 × आवोगाद्रो संख्या
= 1.4/28 × 6.022 × 1023
N2 के एक अणु में इलेक्ट्रानों की संख्या = 14
अतः कुल इलेक्ट्रानों की संख्या = 14/28 × 14 × 6.022 × 1023
= 4.2154 x 1023 इलेक्ट्रॉन
प्रश्न 5.14.
यदि एक सेकंड में 1010 गेहूँ के दाने आवोग्रादो संख्या के वितरित किए जाएँ, तो वितरित करने में कितना समय लगेगा?
उत्तर:
1010 दानों को वितरित करने में लगा समय = 1 सेकण्ड
अतः 6,022 x 1023 ( आवोगाद्रो संख्या) दानों को वितरित
करने में लगा समय = \(\frac{6.022 \times 10^{23}}{10^{10}}\)
\(=\frac{6.022 \times 10^{23}}{10^{10} \times 60 \times 60 \times 24 \times 365}\)
अतः कुल वर्ष = 1.9095 x 106 वर्ष

प्रश्न 5.15.
27°C ताप पर 1 dm आयतन वाले फ्लास्क में 8 ग्राम डाइऑक्सीजन तथा 4 ग्राम डाइहाइड्रोजन के मिश्रण का कुल दाब कितना होगा?
उत्तर:
O2 के मोल (n1) = 8/32 = 0.25
H2 के मोल n2 = 4/2 = 2.0
कुल मोल n = n1 + n2 = 0.25 + 2.0 = 2.25
PV = nRT
V = 1 dm3 n = 2.25 R = 0.083 bar dm3 k-1 mol-1
T = 27°C + 273 = 300k
\(\mathrm{P}=\frac{n R T}{V}=\frac{2.25 \times 0.083 \times 300}{1 \mathrm{dm}^3}\)
P = 56.025 bar.
प्रश्न 5.16.
गुब्बारे के भार तथा विस्थापित वायु के भार के अंतर को 'पेलोड' कहते हैं। यदि 27°C पर 10m त्रिज्या वाले गुब्बारे में 1.66 bar पर 100 kg हीलियम भरी जाए, तो पेलोड की गणना कीजिए। (वायु का घनत्व m-3 तथा R = 0.083 bar dm3 mol-1)
उत्तर:
गुब्बारे की त्रिज्या (r) = 10m
गुब्बारे का आयतन V = 4/3 πr3 = \(\frac{4}{3} \times \frac{22}{7} \times 10^3\)
= 4190.476 = 4190.48 m3
= 4190.48 x 103 dm3
विस्थापित वायु का भार = वायु का आयतन (बैलून) x वायु का घनत्व
= 4190.48m3 x 1.2 (kg gm-3)
= 5028.576
= 5028.58 (kg)
PV = nRT
He के मोल (n) = \(\frac{P V}{R T}\)
\(=\frac{1.66(\mathrm{bar}) \times 4190.48 \times 10^3 \mathrm{dm}^3}{0.083\left(\mathrm{bar} \mathrm{dm^{3 } \mathrm { k } ^ { - 1 } \mathrm { mol } ^ { - 1 } ) \times 3 0 0 ( \mathrm { k } )}\right.}\)
= 279.36 × 103 mol.
(T = 27°C + 273 = 300k )
He का द्रव्यमान = मोल × मोलर द्रव्यमान
He का द्रव्यमान = 279.36 x 103 x 4
= 1117.44 × 103
= 1117.44 kg
भरे हुए गुब्बारे का भार = 1117.44 + 100
= 1217.44 kg
पेलोड = विस्थापित वायु का भार गुब्बारे का भार
= 5028.58 - 1217.44
= 3811.14 kg
प्रश्न 5.17.
31.1° C तथा 1 bar दाब पर 8.8 ग्राम CO2 द्वारा घेरे गए आयतन की गणना कीजिए।
उत्तर:
R = 0.083 bar Lmol
CO2 के मोल =
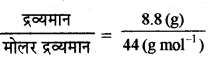
= 0.2 mol
[P = 1 bar, T = 273 + 31.1 k = 304.1kJ]
PV = nRT
\(\begin{aligned} \mathbf{V} & =\frac{n R T}{P} \\ & =\frac{8.2 \mathrm{~mol} \times 0.083\left(\mathrm{bar} \mathrm{Lk}^{-1} \mathrm{~mol}^{-1}\right) \times 304.1(\mathrm{k})}{1(\mathrm{bar})} \end{aligned}\)
V = 5,048 = 5.05 L
प्रश्न 5.18.
समान दाब पर किसी गैस के 2.9g द्रव्यमान का 95°C तथा 0.184 g डाइहाइड्रोजन का 17°C पर आयतन समान है। बताइए कि गैस का मोलर द्रव्यमान क्या होगा?
उत्तर:
माना गैस का मोलर द्रव्यमान = M
गैस के मोल n = 2.9(g)/M
H2 के मोल = \(\frac{0.184(\mathrm{~g})}{2\left(\mathrm{~g} \mathrm{~mol}^{-1}\right)}\)
= 0.092
गैस का आयतन V(g) = \(\frac{n R T}{P}=\frac{2.9 \times R \times 368.15}{M \times P}\)
\(\mathbf{V}_{(\mathrm{g})}=\frac{1067.63 R}{M P}\)
(T = 95°C + 273.15 = 368.15 k )
H2 गैस का आयतन V(H) = \(\frac{n R T}{P}\)
प्रश्नानुसार V(g) = V(H2)
(T = 17°C + 273.15 = 290.15 k )
\(\begin{aligned} & =\frac{1067.63 R}{M P}=\frac{26.70 R}{P} \\ & \mathbf{M}=\frac{1067.63}{26.70}=39.98 \end{aligned}\)
= 40 g mol-1
प्रश्न 5.19.
एक bar दाब पर डाइहाइड्रोजन तथा डाइऑक्सीजन के मिश्रण में 20% डाइहाइड्रोजन (भार से) रखा जाता है, तो डाइहाइड्रोजन का आंशिक दाब क्या होगा?
उत्तर:
माना मिश्रण का कुल द्रव्यमान = 100 g
H2 का द्रव्यमान (20%) = 20g
अतः O2 का द्रव्यमान = 80 g
H2 के मोल (n1) = \(\frac{20(\mathrm{~g})}{2\left(\mathrm{~g} \mathrm{~mol}^{-1}\right)}\)
= 10 mol
O2 के मोल (n2) = \(\frac{80(\mathrm{~g})}{32\left(\mathrm{~g} \mathrm{~mol}{ }^{-1}\right)}\)
= 2.5 mol
कुल दाब = 1 bar
अतः H2 का आंशिक दाब PH2 = 
PH2 = \(\frac{10}{10+2.5} \times 1=\frac{10}{12.5}\)
= 0.8 bar

प्रश्न 5.20.
PV2 T2/n राशि के लिए SI इकाई क्या होगी?
उत्तर:
विभिन्न नियंताकों के SI मान
\(\frac{P V^2 T^2}{n}=\frac{\left(N m^{-2}\right)\left(m^3\right)^2(k)^2}{\text { mol }}\)
= Nm4 (k) 2 mol
(1 Pa = Nm-2)
प्रश्न 5.21.
चार्ल्स के नियम के आधार पर समझाइए कि न्यूनतम संभव ताप - 273°C होता है।
उत्तर:
चार्ल्स के नियम से
\(\mathrm{V}_t=\mathrm{V}_0\left(1+\frac{t}{273}\right)\)
t = -273°C
\(\mathrm{V}_t=\mathrm{V}_0\left(1-\frac{273}{273}\right)\) = 0
अतः इससे यह सिद्ध होता है कि 273°C पर गैस का आयतन शून्य होता है अर्थात् गैस का अस्तित्व नहीं होगा। अतः न्यूनतम सम्भव (सैद्धान्तिक) ताप - 273°C होता है क्योंकि इससे कम ताप पर गैस का आयतन ऋणात्मक होगा जो कि सम्भव नहीं है।
प्रश्न 5.22.
कार्बन डाइऑक्साइड तथा मेथेन का क्रांतिक ताप क्रमशः 31.1°C एवं 81.9°C है। इनमें से किसमें प्रबल अंतर- आण्विक बल है तथा क्यों?
उत्तर:
गैस का क्रान्तिक ताप जितना अधिक होता है उसका द्रवीकरण उतना ही आसानी से होता है अर्थात् अणुओं में अन्तराअणुक आकर्षण बल प्रबल होगा चूँकि CO2 का क्रान्तिक ताप (31.1°C) CH4 के क्रान्तिक ताप ( 81.9°C) से अधिक है अतः CO2 में अणुओं के मध्य आकर्षण बल, CH4 से अधिक है। यद्यपि CO2 तथा CH4 दोनों ही अध्रुवीय हैं लेकिन CO2 का मोलर द्रव्यमान CH4 से अधिक होने के कारण इसके अणुओं के मध्य आकर्षण बल अधिक होता है।
प्रश्न 5.23.
वॉन्डरवाल्स प्राचल की भौतिक सार्थकता को समझाइए।
उत्तर:
वान्डरवाल प्राचल (constant) का मान गैस के अणुओं के मध्य आकर्षण बल की प्रबलता का माप है। अतः का मान अधिक होने पर अन्तराआण्विक आकर्षण बल अधिक होगा। यह ताप तथा दाब पर निर्भर नहीं करता। वान्डरवाल प्राचल b को सह-आयतन (volume) कहते हैं। यह गैस के अणुओं का प्रभावी आकार बताता है। इसका मान गैस के अणुओं के वास्तविक आयतन का चार गुना होता है।

- RBSE Class 11 Chemistry Important Questions Chapter 2 Structure of Atom
- RBSE Solutions for Class 11 Chemistry Chapter 14 Environmental Chemistry
- RBSE Solutions for Class 11 Chemistry Chapter 13 Hydrocarbons
- RBSE Solutions for Class 11 Chemistry Chapter 12 Organic Chemistry - Some Basic Principles and Techniques
- RBSE Solutions for Class 11 Chemistry Chapter 11 The p-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 10 The s-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 9 Hydrogen
- RBSE Solutions for Class 11 Chemistry Chapter 8 Redox Reactions
- RBSE Solutions for Class 11 Chemistry Chapter 7 Equilibrium
- RBSE Solutions for Class 11 Chemistry Chapter 6 Thermodynamics
- RBSE Solutions for Class 11 Chemistry Chapter 5 States of Matter