RBSE Solutions for Class 11 Chemistry Chapter 4 रासायनिक आबंधन तथा आण्विक संरचना
Rajasthan Board RBSE Solutions for Class 11 Chemistry Chapter 4 रासायनिक आबंधन तथा आण्विक संरचना Textbook Exercise Questions and Answers.
Rajasthan Board RBSE Solutions for Class 11 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 11. Students can also read RBSE Class 11 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 11 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 11 Chemistry Solutions Chapter 4 रासायनिक आबंधन तथा आण्विक संरचना
RBSE Class 11 Chemistry रासायनिक आबंधन तथा आण्विक संरचना Textbook Questions and Answers
प्रश्न 4.1.
रासायनिक आबन्ध के बनने की व्याख्या कीजिए।
उत्तर:
रासायनिक आबन्ध - विभिन्न रासायनिक स्पीशीज में उनके घटकों (परमाणु या आयन) को जोड़े रखने वाले आकर्षण बल को रासायनिक आबन्ध कहते हैं। कोसेल लूइस के अनुसार दो परमाणुओं के मध्य बन्ध बनते समय या तो इलेक्ट्रॉनों का स्थानान्तरण होता है। (आयनिक आबन्ध) या इलेक्ट्रॉनों का साझा होता है (सहसंयोजी आबन्ध )। दो परमाणुओं के मध्य बन्ध बनते समय वे अपना अष्टक पूर्ण करते हैं। बन्ध बनते समय आकर्षण तथा प्रतिकर्षण के फलस्वरूप ऊर्जा में कुल कमी होती है। अतः अणु का स्थायित्व बढ़ जाता है।
प्रश्न 4.2.
निम्नलिखित तत्वों के परमाणुओं के लूइस बिन्दु प्रतीक लिखिए:
Mg, Na, B, O, N, Br.
उत्तर:
12Mg 11N 5B 8O 7N 35Br
(2,8,2) (2,8,1) (2,3) (2,6) (2,5) (2,8,18,7)
लूइस बिन्दु प्रतीक 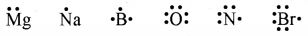
प्रश्न 4.3.
निम्नलिखित परमाणुओं तथा आयनों के लूइस बिन्दु प्रतीक लिखिए।
S और S2-, Al तथा Al3+, H और H-
उत्तर:


प्रश्न 4.4.
निम्नलिखित अणुओं तथा आयनों की लूइस संरचनाएँ लिखिए:
H2,S, SiCl4 BeF2, CO32-, HCOOH
उत्तर:
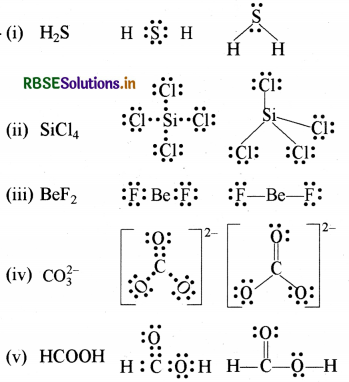
प्रश्न 4.5.
अष्टक नियम को परिभाषित कीजिए तथा इस नियम के महत्व और सीमाओं को लिखिए।
उत्तर:
अष्टक नियम (रासायनिक आबन्धन का इलेक्ट्रॉनिकी सिद्धान्त): परमाणुओं के मध्य बन्ध बनते समय इलेक्ट्रॉनों का एक परमाणु से दूसरे परमाणु पर स्थानान्तरण या साझा होता है। इसमें परमाणु अपने संयोजकता कोश का अष्टक पूर्ण करते (आठ इलेक्ट्रॉन) हैं, इसे अष्टक का नियम कहते हैं।
अष्टक का नियम मुख्य रूप से द्वितीय आवर्त के तत्वों पर लागू होता है तथा यह कार्बनिक यौगिकों की संरचना समझने में उपयोगी है। इसके अपवाद (सीमाएँ ) निम्न हैं
(i) केन्द्रीय परमाणु का अपूर्ण अष्टक (आठ से कम इलेक्ट्रॉन): इनमें केन्द्रीय परमाणु के संयोजकता इलेक्ट्रॉनों की संख्या चार से कम होती है अतः यौगिक के केन्द्रीय परमाणु के चारों ओर इलेक्ट्रॉनों की संख्या 8 से कम होती है।
Cl
LiCl (Li:Cl), BeH2 (H: Be: H), Cl:B:CI (BCI3), AlCl3, BF3
(ii) विषम इलेक्ट्रॉन अणु-इन अणुओं में विषम संख्या में इलेक्ट्रॉन होते हैं, जैसे - NO (15e) ( नाइट्रिक ऑक्साइड), NO2 (23e) ( नाइट्रोजन डाइऑक्साइड) इनमें सभी परमाणु अष्टक के नियम का पालन नहीं करते।

(iii) अष्टक का प्रसार (केन्द्रीय परमाणु पर आठ से अधिक इलेक्ट्रॉन युक्त यौगिक) - इनमें 3s तथा 3p के अतिरिक्त 3d कक्षक भी बन्ध बनाने के लिए उपलब्ध होते हैं। ऐसा तीसरे तथा इसके आगे के आवर्त के तत्वों में होता है।
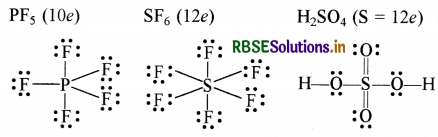
(iv) अष्टक नियम, उत्कृष्ट गैसों की रासायनिक अक्रियता पर आधारित है लेकिन इनके कुछ यौगिक जैसे - XeF2. KrF2 तथा XeOF2 इत्यादि बनते हैं।
(v) यह अणु की आकृति स्पष्ट नहीं करता।
(vi) यह अणुओं के स्थायित्व तथा ऊर्जा की व्याख्या नहीं करता।
प्रश्न 4.6.
आयनिक आबन्ध बनाने के लिए अनुकूल कारकों को लिखिए।
उत्तर:
धनायन तथा ऋणायन के मध्य स्थिर वैद्युत आकर्षण से बने बन्ध को आयनिक बन्ध कहते हैं। यह बन्ध एक परमाणु से दूसरे परमाणु पर इलेक्ट्रॉन के स्थानान्तरण से बनता है तथा आयनिक बन्ध बनने के लिए अनुकूल कारक निम्न हैं:
एन्पी
(i) निम्न आयनन एन्थैल्पी (ii) उच्च ऋणात्मक इलेक्ट्रॉन लब्धि
(iii) उच्च जालक एन्थैल्पी
M(g) → M+(g) + e
X(g) + e → X (g)
M+(g) + X-(g) → MX(s)
प्रश्न 4.7.
निम्नलिखित अणुओं की आकृति की व्याख्या बी.एस.ई. पी. आर. सिद्धान्त के अनुरूप कीजिए:
BeCl2. BCl3, SiCl4, AsF5, H2S, PH3
उत्तर:
लेविस सूत्र
आण्विक आकृति
(i) BeCl2
b. p. = बन्धित इलेक्ट्रॉन युग्म
1.p. = एकाकी इलेक्ट्रॉन युग्म

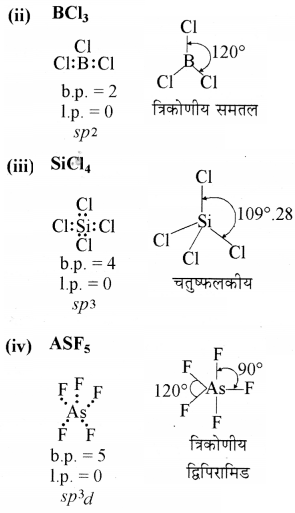
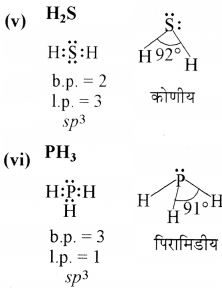
प्रश्न 4.8.
यद्यपि NH3 तथा H2O दोनों अणुओं की ज्यामिति विकृत चतुष्फलकीय होती है, तथापि जल में आबन्ध कोण अमोनिया की अपेक्षा कम होता है। विवेचना कीजिए।
उत्तर:
NH3 तथा H2O में बन्ध कोण में अन्तर का कारण एकाकी (1.p) तथा बन्धित (b.p) की संख्या में अन्तर है। NH3 में N पर एक 1.p तथा 3 b. p है जबकि H2O में 0 पर 21.p तथा 2 b. p है अतः H2O में 1.p-1.p प्रतिकर्षण NH3 के 1.p-b. p प्रतिकर्षण अधिक होने के कारण, H2O में बन्ध कोण (104.5°) (आबन्ध क्रम) NH3 (107) से कम होता है।

प्रश्न 4.9.
आबन्ध प्रबलता को आबन्ध कोटि के रूप में आप किस प्रकार व्यक्त करेंगे?
उत्तर:
आबन्ध कोटि (आबन्ध क्रम) बढ़ने पर आबन्ध एन्थैल्पी बढ़ती है तथा आबन्ध लम्बाई कम होती है। अतः बन्ध की प्रबलता बढ़ेगी तथा स्थायित्व भी बढ़ेगा।
प्रश्न 4.10.
आबन्ध लम्बाई की परिभाषा दीजिए।
उत्तर:
किसी अणु में आबन्धित परमाणुओं के नाभिकों के बीच की साम्यावस्था दूरी को आबन्ध लम्बाई कहते हैं।
प्रश्न 4.11.
CO32- आयन के सन्दर्भ में अनुनाद के विभिन्न पहलुओं को स्पष्ट कीजिए।
उत्तर:
कार्बन तथा ऑक्सीजन परमाणुओं के मध्य दो एकल आबंध तथा एक द्वि-आबंध वाली लूइस संरचना कार्बोनेट आयन की वास्तविक संरचना को दर्शाने के लिए पर्याप्त नहीं है, क्योंकि इसके अनुसार तीन कार्बन ऑक्सीजन आबंधों की लंबाई भिन्न- भिन्न होनी चाहिए। परंतु प्रायोगिक परिणामों के अनुसार कार्बोनेट आयन के तीनों कार्बन ऑक्सीजन आबंधों की लंबाई समान होती है। अतः कार्बोनेट आयन की वास्तविक संरचना को निम्नलिखित तीन विहित संरचनाओं ( I II तथा III) (Canonical Forms) के अनुनाद संकर के रूप में दर्शाया जा सकता है-
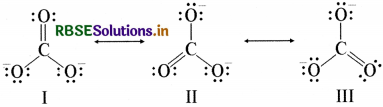
CO32- आयन की संरचना-I, II और III तीन विहित संरचनाएँ
अनुनाद के कारण CO32- में C - O बन्ध क्रम 1.33 होता है।
प्रश्न 4.12.
नीचे दी गई संरचनाओं (1 तथा 2) द्वारा H3PO3 को प्रदर्शित किया जा सकता है। क्या ये दो संरचनाएँ H3PO3 के अनुनाद संकर के विहित (केनॉनीकल ) रूप माने जा सकते हैं? यदि नहीं, तो इसका कारण बताइए।
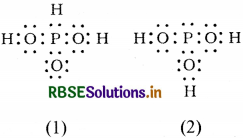
उत्तर:
H3PO3 की इन संरचनाओं को केनॉनीकल रूप (विहित रूप) नहीं मान सकते क्योंकि इनमें परमाणुओं की व्यवस्था भिन्न-भिन्न है जबकि अनुनाद के नियमानुसार विहित (केनॉनीकल रूप) रूपों में केवल इलेक्ट्रॉनों की व्यवस्था भिन्न-भिन्न होनी चाहिए।
प्रश्न 4.13.
SO3, NO2, तथा NO3- की अनुनाद - संरचनाएँ लिखिए।
उत्तर:
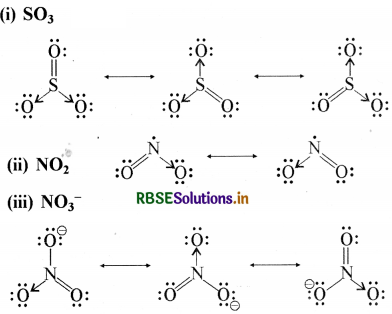
प्रश्न 4.14.
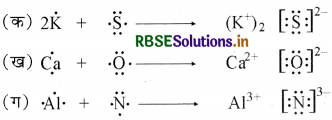
निम्नलिखित परमाणुओं से इलेक्ट्रॉन स्थानांतरण द्वारा धनायनों तथा ऋणायनों में विरचन को लूइस बिंदु प्रतीकों की सहायता से दर्शाइए:
(क) K तथा S (ख) Ca तथा O (ग) Al तथा N
उत्तर:
प्रश्न 4.15.
हालांकि CO2, तथा H2O दोनों त्रिपरमाणुक अणु हैं, परंतु H2O अणु की आकृति बंकित (bent) होती है, जबकि CO2, की रैखिक आकृति होती है। द्विध्रुव आघूर्ण के आधार पर इसकी व्याख्या कीजिए।
उत्तर:
CO2 में दोनों C=O बन्ध आघूर्ण एक-दूसरे के प्रभाव को निरस्त कर देते हैं। अत: CO2 की आकृति रेखीय है तथा इसका द्विध्रुव आघूर्ण शून्य है तथा H2O का द्विध्रुव आघूर्ण शून्य नहीं है जो H2O की कोणीय या बंकित (bent) आकृति की पुष्टि करता है क्योंकि इसमें दोनों O-H बन्ध आघूर्ण एक-दूसरे के प्रभाव को निरस्त नहीं करते।

प्रश्न 4.16.
द्विध्रुव आघूर्ण के महत्त्वपूर्ण अनुप्रयोग बताएँ।
उत्तर:
(i) आबन्ध का आघूर्ण ज्ञात करने में
u = Q (आवेश) × r (दूरी)
HCl, HBr, HI में आबन्ध आघूर्ण ही द्विध्रुव आघूर्ण है अतः द्विध्रुव आघूर्ण अधिक होने पर आबन्ध आघूर्ण भी अधिक होगा।
(ii) अणु की ध्रुवता ज्ञात करने में वे अणु जिनका द्विध्रुव आघूर्ण शून्य होता है वे अध्रुवीय तथा जिनका द्विध्रुव आघूर्ण शून्य नहीं होता, वे ध्रुवीय होते हैं तथा द्विध्रुव आघूर्ण का मान बढ़ने पर अणु की ध्रुवता भी बढ़ती है।
जैसे Cl2 Br2, CCl4, BF3 (अध्रुवीय) HF, NH3 (ध्रुवीय)
(iii) बन्ध में प्रतिशत आयनिक गुण ज्ञात करना: द्विध्रुव आघूर्ण द्वारा किसी अणु या बन्ध में आयनिक गुण की गणना की जा सकती है।
बन्ध में प्रतिशत आयनिक गुण = 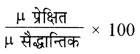
(iv) अणुओं की ज्यामिति ज्ञात करने में CO2 में दोनों C=O बन्ध आघूर्ण एक-दूसरे के प्रभाव को निरस्त कर देते हैं। अत: CO2 की आकृति रेखीय है तथा इसका द्विध्रुव आघूर्ण शून्य है तथा H2O का द्विध्रुव आघूर्ण शून्य नहीं है जो H2O की कोणीय या बंकित (bent) आकृति की पुष्टि करता है क्योंकि इसमें दोनों O-H बन्ध आघूर्ण एक-दूसरे के प्रभाव को निरस्त नहीं करते।


प्रश्न 4.17.
विद्युत ऋणात्मकता को परिभाषित कीजिए। यह इलेक्ट्रॉन बंधुता (इलेक्ट्रॉन लब्धि एन्थैल्पी) से किस प्रकार भिन्न है?
उत्तर:
किसी परमाणु की साझे के इलेक्ट्रॉन युग्म को अपनी ओर आकर्षित करने की प्रवृत्ति को विद्युत ऋणात्मकता कहते हैं। जबकि इलेक्ट्रॉन लब्धि एन्थैल्पी, किसी विलगित गैसीय परमाणु द्वारा इलेक्ट्रॉन ग्रहण कर, ऋणायन बनाने पर उत्सर्जित ऊर्जा होती है।
प्रश्न 4.18.
ध्रुवीय सहसंयोजी आबंध से आप क्या समझते हैं? उदाहरण सहित व्याख्या कीजिए।
उत्तर:
ध्रुवीय सहसंयोजी आबन्ध किसी आबंध का सौ प्रतिशत आयनिक या सहसंयोजी होना एक आदर्श स्थिति है। परंतु वास्तव में कोई भी आबंध या यौगिक पूर्ण रूप से सहसंयोजी या आयनिक नहीं होता है। जब सहसंयोजी आबंध दो समान परमाणुओं के बीच (जैसे- H2 O2, Cl2, N2 तथा F2) बनता है, तब संयोजी इलेक्ट्रॉन युग्म दोनों परमाणुओं द्वारा समान रूप से आकर्षित होता है। इससे इलेक्ट्रॉन युग्म दो समान नाभिकों के ठीक मध्य में स्थित होता है। इस प्रकार प्राप्त आबंध 'अध्रुवीय सहसंयोजी आबंध' कहलाता है। इसके विपरीत HF जैसे विषम परमाणुक अणु में दो परमाणुओं के बीच साझित इलेक्ट्रॉन युग्म अधिक विद्युत ऋणी परमाणु फ्लुओरीन की ओर विस्थापित हो जाता है। इस प्रकार के आबंध को ध्रुवीय सहसंयोजक आबंध कहते हैं।
प्रश्न 4.19.
निम्नलिखित अणुओं को आबंधों की बढ़ती आयनिक प्रकृति के क्रम में लिखिए:
LiF, K2O, N2, SO2 तथा CIF3
उत्तर:
अणु का आयनिक गुण उसमें उपस्थित परमाणुओं की विद्युत ऋणता में अन्तर तथा अणु की ज्यामिति पर निर्भर करता है। इनके आधार पर उपरोक्त स्पीशीज के आयनिक गुण का क्रम निम्न प्रकार है:
N2 < SO2 < CIF3 < K2O < LiF
प्रश्न 4.20.
CH3COOH की नीचे दी गई ढाँचा - संरचना सही है, परंतु कुछ आबंध त्रुटिपूर्ण दर्शाए गए हैं। एसिटिक अम्ल की सही लुइस संरचना लिखिए:
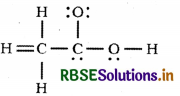
उत्तर:
एसिटिक अम्ल की सही संरचना निम्न प्रकार होती हैक्योंकि उपर्युक्त संरचना लूइस संकल्पना तथा कार्बन की चतुसंयोजी प्रकृति के अनुसार सही नहीं है।
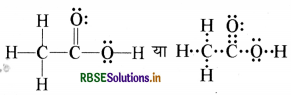
प्रश्न 4.21.
चतुष्फलकीय ज्यामिति के अलावा CH4 अणु की एक और संभव ज्यामिति वर्ग समतली है, जिसमें हाइड्रोजन के चार परमाणु एक वर्ग के चार कोनों पर होते हैं। व्याख्या कीजिए कि CH4 का अणु वर्ग समतलीय नहीं होता है।
उत्तर:
मेथेन की वर्ग समतलीय तथा चतुष्फलकीय संरचना नीचे दर्शायी गयी है।
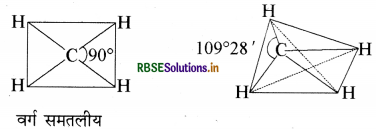
VSEPR सिद्धान्त के अनुसार केन्द्रीय परमाणु के चारों ओर इलेक्ट्रॉन युग्मों की व्यवस्था इस प्रकार होनी चाहिए कि उनमें प्रतिकर्षण न्यूनतम हो। वर्ग समतलीय संरचना में बन्ध कोण 90° होता है जबकि चतुष्फलकीय व्यवस्था में यह बन्ध कोण 109°28' होता है जिसके कारण, चतुष्फलकीय संरचना में प्रतिकर्षण वर्ग समतलीय की तुलना में कम होता है। अतः CH4 की ज्यामिति वर्ग समतलीय न होकर चतुष्फलकीय होती है।
प्रश्न 4.22.
यद्यपि Be-H आबंध ध्रुवीय है, तथापि BeH का द्विध्रुव आघूर्ण शून्य है। स्पष्ट कीजिए।
उत्तर:
BeH2 में BeH आबन्ध ध्रुवीय है लेकिन इसकी रेखीय ज्यामिति बन्ध कोण 180° के कारण दो समान आबन्ध द्विध्रुव विपरीत दिशा में होने से एक-दूसरे के प्रभाव को निरस्त कर देते हैं। अतः BeH2 का द्विध्रुव आघूर्ण शून्य है। अन्य उदाहरण - BeF2
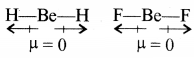
प्रश्न 4.23.
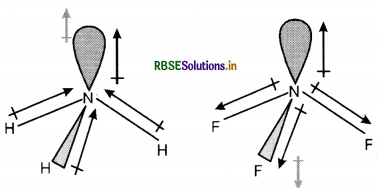
NH3 तथा NF3 में किस अणु का द्विध्रुव आघूर्ण अधिक है और क्यों?
उत्तर:
NH3 तथा NF3 दोनों अणुओं की पिरामिडीय आकृति होती है, जिनमें नाइट्रोजन परमाणु पर एक एकाकी इलेक्ट्रॉन युग्म है। फ्लुओरीन की विद्युत् ऋणात्मकता नाइट्रोजन की अपेक्षा अधिक होती है तथा नाइट्रोजन की विद्युत् ऋणात्मकता हाइड्रोजन से अधिक होती है। परंतु NH3 का परिणामी द्विध्रुव आघूर्ण NF3 के द्विध्रुव आघूर्ण की अपेक्षा अधिक होता है क्योंकि NF3 में नाइट्रोजन परमाणु पर उपस्थित एकाकी इलेक्ट्रॉन युग्म का कक्षक द्विध्रुव आघूर्ण तीन N - F आबंधों के द्विध्रुव-आघूण के परिणामी द्विध्रुव-आघूर्ण की विपरीत दिशा में होता है। अतः कक्षक द्विध्रुव आघूर्ण, एकाकी इलेक्ट्रॉन युग्म के कारण NF3 आबंध आघूर्णो के परिणामी द्विध्रुव-आघूर्ण के प्रभाव को कम कर देता है। इसके कारण NF3 के अणु का द्विध्रुव आघूर्ण कम हो जाता है। जबकि NH3 में कक्षक द्विध्रुव आघूर्ण तथा तीन N - H आबन्धों के परिणामी द्विध्रुव आघूर्ण की दिशा समान होती है। अतः ये दोनों एक-दूसरे के प्रभाव को कम नहीं करते हैं।
प्रश्न 4.24.
परमाणु-कक्षकों के संकरण से आप क्या समझते हैं? sp, sp2 तथा sp3 संकर कक्षकों की आकृति का वर्णन कीजिए।
उत्तर:
(1) sp संकरण (sp Hybridisation): sp संकरण को रेखीय या विकर्णी संकरण भी कहते हैं । इस प्रकार के संकरण में एक 5 तथा एक p कक्षक आपस में मिलकर दो समान sp संकर कक्षक बनाते हैं । sp संकरण के लिए s तथा P. कक्षक उपयुक्त होते हैं। प्रत्येक sp संकर कक्षक में 50% s - लक्षण तथा 50% p- लक्षण होता है। इसमें अणु की ज्यामिति रैखिक होती है। sp संकर कक्षकों के दो उभरे हुए धन लोब (पालि) तथा अत्यंत छोटे ऋण लोब विपरीत दिशाओं में 2-अक्ष की ओर दृष्ट (point) होते हैं। इसके कारण प्रभावी अतिव्यापन होता है, जिसके कारण प्रबल आबंध बनते हैं।
(2) sp2 संकरण - sp2 संकरण को त्रिकोणीय संकरण भी कहते हैं। इस संकरण में एक s कक्षक तथा दो p कक्षक संकरित होकर तीन समान sp2 संकर कक्षक बनाते हैं।
( 3 ) sp3 संकरण - sp3 संकरण को चतुष्फलकीय संकरण भी कहा जाता है। इसमें एक s तथा तीन नए sp3 संकरित कक्षक बनाते हैं। कक्षक आपस में मिलकर चार
प्रश्न 4.25.
निम्नलिखित अभिक्रिया में AI परमाणु की संकरण अवस्था में परिवर्तन (यदि होता है, तो ) को समझाइए:
AICl3 + CI- → AlCl4
उत्तर:
AICl3 में Al पर 3σ बन्ध हैं अतः इसमें sp संकरण होता है। जबकि AICl बनने पर Al पर sp3 संकरण होगा क्योंकि इसमें o बन्धों की संख्या 4 है।
प्रश्न 4.26.
क्या निम्नलिखित अभिक्रिया के फलस्वरूप B तथा N परमाणुओं की संकरण अवस्था में परिवर्तन होता है?
BF3 + NH3 → F3B.NH3
उत्तर:
BF3 में B पर sp2 संकरण है तथा NH3 में N पर sp संकरण है। यौगिक F3B.NH3 में N दाता तथा B ग्राही है तथा इसमें B पर संकरण sp2 से sp3 हो जाता है (40 बन्ध) जबकि N पर संकरण sp3 ही रहता है क्योंकि इसमें N तथा B दोनों पर ही चार σ बन्ध हैं।
प्रश्न 4.27.
C2H4 तथा C2H2 अणुओं में कार्बन परमाणुओं के बीच क्रमशः द्वि-आबंध तथा त्रि आबंध के निर्माण को चित्र द्वारा स्पष्ट कीजिए।
उत्तर:
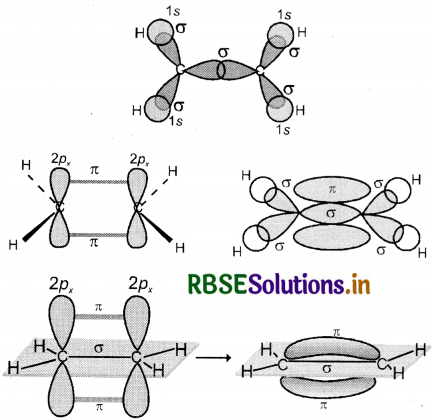
(i) C2H2(HC = CH) (ऐसिटिलीन या एथाइन): एथाइन में दोनों कार्बन sp संकरित अवस्था में होते हैं । इसमें प्रत्येक कार्बन की उत्तेजित अवस्था में (6C = 1s2 2s1 2px1 2py1 2pz1) एक s तथा एक p कक्षक आपस में मिलकर दो sp संकरित कक्षक बनाते हैं तथा दोनों कार्बन परमाणु पर दो-दो असंकरित कक्षक (2Py तथा 2px) उपस्थित रहते हैं। एक कार्बन परमाणु का sp संकर कक्षक दूसरे कार्बन परमाणु के sp संकर कक्षक से अक्षीय अतिव्यापन करके C - C सिग्मा आबंध बनाता है। शेष संकर कक्षक हाइड्रोजन के 1s कक्षकों के साथ अतिव्यापन करके सिग्मा आबंध बनाते हैं। दोनों कार्बन परमाणुओं पर उपस्थित दो-दो असंकरित कक्षक सम्पार्श्विक अतिव्यापन द्वारा दो पाई-आबंध बनाते हैं। इस प्रकार एथाइन में दो कार्बन परमाणुओं के बीच त्रि - आबंध होता है जिसमें एक सिग्मा तथा दो पाई आबंध होते हैं। C2H2 में भी प्रत्येक कार्बन रेखीय ज्यामिति दर्शाता है तथा बन्ध कोण 180° होता है जिनका चित्रण निम्न प्रकार है।
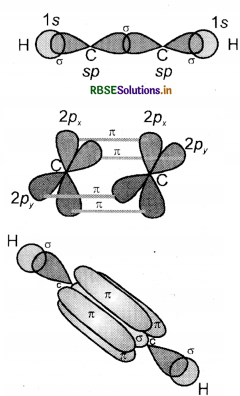
(ii) C2H2
एथीन में कार्बन की उत्तेजित अवस्था में एक s कक्षक तथा दो p कक्षकों के संकरण से तीन sp 2 संकरित कक्षक बनते हैं तथा प्रत्येक कार्बन पर एक असंकरित p कक्षक बच जाता है। एथीन के बनने में एक कार्बन परमाणु का sp2 संकर कक्षक दूसरे कार्बन के sp संकर कक्षक से अक्षीय अतिव्यापन करके C - C सिग्मा आबंध बनाता है, जबकि प्रत्येक कार्बन परमाणु के शेष दो sp2 संकर कक्षक हाइड्रोजन परमाणुओं के s कक्षकों के साथ अतिव्यापन कर sp2 - S सिग्मा आबंध बनाते हैं तथा एक कार्बन का असंकरित कक्षक 2px अथवा 2p, दूसरे कार्बन के समान कक्षक के साथ सम्पार्श्विक अतिव्यापन करके आबंध बनाता है जिसमें कार्बन तथा हाइड्रोजन परमाणुओं के तल के ऊपर तथा नीचे दो समान इलेक्ट्रॉन अभ्र उपस्थित होते हैं । बन्ध बनाने वाले असंकरित कक्षक अणु की अक्ष के लम्बवत् होते हैं। एथीन में H - C - H तथा H - C - C बन्ध कोण का मान क्रमशः 117.6° तथा 121° होता है। एथीन अणु में सिग्मा तथा पाई आबंधों का बनना नीचे दिए गए चित्र में प्रदर्शित किया गया है

प्रश्न 4.28.
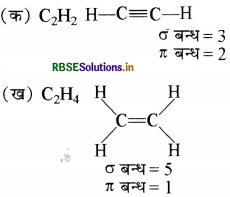
निम्नलिखित अणुओं में सिग्मा (σ) तथा पाई (अ) आबंधों की कुल संख्या कितनी है?
(क) C2H2 (ख) C2H 4
उत्तर:
प्रश्न 4.29
x अक्ष को अंतर्नाभिकीय अक्ष मानते हुए बताइए कि निम्नलिखित में कौनसे कक्षक सिग्मा ( σ) आबंध नहीं बनाएँगे और क्यों?
(क) 1s तथा 1s (ख) 1s तथा 2px (ग) 2py तथा 2py (घ) 1s तथा 2s
उत्तर:
सिग्मा (σ) आबन्ध अक्षीय अतिव्यापन द्वारा बनता है अतः (ग) 2p, तथा 2p, के अलावा सभी σ आबन्ध बनाएँगे क्योंकि (ग) में y अक्ष है जबकि प्रश्न में अन्तर्नाभिकीय अक्ष, x अक्ष को माना गया है।
प्रश्न 4.30.
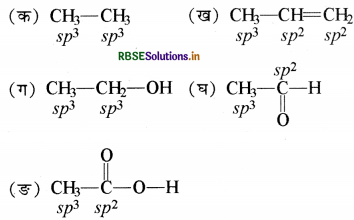
निम्नलिखित अणुओं में कार्बन परमाणु कौनसे संकर कक्षक प्रयुक्त करते हैं?
(क) CH3 - CH3
(ख) CH3 - CH=CH2
(ग) CH3 - CH2 - OH
(घ) CH3CHO
(ङ) CH3COOH
उत्तर:
इन अणुओं में कार्बन परमाणुओं पर स्थित संकर कक्षक निम्न प्रकार हैं, जिनको वे बन्ध बनाने में प्रयुक्त करते हैं।
प्रश्न 4.31.
इलेक्ट्रॉनों के आबंधी युग्म तथा एकाकी युग्म आप क्या समझते हैं? प्रत्येक के एक उदाहरण द्वारा स्पष्ट कीजिए।
उत्तर:
आबन्धी इलेक्ट्रॉन युग्म: वह इलेक्ट्रॉन युग्म जिसका सहसंयोजी बन्ध बनाने के लिए दो परमाणुओं द्वारा साझा किया जाता है, उसे आबन्धी इलेक्ट्रॉन युग्म कहते हैं।
एकाकी इलेक्ट्रॉन युग्म: किसी परमाणु के संयोजी कोश का वह इलेक्ट्रॉन युग्म जो बन्ध बनाने में प्रयुक्त नहीं होता, उसे एकाकी इलेक्ट्रॉन युग्म कहते हैं। जैसे - CH4 में चार आबन्धी इलेक्ट्रॉन युग्म हैं जबकि NH3 में N पर एक एकाकी इलेक्ट्रॉन युग्म है तथा अणु में तीन आबन्धी इलेक्ट्रॉन युग्म हैं।
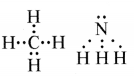
प्रश्न 4.32.
सिग्मा तथा पाई आबंध में अंतर स्पष्ट कीजिए।
उत्तर:
सिग्मा ( σ) आबन्ध - वह सहसंयोजी आबन्ध जो कक्षकों के अन्तर्नाभिकीय अक्ष पर अक्षीय (Head on या axial) अतिव्यापन से बनता है, उसे σ आबन्ध कहते हैं।
पाई (ग) आबन्ध: कक्षकों के सम्पार्श्विक अतिव्यापन से बने बन्धको आबन्ध कहते हैं। इसमें कक्षकों के अक्ष एक-दूसरे के समान्तर तथा अन्तर्नाभिकीय अक्ष के लम्बवत् होते हैं। सिग्मा आबन्ध, आबन्ध की तुलना में प्रबल होता है क्योंकि σ आबन्ध में अतिव्यापन की मात्रा, π आबन्ध की तुलना में अधिक होती है। आबन्ध की प्रबलता अतिव्यापन की सीमा π आबन्ध हमेशा आबन्ध के साथ σ ही पाया जाता है।

प्रश्न 4.33.
संयोजकता आबंध सिद्धांत (VBT) के आधार पर H2 अणु के विरचन की व्याख्या कीजिए।
उत्तर:
व्याख्या: माना कि हाइड्रोजन के दो परमाणु A व B जिनके नाभिक क्रमश: NA व NB हैं तथा उनमें उपस्थित इलेक्ट्रॉन CA और св हैं, एक-दूसरे की ओर बढ़ते हैं। जब ये दोनों परमाणु एक-दूसरे से बहुत अधिक दूरी पर होते हैं, तो उनके बीच कोई अन्योन्य क्रिया (Interaction) नहीं होती। ज्यों-ज्यों दोनों परमाणु एक-दूसरे के पास आते हैं, त्यों-त्यों उनके बीच आकर्षण तथा प्रतिकर्षण बल उत्पन्न होते हैं।
आकर्षण बल निम्नलिखित स्पीशीज के मध्य उत्पन्न होते हैं:
- एक परमाणु के नाभिक तथा उसके इलेक्ट्रॉनों के बीच NA - eA, NB - eB
- एक परमाणु के नाभिक तथा दूसरे परमाणु के इलेक्ट्रॉनों के बीच NA - eB, NB - eA
इसी प्रकार निम्नलिखित स्पीशीज के मध्य प्रतिकर्षण बल उत्पन्न होते हैं:
- दोनों परमाणुओं के इलेक्ट्रॉनों के बीच eA - eB तथा
- दोनों परमाणुओं के नाभिकों के बीच NA - NB
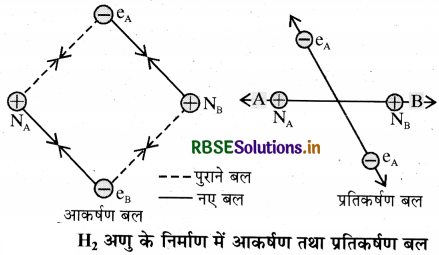
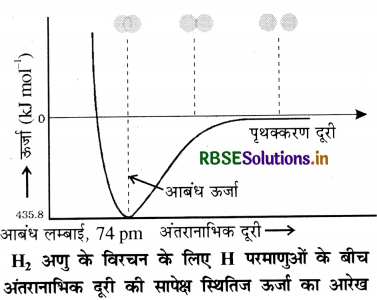
आकर्षण बल के कारण दोनों परमाणु पास आते हैं जबकि प्रतिकर्षण बल के कारण ये दूर होते हैं। प्रयोगों से यह पाया गया कि नए आकर्षण बलों का मान नए प्रतिकर्षण बलों के मान की तुलना में अधिक होता है। इसके कारण दोनों परमाणु एक-दूसरे के पास आते हैं इससे उनकी स्थितिज ऊर्जा में कमी होती है तथा अन्त में एक ऐसी स्थिति आती है, जहाँ पर नेट आकर्षण बल तथा प्रतिकर्षण बल बराबर हो जाता है और निकाय की ऊर्जा न्यूनतम हो जाती है तथा दोनों हाइड्रोजन परमाणुओं के मध्य बन्ध बन जाता है। हाइड्रोजन के दो परमाणुओं के मध्य आबन्ध बनने पर ऊर्जा मुक्त होती है। इसी कारण हाइड्रोजन के अणु का स्थायित्व दो पृथक् परमाणुओं की अपेक्षा अधिक होता है। दो परमाणुओं के मध्य आबन्ध बनने पर मुक्त ऊर्जा को आबंध एन्थैल्पी कहते हैं जो कि नीचे दिए गए चित्र में न्यूनतम के संगत है। इसके विपरीत हाइड्रोजन के एक मोल अणुओं के वियोजन के लिए 435.8KJ ऊर्जा की आवश्यकता होती है।
H2(g) + 435.8 kJmol-1 → H(g) + H(g)
प्रश्न 4.34.
परमाणु कक्षकों के रैखिक संयोग से आण्विक कक्षक बनने के लिए आवश्यक शर्तों को लिखें।
उत्तर:
परमाणु कक्षकों के रैखिक संयोग के बनने के लिए आवश्यक शर्तें निम्न हैं:
- संयोग करने वाले परमाणु कक्षकों की ऊर्जा समान या लगभग समान होनी चाहिए। इसका अर्थ यह है कि एक 15 कक्षक दूसरे 1s कक्षक से संयोग कर सकता है परंतु 25 कक्षक से नहीं, क्योंकि 2s कक्षक की ऊर्जा 1s कक्षक की ऊर्जा से अधिक होती है। भिन्न-भिन्न प्रकार के परमाणुओं के लिए यह सत्य नहीं है।
- संयोग करने वाले परमाणु कक्षकों की आण्विक अक्ष के परितः समान सममिति होनी चाहिए अर्थात् संयोग करने वाले परमाणु कक्षकों की अक्ष समान होनी चाहिए। परम्परा के अनुसार Z-अक्ष को आण्विक अक्ष मानते हैं। इसके अनुसार समान या लगभग समान ऊर्जा वाले परमाणु कक्षक केवल तभी संयोग करेंगे, जब उनकी सममिति समान हो, अन्यथा नहीं जैसे एक परमाणु का - 2Pz. कक्षक दूसरे परमाणु के 2p2 कक्षक से संयोग करेगा, परंतु 2p. या 2p, कक्षकों से नहीं, क्योंकि उनकी सममिति समान नहीं हैं।
- संयोग करने वाले परमाणु कक्षकों के बीच अधिकतम अतिव्यापन होना चाहिए। उनके मध्य जितना अधिक अतिव्यापन होगा, आण्विक कक्षकों के नाभिकों के बीच इलेक्ट्रॉन घनत्व उतना ही अधिक होगा।
प्रश्न 4.35
आण्विक कक्षक सिद्धांत के आधार पर समझाइए कि Be2 अणु का अस्तित्व क्यों नहीं होता?
उत्तर:
Be का परमाणु क्रमांक 4 है। इसका अर्थ है कि Be2 के अणु कक्षकों में 8 इलेक्ट्रॉन भरे जाएँगे अतः Be2 का अणु कक्षक विन्यास निम्न होगा:
(σ1s) (σ1s*)2 (σ2s)2 (σ*2s)2 अथवा KK (σ2s)2 (σ*2s)2
बन्ध क्रम = 1/2[Nb - Na]
= 1/2[4 - 4] = 0 ( शून्य )
बन्ध क्रम का शून्य मान यह दर्शाता है कि Be2 अणु का अस्तित्व नहीं होता।
प्रश्न 4.36.
निम्नलिखित स्पीशीज़ के आपेक्षिक स्थायित्व की तुलना कीजिए तथा उनके चुंबकीय गुण इंगित कीजिए: O2, O2+, O2-, (सुपर ऑक्साइड) तथा O22-( परॉक्साइड)।
उत्तर:
इन स्पीशीज के बन्ध क्रम (आबन्ध कोटि) निम्न प्रकार
O2 = 2.0
O+2 = 2.5
O-2 = 1.5
O2-2 = 1.0
अतः इनका आपेक्षिक स्थायित्व
O+2 > O2 > O-2 > O2-2
क्योंकि आपेक्षिक स्थायित्व बन्ध क्रम ( आबन्ध कोटि) के समानुपाती होता है। आण्विक कक्षक सिद्धान्त (M.O.T.) के आधार पर O2 में दो अयुग्मित इलेक्ट्रॉन होते हैं अतः यह अनुचुम्बकीय होती है। तथा O+2 तथा O-2 एक-एक अयुग्मित इलेक्ट्रॉन होते हैं अतः ये भी अनुचुम्बकीय हैं, जबकि O2-2 में सभी इलेक्ट्रॉन युग्मित हैं अतः यह प्रतिचुम्बकीय है।

प्रश्न 4.37.
कक्षकों के निरूपण में उपयुक्त धन (+) तथा ऋण (-) चिह्नों का क्या महत्त्व होता है?
उत्तर:
तरंग फलन को चित्र के रूप में कक्षक के द्वारा दर्शाया जाता है + तथा चिह्न तरंग फलन (4) की धनात्मक तथा ऋणात्मक प्रकृति को बताते हैं, किन्तु ये आवेश नहीं हैं। जब संयोजित होने वाले परमाणु कक्षकों की पॉलियों के चिह्न समान ( तथा या + तथा +) होते हैं तो आबन्धन आण्विक कक्षक बनते हैं तथा ये चिह्न विपरीत (+तथा) होते हैं तो प्रतिआबन्धन (Antibonding ) आण्विक कक्षक बनते हैं।
प्रश्न 4.38.
PCl5 अणु में संकरण का वर्णन कीजिए। इसमें अक्षीय आबंध विषुवतीय आबंधों की अपेक्षा अधिक लंबे क्यों होते हैं?
उत्तर:
PCl5 में sp3d संकरण होता है।
P का इलेक्ट्रानिक विन्यास निम्न प्रकार है:
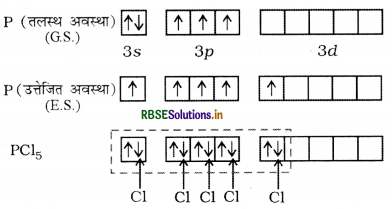
पाँच क्लोरीन परमाणुओं द्वारा साझित इलेक्ट्रॉन युग्मों द्वारा भरे गए sp3d संकरित कक्षक इस प्रकार पाँच कक्षक ( एक s, तीन P तथा एक d कक्षक) संकरण के लिए उपलब्ध हो जाते हैं। जो आपस में मिलकर पाँच sp3d संकर कक्षक बनाते हैं, जो त्रिकोणीय द्वि-पिरामिड के पाँच कोनों की ओर स्थित होते हैं।
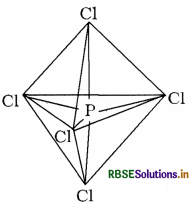
त्रिकोणीय द्विपिरामिडी ज्यामिति में सभी आबंध कोण समान नहीं होते हैं। PCl5 में फॉस्फोरस के पाँच sp3d संकर कक्षक क्लोरीन परमाणुओं के अर्ध-भरे कक्षकों से अतिव्यापन करके पाँच PCl5 सिग्मा-आबंध बनाते हैं। इनमें से तीन PCl5 आबंध एक तल में होते हैं जो परस्पर 120° का कोण बनाते हैं। इन्हें 'विषुवतीय आबंध ' कहते हैं। अन्य दो PCl5 आबंध क्रमश: विषुवतीय तल के ऊपर और नीचे होते हैं तथा तल से 90° का कोण बनाते हैं। इन्हें अक्षीय आबंध कहते हैं। चूँकि अक्षीय आबंध इलेक्ट्रॉन युग्मों में विषुवतीय आबंधी इलेक्ट्रॉन-युग्मों से अधिक प्रतिकर्षण होता है, अतः ये आबंध विषुवतीय आबंधों से लंबाई में कुछ अधिक तथा प्रबलता में कुछ कम होते हैं।
प्रश्न 4.39.
हाइड्रोजन आबंध की परिभाषा दीजिए। यह वान्डरवाल्स बलों की अपेक्षा प्रबल होते हैं या दुर्बल?
उत्तर:
हाइड्रोजन आबन्ध (H-bond): अधिक ध्रुवीय अणुओं जिनमें हाइड्रोजन उपस्थित होता है, आंशिक धनावेशित हाइड्रोजन परमाणु किसी दूसरे आंशिक ऋणावेशित विद्युत ऋणी परमाणु को अपनी ओर आकर्षित करता है तो इस आकर्षण बल को हाइड्रोजन आबन्ध कहते हैं। उदाहरण HF तथा H2O
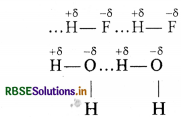
अतः हाइड्रोजन आबन्ध उस आकर्षण बल को कहते हैं जो एक अणु के H-परमाणु को दूसरे अणु के विद्युत ऋणी परमाणु (F, O या N) से बांधे रखता है। हाइड्रोजन आबन्ध, वान्डरवाल बल से प्रबल होता है क्योंकि यह प्रबल द्विध्रुव- द्विध्रुव आकर्षण है जबकि वान्डरवाल बल दुर्बल प्रकीर्णन बल (लंडन बल) होता है।
प्रश्न 4.40.
'आबंध कोटि' से आप क्या समझते हैं? निम्नलिखित में आबंध-कोटि का परिकलन कीजिए:
N2. O2. O+2 तथा O2-
उत्तर:
आबन्धी आण्विक कक्षकों (Nb) एवं प्रति आबन्धी आण्विक कक्षकों में उपस्थित इलेक्ट्रॉनों की संख्या के अन्तर का आधा आबन्ध कोटि कहलाता है।
आबन्ध कोटि = 1/2 (Nb - Na)
आबन्ध कोटि, किसी अणु में उपस्थित सहसंयोजी आबन्धों की संख्या है।
आबन्ध कोटि शून्य या ऋणात्मक होने पर अणु अस्थायी होता है। अर्थात् उसका कोई अस्तित्व नहीं होता।
आबन्ध कोटि का परिकलन:
N2 = KK (σ2s)2 (σ*2s)2 (π2px)2 = (π2py)2, (σ2pz)2
या (σls)2, (σ*1s)2, (σ2s)2 (σ*2s)2 (π2px)2 = (π2py)2, (σ2pz)2
आबन्ध कोटि (B.O.) = \(\frac{\mathrm{Nb}-\mathrm{Na}}{2}=\frac{10-4}{2}\)
= 3
O2 = KK (σ2s)2 (σ*2s)2 (σ2p)2 (π2px)2 = (π2py)2 (π*2px)1 = (π*2py)1
आबन्ध कोटि
\(\frac{10-6}{2}\)
= 2
O2 = KK(σ2s)2 (σ*2s)2 (σ2px)2 (π2py)2 = (π2py) (π*2px)1
आबन्ध कोटि = \(\frac{10-5}{2}\)
= 2.5
O2 = KK (σ2s)2 (σ*2s)2 (σ2pz)2 (π2px)2 = (π2py)2 (π*2px)2 (π*2py)1
आबन्ध कोटि = \(\frac{10-7}{2}\)
= 1.5

- RBSE Class 11 Chemistry Important Questions Chapter 2 Structure of Atom
- RBSE Solutions for Class 11 Chemistry Chapter 14 Environmental Chemistry
- RBSE Solutions for Class 11 Chemistry Chapter 13 Hydrocarbons
- RBSE Solutions for Class 11 Chemistry Chapter 12 Organic Chemistry - Some Basic Principles and Techniques
- RBSE Solutions for Class 11 Chemistry Chapter 11 The p-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 10 The s-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 9 Hydrogen
- RBSE Solutions for Class 11 Chemistry Chapter 8 Redox Reactions
- RBSE Solutions for Class 11 Chemistry Chapter 7 Equilibrium
- RBSE Solutions for Class 11 Chemistry Chapter 6 Thermodynamics
- RBSE Solutions for Class 11 Chemistry Chapter 5 States of Matter