RBSE Solutions for Class 11 Chemistry Chapter 12 कार्बनिक रसायन : कुछ आधारभूत सिद्धांत तथा तकनीकें
Rajasthan Board RBSE Solutions for Class 11 Chemistry Chapter 12 कार्बनिक रसायन : कुछ आधारभूत सिद्धांत तथा तकनीकें Textbook Exercise Questions and Answers.
Rajasthan Board RBSE Solutions for Class 11 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 11. Students can also read RBSE Class 11 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 11 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 11 Chemistry Solutions Chapter 12 कार्बनिक रसायन : कुछ आधारभूत सिद्धांत तथा तकनीकें
RBSE Class 11 Chemistry कार्बनिक रसायन : कुछ आधारभूत सिद्धांत तथा तकनीकें Textbook Questions and Answers
प्रश्न 12.1.
निम्नलिखित यौगिकों में प्रत्येक कार्बन की संकरण अवस्था बताइए:
CH2 = C = O, CH3 - CH = CH2, (CH3)2CO, CH2 = CH - CN, C6H6
उत्तर:
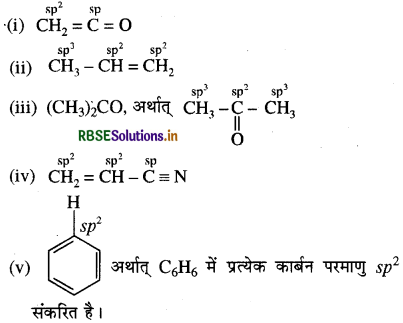

प्रश्न 12.2.
निम्नलिखित अणुओं में σ तथा π आबंध दर्शाइए:
C6H6, C6H12, CH2Cl2, CH2 = C = CH2, CH3 NO2, HCONHCH3
उत्तर:
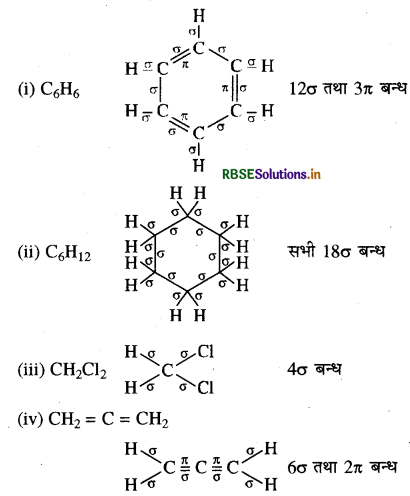
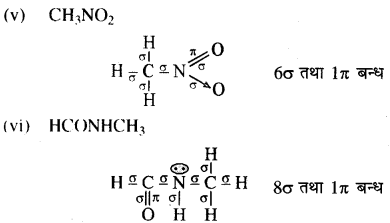
प्रश्न 12.3.
निम्नलिखित यौगिकों के आबंध - रेखा - सूत्र लिखिए:
आइसोप्रोपिल ऐल्कोहॉल, 2, 3 - डाइमेथिलब्यूटेनैल, हेप्टेन 4-ओन
उत्तर:
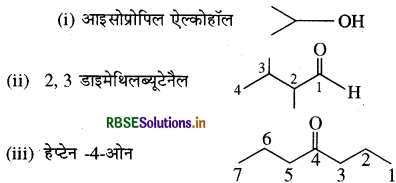
प्रश्न 12.4.
निम्नलिखित यौगिकों के IUPAC नाम लिखिए:
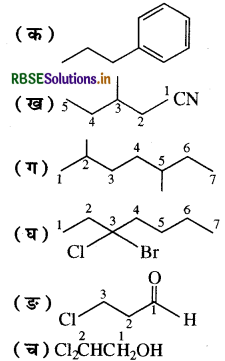
उत्तर:
(क) प्रोपिलबेन्जीन
(Propyl Benzene)
(ख) 3- मेथिलपेन्टेन- 1- नाइट्राइल
(3-Methyl Pentane-1-nitrile)
(ग) 2, 5 - डाईमेथिलहेप्टेन
(2, 5-Dimethyl heptane)
(घ) 3- ब्रोमो-3 क्लोरोहेप्टेन
(3-Bromo-3-Chloro heptane)
3- क्लोरोप्रोपेन- 1- ऐल (3-Chloropropan-1-al)
(च) 2 2 - डाई क्लोरोएथेनॉल
(2,2-Dichloro Ethanol)
प्रश्न 12.5.
निम्नलिखित यौगिकों में से कौनसा नाम IUPAC पद्धति के अनुसार सही है?
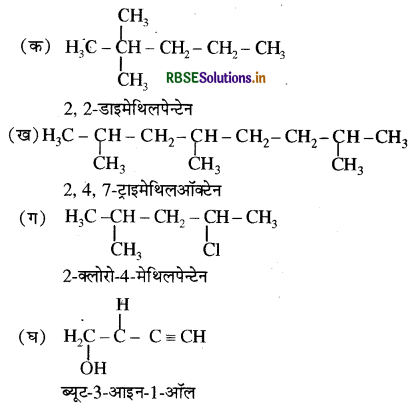
(क) 2, 2- डाइमेथिलपेन्टेन अथवा 2 - डाइमेथिलपेन्टेन
(ख) 2, 4, 7- ट्राइमेथिलऑक्टेन अथवा 2, 5, 7- ट्राइमेथिल ऑक्टेन
(ग) 2- क्लोरो-4 मेथिलपेन्टेन अथवा 4- क्लोरो-2- मेथिलपेन्टेन
(घ) ब्यूट- 3- आइन-1 ऑल अथवा ब्यूट 4 ऑल-1- आइन ।
उत्तर:
दिए गए नाम के अनुसार यौगिक की संरचना बनाकर IUPAC नियमानुसार उसका नाम लिखकर सही नाम ज्ञात किया जाता है।
प्रश्न 12.6.
निम्नलिखित सजातीय श्रेणियों में से प्रत्येक के प्रथम पाँच सजातों के संरचना सूत्र लिखिए:
(क) H - COOH
(ख) CH3COCH3
(ग) HCH = CH2
उत्तर:
(क) HCOOH, CH3COOH, CH3CH2COOH, तथा CH3CH2CH2COOH तथा CH3CH2CH2CH2COOH
(ख) CH3COCH3, CH3CH2COCH3, CH3CH2COCH2CH3, CH3-CH2-CO-CH2-CH2-CH3 तथा CH2CH2COCH2CH2CH3.
(ग) H-CH=CH2 CH3-CH=CH2, CH3-CH2-CH=CH2,CH3-CH2-CH2-CH =CH2 तथा CH3-CH2-CH2-CH2-CH = CH2
प्रश्न 12.7.
निम्नलिखित के संघनित और आबंध रेखा - सूत्र लिखिए तथा उनमें यदि कोई क्रियात्मक समूह हो, तो उसे पहचानिए:
(क) 2, 2, 4- ट्राइमेथिलपेन्टेन
(ख) 2- हाइड्रॉक्सी-1, 2, 3 प्रोपेनट्राइकार्बोक्सिलिक अम्ल
(ग) हेक्सेनडाइऐल|
उत्तर:
(क) 2, 2, 4- ट्राइमेथिलपेन्टेन
संघनित सूत्र - (CH3)3.CCH2CH(CH3)2
आबंध रेखा सूत्र- 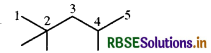
इस यौगिक में कोई क्रियात्मक समूह उपस्थित नहीं है।
(ख) 2- हाइड्रॉक्सी- 1, 2, 3 - प्रोपेनट्राइकार्बोक्सिलिक अम्ल
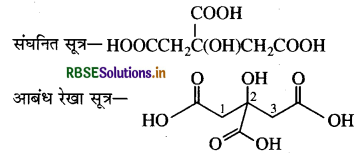
इस यौगिक में OH (हाइड्रॉक्सिल) तथा 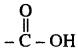 (कार्बोक्सेलिक अम्ल) क्रियात्मक समूह उपस्थित है।
(कार्बोक्सेलिक अम्ल) क्रियात्मक समूह उपस्थित है।
(ग) हेक्सेनडाइऐल, संघनित सूत्र - OHC(CH2)4CHO
आबंध रेखा सूत्र 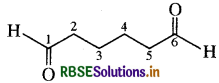
इस यौगिक में CHO (ऐल्डिहाइड ) क्रियात्मक समूह उपस्थित है।

प्रश्न 12.8.
निम्नलिखित यौगिकों में क्रियात्मक समूह पहचानिए:
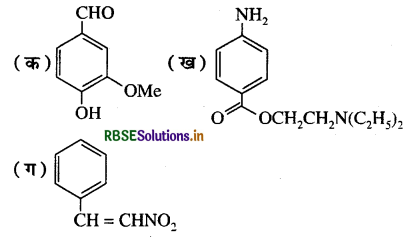
उत्तर:
(क) इस यौगिक में OH समूह (फीनॉलिक), CHO समूह (ऐल्डिहाइडिक) तथा OMe या -OCH, (ईथर समूह ) उपस्थित है।
(ख) इस यौगिक में -NH2 समूह ( ऐरोमैटिक प्राथमिक ऐमीन), 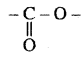 समूह (एस्टर) तथा - N (C2H5)2 समूह (तृतीयक ऐमीन) उपस्थित है।
समूह (एस्टर) तथा - N (C2H5)2 समूह (तृतीयक ऐमीन) उपस्थित है।
(ग) इस यौगिक में -CH = CH समूह (ऐथिलिनिक) तथा - NO2 समूह ( नाइट्रो) उपस्थित है।
प्रश्न 12.9.
निम्नलिखित में से कौन अधिक स्थायी है तथा क्यों?
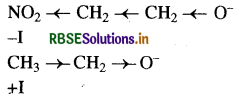
O2 NCH2CH2 O- और CH3 CH2O
उत्तर:
उपरोक्त स्पीशीज में से O2N CH2CH2O अधिक स्थायी है क्योंकि - NO2 समूह में इलेक्ट्रॉन आकर्षित करने का गुण होता है। अतः यह ऋणात्मक प्रेरणिक प्रभाव दर्शाता है। इसलिए O आयन का आवेश फैल जाता है जिसके कारण यह स्थायी हो जाता है। जबकि CH3CH2O में CH3 - CH2 समूह धनात्मक प्रेरणिक प्रभाव दर्शाता है। जिसके कारण पर इलेक्ट्रॉन घनत्व बढ़ जाता है इस कारण इसकी सक्रियता बढ़ जाती है अर्थात् स्थायित्व कम हो जाता है।
प्रश्न 12.10.
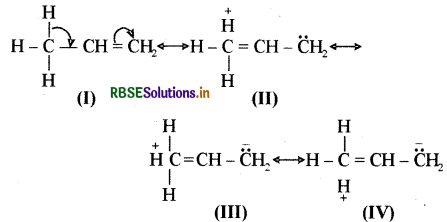
निकाय से आबंधित होने पर ऐल्किल समूह इलेक्ट्रॉनदाता की तरह व्यवहार प्रदर्शित क्यों करते हैं? समझाइए।
उत्तर:
सामान्य तौर पर ऐल्किल समूह (+I) धनात्मक प्रेरणिक प्रभाव दर्शाता है अतः यह इलेक्ट्रॉनदाता की तरह व्यवहार दर्शाता है परन्तु जब यह निकाय से जुड़ा होता है तो अतिसंयुग्मन प्रभाव (Hyper Conjugation Effect ) या बन्धविहीन अनुनाद के कारण यह इलेक्ट्रॉनदाता के समान व्यवहार करता है। प्रोपीन इसका सरल उदाहरण है।
प्रश्न 12.11.
निम्नलिखित यौगिकों की अनुनाद - संरचना लिखिए तथा इलेक्ट्रॉनों का विस्थापन मुड़े तीरों की सहायता से दर्शाइए:
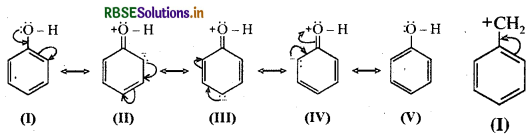
(क) C6H5OH
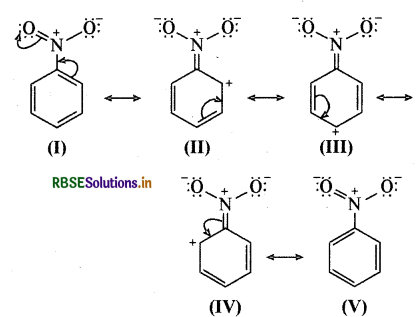
(ख) C6H5NO2
(ग) CH3CH = CHCHO
(घ) C6H5 - CHO
(ङ) C6H5 - CH2
(च) CH3CH = CHCH2
उत्तर:
(क) CHOH ( फीनॉल) - इसकी अनुनादी संरचनाएँ निम्नलिखित हैं:
(ख) C6H5NO2 (नाइट्रोबेन्जीन):
(ग) CH3CH = CHCHO (ब्यूट 2 इन-1 ऐल):
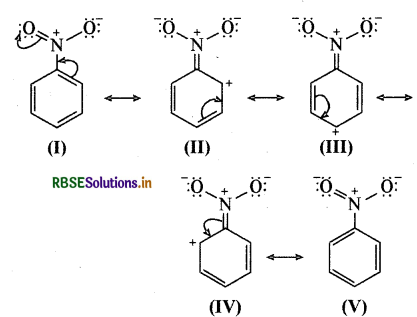
(घ) C6H5 - CHO(बेन्जेल्डिहाइड):
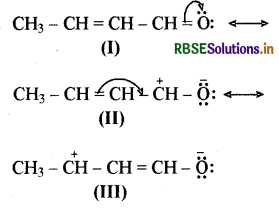
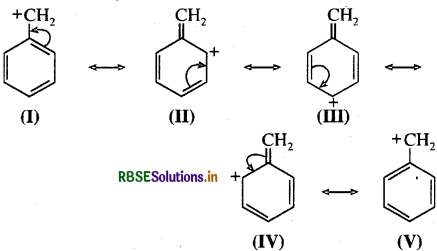
(ङ) C6H5 - CH2(बेन्जिल कार्बधनायन):
(च) CH3CH = CHCH2(कार्बधनायन):
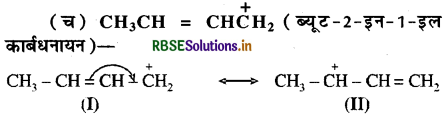
प्रश्न 12.12.
इलेक्ट्रॉनस्नेही तथा नाभिकस्नेही क्या हैं?
उदाहरण सहित समझाइए।
उत्तर:
इलेक्ट्रॉनस्नेही: वे इलेक्ट्रॉन न्यून स्पीशीज (इलेक्ट्रॉन को आकर्षित करने वाली) जो इलेक्ट्रॉन धनी केन्द्र पर क्रिया करके इलेक्ट्रॉन युग्म ग्रहण करती हैं उन्हें इलेक्ट्रॉनस्नेही कहते हैं। जैसे- BF3, AlCl3, FeCl3, ZnCl2, SO3 CH, NO2 Cl
नाभिकस्नेही: इलेक्ट्रॉन युग्म प्रदान करने वाले (इलेक्ट्रॉन धनी) अभिकर्मक जो इलेक्ट्रॉन न्यून केन्द्र पर क्रिया करते हैं, 'नाभिकस्नेही' या नाभिकरागी कहलाते हैं। जैसे:
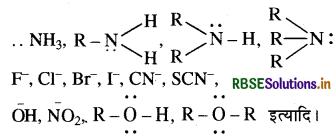
प्रश्न 12.13.
निम्नलिखित समीकरणों में मोटे अक्षरों में लिखे. अभिकर्मकों को नाभिकस्नेही तथा इलेक्ट्रॉनस्नेही में वर्गीकृत कीजिए:
(क) CH3COOH + HŌ → CH3COŌ + H2O
(ख) CH,COCH3 + CN → (CH3)2C(CN)(O)
(ग) C6H6 + CH3CO → C6H5COCH3 + H+
उत्तर:
(क) यह नाभिकस्नेही अभिकर्मक है।
(ख) यह नाभिकस्नेही अभिकर्मक है।
(ग) यह इलेक्ट्रॉनस्नेही अभिकर्मक है।

प्रश्न 12.14.
निम्नलिखित अभिक्रियाओं को वर्गीकृत कीजिए:
(क) CH3CH2Br + HS- → CH3CH2SH + Br
(ख) (CH3)2C = CH2 + HCl (CH3)2ClC - CH3
(ग) CH3CH2Br + HO CH2 = CH2 + H2O + Br-
(घ) (CH3)3C – CH2OH + HBr → (CH3)2 CBr CH2 CH3 + H2O
उत्तर:
(क) यह एक नाभिकस्नेही प्रतिस्थापन अभिक्रिया है।
(ख) यह इलेक्ट्रॉनस्नेही योगात्मक अभिक्रिया है।
(ग) यह विलोपन अभिक्रिया का उदाहरण है।
(घ) यह पुनर्विन्यास के साथ नाभिकस्नेही प्रतिस्थापन अभिक्रिया का उदाहरण है।
प्रश्न 12.15.
निम्नलिखित युग्मों में सदस्य संरचनाओं के मध्य कैसा संबंध है ? क्या ये संरचनाएँ संरचनात्मक या ज्यामितीय समावयव अथवा अनुनाद संरचनाएँ हैं?
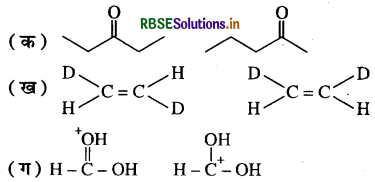
उत्तर:
(क) ये संरचनात्मक समावयवी हैं तथा इनके मध्य स्थिति समावयवता एवं मध्यावयवता पायी जाती है।
(ख) ये संरचनाएँ ज्यामितीय समावयवी हैं।
(ग) ये संरचनाएँ अनुनाद संरचनाएँ हैं।
प्रश्न 12.16.
निम्नलिखित आबंध विदलनों के लिए इलेक्ट्रॉन - विस्थापन को मुड़े तीरों द्वारा दर्शाइए तथा प्रत्येक विदलन को समांश अथवा विषमांश में वर्गीकृत कीजिए। साथ ही निर्मित सक्रिय मध्यवर्ती उत्पादों में मुक्त-मूलक, कार्बधनायन तथा कार्बऋणायन पहचानिए:
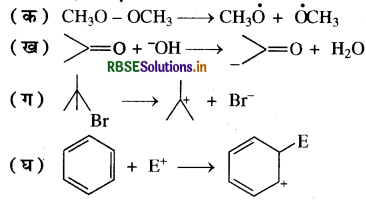
उत्तर:

यह आबंध का समांश या समअपघटनी विदलन (Homolysis) है तथा इसमें बनने वाली प्रजाति दो मेथॉक्सी मुक्तमूलक हैं।

यह कार्बोनिल द्विआबंध से जुड़े मेथिल समूह का नाभिकस्नेही (OH-) द्वारा विषमांश या विषम अपघटनी विदलन है (Heterolysis) तथा इसमें नाभिकस्नेही (OH), CH3- समूह से प्रोटोन को आकर्षित करके कार्बऋणायन बना रहा है।

यह भी आबंध का विषमांश विदलन है जिसमें एकअणुक नाभिकस्नेही प्रतिस्थापन (SN1) अभिक्रिया हो रही है। इसमें पहले पद में Br हट रहा है तथा तृतीयक ब्यूटिल कार्बधनायन (CH3)3 Ć+ बन रहा है।

उपरोक्त अभिक्रिया बेन्जीन वलय पर होने वाली इलेक्ट्रॉनस्नेही प्रतिस्थापन अभिक्रिया है, जिसमें बंध का विषमांश विदलन हो रहा है तथा वलय पर इलेक्ट्रॉनस्नेही का आक्रमण होकर कार्बधनायन बन रहा है जो कि यह अनुनाद द्वारा स्थायी होता है।
प्रश्न 12.17.
निम्नलिखित कार्बोक्सिलिक अम्लों की अम्लता का सही क्रम कौनसा इलेक्ट्रॉन - विस्थापन वर्णित करता है? प्रेरणिक तथा इलेक्ट्रोमेरी प्रभावों की व्याख्या कीजिए:
(क) ClCCOOH > ClCHCOOH > ClCH2COOH
(ख) CH3CH2COOH > (CH3)2CHCOOH > (CH3)3CCOOH
उत्तर:
(क) अम्लता का यह क्रम ऋणात्मक प्रेरणिक (-I) प्रभाव द्वारा समझाया जाता है।
Cl3CCOOH > Cl2CHCOOH > ClCH2COOH अम्लीयता का घटता क्रम
∵ Cl परमाणु का कार्बन श्रृंखला पर ऋणात्मक प्रेरणिक प्रभाव होता है अतः कार्बन श्रृंखला पर Cl परमाणुओं की संख्या बढ़ने के कारण इलेक्ट्रॉन का प्रवाह C से Cl की ओर हो जाता है जिसके कारण प्रोटोन का निष्कासन आसान हो जाता है। इसी कारण ट्राईक्लोरो ऐसीटिक अम्ल प्रबल अम्ल है, डाईक्लोरो ऐसीटिक अम्ल अपेक्षाकृत दुर्बल तथा मोनोक्लोरो ऐसीटिक अम्ल सबसे दुर्बल अम्ल है।
(ख) अम्लता का यह क्रम धनात्मक प्रेरणिक प्रभाव द्वारा समझाया जाता है। जब कार्बन शृंखला पर धनात्मक प्रेरणिक प्रभाव बढ़ाने वाले समूह (ऐल्किल समूह) जुड़े होते हैं तो वे अपने इलेक्ट्रॉन - COOH समूह को देकर OH समूह के ऑक्सीजन पर इलेक्ट्रॉन घनत्व बढ़ा देते हैं जिसके कारण प्रोटोन का निष्कासन कठिन होता है अतः अम्लीय गुण कम हो जाता है। इसलिए दिये गये अम्लों की घटती हुई अम्ल सामर्थ्य का क्रम निम्न प्रकार होता है।
CH3CH2COOH > (CH3)2CHCOOH > (CH3)3CCOOH (अधिक प्रबल अम्ल) घटती हुई अम्ल सामर्थ्य (कम प्रबल अम्ल) प्रेरणिक प्रभाव के लिए भाग कार्बनिक यौगिकों में परमाणुओं की विद्युत ऋणता में अन्तर के कारण साझे का इलेक्ट्रॉन युग्म अधिक विद्युत ऋणी परमाणु या समूह की ओर आंशिक रूप से विस्थापित हो जाता है जिससे बन्ध में ध्रुवता है।
प्रश्न 12.18.
प्रत्येक का एक उदाहरण देते हुए निम्नलिखित प्रक्रमों के सिद्धान्तों का संक्षिप्त विवरण दीजिए:
(क) क्रिस्टलन
(ख) आसवन
(ग) क्रोमेटोग्रफी।
उत्तर:
(क) क्रिस्टलन (Crystallization): यह ठोस कार्बनिक यौगिकों के शोधन की सर्वाधिक प्रयुक्त विधि है। यह विधि कार्बनिक यौगिक तथा अशुद्धि की किसी उपयुक्त विलायक में विलेयताओं में अन्तर पर आधारित है। इस विधि में अशुद्ध यौगिक को किसी ऐसे विलायक में घोलते हैं, जिसमें यौगिक सामान्य ताप पर अल्प-विलेय होता है, परन्तु उच्च ताप पर वह पर्याप्त मात्रा में घुल जाता है। फिर विलयन को इतना सान्द्रित करते हैं कि वह लगभग संतृप्त (Saturate) हो जाए। विलयन को ठण्डा करने पर शुद्ध पदार्थ क्रिस्टलित हो जाता है, जिसे छानकर (Filtration) पृथक् कर लेते हैं। छनित ( मात्र द्रव) में अशुद्धियाँ तथा यौगिक की अल्प मात्रा रह जाती है। जब यौगिक किसी एक विलायक में अत्यधिक विलेय तथा किसी अन्य विलायक में अल्प विलेय होता है, तब क्रिस्टलन उचित मात्रा में इन विलायकों के मिश्रण द्वारा किया जाता है। सक्रियित काष्ठ चारकोल की सहायता से रंगीन अशुद्धियाँ दूर कर दी जाती हैं। यौगिक तथा अशुद्धियों की विलेयताओं में कम अन्तर होने पर बार-बार क्रिस्टलन द्वारा शुद्ध यौगिक प्राप्त किया जाता है।
(ख) आसवन (Distillation): आसवन की सहायता से (i) वाष्पशील (Volatile) द्रवों को अवाष्पशील अशुद्धियों से तथा (ii) ऐसे द्रवों, जिनके क्वथनांकों में पर्याप्त अन्तर हो, को पृथक् कर सकते हैं। भिन्न-भिन्न क्वथनांकों वाले द्रव भिन्न-भिन्न ताप पर वाष्पित होते हैं। वाष्पों को ठण्डा करने से प्राप्त द्रवों को पृथक् पृथक् एकत्रित कर लेते हैं। क्लोरोफार्म (क्वथनांक 334 K) और ऐनिलीन ( क्वथनांक 457K) के मिश्रण को आसवन विधि द्वारा पृथक् कर सकते हैं। इस विधि में द्रव मिश्रण को गोल पेंदे के फ्लास्क में लेकर गरम करते हैं, तो कम क्वथनांक वाले द्रव की वाष्प पहले बनेगी, जिसको संघनित करके ग्राही में एकत्रित कर लेते हैं तथा उच्च क्वथनांक वाले द्रव की वाष्प बाद में बनती है।
(ग) क्रोमेटोग्रैफी (वर्णलेखन): वर्णलेखन एक अत्यन्त महत्त्वपूर्ण तकनीक है जिसका उपयोग यौगिकों का शोधन करने, किसी मिश्रण के अयवयों को पृथक् करने तथा यौगिकों की शुद्धता की जाँच करने के लिए किया जाता है। उदाहरण: ऐमीनो अम्लों के मिश्रण का पृथक्करण। क्रोमेटोग्रफी में सर्वप्रथम यौगिकों के मिश्रण को स्थिर प्रावस्था (Stationary Phase) पर अधिशोषित किया जाता है। स्थिर प्रावस्था ठोस अथवा द्रव होती है। इसके बाद स्थिर प्रावस्था में से उपयुक्त विलायक, विलायकों का मिश्रण अथवा गैस को धीरे-धीरे प्रवाहित किया जाता है जिससे मिश्रण के अवयव क्रमशः एक-दूसरे से पृथक् हो जाते हैं। यहाँ गति करने वाली प्रावस्था को 'गतिशील प्रावस्था' (Mobile Phase) कहते हैं।
इसमें निहित सिद्धान्तों के आधार पर वर्णलेखन को मुख्यतः दो भागों में वर्गीकृत किया गया है:
(a) अधिशोषण-वर्णलेखन (Adsorption Chromatography)
(b) वितरण - वर्णलेखन (Partition Chromatography)।
प्रश्न 12.19.
ऐसे दो यौगिकों, जिनकी विलेयताएँ विलायक S में भिन्न हैं, को पृथक् करने की विधि की व्याख्या कीजिए।
उत्तर:
दो यौगिक जिनकी विलेयताएँ विलायक S में भिन्न हैं, उन्हें प्रभाजी क्रिस्टलन (Fractional Crystallisation) द्वारा पृथक् किया जाता है। इन यौगिकों के मिश्रण का गर्म तथा संतृप्त विलयन बनाकर उसे ठण्डा करने पर पहले वह यौगिक क्रिस्टलित होता है जिसकी विलेयता कम है तथा अधिक विलेय यौगिक विलयन में ही रह जाता है। क्रिस्टलों को मातृ द्रव (Mother Liquor) से पृथक् कर लेते हैं तथा मातृ द्रव को पुनः सान्द्रित करते हैं एवं गर्म विलयन को पुनः ठण्डा करने पर दूसरे यौगिक का भी क्रिस्टलन हो जाता है। क्रिस्टलों को छानकर सुखा लेते हैं।

प्रश्न 12.20
आसवन, निम्न दाब पर आसवन तथा भाप आसवन में क्या अंतर है? विवेचना कीजिए।
उत्तर:
(i) आसवन (Distillation): यह एक सरल प्रक्रिया है जिसमें अशुद्ध द्रव को क्रमशः वाष्पीकृत तथा संघनित (Condense) करके शुद्ध द्रव एकत्रित कर लिया जाता है तथा अशुद्धियाँ आसवन पात्र में ही रह जाती हैं।
आसवन = वाष्पन संघनन
(ii) निम्न दाब पर आसवन (Distillation at Reduced Pressure): आसवन की यह विधि उन द्रवों के आसवन हेतु प्रयुक्त की जाती है जो अपने क्वथनांक पर विघटित हो जाते हैं तथा इसे उच्च क्वथनांक वाले द्रवों के शुद्धीकरण में भी प्रयुक्त किया जाता है। आसवन की यह प्रक्रिया निर्वात पम्प लगाकर की जाती है। निर्वात द्वारा दाब कम होने से द्रव का क्वथनांक भी कम हो जाता है।
(iii) भाषीय आसवन (Steam Distillation): भाषीय आसवन उन द्रवों के शुद्धीकरण में प्रयुक्त किया जाता है जो जल में अविलेय होते हैं परन्तु जल वाष्प से वाष्पीकृत होते हैं। जैसे ऐनिलीन का शुद्धीकरण भाषीय आसवन विधि द्वारा किया जाता है। इस विधि में एक पृथक् पात्र में जल वाष्प बनाते हैं तथा इसे तप्त द्रव में से गुजारते हैं। प्राप्त वाष्प को संघनित करके शुद्ध द्रव को एकत्रित कर लेते हैं तथा अशुद्धियाँ पात्र में ही रह जाती हैं।
प्रश्न 12.21.
लैसें परीक्षण का रसायन सिद्धांत समझाइए।
उत्तर:
लैसें परीक्षण (Lassaigne's Test): कार्बनिक यौगिकों में परमाणु एक-दूसरे से सहसंयोजक बन्धों द्वारा जुड़े होते हैं। अतः ये जलीय विलयन में आयनित नहीं होते हैं। किसी कार्बनिक यौगिक में N, S, P Cl, Br तथा I तत्वों की उपस्थिति की पहचान करने के लिए यौगिक को सोडियम धातु के साथ उच्च ताप पर संगलित (Fuse) करते हैं। यौगिक में उपस्थित Cl, Br, IN या S तत्व सोडियम धातु से अभिक्रिया करके सोडियम लवण बना लेते हैं। सोडियम संगलन से प्राप्त अवशेष को आसुत जल के साथ उबालने पर अभिक्रिया से बने सोडियम सायनाइड, सल्फाइड तथा हैलाइड जल में घुल कर आयनित हो जाते हैं। इस निष्कर्ष को सोडियम संगलन निष्कर्ष या लैसें विलयन कहा जाता है।
सोडियम संगलन में होने वाली अभिक्रियाएँ (Sodium Fusion Reactions):
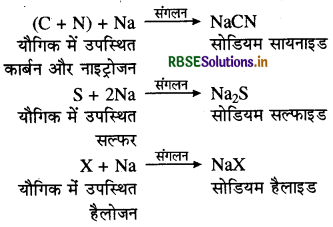
(X = Cl, Br, I)
प्रश्न 12.22.
किसी कार्बनिक यौगिक में नाइट्रोजन के आकलन की (i) ड्यूमा विधि तथा (ii) कैल्डॉल विधि के सिद्धांत की रूपरेखा प्रस्तुत कीजिए।
उत्तर:
फास्फोरस के आकलन के लिए ।कार्बनिक यौगिक की ज्ञात मात्रा को सधूम नाइट्रिक अम्ल HNO3 के साथ गरम करते हैं जिससे उसमें उपस्थित फॉस्फोरस, फॉस्फोरिक अम्ल H3PO4 में ऑक्सीकृत हो जाता है। इसमें अमोनिया तथा अमोनियम मॉलिब्डेट विलयन मिलाने पर अमोनियम फॉस्फोमॉलिब्डेट, NH3PO4, 12 MO3 का अवक्षेप प्राप्त होता है अथवा फॉस्फोरिक अम्ल में मेग्नेसिया मिश्रण मिलाने पर MgNH4 PO4 का अवक्षेप प्राप्त होता है जिसके ज्वलन से Mg2 P2O7 प्राप्त होता है।
प्रश्न 12.23.
किसी यौगिक में हैलोजेन, सल्फर तथा फॉस्फोरस के आकलन के सिद्धांत की विवेचना कीजिए।
उत्तर:
हैलोजेन, सल्फर तथा फॉस्फोरस के आकलन के सिद्धान्तों के अनुसार निम्नलिखित सूत्र प्रयुक्त होते हैं:
(i) हैलोजेनों (CI, Br, I) का आकलन:

यहाँ m1 = प्राप्त AgX का द्रव्यमान
m = कार्बनिक यौगिक का द्रव्यमान
(ii) सल्फर का आकलन:
S का % = \(\frac{32 \times \mathrm{m}_1 \times 100}{233 \times \mathrm{m}}\)
S का परमाणु द्रव्यमान = 32
BaSO4 का आण्विक द्रव्यमान = 233
m1 = BaSO4 का द्रव्यमान
m = कार्बनिक यौगिक का द्रव्यमान
(iii) फॉस्फोरस का आकलन:
P का % = \(\frac{62 \times m_1 \times 100}{1877 \times m}\)
P का परमाणु द्रव्यमान = 62
अमोनियम फॉस्फोमोलिब्डेट का आण्विक द्रव्यमान = 1877
m = अमोनियम फॉस्फोमॉलिब्डेट का द्रव्यमान
m = कार्बनिक यौगिक का द्रव्यमान
प्रश्न 12.24.
पेपर क्रोमेटोग्रैफी के सिद्धांत को समझाइए।
उत्तर: पेपर क्रोमेटोग्रफी - यह एक प्रकार की वितरण क्रोमेटोग्रफी है। यह क्रोमेटोग्रफी स्थिर तथा गतिशील प्रावस्थाओं के मध्य मिश्रण के अवयवों के सतत विभेदी वितरण (Continuous Differential Distribution) पर आधारित है। पेपर क्रोमेटोग्रफी में एक विशिष्ट प्रकार का क्रोमेटोग्रफी पेपर प्रयुक्त करते हैं, जिसके छिद्रों में जल के अणु पाशित (Trapped) रहते हैं जो एक स्थिर प्रावस्था का कार्य करते हैं।
प्रश्न 12.25.
'सोडियम संगलन निष्कर्ष' में हैलोजेन के परीक्षण के लिए सिल्वर नाइट्रेट मिलाने से पूर्व नाइट्रिक अम्ल क्यों मिलाया जाता है?
उत्तर:
यौगिक में नाइट्रोजन अथवा सल्फर उपस्थित होने पर हैलोजन का परीक्षण करने से पहले सोडियम निष्कर्ष को नाइट्रिक अम्ल के साथ उबाला जाता है ताकि सायनाइड अथवा सल्फाइड विघटित हो जाए। नाइट्रिक अम्ल (HNO3) मिलाने पर सोडियम निष्कर्ष से HCN तथा H2S गैस मुक्त होती हैं
रासायनिक अभिक्रिया निम्न प्रकार से होती है:
NaCN + HNO3 → NaNO3 + HCN
Na2S + 2HNO3 → 2NaNO3 + H2S
यदि साइनाइड तथा सल्फाइड को मुक्त नहीं किया जाए तो ये सिल्वर नाइट्रेट (AgNO3) से क्रिया करके AgCN तथा Ag2S का क्रमश: भूरा तथा काला अवक्षेप देंगे, जिससे हैलोजन के परीक्षण में बाधा उत्पन्न होगी।
NaCN + AgNO3 → AgCN + NaNO3
Na2S + 2AgNO3 → Ag2S + 2NaNO3
काला अवक्षेप
प्रश्न 12.26.
नाइट्रोजन, सल्फर तथा फॉस्फोरस के परीक्षण के लिए सोडियम के साथ कार्बनिक यौगिक का संगलन क्यों किया जाता है?
उत्तर:
सोडियम एक क्रियाशील धातु है अतः यह यौगिक में उपस्थित नाइट्रोजन से क्रिया करके NaCN, सल्फर से क्रिया करके Na2S तथा फॉस्फोरस से क्रिया करके Na3 PO4 बनाता है। इस प्रकार से प्राप्त यौगिक आयनिक प्रकृति के होते हैं जो जल में घुलकर आसानी से परीक्षण दे देते हैं। इसी कारण कार्बनिक यौगिकों का सोडियम के साथ संगलन (Fusion ) किया जाता है।
प्रश्न 12.27.
कैल्सियम सल्फेट तथा कपूर के मिश्रण के अवयवों को पृथक् करने के लिए एक उपयुक्त तकनीक बताइए।
उत्तर:
कैल्सियम सल्फेट (CaSO4) एक अकार्बनिक पदार्थ है जो ऊर्ध्वपातित नहीं होता जबकि कपूर (Camphor ) एक ऊर्ध्वपातित होने वाला (Sublime ) वाष्पशील कार्बनिक पदार्थ है जिसे गरम करने पर सीधा ही ठोस से वाष्प अवस्था में बदल जाता है। अतः CaSO4 तथा कपूर के मिश्रण को ऊर्ध्वपातन द्वारा पृथक् किया जा सकता है। ऐसा करने पर कीप के ऊपरी सिरे पर कपूर संघनित हो जायेगा, जबकि पोर्सेलीन के पात्र में नीचे अवाष्पशील CaSO4 रह जायेगा अर्थात् मिश्रण के अवयव पृथक् हो जायेंगे।

प्रश्न 12.28
भाप - आसवन करने पर एक कार्बनिक द्रव अपने क्वथनांक से निम्न ताप पर वाष्पीकृत क्यों हो जाता है?
उत्तर:
भाषीय आसवन विधि द्वारा केवल उन द्रवों का शुद्धीकरण किया जाता है जो जल से क्रिया नहीं करते परन्तु जल वाष्प से वाष्पीकृत हो जाते हैं। भाप आसवन में कार्बनिक द्रव के वाष्प दाब (P1) तथा जल के वाष्प दाब (P2) का योग वायुमण्डलीय दाब (P) के बराबर होने पर द्रव उबलने लगता है, अर्थात् P = P1 + P2 मिश्रण के क्वथनांक के समीप जल का वाष्प दाब बहुत अधिक तथा द्रव का वाष्प दाब बहुत कम हो जाता है, अतः कार्बनिक द्रव वायुमण्डलीय दाब से कम दाब पर ही आसवित हो जाता है। अर्थात् P1 का मान P से कम है अतः द्रव अपने क्वथनांक से कम ताप पर ही वाष्पीकृत हो जाता है।
प्रश्न 12.29.
क्या CCl4 सिल्वर नाइट्रेट के साथ गरम करने पर AgCl का श्वेत अवक्षेप देगा? अपने उत्तर को कारण सहित समझाइए।
उत्तर:
CCl4. सिल्वर नाइट्रेट (AgNO3) विलयन के साथ गरम करने पर AgCl का श्वेत अवक्षेप नहीं देगा क्योंकि CCl4 एक अध्रुवीय सहसंयोजक अणु है, जबकि AgNO3 आयनिक प्रकृति का यौगिक है अत: CCl4 में AgNO3 विलयन मिलाने पर CCl4 का आयनन नहीं होता है अतः विलयन में मुक्त Cl प्राप्त नहीं होते।
प्रश्न 12.30.
किसी कार्बनिक यौगिक में कार्बन का आकलन करते समय उत्पन्न कार्बन डाइऑक्साइड को अवशोषित करने के लिए पोटैशियम हाइड्रॉक्साइड विलयन का उपयोग क्यों किया जाता है?
उत्तर:
कार्बन डाइऑक्साइड (CO2) अम्लीय प्रकृति की गैस होती है जबकि पोटैशियम हाइड्रॉक्साइड (KOH) प्रबल क्षार होता है। अतः कार्बन डाइऑक्साइड, पोटैशियम हाइड्रॉक्साइड के आधिक्य में क्रिया करके पोटैशियम कार्बोनेट (K2CO3) तथा जल बना देती है। अतः किसी कार्बनिक यौगिक में कार्बन की मात्रा का आकलन करने हेतु KOH के विलयन का उपयोग किया जाता है।
रासायनिक क्रिया निम्न प्रकार होती है:
2KOH (l) + CO2 (8) → K2CO3(s) + H2O(l)
KOH युक्त U नली के द्रव्यमान में वृद्धि, उत्पन्न CO2 के द्रव्यमान को दर्शाती है जिससे तथा यौगिक के द्रव्यमान से कार्बन की प्रतिशत मात्रा ज्ञात कर लेते हैं।
कार्बन की % मात्रा = 
प्रश्न 12.31.
सल्फर के लेड ऐसीटेट द्वारा परीक्षण में 'सोडियम संगलन निष्कर्ष' को ऐसीटिक अम्ल द्वारा उदासीन किया जाता है, न कि सल्फ्यूरिक अम्ल द्वारा क्यों?
उत्तर:
लैड ऐसीटेट, ऐसीटिक अम्ल (CH3COOH) में विलेय होता है, लेकिन सल्फ्यूरिक अम्ल (H2SO4) में अविलेय रहता है तथा यह H2SO4 से क्रिया करके लैड सल्फेट बनाता है जिसका श्वेत अवक्षेप प्राप्त होता है जिससे परीक्षण में बाधा उत्पन्न होती है। अतः सोडियम संगलन निष्कर्ष को CH3COOH द्वारा उदासीन किया जाता है, न कि H2SO4 द्वारा

प्रश्न 12.32.
एक कार्बनिक में 69% कार्बन, 4.8% हाइड्रोजन तथा शेष ऑक्सीजन है। इस यौगिक के 0.20g के पूर्ण दहन के फलस्वरूप उत्पन्न कार्बन डाइऑक्साइड तथा जल की मात्राओं की गणना कीजिए।
उत्तर:
कार्बन की प्रतिशत मात्रा

∵ CO2 का भार = \(\frac{69 \times 44 \times 0.20}{12 \times 100}\)
इसी प्रकार हाइड्रोजन की % मात्रा

अथवा
∴ H2O का द्रव्यमान = \(\frac{4.8 \times 18 \times 0.2}{2 \times 100}\)
= 0.0864 ग्राम
प्रश्न 12.33
0.50g कार्बनिक यौगिक को कैल्डॉल विधि के अनुसार उपचारित करने पर प्राप्त अमोनिया को 0.5 MH2SO4 के 50 ml में अवशोषित किया गया। अवशिष्ट अम्ल के उदासीनीकरण के लिए 0.5M NaOH के 50ml की आवश्यकता हुई। यौगिक में नाइट्रोजन की प्रतिशतता की गणना कीजिए।
उत्तर:
प्रथम पद में रासायनिक गणना द्वारा H2SO4 का आयतन ज्ञात किया जायेगा जबकि द्वितीय पद में यौगिक में नाइट्रोजन की प्रतिशत मात्रा ज्ञात की जायेगी।
आयतन
पद - I प्रयुक्त अम्ल (H2SO4) का आयतन
= 50 मि.ली. 0.5M H2SO4
= 25 मि.ली. 1.0M H2SO4
अम्ल के आधिक्य के उदासीनीकरण हेतु प्रयुक्त NaOH का आयतन
= 60 मि.ली. 0.5M NaOH
= 30 मि.ली. 1.0 M NaOH
1 मोल H2SO4, 2 मोल NaOH को उदासीन करता है।
अतः 2NaOH + H2SO4 → Na2SO4 + 2H2O
∴ 30 मि.ली. 1M NaOH = 15 मि.ली. 1M H2SO4
अत: NH3 द्वारा प्रयुक्त अम्ल का आयतन = 25 - 15 = 10 मि.ली.
पद - II
∵ 1 मोल H2SO4 द्वारा 2 मोल NH3 उदासीन होती है।
∴ 10 मि.ली. 1 MH2SO4 = 20 मि.ली. 1M NH3
हम जानते हैं कि 1000 मि.ली. 1M NH3 में 14 ग्राम N2 होती है।
∴ 20 मि.ली. 1M NH3 में उपस्थित नाइट्रोजन = \(\frac{14}{1000} \times 20\)
∴ 0.5 g कार्बनिक यौगिक में उपस्थित नाइट्रोजन की % मात्रा
\(=\frac{14}{1000} \times \frac{20}{0.5} \times 100\)
= 56.0
प्रश्न 12.34.
कैरिअस आकलन में 0.3780g कार्बनिक क्लोरोयौगिक से 0.5740 g सिल्वर क्लोराइड प्राप्त हुआ। यौगिक में क्लोरीन की प्रतिशतता की गणना कीजिए।
उत्तर:
1 मोल AgCl = 1 ग्राम परमाणु Cl
(108 + 35.5) = 143.5 g AgCl = 35.5g Cl
अतः क्लोरीन की प्रतिशतता

∴ Cl की % 37.566 = 37.57
प्रश्न 12.35.
कैरिअस विधि द्वारा सल्फर के आकलन में 0.468 g सल्फरयुक्त कार्बनिक यौगिक से 0.668 g बेरियम सल्फेट -प्राप्त हुआ। दिए गए कार्बनिक यौगिक में सल्फर की प्रतिशतता की गणना कीजिए।
उत्तर:
1 मोल BaSO4 = 1 ग्राम परमाणु सल्फर (S)
[137 + 32 + (4 x 16 )] = 233g
BaSO4 = 32 g S
अतः सल्फर की प्रतिशतता

∴ सल्फर की प्रतिशतता = 19.60

12.36.
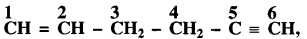
कार्बनिक यौगिक में C2 - C3 आबंध किन संकरित कक्षकों के युग्म से निर्मित होता है?
(क) sp - sp2
(ग) sp2 - sp3
(ख) sp - sp3
(घ) sp3 - sp3
उत्तर:
(ग) जब द्विआबन्ध तथा त्रिआबन्ध की स्थिति समान होती है तो अंकन द्विआबन्ध की तरफ से किया जाता है। C2 पर 3σ बन्ध तथा C3 पर 4σ बन्ध है, अत: C2 - C3 के मध्य बन्ध sp2 - sp3 संकरित कक्षकों से बना है।
प्रश्न 12.37.
किसी कार्बनिक यौगिक में लैसें परीक्षण द्वारा नाइट्रोजन की जाँच में प्रशियन ब्लू रंग निम्नलिखित में से किसके कारण प्राप्त होता है?
(क) Na [Fe (CN)6]
(ख) Fe4 [Fe(CN)6]3
(ग) Fe2[Fe (CN)6]
(घ) Fe3[Fe(CN)6]4
उत्तर:
(ख) Fe4 [Fe(CN)6]3 इस परीक्षण में फैरी फैरोसाइनाइड बनने के कारण प्रशियन ब्लू रंग प्राप्त होता है।
प्रश्न 12.38.
निम्नलिखित कार्बधनायनों में से कौनसा सबसे अधिक स्थायी है?
(क) (CH3)3C.Č+H2
(ख) (CH3)3Č+
(ग) CH3CH2C+H2
(घ) CH3 CHCH2 CH3
उत्तर:
(ख) (CH3)3C+ यह तृतीयकब्यूटिल कार्बधनायन (3) है अतः सबसे अधिक स्थायी कार्बधनायन है।
प्रश्न 12.39.
कार्बनिक यौगिकों के पृथक्करण और शोधन की सर्वोत्तम तथा आधुनिकतम तकनीक कौन-सी है?
(क) क्रिस्टलन
(ग) ऊर्ध्वपातन
(ख) आसवन
(घ) क्रोमेटोग्रफी
उत्तर:
(घ) क्रोमेटोग्रैफी (वर्णलेखिकी)।
प्रश्न 12.40.
CH3CHI + KOH (aq) → CH3CH2OH + KI अभिक्रिया को नीचे दिए गए प्रकार में वर्गीकृत कीजिए:
(क) इलेक्ट्रॉनस्नेही प्रतिस्थापन
(ख) नाभिकस्नेही प्रतिस्थापन
(ग) विलोपन
(घ) संकलन
उत्तर:
(ख) नाभिकस्नेही प्रतिस्थापन।

- RBSE Class 11 Chemistry Important Questions Chapter 2 Structure of Atom
- RBSE Solutions for Class 11 Chemistry Chapter 14 Environmental Chemistry
- RBSE Solutions for Class 11 Chemistry Chapter 13 Hydrocarbons
- RBSE Solutions for Class 11 Chemistry Chapter 12 Organic Chemistry - Some Basic Principles and Techniques
- RBSE Solutions for Class 11 Chemistry Chapter 11 The p-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 10 The s-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 9 Hydrogen
- RBSE Solutions for Class 11 Chemistry Chapter 8 Redox Reactions
- RBSE Solutions for Class 11 Chemistry Chapter 7 Equilibrium
- RBSE Solutions for Class 11 Chemistry Chapter 6 Thermodynamics
- RBSE Solutions for Class 11 Chemistry Chapter 5 States of Matter