RBSE Solutions for Class 11 Chemistry Chapter 11 p-ब्लॉक तत्त्व
Rajasthan Board RBSE Solutions for Class 11 Chemistry Chapter 11 p-ब्लॉक तत्त्व Textbook Exercise Questions and Answers.
RBSE Class 11 Chemistry Solutions Chapter 11 p-ब्लॉक तत्त्व
RBSE Class 11 Chemistry p-ब्लॉक तत्त्व Textbook Questions and Answers
प्रश्न 11.1.
(क) B से TI तक तथा
(ख) C से Pb तक की ऑक्सीकरण अवस्थाओं की भिन्नता के क्रम की व्याख्या कीजिए।
उत्तर:
(क) B से TI तक की ऑक्सीकरण अवस्थाएँ: वर्ग में ऊपर से नीचे जाने पर कक्षक में उपस्थित इलेक्ट्रॉन युग्म की बन्ध बनाने में भाग लेने की प्रवृत्ति कम होती जाती है अर्थात् कक्षक में उपस्थित इलेक्ट्रॉन युग्म निष्क्रिय हो जाता है। इसे अक्रिय युग्म प्रभाव कहते हैं। अक्रिय युग्म प्रभाव के कारण ही ये तत्व +1 ऑक्सीकरण अवस्था भी दर्शाते हैं तथा वर्ग में नीचे जाने पर +1 ऑक्सीकरण अवस्था का स्थायित्व बढ़ता है।
(ख) C से Pb तक की ऑक्सीकरण अवस्थाएँ: वर्ग 14 के तत्वों (C से Pb) का सामान्य इलेक्ट्रॉनिक विन्यास nsnp2 होता है, अतः इस वर्ग के सभी तत्व +4 ऑक्सीकरण अवस्था दर्शाते हैं। परन्तु Ge, Sn तथा Pb +4 अवस्था के साथ-साथ +2 ऑक्सीकरण अवस्था भी दर्शाते हैं, इसका कारण भी अक्रिय युग्म प्रभाव ही है तथा वर्ग में नीचे जाने पर +2 ऑक्सीकरण अवस्था का स्थायित्व बढ़ता है।
प्रश्न 11.2.
TiCl3 की तुलना में BCl3 के उच्च स्थायित्व को आप कैसे समझाएँगे?
उत्तर:
B का इलेक्ट्रॉनिक विन्यास 1s2 2s2 2p1 है। इसमें अक्रिय युग्म प्रभाव नहीं पाया जाता है तथा यह उत्तेजित अवस्था में BCl3 बनाता है जो कि एक स्थायी यौगिक है जिसमें B पर sp2 संकरण है। TI में नाभिकीय आवेश, परिरक्षण प्रभाव से अधिक होता है इसलिए इसमें अक्रिय युग्म प्रभाव, अधिक प्रभावी होता है अतः यह +1 ऑक्सीकरण अवस्था में TICl3 बनाता है जो कि TICl3 से अधिक स्थायी होता है तथा 11 की +1 अवस्था, +3 अवस्था से अधिक स्थायी होती है।

प्रश्न 11.3.
बोरॉन ट्राइफ्लुओराइड लूइस अम्ल के समान व्यवहार क्यों प्रदर्शित करता है?
उत्तर:
BF3 में B पर sp2 संकरण होता है। इसके इलेक्ट्रॉनिक विन्यास से स्पष्ट है कि BF बनने के बाद भी बोरॉन के पास एक 2p- कक्षक रिक्त रह जाता है अर्थात् बोरॉन के पास केवल 6 इलेक्ट्रॉन हैं। 1 (अपूर्ण अष्टक)। अतः यह एक इलेक्ट्रॉन न्यून यौगिक होता है इसलिए यह आसानी से इलेक्ट्रॉन युग्म ग्रहण करता है। अतः यह लूइस अम्ल के समान व्यवहार प्रदर्शित करता है तथा अपना अष्टक पूर्ण करने के लिए लूइस क्षारों से संयोग करता है।
प्रश्न 11.4.
BCl3 तथा CCl4 यौगिकों का उदाहरण देते हुए जल के प्रति इनके व्यवहार के औचित्य को समझाइए।
उत्तर:
BCl3 में बोरॉन के पास केवल 6 इलेक्ट्रॉन हैं अतः यह एक इलेक्ट्रॉन न्यून यौगिक है इसलिए यह जल के ऑक्सीजन परमाणु से इलेक्ट्रॉन युग्म ग्रहण कर लेता है। अत: BCl3 का जल अपघटन हो जाता है तथा HCl HBO3 बनते हैं।
BCl3 + 3H2O → 3HCl + HBO (बोरिक अम्ल )
CCl में कार्बन परमाणु के पास रिक्त d कक्षक उपलब्ध नहीं होते हैं तथा इसमें सभी परमाणुओं के अष्टक भी पूर्ण हैं अतः यह इलेक्ट्रॉन युग्म ग्रहण नहीं करता है तथा कार्बन के पास एकाकी इलेक्ट्रॉन युग्म नहीं होने के कारण यह इलेक्ट्रॉन युग्म का दान भी नहीं कर सकता, इसलिए CCl3, जल से क्रिया नहीं करता है अर्थात् इसका जल अपघटन नहीं होता है।
प्रश्न 11.5.
क्या बोरिक अम्ल प्रोटोनी अम्ल है? समझाइए।
उत्तर:
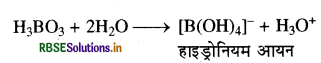
बोरिक अम्ल प्रोटोनी अम्ल नहीं है क्योंकि यह प्रोटोन नहीं देता है। लेकिन यह जल के OH से एक इलेक्ट्रॉन युग्म ग्रहण करता है, अतः यह लूइस अम्ल की भाँति व्यवहार करता है तथा यह एक क्षारकीय दुर्बल अम्ल है, इसी कारण यह NaOH के साथ क्रिया करके सोडियम मेटाबोरेट बनाता है।
B (OH) 3 + 2H2O → [B (OH)4]- + H3O+
B (OH)3 + NaOH → Na+ [B (OH)4]-
या Na+BO2 + 2H2O सोडियम मेटाबोरेट
प्रश्न 11.6.
क्या होता है, जब बोरिक अम्ल को गरम किया जाता है?
उत्तर:
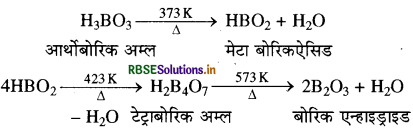
बोरिक अम्ल को 373K ताप पर गरम करने पर जल का अणु त्यागता है तथा मेटाबोरिक अम्ल देता है लेकिन जब इसे 423K ताप पर गरम करते हैं तो यह द्विगुणित होकर टेट्राबोरिक अम्ल बनाता है जो कि उच्च ताप (573K) पर जल का अणु त्यागकर बोरिक एनहाइड्राइड में परिवर्तित हो जाता है।
प्रश्न 11.7.
BF3 तथा BH4- की आकृति की व्याख्या कीजिए। इन स्पीशीज में बोरॉन के बोरिक एन्हाइड्राइड संकरण को निर्दिष्ट कीजिए।
उत्तर:
BF3 तथा BH4- की आकृति की व्याख्या संकरण के आधार पर की जाती है। BF3 का अणु sp2 संकरित होता है, जबकि BH4- आयन sp3 संकरित होता है क्योंकि BF3 में B तीन ० बन्ध बना रहा है जबकि BH-4 में B चार o बन्ध बना रहा है। BF3 के अणु की आकृति त्रिकोणीय समतल होती है, जबकि BH4- समचतुष्फलकीय होती है।

प्रश्न 11.8.
ऐलुमिनियम के उभयधर्मी व्यवहार दर्शाने वाली अभिक्रियाएँ दीजिए।
उत्तर:
ऐलुमिनियम वर्ग संख्या 13 का दूसरा सदस्य है। यह भी इलेक्ट्रॉन न्यून पदार्थ है। यह अम्ल तथा क्षार दोनों के साथ क्रिया करता है अर्थात् उभयधर्मी व्यवहार दर्शाता है, जो कि निम्नलिखित अभिक्रियाओं से स्पष्ट हो जाता है:
HCl से क्रिया:
2Al(s) + 6HCl(aq) → 2AlCl3 (aq) + 3H2 (g)
NaOH से क्रिया:
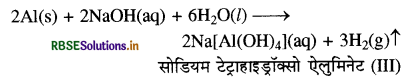
प्रश्न 11.9.
इलेक्ट्रॉन न्यून यौगिक क्या होते हैं? क्या BCl3 तथा SICl4 इलेक्ट्रॉन न्यून यौगिक हैं? समझाइए|
उत्तर:
इलेक्ट्रॉन न्यून यौगिक वे होते हैं जिनमें या तो केन्द्रीय परमाणु का अष्टक अपूर्ण होता है या केन्द्रीय परमाणु पर रिक्त d कक्षक पाए जाते हैं, जिससे वे अपनी संयोजकता का विस्तार कर सकें। BCl3 में B के पास केवल 6 इलेक्ट्रॉन हैं तथा SiCl4 में Si के पास रिक्त d कक्षक उपस्थित हैं अतः ये दोनों ही इलेक्ट्रॉन न्यून यौगिक हैं।

प्रश्न 11.10.
CO23- तथा HCO3- की अनुनादी संरचनाएँ लिखिए।
उत्तर:
कार्बोनेट आयन की अनुनादी संरचनाएँ निम्नलिखित
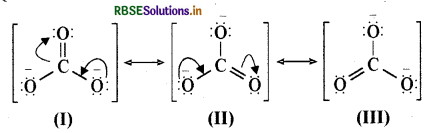
HCO3 की अनुनादी संरचनाएँ निम्नलिखित हैं-
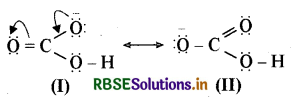
प्रश्न 11.11.
(क) CO3, (ख) हीरा तथा (ग) ग्रेफाइट में कार्बन की संकरण अवस्था क्या होती है ?
उत्तर:
(क) CO (कार्बोनेट आयन) में कार्बन तथा ऑक्सीजन के मध्य एक द्विआबन्ध पाया जाता है। अतः कार्बन तीन बन्ध बना रहा है इसलिए इसकी संकरण अवस्था sp2 है।
(ख) हीरा में मेथेन के समान चतुष्फलकीय जालक संरचना होती है जिसमें प्रत्येक कार्बन बन्ध बनाता है इसलिए इसमें चार कार्बन पर sp संकरण होता है।
(ग) ग्रेफाइट - ग्रेफाइट में कार्बन पर sp2 संकरण होता है; क्योंकि इसमें प्रत्येक कार्बन तीन बन्ध बनाता है।
प्रश्न 11.12.
संरचना के आधार पर हीरा तथा ग्रेफाइट के गुणों में निहित भिन्नता को समझाइए।
उत्तर:
संरचना के आधार पर हीरा तथा ग्रेफाइट के गुणों में निम्नलिखित भिन्नताएँ होती हैं:
|
|
क्षार-धातु |
क्षारीय-मृदा धातु |
|
संकरण |
Sp3 |
Sp2 |
|
संरचना |
इसमें चतुष्फलकीय इकाइयाँ होती हैं। |
इसकी परतदार संरचना होती है, जिसमें षट्कोणीय वलय होती है। |
|
बंध लम्बाई एवं बन्ध कोण |
हीरे में C - C बन्ध लम्बाई 1.54 A तथा बन्ध कोण 109 28 होता है। |
ग्रेफाइट में C - C बंध लम्बाई 1.42 AA तथा बंध कोण 120°C होता है। |
प्रश्न 11.13.
निम्नलिखित कथनों को युक्तिसंगत कीजिए तथा रासायनिक समीकरण दीजिए:
(क) लेड (II ) क्लोराइड Cl2 से क्रिया करके PbCl4 देता
(ख) लेड (IV) क्लोराइड ऊष्मा के प्रति अत्यधिक अस्थायी है।
(ग) लेड एक आयोडाइड Pbl4 नहीं बनाता है।
उत्तर:
(क) लेड (II) क्लोराइड (PbCl2), PbCl4 की अपेक्षा अधिक स्थायी होता है, अतः यह Cl2 से क्रिया नहीं करता तथा PbCl4 नहीं बनाता क्योंकि अक्रिय युग्म प्रभाव के कारण, Pb की +2 ऑक्सीकरण अवस्था +4 अवस्था से अधिक स्थायी होती है।
PbCl2 + Cl2 → PbCl4 (कम स्थायी)
(ख) Pb (IV) क्लोराइड ऊष्मा के प्रति अत्यधिक अस्थायी होता है, क्योंकि अक्रिय युग्म प्रभाव के कारण Pb की +2 ऑक्सीकरण अवस्था अधिक स्थायी होती है। अतः PbCl4 को गरम करते ही यह PbCl2 तथा Cl2 देता है क्योंकि कम स्थायी अवस्था (+4) अधिक स्थायी अवस्था (+2) में परिवर्तित हो जाती है।
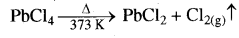
(ग) लेड, Pbl4 नहीं बनाता है क्योंकि Pb-I बन्ध जो प्रारम्भ में बनता है, इतनी ऊर्जा उत्पन्न नहीं कर पाता है कि इससे 6s2 इलेक्ट्रॉन उत्तेजित होकर चार अयुग्मित इलेक्ट्रॉन प्राप्त हो सकें तथा Pb+4, प्रबल ऑक्सीकारक एवं I प्रबल अपचायक होता है, अत: I- Pb+4 को Pb+2 में अपचयित कर देता है।

प्रश्न 11.14.
BF3 में तथा BF4- में बंध लम्बाई क्रमशः 130pm तथा 143 pm होने के कारण बताइए।
उत्तर:
BF3 में B पर sp2 संकरण पाया जाता है। इसमें रिक्त कक्षक तथा F के एकाकी इलेक्ट्रॉन युग्म के मध्य pπ - pπ पश्च बन्धन होने के कारण BF बन्ध में द्वि-आबन्ध के गुण आ जाते हैं। अतः बंध लम्बाई कम होकर 130 pm हो जाती है। जब BF3, F से क्रिया करता है तो BF आयन में बदल जाता है, जिसमें B पर sp3 संकरण होता है। अतः बंध लम्बाई बढ़ कर 143pm हो जाती है। क्योंकि. s गुण कम होने पर बन्ध लम्बाई बढ़ती है तथा BF में B के पास रिक्त कक्षक नहीं होने के कारण इसमें पश्च बन्धन भी नहीं होता अतः इसमें BF बन्ध शुद्ध एकल बन्ध होता है। इसलिए इसकी बन्ध-लम्बाई अधिक होती है।
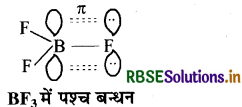
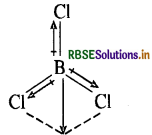
प्रश्न 11.15.
B-Cl आबंध द्विध्रुव आघूर्ण रखता है, किन्तु BCl3 अणु का द्विध्रुव आघूर्ण शून्य होता है। क्यों?
उत्तर:
B एक विद्युतधनी तथा Cl एक विद्युतऋणी तत्व है। (B की EN = 2.0 तथा Cl की EN= 3.0 है) विद्युतॠणता में अंतर के कारण BCl बंध में स्थायी ध्रुवता उत्पन्न हो जाती है अत: B-Cl आबंध द्विध्रुव आघूर्ण रखता है। लेकिन BCl का अणु त्रिकोणीय समतल होता है जिसमें दो BCl बन्धों का परिणामी द्विध्रुव आघूर्ण तीसरे BCl बन्ध के आघूर्ण से निरस्त हो जाता है जिसके परिणामस्वरूप BCl3 अणु का द्विध्रुव आघूर्ण शून्य होता है।
प्रश्न 11.16.
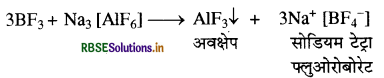
निर्जलीय HF में ऐलुमिनियम ट्राइफ्लुओराइड अविलेय है, परन्तु NaF मिलाने पर घुल जाता है। गैसीय BF3 को प्रवाहित करने पर परिणामी विलयन में से ऐलुमिनियम ट्राइफ्लुओराइड अवक्षेपित हो जाता है। इसका कारण बताइए।
उत्तर:
H-F में प्रबल अंतराअणुक H बंध होता है तथा यह सहसंयोजक अणु है, अतः यह F आयन नहीं देता इस कारण AlF3 निर्जल HF में अविलेय है, जबकि NaF एक आयनिक यौगिक है। अतः इसके विलयन में AIF3 मिलाया जाता है तो यह एक संकुल (सोडियम हैक्साफ्लुओरो ऐलुमिनेट III) बनाकर विलेय हो जाता है।
3NaF + AlF3 → Na3 [AlF6]
जब यह संकुल गैसीय BF के विलयन के संपर्क में आता है, तो टूटकर AIF3 देता है जिसका अवक्षेप प्राप्त होता है तथा साथ ही B का संकुल प्राप्त होता है क्योंकि B के छोटे आकार के कारण इसकी संकुल बनाने की क्षमता Al से अधिक होती है।
प्रश्न 11.17.
CO के विषैली होने का एक कारण बताइए।
उत्तर:
कार्बन मोनोऑक्साइड (CO) हीमोग्लोबिन के साथ स्थायी संकुल बनाती है जिसे कार्बोक्सी - हीमोग्लोबिन कहते हैं। यह ऑक्सी - हीमोग्लोबिन से 300 गुना अधिक स्थायी होता है। अतः इस संकुल के बनने के कारण ऑक्सीजन, ऑक्सी- हीमोग्लोबिन संकुल नहीं बना पाती है। इसलिए शरीर को ऑक्सीजन की आपूर्ति नहीं होती तथा पीड़ित व्यक्ति की मृत्यु हो जाती है।

प्रश्न 11.18.
CO2 की अधिक मात्रा भूमंडलीय तापवृद्धि के लिए उत्तरदायी कैसे है?
उत्तर:
जीवाश्म ईंधन के दहन तथा सीमेन्ट निर्माण के लिए चूना पत्थर के विघटन के कारण वायुमण्डल में CO2 की मात्रा बढ़ रही है यह अधिक CO2 पृथ्वी द्वारा विकिरणित ऊष्मा को अवशोषित करती है। इसमें से कुछ CO2 तो वायुमण्डल में चली जाती है तथा शेष CO2 वापस पृथ्वी की तरफ आ जाती है, जिससे पृथ्वी के ताप में वृद्धि हो रही है। इसे हरित गृह प्रभाव कहते हैं।
प्रश्न 11.19
डाइबोरेन तथा बोरिक अम्ल की संरचना समझाइए।
उत्तर:
क्षारीय। (संकेत- बोरेक्स, प्रबल क्षार (NaOH) तथा दुर्बल अम्ल (HBO3) से बना लवण है, अतः जल में डालने पर यह प्रबल क्षार (NaOH) बनाता है जो कि अधिक मात्रा में ŌH देता है अतः यह विलयन क्षारीय होता है।)
(i) CO का संश्लेषण - प्रयोगशाला विधि - फॉर्मिक अम्ल को सान्द्र H2SO42 की उपस्थिति में 373 K ताप पर गरम करने पर निर्जलीकरण होता है तथा अल्प मात्रा में शुद्ध CO गैस बनती है।
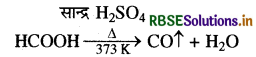
औद्योगिक स्तर पर CO का निर्माण रक्त तप्त कार्बन (कोक) पर जल वाष्प (भाप) प्रवाहित करके किया जाता है।
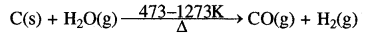
(CO तथा H2 के मिश्रण को वाटर गैस या संश्लेषण गैस कहते हैं।)
(ii) CO2- प्रयोगशाला में CO2 को CaCO3 पर HCl की क्रिया द्वारा बनाया जाता है:
CaCO3(s) + 2HCl(aq) → CaCl2 (aq) + H2O(l) + CO2 (g)
जबकि औद्योगिक स्तर पर इसे चूना पत्थर को गरम करके (तापीय विघटन ) प्राप्त किया जाता है:
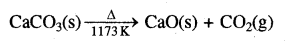
प्रश्न 11.20.
क्या होता है, जब:
(क) बोरेक्स को अधिक गरम किया जाता है।
(ख) बोरिक अम्ल को जल में मिलाया जाता है।
(ग) ऐलुमिनियम की तनु NaOH से अभिक्रिया कराई जाती है।
(घ) BF3 की क्रिया अमोनिया से की जाती है।
उत्तर:
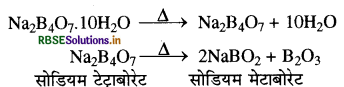
(क) बोरेक्स को गरम करने पर पहले यह क्रिस्टलन जल त्यागता है तथा सोडियम टेट्राबोरेट में बदल जाता है फिर इसे पुनः गरम करने पर सोडियम मेटाबोरेट तथा बोरिक एन्हाइड्राइड प्राप्त होते हैं।
(ख) बोरिक अम्ल, दुर्बल एकक्षारीय अम्ल है। यह लूइस अम्ल की तरह व्यवहार करता है तथा इसे जल में विलेय करने पर यह OH- ग्रहण करके, [B(OH)4]- आयन तथा हाइड्रोनियम आयन (H3O+) देता हैं।
(ग) ऐलुमिनियम की जलीय तनु NaOH से अभिक्रिया कराने पर एक संकुल बनता है जिसे सोडियम टेट्रा हाइड्रॉक्सो ऐलुमिनेट (III) कहते हैं। इस क्रिया में H2 भी मुक्त होती है।
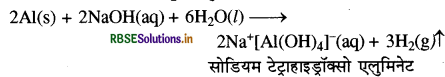
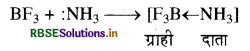
(घ) BF3 एक लूइस अम्ल है, जबकि NH3 एक लूइस क्षार। अत: जब BF3 की NH3 से क्रिया की जाती है, तो यह इलेक्ट्रॉन युग्म ग्रहण करके एक संकुल देता है जिसमें एक दाता ग्राही बंध बनता है। यह एक चतुष्फलकीय संरचनायुक्त यौगिक है।
BF3 + NH3 → [F3B ← NH3]

प्रश्न 11.21.
निम्नलिखित अभिक्रियाओं को समझाइए- क) कॉपर की उपस्थिति में उच्च ताप पर सिलिकन को मेथिल क्लोराइड के साथ गरम किया जाता है।
(ख) सिलिकन डाइऑक्साइड की क्रिया हाइड्रोजन फ्लुओराइड के साथ की जाती है।
(ग) CO को ZnO के साथ गरम किया जाता है।
(घ) जलीय ऐलुमिना की क्रिया जलीय NaOH के साथ की जाती है।
उत्तर:
(क) कॉपर की उपस्थिति में उच्च ताप पर सिलिकन को मेथिल क्लोराइड के साथ गर्म करने पर विभिन्न प्रकार के सिलिकॉन बनते हैं तथा अंतिम उत्पाद टेट्रामेथिल सिलेन (TMS) होता है।

(ख) सिलिकन डाइऑक्साइड (SiO2) की क्रिया HF के साथ की जाती है तो पहले SiF4 बनता है जो कि अन्त में H2SiF6 में परिवर्तित हो जाता है।
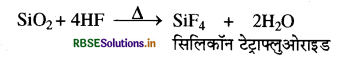
SiF4 + 2HF → H2SiF6
(ग) CO एक प्रबल अपचायक है। अतः इसे ZnO के साथ गरम करने पर यह उसे Zn में अपचयित कर देती है तथा स्वयं CO2 में ऑक्सीकृत हो जाती है।
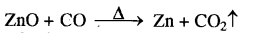
(घ) जलीय ऐलुमिना की जब जलीय NaOH के साथ क्रिया की जाती है तो निम्नलिखित संकुल बनता है-
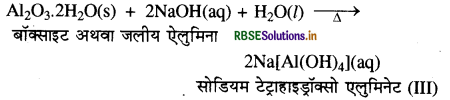
प्रश्न 11.22.
कारण बताइए:
(क) सांद्र HNO का परिवहन ऐलुमिनियम के पात्र द्वारा किया जा सकता है।
(ख) तनु NaOH तथा ऐलुमिनियम के टुकड़ों के मिश्रण का प्रयोग अपवाहिका (drain) खोलने के लिए किया जाता है। (ग) ग्रेफाइट शुष्क स्नेहक (Lubricant) के रूप में प्रयुक्त होता है।
(घ) हीरा का प्रयोग अपघर्षक (abrasive) के रूप में होता है।
(ङ) वायुयान बनाने में ऐलुमिनियम मिश्रधातु का उपयोग होता है।
(च) जल को ऐलुमिनियम पात्र में पूरी रात नहीं रखना चाहिए।
(छ) संचरण केबल बनाने में ऐलुमिनियम तार का प्रयोग होता है।
उत्तर:
(क) ऐलुमिनियम के पात्र में सान्द्र HNO3 का परिवहन करने पर यह ऐलुमिनियम से क्रिया करके ऐलुमिना (Al2O3) बनाता है, जिसकी पतली परत ऐलुमिनियम की सतह पर जम जाती है, जिससे यह कम क्रियाशील हो जाता है। अतः पुन: HNO3 से क्रिया नहीं करता इसलिए सान्द्र HNO3 का परिवहन ऐलुमिनियम के पात्र द्वारा किया जा सकता है।
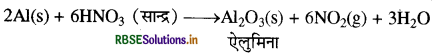
(ख) NaOH तथा ऐलुमिनियम की क्रिया से हाइड्रोजन गैस उत्पन्न होती है जिसके उच्च दाब से अपवाहिका खुल जाती है।
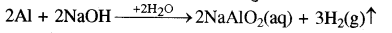
या 2Al(s) + 2NaOH (aq) + 6H2O(I) → 2Na [Al(OH)4](aq) + 3H2↑
(ग) ग्रेफाइट की परतदार संरचना होती है तथा इन परतों के मध्य स्वतंत्र इलेक्ट्रॉन पाये जाते हैं। इन परतों के मध्य दुर्बल वान्डरवाल बल पाया जाता है जिससे परतें एक-दूसरे के ऊपर आसानी से फिसल जाती हैं अतः ग्रेफाइट को शुष्क स्नेहक के रूप में प्रयुक्त किया जाता है।
(घ) हीरे में कार्बन परमाणु पर sp3 इसमें चतुष्फलकीय जालक होता है जिसके संकरण पाया जाता है, अतः किनारे नुकीले होते हैं। तथा यह नेटवर्क ठोस होने के कारण कठोर होता है, अतः इसे अपघर्षक के रूप में प्रयुक्त किया जाता है।
(ङ) ऐलुमिनियम मिश्र धातु (जैसे ड्यूरेलियम) हल्का, कठोर तथा संक्षारणरोधी होता है अतः इसे वायुयान बनाने में प्रयुक्त किया जाता है।
(च) ऐलुमिनियम के पात्र को जल के संपर्क में दीर्घकाल तक रखा जाता है तो यह जल से क्रिया करके ऐलुमिना (Al2O3) बना देता है, जो कुछ मात्रा में जल में विलेय होकर AI+ देता है, जो कि स्वास्थ्य के लिए हानिकारक है। अतः जल को ऐलुमिनियम के पात्र में पूरी रात नहीं रखना चाहिए।
2Al(s) + O2 (g) + H2O(l) → Al2O3(s) + H2 (g)
(छ) ऐलुमिनियम उच्च यांत्रिक सामर्थ्य युक्त विद्युत् का सुचालक धातु होता है तथा भार के आधार पर यह कॉपर की तुलना में दुगुनी विद्युत का संचरण करता है। अतः इसके तार का संचरण केबल बनाने में प्रयोग किया जाता है।
प्रश्न 11.23.
कार्बन से सिलिकॉन तक आयनीकरण एन्थैल्पी में प्रघटनीय (Phenomenal) कमी होती है। क्यों?
उत्तर:
वर्ग 14 का पहला सदस्य कार्बन तथा दूसरा सिलिकॉन है। कार्बन परमाणु में रिक्त d कक्षक नहीं पाये जाते हैं, जबकि Si में. रिक्त d कक्षक पाये जाते हैं। अतः कार्बन से सिलिकॉन तक परमाण्विक त्रिज्या में अधिक वृद्धि होती है। इस वृद्धि के परिणामस्वरूप
प्रश्न 11.24
Al की तुलना में Ga की कम परमाण्वीय त्रिज्या को आप कैसे समझाएँगे ?
उत्तर:
Ga की परमाणु त्रिज्या AI की परमाणु त्रिज्या से कम है। क्योंकि Ga में उपस्थित अतिरिक्त d इलेक्ट्रॉनों का परिरक्षण प्रभाव दुर्बल होता है अतः नाभिकीय आवेश का प्रभाव अधिक होता है, जिससे नाभिकीय आकर्षण बल बढ़ जाता है।
प्रश्न 11.25
अपररूप क्या होता है? कार्बन के दो महत्त्वपूर्ण अपररूप हीरा तथा ग्रेफाइट की संरचना का चित्र बनाइए। इन दोनों अपररूपों के भौतिक गुणों पर संरचना का क्या प्रभाव पड़ता है ?
उत्तर:
अपररूपता - अधात्विक तत्वों का वह गुण जिसमें कोई तत्व प्रकृति में दो या दो से अधिक भिन्न रूपों में पाया जाता है। इन रूपों को अपररूप कहते हैं तथा यह गुण अपररूपता कहलाता है। इनके भौतिक गुण भिन्न-भिन्न होते हैं, परन्तु अधिकांश रासायनिक अभिक्रियाएँ समान होती हैं।हीरा में क्रिस्टलीय जालक होता है। इसमें प्रत्येक कार्बन परमाणु sp3 संकरित अवस्था में होता है तथा अन्य चार कार्बन परमाणुओं से चतुष्फलकीय ज्यामिति में जुड़ा होता है। इसमें कार्बन- कार्बन बंध लम्बाई 154 pm होती है तथा कार्बन परमाणु द्विक् (space) में दृढ़ त्रिविमीय जालक (rigid three dimensional network) का निर्माण करते हैं। हीरे की संरचना में सम्पूर्ण जालक में दिशात्मक सहसंयोजक बंध पाए जाते हैं । अतः इस विस्तृत सहसंयोजक बंधन को तोड़ना कठिन होता है, इसलिए हीरा पृथ्वी पर पाया जाने वाला सर्वाधिक कठोर ठोस पदार्थ है । इसका घनत्व, गलनांक तथा अपवर्तनांक उच्च होता है। हीरे में मुक्त इलेक्ट्रॉन अनुपस्थित होने के कारण यह विद्युत का कुचालक होता है । यह अक्रिय होता है लेकिन उच्च ताप (975K) पर ऑक्सीजन में जल कर CO2 बनाता है। हीरे का उपयोग धार तेज करने के लिए अपघर्षण (Abrasive) के रूप में, रूपदा ( Dies) बनाने में तथा प्रकाश विद्युत लैम्प में टंग्स्टन तंतु बनाने में किया जाता है।
प्रश्न 11.26.
(क) निम्नलिखित ऑक्साइडों को उदासीन, अम्लीय क्षारीय तथा उभयधर्मी ऑक्साइड के रूप में वर्गीकृत कीजिए - CO, B2O3, SiO2, CO2 Al2O3 PbO2, TI2O3
(ख) इनकी प्रकृति को दर्शाने वाली रासायनिक अभिक्रिया लिखिए।
उत्तर:
(क) अम्लीय उभयधर्मी
- B2O3
- SiO2
- CO2
क्षारीय उदासीन
- TI2O3
ऑक्साइड ऑक्साइड
- PbO2
- Al2O3
ऑक्साइड ऑक्साइड
- CO
(ख) इनकी प्रकृति को दर्शाने वाली रासायनिक अभिक्रियाएँ निम्नलिखित हैं:
(i) अम्लीय ऑक्साइड- ये क्षारों के साथ क्रिया करते हैं।
B2O3 + 2NaOH → 2NaBO2 + H2O
SiO2 + 2NaOH → Na2SiO3 + H2O
CO2 + 2NaOH → Na2CO3 + H2O
(ii) क्षारीय ऑक्साइड यह अम्ल के साथ क्रिया करता है।
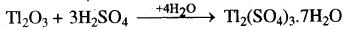
(iii) उभयधर्मी ऑक्साइड - ये अम्ल तथा क्षार दोनों से क्रिया करते हैं।
PbO2 + 2HNO3 → Pb (NO3)2 + H2O + [O]
PbO2 + 2NaOH → Na2PbO3 + H2O
इसी प्रकार:
Al2O3 + 3H2SO4 → Al2(SO4)3 + 3H2O
Al2O3 + 2NaOH → 2NaAlO2 + H2O

प्रश्न 11.27.
कुछ अभिक्रियाओं में थैलियम, ऐलुमिनियम से समानता दर्शाता है, जबकि अन्य में यह समूह-1 के धातुओं से समानता दर्शाता है। इस तथ्य को कुछ प्रमाणों के द्वारा सिद्ध करें।
उत्तर:
समूह-1 के सदस्य 5 खण्ड के तत्व हैं, जिन्हें क्षार धातु कहते हैं। इनकी ऑक्सीकरण अवस्था +1 होती है। इसी प्रकार, अक्रिय युग्म प्रभाव के कारण थैलियम भी +1 स्थायी ऑक्सीकरण अवस्था वाले कुछ यौगिक बनाता है।
उदाहरण: LiCl व NaCl के समान TICl भी ज्ञात है तथा Na2O के समान TI2O ज्ञात है, जो कि प्रबल क्षारीय है। थैलियम वर्ग 13 के सदस्य Al के समान +3 ऑक्सीकरण अवस्था वाले यौगिक जैसे TI2O3, TIF3, TI2(SO4)3 भी बनाता है तथा यह AI के समान संकुल आयनों का निर्माण भी करता है, [TIF6]- ये प्रमाण उपरोक्त तथ्य की पुष्टि करते हैं।
प्रश्न 11.28
जब धातु X की क्रिया सोडियम हाइड्रॉक्साइड के साथ की जाती है, तो श्वेत अवक्षेप (A) प्राप्त होता है, जो NaOH के आधिक्य में विलेय होकर विलेय संकुल (B) बनाता है। यौगिक (A) तनु HCl में घुलकर यौगिक (C) बनाता है। यौगिक (A) को अधिक गरम किये जाने पर यौगिक (D) बनता है, जो धातु के निष्कर्षण में प्रयुक्त होता है। X, A, B, C तथा D को पहचानिए तथा इनकी पहचान के समर्थन में उपयुक्त समीकरण दीजिए।
उत्तर:
X → Al धातु है।
A → Al(OH)3 है।
B → Na[Al(OH)] सोडियम टेट्राहाइड्रॉक्सो
C → AlCl3 है तथा
ऐलुमिनेट (III) संकुल है।
D → Al2O3 (निर्जल ऐलुमिना है) उपर्युक्त प्रक्रमों में होने समीकरण निम्नलिखित हैं:

Al(OH)3, क्षारीय होता है अत: यह तनु HCl में घुलकर AlCl3 ( विलेय) बनाता है।
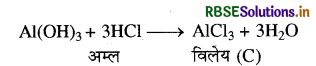
Al(OH)3 को गर्म करने पर Al2O3 बनता है जो एक निष्कर्षित धातु के रूप में प्रयुक्त होता है।
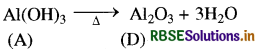
प्रश्न 11.29.
निम्नलिखित से आप क्या समझते हैं?
(क) अक्रिय युग्म प्रभाव (ख) अपररूप ( ग ) श्रृंखलन।
उत्तर:
(क) अक्रिय युग्म प्रभाव - यह प्रभाव P खण्ड के तत्वों द्वारा प्रदर्शित किया जाता है। वर्ग संख्या 13, 14 तथा 15 के हल्के तत्वों के लिए समूह ऑक्सीकरण अवस्था अधिक स्थायी होती है जो इनके संयोजी कोश में उपस्थित इलेक्ट्रॉनों की संख्या के समान होती है। लेकिन वर्ग के भारी तत्वों में समूह ऑक्सीकरण अवस्था से दो इकाई कम ऑक्सीकरण अवस्था अधिक स्थायी होती जाती है, क्योंकि इनमें d तथा/ कक्षकों के दुर्बल परिरक्षण प्रभाव के कारण बढ़ा हुआ नाभिकीय आवेश ns इलेक्ट्रॉनों को प्रबलता से बांधे रखता है। अतः ये इलेक्ट्रॉन बन्ध बनाने में भाग नहीं लेते, अर्थात् यह इलेक्ट्रॉनयुग्म अक्रिय हो जाता है। इसे अक्रिय युग्म प्रभाव कहते हैं।
(ख) अपररूपता - यह अधात्विक तत्वों का गुण है, जिसके अंतर्गत एक ही तत्व प्रकृति में दो अथवा दो से अधिक भिन्न रूपों में पाया जाता है जिनका रासायनिक संगठन तो समान होता है, परन्तु उनके भौतिक गुण भिन्न होते हैं। तत्वों का यह गुण अपररूपता कहलाता है। जैसे- कार्बन का एक अपररूप हीरा, कठोर तथा विद्युत् का कुचालक है, जबकि . दूसरा अपररूप ग्रेफाइट, नरम तथा विद्युत् का सुचालक होता है।
(ग) श्रृंखलन: किसी तत्व का वह गुण जिससे उसके अनेक परमाणु एक-दूसरे से एकल अथवा द्विबंध द्वारा इस प्रकार जुड़ते हैं कि एक दीर्घ श्रृंखला का निर्माण होता है, उसे श्रृंखलन कहते हैं। आवर्त सारणी में यह गुण कार्बन परमाणु में अधिकतम होता है। इसके छोटे परमाणु आकार, मध्यम विद्युतॠणता तथा रिक्त d कक्षकों की अनुपस्थिति के कारण यह श्रृंखलन करके सीधी श्रृंखला, शाखित श्रृंखला अथवा वलय युक्त यौगिक बनाता है।
प्रश्न 11.30.
एक लवण X निम्नलिखित परिणाम देता है- (क) इसका जलीय विलयन लिटमस के प्रति क्षारीय होता है।
(ख) तीव्र गरम किए जाने पर यह काँच के समान ठोस में स्वेदित (Swells up) हो जाता है।
(ग) जब X के गरम विलयन में सांद्र H2SO4 मिलाया जाता है, तो एक अम्ल Z का श्वेत क्रिस्टल बनता है।
उपर्युक्त अभिक्रियाओं के समीकरण लिखिए और X, Y तथा Z को पहचानिए ।
उत्तर:
(क) दिया गया लवण (X) बोरेक्स (Na2B4O7. 10H2O) है तथा इसका जलीय विलयन लिटमस के प्रति क्षारीय होता है क्योंकि यह जल से क्रिया करके प्रबल क्षार (NaOH) तथा दुर्बल अम्ल (H2B4O7) देता है।

(ख) जब बोरेक्स को उच्च ताप पर गरम किया जाता है तो यह काँच के समान ठोस पदार्थ (B2O3) में परिवर्तित हो जाता है जिसे बोरेक्स मनका कहते हैं।
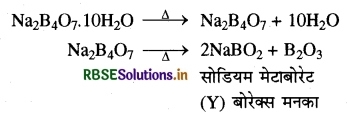
(ग) बोरेक्स (X), सान्द्र H2SO4 से क्रिया करके श्वेत क्रिस्टलीय पदार्थ (Z) बनाता है, जो कि H3BO3 (बोरिक अम्ल) है। इसमें रासायनिक अभिक्रिया निम्न प्रकार होती है:
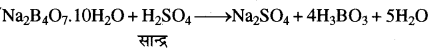
अतः संपूर्ण रासायनिक प्रक्रम में X = Na2B4O710H2O,
Y = B2O3 तथा Z = HBO है।
प्रश्न 11.31.
संतुलित समीकरण दीजिए:
(क) BF3 + LiH →
(ख) B2H6 + H2O →
(ग) NaH + B2H6 →
(घ) H3BO3
(ङ) Al + NaOH →
(च) B2H6 + NH3 →
उत्तर:

प्रश्न 11.32.
CO तथा CO2 प्रत्येक के संश्लेषण के लिए एक प्रयोगशाला तथा एक औद्योगिक विधि दीजिए।
उत्तर:
(i) CO का संश्लेषण - प्रयोगशाला विधि - फॉर्मिक अम्ल को सान्द्र H2SO42 की उपस्थिति में 373 K ताप पर गरम करने पर निर्जलीकरण होता है तथा अल्प मात्रा में शुद्ध CO गैस बनती है।
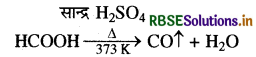
औद्योगिक स्तर पर CO का निर्माण रक्त तप्त कार्बन (कोक) पर जल वाष्प (भाप) प्रवाहित करके किया जाता है।
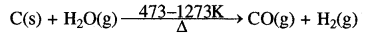
(CO तथा H2 के मिश्रण को वाटर गैस या संश्लेषण गैस कहते हैं।)
(ii) CO2- प्रयोगशाला में CO2 को CaCO3 पर HCl की क्रिया द्वारा बनाया जाता है:
CaCO3(s) + 2HCl(aq) → CaCl2 (aq) + H2O(l) + CO2 (g)
जबकि औद्योगिक स्तर पर इसे चूना पत्थर को गरम करके (तापीय विघटन ) प्राप्त किया जाता है:
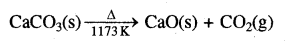

प्रश्न 11.33.
बोरेक्स के जलीय विलयन की प्रकृति कौनसी होती है?
(क) उदासीन
(ग) क्षारीय
(ख) उभयधर्मी
(घ) अम्लीय।
उत्तर:
(ग) क्षारीय। (संकेत- बोरेक्स, प्रबल क्षार (NaOH) तथा दुर्बल अम्ल (HBO3) से बना लवण है, अतः जल में डालने पर यह प्रबल क्षार (NaOH) बनाता है जो कि अधिक मात्रा में ŌH देता है अतः यह विलयन क्षारीय होता है।)
प्रश्न 11.34.
बोरिक अम्ल के बहुलकीय होने का कारण:
(क) इसकी अम्लीय प्रकृति है।
(ख) इसमें हाइड्रोजन बंधों की उपस्थिति है।
(ग) इसकी एक क्षारीय प्रकृति है।
(घ) इसकी ज्यामिति है।
उत्तर:
(ख) इसमें हाइड्रोजन बंधों की उपस्थिति है। (संकेत अंतराअणुक दशा में हाइड्रोजन तथा ऑक्सीजन के मध्य H-बंध बन जाते हैं, जिसके कारण इसका संगुणन हो जाता है तथा बहुलकीय प्रकृति का बोरिक अम्ल बनता है।)
प्रश्न 11.35.
डाइबोरेन में बोरॉन का संकरण कौनसा होता है?
(क) sp
(ख) sp
(ग) sp
(घ) dsp2
उत्तर:
(ग) sp संकरण
(संकेत - B2H में B तथा H के मध्य चार एकल बंध होने के कारण इसमें sp संकरण होता है।)
प्रश्न 11.36.
ऊष्मागतिकीय रूप से कार्बन का सर्वाधिक स्थायी रूप कौनसा है?
(क) हीरा
(ग) फुलरीन्स
(ख) ग्रेफाइट
(घ) कोयला।
उत्तर:
(ख) ग्रेफाइट। (संकेत - प्रकृति में चट्टानों का दाब कम होते ही हीरा, ग्रेफाइट में बदल जाता है, जो वर्षों तक पड़ा रहता है। अतः यह ऊष्मागतिकीय रूप से कार्बन का सर्वाधिक स्थायी रूप है।)
प्रश्न 11.37.
निम्नलिखित में से समूह-14 के तत्वों के लिए कौनसा कथन सत्य है ?
(क) + 4 ऑक्सीकरण प्रदर्शित करते हैं।
(ख) + 2 तथा + 4 ऑक्सीकरण अवस्था प्रदर्शित करते हैं।
(ग) M2- तथा M++ आयन बनाते हैं।
(घ) M2+ तथा M+ आयन बनाते हैं।
उत्तर:
(ख) +2 तथा +4 ऑक्सीकरण अवस्था प्रदर्शित करते हैं।
प्रश्न 11.38.
यदि सिलिकॉन निर्माण में प्रारंभिक पदार्थ RSICl3 है, तो बनने वाले उत्पाद की संरचना बताइए।
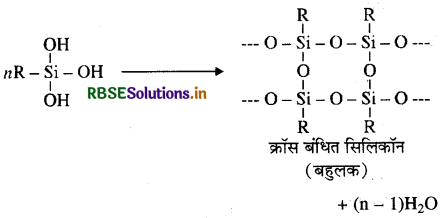
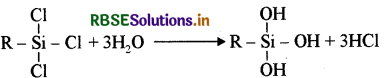
उत्तर:
सिलिकॉन के निर्माण में जब प्रारम्भिक पदार्थ ट्राइक्लोरोसिलेन (RSiCl3) लेते हैं तो क्रॉस बंधित सिलिकॉन प्राप्त होता है, क्योंकि RSICl3 का जल अपघटन कराने पर यह RSi(OH)3 एकलक देता है जिसके संघनन द्वारा क्रॉस बंधित सिलिकॉन बहुलक बनता है। प्राप्त सिलिकॉन की संरचना तथा रासायनिक अभिक्रियाएँ निम्नलिखित हैं:
(i) जल अपघटन:
(ii) संघनन बहुलकीकरण: