RBSE Solutions for Class 11 Chemistry Chapter 10 s-ब्लॉक तत्त्व
Rajasthan Board RBSE Solutions for Class 11 Chemistry Chapter 10 s-ब्लॉक तत्त्व Textbook Exercise Questions and Answers.
RBSE Class 11 Chemistry Solutions Chapter 10 s-ब्लॉक तत्त्व
RBSE Class 11 Chemistry s-ब्लॉक तत्त्व Textbook Questions and Answers
प्रश्न 10.1
क्षार धातुओं के सामान्य भौतिक तथा रासायनिक गुण क्या हैं?
उत्तर:
आवर्त सारणी के वर्ग 1 के तत्व क्षार धातु कहलाते हैं । इनके सामान्य भौतिक गुण निम्नलिखित हैं:
(i) भौतिक अवस्था - सभी क्षार धातु (Li, Na, K, Rb, Cs तथा Fr) ठोस होते हैं।
(ii) इलेक्ट्रॉनिक विन्यास - इनका बाह्यतम सामान्य इलेक्ट्रॉनिक विन्यास ns होता है।
(iii) ऑक्सीकरण अवस्था - क्षार धातुएँ + 1 ऑक्सीकरण अवस्था दर्शाती हैं क्योंकि ये एक इलेक्ट्रॉन त्यागकर स्थायी उत्कृष्ट गैस विन्यास प्राप्त करती हैं।
(iv) घनत्व - इनका घनत्व अन्य धातुओं से कम होता है तथा Li से Cs तक घनत्व बढ़ता है। अपवाद - K का घनत्व, Na घनत्व से कम होता है।
(v) क्वथनांक तथा गलनांक - दुर्बल धात्विक बंध के कारण इनके क्वथनांक तथा गलनांक कम होते हैं।
(vi) आयनन एन्थैल्पी - इन तत्वों की आयनन एन्थैल्पी का मान कम होता है, अतः ये आसानी से इलेक्ट्रॉन त्यागकर धनायन बनाती हैं।
M → M+ + e
(vii) परमाणु तथा आयनिक त्रिज्या - वर्ग में बढ़ती है।
(viii) जलयोजन एन्थैल्पी - आयनों का आकार बढ़ने पर जलयोजन एन्थैल्पी घटती है तथा इसका क्रम निम्न प्रकार होता है:
Li+ > Na+ > K+ > Rb+ > Cs+
(ix) धनायन बनाने की क्षमता - परमाण्विक त्रिज्या अधिक होने के कारण ये आसानी से धनायन बनाती हैं।
(x) ज्वाला को रंग-इनमें संयोजी इलेक्ट्रॉन ढीले बंधे होने के कारण ये ज्वाला को विशिष्ट रंग प्रदान करते हैं। Li लाल, Na सुनहरी - पीला, K बैंगनी, Rb लाल- बैंगनी तथा Cs नीला रंग देता है । (xi) स्रोत - इनके प्रमुख स्रोत पादप होते हैं।
(xii) प्रकाश विद्युत प्रभाव - Cs तथा K का उपयोग फोटो इलेक्ट्रिक सेल में किया जाता है।
(xiii) रेडियोधर्मिता - 87 Fr रेडियोधर्मी होता है। रासायनिक गुण - क्षार धातुएँ अत्यधिक क्रियाशील तत्व हैं।
इनकी प्रमुख रासायनिक अभिक्रियाएँ निम्नलिखित हैं:
(i) वायु से क्रिया - लीथियम ऑक्साइड Na - परॉक्साइड एवं K, Rb तथा Cs सुपर ऑक्साइड बनाते हैं।
4Li + O2 → 2Li2O (ऑक्साइड)
2Na + O2 → Na2O2 (परॉक्साइड)
K + O2 → KO2 (सुपर ऑक्साइड)
(ii) हाइड्रोजन से क्रिया उच्च ताप द्वारा हाइड्राइड बनते हैं।
2M + H2 → 2 M-H ये हाइड्राइड प्रबल अपचायक होते हैं।
(iii) नाइट्रोजन से क्रिया- लीथियम नाइट्रोजन से सीधी क्रिया करता है तथा नाइट्राइड बनाता है। वर्ग के अन्य सदस्य नाइट्रोजन से क्रिया नहीं करते हैं।
6Li + N2 → 2Li3N
(iv) जल से क्रिया - क्षार धातुओं की जल से क्रिया अत्यन्त तीव्र वेग से होती है तथा हाइड्रॉक्साइड बनते हैं तथा इस क्रिया में हाइड्रोजन मुक्त होती है।
2M + 2H2O → 2M-OH + H2↑
(v) हैलोजनों से क्रिया- इनकी हैलोजनों से क्रिया द्वारा हैलाइड बनते हैं।
2M + X2 → 2M-X (हैलाइड)
(vi) अमोनिया में विलयन - क्षार धातु द्रव NH3 में विलेय हो जाते हैं। यह विलयन नीला होता है तथा विद्युत का सुचालक होता है। इस विलयन में स्वतन्त्र (अमोनियाकृत) इलेक्ट्रॉन उपस्थित होते हैं।
M + (x+y) NH3 → [M(NH3)x]+ + [e -(NH3)y]
सारांश में यह कहा जा सकता है कि वर्ग संख्या 1 के तत्व अत्यधिक क्रियाशील होते हैं।

प्रश्न 10.2.
क्षारीय मृदा धातुओं के सामान्य अभिलक्षण एवं गुणों में आवर्तिता की विवेचना कीजिए।
उत्तर:
वर्ग 2 के तत्वों को क्षारीय मृदा धातुएँ कहते हैं। इस वर्ग में Be, Mg, Ca, Sr, Ba तथा Ra आते हैं। इनके सामान्य अभिलक्षण एवं गुण निम्नलिखित हैं:
भौतिक गुणधर्म:
(i) प्राप्ति मृदा की भीतरी परत तथा खनिज लवण युक्त चट्टानें इनके प्रमुख स्रोत हैं।
(ii) इलेक्ट्रॉनिक विन्यास - इनका बाह्यतम सामान्य इलेक्ट्रॉनिक विन्यास ns 2 होता है।
(iii) ऑक्सीकरण अवस्था - क्षारीय मृदा धातुएँ +2 ऑक्सीकरण अवस्था दर्शाती हैं क्योंकि इनके बाह्यतम कोश में दो इलेक्ट्रॉन पाये जाते हैं।
(iv) क्वथनांक तथा गलनांक - ये वर्ग संख्या 1 के तत्वों की तुलना में उच्च क्वथनांक तथा गलनांक रखते हैं।
(v) घनत्व - इनका घनत्व सामान्यतः Be से Ra तक बढ़ता है परन्तु Mg तथा Ca हल्के तत्व हैं।
Be > Mg > Ca < Sr < Ba
(vi) रेडियोधर्मिता - वर्ग का अंतिम तत्व रेडियम (88Ra ), रेडियोधर्मी होता है।
(vii) ज्वाला को रंग- Be तथा Mg ज्वाला को रंग प्रदान नहीं करते हैं लेकिन शेष सदस्य (Ca, Sr, Ba) ज्वाला को विशिष्ट रंग प्रदान करते हैं। Ca ईंट जैसा लाल, Ba सेब जैसा हरा तथा Sr रक्त जैसा लाल रंग देती हैं।
(viii) आयनन एन्थैल्पी - इनकी आयनन एन्थैल्पी वर्ग 1 के तत्वों की तुलना में उच्च होती है क्योंकि इनका नाभिकीय आवेश अधिक होता है। लेकिन इनकी द्वितीय आयनन एन्थैल्पी क्षार धातुओं की अपेक्षा कम होती है।
(ix) परमाण्विक त्रिज्या - वर्ग में परमाणु त्रिज्या बढ़ती है परन्तु वर्ग 1 के तत्वों की तुलना में यह कम होती है।
(x) आयनिक त्रिज्या - वर्ग में आयनिक त्रिज्या बढ़ती है परन्तु यह वर्ग 1 के तत्वों की तुलना में कम होती है।
(xi) धात्विक बंध- क्षारीय मृदा धातुओं में धात्विक बन्ध दुर्बल होता है अतः इन्हें तोड़ा तथा मरोड़ा जा सकता है।
रासायनिक गुण-वर्ग संख्या 1 के तत्वों के समान रासायनिक गुण दिखाते हैं; परन्तु ये उनसे कम क्रियाशील होते हैं।
(i) वायु से क्रिया - ये वायु में क्रिया करके ऑक्साइड बनाते हैं,
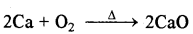
(ii) जल से क्रियाये जल से मन्द गति से क्रिया करते हैं तथा हाइड्रॉक्साइड बनाते हैं।
जैसे Ca + H2O → Ca(OH)2 + H2
लेकिन वर्ग में इनकी क्रियाशीलता कम होती है।
(iii) नाइट्रोजन से क्रिया ये तत्व नाइट्रोजन से क्रिया करके नाइट्राइड बनाते हैं।
3 Be + N2 → Be3N2
3 Ca + N2 → Ca3N2
(iv) हाइड्रोजन से क्रिया - वर्ग 2 के तत्व हाइड्रोजन से क्रिया करके MH2 प्रकार के हाइड्राइड्स बनाते हैं लेकिन BeH2 अप्रत्यक्ष विधि से बनाया जाता है।
2 BeCl2 + LiAlH4 → 2BeH2 + AlCl3 + LiCl
(v) हैलोजनों से क्रिया - यह क्रिया उच्च ताप पर होती है तथा हैलाइड बनते हैं।
M + X2 → MX2
(vi) अम्लों से क्रिया - क्षारीय मृदा धातु, अम्लों से क्रिया करके H2 गैस देते हैं।
M + 2HCl → MCl2 + H2
(vii) अपचायक गुण-क्षार धातुओं में कम होता है परन्तु ये प्रबल अपचायक होती हैं।
(viii) द्रव NH3 में विलेयता - गहरा नीले रंग का विलयन प्राप्त होता है।
M + (x + y) (NH3) (l) → [M (NH3)x] 2+ + 2e(NH3)y-
प्रश्न 10.3.
क्षार धातुएँ प्रकृति में क्यों नहीं पाई जाती हैं?
उत्तर:
अत्यधिक क्रियाशील प्रकृति के तत्व होने के कारण क्षार धातुएँ प्रकृति में स्वतंत्र अवस्था में नहीं पायी जाती हैं। इनके संयोजकता कोश में उपस्थित - इलेक्ट्रॉन आसानी से त्यागने के कारण ये प्रबल विद्युत धनी होते हैं अतः शीघ्रता से क्रिया कर लेते हैं।
प्रश्न 10.4.
Na2O2 में सोडियम की ऑक्सीकरण अवस्था ज्ञात कीजिए।
उत्तर:
परॉक्साइडों में ऑक्सीजन का ऑक्सीकरण अंक -1 होता है तथा Na2O2 एक पराक्साइड है।
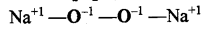 माना Na का ऑक्सीकरण अंक
माना Na का ऑक्सीकरण अंक
(2 × x) + (-1 × 2) = 0
x = +1
प्रश्न 10.5.
पोटैशियम की तुलना में सोडियम कम अभिक्रियाशील क्यों है? बताइए।
उत्तर:
Na के मानक अपचयन विभव (E°) का मान - 2.71V होता है जबकि K के लिए यह मान -2.92V है जो कि Na से कम है तथा Na की आयनन एन्थैल्पी K की तुलना में अधिक होती है, अतः Na, K की तुलना में कम क्रियाशील होता है।
प्रश्न 10.6.
निम्नलिखित के संदर्भ में क्षार धातुओं एवं क्षारीय मृदा धातुओं की तुलना कीजिए:
(क) आयनन एन्थैल्पी, (ख) ऑक्साइडों की क्षारकता, (ग) हाइड्रॉक्साइडों की विलेयता।
उत्तर:
|
|
क्षार-धातु |
क्षारीय-मृदा धातु |
|
(क) आयनन एन्थैल्पी |
इनकी आयनन एन्थैल्पी कम होती है क्योंकि इनका आकार बड़ा होता है तथा नाभिकीय आवेश कम होता है। |
आयनन एन्थैल्पी अपेक्षाकृत उच्च होती है; क्यों कि इ नका नाभिकीय आवेश अधिक होता है। |
|
(ख) ऑक्साइडों की क्षारकता |
इनके ऑक्साइड प्रबल क्षारीय होते हैं। |
इनके ऑक्साइड क्षार धातु ऑक्साइडों से कम क्षारीय होते हैं। |
|
(ग) हाइड्रॉक्साइडों की विलेयता |
क्षार धातु हाइ ड्र फक्साइ डों की विलेयता अधिक होती है क्योंकि बड़े आकार के कारण जालक एन्थैल्पी कम होती है। |
क्षारीय मृदा धातुओं के ह I ड़ T कसाइ ड अपेक्षाकृत कम विलेय होते हैं। |
प्रश्न 10.7.
लीथियम किस प्रकार मैग्नीशियम से रासायनिक गुणों में समानताएँ दर्शाता है?
उत्तर:
लीथियम तथा मैग्नीशियम में निम्नलिखित समानताएँ होती हैं:
(i) लीथियम तथा मैग्नीशियम अपने वर्ग की अन्य धातुओं की अपेक्षा कठोर तथा हल्की होती हैं।
(ii) LiCl तथा MgCl2 दोनों ही एथेनॉल में विलेय हैं।
(iii) LiCl एवं MgCl2 प्रस्वेद्य होते हैं तथा ये जलीय विलयन से LiCl. 2H2O तथा MgCl2 . 8H2O हाइड्रेट के रूप में क्रिस्टलीकृत होते हैं।
(iv) लीथियम तथा मैग्नीशियम सामान्य ऑक्साइड (Li2O तथा MgO) बनाते हैं तथा ये ऑक्सीजन के आधिक्य से क्रिया करके सुपर ऑक्साइड नहीं बनाते हैं।
(v) लीथियम तथा मैग्नीशियम दोनों ही प्रबल अपचायक होते हैं।
(vi) लीथियम तथा मैग्नीशियम, नाइट्रोजन से क्रिया करके नाइट्राइड बनाते हैं जिनके जल अपघटन से संगत हाइड्रॉक्साइड तथा अमोनिया बनती है।
Li3N + 3H2O → 3LiOH + NH3
Mg3N2 + 6H2O → 3Mg(OH)2 + 2NH3
(vii) लीथियम तथा मैग्नीशियम जल के साथ धीमी गति से अभिक्रिया करके हाइड्रॉक्साइड बनाते हैं। इनके ऑक्साइड एवं हाइड्रॉक्साइड जल में बहुत कम घुलनशील होते हैं। तथा इनके हाइड्रॉक्साइडों को गरम करने पर विघटित हो जाते हैं।
(viii) LiOH तथा Mg (OH)2 दुर्बल क्षार होते हैं।
(ix) लीथियम तथा मैग्नीशियम कार्बोनेट को गरम करने पर ये आसानी से विघटित होकर ऑक्साइड एवं CO2 बनाते हैं।
(x) लीथियम तथा मैग्नीशियम दोनों ही ठोस हाइड्रोजन कार्बोनेट नहीं बनाते हैं।

प्रश्न 10.8.
क्षार धातुएँ तथा क्षारीय मृदा धातुएँ रासायनिक अपचयन विधि से क्यों नहीं प्राप्त किए जा सकते हैं? समझाइए।
उत्तर:
क्षार धातु तथा क्षारीय मृदा धातुओं के मानक अपचयन विभव उच्च ऋणात्मक होते हैं अतः वे प्रबल अपचायक होते हैं तथा इनसे प्रबल अपचायक उपलब्ध नहीं हैं। अतः इन्हें रासायनिक अपचयन विधि से प्राप्त नहीं किया जा सकता है।
प्रश्न 10.9.
प्रकाश वैद्युत सेल में लीथियम के स्थान पर पोटैशियम एवं सीजियम क्यों प्रयुक्त किए जाते हैं?
उत्तर:
लीथियम की आयनन एन्थैल्पी उच्च होती है, अतः यह प्रकाशीय ऊर्जा द्वारा इलेक्ट्रॉन का उत्सर्जन नहीं कर सकता है। इसलिए इसे प्रकाश वैद्युत सेल में प्रयुक्त नहीं किया जाता है, जबकि K तथा Cs की आयनन एन्थैल्पी कम होती है, अतः ये प्रकाशीय ऊर्जा द्वारा शीघ्रता से इलेक्ट्रॉनों का उत्सर्जन कर देते हैं इसलिए इन्हें प्रकाश वैद्युत सेल में प्रयुक्त किया जाता है।
प्रश्न 10.10.
जब एक क्षार धातु को द्रव अमोनिया में घोला जाता है, तब विलयन विभिन्न रंग प्राप्त कर सकता है। इस प्रकार के रंग परिवर्तन का कारण बताइए।
उत्तर:
क्षार धातु को द्रव अमोनिया में घोलने पर अमोनीकृत धातु आयन तथा अमोनीकृत इलेक्ट्रॉन प्राप्त होते हैं। इसमें दृश्य क्षेत्र में इलेक्ट्रॉनों का संक्रमण होता है अतः विलयन का रंग गहरा नीला होता है लेकिन सान्द्र विलयन में यह रंग ब्रॉन्ज जैसा हो जाता है, जो कि धातु आयनों के गुच्छे (clusters) के कारण होता है। यह क्रिया निम्न प्रकार होती है
M + (x + y) NH3 → M+(NH3)x + e-(NH3)y
प्रश्न 10.11.
ज्वाला को बेरीलियम एवं मैग्नीशियम कोई रंग नहीं प्रदान करते हैं, जबकि अन्य क्षारीय मृदा धातुएं ऐसा करती हैं। क्यों?
उत्तर:
Be तथा Mg का परमाणु आकार छोटा होता है अतः इनकी आयनन एन्थैल्पी उच्च होती है। अर्थात् इनमें मजबूती से बँधे इलेक्ट्रॉन बुन्सेन ज्वाला की कम ऊर्जा द्वारा आसानी से उच्च ऊर्जा स्तर में उत्तेजित नहीं हो पाते हैं और न ही दृश्य क्षेत्र में विकिरण का उत्सर्जन करते हैं। अतः ये ज्वाला को रंग प्रदान नहीं कर पाते हैं। इसके विपरीत अन्य क्षारीय मृदा धातुओं की आयनन की एन्थैल्पी कम होती है। अतः ये ज्वाला को विशिष्ट रंग प्रदान करते हैं।
प्रश्न 10.12.
साल्वे प्रक्रम में होने वाली विभिन्न अभिक्रियाओं की विवेचना कीजिए।
उत्तर:
साल्वे विधि द्वारा औद्योगिक स्तर पर Na2CO3 बनाया जाता है। यह क्रिया मुख्यतः चार पदों में होती है:
(i) पहले पद में NH से संतृप्त NaCl के सान्द्र विलयन में CO2 गैस प्रवाहित करके (NH4)2CO3 प्राप्त करते हैं।
2NH3 + CO2 + H2O → (NH4)2CO3
(ii) दूसरे पद में (NH4)2CO3, कार्बन डाइऑक्साइड की अधिकता में अमोनियम हाइड्रोजन कार्बोनेट में बदल जाता है।
(NH4)2CO3 + CO2 + H2O → 2NH4HCO3
(iii) तीसरे पद में NH4HCO3 की NaCl से क्रिया द्वारा
NaHCO को अवक्षेपित करते हैं।

(iv) चौथे पद में NaHCO3 को गर्म करने से Na2CO3 प्राप्त हैं।
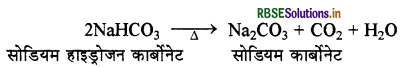
तृतीय पद में प्राप्त NH4Cl पर Ca(OH)2 की क्रिया कराने पर NH3 पुनः प्राप्त हो जाती है।
2NHCl + Ca(OH)2 → 2NH3 + CaCl2 + H2O
प्रश्न 10.13.
पोटैशियम कार्बोनेट साल्वे विधि द्वारा नहीं बनाया जा सकता है, क्यों?
उत्तर:
Na2CO3 बनाने की साल्वे विधि में प्राप्त NaHCO3 अविलेय होने के कारण आसानी से अवक्षेपित हो जाता है जिसे गर्म करने पर Na2CO3 प्राप्त हो जाता है। लेकिन इस विधि से पोटैशियम कार्बोनेट नहीं बनाया जा सकता। क्योंकि KHCO3 जल में शीघ्रता से विलेय हो जाता है, अतः इसका KCl के संतृप्त विलयन की NHHCO3 से क्रिया द्वारा अवक्षेपण नहीं हो पाता है।
प्रश्न 10.14.
Li2CO3 कम ताप पर एवं Na2CO3 उच्च ताप पर क्यों विघटित होता है?
उत्तर:
Li2CO3 एक कम स्थायी कार्बोनेट होता है, अतः यह कम ताप पर ही विघटित होकर Li2O तथा CO2 देता है क्योंकि Li+ आयन का आकार छोटा होता है अत: यह CO2- आयन को ध्रुवित कर उसमें से O2- आयन को अपनी ओर आकर्षित करके अधिक स्थायी Li2O बनाता है। इसके विपरीत Na+, आयन का आकार बड़ा होने के कारण उसमें ऐसा नहीं होता अतः यह Na2CO3 स्थायी होता है, इसलिए यह उच्च ताप पर विघटित होता है।
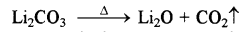
प्रश्न 10.15
क्षार धातुओं के निम्नलिखित यौगिकों की तुलना क्षारीय मृदा धातुओं के संगत यौगिकों से विलेयता एवं तापीय स्थायित्व के आधार पर कीजिए - (क) नाइट्रेट (ख) कार्बोनेट (ग) सल्फेट।
उत्तर:
(i) विलेयता – (क) क्षार धातु तथा क्षारीय मृदा धातुओं के नाइट्रेट जल में विलेय होते हैं तथा वर्ग में इनकी विलेयता बढ़ती है।
(ख) क्षार धातुओं के कार्बोनेट जल में विलेय होते हैं (Li2CO3 के अलावा) तथा वर्ग में विलेयता बढ़ती है लेकिन क्षारीय मृदा धातुओं के कार्बोनेट जल में लगभग अविलेय हैं तथा वर्ग में इनकी विलेयता घटती है।
(ग) क्षार धातुओं के सल्फेट जल में विलेय होते हैं तथा वर्ग में विलेयता बढ़ती है। जबकि क्षारीय मृदा धातुओं के सल्फेट अपेक्षाकृत कम विलेय होते हैं तथा वर्ग में इनकी विलेयता कम होती है।
(ii) तापीय स्थायित्व:
(क) नाइट्रेट - क्षार धातुओं के नाइट्रेटों को (LiNO3 के अतिरिक्त) गरम करने पर ये MNO2 तथा O2 में टूट जाते हैं, लेकिन LiNO3 के विघटन से Li2O, NO2 तथा O2 बनते हैं। क्षारीय मृदा धातुओं के नाइट्रेटों को गरम करने पर ये भी धातु ऑक्साइड, NO2 एवं O2 में टूट जाते हैं।
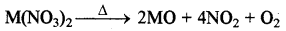
(ख) कार्बोनेट - क्षार धातुओं में लीथियम को छोड़कर शेष सभी कार्बोनेट स्थायी होते हैं तथा वर्ग में इनका स्थायित्व बढ़ता है। क्षारीय मृदा धातुओं के कार्बोनेट अपेक्षाकृत कम स्थायी होते हैं तथा विघटित होकर ऑक्साइड व CO2 देते हैं एवं वर्ग में इन कार्बोनेटों का स्थायित्व भी बढ़ता है।
BeCO3 → BeO + CO2 ↑
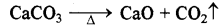
(ग) सल्फेट - क्षार धातुओं के सल्फेट ताप के प्रति स्थायी होते हैं तथा इसी प्रकार क्षारीय मृदा धातुओं के सल्फेट भी ताप के प्रति स्थायी होते हैं।

प्रश्न 10.16.
सोडियम क्लोराइड से प्रारंभ करके निम्नलिखित को आप किस प्रकार बनाएंगे?
(i) सोडियम धातु (ii) सोडियम हाइड्रॉक्साइड (iii) सोडियम परॉक्साइड (iv) सोडियम कार्बोनेट।
उत्तर:
(i) सोडियम धातु (Na) - गलित NaCl का डाउन सेल में विद्युत अपघटन करके सोडियम धातु का निर्माण किया जाता 1 इसके लिए NaCl में CaCl तथा KF को विद्युत अपघट्य के रूप में मिलाकर 850 से 875K ताप तक गरम करते हैं। विद्युत प्रवाहित करने पर कैथोड पर सोडियम धातु प्राप्त होती है।
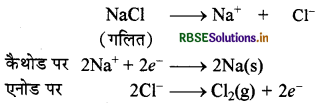
इस प्रकार से प्राप्त Na धातु को मिट्टी के तेल ( किरोसिन) में एकत्रित करके रखते हैं।
(ii) सोडियम हाइड्रॉक्साइड (NaOH): औद्योगिक स्तर पर NaOH का निर्माण कास्टनर कैलनर सेल में NaCl के जलीय विलयन का विद्युत अपघटन करके किया जाता है। इस सेल में Hg का कैथोड तथा ग्रेफाइट का एनोड लिया जाता है। जब विलयन में विद्युत धारा प्रवाहित करते हैं तो Na धातु मर्करी कैथोड पर विसर्जित होकर मर्करी के साथ मिलकर सोडियम अमलगम बनाता है तथा एनोड पर क्लोरीन मुक्त होती है। रासायनिक अभिक्रियाएँ निम्न प्रकार होती है:
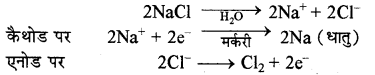
इस प्रकार से बना सोडियम अमलगम जल से क्रिया करके NaOH तथा H2 गैस देता है।
(iii) सोडियम प्रॉक्साइड (Na2O2): इसके लिए पहले NaCl का विद्युत अपघटन करके Na धातु प्राप्त करते हैं तथा प्राप्त Na धातु की 570 K ताप पर ऑक्सीजन से क्रिया कराने पर Na2O2 बनता है ।
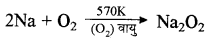
(iv) सोडियम कार्बोनेट (Na2CO3): सोडियम कार्बोनेट को साल्वे प्रक्रम द्वारा बनाया जाता है। इसके लिए पहले NaCl से -(NH4)2 CO3 बनाते हैं फिर NH4 HCO3 तथा अंत में Na2CO3 बनाते हैं। अभिक्रियाएँ निम्न प्रकार होती हैं:
2NH3 + CO2 + H2O → (NH4)2 CO3
(NH4)2 CO3 + CO2 + H2O → 2NH4HCO3
NH4HCO3 + NaCl → NH4Cl + NaHCO3
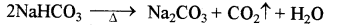
प्रश्न 10.17.
क्या होता है, जब:
(i) मैग्नीशियम को हवा में जलाया जाता है।
(ii) बिना बुझे चूने को सिलिका के साथ गरम किया जाता है।
(iii) क्लोरीन बुझे चूने से अभिक्रिया करती है।
(iv) कैल्सियम नाइट्रेट को गरम किया जाता है।
उत्तर:
(i) मैग्नीशियम को हवा (वायु) में जलाया जाता है तो MgO तथा Mg3N2 का मिश्रण प्राप्त होता है। क्योंकि वायु से O2 तथा N2 प्राप्त होती है। रासायनिक अभिक्रियाएँ निम्न प्रकार होती हैं
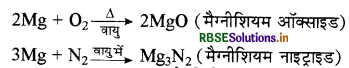
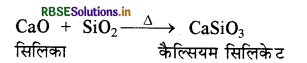
(ii) बिना बुझे चूने (CaO) को सिलिका (SiO2) के साथ गरम करने पर कैल्सियम सिलिकेट का श्वेत अवक्षेप प्राप्त होता है।
(iii) क्लोरीन बुझे हुए चूने से अभिक्रिया करती है तो कैल्सियम हाइपोक्लोराइट बनता है जो विरंजक चूर्ण (ब्लीचिंग पाउडर) का एक अवयव है।
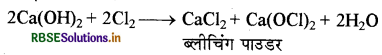
(iv) कैल्सियम नाइट्रेट को गरम किया जाता है तो CaO, NO2 तथा O2 बनती है।
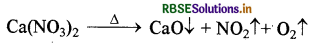
इस प्रकार बिना बुझा चूना (CaO) शेष प्राप्त होता है तथा O2 एवं NO2 बाहर निकल जाती है।
प्रश्न 10.18.
निम्नलिखित में से प्रत्येक के दो-दो उपयोग बताइए:
(i) कास्टिक सोडा
(iii) बिना बुझा चूना
(ii) सोडियम कार्बोनेट
उत्तर:
(i) कास्टिक सोडा (NaOH) - NaOH का प्रमुख उपयोग शुद्ध वसा तथा तेलों के निर्माण में एवं साबुन, कागज तथा कृत्रिम रेशम आदि के निर्माण में किया जाता है 1
(ii) सोडियम कार्बोनेट (Na2CO3) - इसका उपयोग जल को मृदु (Soft) करने में, कपड़े धोने के साबुन बनाने में तथा काँच, उद्योग में होता है।
(iii) बिना बुझा चूना (CaO) - CaO का उपयोग सीमेन्ट के निर्माण के लिए प्राथमिक पदार्थ के रूप में तथा शर्करा के शुद्धिकरण में किया जाता है।
प्रश्न 10.19.
निम्नलिखित की संरचना बताइए:
(i) BeCl2, (वाष्प),
(ii) BeCl2 (ठोस)।
उत्तर:
(i) BeCl2 की वाष्प अवस्था में संरचना निम्न प्रकार होती है:
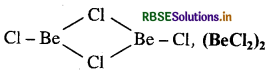
(BeCl2)2 क्लोरो सेतु युक्त द्विलक
(ii) BeCl2 की ठोस अवस्था में संरचना निम्नलिखित है:
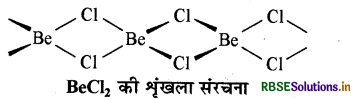
प्रश्न 10.20
सोडियम एवं पोटैशियम के हाइड्रॉक्साइड एवं कार्बोनेट जल में विलेय हैं, जबकि मैग्नीशियम एवं कैल्सियम के संगत लवण जल में अल्प विलेय हैं। समझाइए।
उत्तर:
सोडियम तथा पोटैशियम जैसे एक संयोजी धनायनों के हाइड्रॉक्साइड तथा कार्बोनेट जल में विलेय होते हैं क्योंकि इनकी जालक ऊर्जा का मान जलयोजन ऊर्जा की अपेक्षा कम होता है। अतः ये जल में विलेय होते हैं जबकि मैग्नीशियम तथा कैल्सियम जैसे द्विसंयोजी धनायनों के हाइड्रॉक्साइडों तथा कार्बोनेटों की जालक ऊर्जा अधिक होती है। अतः इनके लिए जलयोजन ऊर्जा का मान जालक ऊर्जा से कुछ कम रह जाता है, इस कारण ये जल में अल्प विलेय होते हैं।

प्रश्न 10.21.
निम्नलिखित की महत्ता बताइए:
(i) चूना पत्थर
(ii) सीमेन्ट
(iii) प्लास्टर ऑफ पेरिस।
उत्तर:
(i) चूना पत्थर के उपयोग निम्नलिखित हैं:
- संगमरमर के रूप में भवन निर्माण में।
- बुझे चूने के निर्माण में।
- आयन के निष्कर्षण में गालक के रूप में।
- कागज निर्माण में।
- ऐन्टासिड, टूथपेस्ट, च्यूइंगम तथा सौन्दर्य प्रसाधनों के निर्माण में।
(ii) सीमेन्ट यह आधुनिक विश्व का आधार है। इसके मुख्य उपयोग निम्नलिखित हैं:
- भवन निर्माण में।
- बाँधों के निर्माण में।
- पुलों के निर्माण में।
- टैंक तथा कंक्रीट की सड़कें बनाने में, एवं प्रबलित कंक्रीट तथा प्लास्टरिंग आदि में।
(iii) प्लास्टर ऑफ पेरिस के मुख्य उपयोग निम्नलिखित हैं:
- हड्डी टूटने पर उसके प्लास्टर तथा दंत चिकित्सा में, मूर्ति उद्योग में तथा
- भवनों के अंदर की दीवारों को सजाने में।
प्रश्न 10.22.
लीथियम के लवण साधारणतया जलयोजित होते हैं, जबकि अन्य क्षार धातुओं के लवण साधारणतया निर्जलीय होते हैं। क्यों?
उत्तर:
लीथियम आयन का आकार छोटा होता है तथा इसका नाभिकीय आवेश अधिक होता है। अतः यह जल के अणुओं को आकर्षित करके आसानी से जलयोजित लवण बना लेता है। जैसे LiCl 2H2O, जबकि अन्य क्षार धातुओं के आयनों का आकार अपेक्षाकृत बड़ा होने के कारण इनकी जल के अणुओं को आकर्षित करने की प्रवृत्ति कम होती है। अतः इनके लवण साधारणतया निर्जलीय होते हैं।
प्रश्न 10.23.
LiF जल में लगभग अविलेय होता है, जबकि LiCl न सिर्फ जल में, बल्कि ऐसीटोन में भी विलेय होता है। कारण बताइए।
उत्तर:
LiF आयनिक यौगिक है लेकिन LiCl तथा F के छोटे आकार के कारण इसकी जालक एन्थैल्पी अधिक होती है अतः इसकी जलयोजन एन्थैल्पी, जालक एन्थैल्पी से अधिक नहीं होती। इसलिए LiF जल में अविलेय है जबकि LiCl में Cl के बड़े आकार के कारण LiCl के द्वारा इसका ध्रुवण हो जाता है। अत: LiCl में आंशिक आयनिक तथा आंशिक सहसंयोजी गुण होता है इस कारण यह जल तथा कम ध्रुवीय विलायक जैसे ऐसीटोन में भी विलेय होता है।
प्रश्न 10.24.
जैव द्रवों में सोडियम, पोटैशियम, मैग्नीशियम एवं कैल्सियम की सार्थकता बताइए।
उत्तर:
- सोडियम आयन मुख्यतः अंतराकाशीय द्रव (Interstitial fluid) में उपस्थित रक्त प्लाज्मा, जो कोशिकाओं को घेरे रहता है, में पाया जाता है।
- सोडियम आयन तंत्रिका (शिरा) आवेग संकेतों (Nerve Signals) के संचरण में भाग लेते हैं, जो कोशिका झिल्ली में जलप्रवाह को नियमित करते हैं तथा कोशिकाओं में शर्करा एवं एमीनो अम्लों के प्रवाह को भी नियंत्रित करते हैं।
- सोडियम तथा पोटैशियम रासायनिक दृष्टि से समान होते हैं लेकिन इनकी कोशिका झिल्ली को पार करने की तथा एन्जाइम को सक्रिय करने की क्षमता भिन्न होती है। इसीलिए कोशिका द्रव में पोटैशियम आयन अधिक होते हैं; जहाँ ये एन्जाइम को सक्रिय करते हैं तथा ग्लूकोज के ऑक्सीकरण से ATP बनने में भी भाग लेते हैं।
प्रश्न 10.25.
क्या होता है, जब:
(i) सोडियम धातु को जल में डाला जाता है।
(ii) सोडियम धातु को हवा की अधिकता में गरम किया जाता है।
(iii) सोडियम परॉक्साइड को जल में घोला जाता है।
उत्तर:
(i) सोडियम को जल में डालने पर यह जल उठता है। तथा तीव्र वेग से क्रिया होती है तथा हाइड्रोजन गैस मुक्त होती है, जो कि जल उठती है क्योंकि यह अभिक्रिया ऊष्माक्षेपी होती है।
2Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g)
(ii) सोडियम को वायु (हवा) के आधिक्य में गरम करने पर यह सोडियम परॉक्साइड बनाता है।
2Na(s) + O2 (वायु) → Na2O2 (s)
(iii) सोडियम परॉक्साइड (Na2O2) को जल में घोलने पर NaOH तथा H2O2 बनते हैं।
Na2O2(s) + 2H2O(l) → 2NaOH (aq) + H2O2 (aq)
प्रश्न 10.26.
निम्नलिखित में से प्रत्येक प्रेक्षण पर टिप्पणी लिखिए:
(क) जलीय विलयनों में क्षार धातु आयनों की गतिशीलता Li+ < Na+ < K+ < Rb+ < Cs क्रम में होती है।
(ख) लीथियम ऐसी एकमात्र क्षार धातु है, जो नाइट्राइड बनाती है।
(ग) M2+ (aq) + 2e- → M(s) हेतु ES (जहाँ M = Ca, Sr या Ba) लगभग स्थिरांक है।
उत्तर:
(क) Li+ का छोटा आकार होता है अतः इसकी जलयोजन की प्रवृत्ति अधिक होती है, जिसके कारण Li+ आयन की गतिशीलता कम होती है; क्योंकि आयन का जलयोजन बढ़ने पर गतिशीलता कम हो जाती है। वर्ग में अन्य सदस्यों का आकार बढ़ने के कारण जलयोजन की प्रवृत्ति कम होती जाती है, इसलिए उनकी आयनिक गतिशीलता बढ़ती है। अतः दिया गया क्रम सही है-
Li+ < Na+ < K+ < Rb+ < Cs+
(ख) Li+ का आकार छोटा है तथा लीथियम क्षार धातुओं में यह प्रबलतम अपचायक है अतः यह नाइट्रोजन से सीधे संयोग करके नाइट्राइड बनाता है जबकि अन्य क्षार धातु ऐसा नहीं करती।
6Li(s) + N2(g) → 3LigN(s)
(ग) किसी आयन के लिए M+2/M हेतु E का मान वाष्पीकरण की एन्थैल्पी, आयनन एन्थैल्पी तथा जलयोजन एन्थैल्पी पर निर्भर करता है। चूँकि Ca, Sr तथा Ba के लिए इन तीन कारकों का कुल प्रभाव लगभग समान होता है, अतः इनकी इलेक्ट्रॉन त्यागने की क्षमता भी लगभग समान होती है इसलिए इनके लिए ES (मानक इलेक्ट्रॉड विभव) का मान लगभग समान होता है।

प्रश्न 10.27.
समझाइए कि क्यों:
(क) Na2CO2का विलयन क्षारीय होता है।
(ख) क्षार धातुएँ उनके संगलित क्लोराइडों के वैद्युत- अपघटन से प्राप्त की जाती हैं।
(ग) पोटैशियम की तुलना में सोडियम अधिक उपयोगी है।
उत्तर:
(क) Na2CO3 को जल में डालने पर, जल अपघटन के कारण प्रबल क्षार (NaOH) तथा दुर्बल अम्ल (H2CO3) बनता है। चूँकि NaOH से प्राप्त OH आयन, H2CO से प्राप्त H+ आयनों से अधिक होते हैं अत: Na2CO3 का जलीय विलयन क्षारीय होता है। यहाँ वास्तव में CO32- जल से क्रिया करके OH की सान्द्रता बढ़ाते हैं।
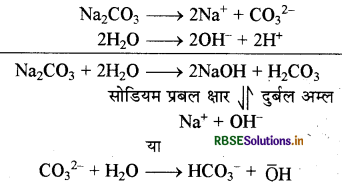
(ख) क्षार धातुएँ प्रबल अपचायक होती हैं अतः इनके किसी अयस्क का रासायनिक विधि से अपचयन नहीं किया जा सकता इसलिए क्षार धातुएँ इनके संगलित क्लोराइडों के वैद्युत अपघटन से प्राप्त की जाती हैं।
(ग) पोटैशियम की तुलना में सोडियम कम क्रियाशील होता है, अतः इसकी अन्य पदार्थों से क्रिया को आसानी से नियंत्रित किया जा सकता है, अतः इसके साथ प्रयोग करना अधिक सुरक्षित है। इसलिए पोटैशियम की तुलना में सोडियम अधिक उपयोगी है।
प्रश्न 10.28.
निम्नलिखित के मध्य क्रियाओं के संतुलित समीकरण लिखिए:
(क) Na2CO3 एवं जल
(ख) KO2 एवं जल
(ग) Na2O एवं CO2
उत्तर:
(क) Na2CO3, जल से क्रिया द्वारा जल अपघटित होकर NaOH तथा H2CO3 बनाता है।
Na2CO3(s) + 2H2O(l) →2NaOH(aq) + H2CO3(aq)
(ख) KO2 एवं जल के मध्य क्रिया निम्न प्रकार होती है जिससे KOH तथा H2O2 प्राप्त होते हैं।
2KO2 (s) + 2H2O(l) → 2KOH (aq) + O2 (g) + H2O2 (aq)
(ग) Na2O एवं CO2 के मध्य क्रिया निम्न प्रकार होती है जिससे KOH तथा H2O2 प्राप्त होते हैं
Na2O + CO2 → Na2CO3 (सोडियम कार्बोनेट)
प्रश्न 10.29.
आप निम्नलिखित तथ्यों को कैसे समझाएँगे:
(क) BeO जल में अविलेय है, जबकि BeSO4 विलेय है।
(ख) BaO जल में विलेय है, जबकि BaSO4 अविलेय है।
(ग) एथेनॉल में Lil, KI की तुलना में अधिक विलेय है।
उत्तर:
(क) BeO में O2- के छोटे आकार के कारण जालक एन्थैल्पी का मान जलयोजन एन्थैल्पी से अधिक होता है। अतः यह जल में अविलेय है जबकि BeSO4 में SO42- के बड़े आकार के कारण इसकी जालक एन्थैल्पी, जलयोजन एन्थैल्पी से कम होती है अतः यह जल में विलेय है।
(ख) BaO में Ba2+ के बड़े आकार के कारण इसकी जालक एन्थैल्पी, जलयोजन एन्थैल्पी की तुलना में कम होती है। अतः यह जल में विलेय है जबकि BaSO4 में Ba2+ तथा SO42- दोनों के बड़े आकार के कारण इसकी जलयोजन एन्थैल्पी का मान जालक एन्थैल्पी से बहुत कम होता है अतः यह अविलेय है।
(ग) Li+ का आकार छोटा होता है तथा K+ का आकार बड़ा होता है। अतः Li+ आयन I का अधिक ध्रुवण करता है इसलिए Li- I एक सहसंयोजक यौगिक है जबकि KI में K+ के बड़े आकार के कारण यह I का ध्रुवण कम करता है। अतः KI आयनिक यौगिक है। इस कारण कम ध्रुवीय विलायक एथेनॉल में Lil, KI की तुलना में अधिक विलेय है।
प्रश्न 10.30.
निम्नलिखित में से किस क्षार धातु का गलनांक न्यूनतम है?
(क) Na
(ग) Rb
(ख) K
(घ) Cs
उत्तर:
(घ) Cs, क्योंकि परमाणु आकार बढ़ने के साथ धात्विक बंध की सामर्थ्य कम होती है इसलिए इनका गलनांक भी कम होता है। Cs का आकार सबसे अधिक है अतः इसका गलनांक न्यूनतम है।
प्रश्न 10.31.
निम्नलिखित में से कौनसी क्षार धातु जलयोजित लवण देती है ?
(क) Li
(ग) K
(ख) Na
(घ) Cs
उत्तर:
(क) Li, क्योंकि Li+ आयन का आकार अत्यधिक छोटा होने के कारण इसका आवेश घनत्व अधिक होता है अतः यह जल के अणुओं को अधिक प्रबलता से आकर्षित करता है इसलिए यह शीघ्रता से जल से जुड़कर जलयोजित लवण बना लेता है।
प्रश्न 10.32.
निम्नलिखित में से कौनसी क्षारीय मृदा धातु कार्बोनेट ताप के प्रति सबसे अधिक स्थायी है?
(क) MgCO3
(ग) SrCO3
(ख) CaCO3
(घ) BaCO3
उत्तर:
(घ) BaCO3, क्योंकि जालक ऊर्जा बढ़ने के कारण वर्ग में क्षारीय मृदा धातु कार्बोनेटों का ताप के प्रति स्थायित्व बढ़ता है।
