RBSE Solutions for Class 11 Chemistry Chapter 1 रसायन विज्ञान की कुछ मूल अवधारणाएँ
Rajasthan Board RBSE Solutions for Class 11 Chemistry Chapter 1 ठोस अवस्थारसायन विज्ञान की कुछ मूल अवधारणाएँ Textbook Exercise Questions and Answers.
Rajasthan Board RBSE Solutions for Class 11 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 11. Students can also read RBSE Class 11 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 11 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 11 Chemistry Solutions Chapter 1 रसायन विज्ञान की कुछ मूल अवधारणाएँ
RBSE Class 11 Chemistry रसायन विज्ञान की कुछ मूल अवधारणाएँ Textbook Questions and Answers
प्रश्न 1.1.
निम्नलिखित के लिए मोलर द्रव्यमान का परिकलन कीजिए
(i) H2O
(ii) CO2
(iii) CH4
उत्तर:
(i) H2O का मोलर द्रव्यमान = 2 x (H का परमाणु द्रव्यमान) + O का परमाणु द्रव्यमान
= 2(1.0079) + 16.00)
= 18.0158
(ii) CO2 का मोलर द्रव्यमान = C का द्रव्यमान + 2 x (O का द्रव्यमान)
= 12.01 + 2(16)
= 44.01
(iii) CH4 का मोलर द्रव्यमान = C का परमाणु द्रव्यमान + 4(H का परमाणु द्रव्यमान )
= 12.01 +4(1.0079)
= 16.0416

प्रश्न 1.2.
सोडियम सल्फेट (Na2SO4) में उपस्थित विभिन्न तत्वों के द्रव्यमान प्रतिशत का परिकलन कीजिए ।
उत्तर:
किसी तत्व का द्रव्यमान प्रतिशत

सोडियम सल्फेट (Na2SO4) का आण्विक द्रव्यमान
= 2 × Na का परमाणु द्रव्यमान + S का परमाणु द्रव्यमान + 4 x O का परमाणु द्रव्यमान
= 2(23.0) + 32.0 + 4 x (16.0)
= 142 g mol-1
सोडियम (Na) का द्रव्यमान प्रतिशत:
सल्फर (S) का द्रव्यमान प्रतिशत =
ऑक्सीजन का द्रव्यमान प्रतिशत:
46/142 x 100 = 32.39%
32/142 x 100 = 22.54%
64/142 x 100 = 45.07%
प्रश्न 1.3.
आयरन के उस ऑक्साइड का मूलानुपाती सूत्र ज्ञात कीजिए जिसमें द्रव्यमान द्वारा 69.9% आयरन और 30.1% ऑक्सीजन है।
उत्तर:
प्रथम पद में तत्वों का सरलतम पूर्णांक मोलर अनुपात ज्ञात करते हैं।
|
तत्व |
द्रव्यमान प्रतिशत |
परमाणु द्रव्यमान |
मोलर अनुपात |
सरलतम मोलर अनुपात |
सरलतम पूर्णांक मोलर अनुपात |
|
Fe |
69.9 |
55.85 |
6.99/55.85 = 1.25 |
1.25/1.25 = 1 |
1.0 x 2 = 2 |
|
O |
30.1 = 1.88 |
16.00 = 1.5 |
30.1/16 = 3 |
1.88/1.25 |
1.5 x 2 |
द्वितीय पद में यौगिक का मूलानुपाती सूत्र ज्ञात करते हैं।
तत्वों का अनुपात Fe : O = 2 : 3
अतः यौगिक का मूलानुपाती सूत्र = Fe2O3
प्रश्न 1.4.
प्राप्त कार्बन डाइऑक्साइड की मात्रा का परिकलन कीजिए जब।
(i) 1 मोल कार्बन को हवा में जलाया जाता है और
(ii) 1 मोल कार्बन को 16g ऑक्सीजन में जलाया जाता है।
उत्तर:
कार्बन का हवा (ऑक्सीजन) में दहन का समीकरण निम्नलिखित है:
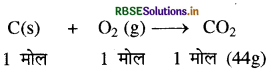
(i) हवा में पूर्ण दहन होगा, अतः 1 मोल कार्बन को जलाने पर 1 मोल CO2 बनेगी जिसका द्रव्यमान = 44 ग्राम
(ii) ऑक्सीजन केवल 16g (1/2 मोल) ही है, अतः यह सीमान्तकारी अभिकर्मक है।

सन्तुलित समीकरण के अनुसार 1 मोल कार्बन को 1/2 ऑक्सीजन में जलाने पर 1/2 मोल CO2 बनेगी जिसका द्रव्यमान
= 44/32 × 16 = 22 ग्राम
प्रश्न 1.5.
सोडियम ऐसीटेट (CH3COONa) का 500ml, 0.375 मोलर जलीय विलयन बनाने के लिए उसके कितने द्रव्यमान की आवश्यकता होगी ? सोडियम ऐसीटेट का मोलर द्रव्यमान 82.0245g mol-1 है।
उत्तर:

विलेय का द्रव्यमान = \(\frac{0.375}{2}\) × 82.0245 ग्राम
विलेय का द्रव्यमान = 15.3795g
= 15.380 g.
प्रश्न 1.6.
सान्द्र नाइट्रिक अम्ल के उस प्रतिदर्श की मोल प्रति लीटर में सान्द्रता का परिकलन कीजिए, जिसमें उसका द्रव्यमान प्रतिशत 69% हो और जिसका घनत्व 1.41 gmL-1 हो।
उत्तर:
नाइट्रिक अम्ल (HNO3) का मोलर द्रव्यमान
= 1 + 14 + 3(16) = 63g mol-1
69% (द्रव्यमान प्रतिशत) HNO3 का अर्थ है HNO3 के 100 g
विलयन में 69g HNO3 उपस्थित है।
अतः HNO3 के मोल = \(\frac{69 \mathrm{~g}}{63 \mathrm{~g} \mathrm{~mol}^{-1}}\) = 1.095 मोल
HNO3 के 100 g विलयन का आयतन = 
= 70.92 mL = 0.07092 L
मोल प्रति लीटर में HNO3 की सान्द्रता = \(\frac{100 \mathrm{~g}}{1.41 \mathrm{~g} \mathrm{~mL}^{-1}}\) = 15.439 = 15.44 M
अथवा


प्रश्न 1.7.
100g कॉपर सल्फेट (CuSO4) से कितना कॉपर प्राप्त किया जा सकता है?
उत्तर:
कॉपर सल्फेट (CuSO4) का मोलर द्रव्यमान = 63.5 + 32 + (4 × 16) = 159.5 gmol-1
\(\mathrm{CuSO}_4 \equiv \mathrm{Cu}\)
159.5 g CuSO4 से प्राप्त Cu = 63.5 g
अत:
100g CuSO4 से प्राप्तं Cu = \(\frac{63.5}{159.5} \times 100 \mathrm{~g}\)
= 39.81 g
प्रश्न 1.8.
आयरन के ऑक्साइड का आण्विक सूत्र ज्ञात कीजिए, जिसमें आयरन तथा ऑक्सीजन का द्रव्यमान प्रतिशत क्रमशः 69.9g तथा 30.1g है।
उत्तर:
प्रथम पद में तत्वों का सरलतम पूर्णांक मोलर अनुपात ज्ञात करते हैं।
|
तत्व |
द्रव्यमान प्रतिशत |
परमाणु द्रव्यमान |
मोलर अनुपात |
सरलतम मोलर अनुपात |
सरलतम पूर्णांक मोलर अनुपात |
|
Fe |
69.9 |
55.85 |
6.99/55.85 = 1.25 |
1.25/1.25 = 1 |
1.0 x 2 = 2 |
|
O |
30.1 = 1.88 |
16.00 = 1.5 |
30.1/16 = 3 |
1.88/1.25 |
1.5 x 2 |
द्वितीय पद में यौगिक का मूलानुपाती सूत्र ज्ञात करते हैं।
तत्वों का अनुपात Fe : O = 2 : 3
अतः यौगिक का मूलानुपाती सूत्र = Fe2O3
आयरन के ऑक्साइड का मूलानुपाती सूत्र
= Fe2O3 जिसका सूत्र भार (2 x 55.85) + (3 x 16) = 159.7 g mol-1
अणु सूत्र द्रव्यमान = n x मूलानुपाती सूत्र द्रव्यमान

अतः अणु सूत्र भी मूलानुपाती सूत्र के समान ही होगा जो कि Fe2O3 है।
प्रश्न 1.9.
निम्नलिखित आँकड़ों के आधार पर क्लोरीन के औसत परमाणु द्रव्यमान का परिकलन कीजिए।
|
% |
प्राकृतिक बाहुल्यता |
मोलर द्रव्यमान |
|
35Cl |
75.77 |
34.9698 |
|
37Cl |
24.33 |
36.9659 |
उत्तर:
क्लोरीन का औसत परमाणु द्रव्यमान

अतः क्लोरीन का औसत परमाणु द्रव्यमान = 35.4527
प्रश्न 1.10.
एथेन (CH) के तीन मोलों में निम्नलिखित का परिकलन कीजिए:
(i) कार्बन परमाणुओं के मोलों की संख्या
(ii) हाइड्रोजन परमाणुओं के मोलों की संख्या
(iii) एथेन के अणुओं की संख्या।
उत्तर:
(i) 1 मोल एथेन में कार्बन परमाणुओं के मोल = 2
अतः तीन मोल एथेन में कार्बन परमाणुओं के मोल = 6
(ii) 1 मोल C2Hg में हाइड्रोजन परमाणुओं के मोल = 6
अतः तीन मोल एथेन में हाइड्रोजन परमाणुओं के मोल = 3 × 6 = 18
(iii) 1 मोल एथेन में अणुओं की संख्या
= आवोगाद्रो संख्या = 6.022 x 1023
अतः 3 मोल एथेन में अणुओं की संख्या
= 3 × 6.022 × 1023 = 18.066 x 1023
प्रश्न 1.11.
यदि 20 g चीनी (C12H22O11) को जल की पर्याप्त मात्रा में घोलने पर उसका आयतन 21 हो जाए, तो चीनी के इस विलयन की सान्द्रता क्या होगी?
उत्तर:
चीनी (C12H22O11) का मोलर द्रव्यमान
= (12 × 12) + (221) + (11 x 16 )
= 342 g mol-1
चीनी की मोलरता (मोल / लीटर)

= 0.02923 M

प्रश्न 1.12.
यदि मेथेनॉल का घनत्व 0.793 kg L हो तो इसके 0.25 M के 2.5L विलयन को बनाने के लिए कितने आयतन की आवश्यकता होगी?
उत्तर:
CH3OH (मेथेनॉल) का मोलर द्रव्यमान
= 12 + 3 + 16 + 1 = 32 g mol-1

विलेय का द्रव्यमान = 0.25 x 32 x 2.5 = 20g.
CH3OH का घनत्व = 0.793 kg L = 0.793 gcm3
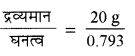
= 25.22 mL
प्रश्न 1.13.
दाब को प्रति इकाई क्षेत्रफल पर लगने वाले बल के रूप में परिभाषित किया जाता है। दाब का SI मात्रक पास्कल नीचे दिया गया है।
1 Pa = 1 Nm-2
यदि समुद्र तल पर हवा का द्रव्यमान 1034 g cm-2 हो, तो पास्कल में दाब का परिकलन कीजिए।
उत्तर:
प्रति इकाई क्षेत्रफल पर लगने वाला बल (भार) दाब होता है।
लेकिन भारद्रव्यमान x त्वरण = mg
दाब = प्रति इकाई क्षेत्रफल पर भार
= 1034 g cm2 x 9.8ms-2
= 1034 g cm2 x 9.8m s-2
\(\frac{1 \mathrm{~kg}}{1000 \mathrm{~g}}\) x \(\frac{100 \mathrm{~cm} \times 100 \mathrm{~cm}}{1 \mathrm{~m} \times 1 \mathrm{~m}}\)
= \(\frac{1 \mathrm{~N}}{\mathrm{~kg} \mathrm{~ms}^{-2}} \times \frac{1 \mathrm{~Pa}}{1 \mathrm{~N} \mathrm{~m}^{-2}}\)
= 1.01332 × 10 Pa
प्रश्न 1.14.
द्रव्यमान का SI मात्रक क्या है? इसे किस प्रकार परिभाषित किया जाता है?
उत्तर:
द्रव्यमान का SI मात्रक किलोग्राम है। (kg) एक किलोग्राम अन्तर्राष्ट्रीय मानक किलोग्राम द्रव्यमान के बराबर होता है।
प्रश्न 1.15.
निम्नलिखित पूर्वलग्नों को उनके गुणांकों के साथ मिलाइए।
|
पूर्वलग्न |
गुणांक |
|
(i) माइक्रो |
106 |
|
(ii) डेका |
109 |
|
(iii) मेगा |
10-6 |
|
(iv) गिगा |
10-15 |
|
(v) फेम्टो |
10 |
उत्तर:
|
पूर्वलग्न |
गुणांक |
|
(i) माइक्रो |
106 |
|
(ii) डेका |
109 |
|
(iii) मेगा |
10-6 |
|
(iv) गिगा |
10-15 |
|
(v) फेम्टो |
10 |
प्रश्न 1.16.
सार्थक अंकों से आप क्या समझते हैं?
उत्तर:
सार्थक अंक वे अर्थपूर्ण अंक होते हैं, जो निश्चित रूप से ज्ञात हों । प्रायोगिक या परिकलित मानों में अनिश्चितता को सार्थक अंकों द्वारा व्यक्त किया जाता है। अनिश्चितता को व्यक्त करने के लिए पहले निश्चित अंक लिखते हैं तथा अन्त में लिखा अंक अनिश्चित होता है। सार्थक अंकों को निश्चित नियमों द्वारा निर्धारित किया जाता है।
प्रश्न 1.17.
पेयजल के नमूने में क्लोरोफॉर्म, जो कैंसरजन्य है, से अत्यधिक संदूषित पाया गया। संदूषण का स्तर 15 ppm (द्रव्यमान के रूप में ) था।
(i) इसे द्रव्यमान प्रतिशतता में दर्शाइए।
(ii) जल के नमूने में क्लोरोफॉर्म की मोललता ज्ञात कीजिए।
उत्तर:
(i) 15 ppm का अर्थ है कि कुल 105 भाग में 15 भाग पदार्थ उपस्थित है।
अतः द्रव्यमान प्रतिशत = \(\frac{15}{10^6}\) x 100
= 1.5 × 10-3
= 15 × 10-4
(ii) CHCl3 का मोलर द्रव्यमान 12 + 1 + (3 x 35.5)
= 119.5 g mol-1
100 ग्राम जल के नमूने में CHCl3 = 1.5 x 10-3 g
अतः 1000 ग्राम (1 kg) जल में CHCl3
= 1.5 x 10-2 g
मोललता = 1 kg विलायक में विलेय के मोल
1 kg जल ( विलायक ) में CHCI के मोल
\(=\frac{1.5 \times 10^{-2}}{119.5}\)
अतः मोललता = 1.255 × 10-4

प्रश्न 1.18.
निम्नलिखित को वैज्ञानिक संकेतन में लिखिए।
(i) 0.0048
(ii) 234,000
(iii) 8008
(iv) 500.0
(v) 6.0012
उत्तर:
(i) 4.8 x 103
(ii) 2.34 × 105
(iii) 8.008 × 103
(iv) 5.000 x 102
(v) 6.0012 x 100 = 6.0012
प्रश्न 1.19.
निम्नलिखित में सार्थक अंकों की संख्या बताइए
(i) 0.0025
(ii) 208
(iii) 5005
(v) 500.00
(iv) 1,26,000
(vi) 2.0034
उत्तर:
(i) 2
(ii) 3
(iii) 4
(iv) 3
(v) 4
(vi) 5
प्रश्न 1.20.
निम्नलिखित को तीन सार्थक अंकों तक निकटित कीजिए
(i) 34.216
(ii) 10.4107
(iii) 0.04597
(iv) 2808
उत्तर:
(i) 34.2
(ii) 10.4
(iii) 0.0460
(iv) 2810
प्रश्न 1.21.
(क) जब डाइनाइट्रोजन और डाइऑक्सीज अभिक्रिया द्वारा भिन्न यौगिक बनाती हैं, तो निम्नलिखित आँक प्राप्त होते हैं-
नाइट्रोजन का द्रव्यमान
|
नाइट्रोजन का द्रव्यमान |
ऑक्सीजन का द्रव्यमान |
|
(i) 14 g |
16 g |
|
(ii) 14 g |
32 g |
|
(iii) 28 g |
32 g |
|
(iv) 28 g |
80 g |
ये प्रायोगिक आँकड़े रासायनिक संयोजन के किस नियम के अनुरूप हैं? बताइए।
(ख) निम्नलिखित में रिक्त स्थान को भरिए
(i) 1 Km = ........ mm = ......... Pm
(ii) 1mg = ......... Km = ........ ng
(iii) 1mL = ........ L = .......... dm3
उत्तर:
(क) डाइनाइट्रोजन का निश्चित द्रव्यमान जैसे 28 लेकर इससे क्रिया करके ऑक्साइड बनाने वाली डाइऑक्सीजन क द्रव्यमान क्रमशः 32, 64, 32 तथा 80 g है, जिनका सरल अनुपात 2 42 : 5 है जो कि एक सरल पूर्णांक अनुपात है। अतः ये आँकड गुणित अनुपात के नियम के अनुरूप हैं।

प्रश्न 1.22.
यदि प्रकाश का वेग 3.00 x 10 ms 1 हो, तो 2.00 ns में प्रकाश कितनी दूरी तय करेगा?
उत्तर:
दूरी = वेग x समय
= 3 x 108 ms-1 x 2.00 ns
= 3.0 x 108 ms-1 x 2.00 ns x \(\frac{10^{-9} \mathrm{~s}}{1 \mathrm{~ns}}\)
= 6.00 x 10-1 m = 0.600m.
प्रश्न 1.23.
किसी अभिक्रिया A + B2 → AB2 में निम्नलिखित अभिक्रिया मिश्रणों में सीमान्त अभिकर्मक (यदि कोई हो, तो ) ज्ञात कीजिए:
(i) A के 300 परमाणु + B के 200 अणु
(ii) 2 मोल A + 3 मोल B
(iii) A के 100 परमाणु + B के 100 अणु
(iv) A के 5 मोल + B के 2.5 मोल
(v) A के 2.5 मोल + B के 5 मोल।
उत्तर:
(i) अभिक्रिया के अनुसार A का एक मोल B2 के एक मोल से क्रिया करेगा। अतः B के 200 अणु A के 200 परमाणु से क्रिया करेंगे तथा A के 100 परमाणु बच जाएँगे अतः A अधिक मात्रा में है इसलिए B सीमान्त अभिकर्मक है।
(ii) अभिक्रिया के अनुसार A के 2 मोल B के 2 मोल से अभिक्रिया करेंगे। इसलिए B का एक मोल बच जाएगा अतः A सीमान्त अभिकर्मक है।
(iii) इसमें कोई सीमान्त अभिकर्मक नहीं है।
(iv) इसमें A अधिक मात्रा में है अत: B सीमान्त अभिकर्मक है।
(v) इसमें B अधिक मात्रा में है अतः A सीमान्त अभिकर्मक है।
प्रश्न 1.24.
डाइनाइट्रोजन और डाइहाइड्रोजन निम्नलिखित रासायनिक समीकरण के अनुसार अमोनिया बनाती हैं।
N2(g) + 3 H2(g) → 2 NH3(g)
(i) यदि 2.00 x 103 g डाइनाइट्रोजन 1.00 x 10 g डाइहाइड्रोजन के साथ अभिक्रिया करती है, तो प्राप्त अमोनिया के द्रव्यमान का परिकलन कीजिए।
(ii) क्या दोनों में से कोई अभिक्रियक (Reactant) शेष बचेगा?
(iii) यदि हाँ, तो कौनसा तथा उसका द्रव्यमान क्या होगा?
उत्तर:
(i) सन्तुलित समीकरण के अनुसार 28 g N2, 6g H2 से क्रिया करती है।
अंतः 2.00 x 10° g N1⁄2 से क्रिया करने वाली H2 की मात्रा = \(\frac{34}{28}\) 2 x 103 = 428.6 g
लेकिन H2 1000 g है अतः यह अधिक मात्रा में है
28 g N2 से प्राप्त NH 5 = 2 × 17 = 34 g
2000 g N1⁄2 से प्राप्त NH3 = 34/38 x 2000 g
= 2428.57 g = 2.43 x 103g
(ii) हाँ, H2 अधिक मात्रा में है अतः अभिक्रिया के पश्चात् यह शेष बचेगी।
(iii) सम्पूर्ण हाइड्रोजन अभिक्रिया नहीं करेगी तथा शेष बची H2
= 1000g - 428.6 g
= 571.4 g
= 5.714 x 102(g)
प्रश्न 1.25
0.5mol Na2CO3 और 0.50M Na2CO3 में क्या अन्तर है?
उत्तर:
Na2CO3 का मोलर द्रव्यमान
= (2 × 23) + 12 + (3 x 16) = 106g mol-1
0.5mol Na2CO3 का अर्थ है 0.50 x 106g
= 53 g Na2CO3 तथा 0.50M Na2CO3 का अर्थ है 53 g Na2CO3 एक लीटर विलयन में उपस्थित है।
प्रश्न 1.26.
यदि डाइहाइड्रोजन गैस के 10 आयतन डाइऑक्सीजन गैस के 5 आयतनों के साथ अभिक्रिया करें, तो जल वाष्प के कितने आयतन प्राप्त होंगे?
उत्तर:
H2 तथा O2 की अभिक्रिया निम्न प्रकार होती
2H2(g) + O2(g) → 2H2O(g)
अभिक्रिया के अनुसार दो आयतन हाइड्रोजन, एक आयतन ऑक्सीजन से क्रिया करती है अतः 10 आयतन H2, 5 आयतन O2 के साथ क्रिया करके, 10 आयतन जलवाष्प बनाएगी।

प्रश्न 1.27.
निम्नलिखित को मूल मात्रकों में परिवर्तित कीजिए।
(i) 28.7 Pm
(ii) 15.15Pm
(iii) 25365mg
उत्तर:
(i) 28.7Pm = 28.7 Pm x \(\frac{10^{-12} \mathrm{~m}}{1 \mathrm{Pm}}\)
= 2.87 × 10-11 m
(ii) 15.15 Pm = 15.15 Pm x \(\frac{10^{-12} \mathrm{~m}}{1 \mathrm{Pm}}\)
= 1.515 x 10-11 m.
(iii) 25365 mg = 25365 mg x \(\frac{1 \mathrm{~g}}{1000 \mathrm{mg}} \times\) \(\frac{1 \mathrm{~kg}}{1000 \mathrm{~g}}\)
= 2.5365 × 10-2 kg
प्रश्न 1.28.
निम्नलिखित में से किसमें परमाणुओं की संख्या सबसे अधिक होगी?
(i) 1g Au (s)
(ii) 1g Na (s)
(iii) 1gLi (s)
(iv) 1g Cl2 (g)
उत्तर:
(i) Au का परमाणु भार 197 अतः 1 g Au
= \(\frac{1}{197}\)
= 1/ 197 x 6.022 x 1023 परमाणु
= 3.056 x 1021 परमाणु
(ii) Na का परमाणु भार 23 अतः 1g Na = 1/23 mol
= 1/23 x 6.022 x 1023 परमाणु
= 2.618 x 1022 परमाणु
(iii) Li का परमाणु भार = 7 अतः 1 g Li = 1/7 mol
= 1/7 x 6.022 x 1023 परमाणु
= 8.6 x 1022 परमाणु
(iv) Cl2 का अणु भार = 71 अतः 1 g Cl2 = 1/71 mol
= 1/71 x 6.022 x 1023 अणु
= 2/71 x 6.022 x 1023 परमाणु
= 1.696 x 1022 परमाणु
अतः 1g, L में परमाणुओं की संख्या अधिकतम है।
प्रश्न 1.29.
एथेनॉल के ऐसे जलीय विलयन की मोलरता ज्ञात कीजिए जिसमें एथेनॉल का मोल अंश 0.040 है। (मान लें कि जल का घनत्व 1 है।)
उत्तर:
दिया गया है एथेनॉल का मोल अंश = 0.040
एथेनॉल का मोल अंश (x) (मोल भिन्न) = 
\({ }^x \mathrm{C}_2 \dot{\mathrm{H}}_5 \mathrm{OH}=\frac{\mathrm{n}_{\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}}}{\mathrm{n}_{\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}}+\mathrm{n}_{\mathrm{H}_2 \mathrm{O}}}\)
द्रव्यमान = घनत्व x आयतन
जल का घनत्व = 1gml-1
अतः 1 लीटर जल का द्रव्यमान = 1gm-1x 1000ml-1 = 1000 g
H2O के मोल = द्रव्यमान (g) / मोलर द्रव्यमान
\(\frac{1000}{18}\)
= 55.55 मोल
\(0.04=\frac{\mathrm{n}_{\mathrm{C}_2 \mathrm{H}_3 \mathrm{OH}}}{\mathrm{n}_{\mathrm{C}_2 \mathrm{H}_3 \mathrm{OH}}+55.55}\)
nC2H5OH = (0.04 × nCHOH) + (55.55 x 0.04)
nC2H5OH - 0.04 nC2H5OH = 2.222
0.96 (nC2H5OH) = 2.222
\(\mathrm{n}_{\mathrm{C}_2 \mathrm{H}_5 \mathrm{OH}}=\frac{2.222}{0.96}\)
nC2H5OH = 2.314
अतः एथेनॉल की मोलरता 2.314 क्योंकि 2.314 मोल एथेनॉल 1 लीटर विलयन में उपस्थित है।
प्रश्न 1.30.
एक 12C कार्बन परमाणु का ग्राम (g) में द्रव्यमान क्या होगा?
उत्तर:
1 मोल 12C परमाणु = 6,022 x 103 C परमाणु
= 12 g कार्बन (कार्बन का मोलर द्रव्यमान)
अतः 12C के 1 परमाणु का द्रव्यमान
= \(\frac{12 \mathrm{~g}}{6.022 \times 10^{23}}\)
= 1.99269 x 10-23 g
प्रश्न 1.31.
निम्नलिखित परिकलनों के उत्तर में कितने सार्थक अंक होने चाहिए?
(i) \(\frac{0.02856 \times 298.15 \times 0.112}{0.5785}\)
(ii) 5 x 5.364
(iii) 0.0125 + 0.7864 + 0.0215
उत्तर:
(i) दिए गए विभिन्न मानों में न्यूनतम 3 सार्थक अंक हैं। (0.112) अतः उत्तर में 3 सार्थक अंक होने चाहिए।
(ii) यथार्थ मान (5) को छोड़कर दूसरे मान में 4 सार्थक अंक हैं अतः उत्तर में 4 सार्थक अंक होने चाहिए।
(iii) दिए गए योग में दशमलव के साथ न्यूनतम चार अंक हैं। अतः उत्तर में 4 सार्थक अंक होंगे।
प्रश्न 1.32.
प्रकृति में उपलब्ध ऑर्गन के मोलर द्रव्यमान की गणना के लिए निम्नलिखित तालिका में दिए गए आँकड़ों का उपयोग कीजिए।
उत्तर:
Ar का मोलर द्रव्यमान
\(=\frac{(35.96755 \times 0.337)+(37.96272 \times 0.063)+(39.9624 \times 99.6)}{0.337+0.063+99.6}\)
= 39.9476 g mol-1
= 39.948 g mol-1
प्रश्न 1.33.
निम्नलिखित में से प्रत्येक में परमाणुओं की संख्या ज्ञात कीजिए।
(i) 52 मोल Ar
(ii) 52u He
(iii) 52g He
उत्तर:
(i) 1 मोल Ar = 6.022 x 1023 परमाणु (आवोगाद्रो संख्या)
परमाणुओं की संख्या = मोल x आवोगाद्रो संख्या
अतः 52 मोल Ar = 52 x 6.022 x 1023
परमाणु = 3.131 x 1025 परमाणु
(ii) He के एक परमाणु का द्रव्यमान = 4 u
अतः 52 u He = 52/4
= 13 परमाणु
(iii) He का मोलर द्रव्यमान = 4g mol-1
52g He में मोल = 52/4 = 13
अतः 52 g He में परमाणुओं की संख्या
= 13 × 6.022 × 1023
= 7.8286 x 1024 परमाणु

प्रश्न 1.34.
एक वेल्डिंग ईंधन गैस में केवल कार्बन तथा हाइड्रोजन उपस्थित है। इसके नमूने की कुछ मात्रा ऑक्सीजन से जलाने परं 3.38 g कार्बन डाइऑक्साइड, 0.690g जल के अतिरिक्त और कोई उत्पाद नहीं बनाती। इस गैस के 10.0L (STP पर मापित ) आयतन का भार 11.69 g पाया गया। इसके
(i) मूलानुपाती सूत्र
(ii) अणु द्रव्यमान और
(iii) अणु सूत्र की गणना कीजिए।
उत्तर:
3.38 g CO2 में कार्बन का द्रव्यमान = imm
0.690 g H2O में हाइड्रोजन का द्रव्यमान
= 2/18 x 0.690 g = 0.07666 = 0.0767g
यौगिक का कुल द्रव्यमान = 0.9218 + 0.0767
= 0.9985 g
यौगिक में C का % = \(\frac{0.9218}{0.9985} \times 100\)
= 99.32
यौगिक में H का % = \(\frac{0.0767}{0.9985} \times 100\)
= 7.68
(i) गैस का मूलानुपाती सूत्र ज्ञात करना
C के मोल = \(\frac{92.32}{12}\) = 7.69
H के मोल = \(\frac{7.68}{1}\) = 7.68
कार्बन तथा हाइड्रोजन का सरलतम अनुपात (C : H)
= 7.69 : 7.68 = 1 : 1
अतः गैस का मूलानुपाती सूत्र = CH
(ii) गैस का अणु द्रव्यमान ज्ञात करना
STP पर 1 मोल गैस का आयतन = 22.4 L
= मोलर द्रव्यमान
STP पर 10.0L गैस का भार = 11.69g
अतः 22.4 L गैस का भार = \(\frac{11.69}{100} \times 22.4\)
= 26.1 g = 26 g
अतः गैस का अणु द्रव्यमान (मोलर द्रव्यमान) = 26.0 g mol-1
(iii) गैस का मूलानुपाती सूत्र भार = CH = 12 + 1 = 13

अतः गैस का अणु सूत्र = (CH)2 = C2H2
प्रश्न 1.35.
CaCO3 जलीय HCI के साथ निम्नलिखित अभिक्रिया कर CaCl2 और CO2 बनाता है।
CaCO3 (s) + 2HCl(aq) → CaCl2 (aq) + CO2 (g) + H2O (l) 0.75M HCI के 25 mL के साथ पूर्णतः अभिक्रिया करने के लिए CaCO3 की कितनी मात्रा की आवश्यकता होगी?
उत्तर:
25ml 0.75 M HCl में HCI का द्रव्यमान:

HCl का अणु भार = 1 + 35.5 = 36.5

= 0.68437g = 0.6844 g
2 मोल HCl (2 x 36.5 = 73 g) से क्रिया करने वाले CaCO3 की मात्रा = 100 g
= \(\frac{100}{73} \times 0.6844 \mathrm{~g}\)
अतः 0.6844g HCl से क्रिया करने वाले CaCO3 की मात्रा
= 0.9375g = 0.94 g
प्रश्न 1.36.
प्रयोगशाला में क्लोरीन का विरचन मैंगनीज डाइऑक्साइड (MnO2) की जलीय HCl विलयन के साथ अभिक्रिया द्वारा निम्नलिखित समीकरण के अनुसार किया जाता है।
4 HCl(aq) + MnO2(s) → 2H2O(l) + MnCl2(aq) + C2(g) 5.0g मैंगनीज डाइऑक्साइड के साथ HCl के कितने ग्राम अभिक्रिया करेंगे?
उत्तर:
1 मोल MnO2 = 55 + (2 x 16 ) = 87g अतः संतुलित समीकरण के अनुसार-
87g MnO2 (1 मोल), HCl के 4 मोल (4 x 96.5g = 146g) से अभिक्रिया करता है।
इसलिए 5g MnO2 से अभिक्रिया करने वाले HCl का भार
\(=\frac{146}{87} \times 5 \mathrm{~g}\)
= 8.39g = 8.40g HCl

- RBSE Class 11 Chemistry Important Questions Chapter 2 Structure of Atom
- RBSE Solutions for Class 11 Chemistry Chapter 14 Environmental Chemistry
- RBSE Solutions for Class 11 Chemistry Chapter 13 Hydrocarbons
- RBSE Solutions for Class 11 Chemistry Chapter 12 Organic Chemistry - Some Basic Principles and Techniques
- RBSE Solutions for Class 11 Chemistry Chapter 11 The p-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 10 The s-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 9 Hydrogen
- RBSE Solutions for Class 11 Chemistry Chapter 8 Redox Reactions
- RBSE Solutions for Class 11 Chemistry Chapter 7 Equilibrium
- RBSE Solutions for Class 11 Chemistry Chapter 6 Thermodynamics
- RBSE Solutions for Class 11 Chemistry Chapter 5 States of Matter