RBSE Class 11 Chemistry Notes Chapter 9 हाइड्रोजन
These comprehensive RBSE Class 11 Chemistry Notes Chapter 9 हाइड्रोजन will give a brief overview of all the concepts.
RBSE Class 11 Chemistry Chapter 9 Notes हाइड्रोजन
→ हाइड्रोजन-प्रकृति का सबसे हल्का तत्व जिसे हेनरी कैवेन्डिश ने 1766 में प्रयोगशाला में बनाया तथा 'ज्वलनशील गैस' का नाम दिया।
→ हाइड्रोजन का नाम-सन् 1783 में लेवोशिये ने दिया था, जिसका अर्थ है जल उत्पन्न करने वाली गैस।
→ स्रोत-ब्रह्माण्ड में सूर्य तथा पृथ्वी पर जल और रासायनिक क्रियाओं द्वारा भी हाइड्रोजन प्राप्त होती है। ज्वालामुखी तथा तेल के कुएँ भी हाइड्रोजन गैस के स्रोत हैं।
→ हाइड्रोजन के समस्थानिक-इसके तीन प्रमुख समस्थानिक ज्ञात हैं
- सामान्य हाइड्रोजन या प्रोटियम H,
- भारी हाइड्रोजन H (ड्यूटेरियम),
- अति भारी हाइड्रोजन H (ट्राइटियम)।
→ रेडियोधर्मी हाइड्रोजन-ट्राइटियम है |H जिसकी t1/2 (अर्ध आयु) 12.33 वर्ष है।
→ आवर्त सारणी में हाइड्रोजन का स्थान निश्चित नहीं है क्योंकि यह क्षार धातुओं, हैलोजनों तथा कार्बन से समानता दर्शाता है अतः इसे आवर्त सारणी में अलग से रखा गया है।
→ प्रयोगशाला में हाइड्रोजन का निर्माण-जल, अम्ल अथवा क्षार की धातुओं पर क्रिया द्वारा किया जाता है।
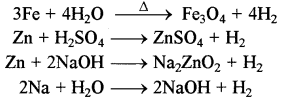

→ औद्योगिक स्तर पर-हाइड्रोजन को जल के विद्युत अपघटन द्वारा तथा ब्राइन के विद्युत अपघटन द्वारा बनाया जाता है।

→ हाइड्रोजन को लेन प्रक्रम, बॉश प्रक्रम तथा हाइड्रोकार्बन द्वारा भी बनाया जाता है।
→ हाइड्रोजन रंगहीन, गंधहीन, स्वादहीन जल में अविलेय गैस है।
→ हाइड्रोजन के दो नाभिकीय चक्रण समावयवी होते हैं जिन्हें आर्थो एवं पैरा हाइड्रोजन कहते हैं।
→ हाइड्रोजन की प्रमुख रासायनिक अभिक्रियाएँ निम्नलिखित
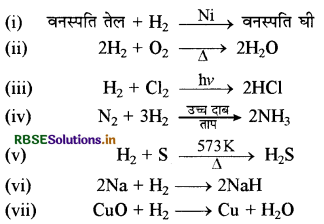
→ हाइड्रोजन के उपयोग-H2 का मुख्य उपयोग NH3 बनाने में, CH3OH बनाने में, वनस्पति तेलों के हाइड्रोजनीकरण में तथा रॉकेट में ईंधन के रूप में किया जाता है।
→ हाइड्राइड्स-हाइड्रोजन के द्विअंगी यौगिक हाइड्राइड कहलाते हैं। इन्हें तीन वर्गों में बाँटा गया है
- आयनिक हाइड्राइड-ये -S- खण्ड के तत्वों द्वारा बनाये जाते हैं। ये क्रियाशील तथा प्रबल अपचायक होते हैं जैसे—NaH, CaH2
- सहसंयोजक हाइड्राइड-ये सामान्यतया p खण्ड के तत्वों द्वारा बनाये जाते हैं। जैसे—CH4, NH3, PH3, HCl इत्यादि।
- अंतराकाशी हाइड्राइड-ये संक्रमण तत्वों द्वारा बनाये जाते हैं। इनमें जो रिक्त स्थान होता है, वह हाइड्रोजन द्वारा भर दिया जाता है।
TiH1.5-1.8, VHo.56
→ जल-(H2O) ऑक्सीजन का प्रमुख हाइड्राइड है। यह उदासीन प्रकृति का होता है तथा यह सार्वभौमिक विलायक है। इसमें ध्रुवीय सहसंयोजक बंध पाया जाता है एवं इसकी आकृति V के आकार की होती है।
→ जल के गुण-अंतराअणुक-हाइड्रोजन बंधन तथा संगुणन के कारण इसका क्वथनांक उच्च (100°C) होता है । यह sp3 संकरित अणु होता है तथा इसमें बंध कोण 104.5° होता है। इसका अधिकतम घनत्व 4°C पर होता है।
→ बर्फ का घनत्व जल से कम होता है अतः यह जल की सतह पर तैरती है।

→ जल की प्रमुख रासायनिक अभिक्रियाएँ-निम्नलिखित
- 2Na + 2H2O → 2NaOH + H2
- C + H2O →CO + H2
- HO + Cl → HCl + HClO
- Na2O + H2O → 2NaOH
- SO3 + H2O → H2SO4
- CaC2 + 2H2O → Ca(OH)2 + CH2
- Na2CO2 + HO → 2NaOH + CO
→ कठोरता-जल में दो प्रकार की कठोरता पायी जाती | है
- अस्थायी कठोरता
- स्थायी कठोरता।
→ अस्थायी कठोरता का कारण हाइड्रोजन कार्बोनेट्स की उपस्थिति है जबकि स्थायी कठोरता का कारण क्लोराइड तथा सल्फेट्स है।
→ जल की अस्थायी कठोरता को उबालकर तथा क्लार्क विधि द्वारा दूर किया जाता है।
→ जल की स्थायी कठोरता निम्नलिखित विधियों द्वारा दूर की जाती है
- धावन सोडा द्वारा
- परम्यूटिट विधि या आयन विनिमय विधि द्वारा
- केलगॉन विधि द्वारा
- आयन विनिमयक संश्लेषित रेजिन्स द्वारा
→ हाइड्रोजन परॉक्साइड बनाने की मुख्य विधियाँ निम्नलिखित हैं
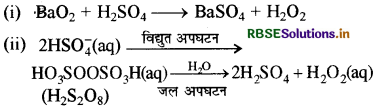
→ H2O2 का औद्योगिक उत्पादन 2 - एथिल - ऐन्थ्राक्विनॉल के स्वतः ऑक्सीकरण द्वारा किया जाता है।
→ H2O2 शीघ्रता से विघटित होता है तथा इसे नीले रंग की बोतल में रखते हैं ।
→ H2O2 की मुख्य रासायनिक अभिक्रियाएँ
(i) अपघटन 2H2O2 → 2H2O + O2
(ii) ऑक्सीकारक गुण
PbS + 4H2O2 → PbSO4 + 4H2O
Mn2++ + H2O2 → Mn4+ + 2OH-
(iii) अपचायक गुण
HOCl + H2O2 → H3O+ + Cl- + O2
2KMnO4 + 3H2SO4 + 5H2O2 → 2MnSO4 + K2SO4 + 8H2O + 5O2
(iv) विरंजक गुण - प्रबल ऑक्सीकारक गुण के कारण यह विरंजक का कार्य करता है ।
→ H2O2 की सान्द्रता को आयतन सान्द्रता में व्यक्त किया जाता है।
→ H2O2 की संरचना खुली किताब की तरह तथा असमतलीय होती है ।

→ भारी जल (D2O) – इसे 'यूरे' (Urey) ने खोजा था तथा यह सामान्य जल के 6000 भाग में 1 भाग होता है तथा उपयोग परमाणु भट्टियों में मंदक (Moderator) के रूप में किया जाता है
→ हाइड्रोजन भविष्य का ईंधन है ।
