RBSE Class 11 Chemistry Notes Chapter 8 अपचयोपचय अभिक्रियाएँ
These comprehensive RBSE Class 11 Chemistry Notes Chapter 8 अपचयोपचय अभिक्रियाएँ will give a brief overview of all the concepts.
RBSE Class 11 Chemistry Chapter 8 Notes अपचयोपचय अभिक्रियाएँ
→ परिचय-ऑक्सीजन तथा हाइड्रोजन प्रकृति में दो अत्यधिक क्रियाशील तत्व हैं। किसी परमाणु, आयन अथवा अणु की इनके साथ होने वाली रासायनिक अभिक्रिया क्रमशः उपचयन (ऑक्सीकरण) तथा अपचयन कहलाती है।
→ ऑक्सीकरण-आधुनिक धारणा के अनुसार किसी परमाणु, आयन अथवा अणु में किसी तत्त्व की ऑक्सीकरण संख्या में वृद्धि होना अथवा इनमें से इलेक्ट्रॉन का निकलना, ऑक्सीकरण कहलाता है।
→ अपचयन-किसी परमाणु, आयन अथवा अणु में किसी तत्त्व की ऑक्सीकरण संख्या में कमी होना अथवा इनमें इलेक्ट्रॉन का जुड़ना अपचयन कहलाता है।
→ रेडॉक्स अभिक्रियाएँ अथवा अपचयोपचय अभिक्रियाएँ-वे रासायनिक अभिक्रियाएँ जिनमें एक पदार्थ का उपचयन (ऑक्सीकरण) होता है जबकि दूसरे पदार्थ का तुल्य मात्रा में अपचयन होता है, उन्हें रेडॉक्स अभिक्रियाएँ कहते हैं।
→ ऑक्सीकारक-वे पदार्थ जो इलेक्ट्रॉन ग्रहण करते हैं तथा दूसरे पदार्थ का ऑक्सीकरण करते हैं, उन्हें ऑक्सीकारक कहते हैं। ये स्वयं अपचयित होते हैं।
→ अपचायक-इलेक्ट्रॉन त्यागने वाले पदार्थ अपचायक कहलाते हैं। ये दूसरे पदार्थ का अपचयन करते हैं तथा स्वयं ऑक्सीकृत हो जाते हैं।

→ किसी धातु लवण के विलयन में से उस धातु का विस्थापन अधिक सक्रिय धातु द्वारा किया जा सकता है लेकिन इसका विपरीत नहीं होता है। जैसे-Cusox के जलीय विलयन में Zn डालने पर Cu का विस्थापन हो जाता है लेकिन Znso, के विलयन में Cu डालने पर Zn का विस्थापन नहीं होता।
→ ऑक्सीकरण संख्या या ऑक्सीकरण अंक-किसी यौगिक में तत्त्व की ऑक्सीकरण संख्या, उसकी ऑक्सीकरण अवस्था को दर्शाती है जिसे इस आधार पर ज्ञात किया जाता है कि सहसंयोजी बन्ध का इलेक्ट्रॉन युग्म केवल अधिक विद्युतऋणी तत्त्व से सम्बद्ध होता है अथवा किसी यौगिक या तत्त्व के अणु में उपस्थित किसी परमाणु पर स्थित आवेश को उस परमाणु की ऑक्सीकरण संख्या कहते हैं। ऑक्सीकरण संख्या की गणना कुछ स्वेच्छिक नियमों के आधार पर की जाती है।
→ स्टॉक संकेतन-इसके अनुसार यौगिकों में धातु की ऑक्सीकरण अवस्था को रोमन संख्या में कोष्ठक में लिखा जाता है, जैसे—ऑरस क्लोराइड [Au(I) Cl] |
→ ऑक्सीकारकों तथा अपचायकों का तुल्यांकी भार— अणुभार या आयनिक भार ऑक्सीकरण अंक में प्रति अणु कुल परिवर्तन
→ अपचयोपचय अभिकि याओं के प्रकार-ये अभिक्रियाएँ चार प्रकार की होती हैं
(i) योगात्मक अभिक्रियाएँ-इन अभिक्रियाओं में दो पदार्थ संयोग करते हैं जिनमें कम से कम एक तत्त्व होना चाहिए।
उदाहरण- C + O2 → CO2
3Mg + N2 → Mg3N2
दहन की सभी अभिक्रियाएँ इस श्रेणी में रखी जाती हैं।
(ii) अपघटन अभिक्रियाएँ-इन अभिक्रियाओं में एक | यौगिक दो या अधिक पदार्थों में टूटता है, जिनमें से एक तत्त्व के रूप में होता है।
उदाहरण- 2H2O(l) → 2H2(g) + O2(g)
(iii) विस्थापन अभिक्रियाएँ-ये वे रासायनिक अभिक्रियाएँ हैं जिनमें एक यौगिक का परमाणु अथवा आयन दुसरे तत्व के परमाणु अथवा आयन के द्वारा विस्थापित होता है।
विस्थापन अभिक्रियाओं को दो उपवर्गों में विभाजित किया जाता है
(a) धातु विस्थापन-इन अभिक्रियाओं में एक धातु दूसरी धातु को विस्थापित करती है लेकिन प्रबल अपचायक धातु ही दुर्बल अपचायक धातु को विस्थापित करती है। उदाहरण
CuSO4(aq) + Zn(s) → ZnSO4(aq) + Cu(s)
(b) अधातु विस्थापन-इन अभिक्रियाओं में धातु अथवा अधातु अन्य किसी अधातु को उसके यौगिक में से विस्थापित करता
उदाहरण
Na2(s) + 2H2O(l) → NaOH(aq) + H2(g)
(iv) असमानुपातन अभिक्रियाएँ-ये एक विशेष प्रकार की अपचयोपचय अभिक्रियाएँ हैं जिनमें किसी तत्व की एक ऑक्सीकरण अवस्था, एक साथ ऑक्सीकृत तथा अपचयित होती है।
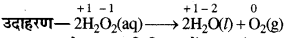
→ अपचयोपचय अभिक्रियाओं का संतुलन-दो प्रमुख विधियों द्वारा किया जाता है
- ऑक्सीकरण अंक विधि द्वारा
- आयन-इलेक्ट्रॉन विधि (अर्ध-अभिक्रिया विधि) द्वारा-यह आधुनिक विधि है।
→ रेडॉक्स अनुमापन-वह अनुमापन जो ऑक्सीकारक पदार्थ तथा अपचायक पदार्थ के विलयनों के मध्य किया जाता है उसे रेडॉक्स अनुमापन कहते हैं। इसमें एक पदार्थ का ऑक्सीकरण तथा दूसरे पदार्थ का अपचयन होता है। जैसे-KMnOA (ऑक्सीकारक) तथा FeSO4. (NH4)2SO4. 6H2O (अपचायक) के मध्य अनुमापन।
→ विद्युत रासायनिक सेल-वह सेल जिसके द्वारा रासायनिक ऊर्जा को विद्युत ऊर्जा में परिवर्तित किया जाता है उसे विद्युत रासायनिक सेल या गैल्वेनी सेल कहते हैं। डेनियल सेल इसका प्रमुख उदाहरण है।
→ डेनियल सेल में Zn|ZnSO4 (aq) का एनोड तथा Cu|CuSO4(aq) का कैथोड होता है तथा इसकी सम्पूर्ण अभिक्रिया इस प्रकार होती है
Zn(s) + Cu2+ (aq) ≅ Zn2+(aq) + Cu(s)

→ इलेक्ट्रॉड विभव-जब किसी धातु की छड़ को विलयन के सम्पर्क में रखा जाता है तो धातु इलेक्ट्रॉन देती है जिससे एक प्रकार का विभव उत्पन्न होता है उसे इलेक्ट्रॉड विभव कहते हैं।
→ विद्युत रासायनिक श्रेणी-जब धातुओं को उनकी सक्रियता के बढ़ते क्रम में रखा जाता है तो प्राप्त श्रेणी को विद्युत रासायनिक श्रेणी कहते हैं।
→ संयोजकता हमेशा पूर्णांक होती है जबकि ऑक्सीकरण अंक भिन्नों में भी हो सकता है।
→ प्रत्येक तत्त्व की संयोजकता सामान्यतः निश्चित होती है लेकिन एक ही तत्त्व का ऑक्सीकरण अंक भिन्न-भिन्न यौगिकों में भिन्न-भिन्न हो सकता है।
→ लीथियम सबसे प्रबल अपचायक धातु होती है।
