RBSE Class 11 Chemistry Notes Chapter 5 द्रव्य की अवस्थाएँ
These comprehensive RBSE Class 11 Chemistry Notes Chapter 5 द्रव्य की अवस्थाएँ will give a brief overview of all the concepts.
RBSE Class 11 Chemistry Chapter 5 Notes द्रव्य की अवस्थाएँ
→ अन्तरा - आण्विक बल - परमाणुओं तथा अणुओं के मध्य आकर्षण और प्रतिकर्षण बलों को अन्तरा - आण्विक बल कहते हैं ।
→ वान्डरवाल्स बलों के मुख्य प्रकार -
- प्रकीर्णन बल अथवा लंडन बल या तात्कालिक द्विध्रुव प्रेरित - द्विध्रुव आकर्षण
- द्विध्रुव - द्विध्रुव बल या अभिविन्यास प्रभाव
- द्विध्रुव - प्रेरित द्विध्रुव बल या प्रेरण प्रभाव
→ अन्य आकर्षण बलों के साथ-साथ आयन- - द्विध्रुव आकर्षण तथा आयन प्रेरित द्विध्रुव आकर्षण भी महत्त्वपूर्ण हैं ।
→ हाइड्रोजन बन्ध - वह आकर्षण बल जो एक अणु के हाइड्रोजन परमाणु को दूसरे अणु के विद्युत ऋणी परमाणु (F, O या N) से जोड़ता है उसे हाइड्रोजन बन्ध कहते हैं।
→ ऊष्मीय ऊर्जा - किसी पदार्थ के अणु या परमाणुओं की गति के कारण उत्पन्न ऊर्जा को ऊष्मीय ऊर्जा कहते हैं
→ ऊष्मीय ऊर्जा पदार्थ के ताप के समानुपाती होती है।
→ ऊष्मीय ऊर्जा बढ़ने से पदार्थ ठोस से द्रव तथा द्रव से गैस अवस्था में परिवर्तित हो जाता है ।
→ गैसों में अणु बहुत दूर-दूर होते हैं तथा इनके मध्य आकर्षण बल नगण्य होता है ।
→ गैसों के नियम निम्न हैं-
- बॉयल का नियम
- चार्ल्स का नियम
- गै-लुसैक नियम
- आवोगाद्रो नियम ।

→ बॉयल का नियम - स्थिर ताप पर गैसों की निश्चित मात्रा का दाब उसके आयतन के व्युत्क्रमानुपाती होता है।
अतः
PV = k1, P1V1 = P2V2
→ चार्ल्स का नियम - स्थिर दाब पर किसी गैस की निश्चित मात्रा का आयतन उसके परम ताप के समानुपाती होता है ।
\(\frac{V}{T}\) = k2
\(\frac{V_1}{T_1}=\frac{V_2}{T_2}\)
→ गै-लुसैक नियम - स्थिर आयतन पर किसी गैस की निश्चित मात्रा का दाब उसके परम ताप के समानुपाती होता है ।
\(\frac{\mathrm{P}}{\mathrm{T}}\) = k3
→ आवोगाद्रो नियम- समान ताप व दाब पर विभिन्न गैसों के समान आयतन में अणुओं की संख्या समान होती है ।
V = k4n
→ किसी गैस का घनत्व उसके मोलर द्रव्यमान के समानुपाती होता है ।
M = k4d
→ आदर्श गैस समीकरण - PV = nRT होता है । इसे अवस्था समीकरण भी कहते हैं । यहाँ R = गैस नियतांक
→ संयुक्त गैस नियम
\(\frac{\mathrm{P}_1 \mathrm{~V}_1}{\mathrm{~T}_1}=\frac{\mathrm{P}_2 \mathrm{~V}_2}{\mathrm{~T}_2}\)
→ गैस स्थिरांक (R) की प्रकृति-गैस स्थिरांक की विमाएँ, ऊर्जा की विमाओं के समान होती हैं।
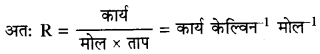
→ विभिन्न मात्रकों में R के संख्यात्मक मान निम्न हैं
- SI मात्रक में- R = 8.314 JK-1 mol-1
- CGS मात्रक में R = 8.314 × 107 erg K-1 mol-1
- कैलोरी में R = 1.987 cal K-1 mol-1 R = 2 cal K-1 mol-1
- लीटर-ऐटमोस्फीयर में R = 0.082 L atm K-1 mol-1
- बार-डी एम में R = 0.0831 bar dm3 K-1 mol-1
→ गैसों के घनत्व तथा मोलर द्रव्यमान में निम्न सम्बन्ध होता है
M = \(\frac{\mathrm{d} \mathrm{RT}}{\mathrm{P}}\)
→ डाल्टन का आंशिक दाब का नियम-दो या दो से अधिक अक्रियाशील गैसों के मिश्रण को एक बन्द पात्र में लेने पर मिश्रण का कुल दाब प्रत्येक गैस के आंशिक दाब के योग के बराबर होता है।
Pकुल = P1 + P2 + P3 + ........ (स्थिर ताप व आयतन पर)
P1, P2, तथा P3 भिन्न-भिन्न गैसों के आंशिक दाब हैं।
→ आंशिक दाब-किसी गैस का आंशिक दाब, उस गैस द्वारा उत्पन्न वह दाब है जब इस गैस को समान ताप पर, समान आयतन वाले पात्र में रखा जाता है।
→ नमी युक्त गैस का वाष्प दाब अधिक होता है अतः इसमें से जल का वाष्प दाब (जलीय तनाव) घटाने पर शुष्क गैस का वाष्प दाब प्राप्त होता है।
→ ग्राहम का विसरण नियम-निश्चित ताप व दाब पर विभिन्न गैसों के विसरण की दर, उनके घनत्व के वर्गमूल के व्युत्क्रमानुपाती होती है।
→ गैसों का अणुगतिक सिद्धान्त-वह सिद्धान्त जो गैसों के व्यवहार को स्पष्ट करता है, उसे गैसों का अणुगतिक सिद्धान्त कहते हैं।
→ गैसों का अणुगति समीकरण-PV = \(\frac{1}{3}\)mnu2
→ गैस की गतिज ऊर्जा (K.E) = \(\frac{3}{2}\)PV = \(\frac{3}{2}\)RT
→ गैस के एक अणु की औसत गतिज ऊर्जा = \(\frac{3}{2}\)RT
→ किसी गैस का औसत वेग (Ū) = \(\sqrt{\frac{8 \mathrm{RT}}{\mathrm{nM}}}\), प्रायिकता वेग (ump) = \(\sqrt{\frac{2 \mathrm{RT}}{\mathrm{M}}}\) तथा वर्ग माध्य मूल वेग (urms) = \(\sqrt{\frac{3 \mathrm{RT}}{\mathrm{M}}}\) होता है।
→ आदर्श गैस-वह गैस, जो दाब व ताप के सभी मानों पर गैस नियमों का पालन करती है।
→ वास्तविक गैस-वह गैस जो ताप व दाब के सभी मानों पर गैस नियमों का पालन नहीं करती। इनमें आदर्श व्यवहार से विचलन पाया जाता है।
→ संपीड्यता गुणांक (Z) = PV = Vवास्तविक
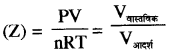

→ वान्डरवाल समीकरण = (P + \(\frac{\mathrm{an}^2}{\mathrm{~V}^2}\))(V - nd) = nRT
a तथा b = वान्डरवाल स्थिरांक
→ जब किसी गैस द्वारा घेरा गया आयतन बहुत अधिक है तो वास्तविक गैस आदर्श गैस की भाँति व्यवहार करती है क्योंकि इस स्थिति में अणुओं का आयतन नगण्य मान सकते हैं।
→ बॉयल ताप या बॉयल बिन्दु-वह ताप जिस पर कोई वास्तविक गैस दाब की पर्याप्त मात्रा पर आदर्श गैस की तरह व्यवहार करती है।
→ क्रान्तिक ताप (To)-वह अधिकतम ताप जिस पर कोई गैस पर्याप्त दाब लगाने पर द्रव अवस्था में परिवर्तित हो जाती है, उसे क्रान्तिक ताप कहते हैं।
→ क्रान्तिक दाब (P)-किसी गैस को उसके क्रान्तिक ताप पर द्रवित करने के लिए आवश्यक दाब को उस गैस का क्रान्तिक दाब कहते हैं।
→ क्रान्तिक आयतन-क्रान्तिक ताप तथा क्रान्तिक दाब पर किसी गैस के एक मोल का आयतन क्रान्तिक आयतन कहलाता है।
→ वाष्य दाब-स्थिर ताप पर एक निर्वातित पात्र में जब कोई द्रव तथा उसकी वाष्प साम्य अवस्था में है तो इस स्थिति में वाष्प द्वारा द्रव की सतह पर लगाया गया दाब उस द्रव का वाष्प दाब कहलाता है।
→ मानक क्वथनांक-1 bar दाब पर किसी द्रव का क्वथनांक मानक क्वथनांक कहलाता है। मानक क्वथनांक, सामान्य क्वथनांक से कुछ कम होता है।
→ पृष्ठ तनाव-द्रव की सतह पर खींची गई एक रेखा की एकांक लम्बाई के तल पर लगने वाले लम्बवत् बल को पृष्ठ तनाव कहते हैं।
→ ताप बढ़ाने पर द्रव का पृष्ठ तनाव कम हो जाता है।
→ श्यानता-किसी द्रव के प्रवाह के प्रति उत्पन्न आंतरिक प्रतिरोध को श्यानता कहते हैं।
→ किसी द्रव की श्यानता के मापन हेतु ऑस्टवाल्ड विस्कोमीटर (श्यानतामापी) का प्रयोग किया जाता है।
→ वे द्रव जिनमें हाइड्रोजन बन्ध पाया जाता है उनकी श्यानता अपेक्षाकृत अधिक होती है जैसे ग्लिसरीन, सान्द्र H2SO4, इत्यादि।
