RBSE Class 11 Chemistry Notes Chapter 4 रासायनिक आबंधन तथा आण्विक संरचना
These comprehensive RBSE Class 11 Chemistry Notes Chapter 4 रासायनिक आबंधन तथा आण्विक संरचना will give a brief overview of all the concepts.
RBSE Class 11 Chemistry Chapter 4 Notes रासायनिक आबंधन तथा आण्विक संरचना
→ रासायनिक आबन्ध (Chemical Bond)-विभिन्न रासायनिक स्पीशीज में उनके घटकों (परमाणु, आयन) को आपस में जोड़ने वाले आकर्षण बल को रासायनिक आबन्ध कहते हैं।
→ संयोजकता इलेक्ट्रॉन (Valance Electron)-किसी अणु के बनने में परमाणुओं के केवल बाह्यतम कोश के इलेक्ट्रॉन ही भाग लेते हैं, इन्हें संयोजकता इलेक्ट्रॉन कहते हैं।
→ वैद्युत संयोजक आबन्ध (आयनिक बन्ध)-धनायन तथा ऋणायन के बीच स्थिर वैद्युत आकर्षण बल से बने बन्ध को आयनिक बन्ध कहते हैं।
→ अष्टक नियम (कॉसेल तथा लूइस)-परमाणुओं के मध्य बन्ध बनते समय संयोजी इलेक्ट्रॉनों का स्थानान्तरण या सह-भाजन (साझा) होता है, इसमें परमाणु अपने संयोजकता कोश में आठ इलेक्ट्रॉन प्राप्त करते हैं, जिससे वे स्थायी हो जाते हैं। इसे अष्टक नियम कहते हैं।
→ सह-संयोजी आबन्ध (Covalent Bond)-दो समान या असमान विद्युतऋणी परमाणुओं के मध्य इलेक्ट्रॉन युग्म के साझे से बने बन्ध को सह-संयोजी आबन्ध कहते हैं।
→ सहसंयोजी यौगिकों के गलनांक व क्वथनांक कम होते हैं तथा इनमें समावयवता का गुण भी पाया जाता है।
→ सहसंयोजी यौगिक अध्रुवीय विलायकों में विलेय होते हैं तथा सामान्यतः ये विद्युत के कुचालक होते हैं। अपवाद-ग्रेफाइट विद्युत का सुचालक होता है।
→ जब दो परमाणुओं के मध्य इलेक्ट्रॉनों के असमान साझे से बन्ध बनता है तो इसे उपसहसंयोजी बन्ध कहते हैं अर्थात् उपसहसंयोजी बन्ध बनते समय साझे के लिए दोनों इलेक्ट्रॉन एक ही परमाणु द्वारा दिए जाते हैं।

→ फॉर्मल आवेश-लूइस संरचना में किसी परमाणु पर फॉर्मल आवेश = मुक्त परमाणु में संयोजकता इलेक्ट्रॉनों की संख्या [अनाबन्धी इलेक्ट्रॉनों की कुल संख्या] - \(\frac{1}{2}\) [आबन्धित इलेक्ट्रॉनों की कुल संख्या] ।
→ अष्टक के नियम के अपवाद-
- केन्द्रीय परमाणु का अपूर्ण अष्टक (BF5)
- विषम इलेक्ट्रॉन अणु (NO)
- अष्टक का प्रसार (PCl5)
- संक्रमण तत्वों से बने यौगिक (Zn2+)।
→ आयनिक आबन्ध, निम्न आयनन एन्थैल्पी तथा अपेक्षाकृत उच्च ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी वाले तत्वों के बीच आसानी से बनते हैं।
→ क्रिस्टल जालक (Crystal Lattice)-आयनिक यौगिकों में धनायनों तथा ऋणायनों की निश्चित त्रिविमीय व्यवस्था को क्रिस्टल जालक कहते हैं। जालक एन्थैल्पी (Lattice Enthalpy)-किसी आयनिक ठोस के एक मोल यौगिक को गैसीय अवस्था में उसके धनायनों तथा ऋणायनों में पृथक् करने के लिए आवश्यक ऊर्जा को जालक एन्थैल्पी कहते हैं।
→ जालक एन्थैल्पी, आयनों के आवेश, आयनों के आकार तथा आयनिक यौगिकों की क्रिस्टल संरचना पर निर्भर करती है।
→ आयनिक यौगिक सामान्यतः कठोर क्रिस्टलीय ठोस होते हैं, जिनके गलनांक तथा क्वथनांक अपेक्षाकृत उच्च होते हैं।
→ आयनिक यौगिक ध्रुवीय विलायकों में विलेय होते हैं तथा विलयन में ये विद्युत के सुचालक होते हैं।
→ आबन्ध लम्बाई (Bond Length)-किसी अणु में आबन्धित परमाणुओं के नाभिकों के बीच की साम्यावस्था दूरी को आबन्ध लम्बाई कहते हैं।
→ आबन्ध कोण (Bond Angle)-किसी अणु के केन्द्रीय परमाणु के पास-पास स्थित वे कक्षक, जिनमें बन्धित इलेक्ट्रॉन युग्म उपस्थित हैं, के मध्य स्थित कोण को आबन्ध कोण कहते हैं।
→ आबन्ध एन्थैल्पी (Bond Enthalpy)-गैसीय अवस्था में दो परमाणुओं के बीच विशिष्ट आबन्धों के एक मोल को तोड़ने के लिए आवश्यक ऊर्जा को आबन्ध एन्थैल्पी कहते हैं।
→ आबन्ध कोटि (Bond Order)-किसी अणु में दो परमाणुओं के मध्य आबन्धों की संख्या को आबन्ध कोटि कहते हैं।
→ समइलेक्ट्रॉनी अणुओं तथा आयनों में आबन्ध कोटि समान होती है, जैसे—F2, तथा O22- (18 इलेक्ट्रॉन) में आबन्ध कोटि 1 है तथा N2, CO तथा NO+ में आबन्ध कोटि 3 है।
→ आबन्ध कोटि बढ़ने पर आबन्ध एन्थैल्पी बढ़ती है तथा आबन्ध लम्बाई कम होती है। अतः स्थायित्व बढेगा।

→ अनुनाद (Resonance)-जब किसी अणु को केवल एक लूइस संरचना द्वारा नहीं दर्शाया जा सके, तो लगभग समान ऊर्जा, नाभिकों (परमाणु) की समान स्थितियों तथा समान आबन्धी एवं अनाबन्धी इलेक्ट्रॉन युग्मों वाली कई संरचनाएँ लिखी जाती हैं, इन्हें अनुनादी संरचनाएँ कहते हैं तथा इन सबके मिले-जुले रूप को अनुनाद संकर कहते हैं जो कि अणु की वास्तविक संरचना को निरूपित करता है तथा इस धारणा को अनुनाद कहते हैं।
→ अनुनाद ऊर्जा-किसी यौगिक में सर्वाधिक स्थायी अनुनादी संरचना (सबसे कम ऊर्जा की संरचना) की ऊर्जा तथा अनुनाद संकर की ऊर्जा का अन्तर अनुनाद ऊर्जा कहलाता है।
→ आबन्ध ध्रुवणता (Polarity of the Bond)-भिन्न-भिन्न तत्वों से बने सहसंयोजी बन्ध को ध्रुवीय सह-संयोजी बन्ध कहते हैं तथा इसे आबन्ध की ध्रुवणता कहते हैं। ऐसे अणु में द्विध्रुव आघूर्ण होता है। अर्थात् ये अणु ध्रुवीय होते हैं। जैसे— HCl
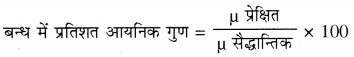
→ फायान का नियम (आयनिक बन्ध में आंशिक सहसंयोजी लक्षण)-यौगिक में जब धनायन, ऋणायन के इलेक्ट्रॉन अभ्र को अपनी ओर आकर्षित करता है तो उनके मध्य आवेश की मात्रा बढ़ती है जिससे दोनों नाभिकों के मध्य इलेक्ट्रॉनीय आवेश घनत्व में वृद्धि होती है इसे ऋणायन का ध्रुवण कहते हैं तथा इससे आयनिक बन्ध में आंशिक सहसंयोजी गुण आ जाता है। इसे फायान का नियम कहते हैं।
→ बन्ध में सहसंयोजी गुण बढ़ने पर यौगिकों के गलनांक तथा क्वथनांक कम होते हैं।
→ आवर्त में बाएँ से दाएँ जाने पर ऑक्साइडों की अम्लीय प्रवृत्ति बढ़ती है लेकिन वर्ग में क्षारीय प्रवृत्ति बढ़ती है।
→ वर्ग में ऊपर से नीचे जाने पर कार्बोनेटों का स्थायित्व बढ़ता है तथा आवर्त में कम होता है।
→ संयोजकता कोश इलेक्ट्रॉन युग्म प्रतिकर्षण सिद्धान्त (V.S.E.P.R. Theory): यह सिद्धान्त अणुओं की ज्यामिति निर्धारित करता है
जो कि 1.p तथा b.p के मध्य प्रतिकर्षण तथा 1.p तथा b.p संख्या पर निर्भर करती है।
प्रतिकर्षण का क्रम- 1.p-1.p > 1.p – b.p > b.p – b.p
→ VSEPR सिद्धान्त के अनुसार किसी अणु में उपस्थित 1.p तथा b.p की व्यवस्था इस प्रकार होती है कि उनके मध्य प्रतिकर्षण न्यूनतम हो।
→ संयोजकता बन्ध सिद्धान्त के अनुसार बन्ध बनाने वाले दो परमाणुओं के बाह्यतम कोश के वे कक्षक जिनमें अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं, आपस में अतिव्यापन करके सहसंयोजी बन्ध का निर्माण करते हैं। लेकिन कक्षकों में उपस्थित अयुग्मित इलेक्ट्रॉनों का चक्रण विपरीत होना चाहिए।
→ कक्षकों का अतिव्यापन—बन्ध बनाते समय दो परमाणु इतने पास-पास आ जाते हैं कि उनके परमाणु कक्षक आंशिक रूप से एक-दूसरे का अन्तर-भेदन करते हैं। इसे परमाणु कक्षकों का अतिव्यापन कहते हैं। अतिव्यापन की मात्रा अधिक होने पर बन्ध की प्रबलता भी अधिक होगी।

→ अतिव्यापन के प्रकार
- ss
- sp
- pp समाक्ष
- p—p सम्पार्श्विक।
→ समाक्ष अतिव्यापन से σ बन्ध तथा सम्पार्श्विक अतिव्यापन से π बन्ध बनता है।
→ σ बन्ध, π बन्ध की तुलना में प्रबल होता है।
→ संकरण (Hybridisation):
जब किसी परमाणु के संयोजी कोश के लगभग समान ऊर्जा वाले दो या दो से अधिक कक्षक आपस में मिलकर, ऊर्जा के पुनर्वितरण द्वारा समान ऊर्जा व समान आकृति वाले नए कक्षक बनाते हैं तो इन कक्षकों को संकर कक्षक कहते हैं तथा इस प्रक्रिया को संकरण कहते हैं।
→ संकरण के प्रकार-sp (BeCl2), sp2 (BCl3), sp3 (CH4), sp3d (PCl5), sp3d2 (SF6) sp3d3 (IF7) तथा dsp2 [Ni(CN)4]2-.
→ किसी अणु के केन्द्रीय परमाणु पर संकरण = केन्द्रीय परमाणु पर संकर कक्षकों की संख्या = o बन्धों की संख्या + एकाकी इलेक्ट्रॉन युग्मों ___ की संख्या केन्द्रीय परमाणु पर संकर कक्षकों की संख्या 2, 3, 4, 5, 6 तथा 7 होने पर क्रमशः sp, sp2, sp3, sp3d, sp3d2 तथा sp3 संकरण होता है।
→ ग्रेफाइट में कार्बन पर sp2 संकरण तथा हीरे में कार्बन पर sp3 संकरण होता है।
→ गकेन्द्रीय परमाणु की विद्युत ऋणता कम होने पर बन्ध कोण का मान कम होता है जैसे
H2O > H2S > H2Se > H2Te
लेकिन केन्द्रीय परमाण से जडे परमाणु की विद्युत ऋणता कम होने पर बन्ध कोण का मान बढ़ता है जैसे OF2 > Cl2O > Br2O
→ आण्विक कक्षक सिद्धान्त (Molecular Orbital Theory) - किसी अणु में दो परमाणुओं के समान ऊर्जा तथा समान सममिति वाले परमाणु कक्षक आपस में मिलकर समान संख्या में अणु कक्षक बनाते हैं (बन्धी तथा विपरीत आबन्धी), इसे आण्विक कक्षक सिद्धान्त कहते हैं ।
→ किसी अणु या आयन में अयुग्मित इलेक्ट्रॉन होने पर वह अनुचुम्बकीय तथा सभी इलेक्ट्रॉन युग्मित होने पर वह प्रतिचुम्बकीय होगा ।
→ आबंध कोटि = \(\frac{1}{2}\) (Nb-Na),
Nb = बन्धी कक्षकों में इलेक्ट्रॉन, Na = विपरीत बन्धी कक्षकों में इलेक्ट्रॉन ।

→ हाइड्रोजन आबन्धन (H-bond) - अधिक ध्रुवीय अणुओं, जिनमें हाइड्रोजन होता है, आंशिक धनावेशित हाइड्रोजन परमाणु किसी दूसरे विद्युत ऋणात्मक परमाणु ( आंशिक ऋणावेशित) को अपनी ओर स्थिर वैद्युत बल द्वारा आकर्षित करता है । इस आकर्षण बल को हाइड्रोजन बन्धन कहते हैं । यह दो प्रकार का होता है-
- अन्तर- अणुक हाइड्रोजन आबन्ध
- अन्तराअणुक हाइड्रोजन आबन्ध ।
