RBSE Class 11 Chemistry Notes Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता
These comprehensive RBSE Class 11 Chemistry Notes Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता will give a brief overview of all the concepts.
Rajasthan Board RBSE Solutions for Class 11 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 11. Students can also read RBSE Class 11 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 11 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 11 Chemistry Chapter 3 Notes तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता
→ तत्त्वों की अधिक संख्या तथा इनके असंख्य यौगिकों के रसायन का अलग-अलग अध्ययन करना बहुत मुश्किल था अतः इनके वर्गीकरण की आवश्यकता हुई।
→ डॉबेराइनर के त्रिक-डॉबेराइनर ने परमाणु भार के आधार पर तीन-तीन तत्त्वों का समूह बनाया जिन्हें डॉबेराइनर के त्रिक कहते हैं । त्रिक में बीच वाले तत्त्व का परमाणु भार शेष दोनों तत्त्वों के परमाणु भार के औसत मान के लगभग बराबर होता है तथा मध्य वाले तत्त्व के गुणधर्म भी शेष दोनों तत्त्वों के गुणधर्मों के मध्य होते हैं।
→ न्यूलैंड का अष्टक नियम-तत्त्वों को उनके परमाणु भार के बढ़ते क्रम में रखने पर किसी भी तत्त्व से प्रारम्भ करने पर आठवें तत्त्व के गुण प्रथम तत्त्व के समान होते हैं। जैसे-संगीत में आठवां स्वर पहले स्वर के समान होता है।
→ लोथर मेयर के वक्र-परमाणु आयतन तथा परमाणु भार के मध्य आलेख को लोथर मेयर के वक्र कहते हैं जिनमें समान गुणों वाले तत्त्व समान स्थिति पर होते हैं अतः ये एक निश्चित समूह वाले तत्त्वों में समानता दर्शाते हैं।
→ मेंडलीव का आवर्त नियम-तत्त्वों के गुणधर्म उनके परमाणु भारों के आवर्ती फलन होते हैं। मेंडलीव, आवर्त सारणी परमाणु द्रव्यमान पर आधारित है तथा इस आवर्त सारणी में 7 आवर्त एवं 8 वर्ग हैं।
→ मोजले ने Z तथा v के मध्य निम्नलिखित सम्बन्ध दिया
√v = a(Z - b)
यहाँ a, b = स्थिरांक, v = X-किरण की आवृत्ति तथा Z = परमाणु क्रमांक
→ आधुनिक आवर्त नियम–तत्त्वों के भौतिक तथा रासायनिक गुणधर्म उनके परमाणु क्रमांकों के आवर्ती फलन होते हैं।
→ आधुनिक आवर्त सारणी में तत्त्वों की व्यवस्था, उनके बढ़ते हुए परमाणु क्रमांक के क्रम में सात क्षैतिज पंक्तियों (आवर्त) तथा 18 ऊर्ध्वाधर स्तम्भों (वर्ग या परिवार) में की गयी है।
→ एक वर्ग के सभी तत्त्वों का संयोजी कोश विन्यास समान होता है, इसलिए इनके रासायनिक गुण भी समान होते हैं।
→ एक आवर्त के तत्त्वों में बाएँ से दाएँ जाने पर इलेक्ट्रॉनों की संख्या बढ़ती है, अतः इनकी संयोजकता भी भिन्न-भिन्न होती है।

→ इलेक्ट्रॉनिक विन्यास के आधार पर आवर्त सारणी को चार ब्लॉकों (खण्डों) में वर्गीकृत किया गया है—s, p, d तथा fब्लॉक।
→ s-ब्लॉक के तत्त्वों का बाह्यतम इलेक्ट्रानिक विन्यास ns1 तथा ns2 होता है, यहाँ n = 1 से 7
→ p-ब्लॉक के तत्वों का बाह्यतम इलेक्ट्रॉनिक विन्यास ns2 np1-6 होता है, यहाँ n = 2 से 6
→ d-ब्लॉक के तत्त्वों का बाह्यतम इलेक्ट्रॉनिक विन्यास (n – 1)1-10 ns0-2 है, यहाँ n = 4 से 7
→ f-ब्लॉक के तत्त्वों का बाह्यतम इलेक्ट्रॉनिक विन्यास (n - 2)f1-14 (n-1)d0-1 ns2 होता है, यहाँ n = 6 तथा 7.
→ S तथा p-ब्लॉक के तत्त्वों को संयुक्त रूप से मुख्य वर्ग के तत्त्व या प्रतिनिधि तत्त्व कहते हैं।
→ d-ब्लॉक के तत्व संक्रमण तत्व तथा f-ब्लॉक के तत्व आन्तरिक संक्रमण तत्व कहलाते हैं।
→ हाइड्रोजन का आवर्त सारणी में स्थान अद्वितीय है अर्थात् निश्चित नहीं है।
→ आवर्त सारणी में बायीं ओर धातु तथा दायीं ओर अधातु स्थित होते हैं।
→ ऐसे तत्त्व जो धातुओं तथा अधातुओं के सीमावर्ती हैं उन्हें उपधातुएँ कहते हैं । जैसे—Si, Ge, As, Sb तथा Te।
→ कुल ज्ञात तत्त्वों में से 78% धातु तथा 20% से कम अधातु हैं।
→ वर्ग में नीचे जाने पर तत्वों के धात्विक गुण में वृद्धि होती है तथा आवर्त में बाएँ से दाएँ जाने पर धात्विक गुण में कमी होती है अर्थात् अधातु गुण बढ़ता है।
→ परमाणु त्रिज्या-एक परमाणु के बाह्यतम इलेक्ट्रॉन तथा नाभिक के बीच की दूरी को परमाणु त्रिज्या कहते हैं।
→ वर्ग में परमाणु त्रिज्या का मान बढ़ता है तथा आवर्त में परमाणु त्रिज्या का मान कम होता है।

→ आवर्त सारणी के किसी आवर्त में क्षार धातुओं का परमाणु आकार अधिकतम तथा हैलोजनों का परमाणु आकार न्यूनतम होता है।
→ धात्विक परमाणुओं में परमाणु त्रिज्या को धात्विक त्रिज्या कहा जाता है।
→ उत्कृष्ट गैसें बन्ध नहीं बनाती हैं अतः इनकी परमाणु त्रिज्या के स्थान पर वान्डर वाल त्रिज्या ज्ञात की जाती है।
→ वान्डर वाल त्रिज्या, परमाणु त्रिज्या से हमेशा अधिक होती है।
→ धनायन की त्रिज्या हमेशा संगत परमाणु की त्रिज्या से कम होती है जबकि ऋणायन की त्रिज्या संगत परमाणु की त्रिज्या से अधिक होती है।
→ समइलेक्ट्रॉनीय स्पीशीज में अधिक धनावेशित स्पीशीज की त्रिज्या न्यूनतम तथा अधिक ऋणावेशित स्पीशीज की त्रिज्या अधिकतम होती है।
→ आयनन एन्थैल्पी, इलेक्ट्रॉन लब्धि एन्थैल्पी तथा विद्युत-ऋणात्मकता में आवर्तिता की प्रवृत्ति पाई जाती है।
→ आयनन एन्थैल्पी-किसी तत्त्व की तलस्थ अवस्था में एक मोल विलगित गैसीय परमाणु में से बाह्यतम इलेक्ट्रॉन को पृथक् करने के लिए. आवश्यक ऊर्जा को आयनन एन्थैल्पी कहते हैं।
→ किसी तत्त्व की विभिन्न आयनन एन्थैल्पी (I.E.) मानों में क्रम निम्न प्रकार होता है
III I.E. > II I.E. > I I.E.
→ आवर्त सारणी में He की आयनन एन्थैल्पी अधिकतम तथा Cs की आयनन एन्थैल्पी न्यूनतम होती है।
→ आयनन एन्थैल्पी को प्रभावित करने वाले कारक निम्नलिखित हैं
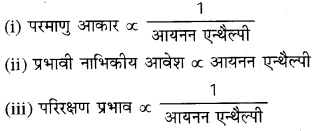
(iv) कक्षकों की भेदन क्षमता : आयनन एन्थैल्पी
(v) अर्धपूरित तथा पूर्णपूरित कक्षकों का स्थायित्व आयनन एन्थैल्पी
→ जिन धातुओं की आयनन एन्थैल्पी कम होती है उनकी क्रियाशीलता तथा धात्विक गुण अधिक होता है तथा वे अच्छे अपचायक भी होते हैं।
→ क्षार धातु +1 तथा क्षारीय मृदा धातु +2 ऑक्सीकरण अवस्था दर्शाते हैं।
→ हाइड्रॉक्साइडों तथा ऑक्साइडों का क्षारीय गुण वर्ग में बढ़ता है जबकि आवर्त कम होता है।
→ इलेक्ट्रॉन लब्धि एन्थैल्पी-किसी तत्त्व की तलस्थ अवस्था में एक मोल विलगित गैसीय परमाणु द्वारा इलेक्ट्रॉन ग्रहण कर ऋणायन में परिवर्तित होने पर उत्सर्जित ऊर्जा को इलेक्ट्रॉन लब्धि एन्थैल्पी कहते हैं।

→ इलेक्ट्रॉन लब्धि एन्थैल्पी को ऋणात्मक माना जाता है क्योंकि इलेक्ट्रॉन जुड़ने पर ऊर्जा का उत्सर्जन होता है लेकिन द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी धनात्मक होती है।
→ इलेक्ट्रॉन लब्धि एन्थैल्पी (EGE) को प्रभावित करने वाले कारक निम्नलिखित हैं
- परमाण्वीय आकार ∝ \(\frac{1}{\text { EGE }}\)
- प्रभावी नाभिकीय आवेश ∝ E.G.E.
- परिरक्षण प्रभाव ∝ \(\frac{1}{\text { EGE }}\)
- अर्धपूरित तथा पूर्णपूरित कक्षकों का स्थायित्व ∝ \(\frac{1}{\text { EGE }}\)
→ द्वितीय आवर्त के तत्त्वों की इलेक्ट्रॉन लब्धि एन्थैल्पी तृतीय आवर्त के तत्त्वों की इलेक्ट्रॉन लब्धि एन्थैल्पी से कम ऋणात्मक होती है।
→ आवर्त सारणी में क्लोरीन की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिकतम ऋणात्मक होती है।
→ उत्कृष्ट गैसों की इलेक्ट्रॉन लब्धि एन्थैल्पी मान अत्यधिक धनात्मक होता है क्योंकि इनमें इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति नहीं होती है।
→ नाइट्रोजन तथा फास्फोरस की इलेक्ट्रॉन लब्धि एन्थैल्पी क्रमशः कार्बन तथा सिलिकन की इलेक्ट्रॉन लब्धि एन्थैल्पी से कम ऋणात्मक होती है।
→ इलेक्ट्रॉन लब्धि एन्थैल्पी सामान्यतः आवर्त में अधिक ऋणात्मक तथा वर्ग में कम ऋणात्मक होती जाती है।
→ विद्युत ऋणात्मकता-किसी परमाणु की सहसंयोजी बंध के इलेक्ट्रॉन युग्म को अपनी ओर आकर्षित करने की प्रवृत्ति को विद्युत ऋणात्मकता कहते हैं।
→ आयनन एन्थैल्पी तथा विद्युत ऋणात्मकता प्रायः आवर्त में बढ़ती है तथा वर्ग में कम होती है।
→ विद्युत ऋणता (E.N.) को प्रभावित करने वाले कारक निम्नलिखित हैं
- परमाण्वीय आकार ∝ \(\frac{1}{\text { EGE }}\).
- प्रभावी नाभिकीय आवेश ∝ E.N.
- परिरक्षण प्रभाव ∝ \(\frac{1}{\text { EGE }}\)
- ऑक्सीकरण अंक ∝ E.N.
- संकरण में 5 गुण ∝ E.N.
→ विद्युत ऋणता किसी तत्त्व के अधातु गुण का माप होती है।
→ आवर्त सारणी में फ्लुओरीन (F) की विद्युत ऋणता अधिकतम होती है।
→ उत्कृष्ट गैसों की विद्युत ऋणता शून्य होती है।
→ विद्युत ऋणता के मापन हेतु भिन्न-भिन्न वैज्ञानिकों ने भिन्न-भिन्न मापक्रम दिए हैं, जैसे-मुलिकन मापक्रम, आलरेड-रोशो मापक्रम तथा पॉलिंग मापक्रम।
→ विद्युत ऋणता की सहायता से सहसंयोजी बन्ध की ध्रुवता, बन्ध सामर्थ्य तथा बन्ध लम्बाई इत्यादि ज्ञात की जाती है।
→ प्रतिनिधि तत्त्वों की संयोजकता, उस तत्त्व के बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संख्या या आठ में से इन इलेक्ट्रॉनों की संख्या घटाने से प्राप्त संख्या के बराबर होती है।
→ द्वितीय आवर्त में Li तथा Be के गुण Mg तथा AI से मिलते हैं, इसे विकर्ण सम्बन्ध कहते हैं।
→ आवर्त सारणी के दोनों छोरों पर स्थित तत्त्वों की क्रियाशीलता अधिक लेकिन बीच के तत्त्वों की क्रियाशीलता कम होती है।

- RBSE Class 11 Chemistry Important Questions Chapter 2 Structure of Atom
- RBSE Solutions for Class 11 Chemistry Chapter 14 Environmental Chemistry
- RBSE Solutions for Class 11 Chemistry Chapter 13 Hydrocarbons
- RBSE Solutions for Class 11 Chemistry Chapter 12 Organic Chemistry - Some Basic Principles and Techniques
- RBSE Solutions for Class 11 Chemistry Chapter 11 The p-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 10 The s-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 9 Hydrogen
- RBSE Solutions for Class 11 Chemistry Chapter 8 Redox Reactions
- RBSE Solutions for Class 11 Chemistry Chapter 7 Equilibrium
- RBSE Solutions for Class 11 Chemistry Chapter 6 Thermodynamics
- RBSE Solutions for Class 11 Chemistry Chapter 5 States of Matter