RBSE Class 11 Chemistry Notes Chapter 2 परमाणु की संरचना
These comprehensive RBSE Class 11 Chemistry Notes Chapter 2 परमाणु की संरचना will give a brief overview of all the concepts.
Rajasthan Board RBSE Solutions for Class 11 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 11. Students can also read RBSE Class 11 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 11 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 11 Chemistry Chapter 2 Notes परमाणु की संरचना
→ परमाणु किसी तत्व का वह छोटे से छोटा भाग जो रासायनिक अभिक्रिया में भाग लेता है, उसे परमाणु कहते हैं। यह पदार्थ का मूल कण होता है।
→ डाल्टन का परमाणु सिद्धान्त—परमाणु, पदार्थ के ऐसे सबसे छोटे कण होते हैं जिन्हें और अधिक विभाजित नहीं किया जा सकता है। इसके बाद प्रयोगों से ज्ञात हुआ कि परमाणु को छोटे कणों जैसे इलेक्ट्रॉन, प्रोटॉन तथा न्यूट्रॉन में विभाजित किया जा सकता है।
→ अवपरमाण्विक कण-परमाणु विभाज्य है जो तीन मूल कणों (इलेक्ट्रॉन, प्रोटॉन तथा न्यूट्रॉन) द्वारा बना होता है।
→ इलेक्ट्रॉन इलेक्ट्रॉन एक ऋणावेशित कण है जिसका द्रव्यमान 9.1 × 10-31 kg तथा आवेश 1.6 × 10-19 कूलाम होता है।
→ प्रोटॉन-प्रोटॉन एक धनावेशित कण है जो नाभिक में पाया जाता है तथा जिसका द्रव्यमान 1.672 × 10-27 kg एवं आवेश का मान इलेक्ट्रॉन के समान ही होता है।
→ न्यूट्रॉन-न्यूट्रॉन भी नाभिक में पाया जाता है जो कि उदासीन कण है तथा इसका द्रव्यमान 1.674 × 10-27 kg होता है।
→ थॉमसन का परमाणु मॉडल-परमाणु एक समान आवेशित गोला होता है, जिस पर धनावेश समान रूप से वितरित रहता है तथा इसके ऊपर इलेक्ट्रॉन इस प्रकार धंसे रहते हैं कि स्थायी स्थिर वैद्युत व्यवस्था प्राप्त हो जाती है। इसे प्लम पुडिंग, रेजिन पुडिंग या तरबूज मॉडल भी कहा जाता है।
→ रेडियोधर्मिता-रेडियोधर्मी पदार्थों से उच्च ऊर्जा युक्त विशिष्ट विकिरणों के स्वतः उत्सर्जन को रेडियोधर्मिता कहते हैं।
→ रदरफोर्ड का परमाणु मॉडल—(α-प्रकीर्णन प्रयोग)-परमाणु के केन्द्र में एक बहुत छोटे आकार का धनावेशित नाभिक होता है और इलेक्ट्रॉन इसके चारों ओर वृत्ताकार कक्षों में गति करते हैं।
→ परमाणु संख्या (Z)—परमाणु के नाभिक में उपस्थित प्रोटॉनों की संख्या को परमाणु संख्या कहते हैं।

→ द्रव्यमान संख्या (A)—परमाणु के नाभिक में स्थित प्रोटॉन तथा न्यूट्रॉन की संख्या के योग को द्रव्यमान संख्या कहते हैं।
n = A -Z
n = न्यूट्रॉनों की संख्या, A = द्रव्यमान संख्या तथा Z = परमाणु क्रमांक
→ समस्थानिक–एक ही तत्व के भिन्न-भिन्न परमाणु जिनकी द्रव्यमान संख्या भिन्न-भिन्न हो लेकिन परमाणु क्रमांक समान हों, उन्हें समस्थानिक कहते हैं। जैसे
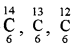
→ समभारिक भिन्न-भिन्न तत्वों के परमाणु जिनकी द्रव्यमान संख्या समान हो लेकिन उनके परमाणु क्रमांक भिन्न-भिन्न हों, उन्हें समभारिक कहते हैं। जैसे—14c तथा 14N
→ समन्यूट्रॉनिक-विभिन्न तत्त्वों के परमाणु जिनमें न्यूट्रॉनों की संख्या समान होती है उन्हें समन्यूट्रॉनिक या आइसोटॉन कहते हैं, जैसे 3014Si, 3115P, 3216S
→ विद्युत चुम्बकीय विकिरण-विद्युत आवेशित कणों को जब त्वरित किया जाता है, तो एकान्तर विद्युत एवं चुम्बकीय क्षेत्र उत्पन्न होते हैं, जो विद्युत एवं चुम्बकीय क्षेत्र तरंगों के रूप में संचरित होते हैं। इन्हें विद्युत चुम्बकीय विकिरण कहते हैं।
→ आवृत्ति (v)—किसी बिन्दु से प्रति सेकण्ड गुजरने वाली तरंगों की संख्या को आवृत्ति कहते हैं। इसका मात्रक हर्ट्स (Hz) या सेकण्ड 1 (s-1) होता है।
→ तरंगदैर्घ्य (λ)—किसी तरंग के दो निकटतम निम्निष्ठों (गों) या उच्चिष्ठों (शृंगों) के बीच की दूरी को तरंगदैर्ध्य कहते हैं । इसका मात्रक meter या cm या Å में होता है।
→ प्रकाश की गति (c)–निर्वात में सभी प्रकार के विद्युत चुम्बकीय विकिरण एक समान गति से चलते हैं, इसे प्रकाश की गति कहते हैं । इसका मान 3.0 × 108 ms-1 होता है।
c = vλ, v = आवृत्ति तथा λ = तरंगदैर्घ्य
→ तरंग संख्या (v̄):
प्रति इकाई लम्बाई में स्थित तरंगदैर्यों की संख्या को तरंग संख्या कहते हैं।
v̄ = \(\frac{1}{\lambda}\), v̄ का मात्रक m-1 या cm-1 होता है।
→ कृष्णिका विकिरण—ऐसा आदर्श पिण्ड जो सभी, प्रकार की आवृत्ति के विकिरणों को उत्सर्जित तथा अवशोषित करता है, उसको कृष्णिका कहते हैं तथा इस पिण्ड से उत्सर्जित विकिरणों को कृष्णिका विकिरण कहते हैं।
→ प्लांक का क्वांटम सिद्धान्त विद्युत चुम्बकीय विकिरण के रूप में ऊर्जा की जिस न्यूनतम मात्रा का उत्सर्जन या अवशोषण होता है, उसे क्वांटम कहते हैं तथा इसे प्लांक का क्वांटम सिद्धान्त कहते हैं। विकिरण के एक क्वांटम की ऊर्जा E = hy, यहाँ h = प्लांक स्थिरांक
= 6.626 × 10-34 Js तथा v = आवृत्ति
→ प्रकाश विद्युत प्रभाव-सक्रिय धातुओं जैसे K, Rb तथा Cs इत्यादि पर उपयुक्त आवृत्ति का प्रकाश डालने पर इनकी सतह में इलेक्ट्रॉनों का निष्कासन प्रकाश विद्युत प्रभाव कहलाता है तथा उत्सर्जित इलेक्ट्रॉनों को प्रकाश इलेक्ट्रॉन कहते हैं। निष्कासित इलेक्ट्रॉन की गतिज
ऊर्जा = hvo + \(\frac{1}{2}\) mev2

→ स्पेक्ट्रम-जब श्वेत प्रकाश को प्रिज्म से गुजारा जाता है तो यह रंगीन पट्टियों की एक श्रृंखला में फैल जाता है जिसे स्पेक्ट्रम कहते हैं। हाइड्रोजन में रेखीय स्पेक्ट्रम बनते हैं।
→ हाइड्रोजन स्पेक्ट्रम की विभिन्न श्रेणियों की रेखाओं की तरंग संख्या
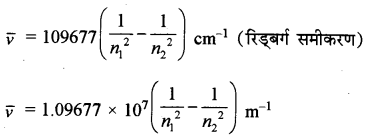
n1 = 1, 2, n2 = n1 + 1, n1 + 2 ....... (अर्थात् n2 > n1)
109677 = R = रिड्बर्ग स्थिरांक
→ हाइड्रोजन परमाणु की स्पेक्ट्रमी श्रेणियाँश्रेणी

→ हाइड्रोजन परमाणु के लिए बोर मॉडल
- हाइड्रोजन परमाणु में इलेक्ट्रॉन नाभिक के चारों ओर निश्चित त्रिज्या और निश्चित ऊर्जा वाले वृत्ताकार पथों में गति करता है, जिन्हें कक्ष या कोश या ऊर्जा स्तर कहते हैं।
गणितीय रूप—mv2 = \(\frac{\mathrm{Ze}^2}{\mathrm{r}}\) - इलेक्ट्रॉन का कोणीय संवेग mevr = \(\frac{n h}{2 \pi}\) (यहाँ n = 1, 2, 3)
- विभिन्न ऊर्जा स्तरों में ऊर्जा अन्तर ΔE = hv
v = \(\frac{\Delta E}{h}=\frac{E_2-E_1}{h}\) (बोर का आवृत्ति का नियम)
→ एक इलेक्ट्रॉन तंत्र (H, He+, Li2+ इत्यादि) के लिए बोर कक्ष की त्रिज्या
rn = \(\frac{n^2}{\mathrm{z}}\) × 0529Å, यहाँ n = कोश, z = परमाणु क्रमांक
या rn = \(\frac{n^2}{\mathrm{z}}\) × a0, (यहाँ a0 = 0.529 Å)
हाइड्रोजन के प्रथम कोश के लिए n = 1 z = 1 तो rn = a0
→ बोर कक्ष में इलेक्ट्रॉन का वेग
Vn = 2.188 × 108 \(\frac{z}{n}\) सेमी सेकण्ड'
→ बोर कक्ष में इलेक्ट्रॉन की ऊर्जा
E = -2.18 × 10-11\(\frac{z^2}{n^2}\) अर्ग प्रति परमाणु
या E = -2.18 × 10-18\(\frac{z^2}{n^2}\) जूल प्रति परमाणु
हाइड्रोजन के लिए En = RH\(\left(\frac{1}{n^2}\right)\). यहाँ n = 1, 2, 3.......... RH = रिडबर्ग स्थिरांक = 2.18 × 10-10 जूल
या En = -13.6 × \(\frac{z^2}{n^2}\)ev प्रति परमाणु ।
→ द्रव्य का द्वैत व्यवहार—द्रव्य में भी कण तथा तरंग दोनों के गुण होते हैं।
λ = \(\frac{h}{p}=\frac{h}{m \mathrm{v}}\) (दे ब्रॉग्ली सूत्र)
λ = तरंगदैर्घ्य
m = कण का द्रव्यमान
h = प्लांक स्थिरांक
v = वेग
p = संवेग
दे ब्रॉग्ली सूत्र केवल सूक्ष्म कणों के लिए ही लागू होता है।
→ कोणीय संवेग का क्वान्टीकरण-इलेक्ट्रॉन केवल उन्हीं वृत्ताकार कक्षों में गति करता है जिनकी परिधि, तरंगदैर्घ्य की बहु समाकल हो।
2πr = nλ

→ हाइजेनबर्ग का अनिश्चितता का सिद्धान्त-परमाणु में किसी इलेक्ट्रॉन की सही स्थिति और सही संवेग अथवा वेग का एक साथ यथार्थता के साथ निर्धारण करना असम्भव है।
- Δx × ΔP ≥ \(\frac{h}{4 \pi}\) = कण की स्थिति में अनिश्चितता तथा ΔP = संवेग में अनिश्चितता
- Δx × mΔv ≥ \(\frac{h}{4 \pi}\)
- Δx × Δv ≥ \(\frac{h}{4 \pi m}\)
→ क्वान्टम यांत्रिकी—द्रव्य के द्वैत व्यवहार को ध्यान में रखकर विकसित किए गए विज्ञान को क्वान्टम यांत्रिकी कहते हैं।
→ श्रोडिन्जर समीकरण
\(\frac{\delta^2 \psi}{\delta \mathrm{x}^2}+\frac{\delta^2 \psi}{\delta \mathrm{y}^2}+\frac{\delta \psi}{\delta \mathrm{z}^2}+\frac{8 \pi^2 \mathrm{~m}}{\mathrm{~h}^2}\)(E - v)Ψ = 0
यहाँ x, y तथा z कार्तिकेय निर्देशांक हैं।
h = प्लांक स्थिरांक, m = इलेक्ट्रॉन का द्रव्यमान,
E = इलेक्ट्रॉन की कुल ऊर्जा, V = इलेक्ट्रॉन की स्थितिज ऊर्जा
Ψ = तरंग फलन या इलेक्ट्रॉन तरंग का संभावित आयाम
→ क्वान्टम संख्याएँ वे संख्याएँ जो किसी परमाणु में इलेक्ट्रॉन की स्थिति, ऊर्जा, कक्षकों का आकार, आकृति, अभिविन्यास तथा चक्रण को दर्शाने के लिए आवश्यक होती हैं, उन्हें क्वान्टम संख्याएँ कहते हैं। ये क्रमशः मुख्य (n), दिगंशीय (l), चुम्बकीय (m) तथा चक्रण (ml) क्वान्टम संख्या होती हैं।
- मुख्य क्वान्टम संख्या (n) = 1, 2, 3, 4 (K, L, M, N)
- दिगंशीय क्वान्टम संख्या (l) = 0 से n-1
- चुम्बकीय क्वान्टम संख्या (ml) = - 1, - (l – 1), - (l – 2) ........ 0, 1, ..... (l – 2), (l – 1), l
- चक्रण क्वान्टम संख्या (ms) = +\(\frac{1}{2}\), तथा -\(\frac{1}{2}\)
→ कोश, उपकोश तथा कक्षक–कोश, मुख्य क्वान्टम संख्या से, उपकोश, दिगंशीय क्वान्टम संख्या से तथा कक्षक, चुम्बकीय क्वान्टम संख्या से दर्शाया जाता है।
- किसी कोश में उपकोशों की संख्या = n का मान = l के कुल मान
- किसी कोश में कक्षकों की संख्या = n2
- किसी कोश में इलेक्ट्रॉनों की संख्या = 2n2
- किसी उपकोश में कक्षकों की संख्या = 2l + 1 = m के कुल मान
- किसी उपकोश में इलेक्ट्रॉनों की संख्या = 2(2l + 1)
- किसी कक्षक में इलेक्ट्रॉनों की संख्या = 2
→ कक्ष तथा कक्षक-किसी परमाणु में नाभिक के चारों ओर वह काल्पनिक पथ जिसमें इलेक्ट्रॉन गति करता है उसे कक्ष कहते हैं जबकि किसी परमाणु में नाभिक के चारों ओर अन्तराल में वह क्षेत्र, जहाँ पर इलेक्ट्रॉन के पाए जाने की सम्भावना अधिकतम होती है उसे कक्षक कहते हैं।
→ s कक्षक एक, p कक्षक तीन (px, Py, तथा pz), d कक्षक पाँच (dxy, dyz, dzx dx-y2 तथा dz2) तथा f कक्षक सात होते हैं।
→ नोड-किसी कक्षक में वह क्षेत्र जहाँ पर इलेक्ट्रॉन प्रायिकता घनत्व शून्य होता है उसे नोड कहते हैं।
नोडों की कुल संख्या = n - 1, कोणीय नोड = l, त्रिज्य नोड = (n - l - 1)
→ विभिन्न परमाणु कक्षकों की आकृतियाँ
- s कक्षक–गोलाकार,
- d कक्षक-द्विडम्बल
- p कक्षक-डम्बलाकार,
- f कक्षक-जटिल

→ हाइड्रोजन में किसी कोश के सभी उपकोशों की ऊर्जा समान होती है जबकि अन्य तत्त्वों में किसी कोश के उपकोशों की ऊर्जा भिन्न-भिन्न होती है।
→ ऑफबाऊ सिद्धान्त —परमाणुओं की मूल अवस्था में कक्षकों को उनकी ऊर्जा के बढ़ते क्रम में भरा जाता है।
→ n+ 1 नियम-किसी कक्षक के लिए n + 1 का मान जितना कम होगा, उसकी ऊर्जा भी उतनी ही कम होगी तथा जब दो कक्षकों के लिए n + l का मान समान है तो उस कक्षक की ऊर्जा कम होगी, जिसके लिए n का मान कम है।
→ पाउली का अपवर्जन नियम—किसी परमाणु में उपस्थित दो इलेक्ट्रॉनों की चारों क्वान्टम संख्याएँ कभी भी समान नहीं होती हैं अथवा एक कक्षक में अधिकतम दो इलेक्ट्रॉन विपरीत चक्रण से भरे जाते हैं।
→ हुंड का अधिकतम बहुलकता का नियम–एक ही उपकोश के कक्षकों में इलेक्ट्रॉनों का युग्मन तब तक नहीं होता है, जब तक कि उस उपकोश के सभी कक्षकों में एक-एक इलेक्ट्रॉन समान चक्रण से न भरे जाएं।
→ अर्धपूरित तथा पूर्णपूरित उपकोशों का स्थायित्व तुलनात्मक रूप से अधिक होता है क्योंकि ये सममित होते हैं तथा इनकी विनिमय ऊर्जा अधिक होती है।
→ तत्त्वों का इलेक्ट्रॉनिक विन्यास-तत्त्वों का इलेक्ट्रॉनिक विन्यास ऑफबाऊ नियम के अनुसार लिखा जाता है।

- RBSE Class 11 Chemistry Important Questions Chapter 2 Structure of Atom
- RBSE Solutions for Class 11 Chemistry Chapter 14 Environmental Chemistry
- RBSE Solutions for Class 11 Chemistry Chapter 13 Hydrocarbons
- RBSE Solutions for Class 11 Chemistry Chapter 12 Organic Chemistry - Some Basic Principles and Techniques
- RBSE Solutions for Class 11 Chemistry Chapter 11 The p-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 10 The s-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 9 Hydrogen
- RBSE Solutions for Class 11 Chemistry Chapter 8 Redox Reactions
- RBSE Solutions for Class 11 Chemistry Chapter 7 Equilibrium
- RBSE Solutions for Class 11 Chemistry Chapter 6 Thermodynamics
- RBSE Solutions for Class 11 Chemistry Chapter 5 States of Matter