RBSE Class 11 Chemistry Important Questions Chapter 7 साम्यावस्था
Rajasthan Board RBSE Class 11 Chemistry Important Questions Chapter 7 साम्यावस्था Important Questions and Answers.
RBSE Class 11 Chemistry Chapter 7 Important Questions साम्यावस्था
बहुचयनात्मक प्रश्न (Multiple Choice Questions):
प्रश्न 1.
यदि अभिकारकों तथा उत्पादों की सान्द्रता दुगुनी कर दी जाए तो साम्य स्थिरांक K का मान निम्न में से किसके समान होगा?
(अ) 2Kc
(ब) Kc/2
(स) Kc2
(द) अपरिवर्तित
उत्तर:
(द) अपरिवर्तित

प्रश्न 2.
उत्क्रमणीय अभिक्रिया imm के लिए K, तथा K. में सम्बन्ध होगा:
(अ) Kp = Kc (RT)2
(ब) Kp = Kc
(स) Kc = Kp (RT)-2
(द) Kp = Kc (RT)-1
उत्तर:
(ब) Kp = Kc
प्रश्न 3.
अभिक्रिया 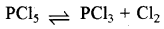 के साम्य में स्थिर दाब पर उत्कृष्ट गैस को मिलाने पर PCl5 का वियोजन होगा:
के साम्य में स्थिर दाब पर उत्कृष्ट गैस को मिलाने पर PCl5 का वियोजन होगा:
(अ) कम
(ब) अधिक
(स) अपरिवर्तित
(द) कुछ नहीं कह सकते
उत्तर:
(ब) अधिक
प्रश्न 4.
अभिक्रिया 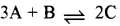 के लिए साम्य स्थिरांक (K) का व्यंजक होगा:
के लिए साम्य स्थिरांक (K) का व्यंजक होगा:

उत्तर:
\(\text { (ब) } \frac{[\mathrm{C}]^2}{[\mathrm{~A}]^3[\mathrm{~B}]}\)
प्रश्न 5.
निम्न में से कौनसे यौगिक जलीय विलयन की pH अधिकतम होगी:
(अ) NH4Cl
(ब) Na2CO3
(स) NaOH
(द) NaCl
उत्तर:
(स) NaOH
प्रश्न 6.
निम्न में से कौनसा युग्म समआयन प्रभाव दर्शाता है:
(अ) KCl + HCI
(ब) NaOH + KOH
(स) CH3COOH + CH3COONa
(द) HCl + H2SO4
उत्तर:
(स) CH3COOH + CH3COONa
प्रश्न 7.
50 mL N/10 NaOH तथा 10 mL 10/2 H2SO4 के मिश्रण की pH होगी:
(अ) 1
(ब) 5.
(स) 7
(द) 10
उत्तर:
(स) 7
प्रश्न 8.
सूत्र M2Y वाले एक अल्प विलेय लवण की विलेयता s है:
(Ksp = विलेयता गुणनफल स्थिरांक)

उत्तर:
\(\text { (ब) }\left(\frac{\mathrm{K}_{\mathrm{sp}}}{4}\right)^{\frac{1}{3}}\)
प्रश्न 9.
25°C पर जल में H+ की सान्द्रता होगी:
(अ) 10-7 M
(ब) 1 M
(स) 7 M
(द) 10-14 M
उत्तर:
(अ) 10-7 M

प्रश्न 10.
जल का आयनिक गुणनफल (K) बढ़ेगा:
(अ) ताप बढ़ाने पर
(ब) OH- की सान्द्रता बढ़ाने पर
(स) H+ की सान्द्रता बढ़ाने पर
(द) दाब कम करने पर
उत्तर:
(अ) ताप बढ़ाने पर
प्रश्न 11.
अभिक्रिया 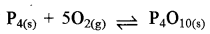 का साम्य स्थिरांक है:
का साम्य स्थिरांक है:
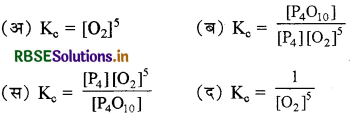
उत्तर:
\(\text { (द) } \mathrm{K}_{\mathrm{c}}=\frac{1}{\left[\mathrm{O}_2\right]^5}\)
प्रश्न 12.
किसी विद्युत अपघट्य का अवक्षेपण तब होगा जब उसका आयनिक गुणनफल:
(अ) विलेयता गुणनफल के बराबर हो
(ब) विलेयता गुणनफल से कम हो
(स) विलेयता गुणनफल से अधिक हो
(द) लगभग शून्य हो।
उत्तर:
(स) विलेयता गुणनफल से अधिक हो
प्रश्न 13.
दो लीटर क्षमता वाले फ्लास्क में 15g नाइट्रिक ऑक्साइड (NO) उपस्थित है तो इसका सक्रिय द्रव्यमान कितना होगा:
(अ) 1.00
(ब) 0.75
(स) 0.50
(द) 0.25
उत्तर:
(स) 0.50
प्रश्न 14.
NH2 का संयुग्मी अम्ल है:
(अ) NH4
(ब) N2H4
(स) NH3
(द) उपर्युक्त में से कोई नहीं
उत्तर:
(स) NH3
प्रश्न 15.
10-8 N HCl विलयन की pH होगी:
(अ) 6
(ब) 8
(स) लगभग 7
(द) 7 व 8 के मध्य
उत्तर:
(स) लगभग 7
प्रश्न 16.
निम्न में से दुर्बलतम क्षारक कौनसा है:
(अ) Cl
(ब) HCO3
(स) OH
(द) H
उत्तर:
(अ) Cl
प्रश्न 17.
CH3COOH तथा CH3COONa के मिश्रण के 2 लीटर विलय में 1 लीटर जल मिलाने पर pH पर क्या प्रभाव होगा?
(अ) कम होगी
(ब) बढ़ेगी
(स) अपरिवर्तित रहेगी
(द) उपर्युक्त में से कोई नहीं
उत्तर:
(स) अपरिवर्तित रहेगी
प्रश्न 18.
निम्न में से कौनसी स्पीशीज प्रोटोनदाता तथा प्रोटोनग्राही दोन कार्य कर सकती है:
(अ) CO32-
(ब) SO42-
(स) HSO4-
(द) H3O-
उत्तर:
(स) HSO4-
प्रश्न 19.
एक लीटर जल में उपस्थित H2O के अणुओं की संख्या कितन होगी?
(अ) 55.5 × 6.022 × 1023
(ब) 55.5 × 6.022 × 1016
(स) 55.5 x 10-7
(द) 55.5 × 10-4
उत्तर:
(अ) 55.5 × 6.022 × 1023
प्रश्न 20.
SnS2 के विलेयता गुणनफल को निम्न में से किस प्रकार दर्शा जाता है?
(अ) [Sn2+] [S2-]2
(ब) [Sn4+] [S-2]2
(स) [Sn4+] [2S2-]
(द) [Sn2+] [S2]
उत्तर:
(ब) [Sn4+] [S-2]2
प्रश्न 21.
अभिक्रिया H2 + I2 = 2HI का साम्य स्थिरांक परिवर्तित होगा:
(अ) H2 तथा I2 की सान्द्रता बढ़ाने पर
(ब) दाब बढ़ाने पर
(स) ताप बढ़ाने पर
(द) उत्प्रेरक मिलाने पर
उत्तर:
(स) ताप बढ़ाने पर
प्रश्न 22.
एक विलयन जिसकी pH = 5 है तो इसमें [ŌH] कित होगी?
(अ) 9
(ब) 5
(स) 10-9
(द) 10-5
उत्तर:
(स) 10-9
रिक्त स्थान वाले प्रश्न (Fill in the blanks):
प्रश्न 1.
साम्यावस्था पर अग्र तथा प्रतीप अभिक्रिया का वेग ................. हो जाता है।
उत्तर:
समान
प्रश्न 2.
जल के आयनन स्थिरांक का मान .................. होता है।
उत्तर:
1.8 × 10-16
प्रश्न 3.
उत्प्रेरक साम्यावस्था संगठन को प्रभावित ..................... करता है।
उत्तर:
नहीं
प्रश्न 4.
किसी संयुग्मी अम्ल क्षार के लिए Ka × Ko = ................. होता है।
उत्तर:
KW

प्रश्न 5.
CH3COOH तथा ....................... से बना मिश्रण अम्लीय बफर कहलाता है।
उत्तर:
CH3COONa
प्रश्न 6.
अम्लीय विलयन की pH 7 से .................. करता होती है।
उत्तर:
कम
प्रश्न 7.
दुर्बल अम्ल तथा दुर्बल क्षार से बने लवण की जल अपघटन की मात्रा इसके विलयन की ........................ पर निर्भर नहीं करती है।
उत्तर:
सान्द्रता
प्रश्न 8.
आयनिक लवणों में समआयन मिलाने पर उनकी विलेयता ...................... हो जाती है।
उत्तर:
कम
प्रश्न 9.
जल के आयनिक गुणनफल का मान ........................ होता है।
उत्तर:
1 x 10-14
प्रश्न 10.
साम्य हमेशा .................... होता है।
उत्तर:
गतिक
प्रश्न 11.
परक्लोरिक अम्ल एक ..................... है।
उत्तर:
प्रबल अम्ल
प्रश्न 12.
KCl, प्रबल अम्ल तथा .................... से बना लवण है।
उत्तर:
प्रबल क्षार
निम्नलिखित में से सत्य एवं असत्य कथन छाँटिए (True and False Statement):
प्रश्न 1.
NaCl के जलीय विलयन की pH 7 से अधिक होती है।
उत्तर:
असत्य
प्रश्न 2.
साम्यावस्था स्थिरांक ताप पर निर्भर करता है।
उत्तर:
सत्य

प्रश्न 3.
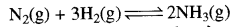 एक समांगी अभिक्रिया है।
एक समांगी अभिक्रिया है।
उत्तर:
सत्य
प्रश्न 4.
KC का मात्रक ( सान्द्रता ) 1 -" होता है।
उत्तर:
असत्य
प्रश्न 5.
मोलर सान्द्रता को सक्रिय द्रव्यमान भी कहते हैं।
उत्तर:
सत्य
प्रश्न 6.
अभिक्रिया 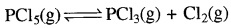 के लिए Kp >PCl5 (g) = K. होता है।
के लिए Kp >PCl5 (g) = K. होता है।
उत्तर:
सत्य
प्रश्न 7.
साम्यावस्था स्थिरांक का मान बहुत कम होने पर अभिक्रिया लगभग पूर्ण हो जाती है।
उत्तर:
असत्य
प्रश्न 8.
साम्यावस्था पर मुक्त ऊर्जा परिवर्तन (AG) का मान शून्य होता है।
उत्तर:
सत्य
प्रश्न 9.
अभिक्रिया भागफल (Q) हमेशा साम्यावस्था स्थिरांक (K) के बराबर होता है।
उत्तर:
असत्य
प्रश्न 10.
स्थिर दाब पर साम्य में अक्रिय गैस मिलाने पर अभिक्रिया उस दिशा में जाती है जिधर गैसीय पदार्थों की संख्या अधिक हो।
उत्तर:
सत्य।
मिलान करने वाले प्रश्न (Matching type Questions):
सूची A तथा सूची B का मिलान कीजिए तथा सही कूट (Code) का चयन कीजिए:
प्रश्न 1.
|
सूची A |
सूची B |
|
|
(a) H3O |
|
|
(b) Kp = Kc |
|
|
(c) K. की इकाई (सान्द्रता) |
|
(4) H2O का संयुग्मी अम्ल |
(d) विषमांगी साम्य |
उत्तर:
|
सूची A |
सूची B |
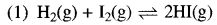 |
(b) Kp = Kc |
|
|
(c) K. की इकाई (सान्द्रता) |
|
|
(d) विषमांगी साम्य |
|
(4) H2O का संयुग्मी अम्ल |
(a) H3O |
प्रश्न 2.
|
सूची A |
सूची B |
|
(1) उभयप्रोटिक विलायक |
(a) CO32- |
|
(2) HCO3 का संयुग्मी क्षार |
(b) BF3 |
|
(3) CH3COOH |
(c) NH3 |
|
(4) लुइस अम्ल |
(d) एक दुर्बल अम्ल |
उत्तर:
|
सूची A |
सूची B |
|
(1) उभयप्रोटिक विलायक |
(c) NH3 |
|
(2) HCO3 का संयुग्मी क्षार |
(a) CO32- |
|
(3) CH3COOH |
(d) एक दुर्बल अम्ल |
|
(4) लुइस अम्ल |
(b) BF3 |

प्रश्न 3.
|
सूची A |
सूची B |
|
(1) CO2- |
(a) pH > 7 |
|
(2) पिरीडीन |
(b) लुइस अम्ल |
|
(3) जल की मोलर सान्द्रता |
(c) 55.5M |
|
(4) क्षारीय विलयन |
(d) लुइस क्षार |
उत्तर:
|
सूची A |
सूची B |
|
(1) CO2- |
(b) लुइस अम्ल |
|
(2) पिरीडीन |
(d) लुइस क्षार |
|
(3) जल की मोलर सान्द्रता |
(a) pH > 7 |
|
(4) क्षारीय विलयन |
(c) 55.5M |
प्रश्न 4.
|
सूची A |
सूची B |
|
(1) [H+] = [OH-] |
(a) उदासीन विलयन |
|
(2) pOH > pH |
(b) N = 2 x M |
|
(3) 1M HCl विलयन |
(c) अम्लीय विलयन |
|
(4) H2SO4 के लिए |
(d) pH = 0 |
उत्तर:
|
सूची A |
सूची B |
|
(1) [H+] = [OH-] |
(a) उदासीन विलयन |
|
(2) pOH > pH |
(c) अम्लीय विलयन |
|
(3) 1M HCl विलयन |
(d) pH = 0 |
|
(4) H2SO4 के लिए |
(b) N = 2 x M |
प्रश्न 5.
|
सूची A |
सूची B |
|
(1) Ba(OH)2 |
\(\text { (a) } \alpha \propto \sqrt{V}\) |
|
(2) दुर्बल अम्ल के लिए |
(b) अम्लता = 2 |
|
(3) ओस्टवाल्ड तनुता नियम |
(c) [H+] = \(\sqrt{C . K_a}\) |
|
(4) द्विक्षारकी अम्ल के लिए |
(d) Ka2 < Ka1 |
उत्तर:
|
सूची A |
सूची B |
|
(1) Ba(OH)2 |
(b) अम्लता = 2 |
|
(2) दुर्बल अम्ल के लिए |
(c) [H+] = \(\sqrt{C . K_a}\) |
|
(3) ओस्टवाल्ड तनुता नियम |
\(\text { (a) } \alpha \propto \sqrt{V}\) |
|
(4) द्विक्षारकी अम्ल के लिए |
(d) Ka2 < Ka1 |
प्रश्न 6.
|
सूची A |
सूची B |
|
(1) बोरिक अम्ल की क्षारकता |
(a) AH धनात्मक |
|
(2) प्रोटोन ग्राही पदार्थ |
(b) pH < 7 |
|
(3) ऊष्माशोषी अभिक्रिया |
(c) ब्रन्स्टेद-लौरी क्षारक |
|
(4) NH4Cl का जलीय विलयन |
(d) 1 |
उत्तर:
|
सूची A |
सूची B |
|
(1) बोरिक अम्ल की क्षारकता |
(d) 1 |
|
(2) प्रोटोन ग्राही पदार्थ |
(c) ब्रन्स्टेद-लौरी क्षारक |
|
(3) ऊष्माशोषी अभिक्रिया |
(a) AH धनात्मक |
|
(4) NH4Cl का जलीय विलयन |
(b) pH < 7 |
प्रश्न 7.
|
सूची A |
सूची B |
|
(1) CH3COONH4 का विलयन |
(a) दुर्बल अम्ल तथा दुर्बल क्षार से बना लवण |
|
(2) NH4Cl |
(b) pH = 7 |
|
(3) NH4OH + NH4Cl |
(c) Kh = KW/Kb |
|
(4) (NH4)2CO3 |
(d) क्षारीय बफर |
उत्तर:
|
सूची A |
सूची B |
|
(1) CH3COONH4 का विलयन |
(b) pH = 7 |
|
(2) NH4Cl |
(c) Kh = KW/Kb |
|
(3) NH4OH + NH4Cl |
(d) क्षारीय बफर |
|
(4) (NH4)2CO3 |
(a) दुर्बल अम्ल तथा दुर्बल क्षार से बना लवण |

प्रश्न 8.
|
सूची A |
सूची B |
|
(1) CH3COOK |
(a) 1 = \(\sqrt{\mathrm{Kh}}\) |
|
(2) CH3COONH4 |
(b) kp = s |
|
(3) अम्लीय बफर की pH परास |
(c) Kh = Kw/Ka |
|
(4) BaSO4 के लिए |
(d) PKa ± 1 |
उत्तर:
|
सूची A |
सूची B |
|
(1) CH3COOK |
(c) Kh = Kw/Ka |
|
(2) CH3COONH4 |
(a) 1 = \(\sqrt{\mathrm{Kh}}\) |
|
(3) अम्लीय बफर की pH परास |
(d) PKa ± 1 |
|
(4) BaSO4 के लिए |
(b) kp = s |
प्रश्न 9.
|
सूची A |
सूची B |
|
(1) अवक्षेपण की शर्त |
(a) जल अपघटित नहीं होता |
|
(2) क्षारीय मूलकों का II समूह |
(b) pH = PKa + |
|
(3) हैण्डरसन समीकरण |
(c) Ksp < Qsp |
|
(4) NaCl |
(d) अम्लीय माध्यम |
उत्तर:
|
सूची A |
सूची B |
|
(1) अवक्षेपण की शर्त |
(c) Ksp < Qsp |
|
(2) क्षारीय मूलकों का II समूह |
(d) अम्लीय माध्यम |
|
(3) हैण्डरसन समीकरण |
(a) जल अपघटित नहीं होता |
|
(4) NaCl |
(b) pH = PKa +  |
प्रश्न 10.
|
सूची A |
सूची B |
|
(1) CuSO4 का विलयन |
(a) 14 |
|
(2) SNS2 |
(b) pH < 7 |
|
(3) Kp तथा Kc में सम्बन्ध |
(c) Ksp = 4s3 |
|
(4) PKa + PKb |
(d) Kp = Kc(RT) |
उत्तर:
|
सूची A |
सूची B |
|
(1) CuSO4 का विलयन |
(b) pH < 7 |
|
(2) SNS2 |
(c) Ksp = 4s3 |
|
(3) Kp तथा Kc में सम्बन्ध |
(a) 14 |
|
(4) PKa + PKb |
(d) Kp = Kc(RT) |
अतिलघूत्तरात्मक प्रश्न (Very Short Answer Type Questions):
प्रश्न 1.
अभिक्रिया NH4Cl(s) = NH3(g) + HCl(g) के लिए साम्य स्थिरांक K का व्यंजक बताइए।
उत्तर:
Kc = [NH3] [HCl]
प्रश्न 2.
मानक गलनांक किसे कहते हैं?
उत्तर:
वायुमण्डलीय दाब पर किसी शुद्ध पदार्थ (ठोस) के लिए वह ताप जिस पर ठोस एवं द्रव प्रावस्थाएँ साम्यावस्था में होती हैं उसे पदार्थ का मानक गलनांक या मानक हिमांक कहते हैं।

प्रश्न 3.
अभिक्रिया A + 2B = 2C में यदि A तथा B की सान्द्रता दुगुनी कर दें तो अग्र अभिक्रिया का वेग कितने गुना बढ़ेगा?
उत्तर:
वेग = K [A][B]2
जब A व B की सान्द्रता दुगुनी करते हैं तो
= K [2A] [2B]2 या
वेग = 8K[A][B]
अतः अभिक्रिया का वेग 8 गुना हो जाता है।
प्रश्न 4.
निम्न विषमांगी रासायनिक साम्य के लिए Kc तथा Kp लिखिए:
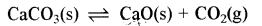
उत्तर:
Kc = [CO2 (g)]
Kp = PCO2
प्रश्न 5.
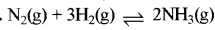 के लिए साम्य स्थिरांक kc = 9 है तो अभिक्रिया
के लिए साम्य स्थिरांक kc = 9 है तो अभिक्रिया 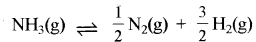 लिए साम्य स्थिरांक K. का मान क्या होगा?
लिए साम्य स्थिरांक K. का मान क्या होगा?
उत्तर:
\(\mathrm{K}_{\mathrm{c}}{ }^1=\frac{1}{\sqrt{\mathrm{K}_{\mathrm{c}}}}=\frac{1}{\sqrt{9}}=\frac{1}{3}\)
प्रश्न 6.
निम्नलिखित अभिक्रिया के लिए Kc तथा Kp में सम्बन्ध बताइए:
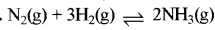
उत्तर:
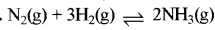 के लिए ∆n = -2
के लिए ∆n = -2
अतः
Kp = K (RT)4n
Kp = K (RT)-2
प्रश्न 7.
अभिक्रिया 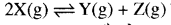 के लिए साम्य पर [X] = 2M, [Z] = 8M तथा K = 1 है तो [Y] का मान कितना होगा?
के लिए साम्य पर [X] = 2M, [Z] = 8M तथा K = 1 है तो [Y] का मान कितना होगा?
उत्तर:
\(\begin{aligned} \mathrm{K}_{\mathrm{c}} & =\frac{[\mathrm{Y}][\mathrm{Z}]}{[\mathrm{X}]^2} \\ 1 & =\frac{[\mathrm{Y}][8]}{[2]^2} \end{aligned}\)
अतः
[Y] = 4/8 = 0.5
प्रश्न 8.
NH3 के निर्माण में यदि 100 ml N2 क्रिया करती है तो कितने ml H2 क्रिया करेगी?
उत्तर:
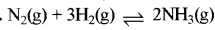 के अनुसार 100 ml N2 के क्रिया करने पर 300 ml H2 क्रिया करेगी।
के अनुसार 100 ml N2 के क्रिया करने पर 300 ml H2 क्रिया करेगी।
प्रश्न 9.
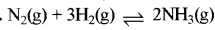 में दाब बढ़ाने पर क्या होगा?
में दाब बढ़ाने पर क्या होगा?
उत्तर:
दाब बढ़ाने पर NH3(g) अधिक बनेगी।
प्रश्न 10.
निम्न में से कौनसे लुइस अम्ल नहीं हैं?
BF3, NH3, H2O, AlCl3
उत्तर:
NH3 तथा H2O

प्रश्न 11.
दाब से प्रभावित नहीं होने वाली उत्क्रमणीय अभिक्रिया लिखिए।
उत्तर:
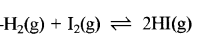
प्रश्न 12.
C2H5OH लुइस अम्ल है या लुइस क्षार तथा क्यों?
उत्तर:
C2H5OH एक लुइस क्षार है क्योंकि C2H5OH में ऑक्सीजन पर दो एकाकी इलेक्ट्रॉन उपस्थित हैं अतः यह इलेक्ट्रॉन युग्म दाता होता है।
प्रश्न 13.
आयनिक साम्य किसे कहते हैं?
उत्तर:
वह साम्य जिसके जलीय विलयन में आयन उपस्थित होते हैं, उसे आयनिक साम्य कहते हैं।
प्रश्न 14.
विद्युत अपघट्य के विलयन में विद्युत धारा का चालन किसके द्वारा होता है?
उत्तर:
आयनों के अभिगमन द्वारा।
प्रश्न 15.
ताप बढ़ाने पर शुद्ध जल की pH पर क्या प्रभाव होगा?
उत्तर:
ताप बढ़ाने पर जल का आयनन बढ़ता है अतः [H] बढ़ेगी अतः pH का मान कम होगा।
प्रश्न 16.
किसी ऊष्माक्षेपी अभिक्रिया में ताप बढ़ाने पर साम्य स्थिरांक पर क्या प्रभाव होगा?
उत्तर:
ऊष्माक्षेपी अभिक्रिया में ताप बढ़ाने पर पश्च अभिक्रिया का वेग बढ़ेगा अतः साम्यं स्थिरांक (K) का मान कम होगा।
प्रश्न 17.
वास्तविक तथा आभासी विद्युत अपघट्यों के एक-एक उदाहरण लिखिये।
उत्तर:
KCl वास्तविक विद्युत अपघट्य है जबकि HCl एक आभासी विद्युत अपघट्य है।
प्रश्न 18.
H2PO4 तथा HCN के संयुग्मी क्षार लिखिए।
उत्तर:
H2PO4- तथा CN
प्रश्न 19.
दो अम्ल HA तथा HB के KA मान क्रमश: 10 + तथा 10 है तो इनमें से किस अम्ल से बना संयुग्मी क्षार प्रबल होगा?
उत्तर:
HB क्योंकि HBr का K मान कम है अत: यह दुर्बल अम्ल है अतः इसका संयुग्मी क्षार प्रबल होगा।

प्रश्न 20.
निम्न में से कौनसी स्पीशीज प्रबलतम प्रोटॉन ग्राही होगी? HPO42- H2PO4- तथा PO43-
उत्तर:
PO43-
प्रश्न 21.
निम्न में से किसमें प्रोटॉन देने की प्रवृत्ति अधिकतम होगी?
NH3, OH, HSO4- तथा H3O+
उत्तर:
H3O+
प्रश्न 22.
अप्रोटिक विलायकों के दो उदाहरण बताइए।
उत्तर:
बेन्जीन (C6H6) तथा क्लोरोफॉर्म (CHCl3)।
प्रश्न 23.
निम्न में से प्रबलतम लुइस अम्ल कौनसा है?
Li+, Na+, K+, Rb+
उत्तर:
Li+ क्योंकि इसके छोटे आकार के कारण इसकी इलेक्ट्रॉन युग्म को आकर्षित करने की प्रवृत्ति अधिक होती है।
प्रश्न 24.
निम्न में से लुइस अम्ल तथा लुइस क्षार छाँटिए:
H2O, BCl3, FeCl3, C2H5OH, PCl5
उत्तर:
लुइस अम्ल BCl3, FeCl3, PCl5 लुइस क्षार H2O, C2H5OH
प्रश्न 25.
ताप बढ़ाने पर K के मान पर क्या प्रभाव होता है?
उत्तर:
ताप बढ़ाने पर जल का आयनन बढ़ता है अत: Kw का मान बढ़ता है।
प्रश्न 26.
1 M NaOH विलयन की pH तथा POH बताइए।
उत्तर:
1M NaOH विलयन की POH = 0 तथा pH = 14
प्रश्न 27.
सिल्वर क्रोमेट (Ag2CrO4) के लिए विलेयता गुणनफल का व्यंजक क्या होगा?
उत्तर:
विलेयता गुणनफल (Ksp) = [Ag+]2 [CrO2]
प्रश्न 28.
Na2CO3 का जलीय विलयन कैसा होता है?
उत्तर:
Na2CO3 दुर्बल अम्ल (H2CO3) तथा (NaOH) प्रबल क्षार का लवण है अतः इसका जलीय विलयन क्षारीय होता है।
प्रश्न 29.
विलयन में HCl की उपस्थिति से H2S के आयनन पर क्या प्रभाव होगा?
उत्तर:
H2S दुर्बल अम्ल है, अत: HCl ( प्रबल अम्ल) की उपस्थिति में समआयन प्रभाव के कारण H2S का आयनन कम हो जाता है।
प्रश्न 30.
KCN के लिए Kw, K तथा Ka में सम्बन्ध लिखिए।
उत्तर:
\(-\mathrm{K}_{\mathrm{h}}=\frac{\mathrm{K}_{\mathrm{w}}}{\mathrm{K}_{\mathrm{a}}}\)
(दुर्बल अम्ल तथा प्रबल क्षार से बना लवण)।
लघूत्तरात्मक प्रश्न (Short Answer Type Questions):
प्रश्न 1.
ठोस - द्रव साम्यावस्था की व्याख्या कीजिए।
उत्तर:
बर्फ का जल में बदलना ठोस द्रव साम्यावस्था का एक उदाहरण है।
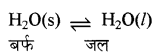
इसमें बन्द पात्र (थर्मस फ्लास्क) में 273 K ताप तथा एक वायुमण्डलीय दाब पर बर्फ व जल साम्यावस्था में होते हैं। 273 K बर्फ का गलनांक तथा जल का हिमांक है। साम्य पर समय के साथ-साथ बर्फ व जल के द्रव्यमान में कोई परिवर्तन नहीं होता है। क्योंकि बर्फ से जल बनने की दर तथा जल से बर्फ के बनने की दर समान होती है।

प्रश्न 2.
संतृप्त विलयन किसे कहते हैं? इस विलयन में किन अवस्थाओं के मध्य साम्य होता है?
उत्तर:
संतृप्त विलयन: किसी निश्चित ताप पर किसी विलयन में यदि और अधिक विलेय न घुल सके, तो इस विलयन को संतृप्त विलयन कहते हैं। संतृप्त विलयन में ठोस अवस्था एवं विलेय के विलयन में उपस्थित कणों के मध्य गतिक साम्य होता है।
उदाहरण: शर्करा ( विलयन) शर्करा (ठोस)
तथा साम्यावस्था पर:
शर्करा के घुलने की दर = शर्करा के क्रिस्टलन की दर।
प्रश्न 3.
हेनरी के नियम को समझाइए।
उत्तर:
हेनरी का नियम निश्चित ताप पर विलायक की दी गई मात्रा में, घुली हुई गैस की मात्रा, विलायक के ऊपर गैस के दाब के समानुपाती होती है। ताप के बढ़ने पर यह मात्रा कम होती जाती है।
अर्थात् m α p
m = kp
यहाँ m = घुली हुई गैस की मात्रा,
k = हेनरी नियतांक
तथा p = गैस का दाब
प्रश्न 4.
किसी भौतिक प्रक्रम में साम्यावस्था के सामान्य अभिलक्षण लिखिए।
उत्तर:
किसी भौतिक प्रक्रम में साम्यावस्था के निम्न अभिलक्षण होते हैं:
- निश्चित ताप पर केवल बंद निकाय में ही साम्यावस्था स्थापित होती है।
- साम्यावस्था पर दोनों विपरीत अभिक्रियाएँ समान वेग से होती हैं। इनमें गतिक, किंतु स्थायी अवस्था होती है।
- निकाय के सभी मापने योग्य गुण-धर्म स्थिर होते हैं। जब किसी भौतिक प्रक्रम में साम्यावस्था स्थापित हो जाती है तो गलनांक, वाष्प दाब आदि का स्थिर होना साम्यावस्था की पहचान होती है।
- किसी समय पर विभिन्न राशियों का मान यह दर्शाता है कि साम्यावस्था तक पहुँचने से पहले प्रक्रम किस सीमा तक आगे बढ़ा है।
प्रश्न 5.
साम्य स्थिरांक के महत्वपूर्ण लक्षण बताइए।
उत्तर:
साम्यावस्था स्थिरांक के महत्वपूर्ण लक्षण निम्न हैं:
- साम्यावस्थां स्थिरांक का व्यंजक तभी उपयोगी होगा, जब अभिकारकों तथा उत्पादों की सांद्रता, साम्यावस्था पर स्थिर हो जाए।
- साम्यावस्था-स्थिरांक का मान अभिकारकों एवं उत्पादों की प्रारंभिक सांद्रता पर निर्भर नहीं करता है।
- प्रतीप अभिक्रिया का साम्यावस्था - स्थिरांक अग्र अभिक्रिया के साम्यावस्था-स्थिरांक का व्युत्क्रम होता है।
- किसी अभिक्रिया का साम्यावस्था - स्थिरांक (K) उस संगत अभिक्रिया के साम्यावस्था स्थिरांक से संबंधित होता है जिसका समीकरण मूल अभिक्रिया के समीकरण में किसी छोटे पूर्णांक से गुणा या भाग देने पर प्राप्त होता है।
- साम्य स्थिरांक का मान एक संतुलित समीकरण द्वारा व्यक्त किसी रासायनिक अभिक्रिया के लिए निश्चित होता है अर्थात् यह अभिक्रिया की रससमीकरणमिति तथा अभिकारकों व उत्पादों की प्रकृति पर निर्भर करता है।
- किसी अभिक्रिया के लिए साम्य स्थिरांक का मान निश्चित ताप पर स्थिर होता है अर्थात् यह ताप पर निर्भर करता है।
प्रश्न 6.
(a) वियोजन तथा आयनन में क्या अन्तर है?
(b) विलायक के परावैद्युतांक तथा आयनों के मध्य स्थिर वैद्युत आकर्षण बल में क्या सम्बन्ध है?
उत्तर:
(a) वियोजन: वह विलेय जिसमें ठोस अवस्था में भी साम्यावस्था आयन उपस्थित होते हैं, को जल में घोलने पर इसके आयनों का पृथक् होना, वियोजन कहलाता है।
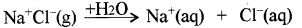
आयनन: वह प्रक्रिया जिसमें उदासीन अणु जिसमें प्रारम्भ में आयन नहीं है, को जल में घोलने पर वह टूटकर आवेशित आयनों में विभक्त हो जाता है, उसे आयनन कहते हैं।
उदाहरण:
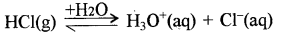
आजकल वियोजन तथा आयनन पदों में कोई अन्तर नहीं माना जाता है।
(b) दो विपरीत आवेशित आयनों के मध्य स्थिर विद्युत आकर्षण बल, माध्यम (विलायक) के परावैद्युतांक के व्युत्क्रमानुपाती होता है अर्थात् जिस विलायक का परावैद्युतांक अधिक होता है वह आयनिक यौगिकों के लिए अच्छा विलायक होता है। जल एक सार्वत्रिक विलायक है जिसका परावैद्युतांक उच्च (80) होता है।
प्रश्न 7.
अम्ल तथा क्षारक की आरेनियस की धारणा को उदाहरण सहित समझाइए।
उत्तर:
आरेनियस के अनुसार अम्ल वे पदार्थ हैं जो जल में वियोजित होकर HP (aq) देते हैं तथा क्षारक वे पदार्थ हैं जो वियोजित होकर ÖH(aq) देते हैं।
उदाहरण:
अम्ल:
HCl(aq) + H2O(l) → H3O(aq) + Cl-(aq)
जलीय विलयन में H+ स्वतन्त्र न रहकर हाइड्रोनियम आयन (H3O+) के रूप में पाया जाता है।
क्षारक:
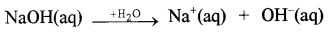
प्रश्न 8.
किसी उत्क्रमणीय अभिक्रिया की साम्यावस्था पर दाब के प्रभाव की व्याख्या कीजिए।
उत्तर:
दाब का प्रभाव केवल गैसीय अभिक्रियाओं पर ही लागू होता है।
(i) गैसीय अभिक्रियाएँ जिनमें ∆ng = 0 है उनमें दाब परिवर्तन का कोई प्रभाव नहीं होता क्योंकि अभिक्रिया के दोनों पक्षों में दाब समान रहता है। जैसे:
H2(g) + I2(g) → 2HI(g)
(ii) वे गैसीय अभिक्रियाएँ जिनमें ∆n = +ve या -ve है अर्थात् समीकरण में अभिकारक तथा उत्पादों के मोलों में भिन्नता है तो उनमें दाब बढ़ाने पर अभिक्रिया उस दिशा में जाती है जिधर गैसीय मोलों की संख्या कम हो।
(a) ∆n = -ve
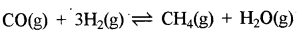
∆n = 2 - 4 = 2
इस अभिक्रिया में दाब बढ़ाने पर अभिक्रिया अग्र दिशा में जाएगी।
(b) ∆n = +ve
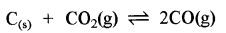
∆n = (2 - 1) = +1
इसमें दाब बढ़ाने पर पश्च अभिक्रिया का वेग बढ़ेगा क्योंकि अभिकारकों के मोलों की संख्या उत्पादों के मोलों की संख्या से कम है।
प्रश्न 9.
साम्यावस्था पर उत्प्रेरक मिलाने पर क्या प्रभाव होता है? समझाइए।
उत्तर:
साम्यावस्था पर उत्प्रेरक मिलाने पर कोई प्रभाव नहीं होता है क्योंकि उत्प्रेरक अग्र तथा प्रतीप दोनों अभिक्रियाओं के वेग को समान रूप से बढ़ाता है। यह अग्र तथा प्रतीप अभिक्रिया की सक्रियण ऊर्जा को समान मात्रा में कम करता है।

प्रश्न 10.
अम्ल तथा क्षारक की लुइस धारणा क्या है? यह ब्रान्स्टेद - लौरी धारणा से किस प्रकार भिन्न है? समझाइए।
उत्तर:
लूइस के अनुसार इलेक्ट्रॉन युग्म ग्रहण करने वाले पदार्थ अम्ल तथा इलेक्ट्रॉन युग्म दान करने वाले पदार्थ क्षार कहलाते हैं। इस प्रकार क्षारक की परिभाषा ब्रान्स्टेद - लौरी तथा लूइस के अनुसार समान है क्योंकि दोनों ही सिद्धान्तों में क्षारक एकाकी इलेक्ट्रॉन युग्म देता है। अतः लुइस के अनुसार प्रोटॉन रहित पदार्थ भी अम्ल होते हैं। सामान्यतया लूइस अम्ल तथा क्षारक के मध्य उप-सहसंयोजक बन्ध बनता है।
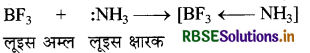
प्रश्न 11.
अम्ल क्षार सूचक के उदाहरण तथा उपयोग बताइए।
उत्तर:
फिनाफ्थैलीन, ब्रोमोथाइमोल ब्लू अम्ल क्षार सूचक इनसे अम्ल क्षार अनुमापन में अन्तिम बिन्दु ज्ञात की जाती है।
जैसे - फिनाफ्थैलीन अम्लीय माध्यम में रंगहीन तथा क्षारीय माध्यम में गुलाबी रंग देता है।

प्रश्न 12.
दुर्बल अम्ल की pH ज्ञात करने के लिए आवश्यक समीकरण की व्युत्पत्ति कीजिए।
उत्तर:
किसी दुर्बल अम्ल का आंशिक आयनन निम्न प्रकार होता है:
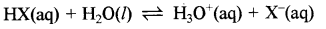
अम्ल वियोजन स्थिरांक (Ka) = \(\frac{\left[\mathrm{H}^{+}\right]\left[\mathrm{X}^{-}\right]}{[\mathrm{HX}]}\)
\(\begin{gathered} \mathrm{K}_{\mathrm{a}}=\frac{(\mathrm{c} \alpha)(\mathrm{c} \alpha)}{(\mathrm{c}-\mathrm{c} \alpha)} \\ \mathrm{K}_{\mathrm{a}}=\frac{\mathrm{c} \alpha^2}{1-\alpha} \end{gathered}\)
pH = - log [H+]
pH ज्ञात करने के लिए [H+ ] = ca
\(\begin{aligned} & {\left[\mathrm{H}^{+}\right]=\mathrm{c} \sqrt{\frac{\mathrm{K}_{\mathrm{a}}}{\mathrm{c}}}} \\ & {\left[\mathrm{H}^{+}\right]=\sqrt{\mathrm{c. \textrm {K } _ { \mathrm { a } }}}} \end{aligned}\)
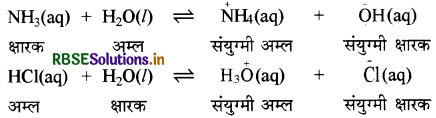
प्रश्न 13.
जल की उभयधर्मी प्रकृति को प्रदर्शित करने वाली रासायनिक अभिक्रियाओं के समीकरण लिखिए।
उत्तर:
निम्न अभिक्रियाओं द्वारा जल की उभयधर्मी प्रकृति की व्याख्या की जा सकती है:
प्रश्न 14.
बफर विलयन किसे कहते हैं? यह कितने प्रकार का होता है?
उत्तर:
बफर विलयन: वह विलयन, जिनका pH, तनु करने अथवा अम्ल या क्षारक की कुछ मात्रा मिलाने के बाद भी अपरिवर्तित रहता है, उसे बफर विलयन कहते हैं। अतः बफर विलयन, pH में परिवर्तन का प्रतिरोध करता है। इस क्रिया को बफर क्रिया कहते हैं।
बफर विलयन दो प्रकार के होते हैं: मिश्रित बफर विलयन तथा सरल बफर विलयन
(i) मिश्रित बफर भी दो प्रकार के होते हैं:
(a) अम्लीय बफर
(b) क्षारीय बफर।
(a) अम्लीय बफर: किसी दुर्बल अम्ल तथा इसकी किसी प्रबल क्षार से क्रिया द्वारा बने लवण का मिश्रण, अम्लीय बफर कहलाता है,
उदाहरण: CH3COOH तथा CH3COONa का मिश्रण
(b) क्षारीय बफर: किसी दुर्बल क्षार तथा इसकी प्रबल अम्ल से क्रिया द्वारा बने लवण का मिश्रण क्षारीय बफर कहलाता है।
उदाहरण: NH4OH तथा NH4Cl का मिश्रण
(ii) सरल बफर: दुर्बल अम्ल तथा दुर्बल क्षार से बने लवण का विलयन सरल बफर कहलाता है।
उदाहरण: CH3COONH4
प्रश्न 15.
दुर्बल अम्ल तथा प्रबल क्षार से बने लवण के विलयन, के लिए Kh, Kw व Ka में सम्बन्ध, जल अपघटन की मात्रा तथा विलयन की pH ज्ञात करने का सूत्र दीजिए।
उत्तर:
दुर्बल अम्ल तथा प्रबल क्षार से बने लवण का उदाहरण CH COONa है। इसके विलयन में ऐसीटेट आयन जल के साथ जल अपघटित होकर ऐसीटिक अम्ल तथा OH- आयनों का निर्माण करते हैं। अतः इसे ऋणायन जल अपघटन कहते हैं।
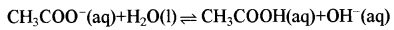
OH आयनों के कारण यह विलयन क्षारीय होता है तथा इस विलयन की pH7 से अधिक होती है।
इस जल अपघटन के लिए:
\(\mathrm{K}_{\mathrm{h}}=\frac{\mathrm{K}_{\mathrm{w}}}{\mathrm{K}_{\mathrm{a}}}\)
Kw = जल का आयनिक गुणनफल
Kn = जल अपघटन स्थिरांक
Ka = अम्ल वियोजन स्थिरांक
(ii) जल अपघटन की मात्रा
\(\mathrm{h}=\sqrt{\frac{\mathrm{K}_{\mathrm{h}}}{\mathrm{c}}}\) \(\mathrm{h}=\sqrt{\frac{\mathrm{K}_{\mathrm{w}}}{\mathrm{K}_{\mathrm{a} \times \mathrm{c}}}}\)
(iii) विलयन की pH:
pH = 1/2(pKw + pKg + log c)
प्रश्न 16.
क्षारीय मूलकों के II समूह में H2S गैस प्रवाहित करने से पहले तनु HCl क्यों मिलाया जाता है?
उत्तर:
क्षारीय मूलकों के II समूह में तनु HCl मिलाने पर समआयन प्रभाव होता है जिसके कारण H2S का आयनन कम हो जाता है जिससे प्राप्त S-2 की सान्द्रता इतनी कम होती है कि केवल II समूह के ही अवक्षेपित हो पाते हैं अन्यथा II समूह के साथ IV समूह के मूलक भी अवक्षेपित हो जाएंगे यदि उपस्थित हों।
आंकिक प्रश्न (Numerical Questions):
प्रश्न 1.
अभिक्रिया N2 (g) + 3H2(g) → 2NH3 (g) के लिए 673 K ताप पर K का मान 0.75 है तो इसके लिए K का मान ज्ञात कीजिए। ( K = 0.082 L atm Degree-1 mol-1)
उत्तर:
हम जानते हैं कि K = K (RT) ∆n
अतः
Kp = 0.75 × (0.082 × 673)-2
\(\begin{aligned} & \mathrm{K}_{\mathrm{p}}=\frac{0.75}{(0.082 \times 673)^2} \\ & \mathrm{~K}_{\mathrm{p}}=\frac{0.75}{(55.186)^2}=\frac{0.75}{3045.49} \end{aligned}\)
Kp = 2.46 × 104

प्रश्न 2.
523 K ताप पर निम्नलिखित अभिक्रिया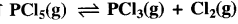 के लिए Kp का मान 2.35 atm है तो इसके लिए K के मान की गणना कीजिए। (R = 0.082 Latm Degree", mol-1)
के लिए Kp का मान 2.35 atm है तो इसके लिए K के मान की गणना कीजिए। (R = 0.082 Latm Degree", mol-1)
उत्तर:
Kp = K (RT)∆n
∆n = (1 + 1) -1 = 1
\(\mathrm{K}_{\mathrm{c}}=\frac{\mathrm{K}_{\mathrm{p}}}{(\mathrm{RT})^{\Delta \mathrm{n}}}=\frac{2.35}{(0.082 \times 523)^1}\)
\(\mathrm{K}_{\mathrm{c}}=\frac{2.35}{42.88}\)
= 5.48 x 10-2
प्रश्न 3.
अभिक्रिया 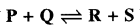 में P की प्रारम्भिक सान्द्रता Q की प्रारम्भिक सान्द्रता की दुगुनी है । साम्य पर R की सान्द्रता Q की सान्द्रता से तीन गुना पायी गयी तो इस अभिक्रिया के लिए साम्य स्थिरांक की गणना कीजिए ।
में P की प्रारम्भिक सान्द्रता Q की प्रारम्भिक सान्द्रता की दुगुनी है । साम्य पर R की सान्द्रता Q की सान्द्रता से तीन गुना पायी गयी तो इस अभिक्रिया के लिए साम्य स्थिरांक की गणना कीजिए ।
उत्तर:
माना P की प्रारम्भिक सान्द्रता = 2M
तो 0 की प्रारम्भिक सान्द्रता = 1M
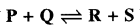
प्रारम्भिक सान्द्रता 2
(मोलरता)
माना साम्य पर P के x मोल क्रिया करते हैं तो
साम्य पर
सान्द्रता
2- x 1 - x x x
प्रश्नानुसार साम्य पर [R] = 3[Q]
x = 3(1 - x)
x = 3 - 3x
4x = 3
x = 3/4
साम्य स्थिरांक Kc = \(\mathrm{K}_{\mathrm{c}}=\frac{[\mathrm{R}][\mathrm{S}]}{[\mathrm{P}][\mathrm{Q}]}\)
\(\begin{aligned} \mathrm{K}_{\mathrm{c}} & =\frac{(x)(x)}{(2-x)(1-x)} \\ & =\frac{3 / 4 \times 3 / 4}{(2-3 / 4)(1-3 / 4)} \end{aligned}\)
= 1.8
प्रश्न 4.
5 L आयतन के एक पात्र में 1250 K ताप पर निम्नलिखित अभिक्रिया करवायी जाती है-
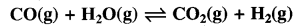
प्रारम्भ में CO तथा H2O के एक-एक मोल लेते हैं तथा साम्य पर 0.4 मोल H2O बच जाता है तो साम्यावस्था स्थिरांक ज्ञात कीजिए।
उत्तर:
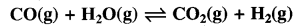
साम्य पर 0.4 मोल H2O बचता है अर्थात् 0.6 मोल H2O क्रिया कर लेता है अतः

अतः साम्य स्थिरांक
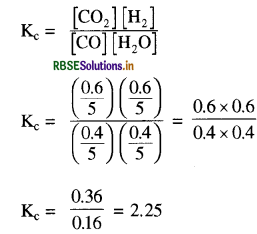
प्रश्न 5.
निम्न की गणना कीजिए:
(i) H2O का आयनन स्थिरांक
(ii) 1 लीटर जल में H+ आयनों की संख्या।
उत्तर:
(i) जल का आयनिक गुणनफल (Kw) = K × [H2O]
जल का आयनन स्थिरांक (K) = \(\frac{\mathrm{K}_{\mathrm{w}}}{\left[\mathrm{H}_2 \mathrm{O}\right]}\)
Kw = 1.0 × 10-14 तथा [H2O] = 55.5 M
\(\mathrm{K}=\frac{1 \times 10^{-14}}{55.5}\)
= 1.8 × 10-16
(ii) 1 लीटर जल में H+ आयनों की सान्द्रता [H+] = 1 × 107M अतः H+ आयनों की संख्या = सान्द्रता आवोगाद्रो संख्या
= 1 × 107 × 6.022 x 1023
= 6.022 x 1016
प्रश्न 6.
8 ग्राम NaOH को जल घोलकर 2 लीटर विलयन बनाया गया है तो इस विलयन की pH कितनी होगी?
उत्तर:
NaOH की मोलरता (M)
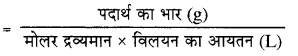
पदार्थ का भार = 8 g
विलयन का आयतन = 2 L
NaOH का मोलर द्रव्यमान = 23 + 16 + 1 = 40
अतः
\(M=\frac{8}{40 \times 2}\) = 0.1
M = 0.1 अत: N = 0.1 क्योंकि NaOH की अम्लता = 1
अतः
[OH-] = 0.1 = 10-1
\(\left[\mathrm{H}^{+}\right]=\frac{\mathrm{K}_{\mathrm{w}}}{[\tilde{\mathrm{O}} \mathrm{H}]}=\frac{10^{-14}}{10^{-1}}=10^{-13}\)
pH = -log[H+] = -log 10-13
pH = 13
प्रश्न 7.
NH के 0.01 M जलीय विलयन के आयनन की मात्रा 2% है तो इसके वियोजन स्थिरांक की गणना कीजिए।
उत्तर:
NH3 का जलीय विलयन (NH4OH) एक दुर्बल क्षार है
अतः इसका वियोजन स्थिरांक \(\mathrm{K}_{\mathrm{b}}=\frac{\mathrm{C} \alpha^2}{1-\alpha}\)
C = 0.01 M तथा \(\propto=\frac{2}{100}\)
\(\begin{aligned} \mathrm{K}_{\mathrm{b}} & =\frac{0.01 \times(0.02)^2}{1-0.02} \\ & =\frac{\left(1 \times 10^{-2}\right) \cdot\left(4 \times 10^{-4}\right)}{0.98} \end{aligned}\)
\(\mathrm{K}_{\mathrm{b}}=\frac{4 \times 10^{-6}}{0.98}\)
= 4.08 × 10-6

प्रश्न 8.
M/100 H2SO4 विलयन की POH कितनी होगी?
उत्तर:
M/100 H2SO4 = 0.01M H2SO4
H2SO4 के आयनन से 2, H+ प्राप्त होते हैं अतः 0.01 M = 0.01 x 2 = 0.02 N
इसलिए
[H+] = 0.02 = 10- 2 x 2
pH = -log 102 - log2
pH = 2 - 0.3010
pH = 1.6990
चूँकि pH + pOH = 14
(log 2 = 0.3010)
रसायन विज्ञान भाग - 1 ( कक्षा - 11 )
अतः
pOH = 14 - pH
pOH = 14 - 1.6990
pOH = 12.3010
प्रश्न 9.
दो दुर्बल क्षारों के [OH ] क्रमश: 10-1 व 10-2 मोल / मीटर हैं तो इनके वियोजन स्थिरांकों का अनुपात क्या होगा?
उत्तर:
\(\frac{\left[\mathrm{OH}^{-}\right]_1}{\left[\mathrm{OH}^{-}\right]_2}=\sqrt{\frac{\mathrm{K}_{\mathrm{b}_1}}{\mathrm{~K}_{\mathrm{b}_2}}}=\frac{\left(10^{-1}\right)^2}{\left(10^{-2}\right)^2}=\frac{\mathrm{K}_{\mathrm{b}_1}}{\mathrm{~K}_{\mathrm{b}_2}}\)
\(=\frac{100}{1}\)
= 100 : 1
प्रश्न 10.
10-8 N KOH विलयन की pH की गणना कीजिए।
उत्तर:
KOH प्रबल क्षार है अतः इसके लिए N = [OH ] = 10-8
अतः
РОН = -log [OH-]
РОН = -log 10-8
pOH = 8 अतः pH = 6
यह संभव नहीं है क्योंकि क्षार की pH, 7 से कम नहीं हो सकती।
चूँकि यह एक अति तनु विलयन है अतः इसमें जल की [OH-] को भी जोड़ना पड़ेगा जो कि 107 होती है।
अतः
[OH-] = 10-7 + 10-8
[OH] = 107 (1 + 0.1)
[OH-] = 107 (1.1)
pOH = -log107 - log1.1
pOH = 7 - (0.0414)
pOH = 7 - 0.0414
pOH = 6.95
अतः
pH = 14 - pOH
(log 1.1 = 0.0414)
pH = 14 - 6.95 = 7:05
प्रश्न 11.
1 ml; 1N HCL के कैप्सूल को एक पात्र तोड़कर विलयन का आयतन 1000 ml कर दिया जाता है तो परिणामी विलयन की pH क्या होगी?
उत्तर:
N1V1 = N2V2
1 × 1 = N2 × 1000
N2 = 10-3 = [H+]
pH = 3
प्रश्न 12.
pH = 2 व pH = 3 के दो विलयन को समान आयतन में मिलाते हैं तो परिणामी विलयन की pH क्या होगी?
उत्तर:
pH = 2 तो [H+] = 10-2
pH = 3 तो [H+] = 103
दोनों विलयन मिलाने पर आयतन दुगुना हो जाता है अतः सान्द्रता आधी हो जायेगी।
साम्यावस्था
\(\begin{aligned} {\left[\mathrm{H}^{+}\right] } & =\frac{10^{-2}+10^{-3}}{2} \\ {\left[\mathrm{H}^{+}\right] } & =\frac{10^{-2}\left(1+10^{-1}\right)}{2}=\frac{10^{-2} \times 1.1}{2} \end{aligned}\)
[H+] = 10-2 x 0.55 = 10-3 x 5.5
pH = -log 10-3 - log 5.5
pH = 3 - 0.7404
pH = 2.2596
(log 5.5 = 0.7404)
प्रश्न 13.
20 ml 0.2N KOH में 0.1 NH2SO4 के कितने ml मिलाएं कि विलयन उदासीन हो जाए?
उत्तर:
KOH H2SO4
N1V1 = N2V2
0.2 × 20 = 0.1 × V2
V2 = 40 ml

प्रश्न 14.
N/10 HCl (100 ml) + N/20 HNO3 (200 ml) M/60 + H2SO4 (300 ml) के मिश्रण की pH क्या होगी?
उत्तर:
\(\frac{\mathrm{M}}{60} \mathrm{H}_2 \mathrm{SO}_4=\frac{1}{60} \times 2=\frac{1}{30} \times \mathrm{N}\)
सभी प्रबल अम्ल हैं अतः
NV = N1V1 + N2V2 + N3V3
\(\mathrm{N} \times 600=\frac{1}{10} \times 100+\frac{1}{20} \times 200+\frac{1}{30} \times 300\)
[V = कुल आयतन = 600 ml]
N x 600 = 10 + 10 + 10
N = 30/600 = 1/20
= 5 x 10-2
pH = 2 - log 5
pH = 2 - 0.6990 = 1.3010 (log 5 = 0.6990)
प्रश्न 15.
AgCl का Ksp = 4 x 10-8 है तो इसके 15 लीटर संतृप्त विलयन में कितना AgCl घुला हुआ है?
उत्तर:
Ksp = s2, s = \(\sqrt{K_{\mathrm{sp}}}=\sqrt{4 \times 10^{-8}}=2 \times 10^{-4}\)
तो
x = 143.5 × 2 x 104 (gm L-1)
अतः 15 लीटर विलयन में AgCI का भार -
= 143.5 × 2 × 104 × 15
= 4.305 x 10-1
प्रश्न 16.
pbS का Ksp = 4 x 10-28 है। यदि [Pb+2] 10-27 है तो PbS के अवक्षेपण हेतु S-2 की न्यूनतम सान्द्रता कितनी होगी?
उत्तर:
जहाँ न्यूनतम शब्द लगाया जाता है वहाँ आयनिक गुणनफल Ksp के बराबर लेते हैं।
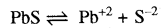
Ksp = [Pb+2][S-2]
\(\begin{aligned} & {\left[\mathrm{S}^{-2}\right]=\frac{\mathrm{K}_{\mathrm{sp}}}{\left[\mathrm{Pb}^{+2}\right]}} \\ & {\left[\mathrm{S}^{-2}\right]=\frac{4 \times 10^{-28}}{4 \times 10^{-27}}} \end{aligned}\)
= 10-1
प्रश्न 17.
HCOONH4 के 0.1 M विलयन की pH ज्ञात कीजिए यदि HCOOH का pKa = 3.6 तथा NH4OH का pK = 4.8
उत्तर:
HCOONH4 एक दुर्बल अम्ल तथा दुर्बल क्षार से बना लवण है अतः इसके विलयन की pH:
\(\begin{aligned} & \mathrm{pH}=7+\frac{1}{2} \mathrm{pK}_{\mathrm{a}}-\frac{1}{2} \mathrm{pK}_{\mathrm{b}} \\ & \mathrm{pH}=7+\left(\frac{1}{2} \times 306\right)-\frac{1}{2}(4.8) \end{aligned}\)
pH = 7 + 1.8 - 2.4
pH = 6.4
प्रश्न 18.
HCOOH तथा CH3COOH के वियोजन स्थिरांक क्रमश: 2 x 10 तथा 1.8 x 10-5 हैं तो 0.03N CH3COOH के साथ, HCOOH की समहाइड्रिक सान्द्रता की गणना कीजिए।
उत्तर:
समहाइड्रिक विलयन के लिए:
\(\begin{aligned} \frac{\mathrm{C}_1}{\mathrm{C}_2} & =\frac{\mathrm{K}_2}{\mathrm{~K}_1} \\ \frac{\mathrm{C}_1}{0.03} & =\frac{1.8 \times 10^{-5}}{2 \times 10^{-4}} \end{aligned}\)
HCOOH की सान्द्रता (C1) =
\(\frac{0.03 \times 1.8 \times 10^{-5}}{2 \times 10^{-4}}\)
C1 = 2.7 × 103 = 0.0027 N

प्रश्न 19.
500 ml बफर विलयन में 0.004 मोल HCl मिलाने पर इसकी pH में 0.04 की कमी हो जाती है तो इस बफर विलयन की बफर क्षमता कितनी होगी?
उत्तर:
500 ml विलयन में मिलाये गये HCl के मोल अतः 1 लीटर विलयन में मिलाए गए HCl के मोल
= 2 × 0.004 = 0.008
अतः बफर क्षमता =

\(=\frac{0.008}{0.04}\)
= 0.2
प्रश्न 20.
0.01 M HCOONa विलयन की pH ज्ञात कीजिए यदि HCOOH के K का मान 2 x 104 है।
उत्तर:
HCOONa, दुर्बल अम्ल तथा प्रबल क्षार से बना लवण है, अतः इसके विलयन की pH:
\(\mathrm{pH}=\frac{1}{2} \mathrm{pK}_{\mathrm{w}}+\frac{1}{2} \mathrm{pK}_{\mathrm{a}}+\frac{1}{2} \log \mathrm{C}\)
Kw = 1 × 10-14 अत: pKw = -log 10-14 = 14
pKa = -log Ka = - log 104 - log 2
pKa = 4 - 0.3010
pKa = 3.6990
अतः
\(\mathrm{pH}=\frac{1}{2}(14)+\frac{1}{2}(3.6990)+\frac{1}{2} \log 10^{-2}\)
pH = 7 + 1.8495 + 1/2(-2)
pH = 8.8495 - 1
pH = 7.8495
विभिन्न प्रतियोगी परीक्षाओं में पछे गये प्रश्न:
प्रश्न 1.
यदि Mg (OH)2 की विलेयता x है, तो इसका विलेयता गुणनफल होगा:
(a) 9x
(b) 108x5
(c) 4x3
(d) 27x4
उत्तर:
(c) 4x3
प्रश्न 2.
A2 तथा B2 द्वारा अभिव्यक्त की गई दो गैसों के बीच अभिक्रिया होने पर AB( g ) यौगिक बनता है।
A2(g) + B2(g) → 2AB(g)
साम्य पर A2, B2 तथा AB की सान्द्रताएँ इस प्रकार हैं:
A2 की सान्द्रता = 3.0 x 10-3 M
B 2 की सान्द्रता = 3.0 x 10-3 M
AB की सान्द्रता = 2.8 × 10-3 M
यदि 527°C ताप पर अभिक्रिया एक बंद पात्र में होती है तो Kc का मान होगा-
(a) 2.0
(b) 1.9
(c) 0.62
(d) 4.5
उत्तर:
(c) 0.62

प्रश्न 3.
यदि अभिक्रिया 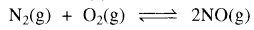 का साम्यावस्था स्थिरांक K है, तब
का साम्यावस्था स्थिरांक K है, तब 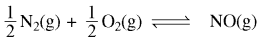 का साम्यावस्था स्थिरांक होगा:
का साम्यावस्था स्थिरांक होगा:
(a) K1⁄2
(b) 1⁄2 K
(c) K
(d) K2
उत्तर:
(a) K1⁄2
प्रश्न 4.
द्रव्य अनुपाती क्रिया के नियम के अनुसार किसी अभिक्रिया की दर समानुपाती है:
(a) उत्पाद की सान्द्रता के
(b) उत्पाद की मोलर सान्द्रता के
(c) अभिकारकों की सान्द्रता के
(d) अभिकारकों की मोलर सान्द्रताओं के
उत्तर:
(d) अभिकारकों की मोलर सान्द्रताओं के
प्रश्न 5.
0.1M CH3COOH की वियोजन की मात्रा कितनी होगी?
यदि Ka = 1 × 105
(a) 10-3
(b) 104
(c) 10-2
(d) 10-5
उत्तर:
(c) 10-2
प्रश्न 6.
अधोलिखित साम्यों में से किसमें Kc तथा Kp के मान बराबर नहीं हैं:
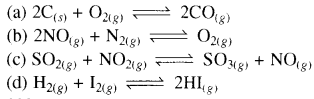
उत्तर:
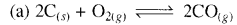
प्रश्न 7.
298 K ताप पर NH4OH का Ko = 1.8 x 10-5 है तो NH4Cl का जल अपघटन स्थिरांक (Kb) कितना होगा?
(a) 5.55 x 10-12
(b) 5.55 x 10-9
(c) 5.55 × 10-14
(d) 5.55 × 10-10
उत्तर:
(d) 5.55 × 10-10

प्रश्न 8.
अभिक्रिया 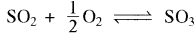 के लिए, यदि हम Kp = Kc(RT)x लिखते हैं, तब x का मान होगा:
के लिए, यदि हम Kp = Kc(RT)x लिखते हैं, तब x का मान होगा:
(a) - 1
(b) - 1/2
(c) 1/2
(d) 1
उत्तर:
(b) - 1/2
प्रश्न 9.
अभिक्रिया 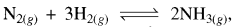 ∆H < 0 में अमोनिया के उत्पाद ( % प्राप्ति) की समय (time) पर निर्भरता (P, T1) नीचे दर्शायी गयी है:
∆H < 0 में अमोनिया के उत्पाद ( % प्राप्ति) की समय (time) पर निर्भरता (P, T1) नीचे दर्शायी गयी है:
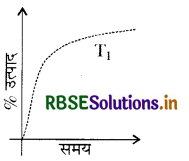
यदि यह अभिक्रिया (PT) पर की जाए, जहाँ T2 > T1, अमोनिया के % उत्पाद की समय पर निर्भरता प्रदर्शित करता है।
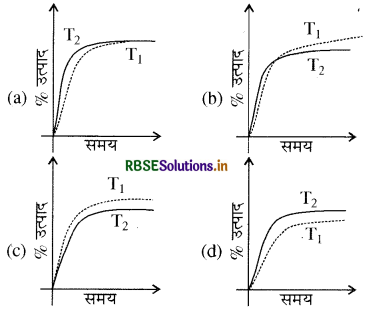
उत्तर:
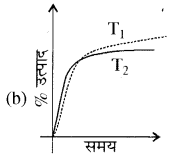
प्रश्न 10.
निम्नलिखित अणुओं में से कौनसा लुईस अम्ल के रूप में क्रिया करता है?
(a) (CH3)3B
(b) (CH3)2O
(c) (CH3)3P
(d) (CH3)3N
उत्तर:
(b) (CH3)2O
प्रश्न 11.
निम्नलिखित व्यवस्थाओं में से कौनसा क्रम उनके सामने लिखित गुणधर्म के अनुसार नहीं है?
(a) HF < HCl < HBr < HI; बढ़ता अम्लीय सामर्थ्य
(b) H2O < H2S < H2Se < H2 Te; बढ़ता pK, मान
(c) NH3 < PH3 < AsH3 < SbH3; बढ़ता अम्लीय व्यवहार
(d) CO2 < SiO2 < SnO2 < PbO2; बढ़ता ऑक्सीकारक
उत्तर:
(b) H2O < H2S < H2Se < H2 Te; बढ़ता pK, मान
प्रश्न 12.
Ba(OH)2 के एक संतृप्त विलयन का pH मान 12 Ba(OH)2 के विलेयता गुणनफल (Ksp) का मान है:
(a) 3.3 × 10-7
(b) 5.0 x 10-7
(c) 4.0 x 10
(d) 5.0 x 10-6
उत्तर:
(d) 5.0 x 10-6

प्रश्न 13.
pH 3, 4 तथा 5 युक्त तीन अम्ल विलयनों के समान आयतन को एक पात्र में मिश्रित करते हैं। मिश्रण में H+ आयन की सान्द्रता होगी:
(a) 3.7 × 103M
(b) 1.11 × 10 -3M
(c) 1.11 × 104 M
(d) 3.7 x 10-4 M
उत्तर:
(d) 3.7 x 10-4 M
प्रश्न 14.
pH = 5 वाले विलयन में अधिक अम्ल डालकर pH = 2 कर दी जाती है, तो हाइड्रोजन आयन सान्द्रता में होने वाली वृद्धि है:
(a) 100 गुना
(b) 1000 गुना
(c) 3 गुना
(d) 5 गुना
उत्तर:
(b) 1000 गुना
प्रश्न 15.
0.05 M Ba(OH)2 विलयन का pH मान क्या होगा:
(a) 12
(b) 13
(c) 1
(d) 12.96
उत्तर:
(d) 12.96
प्रश्न 16.
तापमान T पर MX1, MX2 और M3X प्रकार के लवणों क विलेयता गुणांक स्थिरांक (Ksp) क्रमश: 4.0 x 108, 3.25 10-14 और 2.7 x 10-15 है, अतः तापमान 'T' पर लवणों क विलेयता (moldm 3 ) का क्रम होगा:
(a) MX1 > MX2 > M3X
(b) M3X > MX2 > MX1
(c) MX2 > M3X > MX1
(d) MX1 > M3X > MX2
उत्तर:
(d) MX1 > M3X > MX2
प्रश्न 17.
Mn2+, Ni2+, Cu2+ Hg2+ जलीय विलयन में H2S गैस प्रवाहित करने से अवक्षेपित हो हैं:
(a) CuS तथा HgS
(b) MnS तथा CUS
(c) MnS तथा NIS
(d) NiS तथा HgS
उत्तर:
(a) CuS तथा HgS