RBSE Class 11 Chemistry Important Questions Chapter 4 रासायनिक आबंधन तथा आण्विक संरचना
Rajasthan Board RBSE Class 11 Chemistry Important Questions Chapter 4 रासायनिक आबंधन तथा आण्विक संरचना Important Questions and Answers.
RBSE Class 11 Chemistry Chapter 4 Important Questions रासायनिक आबंधन तथा आण्विक संरचना
बहुचयनात्मक प्रश्न (Multiple Choice Questions):
प्रश्न 1.
निम्न में से किस यौगिक का द्विध्रुव आघूर्ण शून्य है?
(अ) CIF
(ब) PCl3
(स) SiCl4
(द) CHCl3
उत्तर:
(स) SiCl4

प्रश्न 2.
निम्न में से किस अणु में sp3d संकरण होता है?
(अ) BF3
(ब) PF5
(स) SF6
(द) IF5
उत्तर:
(ब) PF5
प्रश्न 3.
ग्रेफाइट में CCC आबन्ध कोण का मान है:
(अ) 90°
(ब) 180°
(स) 109.5°
(द) 120°
उत्तर:
(द) 120°
प्रश्न 4.
निम्न में से किस यौगिक में दो सिग्मा तथा दो आबन्ध होते हैं?
(अ) NO2
(ब) CO2
(स) H2O2
(द) C2H4
उत्तर:
(ब) CO2
प्रश्न 5.
HCl अणु में किस प्रकार का अतिव्यापन होता है?
(अ) s-s
(ब) s-p
(स) p-P (समा)
(द) Pπ - Pπ
उत्तर:
(ब) s-p
प्रश्न 6.
निम्न में से कौनसे यौगिक की ज्यामिति रेखीय है?
(अ) C2H4
(ब) CO2
(स) NH3
(द) HO
उत्तर:
(ब) CO2
प्रश्न 7.
निम्न में से किसका क्वथनांक सबसे कम है?
(अ) H2S
(ब) HO
(स) H2Se
(द) H2Te
उत्तर:
(अ) H2S
प्रश्न 8.
निम्न में से कौनसा बन्ध दुर्बलतम है?
(अ) आयनिक बन्ध
(ब) सहसंयोजी बन्ध
(स) धात्विक बन्ध
(द) वान्डरवाल बन्ध
उत्तर:
(द) वान्डरवाल बन्ध
प्रश्न 9.
C6H6 (बेन्जीन) में कार्बन पर कौनसा संकरण होता है?
(अ) sp3
(ब) sp2
(स) sp
(द) sp3d
उत्तर:
(ब) sp2
प्रश्न 10.
निम्न में से इलेक्ट्रॉन समृद्ध यौगिक का उदाहरण कौनसा हैं?
(अ) BF3
(ब) CH4
(स) BeCl2
(द) NH3
उत्तर:
(द) NH3
प्रश्न 11.
हीरे में कार्बन परमाणु की संकरित अवस्था है:
(अ) sp3
(ब) sp2
(स) sp
(द) dsp3
उत्तर:
(अ) sp3

प्रश्न 12.
HOH आबन्ध कोण का मान:
(अ) 109.28°
(ब) 107°
(स) 104.5°
(द) 110°
उत्तर:
(स) 104.5°
प्रश्न 13.
निम्न में से किस यौगिक में हाइड्रोजन बन्ध नहीं होता?
(अ) द्रव NH3
(ब) HCl
(स) H2O
उत्तर:
(ब) HCl
प्रश्न 14.
निम्न में से किस स्पीशीज में केन्द्रीय परमाणु पर sp2 संकरण होता है?
(अ) NH3
(ब) CH3
(स) PCl3
(द) PCl5
उत्तर:
(ब) CH3
प्रश्न 15.
निम्न में से कौनसा हाइड्रोजन बन्ध सबसे प्रबल है?
(अ) O-H... O
(ब) F H..... F
(स) N-H....N
(द) O-H.... Cl-CI
उत्तर:
(ब) F H..... F
प्रश्न 16.
निम्न में से किस स्पीशीज की संरचना समचतुष्फलकीय है:
(अ) XeF4
(ब) SF4
(स) SiCl4
(द) उपर्युक्त सभी
उत्तर:
(स) SiCl4
रिक्त स्थान वाले प्रश्न ( Fill in the blanks):
प्रश्न 1.
PCl5 में ...................... संकरण होता है।
उत्तर:
sp3d
प्रश्न 2.
H2O में बन्ध कोण H2S में बन्ध कोण से ......................... होता है।
उत्तर:
अधिक
प्रश्न 3.
ग्रेफाइट कार्बन का ................... होता है।
उत्तर:
अपररूप
प्रश्न 4.
NH3 की ज्यामिति ................... होता है।
उत्तर:
त्रिकोणीय पिरामिडी

प्रश्न 5.
C = C की बन्ध लम्बाई > C = C < से ....................... होती है।
उत्तर:
कम
प्रश्न 6.
जलयोजन ऊर्जा बढ़ने पर आयनिक यौगिक की जल में विलेयता ............................. है।
उत्तर:
बढ़ती
प्रश्न 7.
आयनिक यौगिकों का गलनांक सामान्यतः ....................... होती है।
उत्तर:
उच्च
प्रश्न 8.
सहसंयोजी यौगिक सामान्यतः जल में ......................... होता है।
उत्तर:
अविलेय
प्रश्न 9.
SF6 में ....................... का प्रसार होता है।
उत्तर:
अष्टक
प्रश्न 10.
BaSO4 की जल में विलेयता CaSO4 की जल में विलेयता से ....................... होती है।
उत्तर:
कम।
निम्नलिखित में से सत्य एवं असत्य कथन छाँटिए (True and False Statement):
प्रश्न 1.
जल का परावैद्युतांक उच्च होता है अतः यह एक सर्वोत्तम ध्रुवीय विलायक है।
उत्तर:
सत्य
प्रश्न 2.
जालक ऊर्जा का मान अधिक होने पर गलनांक का मान कम होता है।
उत्तर:
असत्य
प्रश्न 3.
ब्रोमीन एक द्रव अधातु है।
उत्तर:
सत्य
प्रश्न 4.
आयनिक यौगिक ठोस अवस्था में भी विद्युत के सुचालक होते हैं।
उत्तर:
असत्य

प्रश्न 5.
SiO2 की दीर्घ जटिल संरचना होती है।
उत्तर:
सत्य
प्रश्न 6.
ग्लुकोस अध्रुवीय यौगिक होते हुए भी जल में विलेय है।
उत्तर:
सत्य
प्रश्न 7.
BCl3 में अष्टक पूर्ण होता है।
उत्तर:
असत्य
प्रश्न 8.
संकरण में गुण बढ़ने पर बन्ध लम्बाई कम होती है।
उत्तर:
सत्य
प्रश्न 9.
बेन्जीन में C – C बन्ध क्रम 1.5 होता है।
उत्तर:
सत्य
प्रश्न 10.
CO की आंबन्ध कोटि 2 होती है।
उत्तर:
असत्य
प्रश्न 11.
HCl का द्विध्रुव आघूर्ण HBr के द्विध्रुव आघूर्ण से अधिक होता है।
उत्तर:
सत्य
प्रश्न 12.
BCl3 की ज्यामिति रेखीय होती है।
उत्तर:
असत्य।
मिलान करने वाले प्रश्न (Matching type Questions):
सूची A तथा सूची B का मिलान कीजिए तथा सही कूट (Code) का चयन कीजिए:
प्रश्न 1.
|
सूची A |
सूची B |
|
(1) sp संकरण |
(a) CO2 |
|
(2) रेखीय ज्यामिति |
(b) H2O |
|
(3) बन्ध कोण 104.50 |
(c) CCl4 |
|
(4) केन्द्रीय परमाणु पर एक अयुग्मित इलेक्ट्रॉन |
(d) NH3 |
उत्तर:
|
सूची A |
सूची B |
|
(1) sp संकरण |
(c) CCl4 |
|
(2) रेखीय ज्यामिति |
(a) CO2 |
|
(3) बन्ध कोण 104.50 |
(b) H2O |
|
(4) केन्द्रीय परमाणु पर एक अयुग्मित इलेक्ट्रॉन |
(d) NH3 |

प्रश्न 2.
|
सूची A |
सूची B |
|
(1) s-p अतिव्यापन |
(a) CsCl |
|
(2) जल में विलेय आयनिक यौगिक |
(b) H-Cl |
|
(3) छद्म अक्रिय गैस विन्यास युक्त धनायन का यौगिक |
(c) उभयधर्मी ऑक्साइड |
|
(4) Al2O3 |
(d) Cu2Cl2 |
उत्तर:
|
सूची A |
सूची B |
|
(1) s-p अतिव्यापन |
(b) H-Cl |
|
(2) जल में विलेय आयनिक यौगिक |
(a) CsCl |
|
(3) छद्म अक्रिय गैस विन्यास युक्त धनायन का यौगिक |
(d) Cu2Cl2 |
|
(4) Al2O3 |
(c) उभयधर्मी ऑक्साइड |
प्रश्न 3.
|
सूची A |
सूची B |
|
(1) p-p समाक्ष अतिव्यापन |
(a) हीरा |
|
(2) एक σ तथा π एक बन्ध |
(b) CH-Cl |
|
(3) एथाइन |
(c) O2 |
|
(4) उच्च गलनांक |
(d) sp संकरण |
उत्तर:
|
सूची A |
सूची B |
|
(1) p-p समाक्ष अतिव्यापन |
(b) CH-Cl |
|
(2) एक σ तथा π एक बन्ध |
(c) O2 |
|
(3) एथाइन |
(d) sp संकरण |
|
(4) उच्च गलनांक |
(a) हीरा |
प्रश्न 4.
|
सूची A |
सूची B |
|
(1) अष्टफलकीय ज्यामिति |
(a) B2 अणु |
|
(2) अस्तित्वहीन अणु |
(b) O2 अणु |
|
(3) बन्धक्रम - एक |
(c) SF |
|
(4) अनुचुम्बकीय |
(d) He2 |
उत्तर:
|
सूची A |
सूची B |
|
(1) अष्टफलकीय ज्यामिति |
(c) SF |
|
(2) अस्तित्वहीन अणु |
(d) He2 |
|
(3) बन्धक्रम - एक |
(a) B2 अणु |
|
(4) अनुचुम्बकीय |
(b) O2 अणु |
प्रश्न 5.
|
सूची A |
सूची B |
|
(1) H2O का उच्च क्वथनांक |
(a) अनुचुम्बकीय |
|
(2) B2 अणु |
(b) बन्ध कोण का घटता क्रम |
|
(3) HCl < HBr <HI < HF |
(c) अन्तराअणुक हाइड्रोजन |
|
(4) H2O > H2S > H2Se > H2Te |
(d) क्वथनांक का बढ़ता क्रम |
उत्तर:
|
सूची A |
सूची B |
|
(1) H2O का उच्च क्वथनांक |
(c) अन्तराअणुक हाइड्रोजन |
|
(2) B2 अणु |
(a) अनुचुम्बकीय |
|
(3) HCl < HBr <HI < HF |
(d) क्वथनांक का बढ़ता क्रम |
|
(4) H2O > H2S > H2Se > H2Te |
(b) बन्ध कोण का घटता क्रम |
प्रश्न 6.
|
सूची A |
सूची B |
|
(1) CO32- |
(a) बन्ध क्रम 1.33 |
|
(2) MgCl2 |
(b) O2 |
|
(3) शून्य द्विध्रुव आघूर्ण |
(c) आयनिक यौगिक |
|
(4) सुपर ऑक्साइड |
(d) BeF2 |
उत्तर:
|
सूची A |
सूची B |
|
(1) CO32- |
(a) बन्ध क्रम 1.33 |
|
(2) MgCl2 |
(c) आयनिक यौगिक |
|
(3) शून्य द्विध्रुव आघूर्ण |
(b) O2 |
|
(4) सुपर ऑक्साइड |
(d) BeF2 |

प्रश्न 7.
|
सूची A |
सूची B |
|
(1) द्विध्रुव आघूर्ण का मात्रक |
(a) F F < Cl-Cl |
|
(2) द्रव यौगिक |
(b) H2O |
|
(3) बंकित आकृति |
(c) HF |
|
(4) आबन्ध एन्थैल्पी |
(d) डिबाई |
उत्तर:
|
सूची A |
सूची B |
|
(1) द्विध्रुव आघूर्ण का मात्रक |
(d) डिबाई |
|
(2) द्रव यौगिक |
(c) HF |
|
(3) बंकित आकृति |
(b) H2O |
|
(4) आबन्ध एन्थैल्पी |
(a) F F < Cl-Cl |
प्रश्न 8.
|
सूची A |
सूची B |
|
(1) बन्धकोण 120° |
(a) sp3 - sp3 अतिव्यापन |
|
(2) H2- <H2+ < H2 |
(b) [Ni(CN)4 ] 2- |
|
(3) dsp2 संकरण |
(c) बेंजीन |
|
(4) एथेन में C-C बन्ध |
(d) स्थायित्व का बढ़ता क्रम |
उत्तर:
|
सूची A |
सूची B |
|
(1) बन्धकोण 120° |
(c) बेंजीन |
|
(2) H2- < H2+ < H2 |
(d) स्थायित्व का बढ़ता क्रम |
|
(3) dsp2 संकरण |
(a) sp3- sp3 अतिव्यापन |
|
(4) एथेन में C-C बन्ध |
(b) [Ni(CN)4 ] 2- |
प्रश्न 9.
|
सूची A |
सूची B |
|
(1) आबन्ध कोटि-2 |
(a) O22 |
|
(2) O > O2 |
(b) XeF2 |
|
(3) पराक्साइड आयन |
(c) C2 |
|
(4) केन्द्रीय परमाणु पर तीन एकाकी इलेक्ट्रॉन युग्म |
(d) स्थायित्व |
उत्तर:
|
सूची A |
सूची B |
|
(1) आबन्ध कोटि-2 |
(c) C2 |
|
(2) O > O2 |
(d) स्थायित्व |
|
(3) पराक्साइड आयन |
(a) O22 |
|
(4) केन्द्रीय परमाणु पर तीन एकाकी इलेक्ट्रॉन युग्म |
(b) XeF2 |
प्रश्न 10.
|
सूची A |
सूची B |
|
(1) sp2 संकरण |
(a) BeCl2 |
|
(2) sp संकरण |
(b) CH3 |
|
(3) Rb2 O |
(C) NH4 |
|
(4) 50/s-गुणयुक्त यौगिक |
(d) अधिक क्षारीय गुणयुक्त ऑक्साइड |
उत्तर:
|
सूची A |
सूची B |
|
(1) sp2 संकरण |
(b) CH3 |
|
(2) sp संकरण |
(C) NH4 |
|
(3) Rb2O |
(d) अधिक क्षारीय गुणयुक्त ऑक्साइड |
|
(4) 50/s-गुणयुक्त यौगिक |
(a) BeCl2 |
अतिलघूत्तरात्मक प्रश्न (Very Short Answer Type Questions):
प्रश्न 1.
आबन्ध कोण किसे कहते हैं?
उत्तर:
किसी अणु के केन्द्रीय परमाणु के पास-पास स्थित वे कक्षक, जिनमें बन्धित इलेक्ट्रॉन युग्म उपस्थित हैं, के मध्य स्थित कोण को आबन्ध कोण कहते हैं।
प्रश्न 2.
CaF2 में किस प्रकार का बन्ध पाया जाता है?
उत्तर:
आयनिक बन्ध (Ca2 + 2F)।
प्रश्न 3.
CO में बन्ध क्रम ( आबन्ध कोटि) का मान कितना होता है?
उत्तर:
तीन।

प्रश्न 4.
O3 में विभिन्न ऑक्सीजन परमाणुओं पर फार्मल आवेश कितना है?
उत्तर:
शून्य, +1 तथा 1
प्रश्न 5.
निम्न में से उन अणुओं को छाँटिए जिनका द्विध्रुव आघूर्ण शून्य नहीं होता है। CF4, BCl3. BeCl2. CO2, NF3, H2O, CHCl3
उत्तर:
NF3, H2O तथा CHCl3 का द्विध्रुव आघूर्ण शून्य नहीं होता है।
प्रश्न 6.
इलेक्ट्रॉन न्यून यौगिक का एक उदाहरण बताइए।
उत्तर:
BF
प्रश्न 7.
CO32- आयन में C-O बन्ध क्रम कितना होता है?
उत्तर:
CO32- आयन में C-O बन्ध क्रम 1.33 होता है।
प्रश्न 8.
निम्न में से कौनसा ऑक्साइड अम्लीय प्रकृति का है:
Na2O, K2O, MgO, P2O5?
उत्तर:
P2O5
प्रश्न 9.
निम्न में से किस यौगिक के तापीय विघटन से CO2 गैस प्राप्त होती है? Li2CO3, Na2CO3 K2CO3 तथा Pb2CO
उत्तर:
Li2CO3
प्रश्न 10.
निम्न में से किस यौगिक का गलनांक न्यूनतम होता है? NaCl, MgCl2, AlCl3 तथा SiCl4
उत्तर:
SiCl4
प्रश्न 11.
छद्म अक्रिय गैस विन्यास युक्त एक आयन बताइए।
उत्तर:
Zn2+ (2, 8, 18) Zn2+ के बाह्यतम कोश में 18 इलेक्ट्रॉन हैं जिसे छद्म अक्रिय गैस विन्यास कहते हैं।
प्रश्न 12.
H2S की ज्यामिति कैसी होती है?
उत्तर:
H2S की ज्यामिति कोणीय या v आकृति की होती है।
प्रश्न 13.
NH3 में आबंध कोण का मान बताइए।
उत्तर:
107°
प्रश्न 14.
CH4 NH3 तथा H2O में बन्ध कोण का घटता क्रम बताइए।
उत्तर:
CH4 > NH3 > H2O (बन्ध कोण)।
प्रश्न 15.
CHCl3 की ज्यामिति कैसी होती है?
उत्तर:
चतुष्फलकीय (sp संकरण)।
प्रश्न 16.
NH4 में कौनसा संकरण होता है?
उत्तर:
sp संकरण (40 बन्ध)।
प्रश्न 17.
dsp2 संकरण के दो उदाहरण बताइए।
उत्तर:
[Ni(CN)4]2- तथा [PtCl4]2
प्रश्न 18.
वर्ग पिरामिड ज्यामिति वाला एक अणु बताइए।
उत्तर:
BrFs (spid संकरण) (50 + 11.p)।
प्रश्न 19
दो जैव अणुओं के नाम बताइए जिनकी संरचना का निर्धारण हाइड्रोजन आबन्ध द्वारा होता है।
उत्तर:
DNA तथा प्रोटीन की संरचना का निर्धारण हाइड्रोजन आबन्ध द्वारा होता है।
प्रश्न 20.
O- नाइट्रोफिनॉल में कौनसा हाइड्रोजन आबन्ध पाया जाता है?
उत्तर:
अन्तः अणुक H-बन्ध
प्रश्न 21.
एथेन में C-Co आबन्ध कौनसे अतिव्यापन से बनता
उत्तर:
sp-sp' अतिव्यापन।

प्रश्न 22.
[Cu(NH3)4]2+ में Cu पर कौनसा संकरण होता है?
उत्तर:
dsp2 संकरण।
प्रश्न 23.
HC = CH में C-CO बन्ध किस अतिव्यापन से बनता है?
उत्तर:
sp-sp अतिव्यापन।
प्रश्न 24.
SO2 में सल्फर की संकरण अवस्था बताइए।
उत्तर:
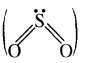
प्रश्न 25.
NO2 में N पर संकरण तथा इसकी आकृति बताइए।
उत्तर:
sp2 संकरण, कोणीय या v - आकृति।
प्रश्न 26
AIF63- में Al पर संकरण तथा इसकी ज्यामिति बताइए।
उत्तर:
sp3d2 संकरण, अष्टफलकीय ज्यामिति।
प्रश्न 27.
H+2 H2 तथा H2- के स्थायित्व का बढ़ता क्रम बताइए।
उत्तर:
H+2 < H2 < H2-
प्रश्न 28.
N2, N2- तथा N2+ के स्थायित्व का घटता क्रम बताइए।
उत्तर:
N2 > N2- > N2+
लघुत्तरात्मक प्रश्न (Short Answer Type Questions ):
प्रश्न 1.
फार्मल आवेश किसे कहते हैं? उदाहरण सहित समझाइए।
उत्तर:
बहुपरमाणुक अणु या आयन के किसी परमाणु का फार्मल आवेश उसकी विगलित स्थिति (अर्थात् मुक्त परमाणु अवस्था) में संयोजकता इलेक्ट्रॉनों की कुल संख्या तथा लूइस संरचना में उस परमाणु को प्रदत्त इलेक्ट्रॉनों की संख्या के अंतर के बराबर होता है। फार्मल आवश को निम्न सूत्र द्वारा ज्ञात किया जाता है
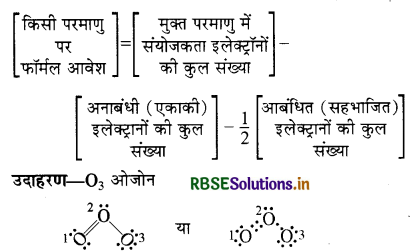
परमाणु (1) पर फार्मल आवेश (F.C.) = 6 - 4 - 1/2(4) = 0
परमाणु (2) पर F.C. = 6 - 2 - 1/2(6) = 1
परमाणु (3) पर F.C. = 6 - 6 - 1/2(2) = -1
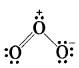
प्रश्न 2.
आबन्ध एन्थैल्पी किसे कहते हैं? बहुपरमाणुक अणुओं में यह किस प्रकार ज्ञात की जाती है?
उत्तर:
आबन्ध एन्थैल्पी गैसीय अवस्था में दो परमाणुओं के मध्य विशिष्ट आबन्धों के एक मोल को तोड़ने के लिए आवश्यक ऊर्जा को आबन्ध एन्थैल्पी कहते हैं। इसका मात्रक kJ mol-1 होता है।
H2(g) → H(g) + H(g) ∆H° = 435.8kJ mol-1
बहुपरमाणुक अणु जैसे - H2O में दो O-H बन्ध हैं लेकिन इनकी आबन्ध एन्थैल्पी का मान भिन्न-भिन्न है अतः इनमें औसत आबन्ध एन्थैल्पी प्रयुक्त की जाती है।
औसत आबन्ध एन्थैल्पी = 
प्रश्न 3.
द्विध्रुव आघूर्ण किसे कहते हैं? उदाहरण सहित समझाइए।
उत्तर:
द्विध्रुव आघूर्ण (u) - किसी ध्रुवीय अणु में आवेश के मान तथा आवेशों के बीच की दूरी के गुणनफल को द्विध्रुव आघूर्ण कहते हैं।
द्विध्रुव आघूर्ण (u) = आवेश (Q) x (r) आवेशों के बीच की दूरी या = Q x r या u = Q x d
द्विध्रुव आघूर्ण का मात्रक (D) Debye है।
1 D = 3.3 × 10-30 Cm C = कूलाम, m = मीटर
द्विध्रुव आघूर्ण एक सदिश राशि है।
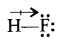
बहुपरमाणुक अणुओं का द्विध्रुव आघूर्ण, उसके विभिन्न ध्रुवीय बन्धों के आबन्ध आपूणों का सदिश योग होता है।
वे अणु जिनमें सभी बन्ध समान होते हैं तथा जिनकी ज्यामिति सममित व नियमित होती है, जैसे - रेखीय, त्रिकोणीय समतल तथा चतुष्फलकीय (इत्यादि) तो अणु का परिणामी द्विध्रुव आघूर्ण शून्य होता है BF3 का द्विध्रुव आघूर्ण शून्य होता है, क्योंकि इसकी ज्यामिति त्रिकोणीय समतल होती है तथा इसमें सभी बन्ध समान हैं जो एक-दूसरे के प्रभाव को निरस्त कर देते हैं।
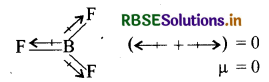
H2O की अंकित (bent) आकृति के कारण इसका द्विध्रुव आघूर्ण उच्च होता है।

प्रश्न 4.
आयनिक बन्ध में आंशिक सहसंयोजी बन्ध के गुण किस प्रकार आते हैं? समझाइए।
उत्तर:
यौगिक में जब धनायन, ऋणायन के इलेक्ट्रॉन अभ्र को अपनी ओर आकर्षित करता है तो उनके मध्य आवेश की मात्रा बढ़ती है। जिससे दोनों नाभिकों के मध्य इलेक्ट्रॉनीय आवेश घनत्व में वृद्धि होती है। इसे ऋणायन का ध्रुवण कहते हैं तथा इससे आयनिक बन्ध में आंशिक सहसंयोजी लक्षण आता है।
धनायन की ध्रुवण क्षमता तथा ऋणायन के ध्रुवण की मात्रा बढ़ने से आबन्ध में सहसंयोजी गुण अधिक आता है।
इसके लिए आवश्यक शर्तें निम्न प्रकार हैं:
- धनायन के आकार के घटने तथा ऋणायन का आकार बढ़ने पर आयनिक आबंध में सहसंयोजी लक्षण में वृद्धि होती है।
- धनायन तथा ऋणायन पर आवेश की मात्रा बढ़ने से भी आयनिक आबंध में सहसंयोजी लक्षण बढ़ते हैं।
- समान आकार तथा समान आवेश के धनायनों में से उस धनायन की ध्रुवण क्षमता अपेक्षाकृत अधिक होती है, जिसका इलेक्ट्रॉनिक विन्यास उत्कृष्ट गैस विन्यास ns1 np1 की अपेक्षा संक्रमण धातुओं के अनुरूप (n - 1) ns2np6 होता है।
प्रश्न 5.
CO2 अध्रुवीय होती है, जबकि SO2 ध्रुवीय, क्यों?
उत्तर:
CO2 तथा SO2 दोनों ही यौगिकों में ध्रुवीय बन्ध होते हैं लेकिन CO2 की ज्यामिति रेखीय होती है, अतः इसके दोनों C-O बन्धों के बन्ध आघूर्ण एक-दूसरे के विपरीत दिशा में होने के कारण इनका प्रभाव निरस्त हो जाता है जिसके कारण इसका द्विध्रुव आघूर्ण शून्य होता है अतः CO2 अध्रुवीय है जबकि SO2 में ऐसा नहीं होता क्योंकि इसकी ज्यामिति कोणीय होती है अतः इसका द्विध्रुव आघूर्ण शून्य नहीं होता अतः यह ध्रुवीय है।

प्रश्न 6.
आयनिक यौगिकों की विलेयता के बारे में समझाइए।
उत्तर:
आयनिक बन्ध के निर्माण के लिए निम्न शर्तें आवश्यक हैं:
(i) धातु की निम्न आयनन एन्थैल्पी-आयनन एन्थैल्पी का मान कम होने पर धनायन आसानी से बन जाते हैं, इसी कारण क्षार धातु तथा क्षारीय मृदा धातु आसानी से धनायन बनाती हैं।
(ii) अधातु की उच्च ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पीअधातु की इलेक्ट्रॉन लब्धि एन्थैल्पी उच्च (ऋणात्मक) होने पर उसकी इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति अधिक होती है अतः वह आसानी से ॠणायन बनाता है। इसी कारण हैलोजन की ऋणायन बनाने की प्रवृत्ति अधिक होती है।
(iii) उच्च जालक एन्थैल्पी: गैसीय धनायनों तथा ऋणायनों के आकर्षण से एक मोल आयनिक क्रिस्टल के बनने पर मुक्त ऊर्जा को जालक ऊर्जा कहते हैं। जालक ऊर्जा का मान जितना अधिक होगा आयनिक यौगिक का निर्माण उतना ही आसान होगा तथा क्रिस्टल संरचना अधिक स्थायी होगी।
आयनिक यौगिक का बनना (MX):

प्रश्न 7.
(i) आबन्ध लम्बाई, संकरण पर निर्भर करती है। समझाइए।
(ii) F F आबन्ध एन्थैल्पी CI-CI आबन्ध एन्थैलपी से कम होती है, क्यों ?
उत्तर:
(i) संकरण में गुण बढ़ने पर बन्ध लम्बाई कम होती है। उदाहरण C-C बन्ध लम्बाई निम्न क्रम में कम होती है:
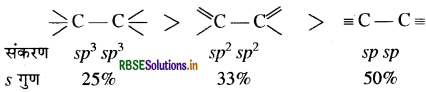
(ii) F F आबन्ध एन्थैल्पी का मान Cl-Cl आबन्ध एन्बैल्पी से कम होता है क्योंकि फ्लुओरीन के छोटे आकार के कारण इसमें दोनों फ्लुओरीन परमाणुओं पर उपस्थित एकाकी इलेक्ट्रॉन युग्मों के मध्य प्रतिकर्षण अधिक होता है जिससे बन्ध आसानी से टूट जाता है।
प्रश्न 8.
आयनिक विभव क्या होता है? इसके आधार पर ऑक्साइडों की अम्लीय प्रवृत्ति तथा कार्बोनेटों के स्थायित्व की व्याख्या कीजिए।
उत्तर:
जब दो समान परमाणुओं के बीच (जैसे H2, O2, Cl2, N2 तथा F2) सहसंयोजी आबंध बनता है, तब साझित इलेक्ट्रॉन युग्म दोनों परमाणुओं द्वारा समान रूप से आकर्षित होता है। इससे यह इलेक्ट्रॉन युग्म दोनों नाभिकों के बीच में रहता है। इस प्रकार के आबंध को 'अध्रुवीय सहसंयोजी आबंध' कहते हैं। लेकिन HF जैसे विषम परमाणुक अणु में दो परमाणुओं के बीच साझित इलेक्ट्रॉन युग्म अधिक विद्युत ऋणी परमाणु फ्लुओरीन की ओर विस्थापित हो जाता है। इस प्रकार के आबंध को ध्रुवीय सहसंयोजक आबंध कहते हैं। दो परमाणुओं के मध्य विद्युत ऋणता में अन्तर बढ़ने पर अणु की ध्रवुता भी बढ़ती है तथा ध्रुवता के कारण ऐसे अणु में द्विध्रुव आघूर्ण उत्पन्न हो जाता है।
द्विध्रुव आघूर्ण (Dipole moment): किसी ध्रुवीय अणु में आवेश के मान तथा आवेशों के बीच की दूरी के गुणनफल को द्विध्रुव आघूर्ण कहते हैं।
द्विध्रुव आघूर्ण µ = आवेश (Q) x (r) आवेशों के बीच की दूरी या µ = (Q) x (r) या µ = (Q) x d
द्विध्रुव आघूर्ण का मात्रक डिबाए D (Debye) है।
1D = 3.33 x 10-30 Cm जहाँ C = कूलाम,
m = मीटर
अध्रुवीय अणुओं के द्विध्रुव आघूर्ण का मान शून्य होता है (µ = 0) लेकिन वे अणु जिनका द्विध्रुव आघूर्ण शून्य नहीं होता है वे ध्रुवीय होते हैं। (µ ≠ 0) जैसे H2Cl2 इत्यादि अध्रुवीय जबकि HCl, HF इत्यादि ध्रुवीय अणु हैं। द्विध्रुव आघूर्ण एक सदिश राशि है जिसे एक छोटे तीर द्वारा दर्शाया जाता है जिसकी पूँछ धनात्मक केन्द्र पर तथा सिर ऋणात्मक केन्द्र पर होता है। उदाहरण HF
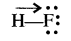
- अणु में इलेक्ट्रॉन घनत्व के विस्थापन की दिशा को लूइस संरचना पर क्रॉस तीर लगाकर दर्शाया जाता है जिसका क्रॉस अणु के धनात्मक सिरे पर तथा शीर्ष ऋणात्मक सिरे पर होता है।
- दो परमाणुओं के मध्य विद्युत ऋणता में अन्तर बढ़ने पर द्विध्रुव आघूर्ण का मान बढ़ता है। जैसे
HF < HCl > HBr > HI

प्रश्न 9.
Sn भिन्न-भिन्न ऑक्सीकरण अवस्थाओं में दो यौगिक बनाता है SnCl2 तथा SnCl2 लेकिन इनमें से SnCl4 ठोस होता है जबकि SnCl2 वाष्पशील द्रव, क्यों?
उत्तर:
SnCl2 तथा SnCl4 में Sn की ऑक्सीकरण अवस्था क्रमश: +2 तथा +4 है Sn+4 के छोटे आकार के कारण इसकी ध्रुवण क्षमता अधिक होती है, अतः यह ऋणायन का ध्रुवण आसानी से कर देता है जिसके कारण SnCl4 सहसंयोजी होता है जबकि SnCl2 में Sn2+ के छोटे आकार के कारण इसमें आयनिक गुण अधिक होते हैं। इसी कारण SnCl2 ठोस होता है जबकि SnCl4 वाष्पशील द्रव।
प्रश्न 10.
CCl2 की जल से क्रिया नहीं होती जबकि SiCl4 जल के साथ आसानी से क्रिया कर लेता है, क्यों?
उत्तर:
CCl2 में कार्बन का अष्टक पूर्ण है तथा कार्बन (द्वितीय आवर्त) के पास रिक्त d कक्षक भी नहीं है अतः यह जल से इलेक्ट्रॉन युग्म ग्रहण करने में सक्षम नहीं है अतः इसकी जल से क्रिया नहीं होती लेकिन SiCl4 Si (तृतीय आवर्त) के पास रिक्त d कक्षक होने के कारण यह जल से इलेक्ट्रॉन युग्म आसानी से ग्रहण कर लेता है। अतः SiCl4 जल से आसानी क्रिया कर लेता है।
SiCl4 + 2H2O → SiO2 + 2HCl
प्रश्न 11.
PCl5 का अस्तित्व होता है जबकि NCl5 नहीं बनता है, क्यों?
उत्तर:
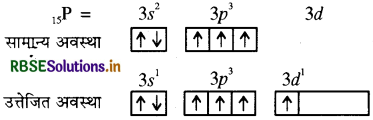
नाइट्रोजन दूसरे आवर्त का तत्त्व है जिसके बाह्यतम कोश में 5 इलेक्ट्रॉन होते हैं लेकिन अयुग्मित इलेक्ट्रॉनों की संख्या केवल 3 है।
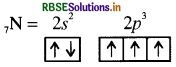
नाइट्रोजन में रिक्त d कक्षक नहीं होता है अतः इसमें इलेक्ट्रॉन का उत्तेजन संभव नहीं है इस कारण इसमें अष्टक का प्रसार नहीं होता अतः इसकी संयोजकता 5 नहीं हो सकती। इसी कारण NCl5 नहीं बनता है। जबकि PCl5 में स्थित फॉस्फोरस तीसरे आवर्त का तत्त्व है अतः इसमें इलेक्ट्रॉन का उत्तेजन होकर इसकी संयोजकता 5 हो जाती है। इस कारण PCl5 आसानी से बन जाता है।
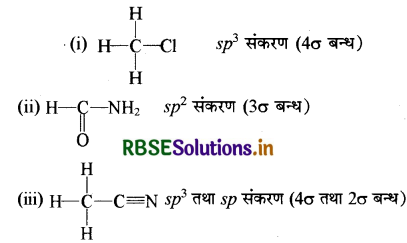
प्रश्न 12.
निम्नलिखित यौगिकों में प्रत्येक कार्बन की संकरण अवस्था कौनसी है?
(i) CH3Cl
(ii) HCONH2
(iii) CH3CN
उत्तर:
प्रश्न 13.
BF3 की ज्यामिति त्रिकोणीय होती है जबकि NH3 की पिरामिडी क्यों? कारण बताइए।
उत्तर:
BF3 में B पर sp2 संकरण (3σ बन्ध) है अतः इसकी ज्यामिति त्रिकोणीय होती है जबकि NH3 में N पर 3σ बन्ध तथा एक संकरण होता है अतः इसकी एकाकी इलेक्ट्रॉन युग्म होने के कारण sp3 ज्यामिति पिरामिडी होती है।
प्रश्न 14.
बर्फ के पिघलने से बने जल का आयतन कम हो जाता है। क्यों?
अथवा
बर्फ का घनत्व जल से कम क्यों होता है?
उत्तर:
जल के ठण्डे होने पर 4°C तक तो घनत्व बढ़ता है, उसके पश्चात् और अधिक ठण्डा होने पर हाइड्रोजन बन्ध के कारण H2O के अणु एक निश्चित खुली पिंजरे जैसी रंभ्रमय संरचना में व्यवस्थित होते हैं जिसमें द्रव्यमान की तुलना में आयतन अधिक होता है। अतः बर्फ का घनत्व जल से कम होता है तथा बर्फ के पिघलने से बने जल का आयतन कम हो जाता है।
प्रश्न 15.
बन्धी आण्विक कक्षक तथा विपरीत बन्धी आण्विक कक्षकों में अन्तर बताइए।
उत्तर:
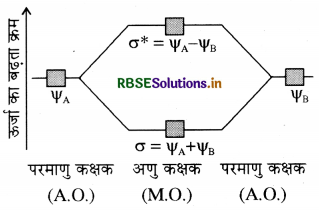
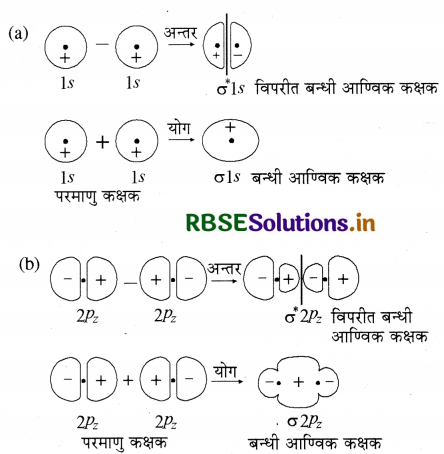
तरंग यान्त्रिकी के अनुसार परमाणु कक्षक को एक तरंग फलन φ के रूप में दर्शाया जाता है। यह इलेक्ट्रॉन तरंग के आयाम (amplitude) को बताता है। इसे श्रोडिंगर-तरंग समीकरण के हल से प्राप्त करते हैं लेकिन बहु-इलेक्ट्रॉन निकाय के लिए श्रोडिंगर समीकरण का हल नहीं किया जा सकता अतः आण्विक कक्षक जो कि अणुओं के लिए इलेक्ट्रॉन तरंग फलन है, को सन्निकट विधि से प्राप्त किया जाता है। इस विधि को परमाणु कक्षकों का रैखिक संयोग (LCAO) कहते हैं। इस विधि का प्रयोग H2 (समनाभिकीय द्विपरमाणुक अणु) पर करते हैं। माना कि हाइड्रोजन अणु दो हाइड्रोजन परमाणुओं φA तथा φB से बना है। प्रत्येक हाइड्रोजन परमाणु की मूल अवस्था में 1 s कक्षक में एक इलेक्ट्रॉन होता है। इन हाइड्रोजन परमाणुओं के परमाणु कक्षकों को हम तरंग फलन φA तथा φB द्वारा प्रदर्शित करते हैं। गणितीय रूप से परमाणु कक्षकों के रैखिक संयोग को व्यक्तिगत परमाणु कक्षकों के तरंग फलनों φA तथा φB के योग या अंतर द्वारा व्यक्त किया जाता है जिससे अणु कक्षक बनते हैं।
φM = φA + φB
इस प्रकार दो प्रकार के आण्विक कक्षक, बन्धी आण्विक कक्षक σ तथा विपरीत बन्धी आण्विक कक्षक σ* प्राप्त होते हैं।
σ = φA + φB φ = φA + φB
σ* = φA - φB φ* = φA - φB
परमाणु कक्षकों के योग से बन्धी आण्विक कक्षक तथा विपरीत बन्धी आण्विक कक्षक परमाणु कक्षकों के अंतर से बनते हैं।
प्रश्न 16.
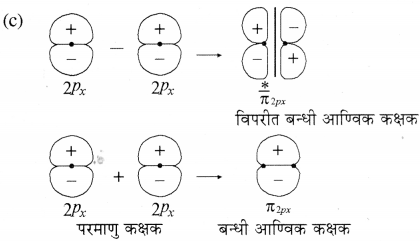
σ अणु कक्षक तथा अणु कक्षक में विभेद कीजिए।
उत्तर:
द्विपरमाणुक अणुओं में आण्विक कक्षकों को σ (सिग्मा), (पाई) तथा 8 ( डेल्टा ) इत्यादि नाम दिया गया है। σ आण्विक कक्षक बन्ध की अक्ष के परित: (around ) सममित होते हैं जबकि ग आण्विक कक्षक सममित नहीं होते। उदाहरण दो नाभिकों पर केन्द्रित 1s कक्षकों के रैखिक संयोग से दो आण्विक कक्षक σ1s तथा σ*1s कक्षक बनते हैं। z-अक्ष को अन्तरनाभिकीय अक्ष मानकर दो परमाणुओं 2p2 कक्षकों के रैखिक संयोग से भी दो ० आण्विक कक्षक बनते हैं जिन्हें σ2p, तथा σ*(2p.) आण्विक कक्षक कहते हैं। 2px तथा 2py कक्षकों के अतिव्यापन से बने आण्विक कक्षकों में आण्विक तल के ऊपर धनात्मक लोब तथा नीचे ऋणात्मक लोब होने के कारण ये आबन्ध अक्ष के परित: (around ) सममित नहीं होते। इन्हें तथा ग आण्विक कक्षक कहते हैं। बन्धी आण्विक कक्षकों में अन्तरानाभिकीय अक्ष के ऊपर तथा नीचे इलेक्ट्रॉन घनत्व अधिकतम होता है जबकि विपरीत बन्धी आण्विक कक्षक में नाभिकों के मध्य एक नोड होता है जहाँ पर इलेक्ट्रॉन घनत्व शून्य होता है। 1s, 2p, तथा 2px परमाणु कक्षकों के संयोग से बन्धी तथा विपरीत बन्धी आण्विक कक्षकों के बनने को निम्न प्रकार दर्शाया जाता है
प्रश्न 17.
निम्न का कारण बताइए:
(a) HF द्रव है जबकि HCl गैस।
(b) CH3OH तथा CH3COOH में सहसंयोजी बन्ध होते हुए, भी ये जल में विलेय हैं।
उत्तर:
(a) HF के अणु प्रबल अन्तरअणुक H-बन्ध द्वारा आकर्षित होकर पास-पास आ जाते हैं अतः यह द्रव है, जबकि HCl में अणुओं के मध्य दुर्बल वांडरवाल बल पाया जाता है अतः यह गैस है।
(b) C2H5OH तथा CH3COOH ध्रुवीय हैं अतः ये जल के साथ H-बन्ध बना लेते हैं, इसलिए ये जल में विलेय हैं।
प्रश्न 18.
NH3 में संकरण की व्याख्या कीजिए।
उत्तर:
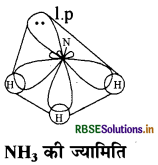
NH3 में N पर sp3 संकरण होता है:
तलस्थ अवस्था में N का इलेक्ट्रॉनिक विन्यास निम्न प्रकार होता
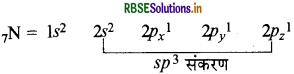
चार sp3 संकर कक्षकों में से तीन sp3 संकर कक्षकों में अयुग्मित इलेक्ट्रॉन होते हैं जबकि चौथे sp3 संकर में एक एकाकी इलेक्ट्रॉन युग्म होता है। नाइट्रोजन के तीन sp संकर कक्षक तीन हाइड्रोजन परमाणुओं के 1s कक्षकों के साथ अतिव्यापन करके तीन N-H आबंध बनाते हैं। एकाकी इलेक्ट्रॉन-युग्म तथा आबंधी इलेक्ट्रॉन युग्म (1.p-b.p) के बीच प्रतिकर्षण, आबंधी इलेक्ट्रॉन युग्म-आबंधी इलेक्ट्रॉन युग्म (b. p bp) की अपेक्षा अधिक होता है। इससे NH3 के अणु आबंध कोण 109.50 से घटकर 107° हो जाता है तथा अणु की ज्यामिति विकृत होकर पिरामिडी हो जाती है।
प्रश्न 19.
आण्विक कक्षक सिद्धान्त के मुख्य बिन्दु क्या हैं? समझाइए।
उत्तर:
- जिस प्रकार परमाणु में इलेक्ट्रॉन विभिन्न परमाणु कक्षकों में उपस्थित रहते हैं, उसी प्रकार अणु में इलेक्ट्रॉन विभिन्न आण्विक कक्षकों में उपस्थित रहते हैं।
- आण्विक कक्षक समान ऊर्जाओं एवं उपयुक्त सममिति वाले परमाणु कक्षकों के संयोग से बनते हैं।
- परमाणु कक्षक के इलेक्ट्रॉन एक ही नाभिक के प्रभाव में रहते हैं, जबकि आण्विक कक्षक के इलेक्ट्रॉन दो या दो से अधिक नाभिकों द्वारा प्रभावित होते हैं। अतः परमाणु कक्षक एककेंद्रीय होते हैं, जबकि आण्विक कक्षक बहुकेंद्रीय होते हैं।
- बनने वाले आण्विक कक्षकों की संख्या संयोग करने वाले परमाणु कक्षकों की संख्या के बराबर होती है। आण्विक कक्षक दो प्रकार के होते हैं- 'आबंधन आण्विक कक्षक' या 'बन्धी आण्विक कक्षक' तथा 'प्रतिआबंधन आण्विक कक्षक' या 'विपरीत बन्धी आण्विक कक्षक'।
- बन्धी आण्विक कक्षकों की ऊर्जा परमाणु कक्षकों की ऊर्जा से कम होती है। अतः उनका स्थायित्व संगत विपरीत बन्धी आण्विक कक्षक से अधिक होता है।
- जिस प्रकार किसी परमाणु के नाभिक के चारों ओर इलेक्ट्रॉन प्रायिकता वितरण परमाणु कक्षक द्वारा दिया जाता है, उसी प्रकार किसी अणु में नाभिकों के समूह के चारों ओर इलेक्ट्रॉन प्रायिकता वितरण आण्विक कक्षक द्वारा दिया जाता है।
- परमाणु कक्षकों की भाँति आण्विक कक्षकों में भी पाउली के नियम तथा हुंड के नियम के अनुसार ऑफबाऊ सिद्धान्त का पालन करते हुए इलेक्ट्रॉन भरे जाते हैं।
प्रश्न 20.
N2 में आबन्ध कोटि 3 होती है तथा यह प्रति चुम्बकीय होता है इसकी व्याख्या आण्विक कक्षक सिद्धान्त के आधार पर कीजिए।
उत्तर:
N का तलस्थ अवस्था विन्यास निम्न प्रकार होता है:
7N = 1s2 2s2 2p3
अतः अणु कक्षक आरेख के अनुसार
N2 का इलेक्ट्रॉनिक विन्यास
= (σls)2 (σ*1s)2 (σ2s)2 (σ*2s)2
(π2px)* = (π2py) 2 (σ2pz) 2
आबन्ध कोटिं = 1/2 (Nb - Na)
= (10 - 4) = 3
अत: N2 की आबन्ध कोटि = 3 तथा इससे सभी इलेक्ट्रॉन युग्मित होने के कारण यह प्रतिचुम्बकीय होता है।
विभिन्न प्रतियोगी परीक्षाओं में पछे गये प्रश्न:
प्रश्न 1.
निम्न में से किस स्पीशीज में अयुग्मित इलेक्ट्रॉन उपस्थित हैं?
(a) O22-
(b) N2
(c) O2
(d) F2
उत्तर:
(c) O2

प्रश्न 2.
निम्न में से किसका गलनांक सबसे अधिक है:
(a) BeCl2
(b) MgCl2
(c) CaCl2
(d) BaCl2
उत्तर:
(d) BaCl2
प्रश्न 3.
इनमें से कौनसा आयनिक यौगिक के लिए सही कथन नहीं है:
(a) उच्च गलनांक
(b) निम्न जालक ऊर्जा
(c) कार्बनिक यौगिक में कम विलेयता
(d) जल में घुलनशील है।
उत्तर:
(b) निम्न जालक ऊर्जा
प्रश्न 4.
मैग्नीशियम एक तत्व (X) से अभिक्रिया करके एक आयनिक यौगिक बनाता है। यदि (X) का निम्नतम अवस्था में इलेक्ट्रिक विन्यास 1s2 2s2 2p3 है, तो इस यौगिक का सामान्य सूत्र है:
(a) Mg2X3
(b) MgX2
(c) Mg2X
(d) Mg3X2
उत्तर:
(d) Mg3X2
प्रश्न 5.
निम्न में से किस स्पीशीज के केन्द्रीय परमाणु पर एकाकी इलेक्ट्रॉन युग्मों की संख्या अधिकतम है:
(a) SF4
(b) XeF4
(c) I3-
(d) XiCl4
उत्तर:
(c) I3-
प्रश्न 6.
निम्न में से किस अणु में बन्ध कोण का मान न्यूनतम है?
(a) NCIl3
(b) PCl3
(c) AsCl3
(d) SbCl3
उत्तर:
(d) SbCl3
प्रश्न 7.
बेन्जीन में बन्ध कोण तथा बन्ध लम्बाई है
(a) 180° तथा 1.20 A
(b) 120° तथा 1.34 Å
(c) 120° तथा 1.39 A
(d) 120° तथा 1.54 A
उत्तर:
(c) 120° तथा 1.39 A
प्रश्न 8.
सहसंयोजी और उपसहसंयोजी दोनों प्रकार के बन्ध उपस्थित हैं:
(a) BF3. NH3
(b) CH2Cl
(c) C2H4
(d) CH3 NH2
उत्तर:
(a) BF3. NH3
प्रश्न 9.
किस निम्न युग्म में द्विध्रुव प्रेरित द्विध्रुव अन्योन्य क्रिया होगी:
(a) SiF4 और He परमाणु
(b) H2O और एल्कोहल
(c) Cl2 और CCl4
(d) HCl और He परमाणु
उत्तर:
(d) HCl और He परमाणु
प्रश्न 10.
O2 H2O2 तथा O, में O-O बन्ध लम्बाई का घटता क्रम है:
(a) O3 > H2O2 > O2
(b) O2 > H2O2 > O3
(c) H2O2 > O3 > O2
(d) O2 > O > H2O2
उत्तर:
(c) H2O2 > O3 > O2
प्रश्न 11.
CaH2, BeH2, BaH2 में आयनिक प्रकृति का क्रम है:
(a) BeH2 < CaH2 < BaH2
(b) CaH2 < BeH2 < BaH2
(c) BeH2 < BaH2 < CaH2
(d) BaH2 < BeH < CaH2
उत्तर:
(a) BeH2 < CaH2 < BaH2
प्रश्न 12.
परक्लोरेट आयन में सभी चार सिग्मा बंध होते हैं:
(a) sp3 - sp3 बंध
(b) sp3 - p बंध
(c) sp2 - sp2 बंध
(d) sp2 - p बंध
उत्तर:
(c) sp2 - sp2 बंध
प्रश्न 13.
निम्न अणुओं में से किस में आबन्ध नहीं है:
(a) NO2
(b) CO2
(c) H2O
(d) SO2
उत्तर:
(c) H2O
प्रश्न 14.
निम्न में से किस बन्ध की ऊर्जा न्यूनतम है?
(a) C - H
(b) N - H
(c) O-H
(d) F - H
उत्तर:
(a) C - H
प्रश्न 15.
XeF2 समसंरचनात्मक है:
(a) BuCl2 के
(b) TeF2 के
(c) ICI2 के
(d) SbCl3 के
उत्तर:
(c) ICI2 के

प्रश्न 16.
निम्नलिखित में से गलत सुमेलित युग्म है:
|
अणु |
संरचना |
|
(a) BrF |
त्रिकोणीय द्विपिरामिडीय |
|
(b) SF4 |
सी-साँ |
|
(c) ClF3 |
T-आकार |
|
(d) NH3 |
चतुष्फलकीय |
|
(e) NH |
त्रिकोणीय पिरामिडीय |
उत्तर:
(a) BrF त्रिकोणीय द्विपिरामिडीय
प्रश्न 17.
H2S, NH3, BF3, तथा SiH4 में बन्ध कोणों का बढ़ता हुआ सही क्रम है:
(a) H2S < NH3 < SiH4 < BF3
(b) NH3 < H2S < SiH4 < BF3
(c) H2S < SiH4 < NH3 < BF3
(d) H2S < NH3 < BF3 < SiH4
उत्तर:
(a) H2S < NH3 < SiH4 < BF3
प्रश्न 18.
निम्नलिखित युग्मों में से किसमें दोनों स्पीशीज सम-संरचनात्मक नहीं हैं:
(a) CO32- और NO3-
(b) PCl4+ और SiCl4
(c) PFs और BrFs
(d) AIF63- और SF6
उत्तर:
(c) PFs और BrFs
प्रश्न 19.
निम्नलिखित युग्मों में से किसमें दोनों स्पीशीज समसंरचनात्मक नहीं हैं?
(a) SiCl तथा PCl
(b) PFs तथा BrFs
(c) AIF 3- तथा SF
(d) CO32- तथा NO3-
उत्तर:
(b) PFs तथा BrFs
प्रश्न 20.
पंचकोणीय द्विपिरामिडीय संरचना में बन्ध कोण होते हैं:
(a) 120°, 90°, 180°
(b) 120°, 72°, 180°
(c) 72°, 90°, 120°
(d) 72°, 90°, 180°
उत्तर:
(d) 72°, 90°, 180°
प्रश्न 21.
NO2+ NO3- और NH4+ में नाइट्रोजन के परमाण्विक कक्षकों के संकरण हैं, क्रमशः
(a) sp2, sp और sp3
(b) sp, sp3 और sp2
(c) sp2, sp3 और sp
(d) sp, sp2 और sp3
उत्तर:
(d) sp, sp2 और sp3
प्रश्न 22.
निम्न में से किसमें आबन्ध लम्बाई न्यूनतम होगी?
(a) O22-
(b) O2-
(c) O2+
(d) O2
उत्तर:
(b) O2-
प्रश्न 23.
निम्नलिखित त्रिपरमाण्विक प्रजातियों में बंध कोण का बढ़ता हुआ सही क्रम है:
(a) NO2+ < NO2 < NO2-
(b) NO2+ < NO2- < NO2
(c) NO2- < NO2+ < NO2
(d) NO2- < NO2 < NO2
उत्तर:
(b) NO2+ < NO2- < NO2
प्रश्न 24.
CIF3 की संरचना में केन्द्रीय परमाणु 'Cl' पर एकाकी युग्म इलेक्ट्रॉनों की संख्या है:
(a) एक
(b) दो
(c) चार
(d) तीन
उत्तर:
(d) तीन
प्रश्न 25.
ऑक्सीजन की प्रजाति के युग्म तथा उनके चुम्बकीय गुण उनके साथ दिए गए हैं। निम्न में से कौनसा मिलान सही है:
(a) O2+, O2- दोनों अनुचुम्बकीय
(b) O, O22- दोनों अनुचुम्बकीय
(c) O2 O22- दोनों प्रतिचुम्बकीय
(d) O+, O22- दोनों अनुचुम्बकीय
उत्तर:
(a) O2+, O2- दोनों अनुचुम्बकीय
प्रश्न 26.
चार द्विपरमाण्विक प्रजाति विभिन्न क्रम में नीचे दी गई है। इनमें से कौन बंध क्रम का बढ़ता हुआ सही क्रम प्रदर्शित करता है:
(a) C2-2 < He+ < NO < O2
(b) He2+ < O2- < NO < C
(c) O-2 < NO < C2-2 < He+2
(d) NO < C2-2 < O-2 < He+2
उत्तर:
(b) He2+ < O2- < NO < C
प्रश्न 27.
जब दो परमाणु कक्षक संयुक्त होते हैं तो बनायेंगे-
(a) एक अणु कक्षक
(b) अणु कक्षक
(c) तीन अणु कक्षक
(d) चार अणु कक्षक
उत्तर:
(b) अणु कक्षक
प्रश्न 28.
निम्न में से कौनसी स्पीशीज प्रतिचुम्बकीय है?
(a) H2-
(b) H2
(c) H2
(d) He2+
उत्तर:
(b) H2
प्रश्न 29.
सल्फेट ( SO2-4) आयन की आकृति है:
(a) त्रिकोणीय समतल
(b) षट्कोणीय
(c) चतुष्फलकीय
(d) वर्गाकार समतलीय
उत्तर:
(d) वर्गाकार समतलीय
प्रश्न 30.
कौनसा संयोग उपसहसंयोजी सहसंयोजी व बन्ध को सर्वश्रेष्ठ प्रकार से वर्णित करता है:
(a) H+ + H2O
(b) Cl + Cl
(c) Mg + 1⁄2 O2
(d) H2 + I2
उत्तर:
(c) Mg + 1⁄2 O2
प्रश्न 31.
माना कि 25-2p मिश्रण कार्यकारी नहीं है, निम्न में से अनुचुम्बकीय प्रजातियाँ हैं:
(a) Be2
(b) B2
(c) C2
(d) N2
उत्तर:
(c) C2
प्रश्न 32.
I3- आयन में इलेक्ट्रॉनों के एकाकी युग्म की कुल संख्या होगी:
(a) 6
(b) 9
(c) 12
(d) 3
उत्तर:
(d) 3
प्रश्न 33.
हाइड्रोजन बन्ध निम्न परिघट्टन / परिघट्टनों में केन्द्रीय भूमिका निभाता है:
(a) बर्फ पानी में तैरती है।
(b) जलीय विलयन में तृतीयक एमीन की अपेक्षा प्राथमिक एमीन की अधिक लुईस क्षारकता
(c) एसीटिक अम्ल की अपेक्षा फार्मिक अम्ल अधिक अम्लीय है।
(d) बेन्जीन में एसीटिक अम्ल का द्विलकीकरण
उत्तर:
(a) बर्फ पानी में तैरती है।
प्रश्न 34.
अणु कक्षक सिद्धान्त (Molecular Orbital Theory) के अनुसार
(a) C1⁄2 प्रत्याशित रूप से प्रतिचुम्बकीयं (diamagnetic) है।
(b) O2+ की आबंध लम्बाई (bond length) प्रत्याशित रूप से O2 की आबंध लम्बाई से लम्बी है।
(c) N1⁄2 तथा N2 की आबंध कोटि (bond order) समान है।
(d) He1⁄2 की ऊर्जा दो एकल ( isolated) He परमाणुओं की ऊर्जा के समान है।
उत्तर:
(d) He1⁄2 की ऊर्जा दो एकल ( isolated) He परमाणुओं की ऊर्जा के समान है।
प्रश्न 35.
सूची-I (List-I) के प्रत्येक संकर कक्षक (hybrid orbitals) के सेट को सूची-II ( List - II) में दिए गए संकुल (संकुलों) के साथ सुमेल करें:
|
सूची-I |
सूची-II |
|
P. dsp2 |
1. [FeF6]4 |
|
Q. sp3 |
2. [Ti(H2O)3Cl3] |
|
R. sp3d2 |
3. [Cr(NH3)6]3+ |
|
S. d2sp3 |
4. [FeCl4]2 |
|
|
5. Ni (CO)4 |
|
|
6. [Ni(CN)4]2- |
उत्तर:
|
सूची-I |
सूची-II |
|
P.dsp2 |
6. [Ni(CN)4]2 |
|
Q. sp3 |
4. [FeCl4]2 5. Ni (CO)4 |
|
R. sp3d2 |
1. [FeF6]4 |
|
S. d2sp3 |
2. [Ti(H2O)3Cl3] 3. [Cr(NH3)6]3+ |
