RBSE Class 8 Science Important Questions Chapter 4 पदार्थ धातु और अधातु
Rajasthan Board RBSE Class 8 Science Important Questions Chapter 4 पदार्थ धातु और अधातु Important Questions and Answers.
RBSE Class 8 Science Chapter 4 Important Questions पदार्थ धातु और अधातु
बहुचयनात्मक प्रश्न:
प्रश्न 1.
निम्न में से अधातु है।
(अ) आयरन (लोहा)
(ब) सल्फर (गंधक)
(स) ऐलुमिनियम
(द) कॉपर
उत्तर:
(ब) सल्फर (गंधक)

प्रश्न 2.
निम्न में से आघातवर्धनीय नहीं है।
(अ) लोहा
(ब) ऐलुमिनियम
(स) पेंसिल लेड
(द) सिल्वर (चाँदी)
उत्तर:
(स) पेंसिल लेड
प्रश्न 3.
सक्रिय अधातु जो वायु में खुला रखने पर आग पकड़ लेती है, वह है।
(अ) सोडियम
(ब) पोटैशियम
(स) जिंक
(द) फास्फोरस
उत्तर:
(द) फास्फोरस
प्रश्न 4.
अधातु जो हमारे जीवन के लिए आवश्यक है और जिसे सभी सजीव श्वसन के समय अन्दर लेते हैं, वह है।
(अ) ऑक्सीजन
(ब) कार्बन डाइऑक्साइड
(स) नाइट्रोजन
(द) हाइड्रोजन
उत्तर:
(अ) ऑक्सीजन
प्रश्न 5.
सोडियम धातु को सामान्य ताप पर जिस द्रव में रखते हैं, वह है।
(अ) पेट्रोल
(ब) जल
(स) मिट्टी का तेल
(द) नींबू का रस
उत्तर:
(स) मिट्टी का तेल
रिक्त स्थानों की पूर्ति:
प्रश्न 1.
................और धातु नरम होते हैं और उन्हें चाकू से काटा जा सकता है।
उत्तर:
सोडियम, पोटैशियम

प्रश्न 2.
सामान्यतः धात्विक ऑक्साइड ............... प्रकृति के होते हैं।
उत्तर:
क्षारीय
प्रश्न 3.
आयरन जल से ................. अभिक्रिया करता है।
उत्तर:
धीमी
प्रश्न 4.
............... जल के साथ तीव्र अभिक्रिया करता है।
उत्तर:
सोडियम।
सत्य / असत्य:
निम्नलिखित कथन यदि सही हैं तो ' T ' और यदि गलत हैं तो ' F लिखिए:
प्रश्न 1.
गंधक विद्युत का सुचालक है।
उत्तर:
असत्य
प्रश्न 2.
मर्करी (पारा) कमरे के तापमान पर द्रव अवस्था में पाया जाता है।
उत्तर:
सत्य
प्रश्न 3.
मैंग्नीशियम के ऑक्साइड की प्रकृति क्षारीय होती है।
उत्तर:
सत्य

प्रश्न 4.
आयरन जल से तीव्र अभिक्रिया करता है।
उत्तर:
असत्य
प्रश्न 5.
सामान्यतः अधातु अम्लों से अभिक्रिया नहीं करते।
उत्तर:
सत्य
प्रश्न 6.
फॉस्फोरस जल से तीव्र अभिक्रिया करता है।
उत्तर:
सत्य
'कॉलम - A' में दिए गए शब्दों का मिलान 'कॉलम - B' से कीजि:
प्रश्न 1.
|
कॉलम - A |
कौलम - B |
|
(i) CUSO4 |
(a) आयरन सल्फेट |
|
(ii) ZnSO4 |
(b) कॉपर सल्फेट |
|
(iii) FeSO4 |
(c) सल्फ्यूरिक अम्ल |
|
(iv) H2SO4 |
(d) ज़िक सल्फेट |
उत्तर:
|
कॉलम - A |
कौलम - B |
|
(i) CUSO4 |
(b) कॉपर सल्फेट |
|
(ii) ZnSO4 |
(d) ज़िक सल्फेट |
|
(iii) FeSO4 |
(a) आयरन सल्फेट |
|
(iv) H2SO4 |
(c) सल्फ्यूरिक अम्ल |

प्रश्न 2.
|
कॉलम - A |
कौलम - B |
|
(i) 'पॉप' ध्वनि |
(a) पारा |
|
(ii) द्रव धातु |
(b) कॉपर सल्फेट |
|
(iii) नीला रंग |
(c) हाइड्रोजन गैस |
|
(iv) नरम धातु |
(d) पोटैशियम |
उत्तर:
|
कॉलम - A |
कौलम - B |
|
(i) 'पॉप' ध्वनि |
(c) हाइड्रोजन गैस |
|
(ii) द्रव धातु |
(a) पारा |
|
(iii) नीला रंग |
(b) कॉपर सल्फेट |
|
(iv) नरम धातु |
(d) पोटैशियम |
प्रश्न 3.
|
कॉलम - A |
कौलम - B |
|
(i) ऑक्सीजन |
(a) एंटीबायोटिक |
|
(ii) नाइट्रोजन |
(b) उर्वरक |
|
(iii) ओजोन |
(c) श्वसन |
|
(iv) आयोडीन |
(d) जल शुद्धिकरण |
उत्तर:
|
कॉलम - A |
कौलम - B |
|
(i) ऑक्सीजन |
(c) श्वसन |
|
(ii) नाइट्रोजन |
(b) उर्वरक |
|
(iii) ओजोन |
(d) जल शुद्धिकरण |
|
(iv) आयोडीन |
(a) एंटीबायोटिक |
अतिलघूत्तरात्मक प्रश्न:
प्रश्न 1.
आघातवर्धनीयता (malleability) से क्या आशय है?
उत्तर:
धातुओं का वह गुण जिसके कारण उन्हें पीटकर शीट में परिवर्तित किया जा सकता है, आघातवर्धनीयता कहलाता है।

प्रश्न 2.
तन्यता (ductility) किसे कहते हैं?
उत्तर:
धातुओं का वह गुण जिससे उन्हें खींचकर तारों में परिवर्तित किया जा सकता है, तन्यता कहलाता है।
प्रश्न 3.
मैग्नीशियम की ऑक्सीजन के साथ निम्न अभिक्रिया को पूरा करिए
Mg मैग्नीशियम (O2 ) ऑक्सीजन → ?
उत्तर:
2 मैग्नीशियम Mg + ऑक्सीजन O2 = मैग्नीशियम ऑक्साइड 2MgO
प्रश्न 4.
आयरन की ऑक्सीजन के साथ निम्नलिखित अभिक्रिया को पूरा कीजिए-
आयरन Fe + ऑक्सीजन O2 जल (H2O) →?
उत्तर:
- 2 आयरन (Fe) + ऑक्सीजन (O2) + 2 जल (H2O) → आयरन हाइड्रोक्साइड 2(Fe(H2O))
प्रश्न 5.
पॉप (pop) ध्वनि से क्या आशय है?
उत्तर:
हाइड्रोजन गैस को जलाने पर जो ध्चनि निकलती है, उसे पॉप ध्वनि कहते हैं।
प्रश्न 6.
धातु सोडियम हाइड्रॉक्साइड से क्रिया करने पर कौनसी गैस देते हैं?
उत्तर:
हाइड्रोजन गैस।
प्रश्न 7.
उस अधातु का नाम लिखिए जिसका उपयोग उर्वरकों में पौधों की वृद्धि हेतु किया जाता है।
उत्तर:
नाइट्रोजन।
प्रश्न 8.
उस अधातु का नाम लिखिए जिसका बैंगनी रंग का विलयन एंटीबायोटिक के रूप में घावों पर लगाया जाता है।
उत्तर:
आयोडीन।
प्रश्न 9.
वह अधातु कौनसी है जिसका उपयोग जल के शुद्धिकरण प्रक्रम में किया जाता है?
उत्तर:
ओओोन ।
प्रश्न 10.
दो ऐसी धातुओं के नाम लिखिए जिन्हें चाकू से सरलता से काटा जा सकता है।
उत्तर:
- सोडियम
- पोटैशियम।
लघूत्तरात्मक प्रश्न:
प्रश्न 1.
आघातवर्धनीयता किसे कहते हैं? इसके कारण ही एक धातु को मिठाइयों को सजाने में उपयोग किया जाता है। उस धातु का नाम लिखिए।
उत्तर:
आघातवर्धनीयता: धातुओं का वह गुण जिसके कारण उन्हें पीटकर शीट में परिवर्तित किया जा सकता है, आघातवर्धनीयता कहलाता है। इस गुण के कारण ही चांदी के वर्क बनाकर उनका उपयोग मिठाइयों को सजाने में किया जाता है।

प्रश्न 2.
धातु किसे कहते हैं? उदाहरण द्वारा समझाइए।
उत्तर:
धातु - वे पदार्थ जो कठोर, चमकीले, आधातवर्ध्य, तन्य, ध्वानिक और ऊष्मा तथा विद्युत के सुचालक होते हैं, धातु कहलाते हैं। जैसे -आयरन, कॉपर, एलुमिनियम आदि में उपरोक्त सभी गुण पाये जाते हैं अतः उन्हें धातु कहते हैं।
प्रश्न 3.
अधातु किसे कहते हैं? उदाहरण द्वारा समझाइए।
उत्तर:
अधातु: वे पदार्थ जो दिखने में मलिन हैं तथा नरम हैं व हथौड़े की हल्की चोट से टूटकर चूरा हो जाते हैं, ध्वानिक नहीं हैं तथा ऊष्मा व विद्युत के कुचालक हैं, अधातु कहलाते हैं। जैसे कोयला, सल्फर, ऑक्सीजन, फोस्फोरस आदि अधातु हैं।
प्रश्न 4.
धातुएँ ध्वानिक हैं। इससे क्या आशय है?
उत्तर:
ध्वानिकता: धातुओं की वस्तुओं को जब कठोर सतह से टकराया जाता है तो एक निनाद ध्वनि उत्पन्न होती है। जैसे मंदिरों में घंटियाँ बजती हैं तब यह ध्वनि निकलती है। अत: धातु गायन ध्वनियाँ उत्पन्न करते हैं। इसी आधार पर धातुओं को ध्वानिक कहते हैं।
प्रश्न 5.
धात्विक ऑक्साइड की प्रकृति अम्लीय है या क्षारीय? समझाइए।
उत्तर:
धात्विक ऑक्साइड की प्रकृति क्षारीय होती है। इसे हम निम्न प्रयोग द्वारा समझ सकते हैं।
प्रयोग: एक मैग्नीशियम रिबन को जलाकर उसकी राख प्राप्त करते हैं। राख को जल में विलय कर लेते हैं तथा इस विलयन में लाल लिटमस पत्र को डालते हैं। हम देखते हैं कि लाल लिटमस पत्र नीला हो जाता है जो यह बताता है कि धातिवक ऑक्साइड क्षारीय प्रकृति के होते हैं।
प्रश्न 6.
क्या अधातुओं के ऑक्साइड अम्लीय प्रकृति के होते हैं? एक प्रयोग द्वारा समझाइए।
उत्तर:
अधातुओं के ऑक्साइड सामान्यतया अम्लीय प्रकृति के होते हैं। इसे हम निम्न प्रयोग द्वारा समझ सकते हैंप्रयोग-एक उद्दहन चम्मच में थोड़ा:
सा सल्फर लेकर उसे गर्म करते हैं। जैसे ही सल्फर जलना प्रारम्भ करे इसे काँच के एक गिलास में ले जाते हैं तथा गिलास को ढक्कन से बन्द् कर देते हैं। गिलास में थोड़ा जल डालते हैं तथा उसे तुरन्त बन्द करके हिलाते हैं। सल्फर व ऑक्सीजन की क्रिया से बनने वाला पदार्थ सल्फर डाइऑक्साइड है तथा यह जल में विलेय होकर सल्फ्यूरस अम्ल बनाता है। सल्फ्यूरस अम्ल नीले लिटमस पत्र को लाल कर देता है। इससे निष्कर्ष निकलता है कि सामान्यतया अधातुओं के ऑक्साइड अम्लीय प्रकृति के होतें हैं।

प्रश्न 7.
क्या धातु तथा अधातु जल के साथ क्रिया करते हैं? समझाइए।
उत्तर:
धातुओं की जल के साध क्रिया: कुछ धातु सोडियम आदि जल के साथ तीव्र अभिक्रिया करते हैं तथा सोडियम ऑक्साइड बनाते हैं। किन्तु अधिकतर धातुओं की जल के साथ अभिक्रिया नहीं होती है। आयरन जल के साथ धीमी अभिक्रिया करता है।
अधातुओं की जल से क्रिया: सामान्यतया अधातु जल से अभिक्रिया नहीं करते हैं इसीलिए कुछ अधातु जो वायु में सक्रिय हो जाते हैं, उन्हें जल में रखते हैं। जैसे फॉस्फोरस एक काफी सक्रिय अधातु है, उसे जल में रखते हैं।
प्रश्न 8.
धातुओं की अम्लों से अभिक्रिया किस प्रकार होती है?
उत्तर:
धातु सामान्यतया अम्लों के साथ अभिक्रिया करके हाइड्रोजन गैस देते हैं। इसके परीक्षण के लिए यदि इस गैस को जलाया जाता है तो यह पॉप ध्वनि के साथ जलती है। सामान्यतया अधातुओं की अम्लों के साथ अभिक्रिया नहीं होती है। धातुओं के साथ अम्ल निम्न प्रकार क्रिया करते हैं (Fe) + (H2SO4) → (FeSO4) +(H2S) (आयरन) (सल्फ्यूरिक अम्ल) फेरस सल्फेट हाइड्रोजन
प्रश्न 9.
धातुओं की क्षारों (Bases) के साथ होने वाली अभिक्रिया को समझाइए।
उत्तर:
धातुओं की क्षारों के साथ अभिक्रिय: धातु क्षारों के साथ अभिक्रिया करके हाइड्रोजन गैस उत्पन्न करते हैं। इसे हम निम्न प्रयोग से समझ सकते हैं।
प्रयोग: एक परखनली में सोडियम हाइड्रॉक्साइड का ताजा विलयन लेकर इसमें एलुमिनियम की पन्नी का टुकड़ा डालिए तथा एक जलती हुई माचिस की तीली को परखनली के निकट ले जाइए। हम देखेंगे कि हमें पॉप ध्वनि सुनाई देती है जो हाइड्रोजन गैस की उपस्थिति दर्शाती है। अतः यह कहा जा सकता है कि धातु क्षारों के साथ क्रिया करके हाइड्रोजन गैस देते हैं।

प्रश्न 10.
आप किस प्रकार सिद्ध करोगे कि रासायनिक दृष्टि से सिल्वर, कॉपर से कम अभिक्रियाशील है?
उत्तर:
सिल्वर धातु की एक छड़ लेकर उसे कॉपर नाइट्रेट के नीले रंग के विलयन में डुबोकर कुछ समय के लिए रख देते हैं। उसमें कोई विस्थापन अभिक्रिया नहीं होगी तथा सिल्वरर की छड़ और कॉपर नाइट्रेट का नीला विलयन ज्यों के त्यों अपरिवर्तित रहते हैं। चूँकि सिल्वर धातु, कॉपर नाइट्रेट के विल्यन में से कॉपर धातु को विस्थापित नहीं कर सकती, इससे पता चलता है कि सिल्वर धातु कॉपर धातु से कम अभिक्रियाशील है।
प्रश्न 11.
यदि निम्नलिखित धातुओं की कॉपर सल्फेट विलयन के साथ कोई अभिक्रिया होती है तो उन्हें बताइए-
(i) कॉपर
(ii) जिंक।
उत्तर:
(i) कॉपर धातु की स्वयं की अपने लवण के विलयन (कॉपर सल्फेट विलयन) के साथ कोई अभिक्रिया नहीं होती।
(ii) जिंक धातु, कॉपर धातु से अधिक अभिक्रियाशील होती है। इसलिए वह कॉपर सल्फेट के विलयन में से कॉपर धातु को विस्थापित कर देती है। इस प्रक्रिया के दौरान कॉपर सल्फेट का नीला रंग उड़ जाता है।
कॉपर सल्फेट (CUSO4) + जिंक (Zn) →
जिंक सल्फेट (ZNSO4) + कॉपर (CU)
प्रश्न 12.
धातुओं के प्रमुख उपयोग लिखिए।
उत्तर:
धातुओं के उपयोग:
- धातुओं का उपयोग मशीनें, मोटर गाड़ियाँ, वायुयान, रेलगाड़ियों आदि के निर्माण में होता है।
- धातुओं का उपयोग उपग्रह निर्माण में किया जाता है।
- औद्योगिक साजो-सामान, खाना बनाने के पात्रों का निर्माण धातुओं से होता है।
- जल बॉयलरों का निर्माण धातुओं से होता है।

प्रश्न 13.
अधातुओं का हमारे जीवन में क्या उपयोग है?
उत्तर:
अधातुओं का उपयोग:
- हम श्वसन के लिए जो प्राणवायु लेते हैं उसका निर्माण आक्सीजन से होता है, जो अधातु है।
- नाइट्रोजन, फॉस्फोरस आदि अधातुओं से उर्वरक का निर्माण होता है जो पौधों की वृद्धि के लिए आवश्यक है।
- जल के शुद्धिकरण में ओजोन(O3) का उपयोग होता है।
- गंधक (सल्फर) का उपयोग कवकनाशी के रूप में होता है तथा इससे बारूद (गन पाउडर) बनाया जाता है जो पटाखीं में भी प्रयुक्त होती है।
प्रश्न 14.
यदि फॉस्फोरस को जल के बजाय वायु में खुला रखा जाये तो क्या होगा?
उत्तर:
फॉस्फोरस एक बहुत सक्रिय धातु है। वायु में खुला रखने पर यह ऑक्सीजन से क्रिया कर आग पकड़ लेगा। इसीलिए फॉस्फोरस को जल में रखा जाता' है।
निबन्धात्मक प्रश्न:
प्रश्न 1.
पदार्थ A तथा B की अभिक्रिया से सल्फर डाइऑक्साइड गैस बनती है जिसे जल में विलेय करने पर C प्राप्त होता है। पदार्थ A, B तथा C का नाम लिखते हुए अभिक्रिया का रासायनिक समीकरण बीजिए।
उत्तर:
पदार्थ A = सल्फर; B = ऑक्सीजन; C = सल्फ्यूरस अम्ल
समीकरण:
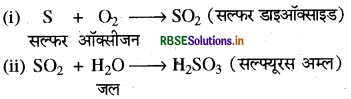
प्रश्न 2.
धातुओं में विस्थापन अभिक्रियाओं को समझाइए।
उत्तर:
धातुओं में विस्थापन अभिक्रियाएँ:
हम जानते हैं कि एक धातु दूसरी धातु को उसके यौगिक के जलीय विलयन से विस्थापित करती है किन्तु यह क्रिया सामान्य नहीं है। इसमें अधिक अभिक्रियाशील धातु कम अभिक्रियाशील धातु को प्रतिस्थापित कर सकती है किन्तु कम अभिक्रियाशील धातु अधिक अभिक्रियाशील धातु को प्रतिस्थापित नहीं कर सकती। इसे हम अग्र प्रकार समझ सकते हैं।
100 मिली. के पाँच बीकर लेकर उन्हें A, B, C, D और E द्वारा चिन्हित कर लेते हैं। प्रत्येक बीकर में लगभग 50 ml जल लेते हैं। बीकर A में एक चम्मच कॉपर सल्फेट तथा जिंक का टुकड़ा; बीकर B में कॉपर सल्फेट तथा लोहे की कील; बीकर C में जिंक सल्फेट + ताँबे की छीलन; बीकर D में आयरन सल्फेट + ताँबे की छीलन तथा बीकर E में जिंक सल्फेट तथा लोहे की कील डालकर इन्हें चम्मच से घोलकर कुछ समय के लिए रख देते हैं। अवलोकन करने पर हम देखते हैं कि बीकर A में जिंक, कॉपर सल्फेट विलयन से कॉपर को विस्थापित करता है। इसी कारण कॉपर सल्फेट का नीला रंग अंदृश्य हो जाता है तथा बीकर के पैंदे पर कॉपर का लाल चूर्ण जमा हो जाता है। इसी प्रकार बीकर ' B ' में भी कॉपर सल्फेट का नीला रंग अदृश्य हो जाता है। इनकी क्रियाएँ निम्न प्रकार होती हैं
CuSO4 + Zn → ZnSO4 + Cu (लाल)
CuSO4 + Fe → FeSO4 + Cu (लाल)
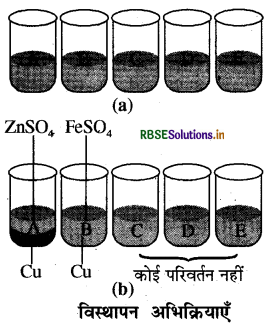
किन्तु बीकर C, D व E में कोई परिवर्तन दिखाई नहीं देता है। बीकर C में Cu जिंक सल्फेट से जिंक को प्रतिस्थापित करने में सक्षम नहीं है जबकि जिंक कॉपर को प्रतिस्थापित कर देता है। इसका कारण यह है कि जिंक कॉपर व आयरन से अधिक अभिक्रियाशील है। एक अधिक अभिक्रियाशील धातु कम अभिक्रियाशील धातु को प्रतिस्थापित कर सकती है किन्तु कम अभिक्रियाशील धातु अधिक अभिक्रियाशील धातु को विस्थापित नहीं कर सकती है। यही कारण हैं कि बीक व D , E में भी विस्थापन अभिक्रियाएँ संपन्न नहीं हुईं।

प्रश्न 3.
धातुओं तथा अधातुओं में अन्तर स्पष्ट कीजिए।
उत्तर:
|
धातुएँ |
अधातुएँ |
|
1. धातुएँ ऊष्मा तथा विद्युत की सुचालक होती हैं। |
1. अधातुएँ ऊष्मा तथा विद्युत की कुचालक होती हैं। (ग्रेफाइट, इसका अपवाद है जो अधातु होते हुए भी ऊष्मा तथा विद्युत का सुचालक है ।) |
|
2. धातुएँ आघातवर्ध्य तथा तन्य होती हैं। |
2. अधातुएँ न तो आघातवर्र्य होती है और न ही तन्य होती हैं। अधातुएँ भंगुर होती हैं। |
|
3. धातुएँ चमकदार होती हैं तथा उन पर पॉलिश की जा सकती है। |
3. अधातुएँ सामान्यतः चमक़दार नहीं होती तथा उन पर पॉलिश नहीं की जा सकती। |
|
4. धातुएँ ठोस होती हैं [केवल मर्करी (पारा) [केवल मर्करी (पारा) को होड़कर जो कि एक द्रव धातु है ]। |
4. अधातुएँ ठोस, द्रव तथा गैसें हो सकती हैं। |
|
5. धातुओं के गलनांक तथा क्वथनांक सामान्यतः उच्च होते हैं। |
5. अधातुओं के गलनांक तथा क्वथनांक अपेक्षाकृत निम्न होते हैं। |
|
6. धातुएँ क्षारीय ऑक्साइड बनाती हैं। |
6. अधातुएँ अम्लीय या ठदासीन ऑक्साइड बनाती हैं। |
|
7. धातुएँ सामान्यतः तनु अम्लों से हाइड्रोजन विस्थापित करती हैं। |
7. अधातुएँ तनु अम्लों में से हाइड्रोजन विस्थापित नहीं करर्ती। |
|
8. धातुएँ सामान्यतः हाइड्रोजन के साथ अभिक्रिया नहीं करती। के वल कुछ अत्यन्त अभिक्रियाशील धातुएँ ही हाइड्रोजन के साथ संयोग करके हाइड्राइड बनाती हैं। |
8. अधातुएँ हाइड्रोजन के साथ अभिक्रिया करके स्थायी हाइड्राइड बनाती है। |
