RBSE Class 11 Physics Important Questions 13 अणुगति सिद्धांत
Rajasthan Board RBSE Class 11 Physics Important Questions Chapter 13 अणुगति सिद्धांत Important Questions and Answers.
Rajasthan Board RBSE Solutions for Class 11 Physics in Hindi Medium & English Medium are part of RBSE Solutions for Class 11. Students can also read RBSE Class 11 Physics Important Questions for exam preparation. Students can also go through RBSE Class 11 Physics Notes to understand and remember the concepts easily.
RBSE Class 11 Physics Chapter 13 Important Questions अणुगति सिद्धांत
बहुचयनात्मक प्रश्न:
प्रश्न 1.
गैसों के अणुगति सिद्धान्त के सम्बन्ध में इनमें से कौनसा कथन सत्य है:
(अ) गैस का दाब अणुओं की माध्य चाल के अनुक्रमानुपाती होता है।
(ब) अणुओं की वर्ग- माध्य मूल चाल, दाब के अनुक्रमानुपाती होती है।
(स) प्रति अणु औसत ऊर्जा परम-ताप के अनुक्रमानुपाती होती है।
(द) इनमें से कोई नहीं।
उत्तर:
(स) प्रति अणु औसत ऊर्जा परम-ताप के अनुक्रमानुपाती होती है।
प्रश्न 2.
एक गैस द्वारा बर्तन की दीवार पर आरोपित बल का कारण यह है कि गैस के अणु:
(अ) अपनी गतिज ऊर्जा खो रहे हैं।
(ब) दीवारों से चिपक रहे हैं।
(स) दीवारों से टक्कर के कारण उनका संवेग बदल रहा
(द) दीवारों की ओर त्वरित हो रहे हैं
उत्तर:
(स) दीवारों से टक्कर के कारण उनका संवेग बदल रहा

प्रश्न 3.
ऑक्सीजन तथा हाइड्रोजन समान ताप T पर हैं। ऑक्सीजन के अणु की गतिज ऊर्जा हाइड्रोजन अणु की गतिज ऊर्जा की:
(अ) 16 गुनी होगी
(ब) 4 गुनी होगी
(स) बराबर होगी
(द) एक चौथाई होगी
उत्तर:
(स) बराबर होगी
प्रश्न 4.
समान ताप पर वर्ग माध्य मूल वेग का मान निम्न में से किस गैस के लिये न्यूनतम होगा:
(अ) ऑक्सीजन
(ब) कार्बन डाइऑक्साइड
(स) हाइड्रोजन
(द) नाइट्रोजन
उत्तर:
(ब) कार्बन डाइऑक्साइड
प्रश्न 5.
गैस का अणुओं का औसत मुक्त पथ समानुपाती होता है:
(अ) दाब के
(ब) ताप के
(स) आयतन के
(द) घनत्व के
उत्तर:
(ब) ताप के
प्रश्न 6.
किसी गैस के अणुओं के औसत मुक्त पथ तथा उसके घनत्व में सम्बन्ध होता है:
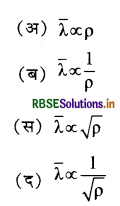
उत्तर:
\(\text { (ब) } \bar{\lambda} \propto \frac{1}{\rho}\)
प्रश्न 7.
किसी आदर्श गैस के दाब P तथा एकांक आयतन में गैस की औसत गतिज ऊर्जा E में सम्बन्ध होता है:
(अ) P = E
(ब) P = 1/2E
(स) P = 3/2E
(द) P = 2/3E
उत्तर:
(द) P = 2/3E
प्रश्न 8.
आदर्श गैस समीकरण में स्थिरांक R का SI मात्रक में सही मान है:
(अ) न्यूटन मीटर प्रति केल्विन प्रति मोल
(ब) जूल प्रति केल्विन प्रति मोल
(स) डाइन सेमी. प्रति डिग्री प्रति मोल
(द) लिटर प्रति मोल
उत्तर:
(अ) न्यूटन मीटर प्रति केल्विन प्रति मोल
प्रश्न 9.
गैसों के आंशिक दाब का नियम दिया था:
(अ) बॉयल ने
(ब) चार्ल्स ने
(स) डॉल्टन ने
(द) आवोगाद्रो ने
उत्तर:
(स) डॉल्टन ने
प्रश्न 10.
निम्न में से किस नियम को गतिज समीकरण द्वारा समझाया जाता है:
(अ) बॉयल का नियम
(ब) चार्ल्स का नियम
(स) आवागाद्रो का नियम
(द) उपर्युक्त सभी नियम
उत्तर:
(द) उपर्युक्त सभी नियम
प्रश्न 11.
अणुगति सिद्धान्त के आधार पर हम निम्न में से कौन-सा नियम ज्ञात नहीं कर सकते हैं:
(अ) चार्ल्स का नियम
(ब) बॉयल का नियम
(स) जूल का नियम
(द) ग्राहम का नियम
उत्तर:
(स) जूल का नियम

प्रश्न 12.
गैसों की अणुगति समीकरण होती है:
(अ) PV = 1/3mnV
(ब) PV = 1/3mn
(स) PV = 1/3mnC2
(द) PV = 3/2mnV
उत्तर:
(स) PV = 1/3mnC2
प्रश्न 13.
गैस द्वारा लगाया गया दाब उसके घनत्व के होता है:
(अ) समानुपाती
(ब) व्युत्क्रमानुपाती
(स) वर्ग के समानुपाती
(द) घनत्व पर निर्भर नहीं करता
उत्तर:
(अ) समानुपाती
प्रश्न 14.
आदर्श गैस समीकरण PV = nRT में R का मान निर्भर करता
(अ) गैस के दाब पर
(ब) गैस के ताप पर
(स) गैस की प्रकृति पर
(द) मापक इकाई पर
उत्तर:
(द) मापक इकाई पर
प्रश्न 15.
स्थिर आयतन पर एक अणुक गैस का दाब निर्भर करता है:
(अ) परम ताप पर
(ब) परमाणु क्रमांक पर
(स) दीवार की मोटाई पर
(द) संयोजकता (e) की संख्या पर
उत्तर:
(अ) परम ताप पर
प्रश्न 16.
ऊर्जा समविभाजन के नियम से द्विपरमाणुक गैस के एक अणु की औसत ऊर्जा का मान होगा:
(अ) 3/2KT
(ब) 5/2KT
(स) 3/2RT
(द) 5/2 RT
उत्तर:
(ब) 5/2KT
प्रश्न 17.
एक यदि गैस के तीन अणुओं के वेग क्रमशः √7, 4 और 5 मी./से. हों तो इनका वर्ग माध्य मूल वेग का मान मी./से. में होगा:

उत्तर:
(स) 4
प्रश्न 18.
एक स्वातंत्र्य कोटि वाली गैस के लिये रुद्धोष्म निष्पत्ति y = Cp/Cv होती है:
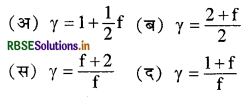
संकेत: Cv = 1/2fR Cp = 1/2(f + 2)R
\(\therefore \gamma=\frac{C_p}{C_V}=\frac{f+2}{f}\)
उत्तर:
\(\text { (स) } \gamma=\frac{f+2}{f}\)
प्रश्न 19.
ऑक्सीजन गैस के लिये मोलर विशिष्ट ऊष्माओं का अनुपात होगा:
(अ) 5/3
(ब) 7/4
(स) 4/3
(द) 7/5
संकेत: ऑक्सीजन गैस द्विपरमाणुक गैस है। इस कारण से इसके लिये स्वातंत्र्य कोटियाँ f = 5 होंगी
\(\frac{C_P}{C_{\mathrm{V}}}=\frac{\mathrm{f}+2}{\mathrm{f}}=\frac{5+2}{5}=\frac{7}{5}\)
उत्तर:
(द) 7/5
प्रश्न 20.
SI मात्रक में R का मान होगा:
(अ) 2 कैलोरी / मोल- K
(ब) 8.3 जूल / मोल - K
(स) 2 किलो कैलोरी / किलो मोल - K
(द) 8.3 x 103 जूल /किलो मोल - K
उत्तर:
(द) 8.3 x 103 जूल /किलो मोल - K

प्रश्न 21.
अणुगति सिद्धान्त से परम शून्य ताप पर अणुओं का वेग:
(अ) धनात्मक किन्तु नगण्य होता है
(ब) शून्य होता है
(स) अनन्त होता है
(द) इनमें से कोई नहीं
उत्तर:
(ब) शून्य होता है
प्रश्न 22.
यदि एक गैस बॉयल नियम का पालन करती है, तब PV तथा V के बीच ग्राफ का रूप किस तरह का होगा:
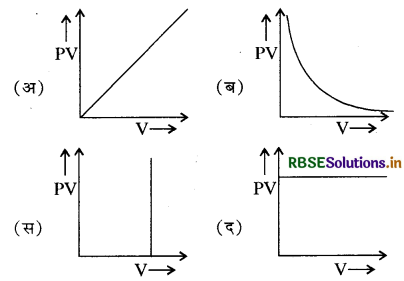
उत्तर:
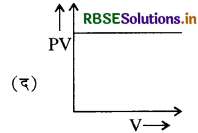
प्रश्न 23.
सामान्य ताप व दाब पर वर्ग माध्य मूल वेग का मान निम्न में से किस गैस के लिये अधिकतम होगा:
(अ) ऑक्सीजन
(ब) वायु
(स) हाइड्रोजन
(द) हीलियम
उत्तर:
(स) हाइड्रोजन
रिक्त स्थानों की पूर्ति कीजिए:
प्रश्न 1.
कोई गैस जो आदर्श गैस समीकरण का पालन नहीं करती है, उसे ......................... कहते हैं।
उत्तर:
वास्तविक गैस
प्रश्न 2.
नियत ताप पर गैस के किसी दिये गये द्रव्यमान का दाब उसके आयतन के ....................... होता है।
उत्तर:
व्युत्क्रमानुपाती

प्रश्न 3.
गैस के 1 ग्राम अणु में अणुओं की संख्या NA = 6.023 x 1023 प्रति ग्राम मोल होती है। इस संख्या को ही .......................... कहते हैं।
उत्तर:
आवोगाद्रो संख्या
प्रश्न 4.
नियत ताप व दाब पर दो गैसों की विसरण की गतियाँ (वर्ग माध्य मूल वेग) उनके घनत्व .................... व्युत्क्रमानुपाती होती हैं।
उत्तर:
वर्गमूल
प्रश्न 5.
सामान्य ताप व दाब पर किसी गैस के 1 मोल का आयतन ....................... लीटर होता है।
उत्तर:
22.4
प्रश्न 6.
गैस की विशिष्ट ऊष्माओं Cp व Cv का अनुपात (r) जिसे रुद्धोष्म निष्पत्ति भी कहते हैं। r = 1 + .......................
उत्तर:
f
प्रश्न 7.
रेखीय अणुओं वाली त्रिपरमाणुक गैस के लिए f = .................
उत्तर:
f = 7
प्रश्न 8.
विसरण की सर्वाधिक क्षमता ....................... पायी जाती है।
उत्तर:
गैसों में
प्रश्न 9.
यदि गैस के अणुओं की संख्या दुगुनी कर दी जाये तो दाब और गतिज ऊर्जा के मान ......................... हो जायेंगे।
उत्तर:
दुगुना
प्रश्न 10.
सिकाई के लिए पानी की बोतल का उपयोग ....................... करते हैं।
उत्तर:
पानी की उच्च विशिष्ट ऊष्मा के कारण
नीचे दिये गये वाक्यों में सत्य/असत्य कथन का चयन कीजिए:
प्रश्न 1.
ब्राउनी गति को प्रभावित करने वाले कारक माध्यम की श्यानता, माध्यम का घनत्व, माध्यम का ताप तथा कणों का आकार होते हैं।
उत्तर:
सत्य
प्रश्न 2.
आदर्श गैस काल्पनिक गैसें नहीं होती हैं।
उत्तर:
असत्य

प्रश्न 3.
एक नियत ताप पर गैसों के मिश्रण में औसत चाल अपेक्षाकृत अधिक होती है।
उत्तर:
असत्य
प्रश्न 4.
K एक बोल्ट् समान नियतांक है जिसका 1.38 x 10-23 जूल / प्रतिमोल कैल्विन होता है।
उत्तर:
सत्य
प्रश्न 5.
अणुगति सिद्धान्त के आधार पर हम जूल नहीं कर सकते हैं।
उत्तर:
सत्य
प्रश्न 6.
ऑक्सीजन गैस के लिए मोलर विशिष्ट ऊष्माओं का अनुपात 5/7 होता है।
उत्तर:
असत्य
प्रश्न 7.
अणुगति सिद्धान्त से परम शून्य ताप पर अणुओं का वेग शून्य होता है।
उत्तर:
सत्य
प्रश्न 8.
आदर्श गैस समीकरण में स्थिरांक R का SI मात्रक में सही मान न्यूटन मीटर प्रति केल्विन प्रति मोल होता है।
उत्तर:
सत्य
प्रश्न 9.
ऊर्जा समविभाजन के नियम से द्विपरमाणुक गैस के एक अणु की औसत ऊर्जा का मान 5/2 KT होता है।
उत्तर:
सत्य
प्रश्न 10.
एक पात्र में अणुओं की संख्या दुगुनी कर दी जाती है, तो अणुओं की rms चाल पर प्रभाव पड़ता है।
उत्तर:
असत्य
कॉलम - A से कॉलम - B का सही मिलान कीजिए:
प्रश्न 1.
|
कॉलम-A |
कॉलम-B |
|
1. डाल्टन का आंशिक दाबों का नियम है। |
(A) 2/3 |
|
2. PV = |
(B) अधिक |
|
3. इकाई आयतन वाली गैस की औसत गतिज ऊर्जा का भाग कुल दाब के बराबर होता है। |
(C) आदर्श गैस की तरह |
|
4. वर्ग माध्य मूल वेग शून्य होने से गतिज ऊर्जा का मान होगा। |
(D) 6.023 x 1026 प्रति किग्रा मोल |
|
5. जिस गैस के लिए घनत्व p का मान कम होने पर वर्ग माध्य मूल Crms का मान होगा। |
\(\text { (E) } \frac{a}{27 b^2}\) |
|
6. कोई भी गैस उच्च ताप व अल्प दाब पर व्यवहार करती है। |
\(\text { (F) } \frac{89}{27 \mathrm{R} b}\) |
|
7. NA का मान होगा। |
(G) P = P1 + P2 + P3 + ………………….. |
|
8. PC = |
(H) 1/3MC2rms |
|
9. TC = |
(I) शून्य |
|
10. किसी पात्र में गैस के अणुओं का माध्य मुक्त पथ किसके व्युत्क्रमानुपाती होता है? |
(J) घनत्व |
उत्तर:
|
कॉलम-A |
कॉलम-B |
|
1. डाल्टन का आंशिक दाबों का नियम है। |
G) P = P1 + P2 + P3 + ………………….. |
|
2. PV = |
(H) 1/3MC2rms |
|
3. इकाई आयतन वाली गैस की औसत गतिज ऊर्जा का भाग कुल दाब के बराबर होता है। |
(A) 2/3 |
|
4. वर्ग माध्य मूल वेग शून्य होने से गतिज ऊर्जा का मान होगा। |
(I) शून्य |
|
5. जिस गैस के लिए घनत्व p का मान कम होने पर वर्ग माध्य मूल Crms का मान होगा। |
(B) अधिक |
|
6. कोई भी गैस उच्च ताप व अल्प दाब पर व्यवहार करती है। |
(C) आदर्श गैस की तरह |
|
7. NA का मान होगा। |
(D) 6.023 x 1026 प्रति किग्रा मोल |
|
8. PC = |
\(\text { (E) } \frac{a}{27 b^2}\) |
|
9. TC = |
\(\text { (F) } \frac{89}{27 \mathrm{R} b}\) |
|
10. किसी पात्र में गैस के अणुओं का माध्य मुक्त पथ किसके व्युत्क्रमानुपाती होता है? |
(J) घनत्व |
अतिलघूत्तरात्मक प्रश्न:
प्रश्न 1.
किसी आदर्श गैस के लिये पात्र के आयतन तथा व.मा.मू. वेग के रूप में दाब का समीकरण लिखिये।
उत्तर:
P = 1/3M/VC2rms
प्रश्न 2.
किसी गैस के दाब तथा एकांक आयतन ऊर्जा में क्या सम्बन्ध है?
उत्तर:
p = 2/3E

प्रश्न 3.
किसी गैस के लिये नियत ताप पर दाब दोगुना कर देने पर अणुओं के व.मा.मू. वेग पर क्या प्रभाव पड़ेगा?
उत्तर:
निम्न सूत्र के अनुसार वर्ग माध्य मूल वेग ताप पर निर्भर करता है, दाब पर नहीं निर्भर करता है।
\(\mathrm{C}_{r m s}=\sqrt{\frac{3 \mathrm{RT}}{\mathrm{M}}}\)
इसलिए दाब दुगुना करने पर कोई प्रभाव नहीं पड़ेगा।
प्रश्न 4.
गैस द्वारा बर्तन की दीवारों पर आरोपित बल का कारण क्या है?
उत्तर:
गैस के अणु दीवार पर टक्कर में अपना संवेग बदलते हैं, जिससे बल उत्पन्न होता है।
प्रश्न 5.
किसी गैस के लिये प्रति अणु प्रति स्वातंत्र्य कोटि गतिज ऊर्जा क्या होगी?
उत्तर:
1/2KT
प्रश्न 6.
आदर्श गैस की सम्पीड्यता के लिए सूत्र लिखिये।
उत्तर:
Z = PV/RT तथा PV/nRT > 1
अर्थात् (Z > 1)
(संकेत- यहाँ Z सम्पीड्यता गुणांक कहलाता है।)
प्रश्न 7.
गैस समीकरण PV=ART में R क्या है? R का मान लीटर एटमास्फियर प्रति केल्विन प्रति मोल में लिखिए।
उत्तर:
R एक स्थिरांक है, जिसे 'मोलर गैस स्थिरांक ' या ' गैस स्थिरांक' कहते हैं।
R = 8.3 जूल / मोल- K
= 8.3 न्यूटन मीटर / मोल-K
= 8.3 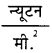 मी.3 /मोल - K
मी.3 /मोल - K
= \(\frac{8.3}{1.03 \times 10^5}\) x 105 लीटर एटमास्फियर / मोल - K
[ ∵ 1 एटमास्फियर = 1.013 x 105 न्यूटन / मी.2 एवं 1 मी.3 = 103 लीटर)
अतः R = 0.821 लीटर वायुमण्डल केल्विन 'मोल'
प्रश्न 8.
विसरण की सर्वाधिक क्षमता किसमें पायी जाती है?
उत्तर:
गैसों में विसरण की क्षमता सर्वाधिक पायी जाती है।
प्रश्न 9.
वास्तविक गैसों को परिभाषित कीजिए।
उत्तर:
वे गैसें जो गैस नियमों का पालन समस्त ताप व दाब पर नहीं करती हैं, वास्तविक गैसें कहलाती हैं।
प्रश्न 10.
किसी गैस के मोलों की संख्या ज्ञात करने का सूत्र दीजिये।
उत्तर:

प्रश्न 11.
वर्ग माध्य मूल चाल किसे कहते हैं?
उत्तर:
किसी गैस के अणुओं के वर्ग माध्य चाल के वर्गमूल के मान को वर्ग माध्य मूल चाल कहते हैं।
\(\mathrm{C}_{\mathrm{ms}}=\left[\frac{\mathrm{C}_1{ }^2+\mathrm{C}_2{ }^2+\mathrm{C}_3{ }^2+\ldots \ldots . . \mathrm{C}_n{ }^2}{n}\right]^{\frac{1}{2}}\)
प्रश्न 12.
परम शून्य ताप किसे कहते हैं?
उत्तर:
वह ताप जिस पर गैस के अणुओं के वर्ग माध्य मूल का मान शून्य होता है।
प्रश्न 13.
परम ताप पैमाने पर ऋणात्मक ताप सम्भव नहीं होता है, कारण लिखिये।
उत्तर:
क्योंकि गैस के अणु के वर्ग माध्य मूल वेग का मान ऋणात्मक नहीं हो सकता है।

प्रश्न 14.
आदर्श गैसें कौनसी होती हैं?
उत्तर:
सामान्यतया एकपरमाणुक गैसें आदर्श गैसें होती हैं। हाइड्रोजन, नाइट्रोजन ऑक्सीजन तथा हीलियम गैसों को आदर्श गैस माना जाता है क्योंकि ये सभी कठिनाई से द्रवित होती हैं। ये गैसें उच्च ताप तथा निम्न दाब पर वास्तविक गैस आदर्श गैस की तरह व्यवहार करती हैं।
प्रश्न 15.
यदि गैस के अणुओं की संख्या दुगुनी कर दी जाये तो दाब तथा गतिज ऊर्जा के मान पर क्या प्रभाव पड़ेगा?
उत्तर:
दाब तथा गतिज ऊर्जा का मान दुगुना हो जायेगा।
प्रश्न 16.
निश्चित ताप पर किसी गैस के आयतन को दुगुना परिवर्तित करने पर उसके अणुओं के वर्ग माध्य मूल वेग के मान पर क्या प्रभाव पड़ेगा?
उत्तर:
वर्ग माध्य मूल वेग के मान पर कोई परिवर्तन नहीं होता है।
\(\left[\because C_{\mathrm{rms}}=\sqrt{3 R T / M}\right]\)
प्रश्न 17.
यदि किसी संरन्ध्रमयी दीवारों से बने पात्र में दो गैसों का मिश्रण भरा हो तथा इसे एक निर्वातित कोष्ठ में रख दिया जाये तो हल्की गैस पहले बाहर क्यों निकलती है? कारण लिखिये।
उत्तर:
क्योंकि हल्की गैस के अणुओं के वेग का मान भारी गैसों के अणुओं की तुलना में अधिक होता है।
\(\frac{\left(\mathrm{C}_{\mathrm{rms}}\right)_1}{\left(\mathrm{C}_{\mathrm{rms}}\right)_2}=\sqrt{\frac{\mathrm{M}_2}{\mathrm{M}_1}}\)
प्रश्न 18.
वास्तविक गैसें PV= RT का कब अधिक सही पालन करती हैं?
उत्तर:
उच्च ताप तथा निम्न दाब पर।
प्रश्न 19.
समान ताप पर हाइड्रोजन और ऑक्सीजन के अणुओं के वर्ग माध्य मूल वेगों का अनुपात क्या होगा?
उत्तर:
\(\frac{\left(\mathrm{C}_{\mathrm{rms}}\right)_{\mathrm{H}_2}}{\left(\mathrm{C}_{\mathrm{rms}}\right)_{\mathrm{O}_2}}=\sqrt{\frac{(\mathrm{M})_{\mathrm{O}_2}}{(\mathrm{M})_{\mathrm{H}_2}}}=\sqrt{\frac{32}{2}}=\frac{4}{1}=4: 1\)
प्रश्न 20.
270 K तथा 30 K पर किसी गैस के वर्ग माध्य मूल वेगों तथा गतिज ऊर्जाओं में क्या अनुपात होगा?
उत्तर:
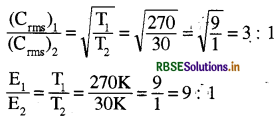
प्रश्न 21.
जब गर्म वायु वायुमण्डल में ऊपर उठती है तो पहाड़ की चोटी पर इसका ताप समुद्र तल की अपेक्षा कम क्यों हो जाता है?
उत्तर:
क्योंकि पहाड़ की चोटी पर दाब कम होने से गैस प्रसारित होती है जिसके कारण उसके ताप में कमी होती है।
प्रश्न 22.
दो गैसें A तथा B मिश्रित की गयी हैं। प्रत्येक का आयतन V, दाब P तथा ताप T है। यदि मिश्रण का आयतन भी V तथा ताप T है तो उनके मिश्रण के दाब का मान कितना होगा?
उत्तर:

प्रश्न 23.
एक गैस के चार अणुओं के वेग क्रमशः √3, 3, 4, 6 मीटर/सेकण्ड हैं तो इनके वर्ग माध्य मूल वेग का मान लिखिये।
उत्तर:

प्रश्न 24.
किसी गैस के परमताप को चार गुना कर देने पर उसके अणुओं का वर्ग माध्य मूल वेग कितने गुना हो जायेगा? उसकी कुल गतिज ऊर्जा कितने गुना हो जायेगी?
उत्तर:
\(\because C_{\text {rms }} \propto \sqrt{\mathrm{T}}\)
अतः T को 4 गुना कर देने पर यह गुना हो जायेगा तथा E α T अर्थात् ऊर्जा चार गुनी हो जायेगी।
प्रश्न 25.
निश्चित ताप पर बर्तन का आयतन आधा कर दें तो एक अणु के वर्गमाध्य मूल वेग के मान में क्या परिवर्तन होगा?
उत्तर:
वेग आयतन पर निर्भर नहीं करता है। अतः समान रहेगा।
प्रश्न 26.
ऊर्जा के समविभाजन नियम का उल्लेख कीजिये।
उत्तर:
इस नियमानुसार ऊष्मीय संतुलन में किसी गतिक निकाय की कुल गतिज ऊर्जा विभिन्न स्वतंत्रता की कोटियों के मध्य समान रूप से वितरित रहती है तथा प्रत्येक स्वतंत्रता की कोटि के संगत ऊर्जा का मान KT/2 होता है जहाँ k = बोल्ट्जमान नियतांक तथा T = परम ताप
प्रश्न 27.
ऑक्सीजन गैस के लिये विशिष्ट ऊष्माओं का अनुपात (Cp/Cy) का मान लिखो।
उत्तर:
ऑक्सीजन के लिये \((\gamma)=\frac{C_P}{C_\gamma}=\frac{7 R}{5 R}=\frac{7}{5}\)
प्रश्न 28.
किसी गैस का ताप क्या व्यक्त करता है?
उत्तर:
किसी गैस का ताप गैस के अणुओं की औसत गतिज ऊर्जा को व्यक्त करता है।

प्रश्न 29.
किसी द्विपरमाणुक गैस के अणुओं का कमरे के ताप पर वर्ग माध्य मूल वेग (Crms ) 1930 मी./से. पाया जाता है तो गैस का नाम लिखिये।
उत्तर:
H2
प्रश्न 30.
यदि सभी अणुओं के द्रव्यमान एक गैस में आधे कर दिये जायें और उनकी चाल दुगुनी, आरम्भिक और अन्तिम दाब में क्या अनुपात होगा?
उत्तर:
\(\because\left(\mathrm{P}=\frac{1}{3} \frac{m n}{\mathrm{~V}} \mathrm{C}^2\right)\)
प्रश्न 31.
संतुलन में एक गैस के अणुओं का औसत वेग क्या है?
उत्तर:
शून्य।
प्रश्न 32.
एक पात्र में अणुओं की संख्या दुगुनी कर दी जाती है। अणुओं की rms चाल पर क्या प्रभाव होगा?
उत्तर:
कोई प्रभाव नहीं।
प्रश्न 33.
सभी कारकों को अपरिवर्तित रखते हुये एक गैस का घनत्व दुगुना कर दिया जाता है, गैस के दाम पर क्या प्रभाव पड़ेगा? उत्तर:
यह दुगुना हो जाता है।
प्रश्न 34.
परम ताप T पर गैस के अणु की औसत स्थानान्तरीय KE. कितनी है?
उत्तर:
3/2 KT. जहाँ K वोल्ट्जमान नियतांक है।
प्रश्न 35.
दो गैसें समान ताप पर हैं। क्या हम यह निष्कर्ष निकाल सकते हैं कि गैस अणुओं के r.m.s. वेग समान होंगे? क्यों?
उत्तर:
नहीं, यदि ताप समान होंगे, तब 3/2 KT और 1/2mc2 भी समान होंगे परन्तु अलग-अलग गैसों में m का मान भिन्न है। अत: C भी भिन्न होगा।
प्रश्न 36.
जब वास्तविक गैस आदर्श गैस समीकरण PV = RT का पालन करे वह दो प्रतिबन्ध क्या हैं?
उत्तर:
कम दाब तथा उच्च ताप।
प्रश्न 37.
एक- परमाणुक तथा द्वि-परमाणुक गैसों के लिये Y का मान क्या है?
उत्तर:
y = 1.67 और y = 1.4
प्रश्न 38.
कमरे के ताप पर एक-परमाणुक अथवा द्वि-परमाणुक किस गैस की विशिष्ट ऊष्मा अधिक होगी?
उत्तर:
द्वि- परमाणुक गैस की।

प्रश्न 39.
सिकाई के लिये पानी की बोतल का उपयोग क्यों करते हैं?
उत्तर:
पानी की उच्च विशिष्ट ऊष्मा के कारण।
प्रश्न 40.
यदि किसी पात्र में अणुओं की संख्या आधी कर दी जाये तो दाब में क्या परिवर्तन होगा?
उत्तर:
बन्द बर्तन में यदि गैस के अणुओं की संख्या आधी कर दें तो बर्तन के इकाई क्षेत्रफल पर अणुओं के टक्करों की संख्या
आधी हो जायेगी जिसके कारण दाब पहले की तुलना में आधा रह जायेगा।
प्रश्न 41.
आदर्श गैस को ठोस या द्रव अवस्था में क्यों नहीं परिवर्तित किया जा सकता है?
उत्तर:
किसी गैस को ठोस या द्रव अवस्था में परिवर्तित करने के लिये अणुओं के बीच आकर्षण बल होना आवश्यक है जबकि आदर्श गैस के अणुओं के बीच कोई आकर्षण बल नहीं होता है जिससे आदर्श गैस को ठोस या द्रव में नहीं बदल सकते हैं।
प्रश्न 42.
एक बक्से में हाइड्रोजन तथा ऑक्सीजन के बराबर अणु हैं। यदि बक्से में एक सूक्ष्म छिद्र कर दिया जाये तो कौनसी गैस तेजी से लीक होगी तथा क्यों?
उत्तर:
\(C_{\mathrm{rms}} \propto \frac{1}{\sqrt{M}}\) क्योंकि हाइड्रोजन का अणुभार M, ऑक्सीजन को अणुभार की तुलना में कम होता है। अतः हाइड्रोजन तेजी से लीक करेगी।
प्रश्न 43.
यदि किसी गैस का घनत्व स्थिर रखा जाये परन्तु गैस अणुओं का वर्गमाध्य मूल वेग दो गुना हो जाये तो गैस का दाब कितने गुना हो जायेगा?
उत्तर:
गैसों के अणुगति सिद्धान्त के आधार पर दाब का सूत्र P = 1/3PC2rms में जब घनत्व P स्थिर रखा जाता है तो स्पष्ट है कि दाब P α C2rms इसलिए वर्ग माध्य मूल वेग Crms को 2 गुना करने से दाब 22 अर्थात् 4 गुना हो जायेगा।
प्रश्न 44.
एक- परमाणुक तथा द्वि-परमाणुक गैसों के लिए Cp तथा CV के मान लिखिये।
उत्तर:
एक-परमाणुक के लिए Cp = 5R/2 तथा CV = 3R/2
लघूत्तरात्मक प्रश्न:
प्रश्न 1.
अणुगति सिद्धान्त के आधार पर ताप की व्याख्या करो।
उत्तर:
जब पदार्थ को ऊष्मा देते हैं तब दी गई ऊष्मा पदार्थ के अणुओं में वितरित हो जाती है जिसे प्राप्त कर पदार्थ के अणु अपनी सामान्य स्थिति के इर्द-गिर्द ज्यादा आयाम से सरल आवर्त गति करने लगते हैं। पदार्थ के द्रव या गैस होने पर अणुओं के कम्पन का आयाम बढ़ने के साथ रेखीय और चक्रण गतियाँ भी बढ़ जाती हैं और बढ़ी हुई कुल गतिज ऊर्जा दी हुई ऊष्मा के बराबर होती है। इस तरह पदार्थ को दी गई ऊष्मा पदार्थ के अणुओं की कुल गतिज ऊर्जा के रूप में बदल जाती है और पदार्थ की निश्चित मात्रा के ताप में वृद्धि दी गयी ऊष्मा वृद्धि के समानुपाती होती है।
इसलिये पदार्थ की निश्चित मात्रा को दी गयी ऊष्मा α ताप में वृद्धि
या पदार्थ की निश्चित मात्रा के अणुओं की कुल गतिज ऊर्जा में वृद्धि α पदार्थ के ताप में वृद्धि
हम जानते हैं कि 0K पर पदार्थ के अणुओं की कुल गतिज ऊर्जा शून्य होती है। यदि पदार्थ की निश्चित मात्रा में TK पर अणु की कुल गतिज ऊर्जा θ हो तब
θ α T
प्रश्न 2.
गैसों के अणुगति सिद्धान्त के अनुसार माध्य मुक्त पथ क्या होता है?
उत्तर:
माध्य मुक्त पथ-गैस के अणु दूसरे अणु से टकराने के पूर्व जितनी दूरी चलते हैं उसे मुक्त पथ कहते हैं। विभिन्न टक्करों में मुक्त पथ का मान अलग-अलग हो सकता है। इसको हम दूसरी तरह से इस प्रकार से समझ सकते हैं।
किसी अणु द्वारा दो क्रमागत टक्करों के बीच तय की गयी माध्य दूरी को औसत मुक्त पथ कहते हैं। इसे से प्रदर्शित करते हैं।
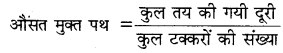
यदि कोई अणु। समय में N विभिन्न टक्करों में क्रमश: λ1, λ2, λ3, ......... λN इत्यादि दूरियाँ तय करता है तो औसत मुक्त पथ का मान होगा
\(\bar{\lambda}=\frac{\lambda_1+\lambda_2+\lambda_3 \ldots \ldots \ldots \lambda_N}{N}\)
औसत मुक्त पथ का मान गैस के घनत्व के व्युत्क्रमानुपाती तथा अणु के द्रव्यमान के समानुपाती होता है।
\(\bar{\lambda} \propto \frac{1}{\rho}\)
औसत मुक्त पथ की ताप तथा दाब पर निर्भरता होती है।
अर्थात् \(\bar{\lambda} \propto \mathrm{T}\)
तथा \(\bar{\lambda} \propto \frac{1}{\rho}\)

प्रश्न 3.
मैक्सवेल का ऊर्जा समविभाजन का नियम लिखिये।
उत्तर:
मैक्सेवल का ऊर्जा समविभाजन:
इस नियम को मैक्सवेल (Maxwell) ने गैसों के गत्यात्मक सिद्धान्त के आधार पर प्रतिपादित किया था। जब दो गैसें जो भिन्न-भिन्न ताप पर हैं, मिश्रित की जाती हैं तो उनके अणुओं की टक्करें होती हैं तथा गैस के अणुओं की ऊर्जाओं में अन्तर घटता जाता है जब तक दोनों गैसों की माध्य गतिज ऊर्जायें समान नहीं हो जातीं। गतिज ऊर्जायें समान हो जाने पर ताप समान हो जाते हैं। यह अवस्था तापीय साम्य (Thermal equilibrium) की अवस्था कहलाती है। इसे ही मैक्सवेल का ऊर्जा समविभाजन का नियम कहते हैं।
प्रश्न 4.
आवोगादो नियम को लिखिये।
उत्तर:
आवोगादो का नियम- इस नियम के अनुसार सभी गैसों के समान आयतनों में समान दाब व ताप पर उपस्थित अणुओं की संख्या समान होती है।
अर्थात् P1 = P2 T1 = T2
और V1 = V2 होने पर
N1 = N2
प्रश्न 5.
ग्राहम का गैस विसरण का नियम क्या है? अणु गति सिद्धान्त के आधार पर इस नियम को प्रतिपादित कीजिये।
उत्तर:
ग्राहम का गैस विसरण नियम- इस नियम के अनुसार, स्थिर दाब पर किसी गैस के विसरण की दर उसके घनत्व के वर्गमूल के व्युत्क्रमानुपाती होती है।
अर्थात्
\(\mathrm{D} \propto \frac{1}{\sqrt{\rho}}\)
जहाँ गैस का घनत्व है।
गैस के अणुगति सिद्धान्त के आधार पर,

चूँकि विसरण की दर गैस के अणुओं के वर्ग माध्य मूल वेग के अनुक्रमानुपाती होती है, अतः
विसरण की दर \(\text { (D) } \propto \frac{1}{\sqrt{\rho}}\)
यही ग्राहम का विसरण का नियम है।
प्रश्न 6.
सिद्ध कीजिये कि एक अणु की औसत गतिज ऊर्जा 3/2KT के बराबर होती है।
उत्तर:
गैसों की गतिक समीकरण के अनुसार:
PV = 1/3mNc2
या
PV = 2/3 x 1/2mNc2
अतः
PV = 2/3K.E.
(∵ K.E = 1/2mNc2 एवं द्रव्यमान = mN)
अतः
KE. = 3/2P.V.
आदर्श गैस समीकरण के अनुसार PV = nRT किसी गैस के (n) अणुओं के लिये गतिज ऊर्जा
K.E. = 3/2nRT
∴ KE α T यहाँ T परम ताप है।
∴ KE. = 3/2KT यहाँ k बोल्ट्जमान स्थिरांक है।
प्रश्न 7.
वास्तविक गैसें अपनी व्यवहार में आदर्श गैसों से क्यों विचलित होती हैं?
उत्तर:
गैसों के अणु गति सिद्धान्त के अनुसार ताप कम करने पर एवं दाब बढ़ाने पर वास्तविक गैसों का आदर्श व्यवहार से विचलन (Deviation) बढ़ जाता है; क्योंकि गैस का दाब बढ़ाने पर उसके अणु पास-पास आते हैं तथा उनके आयतन में कमी आ जाती है जिससे गैस की संपीड्यता (Compressibility) अर्थात् दबने की क्षमता कम हो जाती है और वह आदर्श व्यवहार से विचलन दर्शाती है। किसी गैस का विचलन उसके संपीड्यता गुणांक Z से प्रदर्शित किया जाता है।
अर्थात्
Z = PV/RT
प्रश्न 8.
दाब का नियम या गे-लूसॉक का नियम क्या है?
उत्तर:
दाब का नियम या गे-लूसॉक का नियम- इस नियम के अनुसार, स्थिर आयतन पर किसी गैस की एक निश्चित मात्रा का दाब उसके परम ताप के अनुक्रमानुपाती होता है।
अर्थात् P α T
या p/T = नियतांक .... (1)
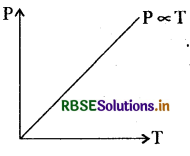
समीकरण (1) को निम्न प्रकार से भी लिख सकते हैं
P1/T1 = P2/T2 ....(2)
जबकि (P1T1) व (P2T2) गैस की दो अवस्थाओं के क्रमशः दाब व ताप हैं।
प्रश्न 9.
यदि किसी गैस का परमताप 16 गुना कर दें तो उस गैस के अणुओं का वर्ग-माध्य मूल वेग कितने गुना हो जायेगा?
उत्तर:
गैस के अणुओं का वर्गमाध्य मूल वेग:

अर्थात् गैस का ताप 16 गुना कर देने पर गैस का वर्ग माध्य मूल वेग 4 गुना हो जायेगा।
प्रश्न 10.
किसी गैस के परम ताप T तथा गैस के वर्ग माध्य वेग (C2rms) में ग्राफ खींचिये।
उत्तर:
गैस का वर्ग माध्य वेग
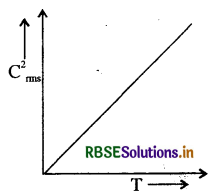
अर्थात् C2rms व T के बीच खींचा गया ग्राफ सरल रेखा में होगा।
प्रश्न 11.
एक पात्र में H2 तथा O के बराबर-बराबर अणु हैं, यदि पात्र में एक सूक्ष्म छिद्र हो, तो कौन-सी गैस तेजी से लीक होगी?
उत्तर:
प्रति सेकण्ड छिद्र से गैस लीक होने का आयतन = छिद्र का क्षेत्रफल x गैस की औसत चाल
गैस के अणुओं की चाल = 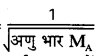
हाइड्रोजन का अणुभार ऑक्सीजन की तुलना में कम होता है। अतः पात्र में से छिद्र द्वारा हाइड्रोजन गैस तेजी से लीक होगी।

प्रश्न 12.
वह कौन-सा ताप है जिस पर गैस के सभी अणु गतिविहीन हो जाते हैं?
उत्तर:
गैस के अणुगति सिद्धान्त से गैस की प्रति अणु औसत गतिज ऊर्जा परमताप के अनुक्रमानुपाती होती है अर्थात्
1/2m C2rms α T
गैस का वर्गमाध्य वेग (Camps) शून्य होगा यदि परमताप T = शून्य । अतः परम शून्य ताप पर सभी अणु गतिविहीन हो जाते हैं।
प्रश्न 13.
270 K तथा 30 K तापों पर किसी आदर्श गैस के वर्गमाध्य मूल वेगों का क्या अनुपात होगा?
उत्तर:
हम जानते हैं- गैस का वर्गमाध्य मूल वेग

प्रश्न 14.
सामान्य ताप व दाब पर 1 सेमी. 3 ऑक्सीजन के नमूने दिये गये हैं। किस नमूने में अणुओं की संख्या अधिक है ?
उत्तर:
N अणुओं के लिए
आदर्श गैस समीकरण PV = NkT
N = PV/kT
चूँकि दोनों गैसों के लिए दाब P = 1 वायुमण्डल, ताप T = 0°C = 273K तथा आयतन V = 1 सेमी 3 और वोल्ट्जमान स्थिरांक k के मान समान हैं, अतः दोनों गैसों में अणुओं की संख्या समान है।
प्रश्न 15.
NTP पर गैस के 1 घन सेमी. आयतन में अणुओं की संख्या ज्ञात करें।
उत्तर:
आदर्श समीकरण PV = NKT से
अणुओं की संख्या N = PV/KT
दिया है P = 1 वायुमण्डल = 1.013 x 105 न्यूटन / मी2
T = 273K
V = 1 घन सेमी = 106 घन मीटर
वोल्ट्जमान नियतांक k = 1.38 x 10-23 जूल / K
मान रखने पर
\(\mathrm{N}=\frac{\mathrm{PV}}{\mathrm{kT}}=\frac{1.013 \times 10^5 \times 10^{-6}}{1.38 \times 10^{-23} \times 273}\)
N = 2.7 x 1019 अणु
प्रश्न 16.
यदि किसी गैस का घनत्व स्थिर रखा जाये परन्तु गैस अणुओं का वर्गमाध्य मूल वेग दो गुना हो जाये तो गैस का दाब कितने गुना हो जायेगा?
उत्तर:
गैसों के अणुगति सिद्धान्त से दाब का सूत्र P = 1/3P C2ms में जब घनत्व P स्थिर रखा जाता है तो स्पष्ट है कि दाब
p α C2rms
इसलिए वर्ग माध्य मूल वेग Crms को 2 गुना करने से दाब 22 अर्थात् 4 गुना हो जायेगा।
प्रश्न 17.
नियत ताप पर गैस का आयतन कम कर देने पर उसका दाब बढ़ जाता है। अणुगति सिद्धान्त से स्पष्ट कीजिये।
उत्तर:
आयतन कम कर देने पर उसका दाब बढ़ने का कारण है कि ऐसा करने से प्रति इकाई आयतन की मात्रा बढ़ी है। उससे बर्तनों की दीवारों से प्रति सेकण्ड टकराने वाले अणुओं की संख्या में वृद्धि होने से दीवार का प्रति सेकण्ड हस्तान्तरित संवेग बढ़ जाता है अर्थात् दाब बढ़ जाता है।
आंकिक प्रश्न:
प्रश्न 1.
वह ताप ज्ञात कीजिये जिस पर ऑक्सीजन अणुओं का वर्ग माध्य मूल वेग हाइड्रोजन अणुओं के 200K पर वर्ग माध्य मूल वेग के बराबर होता है। (ऑक्सीजन का अणुभार 32, हाइड्रोजन का अणुभार = 2 )।
उत्तर:
माना वह ताप TK है।
हम जानते हैं:

प्रश्न 2.
27°C पर एक मोल नाइट्रोजन गैस की कुल गतिज ऊर्जा ज्ञात कीजिये।
उत्तर:
हम जानते हैं कि गैस के अणुओं की गतिज ऊर्जा
K.E. = 3/2nRT
दिया गया है:
n = 1 मोल
T = 273 + 27 = 300K
और R = 8.314 जूल / मोल °C
मान रखने पर
KE. = 3/2 × 1 × 8.314 × 300
= 3 × 8.314 × 150 = 3741.3 जूल
\(\text { K.E. }=\frac{3741.3}{4.18}\)
= 895 कैलोरी

प्रश्न 3.
परम ताप T पर किसी गैस के N अणु एक पात्र में हैं। अब अणुओं की संख्या दोगुनी कर दी जाती है तथा पात्र में गैस की कुल ऊर्जा पूर्ववत् रहती है, तो गैस का परम ताप ज्ञात कीजिये।
उत्तर:
E1 =N अणुओं की ऊर्जा T K पर
E1 = 3/2NKT ....(1)
E2 = 2N अणुओं की ऊर्जा TK पर (T'K, 2N अणुओं का ताप)
= 3/2 × 2NkT
दिया गया है:
E1 = E2
3/2NkT = 3/2 × 2NkT
T = 2T'
∴ T' = 1/2T
गैस का परम ताप = 1/2T K
प्रश्न 4.
एक बन्द पात्र में भरी गैस का ताप 1°C बढ़ाने से उसके दाब में 0.4 प्रतिशत की वृद्धि होती है। गैस का प्रारम्भिक ताप ज्ञात कीजिये।
उत्तर:
गे-लूसाक के नियमानुसार
P α T
p1/p2 = T1/T2
माना प्रा. दाब
P1 = 100
अन्तिम दाब
P2 = 100.4
\(\frac{100}{100.4}=\frac{T}{T+1}\)
100T + 100 = 100.4T
100 = 100.4T - 100T
100 = 0.4T
\(\mathrm{T}=\frac{100}{0.4}=\frac{1000}{4}\)
T = 250K
प्रश्न 5.
10 लीटर आयतन व 27° C वाले एक पात्र में 8 ग्राम ऑक्सीजन, 14 ग्राम नाइट्रोजन व 22 ग्राम कार्बन डाइऑक्साइड मिश्रित की जाती है। मिश्रण द्वारा आरोपित दाब निकालिये।
उत्तर:
डाल्टन के आंशिक दाब के नियम से
P = P1 + P2 + P3
P = nRT/V और n = m/M अतः P = m/MRT/V
∴ \(\mathbf{P}=\frac{\mathbf{R T}}{\mathbf{V}}\left[\frac{m_1}{\mathbf{M}_1}+\frac{m_2}{\mathbf{M}_2}+\frac{m_3}{\mathbf{M}_3}\right]\)
मान रखने पर
\(=\frac{8.3 \times 300}{10^{-2}}\left[\frac{8}{32}+\frac{14}{28}+\frac{22}{44}\right]\)
∵ R = 8.3 जूल / ग्राम - मोल केल्विन
T = 273 + 27 = 300K V = 10 लीटर
= 10 x 1000 घन सेमी.
= 104 घन सेमी.
\(=\frac{10^4}{10^6}\) घन मी. = 10-2 घन मीटर
और O2, N2 और CO2 के अणुभार क्रमशः 32, 28, 44 होंगे।

प्रश्न 6.
30°C ताप, 76 सेमी. (पारे का) दाब पर नाइट्रोजन अणुओं का वर्ग माध्य मूल वेग ज्ञात कीजिये।
उत्तर:
नाइट्रोजन का आण्विक भार = 28
तथा R = 8. 31 जूल / ग्राम अणु डिग्री = 8.31 × 107 अर्ग केल्विन
1'मोल' माना कि 30°C ताप पर नाइट्रोजन का एक ग्राम अणु है तो

प्रश्न 7.
किस ताप पर हीलियम के अणुओं का वर्ग माध्य मूल वेग सामान्य ताप व दाब पर हाइड्रोजन के अणुओं के वर्ग माध्य मेल वेग से आधा होगा?
उत्तर:
माना हीलियम के अणुओं का CHe(ma) ताप T पर हाइड्रोजन के सामान्य ताप व दाब पर CH(ms) से आधा होगा।

अत: वह ताप 136.5K होगा।
प्रश्न 8.
एक ग्राम ऑक्सीजन के समस्त अणुओं की गतिज ऊर्जा एक ग्राम नाइट्रोजन के अणुओं की गतिज ऊर्जा के मान के बराबर हो तो उनके तापक्रमों का अनुपात क्या होगा?
उत्तर:


प्रश्न 9.
दो समान आयतन के पात्र हैं। एक में ऑक्सीजन गैस् भरी हुई है तथा दूसरे में हाइड्रोजन गैस भरी है। दोनों गैसें समान ताप पर हैं तो उनके दाबों का अनुपात क्या होगा? यदि का अनुपात 1 : 4 है।
उत्तर:
उनके वर्गमूल वेग
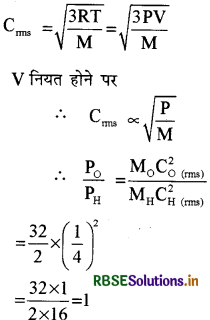
PO : PH = 1 : 1
प्रश्न 10.
स्थिर दाब पर गैस के ताप का आकलन कीजिये जिस पर उसकी 27°C पर चाल से r.m.s. वेग दुगुना हो जायेगा।
उत्तर:
माना वांछित ताप = t = ?
Ct और C27 इसके t°C और 27°C पर अणुओं का वेग है
Ct/C27 = 2
माना गैस का अणुभार = M
T = t + 273 और
T27 = 27 + 273 = 300K

या 1200 = t + 273
या
t = 1200 - 273 = 927°C
प्रश्न 11.
यदि n0 = 2.79 x 1025 अणु m-3 और औसत मुक्त पथ = 2.2 x 10-8 mm है तो अणु के व्यास का आकलन कीजिए।
उत्तर:
दिया गया है:
सम्बन्ध
no = 2.79 × 105 अणु/m3
λ = 2.2 × 108m
d = ?

प्रश्न 12.
27°C ताप पर किसी गैस के अणुओं का मुक्त पथ 2.76 x 10 मीटर है। यदि अणु का व्यास 3.00 हो तो गैस का दाब ज्ञात कीजिये।
उत्तर:
दिया है:
T = 27°C = (27 + 273) k = 300K
λ = 2.76 x 105 मीटर
d = 3A° = 3 × 10-10 मीटर
बोल्ट्जमान नियतांक k = 1.38 x 10-23 जूल /केल्विन
हम जानते हैं कि माध्य मुक्त पथ

प्रश्न 13.
ऑक्सीजन के एक अणु का व्यास लगभग 3A° है। सामान्य ताप व दाब पर ऑक्सीजन के अणुओं के माध्य मुक्त पथ एवं टक्करों में मध्य लगे माध्य समय की गणना कीजिये। सामान्य ताप एवं दाब पर अणुओं की प्रति घन सेमी संख्या 3 x 1019 है।
उत्तर:
प्रश्नानुसार
d = 3A° = 3 x 10-8 cm
n0 = 3 x 1019
माध्य मुक्त पथ


प्रश्न 14.
एक खुले मुँह के बर्तन में 60°C पर वायु भरी है। बर्तन को किस ताप तक गर्म करें कि इस वायु का 1/4 भाग बाहर निकल जाये?
उत्तर:
माना कि प्रारम्भ में बर्तन में n अणु हैं जबकि गैस का परम T1K है। T2K तक गर्म करने पर 1/4 अणु बाहर निकल जाते हैं,
अतः शेष बचे हुए अणु
n = n - 1/4n = 3/4n
∵nT1 = nT2 ⇒ n/n = T2/T1
∵ \(\begin{aligned} \frac{4}{3} & =\frac{\mathrm{T}_2}{333} \therefore \mathrm{T}_2=\frac{4 \times 333}{3} \mathrm{~T}_2=444 \mathrm{~K} \\ \mathrm{~T}_2 & =444-273=171^{\circ} \mathrm{C} \end{aligned}\)
प्रश्न 15.
एक बर्तन में 80 सेमी. पारे के दाब तथा किसी ताप पर कोई गैस भरी है। उसी ताप पर बर्तन में और अधिक गैस भरकर उसका द्रव्यमान 60% बढ़ा दिया जाता है। बर्तन में परिणामी दाब की गणना कीजिये।
उत्तर:
गैसों के अणुगति सिद्धान्त के आधार पर दाब।
P = 1/3(M/V)C2rms
जहाँ M= गैस का द्रव्यमान, V = गैस का आयतन, Crms = गैस अणुओं का वर्ग माध्य मूल वेग
चूँकि ताप के नियत रहने पर Crms का मान अर्थात्
C2rms का मान नियत होगा तथा नियत आयतन के लिए V नियतांक होगा।
अतः नियत ताप व नियत आयतन पर
P α M
∴ \(\frac{\Delta \mathrm{P}}{\mathrm{P}} \times 100=\frac{\Delta \mathrm{M}}{\mathrm{M}} \times 100\)
जहाँ AP = द्रव्यमान में AM परिवर्तन के संगत दाब में परिवर्तन
अतः दाब में प्रतिशत = वृद्धि द्रव्यमान में प्रतिशत वृद्धि
इसलिए गैस के द्रव्यमान में 60% वृद्धि करने पर उसके दाब में भी 60% वृद्धि हो जायेगी।
गत वर्षों की विभिन्न प्रतियोगी परीक्षाओं में पूछे गये प्रश्न:
प्रश्न 1.
दो अनभिक्रियाशील एकपरमाणुक आदर्श गैसों का परमाणु द्रव्यमान 2: 3 के अनुपात में है। जब इनको एक स्थिरतापीय बर्तन में परिबद्ध किया जाता है, तब इनके आंशिक दाबों का अनुपात 4 : 3 है। इनके घनत्व का अनुपात है:
(a) 1 : 4
(b) 1 : 2
(c) 6 : 9
(d) 8 : 9
उत्तर:
(d) 8 : 9
प्रश्न 2.
एक आदर्श गैस के दाब, आयतन और ताप क्रमश: P, V व T हैं। यदि इसके अणु का द्रव्यमान 12 हो तब उसका घनत्व होगा: [K = बोल्ट्जमान नियतांक]
(a) mkT
(b) p/kT
(c) p/kTV
(d) Pm/kT
उत्तर:
(d) Pm/kT
प्रश्न 3.
एक समान तापमान पर दो पात्रों में से एक में आदर्श गैस A तथा दूसरे में आदर्श गैस B भरी है। गैस A का दाब गैस B के दाब का दोगुना है। इन दशाओं के अन्तर्गत गैस A का घनत्व, गैस B के घनत्व से 1.5 गुना पाया जाता है तो A तथा B के अणुभारों का अनुपात होगा.
(a) 3/4
(b) 2
(c) 1/2
(d) 2/3
उत्तर:
(a) 3/4

प्रश्न 4.
किसी गुब्बारे में 500m3 हीलियम गैस 27 °C ताप तथा एक वायुमण्डल दाब पर है। 3 °C ताप तथा 0.5 वायुमण्डल दाब पर हीलियम गैस का आयतन होगा:
(a) 500m3
(b) 700 m3
(c) 900m3
(d) 1000 m3
उत्तर:
(c) 900m3
प्रश्न 5.
सूर्य की किरणों से एक खुले हुए 30 m' आयतन वाले कमरे का तापमान 17°C से 27 °C हो जाता है। कमरे के अन्दर वाडा 1 x 105 Pa ही रहता है। यदि कमरे के अन्दर अणुओं की संख्या गर्म होने से पहले एवं बाद में क्रमशः है तो nf - ni का मान होगा:
(a) -2.5 x 1020
(b ) - 1.61 x 1021
(c) 1.38 x 1023
(d) 2.5 x 1025
उत्तर:
(a) -2.5 x 1020
प्रश्न 6.
एक बर्तन में दो मोल हीलियम गैस (परमाणु द्रव्यमान = 4 amuu) और एक मोल ऑर्गन (परमाणु द्रव्यमान = 4 amu) का मिश्रण 300 K तापमान पर है। इनकी वर्ग माध्य-मूल चाल का अनुपात, Vrms (हीलियम)/Vms (ऑर्गन) है:
(a) 0.32
(b) 0.45
(c) 2.24
(d) 3.16
उत्तर:
(d) 3.16
प्रश्न 7.
ताप 27 °C और दाब 1.0 x 105 Nm-2 पर किसी दिए गए द्रव्यमान की गैस के अणुओं का वर्ग माध्य मूल (r.m.s.) वेग 200ms है। जब इस गैस के ताप और दाब क्रमश: 127 °C और 0.05 x 105 Nm2 हैं, तो ms1 में इस गैस के अणुओं
का वर्ग माध्य मूल वेग है:
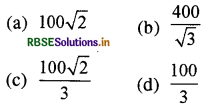
उत्तर:
\(\text { (b) } \frac{400}{\sqrt{3}}\)
प्रश्न 8.
एक आदर्श गैस का तापमान 120 K से 480 K तक बढ़ा दिया गया है। यदि 120 K पर गैस के अणुओं का वर्ग- माध्य-मूल वेग v हो, तो 480 K पर इसका मान होगा:
(a) 4v
(b) 2v
(c) v/2
(d) v/4
उत्तर:
(b) 2v
प्रश्न 9.
किस ताप पर ऑक्सीजन अणुओं की वर्ग माध्य मूल (rms) चाल पृथ्वी के वायुमण्डल से पलायन कर सकने के लिए मात्र पर्याप्त हो जाएगी:
(दिया गया है ऑक्सीजन के अणु का द्रव्यमान (m) 2.76 x 10-26 kg बोल्ट्जमान स्थिरांक k = 1.38 × 10-23JK-1)
(a) 2.508 x 104 K
(b) 8.360 × 104 K
(c) 5.016 x 104 K
(d) 1.254 x 104 K
उत्तर:
(b) 8.360 × 104 K
प्रश्न 10.
मानक ताप व दाब पर 1 g हीलियम का ताप T1 कैल्विन से T2 कैल्विन तक बढ़ाने के लिए आवश्यक ऊष्मीय ऊर्जा का मान है:
(a) 3/4NakBT2/T1
(b) 3/8 NakB(T2 - T1)
(c) 3/2NakB(T2 - T1)
(d) 3/4NakB(T2 - T1)
उत्तर:
(b) 3/8 NakB(T2 - T1)
प्रश्न 11.
स्थिर दाब तथा स्थिर आयतन पर किसी आदर्श गैस की मोलर विशिष्ट ऊष्मा को क्रमश: Cp तथा C से निर्दिष्ट किया जाता है। यदि Y = Cp/Cv और R सार्वत्रिक गैस नियतांक है तो Cv बराबर है:
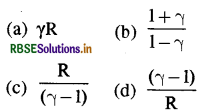
उत्तर:
\(\text { (c) } \frac{\mathrm{R}}{(\gamma-1)}\)
प्रश्न 12.
किसी प्रक्रम में एकपरमाणुक आदर्श गैस के एक मोल के परिवर्तन को समीकरण PV3 = स्थिरांक द्वारा व्यक्त किया जाता है। इस प्रक्रम की अवधि में गैस की ऊष्मा धारिता होगी:
(a) R
(b) 3/2R
(c) 5/2R
(d) 2R
उत्तर:
(a) R
प्रश्न 13.
स्थिर दाब तथा स्थिर आयतन पर विशिष्ट ऊष्मा Cp तथा Cv है,
पाया जाता है:
हाइड्रोजन के लिये Cp - Cv = a
नाइट्रोजन के लिये Cp - Cv = b
a तथा b के बीच का सही सम्बन्ध होगा
(a) a = 28 b
(b) a = 1/14b
(c) a = b
(d) a = 14b
उत्तर:
(d) a = 14b
प्रश्न 14.
NH3 की स्थिर दाब पर विशिष्ट विशिष्ट ऊष्मा का अनुपात है:
(a) 1.33
(b) 1.44
(c) 1.28
(d) 1.67
उत्तर:
(c) 1.28

प्रश्न 15.
3 x 106 Pa दाब पर एक आदर्श गैस 2m3 आयतन घेरती है। इस गैस की ऊर्जा होगी:
(a) 3 x 102
(b) 9 x 108 J
(c) 6 x 104 J
(d) 9 x 106 J
उत्तर:
(d) 9 x 106 J
प्रश्न 16.
एक गैस को अवस्था A से B में दो भिन्न प्रक्रमों ACB तथा ADB द्वारा ले जा सकते हैं। प्रक्रम ACB में 60J ऊष्मा निकाय में जाती है तथा निकाय द्वारा 30 J कार्य किया जाता है। यदि प्रक्रम ADB में निकाय द्वारा 10 J कार्य किया जाता है तो इसमें, निकाय में ऊष्मा प्रवाह का मान होगा:
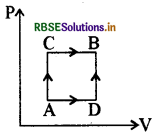
(a) 80 J
(b) 20 J
(c) 100 J
(d) 40 J
उत्तर:
(d) 40 J
प्रश्न 17.
नाइट्रोजन गैस की 15 g मात्रा को एक पात्र में 27 °C पर रखा है। ऊष्मा की वह मात्रा, जिससे गैस के अणुओं का वर्ग माध्य मूल वेग दोगुना हो जायेगा, का मान होगा:
[ दिया है R = 8.3 J/K mole)
(a) 10 kJ
(b) 0.9 kJ
(c) 6kJ
(d) 14 kJ
उत्तर:
(a) 10 kJ
प्रश्न 18.
गैस के एक मिश्रण में ऑक्सीजन के 3 मोल तथा आर्गन के 5 मोल तापमान T पर हैं। केवल स्थानान्तरणीय और घूर्णन विधा मानें तो संकाय की कुल आन्तरिक ऊर्जा होगी:
(a) 12 RT
(b) 20 RT
(c) 15 RT
(d) 4 RT
उत्तर:
(c) 15 RT
प्रश्न 19.
यदि प्रत्येक द्रव्यमान 10-26 kg के 1022 गैस अणु 10t m/s की चाल से 1m 2 क्षेत्रफल पर प्रति सेकण्ड प्रत्यास्थ संघट्ट कर रहे हैं, तब गैस अणुओं द्वारा लगाया गया दाब का कोटिमान होग:
(a) 2 N/m2
(b) 4N/m2
(c) 6 N/m2
(d) 8N/m2
उत्तर:
(a) 2 N/m2
प्रश्न 20.
हीलियम गैस के दो मोल को, (जो कि दृढ़ माने गये हैं) के हाइड्रोजन के तीन मोल अणुओं साथ मिलाया जाता है। स्थिर आयतन पर इस मिश्रण की मोलर विशिष्ट ऊष्मा क्या होगी:
(a) 21.6 J / mol/K
(b) 19.7 J / mol/K
(c) 17.4 J / mol/K
(d) 15.7 J / mol/K
उत्तर:
(c) 17.4 J / mol/K
प्रश्न 21.
एक मोल हाइड्रोजन और एक मोल हीलियम गैस का मिश्रण एक नियत आयतन के बर्तन में T तापमान पर साम्यावस्था में रखा है। यदि गैसों का व्यवहार आदर्श है, तब सही विकल्प है ( हैं ):
(a) गैस के मिश्रण में प्रति औसत ऊर्जा 2RT है।
(b) गैस के मिश्रण तथा हीलियम गैस में ध्वनि की गतियों का अनुपात 1675 है।
(c) हीलियम के परमाणुओं तथा हाइड्रोजन के अणुओं की rms चालों का अनुपात 1/2 है।
(d) हीलियम के परमाणुओं तथा हाइड्रोजन के अणुओं की rms चालों का अनुपात 1/√2 है।
उत्तर:
(a) गैस के मिश्रण में प्रति औसत ऊर्जा 2RT है।
प्रश्न 22.
किसी गैस की आण्विक विशिष्ट ऊष्मा धारिता को नियत आयतन तथा दाब पर क्रमश: C एवं C से दर्शाया जाता है। तब:
(a) Cp - Cv का मान एकपरमाणुक आदर्श गैस की अपेक्षा द्विपरमाणुक आदर्श गैस में अधिक होता है।
(b) Cp + Cv का मान एकपरमाणुक आदर्श गैस की अपेक्षा द्विपरमाणुक आदर्श गैस में अधिक होता है।
(c) Cp / Cv का मान एकपरमाणुक आदर्श गैस की अपेक्षा द्विपरमाणुक आदर्श गैस में अधिक होता है।
(d) Cp Cv का मान एकपरमाणुक आदर्श गैस की अपेक्षा द्विपरमाणुक आदर्श गैस से अधिक होता है।
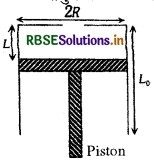
Passage-I
एक स्थिर ऊष्मीय चालक बेलन की त्रिज्या R तथा ऊँचाई Lg है। तली पर बेलन खुला है तथा इसके ऊपर के पृष्ठ पर एक छोटा छिद्र है। ऊपर के पृष्ठ से L दूरी पर एक M द्रव्यमान का पिस्टन लगा है (चित्रानुसार)। वायुमण्डलीय दाब Po है।
उत्तर:
(b) Cp + Cv का मान एकपरमाणुक आदर्श गैस की अपेक्षा द्विपरमाणुक आदर्श गैस में अधिक होता है।
प्रश्न 23.
बेलन से पिस्टन को पूर्णतः बाहर निकाल लिया जाता है। ऊपर के पृष्ठ का छिद्र बन्द कर दिया जाता है। बेलन के नीचे एक जल से भरा टैंक लाया जाता है तथा चित्रानुसार इसे इस प्रकार टैंक में रखा जाता है कि जल का स्तर बेलन के ऊपर के पृष्ठ के समान रहे। जल का घनत्व p है। सन्तुलन की अवस्था में बेलन में जल स्तम्भ की ऊँचाई सन्तुष्ट होगी:
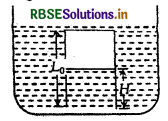
(a) pg(Lo – H)2 + Pg (Lo – H) + LgP0 = 0
(b) Pg (L) - H) 2 - Po (LH) – Lg Po = 0
(c) Pg (L) – H) 2 + Po (LH) Lo P = 0
(d) P8 (L) - H ) 2 - P (LH) + LP = 0
उत्तर:
(c) Pg (L) – H) 2 + Po (LH) Lo P = 0

प्रश्न 24.
पिस्टन की ऊपर के पृष्ठ की दूरी 21 पर छिद्र को बन्द कर दिया जाता है। फिर पिस्टन को छोड़ दिया जाता है, जहाँ से पिस्टन सन्तुलन की स्थिति में रुक सकता है। इस स्थिति में ऊपर के पृष्ठ से पिस्टन की दूरी होगी:

उत्तर:
\(\text { (d) }\left(\frac{\mathrm{P}_0 \pi \mathrm{R}^2}{\pi \mathrm{R}^2 \mathrm{P}_0-M g}\right)(2 \mathrm{~L})\)
प्रश्न 25.
अब पिस्टन को बाहर की ओर मंद गति से खींचा जाता है तथा ऊपर के पृष्ठ से 21 दूरी पर रखा जाता है। बेलन के अन्दर ऊपर के पृष्ठ तथा पिस्टन के मध्य दाब हो जाएगा:
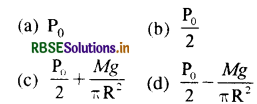
उत्तर:
\(\text { (a) } P_0\)
प्रश्न 26.
एक एकपरमाणुक आदर्श गैस के एक मोल PV आरेख के अनुसार दो चक्रीय प्रक्रमों E → F → G → E E → F → H → E में ले जाया जाता है। सम्बन्धित प्रक्रम शुद्धतः समआयतनिक, समदाबी, समतापीय या रुद्धोष्म है:
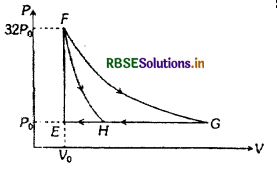
कॉलम में दिये गये पथों को कॉलम II में किये गये कार्य के परिमाण के साथ सुमेलित कीजिए और सूचियों के नीचे दिये गये कोड का प्रयोग करके सही उत्तर चुनिये।
कॉलम-I
(a) G → E
(b) G → H
(c) F → H
(d) F → G
कॉलम-II
(p) 160PVg In 2
(q) 36Pg Vo
(r) 24PoVo
(s) 31Pg Vo
उत्तर:
प्रश्न 27.
एकपरमाण्विक आदर्श गैस (monatomic ideal gas) के एक मोल का आयतन (volume), रुद्धोष्म प्रसार ( adiabatic expansion) से अपने आरम्भिक मान का आठ गुना बढ़ जाता है। सार्वत्रिक गैस नियतांक (universal gas constant) R का मान 8.0Jmol-1 / K-1 लें। यदि गैस का आरम्भिक तापमान 100 K हो, तो इस प्रक्रिया में गैस की आन्तरिक ऊर्जा (internal energy) जूल (Joule) से कम हो जाती है।
उत्तर:
900

- RBSE Class 11 Physics Important Questions Chapter 4 Motion in a Plane
- RBSE Solutions for Class 11 Physics Chapter 15 Waves
- RBSE Solutions for Class 11 Physics Chapter 14 Oscillations
- RBSE Solutions for Class 11 Physics Chapter 13 Kinetic Theory
- RBSE Solutions for Class 11 Physics Chapter 12 Thermodynamics
- RBSE Solutions for Class 11 Physics Chapter 11 Thermal Properties of Matter
- RBSE Solutions for Class 11 Physics Chapter 10 Mechanical Properties of Fluids
- RBSE Solutions for Class 11 Physics Chapter 9 Mechanical Properties of Solids
- RBSE Solutions for Class 11 Physics Chapter 8 Gravitation
- RBSE Solutions for Class 11 Physics Chapter 7 System of Particles and Rotational Motion
- RBSE Solutions for Class 11 Physics Chapter 6 Work, Energy and Power