RBSE Solutions for Class 12 Chemistry Chapter 8 d- एवं f-ब्लॉक के तत्व
Rajasthan Board RBSE Solutions for Class 12 Chemistry Chapter 8 d- एवं f-ब्लॉक के तत्व Textbook Exercise Questions and Answers.
Rajasthan Board RBSE Solutions for Class 12 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 12. Students can also read RBSE Class 12 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 12 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 12 Chemistry Solutions Chapter 8 d- एवं f-ब्लॉक के तत्व
RBSE Class 12 Chemistry d- एवं f-ब्लॉक के तत्व InText Questions and Answers
प्रश्न 1.
सिल्वर परमाणु की मूल अवस्था में पूर्ण भरित कक्षक (4d10) हैं। आप कैसे कह सकते हैं कि यह एक संक्रमण तत्व है?
उत्तर:
सिल्वर (Z = 47) +2 ऑक्सीकरण अवस्था प्रदर्शित कर सकता है जिसमें उसके 4d - कक्षक अपूर्ण भरे हुये हैं, अतः यह संक्रमण तत्व है।
प्रश्न 2.
श्रेणी Sc (Z = 21) से Zn (Z = 30) में, जिंक की कणन एन्थैल्पी का मान सबसे कम होता है, अर्थात् 126 kJ mol-1 क्यों?
उत्तर:
जिंक के इलेक्ट्रॉनिक विन्यास में अयुग्मित इलेक्ट्रॉन उपस्थित नहीं होते हैं अत: Zn के 3d- कक्षकों के इलेक्ट्रॉन धात्विक बन्ध बनाने में प्रयुक्त नहीं होते हैं जबकि 3d- श्रेणी के शेष सभी धातुओं के d- कक्षकों केइलेक्ट्रॉन धात्विक बन्ध बनाने में प्रयुक्त होते हैं। इसी कारण Zn में धात्विक बन्ध कमजोर होते हैं जिससे इनकी कणन एन्थैल्पी का मान सबसे कम हो जाता है।
प्रश्न 3.
संक्रमण तत्वों की 34 श्रेणी का कौन-सा तत्व बड़ी संख्या में ऑक्सीकरण अवस्थाएँ दर्शाता है एवं क्यों?
उत्तर:
Mn (Z = 25) के परमाणु में सर्वाधिक अयुग्मित इलेक्ट्रॉन पाये जाते हैं अतः यह + 2 से + 7 तक की ऑक्सीकरण अवस्था को प्रदर्शित करता है, जो कि सबसे बड़ी संख्या है।

प्रश्न 4.
कॉपर के लिये \(\mathbf{E}_{\left(\mathbf{M}^{2+} / \mathbf{M}\right)}^0\) का मान धनात्मक (+ 0.34V) है। इसके सम्भावित कारण क्या है?
उत्तर:
किसी धातु का मानक इलेक्ट्रोड विभव \(\left[\mathrm{E}_{\left(\mathrm{M}^{2+} / \mathrm{M}\right)}^0\right]\) निम्नलिखित एन्थैल्पियों में होने वाले परिवर्तन पर निर्भर करता है।
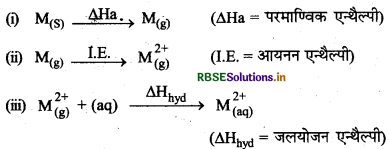
कॉपर की परमाण्विक एन्कैल्पी उच्च परन्तु जलयोजन एन्थैल्पी का मान कम होता है। इसी कारण इन तीनों एन्थैल्पियों का योग धनात्मक आता है और \(\mathrm{E}_{\left(\mathrm{Cu}^{2+} / \mathrm{Cu}\right)}^0\) का मान धनात्मक हो जाता है। दूसरे शब्दों में, हम यह कह सकते हैं कि CU(s) के cu2+(aq) में रूपान्तरण की उच्च ऊर्जा इसकी जलयोजन एन्थैल्पी द्वारा सन्तुलित नहीं हो पाती और मानक अपचयन विभव (Em) का मान धनात्मक हो जाता है।
प्रश्न 5.
संक्रमण तत्वों की प्रथम श्रेणी में आयनन एन्थैल्पी (प्रथम और द्वितीय) में अनियमित परिवर्तन को आप कैसे समझायेंगे?
उत्तर:
संक्रमण तत्वों की प्रथम श्रेणी में आयनन एन्थैल्पी (प्रथम और द्वितीय) में अनियमित परिवर्तन विभिन्न 3d- विन्यासों के स्थायित्व की क्षमता में भिन्नता के कारण होता है। यहाँ पर तथा विन्यास असामान्य रूप से स्थायी होते हैं एवं इनकी आयनन एन्चैल्पी काफी उच्च होती है।
प्रश्न 6.
कोई धातु अपनी उच्चतम ऑक्सीकरण अवस्था केवल ऑक्साइड अथवा फ्लुओराइड में ही क्यों प्रदर्शित करती है?
उत्तर:
ऑक्सीजन एवं फ्लु ओरीन दोनों ही छोटे आकार के होते हैं। इनकी विद्युत-ऋणात्मकता भी अधिक होती है, इसी कारण ये दोनों धातुओं को उनकी उच्च ऑक्सीकरण अवस्था तक ऑक्सीकृत कर सकते
प्रश्न 7.
Cr2+ एवं Fe2+ में से कौन प्रबल अपचायक है, और क्यों?
उत्तर:
Fe2+ की तुलना में Cr2+ एक प्रबल अपचायक पदार्थ है, क्योंकि Cr2+ से Cr3+ के बनने में \(d^6 \longrightarrow d^5\) में परिवर्तन होता है किन्तु Fe2+ से Fe3+ मैं \(d^4 \longrightarrow d^3\) में परिवर्तन होता है। जल जैसे माध्यम में की तुलना में अधिक स्थायी होता है क्योंकि विन्यास में कक्षक अर्द्धभरित होते हैं।

प्रश्न 8.
Mi+ आयन (2327) के लिए 'प्रचक्रण-मात्र' चुम्बकीय आघूर्ण की गणना कीजिए।
उत्तर:
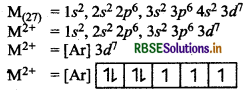
इसमें तीन अयुग्मित इलेक्ट्रॉन हैं।
∴ 'प्रचक्रण मात्र' चुम्बकीय आघूर्ण
\(\begin{aligned} \mu &=\sqrt{n(n+2)} \mathrm{BM} \\ &=\sqrt{3(3+2)} \mathrm{BM} \\ &=\sqrt{15} \mathrm{BM}=3.87 \mathrm{BM} \end{aligned}\)
प्रश्न 9.
स्पष्ट कीजिए कि Cu+ आयन जलीय विलयन में स्थायी नहीं है, क्यों ? समझाइए।
उत्तर:
Cu+(aq) से Cu2+ (aq)अधिक स्थायी होता है। क्योंकि कॉपर की द्वितीय आवनन ऊर्जा का मान अधिक होता है। परन्तु Cu2+(aq) के लिए जलयोजन एन्थैल्पी का मान Cu+(aq) की तुलना में अधिक ऋणात्मक होता है, इसलिए जलयोजन एन्थैल्पी कॉपर की द्वितीय आयनन एन्थैल्पी से होने वाली क्षति की पूर्ति कर देती है। अत: अनेक कॉपर (1) यौगिक जलीय विलयन में अस्थायी होते हैं तथा निम्नलिखित अभिक्रिया के अनुसार असमानुपातन प्रदर्शित करते हैं
\(2 \mathrm{Cu}_{(\text {aq) }}^{+} \longrightarrow \mathrm{Cu}^{2+}{ }_{(\mathrm{aq})}+\mathrm{Cu}_{(\mathrm{s})}\)
एवं Cu2+ उपर्युक्त कारणों से अत्यधिक स्थायी हो जाता है।
प्रश्न 10.
लैन्थेनॉइड आकुंचन की तुलना में एक तत्व से दूसरे तत्व के बीच ऐक्टिनॉइड आकुंचन अधिक होता है। क्यों?
उत्तर:
ऐक्टिनॉइड में 5f- इलेक्ट्रॉन नाभिकीय आवेश से प्रभावी रूप से परिरक्षित रहते हैं जबकि 4f- इलेक्ट्रॉन इतना ज्यादा परिरक्षित नहीं होते हैं। दूसरे शब्दों में हम कह सकते हैं, कि 5f- इलेक्ट्रॉन की श्रेणी में एक तत्व से दूसरे तत्व की ओर जाने पर दुर्बल परिरक्षण प्रभाव परिलक्षित होता है। इस कारण लैन्थेनॉइड आकुंचन की तुलना में एक तत्व से दूसरे तत्व के बीच ऐक्टिनॉइड आकुंचन अधिक होता है।
RBSE Class 12 Chemistry d- एवं f-ब्लॉक के तत्व Textbook Questions and Answers
प्रश्न 1.
निम्नलिखित के इलेक्ट्रॉनिक विन्यास लिखिए:
1. Cr3+
2. PM3+
3. Cu+
4. Ce4+
5. CO2+
6. Lu2+
7. Mn2+
8. Th4+
उत्तर:
- \(\mathrm{Cr}^{3+}=[\mathrm{Ar}] 3 d^3\)
- \(\mathrm{Pm}^{3+}=[\mathrm{Xe}] 4 f^4\)
- \(\mathrm{Cu}^{+}=[\mathrm{Ar}] 3 d^{10}\)
- \(\mathrm{Ce}^{4+}=[\mathrm{Xe}]\)
- \(\mathrm{Co}^{2+}=[\mathrm{Ar}] 3 d^7\)
- \(\mathrm{Lu}^{2+}=[\dot{\mathrm{X}} \mathrm{e}] 4 f^{14} 5 d^1\)
- \(\mathrm{Mn}^{2+}=[\mathrm{Ar}] \cdot 3 d^5\)
- \(\mathrm{Th}^{4+}=[\mathrm{Rn}]\)
प्रश्न 2.
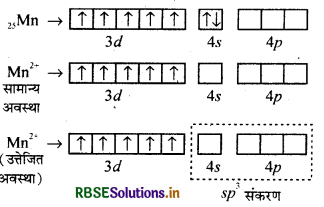
+3 ऑक्सीकरण अवस्था में ऑक्सीकृत होने के सन्दर्भ में Mn2+ के यौगिक Fe2+ के यौगिकों की तुलना में अधिक स्थायी क्यों है?
उत्तर:
Mn2+ का इलेक्ट्रॉनिक विन्यास 3d5 होता है, एवं यह अर्थपूरित होने के कारण स्थायी है। इसलिए इसकी तृतीय आयनन एन्थैल्पी बहुत अधिक होती है। क्योंकि स्थायी विन्यास से तीसरा इलेक्ट्रॉन सरलता से नहीं निकलता है। वहीं दूसरी ओर Fe2+ का इलेक्ट्रॉनिक विन्यास 34 होता है। अत: यह सरलता से एक इलेक्ट्रॉन त्यागकर स्थायी विन्यास 3d6 प्राप्त कर सकता है। यहाँ Fe2+ से Fe3+ में परिवर्तित होने के लिए आवश्यक आयनन एन्थैल्पी का मान कम होता है। इस कारण + 3 ऑक्सीकरण अवस्था में ऑक्सीकृत होने के सन्दर्भ में Mn2+ के यौगिक Fe2+ के बौगिकों की तुलना में अधिक स्थायी होते है।

प्रश्न 3.
संक्षेप में स्पष्ट कीजिए कि प्रथम संक्रमण श्रेणी के प्रथम अर्ट भाग में बढ़ते हुए परमाणु क्रमांक के साथ + 2 ऑक्सीकरण अवस्था कैसे अधिक स्थायी होती जाती है?
उत्तर:
संक्रमण तत्व की 3d - श्रेणी के प्रथम अर्द्धभाग में परमाणु क्रमांक के बढ़ने के साथ-साथ IE1 तथा IE2 का योग भी बढ़ता जाता है। अत: मानक अपचायक विभव (E) का मान कम ऋणात्मक होता है। इस कारण M2+ आयन बनाने की प्रवृत्ति भी घट जाती है। Mn की + 2 ऑक्सीकरण अवस्था का अधिक स्थायित्व इसके 4 अर्द्धपूरित कक्षक के कारण होता है, वहीं Zn के लिए + 2 ऑक्सीकरण अवस्था का अधिक स्थायित्व इसके 10 पूर्णपूरित कक्षक के कारण होता है। इसके अलावा निकिल के लिए + 2 ऑक्सीकरण अवस्था का स्थायित्व इसकी अत्यधिक जलयोजन एन्थैल्पी के कारण है।
प्रश्न 4.
प्रथम संक्रमण श्रेणी के तत्वों के इलेक्ट्रॉनिक विन्यास किस सीमा तक ऑक्सीकरण अवस्थाओं को निर्धारित करते हैं? उत्तर को उदाहरण देते हुए स्पष्ट कीजिए।
उत्तर:
प्रथम संक्रमण श्रेणी के तत्वों के इलेक्ट्रॉनिक विन्यास तथा उनकी ऑक्सीकरण अवस्थाओं के स्थायित्व परस्पर सम्बन्धित होते हैं। कुछ तत्व तथा उनकी ऑक्सीकरण अवस्थाएँ एवं विन्यास निम्न सारणी में दिये गये हैंतत्त्व इलेक्ट्रॉनिक ऑक्सीकरण विन्यास
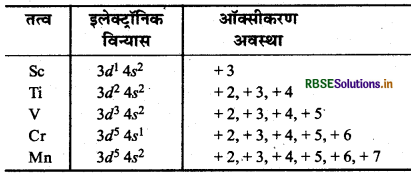
उपरोक्त सारणी का अध्ययन करने पर निम्न निष्कर्ष निकलते हैं प्रथम संक्रमण श्रेणी में, Mn से पहले पाँच तत्वों की, जिनमें 3d उपकोश अर्द्धपूरित से अधिक भरे नहीं होते, न्यूनतम ऑक्सीकरण अवस्था, बाह्य: उपकोश में इलेक्ट्रानों की संख्या द्वारा दी जाती है तथा अधिकतम ऑक्सीकरण
संख्या बाह्य: तथा d - इलेक्ट्रॉनों के योग के द्वारा दी जाती है। इस प्रकार किसी तत्व के इलेक्ट्रॉनिक विन्यास के आधार पर हम उसकी न्यूनतम व अधिकतम ऑक्सीकरण संख्या का परिकलन कर सकते हैं।
प्रश्न 5.
संक्रमण तत्वों की मूल अवस्था में नीचे दिये गये 4-इलेक्ट्रॉनिक विन्यासों में कौन-सी ऑक्सीकरण अवस्था स्थायी होगी?
3d3 3d5 3d8 तथा 3d4
उत्तर:
दिये गये -इलेक्ट्रॉनिक विन्यासों की ऑक्सीकरण अवस्थाएँ
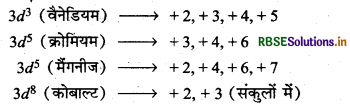
3d4 मूल या सामान्य अवस्था में विन्यास नहीं होता है।
प्रश्न 6.
प्रथम संक्रमण श्रेणी के ऑक्सो-धातु ऋणायनों के नाम लिखिए, जिसमें धातु संक्रमण श्रेणी की वर्ग संख्या के बराबर ऑक्सीकरण अवस्था प्रदर्शित करती है।
उत्तर:

(वर्ग संख्या = Cr की ऑक्सीकरण अवस्था = 6)
(ii) MnO4- (वर्ग संख्या = Mn की ऑक्सीकरण अवस्था = 7)
परमैंगनेट आयन
(ii) VO3- (वर्ग संख्या = V की सीकरण अवस्था = 5)
वैनेडेट आयन

प्रश्न 7.
लैन्थेनॉइड आंकुचन क्या है? लैन्थेनॉइड आंकुचन के परिणाम क्या है?
उत्तर:
लैन्थेनॉइड आंकुचन (Lanthanoid contraction): लैन्थेनॉइड श्रेणी में परमाणु क्रमांक के बढ़ने के साथ-साथ परमाण्विक व आयनिक त्रिज्याएँ एक तत्व से दूसरे तत्व तक घटती जाती हैं। इसे लैन्थेनॉइड आकुंचन (Lanthanoid contraction) कहते हैं। यहाँ तत्वों की त्रिज्याओं में होने वाली कमी अत्यन्त कम होती है। उदाहरण के लिए, से Lu तक जाने पर परमाण्विक त्रिज्या 183 pm से 173 pm तक ही घटती है अर्थात् पूरी श्रेणी में होने वाली कमी मात्र 10 pm ही है। इसी प्रकार Ce3+ से Lu3+ तक आने पर आयनिक त्रिज्या 103 pm से घटकर 85 pm रह जाती है अर्थात् कमी केवल 14 pm ही है।
कारण (Cause): लैन्थेनॉइड श्रेणी में एक तत्व से दूसरे तत्व तक जाने पर नाभिकीय आवेश केवल एक इकाई ही बढ़ता है क्योंकि केवल एक इलेक्ट्रॉन ही परमाणु में जुड़ता है। नये इलेक्ट्रॉन आन्तर 4f- उपकोशों में प्रवेश करते हैं। यहाँ एक 4f- इलेक्ट्रॉन का दूसरे 4f- इलेक्ट्रॉन पर परिरक्षण प्रभाव (नाभिकीय आवेश से) कक्षकों के अत्यन्त विस्तृत आकार के कारण कम होता है। यद्यपि नाभिकीय आवेश प्रत्येक पद पर एक इकाई बढ़ जाता है, इस कारण प्रत्येक 4f- इलेक्ट्रॉन द्वारा अनुभव किया जाने वाला प्रभावी नाभिकीय आवेश भी बढ़ जाता है। परिणामस्वरूप सम्पूर्ण 4f- इलेक्ट्रॉन कोश प्रत्येक तत्व के जुड़ने पर आकुंचित होता जाता है। परन्तु यह कमी अल्प होती है। इसी कारण परमाणु क्रमांक के बढ़ने पर लैन्थेनॉइडों के आकार में नियमित कमी आती जाती है, जिसे लैन्थेनॉइड आकुंचन कहते हैं।
लैग्वेनॉइड आकुंचन के परिणाम (Consequences of Lanthanoid Contraction): इसके निम्नलिखित परिणाम हैं:
(i) द्वितीय तथा तृतीय संक्रमण श्रेणियों में समानता (Similarities between second and third transition series): लैन्थेनॉइड आकुंचन के कारण, इस श्रेणी के बाद के तत्वों (Hf, Ta, w आदि) की परमाणु-त्रिज्याएँ, द्वितीय संक्रमण-श्रेणी में स्थित संगत तत्वों (क्रमश: Zr, Nb, Mo, आदि) की आयनिक त्रिज्याओं के एकदम बराबर हो जाती हैं। इसके फलस्वरूप आवर्त सारणी में अत्यन्त निकट समानता वाले zr- Hf, Nb - Ta तथा Mo - w जैसे जुड़वां तत्व (Twin-element) पाये जाते हैं। अत: लैन्थेनॉइड आकुंचन ही द्वितीय व तृतीय संक्रमण श्रेणियों में समानता के लिए उत्तरदायी है।
(ii) लैन्थेनॉइडों में समानता (Similarities among lanthanoids): लैन्थेनॉइडों को त्रिज्याओं में अल्प परिवर्तन के कारण, इनके रासायनिक गुण लगभग समान होते हैं अत: तत्वों का शुद्ध अवस्था में पृथक्करण करना अत्यन्त कठिन होता है। पुनरावृत्त प्रभाजी क्रिस्टलन अथवा आयनविनिमय तरीकों पर आधारित आधुनिक विधियों द्वारा इनके त्रिसंयोजी आयनों के आकारों में अत्यन्त अल्प अन्तर के आधार पर पृथक्करण करते हैं। इन विधियों द्वारा तत्वों के गुणों, जैसे-विलेयता, संकुल आयन निर्माण, जलयोजन आदि में बहुत कम अन्तर के आधार पर पृथक्करण किया जाता है।
(iii) क्षारकता अन्तर (Basicity difference): लैन्थेनॉइड आकुंचन के कारण लैन्थेनॉइड के तत्वों के क्षारकीय गुणों में क्रमश: कमी आती जाती है। इस गुण में क्रमिक परिवर्तन का उपयोग इनके पृथक्करण के लिए किया जाता है। अत: La(OH)3 अधिकतम क्षारीय एवं Lu(OH)3 सबसे कम क्षारीय होता है।

प्रश्न 8.
संक्रमण धातुओं के अभिलक्षण क्या हैं? इन्हें संक्रमण धातु क्यों कहा जाता है? 4 ब्लॉक के तत्वों में कौन से तत्व संक्रमण श्रेणी के तत्व नहीं कहे जा सकते?
उत्तर:
संक्रमण धातुओं के सामान्य अभिलक्षण (General Characteristics ofTransition Elements): ब्लॉक तत्वों के सामान्य गुण निम्न है
- सभी संक्रमण तत्व धातु हैं एवं वे अभिधात्विक गुण, जैसे-उच्च तनन सामर्थ्य (tensile strength), तन्यता (ductility), वर्धनीयता (malleability), उच्च तापीय तथा विद्युत चालकता एवं धात्विक चमक प्रदर्शित करते हैं।
- इन तत्वों के गलनांक तथा क्वथनांक उच्च होते हैं। इन तत्वों की वाष्पन ऊष्मा असंक्रमण तत्वों की तुलना में उच्च होती है।
- इन तत्वों के घनत्व -ब्लॉक के तत्वों से काफी उच्च होते हैं।
- मरकरी को छोड़कर, जो कि कमरे के ताप पर द्रव है, अन्य संक्रमण तत्वों की अभिधात्विक संरचनाएं होती हैं।
- इन तत्वों की प्रथम आयनन एन्थैल्पी -ब्लॉक तत्वों से अधिक परन्तु p-ब्लॉक तत्वों से कम होती है।
- ये अत्यधिक विद्युत धनात्मक तत्व होते हैं।
- ये विभिन्न ऑक्सीकरण अवस्थाएँ रिक्त कक्षकों के कारण प्रदर्शित करते हैं।
- नमें संकुल बनाने की प्रवृत्ति अत्यधिक होती है जो कि परिवर्ती ऑक्सीकरण अवस्था प्रदर्शित करने के कारण होती है।
- रिक्त कक्षकों एवं अयुग्मित इलेक्ट्रॉनों की उपस्थिति के कारण इन तत्वों के अधिकांश यौगिक रंगीन होते हैं।
- अधुग्मित इलेक्ट्रॉनों के कारण इनके यौगिक सामान्यतः अनुचुम्बकीय होते हैं।
- Mn, Ni, Co, Cr, . P आदि तत्व अंतराकाशी यौगिकों का निर्माण करते हैं। छोटे तत्व, जैसे-हाइड्रोजन, बोरॉन, कार्बन, नाइट्रोजन आदि इनके जालक में आकर रहते हैं।
- अधिकांश संक्रमण धातुएँ, जैसे - Mn, Ni, Co. Cr. Pt आदि एवं इनके यौगिक उत्प्रेरकों के रूप में प्रयुक्त किये जाते हैं।
- ये धातुएँ मिश्र धातु बनाने में प्रयुक्त होती हैं।
d - क्लॉक के तत्व संक्रमण धातुएँ कहलाती हैं क्योंकि ये तत्व अधिक विद्युत धनात्मक -स्लॉक तत्वों तथा कम विद्युत धनात्मक p ब्लॉक तत्वों से मध्यवर्ती गुण प्रदर्शित करते हैं तथा आवर्त सारणी में इनका स्थान - तथा ब्लॉक तत्वों के मध्य में है।
समूह-12 के तत्व Zn, Cd, Hg का इलेक्ट्रॉनिक विन्यास सामान्य सूत्र (n - 1)d10 ns2 से प्रदर्शित किया जा सकता है। इन तत्वों की सामान्य एवं साधारण ऑक्सीकरण अवस्था में उपकोश पूर्ण पूरित होते हैं। इनका विन्यास सामान्य अवस्था में ns2 np6 व + 2 ऑक्सीकरण अवस्था में np6 होता है।
प्रश्न 9.
संक्रमण धातुओं के इलेक्ट्रॉनिक विन्यास किस प्रकार असंक्रमण तत्वों के इलेक्ट्रॉनिक विन्यास से भिन्न है?
उत्तर:
संक्रमण तत्वों में अन्तिम इलेक्ट्रॉन उपानय कोश के के उपकोश में भरा जाता है जबकि असंक्रमण तत्वों में अन्तिम इलेक्ट्रॉन s या p उपकोश में भरा जाता है। संक्रमण तत्वों के अलेक्ट्रॉनिक विन्यास में उपान्त्य कोश में आंशिक भरे d उपकोश होते हैं, जबकि असंक्रमण तत्वों में आंशिक भरे उपकोश नहीं होते, लेकिन इनके आन्तरिक विन्यास में पर्ण भरे उपकोश होते है। संक्रमण तत्त्वों में ऑक्सीकरण अवस्थाओं में एक का अंतर होता है। जैसे मैंगनीज, + 2, + 3, + 4, + 5, + 6, + 7 अवथा दर्शाता है जबकि असंक्रमण ताचों जैसे p - ब्लॉक के तत्वों में सदैव दो का अंतर होता है, जैसे- + 2, + 4 या + 3, + 5 या + 4, + 6 आदि।
प्रश्न 10.
लैन्थेनॉइडों द्वारा कौन-कौनसी ऑक्सीकरण अवस्थाएँ प्रदर्शित की जाती हैं?
उत्तर:
लैन्थेनॉइडों की सामान्य ऑक्सीकरण अवस्था +3 होती है। इसके तत्व + 2 + 4 ऑक्सीकरण अवस्थाएँ भी प्रदर्शित करते है। इनकी वे ऑक्सीकरण अवस्थाएँ ज्यादा स्थायी होती हैं, जिनके विन्यास 4f0, 4f7 व 4f14 होते हैं।
उदाहरण के लिए: CE4+ (4f°), Tb4+ (4f7), Eu2+ (4f7), Yb2+ (4f14) ज्यादा स्थायी है। इन तत्वों की + 2 व + 4 ऑक्सीकरण अवस्थाएँ + 3 में परिवर्तित होने की प्रवृत्ति रखती हैं। ये इलेक्ट्रॉनों को त्याग कर या ग्रहण कर + 3 ऑक्सीकरण अवस्था में परिवर्तित होती है। इसी कारण Eu2+ तथा Yb2+ विलयन में अच्छे अपचायक की भाँति तथा Ce4+ व Tb4+ अच्छे ऑक्सीकारक की भाँति कार्य करते हैं।
कुछ तत्व ऐसे भी हैं जो कि f0 f7 व f14 विन्यास न होते हुए भी + 2 व + 4 ऑक्सीकरण अव प्रदर्शित करते हैं।
उदाहरण: Pr4+ (4f1), Nd2+ (4f2), Nd4+ (4f2). Sm2+ (4f6) Dy4+ (4f8) आदि।
|
लैन्थेनॉइड |
La |
Ce |
Pr |
Nd |
Pm |
Sm |
Eu |
Gd |
Tb |
|
ऑक्सीकरण अवस्था |
+3 |
+3, +4 |
+3, +4 |
+2 |
+3 |
+2 |
+2 +3 |
+3 |
+3 |
प्रश्न 11.
कारण देते हुए स्पष्ट कीजिए:
1 संक्रमण धातुएँ तथा उनके अधिकांश यौगिक अनुचुम्बकीय हैं।
2 संक्रमण धातुओं की कणन एन्थैल्पी का मान उच्च होता है।
3 संक्रमण धातुएँ सामान्यतः रंगीन यौगिक बनाती हैं।
4 संक्रमण धातुएँ तथा इनके यौगिक उत्तम उत्प्रेरक का कार्य करते हैं।
उत्तर:
1 संक्रमण धातुएँ तथा उनके अधिकांश यौगिक अयुग्मित इलेक्ट्रॉनों की उपस्थिति के कारण अनुचुम्बकीय होते हैं। इनके अनुचुम्बकत्व का निधारण 'प्रचक्रण मात्र' सूत्र द्वारा किया जाता है। यह सूत्र निम्न है
\(\mu=\sqrt{n(n+2)} \mathrm{BM}\)
यहाँ n अधुगलित इलेक्ट्रॉनों की संख्या है। इसका मात्रक बोर मैग्नेटॉन (BM) होता है।
2 संक्रमण धातुओं को कणन एन्थैल्पी के मान उच्च होते हैं, क्योंकि इनके परमाणुओं में अयुग्मित इलेक्ट्रॉनों की संख्या अधिक होती है। इस कारण इनमें प्रबल अन्तरापरमाण्विक अन्योन्यक्रियाएँ होती है तथा इसलिये परमाणुओं के मध्य प्रबल आबन्ध उपस्थित होते हैं।
3 अधिकांश संक्रमण धातु आवन विलयन तथा ठोस अवस्थाओं में रंगीन होते हैं। इसका कारण इसमें उपस्थित अयुग्मित इलेक्ट्रॉन होते हैं। ये इलेक्ट्रॉन दृश्य प्रकाश का आंशिक अवशोषण कर लेते हैं, जिससे अवशोषित प्रकाश इलेक्ट्रॉन को समान उपकोश के एक कक्षक से दूसरी कक्षक पर पहुँचा देते हैं। चूंकि इलेक्ट्रॉनिक संक्रमण धातु आयनों के-कक्षकों में होते हैं। इसलिए इसे d - d संक्रमण (d - d transition) कहते हैं। इसीdd संक्रमण के कारण ही धातु आयन विलयन तथा ठोस अवस्था में रंगीन होते हैं।
4 संक्रमण धातुएँ एवं इनके यौगिक उत्प्रेरक की तरह कार्य करते हैं। इसका कारण इनकी परिवर्तनशील संयोजकता एवं संकुल यौगिक बनाने का गुण है साथ ही इनमें खाली -कक्षक भी पाये जाते हैं जो कि इसके उत्प्रेरकीय गुण को बढ़ाने में सहायक होते हैं।
उदाहरण: V2O5 (संस्पर्श प्रक्रम में), सूक्ष्म विभाजित आयरन (हेबर प्रक्रम में), निकिल (उत्प्रेरकीय हाइड्रोजनन में) प्रयुक्त होते हैं।

प्रश्न 12.
अन्तराकाशी यौगिक क्या हैं? इस प्रकार के यौगिक संक्रमण धातुओं के लिए भली प्रकार से ज्ञात क्यों हैं?
उत्तर:
वे यौगिक जिनके क्रिस्टल जालक या अन्तराकाशी स्थलों को छोटे आकार वाले परमाणु अध्यासित कर लेते हैं, अन्तराकाशी यौगिक कहलाते हैं। अन्तराकाशी यौगिक संक्रमण धातुओं के लिए भली प्रकार से ज्ञात होते हैं; क्योंकि संक्रमण धातुओं के क्रिस्टल जालकों में उपस्थित रिक्तियों (voids) में छोटे आकार वाले परमाणु; जैसे - H, N या C सरलता से सम्पाशित या अध्यासित हो जाते हैं।
प्रश्न 13.
संक्रमण थातुओं की ऑक्सीकरण अवस्थाओं में परिवर्तनशीलता, असंक्रमण धातुओं में ऑक्सीकरण अवस्थाओं में परिवर्तनशीलता से किस प्रकार भिन्न है? उदाहरण देकर स्पष्ट कीजिए।
उत्तर:
परिवर्तनशील ऑक्सीकरण अवस्थाएँ संक्रमण धातुओं की एक प्रमुख विशेषता है। इसका कारण है, अपूर्ण व-कक्षकों में इलेक्ट्रॉनों का इस प्रकार से प्रवेश करना जिससे इन तत्वों की ऑक्सीकरण अवस्थाओं में एक का अन्तर बना रहता है। इसका उदाहरण, vII, vIII, vIv. vv हैं। दूसरी ओर असंक्रमण तत्वों में विभिन्न ऑक्सीकरण अवस्थाओं में सामान्यतः दो का अन्तर पाया जाता है। यह अन्तर असंक्रमण धातुओं में अक्रिय युग्म प्रभाव के कारण होता है।
उदाहरण: Pb(II), Pb(IV), यहाँ ऑक्सीकरण अवस्था में दो का अन्तर है।
प्रश्न 14.
आवरन क्रोमाइट अयस्क से पोटैशियम डाइक्रोमेट बनाने की विधि का वर्णन कीजिए। पोटैशियम डाइक्रोमेट विलयन पर pH बढ़ाने से क्या प्रभाव पड़ेगा?
उत्तर:
पोटैशियम डाइक्रोमेट बनाने की विधि (Method of preparation of Potassium Dichromate)
(i) क्रोमाइट अयस्क का सोडियम क्रोमेट में रूपान्तरण (Conversion of chromite ore into sodium chromate): क्रोमाइट अयस्क (FeCr2O7) को जब वायु की उपस्थिति में सोडियम या पोटैशियम कार्बोनेट के साथ संगलित किया जाता है तो सोडियम क्रोमेट प्राप्त होता है।
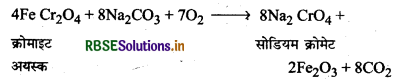
(ii) सोडियम क्रोमेट का सोडियम डाइक्रोमेट में रूपान्तरण (Conversion of sodium chromate into sodium dichromate) सोडियम क्रोमेट के पीले बिलयन को छानकर उसे सल्फ्यूरिक अम्ल द्वारा अम्लीय बना लिया जाता है, जिसमें से नारंगी सोडियम डाइक्रोमेट (Na2Cr2O7, 2H2O) को क्रिस्टलित कर लिया जाता है।
2Na2CrO4 + 2H+ → Na2Cr2O7, + 2Na+ + H2O
(iii) सोडियम डाइक्रोमेट का पोटैशियम डाइक्रोमेट में रूपान्तरण (Conversion of sodium dichromate into potassium dichromate): सोडियम डाइक्रोमेट की विलेयता, पोटेशियम हाइक्रोमेट से अधिक होती है इसलिए सोडियम डाइक्रोमेट के विलयन में पोटैशियम क्लोराइड डालकर पोटैशियम डाइक्रोमेट प्राप्त कर लिया जाता है।
Na2CrO7 + 2KCl → K2Cr2O7, + 2NaCl
पोटैशिवम डाइक्रोमेट के नारंगी रंग के क्रिस्टल, क्रिस्टलीकृत हो जाते हैं। जलीय विलयन में क्रोमेट तथा डाइक्रोमेट का अन्तरारूपान्तरण होता है जो कि विलयन के pH पर निर्भर करता है।

यहाँ क्रोमेट व डाइक्रोमेट आयनों में क्रोमियम की ऑक्सीकरण संख्या समान होती है। PH बढ़ाने पर अर्थात् विलयन को क्षारीय करने पर, डाइक्रोमेट आयन (नारंगी रंग) क्रोमेट आयनों में परिवर्तित हो जाते हैं तथा विलयन का रंग पीला हो जाता है।

प्रश्न 15.
पोटैशियम डाइक्रोमेट की ऑक्सीकरण क्रिया का उल्लेख कीजिए तथा निम्नलिखित के साथ आयनिक समीकरण लिखिए।
(i) आयोडाइड आयन
(ii) आयरन (II) विलयन
(iii) H2S
उत्तर:
पोटैशियम डाइक्रोमेट अम्लीय माध्यम में प्रबल ऑक्सीकारक का कार्य करता है। इसका उपयोग आयतनमितीय विश्लेषण में प्राथमिक मानक के रूप में किया जाता है। इसकी ऑक्सीकरण क्रिया निम्न प्रकार
\(\mathrm{Cr}_2 \mathrm{O}_7^{2-}+14 \mathrm{H}^{+}+6 \mathrm{e}^{-} \longrightarrow 2 \mathrm{Cr}^{3+}+2 \mathrm{H}_2 \mathrm{O}\)
(E= 1.33V)
आयनिक अभिक्रियाएँ (Ionic Reactions):
(i) आयोडाइड आवन के साथ (With iodide ion):

(ii) आयरन (II) विलयन के साथ (With iron (II) solution):
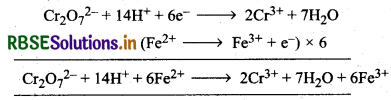
(iii) H2S के साथ (With H2S):
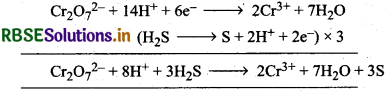
प्रश्न 16.
पोटैशियम परमैंगनेट को बनाने की विधि का वर्णन कीजिए। अम्लीय पोटैशियम परमैंगनेट किस प्रकार: (i) आयरन (ii) आयन SO2, तथा (iii) ऑक्सेलिक अम्ल से अभिक्रिया करता है। अभिक्रियाओं के रासायनिक समीकरण लिखिए।
उत्तर:
पोटैशियम परमैंगनेट बनाने की विधि (Methods of preparation of Potassium permanganate)
(A) पायरोल्यूसाइट खनिज से (From Pyrolusite Mineral): पोटैशियम परमैंगनेट को प्राप्त करने के लिए MnO2 को क्षारीय धातु हाइड्रॉक्साइड तथा KNO3 जैसे ऑक्सीकारक के साथ संगलित किया जाता है। इससे गाड़े हरे रंग का उत्पाद K2MnO4 प्राप्त होता है, जो उदासीन या अम्लीय माध्यम से असमानुपातित होकर पोटैशियम परमैंगनेट देता है।
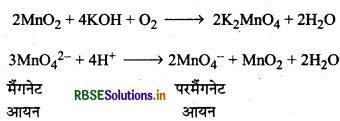
(B) औद्योगिक विधि (Industrial Method): औद्योगिक स्तर पर इसका उत्पादन MnO2 के क्षारीय ऑक्सीकरण संगलन के पश्चात्, मैंगनेट (VI) के विद्युत अपघटनी ऑक्सीकरण द्वारा किया जाता है।

(C) प्रयोगशाला विधि (Laboratory Method): प्रयोगशाला में मैंगनीज (II) आयन के लवण परऑक्सी- डाइसल्फेट द्वारा ऑक्सीकृत होकर परमैंगनेट बनाते हैं।
\(2 \mathrm{Mn}^{2+}+.5 \mathrm{~S}_2 \mathrm{O}_8{ }^{2-}+8 \mathrm{H}_2 \mathrm{O} \longrightarrow 2 \mathrm{MnO}_4{ }^{-}+10 \mathrm{SO}_4{ }^{2-}+16 \mathrm{H}^{+}\)
रासायनिक अभिक्रियाएँ (Chemical Reactions): अम्लीय पोटैशियम परमैंगनेट की रासायनिक अभिक्रियाएँ निम्नलिखित हैं
(i) आयरन (II) आयन के साथ (With Iron (II) ion)):
\(\mathrm{MnO}_4^{-}+8 \mathrm{H}^{+}+5 \mathrm{Fe}^{2+} \longrightarrow \mathrm{Mn}^{2+}+4 \mathrm{H}_2 \mathrm{O}+5 \mathrm{Fe}^{3+}\)
(ii) SO2 के साथ (With SO2):
\(2 \mathrm{MnO}_4^{-}+2 \mathrm{H}_2 \mathrm{O}+5 \mathrm{SO}_2 \longrightarrow 2 \mathrm{Mn}^{2+}+4 \mathrm{H}^{+}+5 \mathrm{SO}_4^{2-}\)
(iii) ऑक्सेलिक अम्ल के साथ (With Oxalic acid):
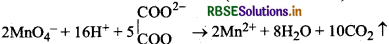
प्रश्न 17.
M2+ /M तथा M3+ / M2+ निकाय के सन्दर्भ में कुछ धातुओं के E के मान नीचे दिए गए हैं:

उपयुक्त आँकड़ों के आधार पर निम्नलिखित पर टिप्पणी कीजिए
(i) अम्लीय माध्यम में Cr3+ या Mn3+ की तुलना में Fe3+ का स्थायित्व।
(ii) समान प्रक्रिया के लिए क्रोमियम अथवा मैंगनीज धातुओं की तुलना में आयरन ऑक्सीकरण में सुगमता।
उत्तर:
(i) Cr3+/Cr2+ का अपचयन विभव ऋणात्मक है, इसलिये Cr3+ का अपचयन Cr2+ में नहीं हो सकता अर्थात् Cr3+ अत्यधिक स्थायी है। Mn3+/Mn2+ का मानक अपचयन विभव धनात्मक है तथा मान भी अधिक है, इसलिए Mn3+ का अपचयन Mn2+ में सरलता से हो सकता है अर्थात् Mn3+ कम स्थायी है। Fe3+/Fe2+ का E0 मान धनात्मक है परन्तु यह मान Mn3+/Mn2+ की अपेक्षा कम है। अत: Fe3+ आयन Mn3+ से अधिक परन्तु Cr3+ से कम स्थायी है।
Cr3+ > Fe3+ > Mn3+ (स्थायित्व)
(ii) क्रोमियम, मैंगनीज व आयरन के ऑक्सीकरण विभवों के मान क्रमश: + 0.9V, + 1.2V तथा + 0.4V होंगे जिसके ऑक्सीकरण विभव का मान जितना ज्यादा होगा वह उतना ही शीघ्र ऑक्सीकृत होगा। अत: इनके ऑक्सीकृत होने का क्रम Mn > Cr > Fe है।

प्रश्न 18.
निम्नलिखित में से कौन-से आयन जलीय विलयन में रंगीन होंगे? Ti3+, v3+, Cu+, Sc3+, Mn2+, Fe3+ तथा CO2+, प्रत्येक के लिए कारण बताइए।
उत्तर:
केवल वे आयन ही जलीय विलयन में रंगीन होंगे जिनके ब-कक्षक अपूर्ण हैं। पूर्णतया भरे हुए व रिक्त कक्षकों वाले आयन रंगहीन होते हैं। इसलिए Ti3+, v3+, Cu+, Sc3+, Mn2+, Fe3+ तथा CO2+ सभी रंगीन हैं, क्योंकि इनके -कक्षकों में अबुग्मित इलेक्ट्रॉन उपस्थित होते हैं जबकि Se3+ (3) तथा Cu2+ (3d10) रंगहीन है क्योंकि वहाँ कोई भी अयुग्मित इलेक्ट्रॉन नहीं है।
प्रश्न 19.
प्रथम संक्रमण श्रेणी की धातुओं की +2 ऑक्सीकरण अवस्थाओं के स्थायित्व की तुलना कीजिए।
उत्तर:
संक्रमण तत्व की 3d - श्रेणी के प्रथम अर्द्धभाग में परमाणु क्रमांक के बढ़ने के साथ-साथ IE1 तथा IE2 का योग भी बढ़ता जाता है। अत: मानक अपचायक विभव (E) का मान कम ऋणात्मक होता है। इस कारण M2+ आयन बनाने की प्रवृत्ति भी घट जाती है। Mn की + 2 ऑक्सीकरण अवस्था का अधिक स्थायित्व इसके 4 अर्द्धपूरित कक्षक के कारण होता है, वहीं Zn के लिए + 2 ऑक्सीकरण अवस्था का अधिक स्थायित्व इसके 10 पूर्णपूरित कक्षक के कारण होता है। इसके अलावा निकिल के लिए + 2 ऑक्सीकरण अवस्था का स्थायित्व इसकी अत्यधिक जलयोजन एन्थैल्पी के कारण है।

प्रश्न 20.
निम्नलिखित के सन्दर्भ में लैन्थेनॉइड एवं ऐक्टिनॉइड के रसायन की तुलना कीजिए।
(i) इलेक्ट्रॉनिक विन्यास
(ii) परमाण्वीय एवं आयनिक आकार
(iii) ऑक्सीकरण अवस्था
(iv) रासायनिक अभिक्रियाशीलता
उत्तर:
(i) इलेक्ट्रॉनिक विन्यास (Electronic configuration): लैन्धेनॉइडों का सामान्य इलेक्ट्रॉनिक विन्यास [Xe]54 4f1-14 5d0-1 6s2 होता है, जबकि ऐक्टिनॉइडों का सामान्य इलेक्ट्रॉनिक विन्यास [Rn]86 5f1-14 6d0-1 7s2 होता है। अत: लैन्थेनॉइड 4/श्रेणी से तथा ऐक्टिनॉइड 5/श्रेणी से सम्बद्ध होते हैं।
(ii) परमाण्वीय एवं आयनिक आकार (Atomic and ionic sizes): सैन्धेनॉइड तथा ऐक्टिनॉइड दोनों +3 ऑक्सीकरण अवस्था में अपने परमाणुओं अथवा आयनों के आकारों में कमी प्रदर्शित करते हैं। लैन्येनॉइडों में यह कमी लैन्थेनॉइड आकुंचन कहलाती है, जबकि ऐक्टिनॉइडों में यह ऐक्टिनॉइड आकुंचन कहलाती है। यद्यपि ऐक्टिनॉइडों में एक तत्व से दूसरे तत्व तक 5f- इलेक्ट्रॉनों द्वारा अत्यन्त कम परिरक्षण प्रभाव के कारण आकुंचन उत्तरोत्तर बढ़ता है। जबकि लैन्थेनॉइड आकुंचन 4f- इलेक्ट्रॉनों द्वारा परिरक्षण प्रभाव के कारण होता है तथा आकुंचन कम होता है।
(iii) ऑक्सीकरण अवस्था (Oxidation states): लैन्थेनॉइड सीमित ऑक्सीकरण अवस्थाएँ (+ 2, + 3, + 4) प्रदर्शित करते हैं जिसमें से + 3 ऑक्सीकरण अवस्था सबसे अधिक सामान्य है। इसका कारण 4f 5d तथा 6s- उपकोशों के बीच अधिक ऊर्जा-अन्तर का होना है। दूसरी ओर ऐक्टिनॉइड अधिक संख्या में ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं। क्योंकि 5f 6d तथा 7s- उपकोशों में ऊर्जा-अन्तर कम होता है।
(iv) रासायनिक अभिक्रियाशीलता (Chemical reactivity):
लैन्थेनॉइड (Lanthanoids):सामान्य रूप से श्रेणी के आरम्भ वाले सदस्य अपने रासायनिक व्यवहार में कैल्शियम की तरह बहुत क्रियाशील होते हैं, परन्तु बढ़ते परमाणु क्रमांक के साथ ये ऐलुमिनियम की तरह व्यवहार करते हैं।
लैन्थेनॉइड आलों के साथ क्रिया करने पर हाइड्रोजन गैस मुक्त करते हैं। ये कार्बन के साथ क्रिया करने पर Ln3C, Ln2C, तथा LnC2 प्रकार के कार्बाइडों को बनाते हैं। अत्यधिक क्रियाशील होने के कारण ये नाइट्रोजन, सल्फर व हैलोजन के साथ भी क्रिया कर लेते हैं, और क्रमश: नाइट्राइड, सल्फाइड व हैलाइड बनाते हैं।
लैन्थेनॉइडों की विभिन्न अभिक्रियाओं को निम्न चित्र द्वारा प्रदर्शित कर सकते हैं
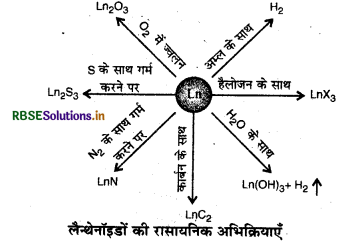
ऐक्टिनॉइड (Actinoids): ऐक्टिनॉइड अत्यधिक अभिक्रियाशील धातुएँ हैं, विशेषकर जब वे सूक्ष्म विभाजित हों। इन पर उबलते हुए जल की क्रिया से ऑक्साइड तथा हाइड्राइड का मिश्रण प्राप्त होता है और अधिकांश ऐक्टिनॉइड धातुएँ अधातुओं के साथ सामान्य ताप पर ही क्रिया करती हैं। हाइड्रोक्लोरिक अम्ल सभी ऐक्टिनॉइड धातुओं को प्रभाषित करता है, परन्तु नाइट्रिक अम्ल के साथ ये धातुएँ क्रिया करके एक संरक्षी सतह बना लेती हैं जिससे और अधिक नाइट्रिक अम्ल का प्रयोग करने पर इन पर कोई प्रभाव नहीं पड़ता है।
प्रश्न 21.
आप निम्नलिखित को किस प्रकार से स्पष्ट करेंगे:
(i) d4+ स्पीशीज में से Cr2+ प्रबल अपचायक है, जबकि मैंगनीज (III) प्रबल ऑक्सीकारक है।
(ii) जलीय विलयन में CO II स्थायी है, परन्तु संकुलनकारी अभिकर्मकों की उपस्थिति में यह सरलतापूर्वक ऑक्सीकृत हो जाती
(iii) आयनों का विन्यास अत्यन्त अस्थायी है।
उत्तर:
(i) Cr3+/Cr2+ के मानक अपचयन विभव का मान -0.41 V अर्थात् अणात्मक होता है जबकि (Mn3+/Mn2+) के मानक अपचयन विभव का मान +1.57V होता है। इस कारण Cr2+ आयन सरलता से विलयन में ऑक्सीकृत हो जाता है और Cr3+ आयन बनाता है। इसी कारण Cr2+ प्रथल.अपचायक की भाँति कार्य करता है जबकि Mn2+ आयन विलयन में सरलता से अपचयित होकर Mn2+ आयन देते हैं। इस कारण से मैंगनीज (III) प्रबल ऑक्सीकारक होता है।
(ii) Co(11) की तुलना में Co(III) का आकार छोटा व जलयोजन एन्थैल्पी ज्यादा होती है इस कारण से Co(III) की लिगण्डों की उपस्थिति में उपसहसंयोजक संकुल बनाने की प्रवृत्ति ज्यादा होती है। अत: जलीय विलयन में Co(II) स्थायी होते हुए भी संकुलनकारी अभिकर्मकों अर्थात् लिगैण्ड की उपस्थिति में आसानी से ऑक्सीकृत हो जाती है।
(iii) d1 विन्यास के आयनों में d-उपकोश में उपस्थित एक इलेक्ट्रॉन खोकर d0 स्थायी विन्यास प्राप्त करने की प्रवृत्ति अधिक होती है इसलिए d1 विन्यास अस्थायी होता है और ऑक्सीकरण या असमानुपातन अभिक्रियाओं को प्रदर्शित करता है।
प्रश्न 22.
असमानुपातन से आप क्या समझते हैं? जलीय विलयन में असमानुपातन अभिक्रियाओं के दो उदाहरण दीजिए।
उत्तर:
अभिक्रियाएँ जिनमें एक ही पदार्थ का ऑक्सीकरण तथा अपचयन होता है, असमानुपातन अभिक्रियाएँ कहलाती हैं। असमानुपातन अभिक्रियाओं में सम्मिलित तत्व की ऑक्सीकरण संख्या के घटने तथा बड़ने पर दो भिन्न उत्पाद बनते हैं।
उदाहरण:
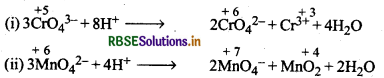
प्रश्न 23.
प्रथम संक्रमण श्रेणी में कौन-सी धातु बहुधा तथा क्यों +1 ऑक्सीकरण अवस्था दर्शाती है?
उत्तर:
कॉपर का इलेक्ट्रॉनिक विन्यास 3d10 4s1 है। यह सरलता से 4s1 इलेक्ट्रॉन खोकर स्थायी d10 विन्यास दे सकता है। इसलिए यह बहुधा + 1 ऑक्सीकरण अवस्था प्रदर्शित करता है।

प्रश्न 24.
निम्नलिखित गैसीय आयनों में अयुग्मित इलेक्ट्रॉनों की गणना कीजिए:
Mn3+, Cr3+ ,v3+ तथा Ti3+ इनमें से कौन-सा जलीय विलयन में अति स्थायी है?
उत्तर:
- Mn3+ के d-उपकोश में चार इलेक्ट्रॉन (3d4) है; अत: इसमें चार अयुग्मित इलेक्ट्रॉन होते हैं।
- cr3+ के-उपकोश में तीन इलेक्ट्रॉन (3d3) है, अत: इसमें तीन अयुग्मित इलेक्ट्रॉन होते हैं।
- v3+ के त-उपकोश में दो इलेक्ट्रॉन (3d2) है, अत: इसमें दो अयुग्मित इलेक्ट्रॉन होते हैं।
- Ti3+ के उपकोश में एक इलेक्ट्रॉन (3d1) है, अत: इसमें एक अयुग्मित इलेक्ट्रॉन होता है।
- इनमें से Cr3+ जलीय विलयन में अति स्थायी है; क्योंकि इसमें अर्द्धपूरित t2g स्तर अर्थात् (t2) होता है।
प्रश्न 25.
उदाहरण देते हुए संक्रमण धातुओं के रसायन के निम्नलिखित अभिलक्षणों के कारण बताइए:
(i) संक्रमण धातु का निम्नतम ऑक्साइड क्षारकीय हैं, जबकि उच्चतम ऑक्साइड उभयधर्मी या अम्लीय है।
(I) संक्रमण धातु की उच्चतम ऑक्सीकरण अवस्था ऑक्साइडों तथा फ्लुओराइडों में प्रदर्शित होती है।
(ii) धातु के ऑक्सो ऋणायनों में उच्चतम ऑक्सीकरण अवस्था प्रदर्शित होती है।
उत्तर:
(i) जब धातुओं के ऑक्साइडों में निम्न ऑक्सीकरण अवस्थाएँ होती हैं, तो वे आयनिक बन्ध बनाते हैं। निम्न ऑक्सीकरण अवस्था में आयनिक बन्ध बनने के दौरान कम इलेक्ट्रॉन भाग लेते हैं, जिस कारण प्रभावी नाभिकीय आवेश कम होता है, और धातु के ऑक्साइड इलेक्ट्रॉनों का दान आसानी से कर सकते हैं तथा क्षार के समान व्यवहार करते है। जबकि संक्रमण धातुओं के उच्चतम ऑक्साइड उभयधर्मी या अम्लीय होते हैं क्योंकि धातु का परमाणु उच्च ऑक्सीकरण अवस्था में होता है। उच्च ऑक्सीकरण अवस्था में सहसंयोजी आबन्ध बनते हैं तथा अधिक इलेक्ट्रॉन आवन्धन में भाग लेते हैं जिस कारण प्रभावी नाभिकीय आवेश उच्च होता है और धातु के ऑक्साइड इलेक्ट्रॉन ग्रहण कर सकते हैं तथा लुईस अम्लों के समान व्यवहार करते हैं।
(ii) ऑक्सीजन तथा फ्लुओरीन का आकार कम तथा विद्युतऋणात्मकता अत्यधिक होती है, इस कारण संक्रमण धातुओं की उच्चतम ऑक्सीकरण अवस्थाएँ ऑक्साइडों एवं फ्लुओराइडों द्वारा प्रदर्शित होती हैं। उदाहरण: O5F6 में ओसमियम की ऑक्सीकरण अवस्था (+ 6) तथा V2O5 में वैनेडियम की ऑक्सीकरण अवस्था (+ 5) होती है।
(iii) धातु के ऑक्सो अणायनों में उच्च ऑक्सीकरण अवस्था प्रदर्शित होती है, जैसे - Cr2O72- में cr को ऑक्सीकरण अवस्था + 6 है, जबकि MnO4- में Mn की ऑक्सीकरण अवस्था + 7 है। धातु का ऑक्सीजन से संयोग का कारण ऑक्सीजन की उच्च विद्युत-ऋणात्मकता, छोटा आकार तथा इसका प्रबल ऑक्सीकारक का गुण है।

प्रश्न 26.
निम्नलिखित को बनाने के लिए विभिन्न पदों का उल्लेख कीजिए:
(i) क्रोमाइट अयस्क से K2Cr2O7
(ii) पाइरोल्यूसाइट से KMnO4
उत्तर:
(i) क्रोमाइट अयस्क से K2Cr2O7 , (K2Cr2O7 , from chromite ore): परिवर्तनशील ऑक्सीकरण अवस्थाएँ संक्रमण धातुओं की एक प्रमुख विशेषता है। इसका कारण है, अपूर्ण व-कक्षकों में इलेक्ट्रॉनों का इस प्रकार से प्रवेश करना जिससे इन तत्वों की ऑक्सीकरण अवस्थाओं में एक का अन्तर बना रहता है। इसका उदाहरण, vII, vIII, vIv. vv हैं। दूसरी ओर असंक्रमण तत्वों में विभिन्न ऑक्सीकरण अवस्थाओं में सामान्यतः दो का अन्तर पाया जाता है। यह अन्तर असंक्रमण धातुओं में अक्रिय युग्म प्रभाव के कारण होता है।
उदाहरण: Pb(II), Pb(IV), यहाँ ऑक्सीकरण अवस्था में दो का अन्तर है।
(ii) पाइरोल्यूसाइट से KMnO4, (KMnO4, from Pyrolusite): पोटैशियम डाइक्रोमेट अम्लीय माध्यम में प्रबल ऑक्सीकारक का कार्य करता है। इसका उपयोग आयतनमितीय विश्लेषण में प्राथमिक मानक के रूप में किया जाता है। इसकी ऑक्सीकरण क्रिया निम्न प्रकार
\(\mathrm{Cr}_2 \mathrm{O}_7^{2-}+14 \mathrm{H}^{+}+6 \mathrm{e}^{-} \longrightarrow 2 \mathrm{Cr}^{3+}+2 \mathrm{H}_2 \mathrm{O}\)
(E= 1.33V)
आयनिक अभिक्रियाएँ (Ionic Reactions):
(i) आयोडाइड आवन के साथ (With iodide ion):

(ii) आयरन (II) विलयन के साथ (With iron (II) solution):
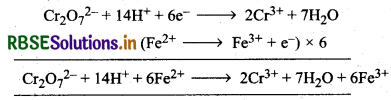
(iii) H2S के साथ (With H2S):
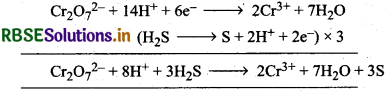
प्रश्न 27.
मिश्र धातुएँ क्या हैं? लैन्थेनॉइड धातुओं से युक्त एक प्रमुख मिश्र धातु का उल्लेख कीजिए। इसके उपयोग भी बताइए।
उत्तर:
मिश्र धातुएँ (Alloys): मिश्रातु या मिश्रधातु (Alloy) विभिन्न धातुओं का मिश्रण होता है। यह एक प्रकार से समांगी ठोस विलयन हो सकता है जिनमें एक धातु के परमाणु दूसरी धातु के परमाणुओं में अनियमित रूप से वितरित रहते हैं। इस प्रकार मिश्रधातु उनमें उपस्थित धातुओं के परमाणुओं के वितरण से बनती हैं। यहाँ धातुओं की परमाणु त्रिज्याओं में 15% का अन्तर होता है। सैन्धेनॉइडों की एक मिश्र धातु मिश धातु (Misch metal) है। इसमें लैन्थेनॉइड धातु (Ln 95%), आयरन (Fe5%) तथा कुछ मात्रा में S,C,C RAI उपस्थित होता है। मिश धातु मैग्नीशियम आधारित मित्रातु में प्रयुक्त होती है जो कि बन्दूक की गोली, कवच या खोल तथा हल्के पिलण्ट के उत्पादन में प्रयोग होता है।
प्रश्न 28.
आन्तरिक संक्रमण तत्व क्या हैं? बताइए कि निम्नलिखित में कौन-से परमाणु क्रमांक आन्तरिक संक्रमण तत्वों के हैं?
29, 59, 74, 95, 102, 104
उत्तर:
f - ब्लॉक के तत्व आन्तरिक संक्रमण तत्व कहलाते हैं। इन तत्वों में अन्तिम इलेक्ट्रॉन-उपक्रोश में प्रवेश करता है। इसकी दो श्रेणियाँ होती है
- लैन्थेनॉइड श्रेणी (परमाणु क्रमांक 58 - 71):
- ऐक्टिनॉइड श्रेणी (परमाणु क्रमांक 90 - 103)
इसी प्रकार परमाणु क्रमांक 59, 95 तथा 102 वाले तत्व आंतरिक संक्रमण तत्व है।
प्रश्न 29.
ऐक्टिनॉइड तत्वों का रसायन उतना नियमित नहीं है जितना कि लैन्थेनॉइड तत्वों का रसायन। इन तत्वों की ऑक्सीकरण अवस्थाओं के आधार पर इस कथन का आधार प्रस्तुत कीजिए।
उत्तर:
ऐक्टिनॉइडों की ऑक्सीकरण अवस्थाएँ विस्तृत परास में होती हैं तथा इनमें अधिकतर तत्व रेडियोधर्मी होते हैं, इस कारण इन तत्वों के अध्ययन में विशेष कठिनाइयाँ उत्पन्न होती है। लैन्थेनॉइड तत्वों में केवल एक स्थायी ऑक्सीकरण अवस्था होती है। इसके अलावा इनके तत्वों के आकार व नाभिकीय आवेश में अल्प परिवर्तन होता है जो लैन्येनॉइडों के रसायन को आसान कर देते हैं।
ऑक्सीकरण अवस्थाओं के आधार पर व्याख्या- लैन्थेनॉइडों में सामान्य व स्थायी ऑक्सीकरण अवस्था + 3 होती है। इसके अलावा ये + 2 व + 4 ऑक्सीकरण अवस्थाओं को ही प्रदर्शित करते हैं जबकि ऐक्टिनॉइडों में ऑक्सीकरण अवस्था का परास + 2 से लेकर + 7 तक होता है, अर्थात् ऐक्टिनॉइड अधिक मात्रा में ऑक्सीकरण अवस्थाओं को प्रदर्शित करते हैं। इस कारण से ऐक्टिनॉइडों का अध्ययन ऑक्सीकरण अवस्थाओं के आधार पर अत्यन्त कठिन है।

प्रश्न 30.
ऐक्टिनाइड श्रेणी का अन्तिम तत्व कौन-सा है? इस तत्व का इलेक्ट्रॉनिक विन्यास लिखिए। इस तत्व की सम्भावित ऑक्सीकरण अवस्थाओं पर टिप्पणी कीजिए।
उत्तर:
ऐक्टिनॉइड श्रेणी का अन्तिम तत्व लॉरेन्शियम (Z = 103) है। इसका इलेक्ट्रॉनिक विन्यास निम्नलिखित है
- Lr (Z = 103) = [Rn]86 5f14 6d1 7s2
- Lr की सम्भावित ऑक्सीकरण अवस्था + 3 है।
प्रश्न 31.
हुण्ड-नियम के आधार पर Ce3+ आयन के इलेक्ट्रॉनिक विन्यास को व्युत्पन्न कीजिए तथा 'प्रचकण मात्र' सूत्र के आधार पर इसके चुम्बकीय आघूर्ण की गणना कीजिए।
उत्तर:
हुण्ड-नियम के आधार पर Ce3+ आयन का इलेक्ट्रॉनिक विन्यास निम्नवत् व्युत्पन्न किया जा सकता है
\(\begin{aligned} { }^{58} \mathrm{Ce} &=[\mathrm{Xe}] 4 f^1 5 d^1 6 s^2 \\ \mathrm{Ce}^{3+} &=[\mathrm{Xe}] 4 f^1 \end{aligned}\)
अत: Ce3+ में केवल एक ही अयुग्मित इलेक्ट्रॉन है अर्थात् n = 1 इसलिए
चुम्बकीय आघूर्णं
\(\begin{aligned} (\mu) &=\sqrt{n(n+2)} \\ &=\sqrt{1(1+2)} \\ &=\sqrt{3}=1 \cdot 73 \mathrm{BM} \end{aligned}\)
प्रश्न 32.
लैन्थेनॉइड श्रेणी के उन सभी तत्वों का उल्लेख कीजिए, जो + 4 तथा + 2 ऑक्सीकरण अवस्थाएं प्रदर्शित करते हैं। इस प्रकार के व्यवहार तथा उनके इलेक्ट्रॉनिक विन्यास के बीच सम्बन्ध स्थापित कीजिए।
उत्तर:
लैन्येनॉइड श्रेणी में + 4 ऑक्सीकरण अवस्था दर्शाने वाले तत्व हैं
\({ }_{58} \mathrm{Ce},{ }_{59} \mathrm{Pr},{ }_{60} \mathrm{Nd},{ }_{65} \mathrm{~Tb},{ }_{66} \mathrm{Dy}\)
इसी प्रकार सैन्येनॉइड श्रेणी में + 2 ऑक्सीकरण अवस्था प्रदर्शित करने वाले तत्व है:
\({ }_{60} \mathrm{Nd},{ }_{62} \mathrm{Sm},{ }_{63} \mathrm{Eu},{ }_{69} \mathrm{Tm},{ }_{70} \mathrm{Yb}\)
तत्व + 2 ऑक्सीकरण अवस्थाएँ तब प्रदर्शित करता है जब लैन्थेनॉइडों का विन्यास 5d0 6s2 होता है जिससे दो इलेक्ट्रॉन आसानी से निकल सके।
ये + 4 ऑक्सीकरण अवस्थाएँ तब प्रदर्शित करते हैं जब लैन्येनॉइडों का शेष विन्यास 4f0 या 4f7 पर समाप्त हो। इसके अलावा 4f1 4f2 तथा 4f8 विन्यास वाले तत्व भी + 4 ऑक्सीकरण अवस्था दशति हैं।

प्रश्न 33.
निम्नलिखित के सन्दर्भ में ऐक्टिनॉइड श्रेणी के तत्वों तथा लैन्थेनॉइड श्रेणी के तत्वों के रसायन की तुलना कीजिए:
(i) इलेक्ट्रॉनिक विन्यास
(ii) ऑक्सीकरण अवस्थाएँ
(iii) रासायनिक अभिक्रियाशीलता।
उत्तर:
(i) इलेक्ट्रॉनिक विन्यास (Electronic configuration): लैन्धेनॉइडों का सामान्य इलेक्ट्रॉनिक विन्यास [Xe]54 4f1-14 5d0-1 6s2 होता है, जबकि ऐक्टिनॉइडों का सामान्य इलेक्ट्रॉनिक विन्यास [Rn]86 5f1-14 6d0-1 7s2 होता है। अत: लैन्थेनॉइड 4/श्रेणी से तथा ऐक्टिनॉइड 5/श्रेणी से सम्बद्ध होते हैं।
(ii) परमाण्वीय एवं आयनिक आकार (Atomic and ionic sizes): सैन्धेनॉइड तथा ऐक्टिनॉइड दोनों +3 ऑक्सीकरण अवस्था में अपने परमाणुओं अथवा आयनों के आकारों में कमी प्रदर्शित करते हैं। लैन्येनॉइडों में यह कमी लैन्थेनॉइड आकुंचन कहलाती है, जबकि ऐक्टिनॉइडों में यह ऐक्टिनॉइड आकुंचन कहलाती है। यद्यपि ऐक्टिनॉइडों में एक तत्व से दूसरे तत्व तक 5f- इलेक्ट्रॉनों द्वारा अत्यन्त कम परिरक्षण प्रभाव के कारण आकुंचन उत्तरोत्तर बढ़ता है। जबकि लैन्थेनॉइड आकुंचन 4f- इलेक्ट्रॉनों द्वारा परिरक्षण प्रभाव के कारण होता है तथा आकुंचन कम होता है।
(iii) ऑक्सीकरण अवस्था (Oxidation states): लैन्थेनॉइड सीमित ऑक्सीकरण अवस्थाएँ (+ 2, + 3, + 4) प्रदर्शित करते हैं जिसमें से + 3 ऑक्सीकरण अवस्था सबसे अधिक सामान्य है। इसका कारण 4f 5d तथा 6s- उपकोशों के बीच अधिक ऊर्जा-अन्तर का होना है। दूसरी ओर ऐक्टिनॉइड अधिक संख्या में ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं। क्योंकि 5f 6d तथा 7s- उपकोशों में ऊर्जा-अन्तर कम होता है।
प्रश्न 34.
61,91, 101 तथा 109 परमाणु क्रमांक वाले तत्वों के इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
(i) z = 61 (यह प्रोमिथियम, Pr का परमाणु क्रमांक है)
\({ }_{61} \mathrm{Pr}=[\mathrm{Xe}] 4 f^5 5 d^0 6 s^2\)
(ii) z = 91 (यह प्रोटेक्टिनियम, Pa का परमाणु क्रमांक है।)
\({ }_{91} \mathrm{~Pa}=[\mathrm{Rn}] 5 f^2 6 d^1 7 s^2\)
(iii) z = 101 (यह मेण्डेलीवियम Md का परमाणु क्रमांक है।)
\({ }_{101} \mathrm{Md}=[\mathrm{Rn}] 5 f^{13} 6 d^0 7 s^2\)
(iv) z = 109 (यह मेटनेरियम, Mt का परमाणु क्रमांक है।)
\({ }_{109} \mathrm{Mt}=[\mathrm{Rn}] 5 f^{14} 6 d^7 7 s^2\)
प्रश्न 35.
प्रथम श्रेणी के संक्रमण तत्वों के अभिलक्षणों की द्वितीय एवं तृतीय श्रेणी के वर्गों के संगत तत्वों से क्षैतिज वर्गों में तुलना कीजिए। निम्नलिखित बिन्दुओं पर विशेष महत्व दीजिए:
(i) इलेक्ट्रॉनिक विन्यास
(ii) ऑक्सीकरण अवस्थाएँ
(iii) आबनन एन्थैल्पी तथा
(iv) परमाण्वीय आकार।
उत्तर:
(i) इलेक्ट्रॉनिक विन्यास (Electronic configuration): एक ही वर्ग के तत्वों के इलेक्ट्रॉनिक विन्यास सामान्यतः समान होते हैं परन्तु अग्रांकित प्रकार मैतिज वर्गों की तुलना की जा सकती है:
प्रथम श्रेणी: केवल दो अपवाद होते हैं।
\((i) { }_{24} \mathrm{Cr}=[\mathrm{Ar}] 3 d^5 4 s^1 (ii) { }_{29} \mathrm{Cu}=[\mathrm{Ar}] 3 d^{10}\)
द्वितीय श्रेणी: इसमें छ: अपवाद होते हैं:
- \( { }_{42} \mathrm{Mo}=[\mathrm{Kr}] 4 d^5 5 s^1\)
- \({ }_{41} \mathrm{Nb}=[\mathrm{Kr}] 4 d^4 5 s^1\)
- \({ }_{44} \mathrm{Ru}=[\mathrm{Kr}] 4 d^7 5 s^1\)
- \({ }_{45} \mathrm{Rh}=[\mathrm{Kr}] 4 d^8 5 s^1\)
- \({ }_{46} \mathrm{Pd}=[\mathrm{Kr}] 4 d^{10} 5 s^0\)
- \({ }_{47} \mathrm{Ag}=[\mathrm{Kr}] 4 d^{10} 5 s^1\)
तृतीय श्रेणी: इसमें दो अपवाद हैं
- \({ }_{78} \mathrm{Pt}=[\mathrm{Xe}] 4 f^{14} 5 d^9 6 s^1\)
- \({ }_{79} \mathrm{Au}=[\mathrm{Xe}] 4 f^{14} 5 d^{19} 6 s^1\)
(ii) ऑक्सीकरण अवस्थाएँ (Oxidation states): समान क्षैतिज वर्ग में तत्व सामान्यतः समान ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं। प्रत्येक श्रेणी के मध्य में तत्वों द्वारा प्रदर्शित ऑक्सीकरण अवस्थाओं की संख्या अधिकतम होती है, जबकि अन्त में न्यूनतम होती है।
(iii) आबनन एन्थैल्पी (Ionization enthalpy): प्रत्येक श्रेणी में बाएँ से दाएँ जाने पर प्रथम आयनन एन्यैल्पी सामान्यतः धीरे-धीरे बढ़ती है, यद्यपि प्रत्येक श्रेणी में कुछ अपवाद भी प्रेक्षित होते हैं। समान क्षैतिज वर्ग में 3d- श्रेणी के तत्वों की तुलना में 4d- श्रेणी के कुछ तत्वों की प्रथम आयनन एन्थैल्पी उच्च तथा कुछ तत्वों की कम होती है, यद्यपि 5d- श्रेणी की प्रथम आयनन एन्थैल्पी 3 तथा 4d- श्रेणियों की तुलना में उच्च होती है। इसका कारण 5d- श्रेणी में 4f- इलेक्ट्रॉनों पर नाभिक का दुर्बल परिरक्षण प्रभाव है।
(iv) परमाण्वीय आकार (Atomic sizes): सामान्यत: किसी श्रेणी मैं समान आवेश के आयन अथवा परमाणु, परमाणु क्रांक बढ़ने के साथ त्रिज्याओं में क्रमिक कमी प्रदर्शित करते हैं, यद्यपि यह कमी अत्यन्त कम होती है, परन्तु 4d- श्रेणी के परमाणुओं के आकार, 3d- श्रेणी के सम्बन्धित तत्वों की तुलना में अधिक होते हैं, जबकि 5d- श्रेणी के सम्बन्धित तत्वों के आकार लगभग समान होते हैं। इसका कारण लैन्थेनॉइड आकुंचन है।

प्रश्न 36.
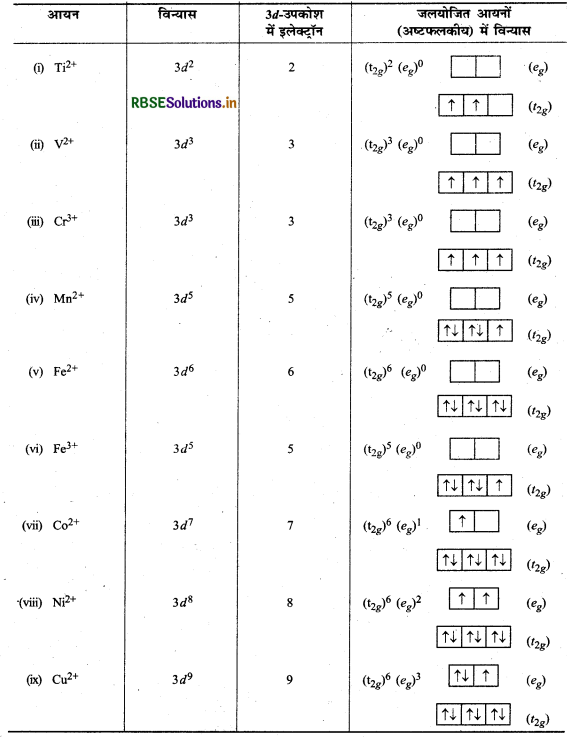
निम्नलिखित आवनों में प्रत्येक के लिए 3d इलेक्ट्रॉनों की संख्या लिखिए:
\(\mathrm{Ti}^{2+}, \mathrm{V}^{2+}, \mathrm{Cr}^{3+}, \mathrm{Mn}^{2+} \mathrm{Fe}^{2+}, \mathrm{Fe}^{3+}, \mathrm{Co}^{2+}, \mathrm{Ni}^{2+}, \mathrm{Cu}^{2+}\)
आप न जलयोजित आयनों (अष्टफलकीय) में पाँच 34 कक्षकों को किस प्रकार अधिग्रहीत करेंगे
उत्तर:
प्रश्न 36.
प्रथम संक्रमण श्रेणी के तत्व भारी संक्रमण तत्वों के अनेक गुणों से भिन्नता प्रदर्शित करते हैं। टिप्पणी कीजिए।
उत्तर:
प्रथम संक्रमण श्रेणी के तत्व भारी संक्रमण तत्त्वों के अनेक गणों से भिन्नता प्रदर्शित करते हैं, यह कथन पूर्णतया सत्य है, क्योंकि इस कथन के पक्ष में कुछ प्रमाण निम्न हैं:
- भारी संक्रमण तत्वों (4d तथा 5d श्रेणियों) की परमाणु त्रिज्याएँ प्रथम संक्रमण श्रेणी के सम्बन्धित तत्त्वों की तुलना में अधिक होती हैं। परन्तु 4 तथा 50 श्रेणियों की त्रिज्याएँ आपस में समान होती हैं।
- 5d श्रेणी की आयनन एन्थैल्पियों 3d तथा 4d श्रेणियों के तत्वों से उच्च होती हैं।
- 4d व 5d श्रेणियों की कणन एन्थैल्पियाँ प्रथम श्रेणी के सम्बन्धित तत्वों की तुलना में उच्च होती है।
- 4d व 5d श्रेणियों के तत्वों के गलनांक व क्वथनांक प्रथम श्रेणी की तुलना में अधिक होते हैं। इनके गलनांक व क्वथनांक के उच्च होने का कारण इनमें उपस्थित प्रबल अन्तराधात्विक बन्धों की उपस्थिति है।
प्रश्न 37.
निम्नलिखित संकुल स्पीशीज के चुम्बकीय आघूणों के मान से आप क्या निष्कर्ष निकालेंगे?
उदाहरण: चुम्बकीय आघूर्ण (BM)
\(\begin{array}{ll} \mathrm{K}_4\left[\mathrm{Mn}(\mathrm{CN})_6\right] & 2 \cdot 2 \\ {\left[\mathrm{Fe}\left(\mathrm{H}_2 \mathrm{O}\right)_6\right]^{2+}} & 5 \cdot 3 \\ \mathrm{~K}_2\left[\mathrm{MnCl}_4\right] & 5 \cdot 9 \end{array}\)
उत्तर:
n = 1 के लिए, \(\mu=\sqrt{1(1+2)}=\sqrt{3}=1.73 \mathrm{BM}\)
n = 2 के लिए \(\mu=\sqrt{2(2+2)}=\sqrt{8}=2.83 \mathrm{BM}\)
n = 3 के लिए \(\mu=\sqrt{3(3+2)}=\sqrt{15}=3.87 \mathrm{BM}\)
n = 4 के लिए \(\mu=\sqrt{4(4+2)}=\sqrt{24}=4.9 \text { B.M. }\)
n = 5 के लिए \(\mu=\sqrt{5(5+2)}=\sqrt{35}=5 \cdot 92 \text { B.M. }\)
(i) K4[Mn(CN)6]: इस संकुल के चुम्बकीय आघूर्ण का मान 2.2 दिया गया है। यहाँ संकुल में Mn की ऑक्सीकरण अवस्था + 2 है। ये दोनों बातें यह दर्शाती हैं कि दिये गये संकुल में एक अयुग्मित इलेक्ट्रॉन है अर्थात् जब CN- लिगैण्ड Mn2+ से जुड़ता है, तो इलेक्ट्रॉन स्थानान्तरित होकर 3d- उपकोश में बुगलित हो जाते हैं। अत: CN- एक प्रबल लिगैण्ड है, तथा यहाँ d2sp3 संकरण पाया जाता है और अष्टफलकीय संकुल बनाता है।
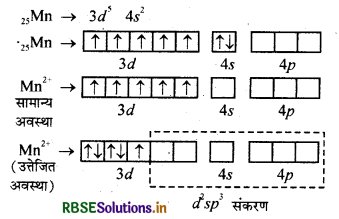
K4[Mn(CN)6] में एक अयुग्मित इलेक्ट्रॉन है इस कारण इसमें कम अनुचुम्बकत्व पाया जाता है।
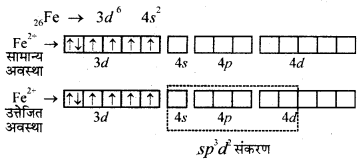
(ii) [Fe(H2O)6]2+ इस संकुल के चुम्बकीय आघूर्ण का मान 5.3 BM दिया गया है। यहाँ संकुल में Fe की ऑक्सीकरण संख्या (+2) है। ये दोनों बातें दर्शाती है कि दिये गये संकुल में 4 अयुग्मित इलेक्ट्रॉन होंगे अर्थात् जब H2O लिगैण्ड आयरन से जुड़ता है तो कोई भी इलेक्ट्रॉन युगलित नहीं होता है। अत: H2O एक दुर्बल लिगैण्ड है। यहाँ sp3 d2 संकरण पाया जाता है। अयुग्मित इलेक्ट्रॉनों की संख्या अधिक होने के कारण इस संकुल का अनुचुम्बकत्व गुण अत्यधिक होता है तथा संरचना अष्टफलकीय होती है।
(iii) K2[MnCl4]- इस संकुल के चुम्बकीय आघूर्ण का मान 5.9 BM दिया गया है तथा संकुल में Mn की ऑक्सीकरण संख्या (+ 2) है। ये दोनों बातें दर्शाती हैं कि दिये गये संकुल में 5 अयुग्मित इलेक्ट्रॉन है, अर्थात् जब लिगैण्ड Mn से जुड़ता है तो कोई भी इलेक्ट्रॉन युगलित नहीं होता है। अत: CI एक दुर्बल लिगैण्ड है। यहाँ पर sp3 संकरण पाया जाता है। अयुग्मित इलेक्ट्रॉनों की संख्या अधिक होने के कारण इस संकुल का अनुचुम्बकत्व गुण अत्यधिक होगा तथा संरचना चतुष्फलकोय होगी।

- RBSE Class 12 Chemistry Notes Chapter 16 दैनिक जीवन में रसायन
- RBSE Class 12 Chemistry Notes Chapter 15 बहुलक
- RBSE Class 12 Chemistry Notes Chapter 14 जैव-अणु
- RBSE Class 12 Chemistry Notes Chapter 13 ऐमीन
- RBSE Class 12 Chemistry Notes Chapter 12 ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
- RBSE Class 12 Chemistry Notes Chapter 11 ऐल्कोहॉल, फीनॉल एवं ईथर
- RBSE Class 12 Chemistry Notes Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
- RBSE Class 12 Chemistry Notes Chapter 9 उपसहसंयोजन यौगिक
- RBSE Class 12 Chemistry Notes Chapter 8 d- एवं f-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम