RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व
These comprehensive RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व will give a brief overview of all the concepts.
Rajasthan Board RBSE Solutions for Class 12 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 12. Students can also read RBSE Class 12 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 12 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 12 Chemistry Chapter 7 Notes p-ब्लॉक के तत्व
→ निकोजेन्स (Pnicogens):
निकोजेन्स का अर्थ है “दम घोंटने वाला।" समूह-15 के तत्व निकोजन्स कहलाते हैं तथा इन तत्वों के यौगिकों को निकोनाइड्स कहा जाता है।
→ समूह-15 के हाईड्राइडों के गुण (Properties of Hydrides of Group-15)
- NH3 > PH3 > AsH3 > SbH3 > BiH3 (स्थायित्व)
- NH3 > PH3 > ASH3> SbH3 > BiH3 (क्षारीय गुण)
- NH3 < PH3 < AsH3 < SbH3 < BiH3 (अपचायक गुण)
- PH3 < AsH3 < NH3 < SbH3 < BiH3 (क्वथनांक)
- NH3 > PH3 > ASH3 > SbH3 > BiH3 (बन्ध कोंण)
- PH3 < ASH3 < SbH3 <NH3 < BiH3 (गलनांक)
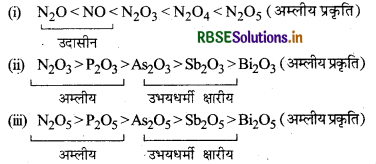
→ समूह-15 के ऑक्साइडों के गुण (Properties of Oxides of Group-15)
→ फॉसी जाँ बीमारी (Phossy Jaw Disease):
सफेद फॉस्फोरस की वाष्प जहरीली होती है। फॉस्फोरस उद्योग में काम करने वाले मनुष्यों के जबड़े धीरे-धीरे क्षयित हो जाते हैं। इस बीमारी को फॉसी जॉ बीमारी कहते हैं।

→ स्फुरदीप्ति (Phosphorescene):
वायु के सम्पर्क में आने पर सफेद फॉस्फोरस अंधेरे में रसोसंदीप्ति क्रिया के कारण दीप्तिमान हो जाता है। इसे स्फुरदीप्ति कहते हैं।
→ वोर्टेक्स वलय (Vortex Rings):
फॉस्फीन गैस के बुलबुले वायु के सम्पर्क में आते हैं तथा आग पकड़ लेते हैं एवं स्वतः ही धुएँ के छल्ले बनाते हैं जिन्हें वोर्टेक्स वलय (vortex rings) कहते
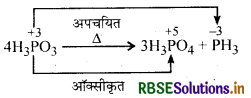
→ असमानुपातन अभिक्रिया (Disproportionation Reaction):
जब किसी अभिक्रिया में एक तत्व ऑक्सीकृत व अपचयित साथसाथ होता है तो इस अभिक्रिया को असमानुपातन अभिक्रिया कहते हैं।
→ कैल्कोजेन (Chalcogens):
कैल्कोजेन का अर्थ है अयस्क बनाने वाले तत्व। समूह-16 के ऊपर के चार तत्व कैल्कोजेन कहलाते हैं।
→ समूह-16 के हाइड्राइडों के गुण (Properties of Hydrides of Group-16)
- H2O < H2Te < H2Se < H2S (वाष्पशीलता)
- H2S <H2Se < H2Te < H2O (क्वथनांक व गलनांक)
- H2O > H2S > H2Se > H2Te (तापीय स्थायित्व)
- H2O < H2S < H2Se < H2Te (अपचायक गुण)
- H2O < H2S < H2e < H2Te (सह-संयोजक लक्षण)
- H2O > H2S > H2Se > H2Te (बन्ध कोंण)
- H2O < H2S < H2Se < H2Te (अम्लीय लक्षण)
→ मिश्रित ऑक्साइड या सेस्क्यीऑक्साइड (Mixed Oxide or Sesquioxide):
ऐसे ऑक्साइड जो कि दो सामान्य ऑक्साइड का मिश्रण होते हैं। जिनमें धातु अलग-अलग ऑक्सीकरण अवस्था में उपस्थित होती है, संयुक्त ऑक्साइड कहलाते हैं। उदाहरण-Fe3O4 [Fe (II), Fe (III)], Pb3O4 [Pb (IV), Pb (II)]
Mn3O4[Mn (II), Mn (IV)]
→ संक्रमण ताप (Transition Temperature):
एकनताक्ष सल्फर 369K के ऊपर के ताप पर स्थायी होता है। इसके नीचे के ताप पर यह विषमलम्बाक्ष सल्फर में परिवर्तित हो जाता है। इसके विपरीत a-सल्फर 369 K से नीचे के ताप पर स्थायी है तथा इसके ऊपर B-सल्फर में परिवर्तित हो जाता है। 369 K पर दोनों रूप स्थायी होते हैं यह ताप, संक्रमण ताप (Transition Temperature) कहलाता है।
→ हैलोजन (Halogens):
हैलोजेन में हेलो का अर्थ है लवण तथा जेनेस का अर्थ है उत्पन्न करना अर्थात् लवण पैदा करने वाले। समूह 17 के तत्व हैलोजेन कहलाते हैं।
→ समूह-17 के हाइड्राइडों के गुण (Properties of Hydrides of Group-17)
- HCl > HBr > HI > HF
- HCl < HBr < HI
- HCl > HBr > HI (तापीय स्थायित्व)
- HF < HCl < HBr < HI (अम्लीय गुण)
- HF < HCl < HBr < HI (अपचायक गुण)
→ काँच पर अंकन (Etching of Glass):
HF की प्रवृत्ति काँच से क्रिया कर उसे घोलने की होती है। HF के इस गुण का उपयोग काँच पर अंकन के लिये करते हैं। अंकन के लिये काँच की जिस सतह को । चिकना रखना होता है उस पर मोम लगा करके, उपकरण या बर्तन को HF के विलयन में डाल देते हैं। कुछ समय पश्चात् खुली सतह का अंकन हो जाता है।

→ अन्य महत्त्वपूर्ण बिन्दु (Other Important Points)
- समूह-15 के तत्वों के हाइड्राइडों की संरचना पिरैमिडीय होती
- नाइट्रोजन में d-कक्षकों की अनुपस्थिति के कारण यह पेन्टा-हैलाइड नहीं बनाता है।
- अमोनिया NaOCl के साथ क्रिया करके हाइड्राजीन (N2H4) बनाती है।
- N2O को हँसाने वाली गैस (Laughing gas) कहते हैं।
- H3PO4 (फॉस्फोरिक अम्ल) त्रिक्षारीय जबकि H3PO2 (फॉस्फोरस अम्ल) द्विक्षारीय होता है।
- ऑक्सीजन की ऑक्सीकरण संख्या (-2) है जबकि इस समूह के अन्य तत्वों की ऑक्सीकरण संख्या (--2, + 2, +4, +6) होती
- SO2 की विरंजन क्रिया अस्थायी (अपचयन के कारण) होती है जबकि क्लोरीन की (ऑक्सीकरण के कारण) स्थायी होती है।
- सल्फ्यूरिक अम्ल जो कि एक प्रबल अम्ल है तथा यह निर्जली कारक तथा ऑक्सीकारक दोनों की तरह व्यवहार करता है।
- CN-, SCN- व OCN- स्यूडो हैलाइड आयन कहलाते हैं, जबकि (CN)2, (SCN)2 व (OCN)2 स्यूडो हैलोजन कहलाते हैं।
→ जीनॉन का पहला यौगिक Xe+[PtF6]- है जिसे 1962 में नील बर्टलेट (Neil Bartlett) ने बनाया था।

- RBSE Class 12 Chemistry Notes Chapter 16 दैनिक जीवन में रसायन
- RBSE Class 12 Chemistry Notes Chapter 15 बहुलक
- RBSE Class 12 Chemistry Notes Chapter 14 जैव-अणु
- RBSE Class 12 Chemistry Notes Chapter 13 ऐमीन
- RBSE Class 12 Chemistry Notes Chapter 12 ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
- RBSE Class 12 Chemistry Notes Chapter 11 ऐल्कोहॉल, फीनॉल एवं ईथर
- RBSE Class 12 Chemistry Notes Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
- RBSE Class 12 Chemistry Notes Chapter 9 उपसहसंयोजन यौगिक
- RBSE Class 12 Chemistry Notes Chapter 8 d- एवं f-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम
- RBSE Class 12 Chemistry Notes Chapter 5 पृष्ठ रसायन