RBSE Solutions for Class 12 Chemistry Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम
Rajasthan Board RBSE Solutions for Class 12 Chemistry Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम Textbook Exercise Questions and Answers.
Rajasthan Board RBSE Solutions for Class 12 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 12. Students can also read RBSE Class 12 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 12 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 12 Chemistry Solutions Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम
RBSE Class 12 Chemistry तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम InText Questions and Answers
प्रश्न 1.
सारणी (6.1) पाठ्य - पुस्तक (इस पुस्तक में सारणी 2 पृष्ठ सं. 449 में दर्शाये गये अयस्कों में से कौन से चुम्बकीय पृथक्करण विधि द्वारा सान्द्रित किये जा सकते हैं?
उत्तर:
ऐसे अयस्क जिनमें एक घटक चुम्बकीय होता है, वे ही चुम्बकीय पृथक्करण विधि द्वारा सान्द्रित किये जा सकते हैं। अतः सारणी में दिये गये अयस्कों में से निम्न अयस्क चुम्बकीय पृथक्करण विधि से सान्द्रित किये जा सकते हैं:
- हेमेटाइट (Fe2O3)
- मैग्नेटाइट (Fe3O4)
- सिडेराइट (Fe2O3)
- आयरन पाइराइट (FeS2)
प्रश्न 2.
ऐल्यूमीनियम के निष्कर्षण में निक्षालन का क्या महत्व
उत्तर:
निक्षालन की सहायता से बॉक्साइट अयस्क में उपस्थित अशुद्धियाँ, जैसे: SiO, Fe2O3, TiO2 आदि को हटाया जा सकता है एवं शुद्ध ऐलुमिना प्राप्त कर सकते हैं।

प्रश्न 3.
अभिक्रिया
Cr2O3 + 2Al → Al2O3 + 2Cr (∆G° = -421 kJ) के गिब्ज ऊर्जा मान से लगता है कि अभिक्रिया ऊष्मागतिकी के अनुसार सम्भव है, पर यह कक्ष ताप पर सम्पन्न क्यों नहीं होती?
उत्तर:
ऊष्मागतिकीय रूप से सम्भव अभिक्रियाओं के लिए भी सक्रियण ऊर्जा की एक निश्चित मात्रा की आवश्यकता होती है। अत: उपर्युक्त प्रश्न में दी गई अभिक्रिया को सम्पन्न कराने के लिए अतिरिक्त ऊष्मा की आवश्यकता होगी, इसलिए यह अभिक्रिया कक्ष ताप पर सम्भव नहीं है।
प्रश्न 4.
क्या यह सत्य है कि कुछ विशिष्ट परिस्थितियों में मैग्नीशियम, SiO2 को अपचयित कर सकता है और Si, MgO को भी। वे परिस्थितियाँ कौन-सी हैं?
उत्तर:
एलिंघम आलेख के अनुसार, 1693K से कम ताप पर, SiO2 के निर्माण के लिए ∆GO वक्र, MgO के ∆Go वक्र से ऊपर स्थित होता है। अत: 1693K से कम ताप पर Mg, SiO2 को Si में अपचयित कर सकता है, वहीं पर 1693K से अधिक ताप पर Si, MgO को Mg में अपचयित कर सकता है।
RBSE Class 12 Chemistry तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम Textbook Questions and Answers
प्रश्न 1.
कॉपर का निष्कर्षण हाइड्रोधातुकर्म द्वारा किया जाता है, परन्तु जिंक का नहीं। व्याख्या कीजिए।
उत्तर:
विद्युत रासायनिक श्रेणी में Zn का स्थान हाइड्रोजन से ऊपर है अर्थात् जिंक के मानक इलेक्ट्रोड विभव का मान \(\mathrm{E}_{\mathrm{Zn}^{2+} / \mathrm{Zn}}\) = -0.76 v है जबकि Cu का स्थान हाइड्रोजन से नीचे है। अर्थात् इसके मानक इलेक्ट्रोड विभव का मान \(\mathrm{E}_{\mathrm{Zn}^{2+} / \mathrm{Zn}}\) = +0.34V है। अत: Zn धातु जल से क्रिया करके अपना सम्बन्धित आयन बनाती है तथा H2 गैस को मुक्त करती है। परन्तु Cu जल से अभिक्रिया नहीं करता। इस कारण से कॉपर का निष्कर्षण हाइड्रोधातुकर्म द्वारा किया जा सकता है, परन्तु जिंक का नहीं।
प्रश्न 2.
फेन प्लवन विधि में अवनमक की क्या भूमिका है?
उत्तर:
फेन प्लवन विधि में अवनमक का प्रयोग दो सल्फाइड अयस्कों को पृथक् करने में किया जाता है। यह एक प्रकार के सल्फाइड अयस्क को वायु-बुलबुलों के साथ फेन में आने से रोकता है। उदाहरण के लिए, Pbs तथा ZnS को पृथक् करने के लिए NaCN का प्रयोग करते हैं। NaCN, ZnS के साथ क्रिया करके एक जिंक संकुल, Na2[Zn (CN)4] का निर्माण करता है जो कि जल में ही रहता है तथा झाग के साथ सतह पर नहीं जाता है जबकि Pbs झाग के साथ सतह पर चला जाता है। इस प्रकार हम PbS तथा Zns को अवनमक की सहायता से पृथक् कर सकते हैं।

प्रश्न 3.
अपचयन द्वारा ऑक्साइड अयस्कों की अपेक्षा पाइराइट से ताँबे का निष्कर्षण अधिक कठिन क्यों है?
उत्तर:
एलिंघम आरेख से ज्ञात होता है कि Cu2S के निर्माण की मानक मुक्त ऊर्जा (∆G) का मान CS2 तथा H2S के निर्माण की मानक मुक्त ऊर्जा की तुलना में अधिक है। अत: कार्बन तथा हाइड्रोजन, Cu2S को Cu में अपचयन नहीं कर सकते हैं।
CuS + H2 → अपचयन नहीं
Cu2S + C → अपचयन नहीं
वहीं दूसरी ओर Cu2O के निर्माण की मानक मुक्त ऊर्जा (∆G) का मान CO2 के (∆G°) की तुलना में अत्यन्त कम होता है। अत: कार्बन सरलता से Cupo का अपचयन कर देता है।
Cu2O + C → 2Cu + CO
अतः अपचयन द्वारा ऑक्साइड अयस्कों की अपेक्षा पाइराइट से ताँबे का निष्कर्षण अधिक कठिन होता है।
प्रश्न 4.
व्याख्या कीजिए:
(i) मण्डल परिष्करण
(ii) स्तम्भ वर्णलेखिकी।
उत्तर:
(i) मण्डल परिष्करण (Zone refining): इस प्रक्रम के द्वारा अत्यधिक शुद्ध धातुएँ प्राप्त होती हैं। परिष्करण की यह विधि इस तथ्य पर आधारित है कि अशुद्धियाँ गलित धातु के साथ रहने की प्रवृत्ति रखती हैं। Ge, Si और Ga को जिन्हें अर्द्ध-चालक के रूप में प्रयुक्त किया जाता है, इसी विधि द्वारा परिष्कृत करते हैं।
(ii) स्तम्भ वर्णलेखिकी: यह विधि इस सिद्धान्त पर आधारित है कि अधिशोषक पर मिश्रण के विभिन्न घटकों का अधिशोषण अलग-अलग होता है। मिश्रण को द्रव या गैसीय माध्यम में रखा जाता है जो कि अधिशोषक में से गुजरता है। स्तम्भ में विभिन्न घटक भिन्न-भिन्न स्तरों पर अधिशोषित हो जाते हैं। बाद में अधिशोषित घटक उपयुक्त विलायकों (निक्षालक) द्वारा निक्षालित कर लिये जाते हैं। गतिशील माध्यम की भौतिक अवस्था, अधिशोषक पदार्थ की प्रकृति एवं गतिशील माध्यम के गमन के प्रक्रम पर भी निर्भर होने के कारण इसे वर्णलेखिकी नाम दिया जाता है। इस प्रकार की एक विधि में कांच की नली का एक स्तम्भ बनाया जाता है तथा गतिशील माध्यम जिसमें अवयवों का विलयन उपस्थित होता है, द्रव प्रावस्था में होता है। यह स्तम्भ वर्णलेखिकी (कॉलम क्रोमैटोग्राफी) का एक उदाहरण है।
स्तंभ वर्णलेखिकी सूक्ष्म मात्रा में पाए जाने वाले तत्वों के शुद्धिकरण और शुद्ध किये जाने वाले तत्व तथा अशुद्धियों के रासायनिक गुणों में अधिक भिन्नता न होने की स्थिति में शुद्धिकरण के लिए अत्यधिक उपयोगी होती है। अनेक वर्णलेखिकी तकनीक हैं, जैसे कि पेपर वर्णलेखिकी, स्तम्भ वर्णलेखिकी, गैस वर्णलेखिकी आदि।
प्रश्न 5.
673 K ताप पर C तथा CO में से कौन-सा अच्छा अपचायक है?
उत्तर:
CO
प्रश्न 6.
कॉपर के विद्युत अपघटन शोधन में ऐनोड पंक में उपस्थित सामान्य तत्वों के नाम दीजिए। वे वहाँ कैसे उपस्थित होते हैं?
उत्तर:
कॉपर के विद्युत अपघटन शोधन में ऐनोड पंक में उपस्थित सामान्य तत्व सेलीनियम (Se), ऐण्टिमनी (Sb), टेल्यूरियम (Te), सिल्वर (Ag), गोल्ड (Au), प्लैटिनम (Pt) आदि हैं। ये तत्व कम क्रियाशील होने के कारण विद्युत अपघट्य (CuSO4 + H2SO4) के विलयन द्वारा प्रभावित नहीं होते और ऐनोड पंक में एकत्र हो जाते हैं।

प्रश्न 7.
आयरन (लोहे) के निष्कर्षण के दौरान वात्या भट्टी के विभिन्न क्षेत्रों में होने वाली रासायनिक अभिक्रियाएँ लिखिए।
उत्तर:
आयरन (लोहे) के निष्कर्षण के दौरान वात्या भट्टी के विभिन्न क्षेत्रों में होने वाली रासायनिक अभिक्रियाएँ निम्न है
(1) दहन खण्ड (Combustion zone): इसका तापमान 2170 K होता है। यह सबसे नीचे का क्षेत्र है। यहाँ कार्बन का दहन होता है।
C + O2 → CO2 + ऊर्जा
(2) गलन खण्ड (Fusion zone): इसका तापमान 1570K होता है। यह दहन खण्ड से ऊपर का क्षेत्र है। यहाँ कार्बन मोनो-ऑक्साइड का निर्माण तथा शेष बचे हुए आयरन ऑक्साइड का अपचयन होता है।
CO2 + C → 2CO ऊर्जा
FeO + CO → Fe + CO2
(3) धातुमल खण्ड (Slag formation zone): इसका तापमान 1270 K होता है। इस खण्ड में धातुमल का निर्माण होता है।
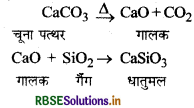
(4) अपचयन खण्ड (Reduction zone): इसका तापमान 1070 K होता है यह सबसे ऊपर जाने वाला क्षेत्र है। इस खण्ड में आयरन का निर्माण होता है।
Fe2O3 + 3CO → + 2Fe + 3CO2
FeO + CO → Fe + CO2
Fe2CO + FeO → Fe3O4
Fe3O4 + CO → 3FeO + CO2
FeO + CO → Fe + CO2
प्रश्न 8.
जिंक ब्लेण्ड से जिंक के निष्कर्षण में होने वाली रासायनिक अभिक्रियाओं को लिखिए।
उत्तर:
जिंक ब्लेण्ड से जिंक के निष्कर्षण में होने वाली रासायनिक अभिक्रियाएँ निम्नलिखित हैं:
(1) सान्द्रण (Concentration): अयस्क को पीसकर फेन प्लवन प्रक्रम द्वारा इसका सान्द्रण किया जाता है।
(2) भर्जन (Roasting): सान्द्रित अयस्क का लगभग 1200 K ताप पर वायु की अधिकता में भर्जन किया जाता है जिससे जिंक ऑक्साइड (ZnO) प्राप्त होता है।
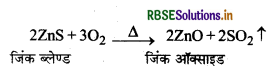
(3) अपचयन (Reduction): प्राप्त जिंक ऑक्साइड को चूर्णित कोक के साथ मिलाकर एक फायर क्ले रिटॉर्ट में 1673K तक गर्म किया जाता है। परिणामस्वरूप यह जिंक धातु में अपचयित हो जाता है।
\(\mathrm{ZnO}+\mathrm{C} \stackrel{1673 \mathrm{~K}}{\longrightarrow} \mathrm{Zn} \uparrow+\mathrm{CO} \uparrow\)
1673K पर जिंक धातु वाष्पीकृत होकर (क्वथनांक 1180 K) आसवित हो जाती है।
(4) विद्युत अपघटनी शोधन (Electrolytic refining): अशुद्ध जिंक ऐनोड बनाता है तथा कैथोड शुद्ध जिंक की शीट से बना होता है। विद्युत - अपघट्य तनु H2SO4 से अम्लीकृत ZnSO4 विलयन होता है। विद्युत धारा प्रवाहित करने पर शुद्ध Zn कैथोड पर एकत्र हो जाता है।
प्रश्न 9.
कॉपर के थातुकर्म में सिलिका की भूमिका बताइए।
उत्तर:
भर्जन के दौरान कॉपर पाइराइट FeO तथा Cu2O के मिश्रण में परिवर्तित हो जाते हैं।
FeO (क्षारीय) को हटाने के लिए प्रगलन के दौरान एक अम्लीय गालक सिलिका मिलाया जाता है। FeO SiO2 से संयोग करके फेरस सिलिकेट (FeSiO3) धातुमल बनाता है जो गलित अवस्था में प्राप्त मैट पर तैरने लगता है।
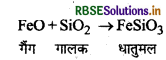
कॉपर के निष्कर्षण में siO2 गालक का कार्य करता है।

प्रश्न 10.
यदि किसी सूक्ष्म मात्रा में प्राप्त हुआ हो तो शोधन की कौन-सी तकनीक अधिक उपयोगी होगी?
उत्तर:
स्तम्भ वर्ण लेखिकी (कॉलम क्रोमैटोग्राफ़ी) सूक्ष्म मात्रा में पाए जाने वाले तत्वों के शुद्धिकरण और शुद्ध किए जाने वाले तत्व तथा अशुद्धियों के रासायनिक गुणों में अधिक भिन्नता न होने की स्थिति में, शुद्धिकरण के लिए अत्यधिक उपयोगी होती है।
प्रश्न 11.
यदि किसी तत्व में उपस्थित अशुद्धियों के गुण तत्व से -मिलते-जुलते हों तो आप शोधन के लिए किस विधि का सुझाव देगें।
उत्तर:
जब किसी तत्व में उपस्थित अशुद्धियाँ के गुण तत्व से मिलते-जुलते हो तो ऐसी स्थिति स्तम्भ वर्ण लेखिकी विधि द्वारा शुद्धिकरण के लिए सुझाव दिया जा सकता है।
प्रश्न 12.
निकिल शोधन की विधि समझाइए।
उत्तर:
माण्ड प्रक्रम (Mond's Process): इस विधि में निकिल को कार्बन मोनो-ऑक्साइड के साथ गर्म करने पर वाष्पशील निकिल टेट्राका निल संकुल बनता है जो कि वाष्पशील होता है। इस कार्बोनिल को और अधिक ताप पर गर्म करने पर, यह विघटित होकर शुद्ध निकिल बनाता है।

प्रश्न 13.
सिलिका युक्त बॉक्साइट अयस्क में से सिलिका को ऐलुमिना से कैसे अलग करते हैं? और यदि कोई समीकरण हो तो दीजिए।
उत्तर:
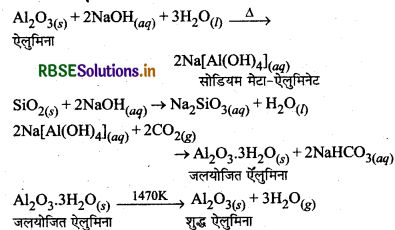
बॉक्साइट को शुद्ध करने का बेयर प्रक्रम (Baeyer's Process for the Purification of Rauxite): सर्वप्रथम अशुद्ध बॉक्साइट अयस्क को सान्द्र NaOH के विलयन के साथ 473 - 523K ताप पर तथा 35 - 36 bar दाब पर गर्म करते हैं जिससे ऐलुमिना, सोडियम मेटा-ऐलुमिनेट के रूप में तथा सिलिका, सोडियम सिलिकेट के रूप में घुल जाती हैं तथा विलयन में शेष अशुद्धियाँ, जैसे - TiO2 Fe2O3 आदि अवशेष के रूप में रह जाती हैं। विलयन को छानकर पृथक् कर लिया जाता है। अब विलयन में CO2 गैस प्रवाहित करते हैं जिससे विलयन उदासीन हो जाता है तथा इस अवस्था में विलयन को ताजा बने हुए जलयोजित Al2O3 के नमूने से बीजारोपित किया जाता है जो कि अवक्षेप को प्रेरित करता है।
अवक्षेप के आ जाने पर उसे छान लेते हैं तथा धोकर, सुखाकर तेज गर्म करते हैं जिससे पुनः शुद्ध Al2O3 प्राप्त हो जाता है।
अभिक्रियाएँ:
प्रश्न 14.
उदाहरण देते हुए भर्जन व निस्तापन में अन्तर बताइए।
उत्तर:
|
भर्जन (Roasting) |
निस्तापन (Calcination) |
|
1. अयस्कों को उनके ऑक्साइड में परिवर्तित करने के लिए, उसे वायुकी उपस्थिति में उसके गलनांक के नीचे ताप पर तेज गर्म करते हैं। |
1. अयस्कों को उनके ऑक्साइड में परिवर्तित करने के लिए उसे वायु की अनुपस्थिति में उसके गलनांक के नीचे ताप पर तेज गर्म करते हैं। |
|
2 भर्जन अधिकतर सल्फाइड अयस्कों का होता है। |
2 निस्तापन कार्बोनेट तथा हाइड्रॉक्साइड अयस्कों का होता है। |
|
उदाहरण: |
उदाहरण: |

प्रश्न 15.
उलवा लोहा कच्चे लोहे से किस प्रकार भिन्न होता है?
उत्तर:
वात्या भट्टी से प्राप्त लोहे में लगभग 4% कार्बन तथा अन्य अशुद्धियाँ; जैसे - S, P. Si, Mn सूक्ष्म मात्रा में उपस्थित रहती हैं। यह कच्चे लोहे (pig iron) के नाम से जाना जाता है तथा इसे विभिन्न आकृतियों में डाला जा सकता है। दलवा लोहा (cast iron) कच्चे लोहे से भिन्न होता है तथा इस कच्चे लोहे को, रद्दी लोहे एवं कोक के साथ गर्म हवा के झोंकों द्वारा पिघलाकर बनाया जाता है। इसमें थोड़ा कम कार्बन (लगभग 3%) होता है तथा यह अति कठोर और भंगुर होता है।
प्रश्न 16.
अयस्कों तथा खनिजों में अन्तर स्पष्ट कीजिए।
उत्तर:
- खनिज (Minerals): प्राकृतिक रूप से पाये जाने वाले वे सभी रासायनिक पदार्थ, जिनके रूप में धातुएँ अशुद्धियों के साथ भू-पर्पटी में उपस्थित होती हैं, खनिज कहलाते हैं। उदाहरण: क्ले, बॉक्साइट, माइका, डोलोमाइट, जिंक ब्लेण्ड आदि।
- अयस्क (Ores): वे खनिज, जिनसे धातुओं का निष्कर्षण सरल तथा आर्थिक रूप से लाभदायक हो, अयस्क कहलाते हैं। अत: सभी अयस्क खनिज होते हैं, परन्तु सभी खनिज अयस्क नहीं होते हैं।
उदाहरण: बॉक्साइट एक अयस्क है परन्तु क्ले या माइका नहीं, क्योंकि बॉक्साइट से ऐल्यूमीनियम का निष्कर्षण आसानी से हो जाता है एवं वह आर्थिक रूप से भी लाभदायक होता है।
प्रश्न 17.
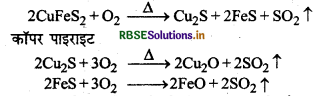
कॉपर मैट को सिलिका की परत चढ़े हुए परिवर्तकों में क्यों रखा जाता है?
उत्तर:
कॉपर मैट में Cu2S तथा FeS होता है, जिसमें से एक अयस्क एवं एक गैंग है। जब कॉपर मैट को सिलिका की परत चढ़े हुए परिवर्तक में लेकर इसमें गर्म वायु का तेज झोंका प्रवाहित करते है तो मैट में उपस्थित गैंग FeS गालक SiO2 जो कि परिवर्तक में परत के रूप में चढ़ा होता है, के साथ मिलकर FesiO3 धातुमल का निर्माण करता है जिसे अयस्क से अलग कर दिया जाता है।

जब सम्पूर्ण Fes धातुमल के रूप में पृथक् हो जाता है तब Cu2S का ऑक्सीकरण Cu2O में होता है जो कि अपचवित होकर Cu धातु बनाता है।
\(\begin{aligned} 2 \mathrm{Cu}_2 \mathrm{~S}+3 \mathrm{O}_2 & \rightarrow 2 \mathrm{Cu}_2 \mathrm{O}+2 \mathrm{SO}_2 \\ 2 \mathrm{Cu}_2 \mathrm{O}^{\circ}+\mathrm{Cu}_2 \mathrm{~S} & \rightarrow 6 \mathrm{Cu}+\mathrm{SO}_2 \end{aligned}\)
अत: सिलिका की परत चढ़े हुए परिवर्तक को लेने का मुख्य कारण यह है कि यहाँ SiO2 गालक का कार्य करती है तथा FeS को FesiO3 (धातुमल) के रूप में बदल कर अयस्क CuS से पृथक कर देती है।

प्रश्न 18.
एल्यूमीनियम क धातुकर्म में क्रायोलाइट का क्या भूमिका है?
उत्तर:
ऐल्यूमीनियम के धातुकर्म में क्रायोलाइट की भूमिका:
- यह मुख्यतः वैद्युत अपघट्य ऐलुमिना के गलनांक को कम कर देता है।
- यह चालकता की वृद्धि कर देता है।
प्रश्न 19.
निम्न कोटि के कॉपर अयस्कों के लिए निक्षालन क्रिया को कैसे किया जाता है?
उत्तर:
निम्न कोटि के कॉपर अयस्कों के लिए निक्षालन क्रिया वायु की उपस्थिति में अम्लों के साथ करते हैं। क्रिया करने पर कॉपर धातु Cu2+ आयनों में परिवर्तित होकर विलयन में चली जाती है।
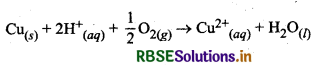
प्रश्न 20.
CO का उपयोग करते हुए अपचयन द्वारा जिंक ऑक्साइड से जिंक निष्कर्षण क्यों नहीं किया जाता?
उत्तर:
CO का उपयोग करते हुए अपचयन द्वारा जिक ऑक्साइड से जिंक का निष्कर्षण इसलिए नहीं किया जाता है क्योंकि एलिघम आरेख से ज्ञात होता है कि CO से CO2 के निर्माण की मानक मुक्त कर्जा (∆G) का मान Zn से ZnO के निर्माण की मानक मुक्त ऊर्जा (∆Go) के मान की तुलना में अधिक होता है अत: CO का उपयोग नहीं करते हैं।
प्रश्न 21.
Cr2O3 के विरचन के लिए ∆fG° का मान -540J/mol है तथा Al2O3 के लिए -827J/mol है। क्या Cr2O3 का अपचयन से सम्भव है?
उत्तर:
दोनों समीकरण निम्न प्रकार है:
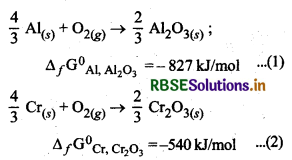
समीकरण (2) को (1) में से घटाने पर,
\(\frac{4}{3} \mathrm{Al}_{(s)}+\frac{2}{3} \mathrm{Cr}_2 \mathrm{O}_{3(s)} \rightarrow \frac{2}{3} \mathrm{Al}_2 \mathrm{O}_{3(s)}+\frac{4}{3} \mathrm{Cr}_{(s)}\)
∆fGO = -287J/mol
चूँकि संयुक्त रेडॉक्स अभिक्रिया की मानक मुक्त ऊर्जा का मान ऋणात्मक है अत: Cr2O3 का अपचयन Al से सम्भव है।

प्रश्न 22.
C व CO में से ZnO के लिए कौन-सा अपचायक अच्छा है?
उत्तर:
हम जानते हैं कि जिक ऑक्साइड का अपचयन कोक द्वारा किया जाता है। इसमें कॉपर की स्थिति की अपेक्षा ताप अधिक रखा जाता है। तापन के लिए ऑक्साइड की कोक तथा मृदा के साथ छोटी-झेटी ईंटें बनाई जाती हैं।
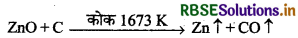
धातु को आसवित कर तथा तीव्र शीतलन द्वारा एकत्र कर लेते हैं। एलिंघम आरेख से ज्ञात होता है कि C से CO के निर्माण की मुक्त ऊर्जा (∆fGo) 1120K से अधिक ताप पर कम हो जाती है, जबकि C से CO2 के निर्माण की मुक्त ऊर्जा, ZnO के ∆fG° की तुलना में, 1323 K से अधिक ताप पर कम हो जाती है। यद्यपि CO से CO2 की ∆fG°ZnO से हमेशा अधिक होती है। यही कारण है कि ZnO का अपचयन Zn में कार्बन तो कर सकता है परन्तु CO नहीं।
प्रश्न 23.
किसी विशेष स्थिति में अपचायक का चयन ऊष्मागतिकी कारकों पर आधारित है। आप इस कथन से कहाँ तक सहमत हैं? अपने मत के समर्थन में दो उदाहरण दें।
उत्तर:
किसी विशेष स्थिति में अपचायक का चयन ऊष्मागतिकी कारकों पर आधारित है। इस कथन को हम निम्न प्रकार समझ सकते एलिंघम आरेख से वह ज्ञात होता है कि वे धातुएँ जिनके लिये उनके ऑक्साइड के निर्माण की मानक मुक्त ऊर्जा अधिक ऋणात्मक होती है वे उन धातुओं के ऑक्साइडों का अपचयन कर सकती है जिनके लिए उनके ऑक्साइड के निर्माण की मानक मुक्त ऊर्जा कम ऋणात्मक होती है।
अर्थात् एलिंघम आरेख में ऊपर वाली धातुएँ आलेख में अपने से नीचे वाली धातुओं को अपचयित कर सकती हैं। क्योंकि संयुक्त रेडॉक्स अभिक्रिया तभी सम्भव होती है जबकि मानक मुक्त ऊर्जा का परिवर्तन ऋणात्मक हो। उदाहरण के लिए, Al तथा Zn दोनों ही FeO को Fe में अपचयित कर सकते हैं परन्तु Fe, Al2O3 एवं ZnO को अपचयित नहीं कर सकता है। इसी प्रकार कार्वन ZnO को Zn में परिवर्तित कर सकता है परन्तु CO नहीं।
प्रश्न 24.
उस विधि का नाम लिखिए जिसमें क्लोरीन सहउत्पाद के रूप में प्राप्त होती है। क्या होगा यदि NaCl के जलीय विलयन का विद्युत अपघटन किया जाए?
उत्तर:
सोडियम धातु डॉउन प्रक्रम (Down's process) द्वारा प्राप्त की जाती है। इस प्रक्रम में NaCl तथा CaCl2 के संगलित मिश्रण का 873K पर विद्युत-अपघटन किया जाता है। विद्युत-अपघटन कराने पर सोडियम धातु कैथोड पर निरावेशित होती है तथा Cl2 ऐनोंड पर सह उत्पाद के रूप में प्राप्त होती है।
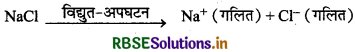
कैथोड: Na+ (गलित) + e- → Na
ऐनोड: Cl- (गलित) → Cl(g) + e-
2Cl(g) → Cl2(g)
NaCI के जलीय विलयन का विद्युत अपघटन:

चूँकि H+ का विसर्जन विभव Na+ से कम है अत: कैथोड पर H+ आयन जायेगा एवं H2 गैस मुक्त होगी। इसी प्रकार Cl- का विसर्जन विभव OH- से कम है। अत: ऐनोड पर Cl- आबन जायेगा और CI2 गैस मुक्त होगी। विलयन में Na+ तथा OH- आपस में संयोग कर NaOH बना लेंगे।
कैथोड पर, \(\mathrm{H}^{+}+e^{-} \rightarrow \frac{1}{2} \mathrm{H}_2\)
ऐनोड पर \(\mathrm{Cl}^{-} \rightarrow \frac{1}{2} \mathrm{Cl}_2+e^{-}\)
Na+ + OH- → NaOH

प्रश्न 25.
ऐल्यूमीनियम के विद्युत-धातुकर्म में ग्रेफाइट छड़ की क्या भूमिका है?
उत्तर:
ग्रेफाइट छड़ का प्रयोग हॉल-हैराउल्ट प्रक्रम (Hall - Heroult's Process) में होता है। यहाँ ग्रेफाइट की छड़ ऐनोड का काम करती है तथा ग्रेफाइट की परत चढ़ा आयरन कैथोड का कार्य करता है। यहाँ वैद्युत अपघट्य ऐलुमिना, क्रायोलाइट तथा फ्लुओरस्पार (CaF2) का गलित मिश्रण होता है।
वैद्युत अपघटन करने पर कैथोड पर ऐल्यूमीनियम धातु मुक्त होती है तथा ऐनोड पर O2 । यह O2 ग्रेफाइट छड़ से क्रिया करके CO तथा CO2 का निर्माण करती है जिसमें मुक्त O2 कैथोड पर मुक्त धातु से क्रिया नहीं कर पायेगी और Al2O3 नहीं बनेगा।
Al2O3 + 2Al3+ + 3O2-
कैथोड पर, Al3+ + 3e- → Al
ऐनोड पर,
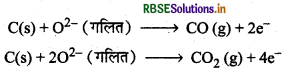
4 चूँकि ग्रेफाइट अन्य किसी धातु से सस्ता होता है अत: इसका उपयोग आर्थिक दृष्टि से उचित है।
प्रश्न 26.
निम्नलिखित विधियों द्वारा धातुओं के शोधन के सिद्धान्तों की रूपरेखा दीजिए
(i) मण्डल परिष्करण
(ii) विद्युत अपघटनी परिष्करण
(iii) वाष्य प्रावस्था परिष्करण।
उत्तर:
(i) मण्डल परिष्करण-कृपया पाठ्य-पुस्तक के प्रश्न एवं उत्तर के अन्तर्गत प्रश्न संख्या 4 का भाग (i) पृष्ठ संख्या 260 पर देखें।
(ii) विद्युत अपघटनी परिष्करण: धातुएँ, जैसे - Cu, Ag Zn, Sn, Pb AI, Ni, Cr को इस विधि द्वारा परिष्कृत करते हैं। विद्युत अपघटनी सेल में अशुद्ध धातु को ऐनोड बनाया जाता है जबकि कैथोड शुद्ध धातु की एक पतली पट्टी होती है। विलेष धातु लवण का विलयन विद्युत अपघट्य (electrolyte) होता है। धारा प्रवाहित करने पर ऐनोड घुल जाता है और शुद्ध धातु कैथोड पर निक्षेपित (deposit) हो जाती है। विलेयशील अशुद्धियाँ विलयन में चली जाती हैं जबकि अघुलनशील अशुद्धियाँ ऐनोड के नीचे ऐनोड पंक (anode mud) के रूप में बैठ जाती हैं।
कॉपर का विद्युतीय शुद्धिकरण - ऐनोड - फफोलेदार कॉपर (Blister copper, 98% pure)
कैथोड - शुद्ध ताँबे का
विद्युत अपघट्य: कॉपर सल्फेट का (15%) जलीय विलयन + 5% तनु H2SO4
तनु H2SO का कार्य CuSO4 के जल-अपघटन को रोकना तथा विलयन की चालकता बढ़ाना होता है।
विद्युत धारा प्रवाहित करने पर फफोलेदार कॉपर का ऐनोड घुल जाता है तथा शुद्ध कॉपर (99.95%) कैथोड पर जम जाता है।
विद्युत अपघटन के दौरान विद्युत-अपघट्य की सान्द्रता परिवर्तित नहीं होती है।
फ़फोलेदार कॉपर में उपस्थित गोल्ड तथा सिल्वर की अशुद्धियाँ ऐनोड कीचड़ के रूप में ऐनोड के नीचे बैठ जाती हैं।
(iii) वाष्य प्रावस्था परिष्करण: इस विधि में धातु के अशुद्ध नमूने से धातु को एक वाष्पशील यौगिक के रूप में हटा लिया जाता है। इस वाष्पशील यौगिक का ऊष्मीय अपघटन करने पर शुद्ध धातु प्राप्त होती है।
उदाहरण:
(a) मॉण्ड प्रक्रम (Mond's Process): इस विधि से निकिल को शुद्ध करते हैं।

(b) वान-आर्केल प्रक्रम (Van-Arkel Process): इस विधि से Ti Zr, Hf, U, Th आदि का परिष्करण करते हैं।
उदाहरण:


प्रश्न 27.
उन परिस्थितियों का अनुमान लगायें जिनमें Al, MgO को अपचयित कर सकता है।
उत्तर:
एलिंघम आरेख से ज्ञात होता है कि 1665 K से ऊपर तापमान पर Mg Al2O3 को अपचयित करता है क्योंकि Mg से MgO के बनने की मानक मुक्त ऊर्जा का मान Al से Al2O3, के बनने की मानक मुक्त ऊर्जा के मान से अधिक ऋणात्मक होता है। अतः तापमान 1665K से ऊपर Mg. Al2O3, को अपचयित कर सकता है। वहीं पर 1665K से नीचे ताप पर Mg से MgO के बनने की मानक मुक्त ऊर्जा का मान Al से Al2O3, के बनने की मानक मुक्त ऊर्जा के मान से कम ऋणात्मक होता है। अत: इस परिस्थिति में Al, MgO को अपचयित कर सकता है।

- RBSE Class 12 Chemistry Notes Chapter 16 दैनिक जीवन में रसायन
- RBSE Class 12 Chemistry Notes Chapter 15 बहुलक
- RBSE Class 12 Chemistry Notes Chapter 14 जैव-अणु
- RBSE Class 12 Chemistry Notes Chapter 13 ऐमीन
- RBSE Class 12 Chemistry Notes Chapter 12 ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
- RBSE Class 12 Chemistry Notes Chapter 11 ऐल्कोहॉल, फीनॉल एवं ईथर
- RBSE Class 12 Chemistry Notes Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
- RBSE Class 12 Chemistry Notes Chapter 9 उपसहसंयोजन यौगिक
- RBSE Class 12 Chemistry Notes Chapter 8 d- एवं f-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम