RBSE Solutions for Class 12 Chemistry Chapter 3 वैद्युत रसायन
Rajasthan Board RBSE Solutions for Class 12 Chemistry Chapter 3 वैद्युत रसायन Textbook Exercise Questions and Answers.
Rajasthan Board RBSE Solutions for Class 12 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 12. Students can also read RBSE Class 12 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 12 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 12 Chemistry Solutions Chapter 3 वैद्युत रसायन
RBSE Class 12 Chemistry वैद्युत रसायन InText Questions and Answers
प्रश्न 1.
निकाय Mg2+ Mg का मानक इलेक्ट्रोड विभव आप किस प्रकार ज्ञात करेंगे?
उत्तर:
निकाय Mg2+ | Mg का मानक इलेक्ट्रोड विभव ज्ञात करने के लिए एक सेल स्थापित करते हैं जिसमें एक इलेक्ट्रोड Mg | MgSO4 (1 M), एक मैग्नीशियम के तार को 1 M MgSO4 विलयन में डुबोकर व्यवस्थित करते हैं तथा मानक हाइड्रोजन इलेक्ट्रोड Pt, H2 (1 atm)| H' (1 M) को दूसरे इलेक्ट्रोड की भाँति व्यवस्थित करते हैं।
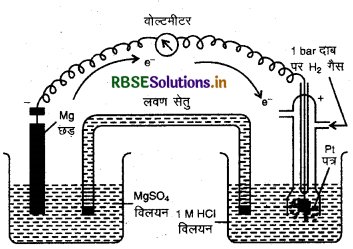
व्यवस्थित करने के बाद सेल का e.mf. नापते हैं तथा दिशा को नोट करते हैं। यहाँ विक्षेप की दिशा से पता चलता है कि इलेक्ट्रॉन मैग्नीशियम इलेक्ट्रोड से हाइड्रोजन की तरफ जाते हैं तथा विद्युत धारा इसके विपरीत बहती है। इन सभी क्रियाओं से ज्ञात होता है कि यहाँ पर मैग्नीशियम का ऑक्सीकरण तथा हाइड्रोजन का अपचयन हो रहा है। अत: सेल इस प्रकार होगा
\(\mathrm{Mg}\left|\mathrm{Mg}^{2+}(1 \mathrm{M}) \| \mathrm{H}^{+}(1 \mathrm{M})\right| \mathrm{H}_2(1 \mathrm{~atm}), \mathrm{Pt}\)
तथा
\(\begin{aligned} &\mathrm{E}_{\text { }}^0=\mathrm{E}_{\mathrm{H}^{+} / \frac{1}{2} \mathrm{H}_2}-\mathrm{E}_{\mathrm{Mg}^{2+} / \mathrm{Mg}}^0\\ &=0.0-\mathrm{E}_{\mathrm{Mg}^{2+} / \mathrm{Mg}}^0 \end{aligned}\)
अतः \(\mathrm{E}_{\mathrm{Mg}^{2+} / \mathrm{Mg}}^0=-\mathrm{E}_{\text { }}^0\)
E इस प्रकार हम Mg2+/Mg का विभव ज्ञात कर सकते हैं।

प्रश्न 2.
क्या आप एक जिंक के पात्र में कॉपर सल्फेट का विलयन रख सकते हैं?
उत्तर:
\(\mathrm{E}_{\mathrm{Zn}^{2+} / \mathrm{Zn}}^0\) = - 0.76 v
\(\mathrm{E}_{\mathrm{Cu}^{2+} / \mathrm{Cu}}^0\) = 0.34 V
यहाँ जिंक तथा CuSO4 में होने वाली अभिक्रिया निम्न प्रकार है
\(\mathrm{Zn}+\mathrm{CuSO}_4 \longrightarrow \mathrm{ZnSO}_4+\mathrm{Cu}\)
चूँकि Zn विद्युत रासायनिक श्रेणी में ऊपर है अतः यह CusO4 के विलयन से Cu को अलग कर देगा और स्वतः रासायनिक अभिक्रिया में भाग लेगा। अत: हम जिंक के पात्र में CusO4 को नहीं रख सकते क्योंकि जिंक के पात्र में छेद हो जायेंगे।
प्रश्न 3.
मानक इलेक्ट्रोड विभव की तालिका का निरीक्षण कर तीन ऐसे पदार्थ बताइए जो अनुकूल परिस्थितियों में फेरस आयनों को ऑक्सीकृत कर सकते हैं।
उत्तर:
फेरस आयनों को ऑक्सीकृत करने का अर्थ है:
\(\mathrm{Fe}^{2+} \longrightarrow \mathrm{Fe}^{3+}+e^{-}\)
केवल वे पदार्थ Fe2+ को ऑक्सीकृत कर सकते हैं जो प्रबल ऑक्सीकारक हों तथा जिनका अपचयन विभव Fe2+ के अपचयन विभव से अधिक हो, अतः
H2O2 MnO4 - Cr2O72- इसे ऑक्सीकृत कर सकते हैं।
प्रश्न 4.
pH = 10 के विलयन के सम्पर्क वाले हाइड्रोजन इलेक्ट्रोड के विभव का परिकलन कीजिए।
उत्तर:
pH = 10 के लिए
pH = -log [H+]
[H+] = 10-pH
[H+] = 10-10 mol L-I
हाइड्रोजन इलेक्ट्रोड के लिए
\(\mathrm{H}^{+}+e^{-} \longrightarrow \frac{1}{2} \mathrm{H}_2\)
अत: \(\mathrm{E}_{\mathrm{H}^{+} / \frac{1}{2} \mathrm{H}_2}=\mathrm{E}_{\mathrm{H}^{+} / \frac{1}{2} \mathrm{H}_2}^0+\frac{0-059}{n} \log \frac{\left[\mathrm{H}^{+}\right]}{\left(\mathrm{p}_{\mathrm{H}_2}\right)^{1 / 2}}\)
= 0.0 + \(-\frac{0.059}{1} \log \frac{10^{-10}}{(1)^{\frac{1}{2}}}\)
= 0.0 + \(\frac{0.059}{1} \log 10^{-10}\)
= 0.059(-10 log 10)
= 0.059 x -10
= 0.59V
अत:
\(\mathrm{E}_{\left(\mathrm{H}^{+} / \frac{1}{2} \mathrm{H}_2\right)}\) = 0.59V है।

प्रश्न 5.
एक सेल के em.f. का परिकलन कीजिए जिसमें निम्नलिखित अभिक्रिया होती है। दिया गया है
E0 = 1.05 V
\(\mathrm{Ni}_{(s)}+2 \mathrm{Ag}^{+}(0.002 \mathrm{M}) \longrightarrow \mathrm{Ni}^{2+}(0 \cdot 160 \mathrm{M})+2 \mathrm{Ag}_{(s)}\)
उत्तर:
सेल के लिए नेस्ट समीकरण,

= \(1.05-\frac{0.059}{2} \log 4 \times 10^4\)
= 1.05 - 0.14 = 0.91 V
Em = 0.91है।
प्रश्न 6.
एक सेल जिसमें निम्नलिखित अभिक्रिया होती है:
\(2 \mathrm{Fe}^{3+}(a q)+2 \mathrm{I}_{(a q)}^{-} \rightarrow \longrightarrow 2 \mathrm{Fe}^{2+}(a q)+\mathrm{I}_{2(s)}\)
का 298K ताप पर \(\mathrm{E}_{\text {सेल }}^{\Theta}=0.236 \mathrm{~V}\) है। सेल अभिक्रिया की मानक गिब्ज ऊर्जा एवं साम्य स्थिरांक का परिकलन कीजिए।
उत्तर:
\(\begin{aligned} 2 \mathrm{Fe}^{3+}+2 e^{-} \longrightarrow 2 \mathrm{Fe}^{2+} \\ 2 \mathrm{I}^{-} \longrightarrow \mathrm{I}_2+2 e^{-} \end{aligned}\)
अतः दी गई सेल अभिक्रिया के लिए. n = 2
\(\Delta_r \mathrm{G}^{\Theta}=-n \mathrm{FE}^{\Theta} \text { }\)
= -2 × 96500 × 0.236 J
= - 45.55 kJ mol-1
\(\begin{aligned} \Delta_r \mathrm{G}^{\Theta} &=-2 \cdot 303 \mathrm{RT} \log \mathrm{K}_c \\ \log \mathrm{K}_c &=\frac{-\Delta_r \mathrm{G}^{\Theta}}{2 \cdot 303 \mathrm{RT}} \end{aligned}\)
\(=-\left(\frac{-45.55 \mathrm{~kJ} \mathrm{~mol}^{-1}}{2.303 \times 8.314 \times 10^{-3} \mathrm{kJK}^{-1} \mathrm{~mol}^{-1} \times 298 \mathrm{~K}}\right)\)
= 7.93
Kc = Antilog (7.93)
= 9.616 × 107
प्रश्न 7.
किसी विलयन की चालकता तनुता के साथ क्यों घटती
उत्तर:
बिलयन की चालकता, विलयन के एकांक आयतन में उपस्थित आयनों की चालकता होती है। तनुकरण करने पर प्रति एकांक आयतन आयनों की संख्या घटती है; अत: चालकता भी घट जाती है।

प्रश्न 8.
जल की ज्ञात करने का एक तरीका बताइए।
उत्तर:
अनन्त तनुता पर जल की सीमान्त मोलर चालकता \(\wedge_m^0\) अनन्त तनुता पर सोडियम हाइड्रॉक्साइड, हाइड्रोक्लोरिक अम्ल तथा सोडियम क्लोराइड (जिसमें सभी प्रबल विद्युत अपघट्य है) की मोलर चालकताएँ ज्ञात होने पर, प्राप्त की जा सकती है।
\(\Lambda_{m\left(\mathrm{H}_2 \mathrm{O}\right)}^0=\Lambda_{m(\mathrm{NaOH})}^0+\Lambda_{m(\mathrm{HCl})}^0-\Lambda_{m(\mathrm{NaCl})}^0\)
प्रश्न 9.
0:025 mol L-1 मेथेनोइक अम्ल की चालकता 46.1s cm2 moL-1 है। इसकी वियोजन मात्रा एवं वियोजन स्थिरांक का परिकलन कीजिए। दिया गया है कि \(\lambda_{\left(H^{+}\right)}^0=349 \cdot 6 \mathrm{~S} \mathrm{~cm}^2 \mathrm{~mol}^{-1}\) एवं \(\lambda^0\left(\mathrm{HCOO}^{-}\right)=54 \cdot 6 \mathrm{~S} \mathrm{~cm}^2 \mathrm{~mol}^{-1}\)
उत्तर:
\(\Lambda_{m(\mathrm{HCOOH})}^0=\lambda_{\left(\mathrm{H}^{+}\right)}^0+\lambda_{\left(\mathrm{HCOO}^{-}\right)}^0\)
= 349.6 + 54.6
= 404.2 S cm2 mol-1
96500
दिया है:
\(\Lambda_{m(\mathrm{HCOOH})}^{\mathrm{C}}\) = 46.1S cm2 mol-1
\(\begin{aligned} \alpha &=\frac{\Lambda_m^{\mathrm{C}}}{\Lambda_m^0}=\frac{46 \cdot 1 \mathrm{~S} \mathrm{~cm}^2 \mathrm{~mol}^{-1}}{404 \cdot 2 \mathrm{~S} \mathrm{~cm}^2 \mathrm{~mol}^{-1}} \\ &=0 \cdot 114 \\ \mathrm{~K} &=\frac{\mathrm{C} \alpha^2}{1-\alpha}=\frac{0.025 \times(0.114)^2}{1-0.114} \end{aligned}\)
= 3.67 x 10-4
वियोजन स्थिरांक का मान 3.67 x 10-4 है।
प्रश्न 10.
यदि एक धात्विक तार में 0.5 ऐम्पियर की धारा ? घण्टों तक प्रवाहित की जाये तो तार में से कितने इलेक्ट्रॉन प्रवाहित होंगे?
उत्तर:
Q = i x 1
i = 0.5A
t = 2 x 60 x 605
∴ Q = 0.5 x 2 x 60 x 60 = 3600C
96500 कूलॉम धारा प्रवाहित करते हैं = 1 मोल इलेक्ट्रॉन
3600 कूलॉम धारा प्रवाहित करंगे = \(\frac{3600}{96500}\)
\(=\frac{3600 \times 602 \times 10^{23}}{96500}\)
= 2:246 x 102 इलेक्ट्रॉन
अत: 2:246 x 102 इलेक्ट्रॉन प्रवाहित होंगे।
प्रश्न 11.
उन धातुओं की एक सूची बनाइए जिनका विद्युत अपघटनी निष्कर्षण होता है।
उत्तर:
Na, Ca, Mg तथा AI
प्रश्न 12.
निम्नलिखित अभिक्रिया में CrO2-7 आयनों के एक मोल के अपचयन के लिए कूलॉम में विद्युत की कितनी मात्रा की आवश्यकता होती है?
\(\mathrm{Cr}_2 \mathrm{O}_7^{2-}+14 \mathrm{H}^{+}+6 e^{-} \longrightarrow 2 \mathrm{Cr}^{3+}+7 \mathrm{H}_2 \mathrm{O}\)
उत्तर:
CrO2-7 के एक मोल के अपचयन के लिए 6 मोल इलेक्ट्रॉनों की आवश्यकता होती है।
अतः विद्युत की मात्रा = 6F
= 6 x 96500C = 579000C
Cr3+ में अपचयन के लिए 579000 C विद्युत की आवश्यकता होगी।

प्रश्न 13.
चार्जिंग के दौरान प्रयुक्त पदार्थों का विशेष उल्लेख करते हुए लैंड-संचायक सेल की चार्जिग किया विधि का वर्णन रासायनिक अभिक्रियाओं की सहायता से कीजिए।
उत्तर:
चार्जिंग के दौरान हम किसी बाहरी स्रोत द्वारा सेल को विद्युत ऊर्जा प्रदान करते हैं अर्थात् सेल एक विद्युत अपघटनी सेल की भाँति कार्य करता है। चार्जिंग के दौरान होने वाली अभिक्रियाएँ डिस्चार्ज के दौरान होने वाली अभिक्रियाओं से विपरीत होती हैं। चार्जिंग के दौरान निम्न अभिक्रियाएँ होती है
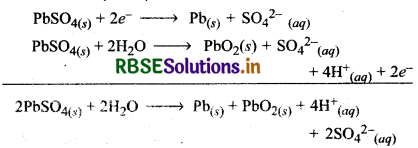
प्रश्न 14.
हाइड्रोजन को छोड़कर ईंधन सेलों में प्रयुक्त किये जा सकने वाले दो अन्य पदार्थ सुझाइए।
उत्तर:
- मेथेनॉल CH3OH
- मेथेन CH4
प्रश्न 15.
समझाइए कि कैसे लोहे पर जंग लगने का कारण एक विद्युत रासायनिक सेल बनना माना जाता है?
उत्तर:
संक्षारण या लोहे पर जंग लगना एक विद्युत रासायनिक प्रक्रम है। यहाँ,
ऐनोड = आयरन पृष्ट
कैथोड = अशुद्ध आयरन पृष्ठ
विद्युत अपघट्य = जल की बूँद जिसमें CO2 तथा O2 विलेय हैं।
ऐनोड पर अभिक्रिया (Reactions on Anode): आयरन ऑक्सीकृत होकर Fe2+ आयन बनाता है तथा इलेक्ट्रॉन कैथोड पर चले जाते हैं।
\(\mathrm{Fe}_{(s)} \longrightarrow \mathrm{Fe}_{(a q)}^{2+}+2 e^{-}\)
कैथोड पर अभिक्रिया (Reactions on cathode) : यहाँ ऐनोड से आये इलेक्ट्रॉंनों को H+ ग्रहण कर लेता है और CO2 के साथ H2CO बनाता है।
\(\begin{aligned} \mathrm{H}_2 \mathrm{O}+\mathrm{CO}_{2(q)} & \rightleftharpoons \mathrm{H}_2 \mathrm{CO}_3 \\ \mathrm{H}_2 \mathrm{CO}_3 & \rightleftharpoons \mathrm{H}^{+}+\mathrm{HCO}_3^{-} \\ 2 \mathrm{H}^{+}+2 e^{-} & \longrightarrow 2 \mathrm{H} \end{aligned}\)
ये H-परमाणु ऑक्सीजन से क्रिया करके जल बना लेते हैं।
\(2 \mathrm{H}+\frac{1}{2} \mathrm{O}_2 \longrightarrow \mathrm{H}_2 \mathrm{O}\)
अतः कैथोड पर अभिक्रिया
\(2 \mathrm{H}^{+}+\frac{1}{2} \mathrm{O}_2+2 e^{-} \rightleftharpoons \mathrm{H}_2 \mathrm{O}\)
जंग लगने के दौरान लोहे की सतह पर बने विद्युत - रासार्यनिक सेल में होने वाली पूर्ण या समग्र अभिक्रिया निम्न प्रकार है:
\(2 \mathrm{Fe}+4 \mathrm{H}^{+}+\mathrm{O}_2 \longrightarrow 2 \mathrm{Fe}^{2+}+2 \mathrm{H}_2 \mathrm{O}\)
फेरस आयन पुन: वायुमण्डलीय ऑक्सीजन द्वारा फेरिक आयनों में ऑक्सीकृत हो जाते हैं जिसके कारण लोहे पर जंग लगती है।
\(\begin{gathered} 2 \mathrm{Fe}^{2+}+\frac{1}{2} \mathrm{O}_2+2 \mathrm{H}_2 \mathrm{O} \longrightarrow \mathrm{Fe}_2 \mathrm{O}_3+4 \mathrm{H}^{+} \\ \mathrm{Fe}_2 \mathrm{O}_3+x \mathrm{H}_2 \mathrm{O} \longrightarrow \mathrm{Fe}_2 \mathrm{O}_3 x \mathrm{H}_2 \mathrm{O} \end{gathered}\)
RBSE Class 12 Chemistry वैद्युत रसायन Textbook Questions and Answers
प्रश्न 1.
निम्नलिखित धातुओं को उस क्रम में व्यवस्थित कीजिए जिसमें वे एक-दूसरे को उनके लवणों के विलयनों में से प्रतिस्थापित करती है: Al, Cu, Fe, Mg एवं Zn.
उत्तर:
Mg, Al, Zn, Fe, Cu.
प्रश्न 2.
नीचे दिए गए मानक इलेक्ट्रोड विभवों के आधार पर धातुओं को उनकी बढ़ती हुई अपचायक क्षमता के क्रम में व्यवस्थित कीजिए:
\(\begin{aligned} \mathrm{K}^{+}\left|\mathrm{K}=-2.93 \mathrm{~V}, \mathrm{Ag}^{+}\right| \mathrm{Ag}=\mathbf{0 . 8 0 V} \\ \mathrm{Hg}^{2+} \mid \mathrm{Hg}=0.79 \mathrm{~V} \\ \mathrm{Mg}^{2+}\left|\mathrm{Mg}=-2 \cdot 37 \mathrm{~V}, \mathrm{Cr}^{3+}\right| \mathrm{Cr}=-\mathbf{0} \cdot 74 \mathrm{~V} \end{aligned}\)
उत्तर:
ऑक्सीकरण विभव उच्च होने का तात्पर्य है कि वह धातु सरलता से ऑक्सीकृत हो जाएगी अर्थात् उसकी अपचायक क्षमता अधिक होगी। इस प्रकार धातुओं की अपचायक क्षमता का बढ़ता क्रम निम्नलिखित है।
\(\mathrm{Ag}<\mathrm{Hg}<\mathrm{Cr}<\mathrm{Mg}<\mathrm{K}\)

प्रश्न 3.
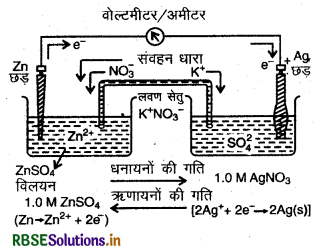
उस गैल्वैनी सेल को दर्शाइए जिसमें निम्नलिखित अभिक्रिया होती है:
\(\mathrm{Zn}_{(s)}+2 \mathrm{Ag}_{(a q)}^{+} \longrightarrow \mathrm{Zn}_{(a q)}^{2+}+2 \mathrm{Ag}_{(s)}\)
(i) कौन-सा इलेक्ट्रोड ऋणात्मक आवेशित है ?
(ii) सेल में विद्युत धारा के वाहक कौन-से हैं ?
(iii) प्रत्येक इलेक्ट्रोड पर होने वाली अभिक्रिया क्या है ?
उत्तर:
दी गयी रासायनिक अभिक्रिया,
\(\mathrm{Zn}_{(s)}+2 \mathrm{Ag}_{(a q)}^{+} \longrightarrow \mathrm{Zn}_{(a q)}^{2+}+2 \mathrm{Ag}_{(s)}\)
को हम निम्नलिखित के अनुसार दर्शा सकते हैं:
\(\mathrm{Zn}_{(s)}\left|\mathrm{Zn}^{2+}{ }_{(a q)} \| \mathrm{Ag}_{(a q)}^{+}\right| \mathrm{Ag}_{(s)}\)
(i) चूँकि वह इलेक्ट्रोड जिस पर ऑक्सीकरण होता है, अर्थात् ऐनोड ऋणात्मक आवेशित होता है अतः जिक इलेक्ट्रोड ऋणात्मक आवेशित है।
(ii) सेल में विद्युत धारा के वाहक इलेक्ट्रॉन होते हैं।
(iii) इलेक्ट्रोडों पर होने वाली अभिक्रियाएँ निम्नलिखित हैं।
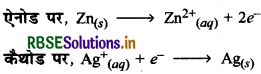
सेल को हम निम्न चित्र द्वारा दर्शा सकते हैं:
प्रश्न 4.
निम्नलिखित अभिक्रियाओं वाले गैल्वेनी सेल का मानक सेल-विभव परिकलित कीजिए:
\((i) 2 \mathrm{Cr}_{(s)}+3 \mathrm{Cd}^{2+}(a q) \longrightarrow 2 \mathrm{Cr}^{3+}(a q)+3 \mathrm{Cd}_{(s)} (ii) \mathrm{Fe}^{2+}(a q)+\mathbf{A g}_{(a q)}^{+} \longrightarrow \mathrm{Fe}^{3+}(a q)+\mathbf{A g}_{(s)}\)
उपर्युक्त अभिक्रियाओं के लिए $\Delta G^0$ तथा साम्य स्थिरांकों की गणना कीजिए।
\(\begin{aligned} \mathbf{E}^0\left(\mathrm{Cr}^{3+} / \mathrm{Cr}\right) &=-0 \cdot 74 \mathrm{~V}, \mathbf{E}^0\left(\mathrm{Cd}^{2+} / \mathrm{Cd}\right)-0.40 \mathrm{~V} \\ \mathrm{E}^0\left(\mathrm{Ag}^{+} / \mathrm{Ag}\right) &\left.=0.80 \mathrm{~V}, \mathbf{E}_{\left(\mathrm{Fe}^{0+} / \mathrm{Fe}^{2+}\right)}=0.77 \mathrm{~V}\right) \end{aligned}\)
उत्तर:
\(\text { (i) } 2 \mathrm{Cr}_{(s)}+3 \mathrm{Cd}^{2+}{ }_{(a q)} \longrightarrow 2 \mathrm{Cr}^{3+}(a q)+3 \mathrm{Cd}_{(s)}\)
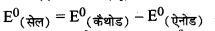
= \(=\mathrm{E}_{\left(\mathrm{Cd}^{2+} / \mathrm{Cd}\right)}^0-\mathrm{E}_{\left(\mathrm{Cr}^{3+} / \mathrm{Cr}\right)}^0\)
= - 0.40 V - (-0.74 V)
=- 0.40 V + 0.74 V
= + 0.34 V
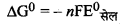
= - 6 × 96500 × 0.34
= - 196860 J mol-1
= - 196.860 KJ mol-1
∆ G0 = - 2. 303 RT logKc
- 196.860 KJ = - 2.303 × 8.314 × 298 × logKc
या 196.860 = 2.303 × 8.314 × 298 × logKc
या \(\frac{196860}{2 \cdot 303 \times 8.314 \times 298}=\log \mathrm{K}_c\)
log KC = 34.5014
KC = Antilog 34.5014
= 3.173 × 1034
अतः सेल की गिब्स ऊर्जा (∆ G0 ) = -196.86 KJ/mol
सेल का साम्य स्थिरांक (KC ) = 3.173 × 1034
\(\text { (ii) } \mathrm{Fe}^{2+}(a q)+\mathrm{Ag}_{(a q)}^{+} \longrightarrow \mathrm{Fe}_{(a q)}^{3+}+\mathrm{Ag}_{(s)}\)
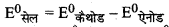
\(=\mathrm{E}_{\left(\mathrm{Ag}^{+} / \mathrm{Ag}\right)}^0-\mathrm{E}_{\left(\mathrm{Fe}^{3+} / \mathrm{Fe}^{2+}\right)}\)
= + 0.80 v - 0.77v
= + 0.03 V
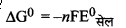
= - 1 × 96500 × 0.03
= - 2895 J/mol
= - 2.895 KJ/mol
∆ G0 = - 2.303 RTlog Kc
- 2895 = - 2.303 × 8.314 × 298 × log Kc
\(\frac{2895}{2.303 \times 8.314 \times 298}=\log \mathrm{K}_c\)
या llog Kc = 0.574
Kc = Anti log 0.5704
Kc = 3.22
सेल की गिब्स ऊर्जा = -2.895 kJ/mol
सेल का साम्य स्थिरांक = 3.22
प्रश्न 5.
निम्नलिखित सेलों की 298 K पर नेर्न्स्ट समीकरण एवं e.m.f. लिखिए:

उत्तर:
\(\text { (i) } \mathrm{Mg}_{(s)}\left|\mathrm{Mg}^{2+}(0.001 \mathrm{M}) \| \mathrm{Cu}^{2+}(0.0001 \mathrm{M})\right| \mathrm{Cu}_{(s)}\)
\(\mathrm{E}_{\left(\mathrm{Mg}^{2+} / \mathrm{Mg}\right)}=-2.37 \mathrm{~V}, \mathrm{E}_{\left(\mathrm{Cu}^{2+} / \mathrm{Cu}\right)}^0=+0.34 \mathrm{~V}\)
उपर्युक्त सेल के लिए सेल अभिक्रिया,
\(\mathrm{Mg}+\mathrm{Cu}^{2+} \longrightarrow \mathrm{Mg}^{2+}+\mathrm{Cu}\)
नेर्न्स्ट समीकरण,

\((ii) \mathrm{Fe}_{(s)}\left|\mathrm{Fa}^{2+}(0.001 \mathrm{M}) \| \mathrm{H}^{+}\left(\begin{array}{ll}1 & \mathrm{M}\end{array}\right)\right| \mathrm{H}_{2(g)} (1 bar) \mid \mathrm{Pt}_{(s)}\)
उपर्युक्त सेल के लिएं सेल अभिक्रिया

\(\text { (iii) } \mathrm{Sn}_{(s)}\left|\mathrm{Sn}^{2+}(0.050 \mathrm{M}) \| \mathrm{H}^{+}(0.020 \mathrm{M})\right| \mathrm{H}_{2(g)}(1 \mathrm{bar}) \mid \mathrm{Pt}_{(s)}\)
उपर्युक्त सेल के लिए सेल अभिक्रिया,

\((iv) \mathrm{Pt}_{(s)}\left|\mathrm{Br}_{2(l)}\right| \mathrm{Br}^{-}(0.010 \mathrm{M}) \| \mathrm{H}^{+}(0.030 \mathrm{M}) \mid \mathrm{H}_{2(g)}(1 bar \mid \mathrm{Pt}_{(s)}\)
उपर्युक्त सेल के लिए अभिक्रिया,

= - 1.08 - 0.2078
= - 1.2878V
= - -1.288V

प्रश्न 6.
घड़ियों एवं अन्य युक्तियों में अत्यधिक उपयोग में आने वाली बटन सेलों में निम्नलिखित अभिक्रिया होती है:
\(\mathrm{Zn}_{(s)}+\mathrm{Ag}_2 \mathrm{O}_{(s)}+\mathrm{H}_2 \mathrm{O}_{(l)} \longrightarrow \mathrm{Zn}^{2+}(a q)+2 \mathrm{Ag}_{(s)}+2 \mathrm{OH}^{-}(a q)\)
अभिक्रिया के लिए ∆ G0 एवं ज्ञात कीजिए।
उत्तर:
यहाँ Zn ऑक्सीकृत हो रहा है अत: यह ऐनोड का कार्य करेगा तथा AgO3 अपचयित अर्थात् Ag+आयन Ag में परिवर्तित हो रहे हैं अतः यह कैथोड का कार्य करेगा।
\(\mathrm{E}_{\left(\mathrm{Zn}^{2+} / \mathrm{Zn}\right)}^0=-0.76 \mathrm{~V}, \mathrm{E}_{\left(\mathrm{Ag}^{+} / \mathrm{Ag}\right)}^0=0.80 \mathrm{~V}\)
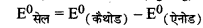
\(=\mathrm{E}_{\left(\mathrm{Ag}^{+} / \mathrm{Ag}\right)}^0-\mathrm{E}_{\left(\mathrm{Zn}^{2+} / \mathrm{Zn}\right)}^0\)
= 0.80 - (-0.76)
= 0.80 + 0.76
=1.56V
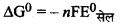
= - 2 × 96500 × 1.56
= - 301080 J/mol
= - 3.01 × 105 J/mol
= - 3.01 × 102 KJ/mol
यहाँ सेल के E0(सेल) = 1.56 V
∆ G0 = - 3.01 V × 102 KJ/mol
प्रश्न 7.
किसी वैद्युत-अपघट्य के विलयन की चालकता एवं मोलर चालकता की परिभाषा दीजिए। सान्द्रता के साथ इनके परिवर्तन की विवेचना कीजिए।
उत्तर:
कृपया अनुच्छेद 3.4 एवं 3.4 .2 अध्ययन करें। प्रश्न 8.298K पर 0.20 M KCl विलयन की चालकता 0.0248 S cm-1 है। इसकी मोलर चालकता का परिकलन कीजिए:
मोलरता (C) = 0.20 M
चालकता K = 0.0248 cm-1
मोलर चालकता \(\left(\wedge_m\right)=\frac{\kappa \times 1000}{\mathrm{C}}\)
\(=\frac{0.0248 \times 1000}{0.20}\)
= 124 S cm2 mol-1
विलयन की मोलर चालकता = 124 S cm2 mol-1
प्रश्न 9.
298 K पर एक चालकता सेल जिसमें 0.001M KCl विलयन है, का प्रतिरोध 1500\(\Omega\) है। यदि 0.001 M\KCl विलयन की चालकता 298 K पर 0.146 × 10-3 S cm-1 हो तो सेल स्थिरांक क्या है?
उत्तर:
मोलरता (C)=0.001 M
प्रतिरोध (R)=1500 \(\Omega\)
चालकता (K) =0.146 × 10-3 S cm-1
सेल स्थिरांक (G*) = ?
चालकता = 1/R × सेल स्थिरांक
सेल स्थिरांक = चालकता × R
= 0.146 × 10-3 × 1500
= 0.219 Cm-1
प्रश्न 10.
298 K पर सोडियम क्लोराइड की विभिन्न सान्दताओं पर चालकता का मापन किया गया जिसके आँकड़े निम्नलिखित हैं:
सभी सान्द्रताओं के लिए \(\wedge_m\) का परिकलन कीजिए एवं \(\wedge_m\) तथा C1/2 के मध्य एक आरेख खींचिए। \(\wedge_m\) का मान ज्ञात कीजिए।
उत्तर:
\(\frac{1 \mathrm{~S} \mathrm{~cm}^{-1}}{100 \mathrm{~S} \mathrm{~m}^{-1}}=10^{-2}\)

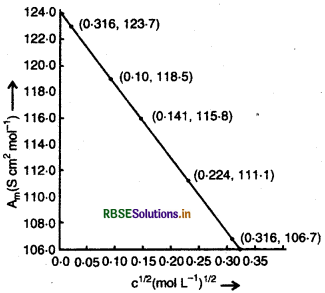
\(\wedge_m^0=\wedge_m\) अक्ष पर अन्तःखण्ड = 124.0 S cm2 mol-1
प्रश्न 11.
0.00241 M ऐसीटिक अम्ल की चालकता 7.896 x 10-5 s cm-1 है। इसकी मोलर चालकता को परिकलित कीजिए। यदि ऐसीटिक अम्ल के लिए imm का मान 390.5 s cm. mol- हो तो इसका वियोजन स्थिरांक क्या है?
उत्तर:
सान्द्रता (C) = 0.00241 M
चालकता (k) = 7.896 x 10-5 s cm-1
मोलर चालकता \(\wedge_m\) = ?
शून्य सान्द्रता पर मोलर चालकता (x)
=390.5 S cm-1 mol
वियोजन स्थिरांक (K) = ?
\(\begin{aligned} \wedge_m &=\frac{\mathrm{K} \times 1000}{\mathrm{C}} \\ &=\frac{7.896 \times 10^{-5} \times 1000}{0.00241} \end{aligned}\)
= 32.76 s cm2 mol-1

= 1.86 × 10-5
वियोजन स्थिरांक = 1.86 × 10-5

प्रश्न 12.
निम्नलिखित के अपचयन के लिये कितने आवेश की आवश्यकता होगी?
(i) मोल Al3+ को AI में
(ii) 1 मोल Cut को Cu में
(iii)1 मोल MnO को Mn2+ में।
उत्तर:
(i) इलेक्ट्रोड अभिक्रिया निम्नवत् दी जा सकती है
\(\mathrm{Al}^{3+}+3 e^{-} \longrightarrow \mathrm{Al}\)
∴ 1 mol Al3+ के अपचयन के लिए आवश्यक आवेश की मात्रा
= 3F
= 3 x 96500c = 289500C
(ii) इलेक्ट्रोड अभिक्रिया निम्नवत् दी जा सकती है
\(\mathrm{Cu}^{2+}+2 e^{-} \longrightarrow \mathrm{Cu}\)
∴ 1 mol Cu2+ के अपचयन के लिए आवश्यक आवेश की मात्रा
= 2F
= 32 x 965000
= 193000c
(iii) इलेक्ट्रोड अभिक्रिया निम्नवत् दी जा सकती है
\(\begin{aligned} \mathrm{MnO}_4^{-} & \longrightarrow \mathrm{Mn}^{2+} \\ \mathrm{Mn}^{7+}+5 e^{-} & \longrightarrow \mathrm{Mn}^{2+} \end{aligned}\)
∴ 1 mol MnO-4 के अपचयन के लिए आवश्यक आवेश की मात्रा
= 5F
= 5 x 96500C
= 4825000
प्रश्न 13.
निम्नलिखित को प्राप्त करने में कितने फैराडे विद्युत की आवश्यकता होगी?
(i) गलित CaCI2 से 20.04Ca
(ii) गलित AI2O3 से 400g Al
उत्तर:
(i) CaCl2 में,
Cal+ + 28 →cal
2 मोल
40g ca को विद्युत की आवश्यकता = 2F
20 g Ca को विद्युत की आवश्यकता
\(=\frac{2 \times 20}{40}\) = 1F
अर्थात् एक फैराडे विद्युत की आवश्यकता होगी।
(ii) Al2O3 के लिए,
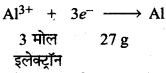
27 g Al को विद्युत की आवश्यकता = 3F
40 g Al को विद्युत की आवश्यकता = \(\frac{3 \times 40}{27} \mathrm{~F}\)
= 4.44F
अर्थात् 4.44 फैराडे विद्युत की आवश्यकता होगी।
प्रश्न 14.
निम्नलिखित को ऑक्सीकृत करने के लिए कितने कूलॉम विद्युत आवश्यक है?
(i) 1 मोल H2O को O2 में।
(ii) 1 मोल Feo को Fe2O3 में।
उत्तर:
(i) 1 mol H2O के लिए इलेक्ट्रोड अभिक्रिया इस प्रकार दी जाती है:
\(\begin{aligned} &\mathrm{H}_2 \mathrm{O} \longrightarrow \mathrm{H}_2+\frac{1}{2} \mathrm{O}_2 \\ &\mathrm{O}^{2-} \longrightarrow \frac{1}{2} \mathrm{O}_2+2 e^{-} \end{aligned}\)
आवश्यक विद्युत की मात्रा = 2F
= 32 x 96500C
= 1930000
(ii) 1 mol FeO के लिए इलेक्ट्रोड अभिक्रिया इस प्रकार दी जाती है:
\( 2 \mathrm{FeO}+\frac{1}{2} \mathrm{O}_2 \longrightarrow \mathrm{Fe}_2 \mathrm{O}_3 \mathrm{Fe}^{2+} \longrightarrow \mathrm{Fe}^{3+}+e^{-}\)
∴ आवश्यक विद्युत की मात्रा = 1F
= 96500c
प्रश्न 15.
Ni(NO3) के एक विलयन का प्लैटिनम इलेक्ट्रोडों के बीच 5 ऐम्पियर की धारा प्रवाहित करते हुए 20 मिनट तक विद्युत अपघटन किया गया। Ni की कितनी मात्रा कैथोड पर निक्षेपित होगी?
उत्तर:
धारा (i) = 5 ऐम्पियर
समय (t) = 20
मिनट = 320 x 60
सेकण्ड विद्युत आवेश (Q) = i × t
= 5 x 20 x 60
= 6000C
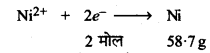
2F विद्युत आवेश अर्थात् 2 x 96500C निक्षेपित करता है
=58.7gNi
6000C निक्षेपित करेगा = \(\frac{58.7 \times 6000}{2 \times 96500}\)
= 1.825g अत: 1.8258 निकिल की मात्रा कैथोड पर निक्षेपित होगी।
प्रश्न 16.
ZnsO4 AgNO3 एवं CusO4 विलयन वाले तीन विद्युत अपघटनी सेलों A, B, C को श्रेणीबद्ध किया गया एवं 1.5 ऐम्पियर की विद्युत धारा, सेल B के कैथोड पर 1.458 सिल्वर निक्षेपित होने तक लगातार प्रवाहित की गई। विद्युत धारा कितने समय तक प्रवाहित हुई? निक्षेपित कॉपर एवं जिंक का द्रव्यमान क्या होगा?
उत्तर:
धारा (i) = 1.5
ऐम्पियर सिल्वर का भार (WAg) = 1.45g
Ag+ + e- → Ag
1 मोल = 108g
108 gAg निक्षेपित होती है = IF अर्थात्
= 96500 c
विद्युत धारा से
1.45 gAg निक्षेपित होगी = \(\frac{96500 \times 1.45}{108}\)
= 1295.6 कुलॉम
Q = i x t
∴ t = Q/i
\(=\frac{1295 \cdot 6}{15}\) = 863.7 सेकण्ड
= 14 मिनट 24 सेकण्ड
2 x 96500 C से Cu निक्षेपित होती है = 63.5 g
1295.6 कूलॉम से Cu निक्षेपित होगी = \(\frac{63.5 \times 12956}{2 \times 96500}\)
= 426gCu
इसी प्रकार,
\(\mathrm{Cu}^{2+}+2 e^{-} \longrightarrow \mathrm{Cu}\)
2 x 96500 कूलॉम से Zn निक्षेपित होती है = 65.4g
1295.6 कूलॉम से Zn निक्षेपित होगी
\(\mathrm{Zn}^{2+}+2 e^{-} \longrightarrow \mathrm{Zn}\)
\(=\frac{65.4 \times 12956}{2 \times 96500}\)
= 0.44g Zn
प्रश्न 17.
तालिका 3.1(पाठ्य-पुस्तक) (इस पुस्तक के पृष्ठ 185 सारणी 3.1) में दिए गए मानक इलेक्ट्रोड विभवों की सहायता से अनुमान लगाइए कि क्या निम्नलिखित अभिकर्मकों के बीच अभिक्रिया सम्भव है?
(I) Fe3+ और I- (aq)
(ii) Ag+ और Cu(s)
(iii) Fe3+ (aq) और Br-
(iv) AR(s) और Fe3+
(v) Br2 (aq) और Fe2+(aq)-
उत्तर:
तालिका से,
\(\begin{aligned} &\mathrm{E}_{1 / 2 \mathrm{I}_2, \mathrm{I}^{-}}^{\Theta}=0.541 \mathrm{~V} \\ &\mathrm{E}_{\mathrm{Cu}^{2+}, \mathrm{Cu}}^{\Theta}=+0.34 \mathrm{~V} \end{aligned}\)
\(\begin{aligned} \mathrm{E}_{1 / 2 \mathrm{Br}_2, \mathrm{Br}^{-}}^{\Theta} &=+1.09 \mathrm{~V} \\ \mathrm{E}_{\mathrm{Ag}^{+}, \mathrm{Ag}}^{\Theta} &=0.80 \mathrm{~V} \end{aligned}\)
\(\mathrm{E}_{\mathrm{Fe}^{3+}, \mathrm{Fe}^{2+}}^{\Theta}=+0.77 \mathrm{~V}\)
अभिक्रिया केवल तब सम्भव होगी जब सेल अभिक्रिया का वि. वा. बल धनात्मक होगा।
(i) Fe3+ (aq) और I-(aq) में होने वाली अभिक्रिया,
\(\mathrm{Fe}^{3+}{ }_{(a q)}+\mathrm{I}_{(a q)}^{-} \longrightarrow \mathrm{Fe}^{2+}(a q)+\frac{1}{2} \mathrm{I}_2\)
Fe3+ का अपचयन तथा I- का ऑक्सीकरण होगा।
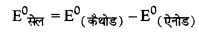
= \(\mathrm{E}_{\left(\mathrm{Fe}^{3+} / \mathrm{Fe}^{2+}\right)}-\mathrm{E}_{\left(\frac{1}{2} \mathrm{I}_2 / \mathrm{I}^{-}\right)}\)
= 0.770 - 0.541
= 0.299 V (अभिक्रिया सम्भव है)
(ii) Ag+(aq) और Cu(s)
\(\mathrm{Ag}^{+}+\mathrm{Cu} \longrightarrow \mathrm{Ag}+\mathrm{Cu}^{2+}\)
यहाँ Ag+ अपर्चयित एवं Cu ऑक्सीकृत होगा।
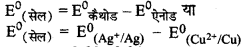
= 0.80 - 0.34
= 0.46 V
\(\text { (iii) } \mathrm{Fe}^{3+}+\mathrm{Br}^{-} \longrightarrow \mathrm{Fe}^{2+}+\frac{1}{2} \mathrm{Br}_2\)
यहाँ Fe3+ अपचयित तथा Br- ऑक्सीकृत हो रहा है।
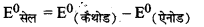
\(=\mathrm{E}_{\left(\mathrm{Fe}^{3+} / \mathrm{Fe}^{2+}\right)}-\mathrm{E}_{\left(\frac{1}{2} \mathrm{Br}_2 / \mathrm{Br}^{-}\right)}\)
= 0.77 - 1.09
= - 0.32v

प्रश्न 18.
निम्नलिखित में से प्रत्येक के लिए वैद्युत- अपघटन से प्राप्त उत्पाद बताइए:
(i) सिल्वर इलेक्ट्रोडों के साथ AgNO3 का जलीय विलयन
(ii) प्लैटिनम इलेक्ट्रोडों के साथ AgNO3 का जलीय विलयन
(iii) प्लैटिनम इलेक्ट्रोडों के साथ H2SO4 का तनु विलयन
(iv) प्लैटिनम इलेक्ट्रोडों के साथ CuCl2 का जलीय विलयन।
उत्तर:
(i) सिल्वर इलेक्ट्रोडों के साथ AgNO3 के जलीय विलयन का विद्युत-अपघटन
\(\begin{aligned} \mathrm{AgNO}_{3(s)}+a q & \longrightarrow \mathrm{Ag}^{+}(a q)+\mathrm{NO}_3^{-}(a q) \\ \mathrm{H}_2 \mathrm{O} & \rightleftharpoons \mathrm{H}^{+}+\mathrm{OH}^{-} \end{aligned}\)
कैथोड पर, Ag+ आयनों का डिस्चार्ज विभव H+ आयनों से कम होता है। इसलिए H+ आयनों का निक्षेपण न होकर Ag+ आयन Ag की भाँति निक्षेपित होंगे।
\(\mathrm{Ag}^{+}+e^{-} \longrightarrow \mathrm{Ag}\)
यहाँ कैथोड पर Ag निक्षेपित होगा एवं ऐनोड घुल जायेगा।
(ii) प्लेटिनम इलेक्ट्रोडों के साथ AgNO3 का जलीय विलयन।
\(\begin{aligned} \mathrm{AgNO}_3 & \stackrel{a q}{\rightleftarrows} \mathrm{Ag}^{+}+\mathrm{NO}_3^{-} \\ \mathrm{H}_2 \mathrm{O} & \rightleftharpoons \mathrm{H}^{+}+\mathrm{OH}^{-} \end{aligned}\)
कथाड पर, Ag+ का डिस्चाज विभव H+आयना से कम हाता है
अतः H+ का निक्षेपण न होकर Ag+आयनों का निक्षेपण होगा।
\(\mathrm{Ag}^{+}+e^{-} \longrightarrow \mathrm{Ag}\)
ऐनोड पर, यहाँ OH- का डिस्चार्ज विभव कम होता है अतः यह ऐनोड पर विघटित होकर O2 देता है।
\(\begin{aligned} &\mathrm{OH}^{-} \longrightarrow \mathrm{OH}+e^{-} \\ &4 \mathrm{OH} \longrightarrow 2 \mathrm{H}_2 \mathrm{O}+\mathrm{O}_2 \end{aligned}\)
अत: यहाँ कैथोड पर Ag निक्षेपित होगी एवं ऐनोड पर O2 प्राप्त होगी।
(iii) प्लेटिनम इलेक्ट्रोडों के साथ H2SO4 के तनु विलयन का विद्युत अपघटन
\(\begin{aligned} \mathrm{H}_2 \mathrm{SO}_4 & \longrightarrow 2 \mathrm{H}^{+}+\mathrm{SO}_4^{2-} \\ \mathrm{H}_2 \mathrm{O} & \longrightarrow \mathrm{H}^{+}+\mathrm{OH}^{-} \end{aligned}\)
कैथोड पर
\(\mathrm{H}^{+}+e^{-} \longrightarrow \frac{1}{2} \mathrm{H}_2\)
ऐनोड पर, चूँकि OH- का डिस्वार्ज विभव कम होता है अतः यह विघटित होकर O2 देता है।
\(\begin{aligned} &\mathrm{OH}^{-} \longrightarrow \mathrm{OH}+e^{-} \\ &4 \mathrm{OH} \longrightarrow 2 \mathrm{H}_2 \mathrm{O}+\mathrm{O}_2 \end{aligned}\)
अतः कैथोड पर H2 गैस व ऐनोड पर O2 प्राप्त होगी ।
(iv) प्लेटिनम इलेक्ट्रोडों के साथ CuCl2 के जलीय विलयन का विद्युत-अपघटन:
\(\begin{gathered} \mathrm{H}_2 \mathrm{O} \longrightarrow \mathrm{H}^{+}+\mathrm{OH}^{-} \\ \mathrm{CuCl}_2 \stackrel{\longrightarrow}{\longrightarrow} \mathrm{Cu}^{2+}+2 \mathrm{Cl}^{-} \end{gathered}\)
कैथोड पर, चूँकि Cu2+ का डिस्चार्ज विभव H+से कम होता है अतः यह कैथोड पर निक्षेपित होगी।
\(\mathrm{Cu}^{2+}+2 e^{-} \longrightarrow \mathrm{Cu}\)
ऐनोड पर, चूँकि Cl- का डिस्चार्ज विभव OH- से कम होता है अत: यह ऐनोड पर Cl2 को मुक्त करेगा।
\(2 \mathrm{CH} \longrightarrow \mathrm{Cl}_2+2 e^{-}\)
अतः कैथोड़ पर Cu निक्षेपित तथा ऐनोड पर Cl2 मुक्त होगी।

- RBSE Class 12 Chemistry Notes Chapter 16 दैनिक जीवन में रसायन
- RBSE Class 12 Chemistry Notes Chapter 15 बहुलक
- RBSE Class 12 Chemistry Notes Chapter 14 जैव-अणु
- RBSE Class 12 Chemistry Notes Chapter 13 ऐमीन
- RBSE Class 12 Chemistry Notes Chapter 12 ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
- RBSE Class 12 Chemistry Notes Chapter 11 ऐल्कोहॉल, फीनॉल एवं ईथर
- RBSE Class 12 Chemistry Notes Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
- RBSE Class 12 Chemistry Notes Chapter 9 उपसहसंयोजन यौगिक
- RBSE Class 12 Chemistry Notes Chapter 8 d- एवं f-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम