RBSE Class 12 Chemistry Notes Chapter 5 पृष्ठ रसायन
These comprehensive RBSE Class 12 Chemistry Notes Chapter 5 पृष्ठ रसायन will give a brief overview of all the concepts.
Rajasthan Board RBSE Solutions for Class 12 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 12. Students can also read RBSE Class 12 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 12 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 12 Chemistry Chapter 5 Notes पृष्ठ रसायन
→ अधिशोषण (Adsorption):
अणुक स्पीशीज का सूक्ष्म विभाजित अवस्था में किसी ठोस या द्रव के स्थूल की अपेक्षा पृष्ठ पर संचित होना या जुड़ना अधिशोषण कहलाता है।
→ अधिशोष्य (Adsorbate):
अणुक स्पीशीज या पदार्थ जो सूक्ष्म विभाजित अवस्था में ठोस अथवा द्रव की सतह पर सान्द्रित या संचित या अधिशोषित होता है, अधिशोष्य कहलाता है।
→ अधिशोषक (Adsorbent):
वह पदार्थ जिसके पृष्ठ अथवा सतह पर किसी पदार्थ के अणु, परमाणु अथवा आयनिक स्पीशीज का अधिशोषण होता है, अधिशोषक (Adsorbent) कहलाता है।
→ विशोषण (Desorption):
अधिशोषित पदार्थ को अधिशोषक की सतह से हटाये जाने की क्रिया को विशोषण कहते हैं।

→ शोषण.(Sorption):
वह प्रक्रम जिसमें अधिशोषण एवं अवशोषण दोनों ही प्रक्रियाएँ एक साथ सम्पन्न होती हैं, शोषण कहलाती है।
→ अन्तरापृष्ठ (Interface):
अधिशोषक की वह सतह जिस पर अधिशोषक पदार्थ संकेन्द्रित (concentrated) होता है, अन्तरापृष्ठ (Interface) कहलाता है।
→ अधिशोषण के सक्रिय केन्द्र (Active Center of Adsorption):
अधिशोषक सतह की मुक्त संयोजकताओं पर अधिशोष्य, अधिशोषित होता है। ये मुक्त संयोजकताएँ अधिशोषक सतह पर एक समान नहीं होती। खुरदरे अन्तरापृष्ठ पर मुक्त संयोजकताएँ अधिक होती हैं तथा इन्हीं स्थानों पर अधिशोषण अधिक होता है। यही मुक्त संयोजकताएँ सक्रिय केन्द्र (Active centres) कहलाती हैं।
→ धनात्मक अधिशोषण (Positive Adsorption):
किसी रासायनिक प्रक्रम में यदि अधिशोष्य पदार्थ की अधिकतम मात्रा का अधिशोषक के पृष्ठ पर अधिशोषण हो जाता है तो इसे धनात्मक अधिशोषण कहते हैं।
→ ऋणात्मक अधिशोषण (Negative Adsorption):
किसी रासायनिक प्रक्रम में अधिशोष्य पदार्थ की कुल मात्रा का कम भाग अधिशोषित होता है तो इसे ऋणात्मक अधिशोषण कहते हैं।
→ अधिशोषण की ऊष्मा (Heat of Adsorption):
ठोस के पृष्ठ पर किसी गैस के एक ग्राम मोल के अधिशोषित होने पर मुक्त ऊष्मा, अधिशोषण की ऊष्मा कहलाती है।
→ भौतिक अधिशोषण (Physical Adsorption):
जब अधिशोषक की सतह पर अधिशोष्य भौतिक बलों जैसे-वाण्डर वाल्स बन्धों के द्वारा बँधे होते हैं तब इसे भौतिक अधिशोषण (Physical adsorption) या वाण्डर वाल्स अधिशोषण (van der Waal's adsorption) कहते हैं।
→ रासायनिक अधिशोषण या रसोवशोषण (ChemicalAdsorption or Chemisorption):
जब अधिशोषक अणु व अधिशोष्य अणुओं के मध्य रासायनिक बन्ध होता है तो इस प्रकार का अधिशोषण रासायनिक अधिशोषण कहलाता है।
→ क्रान्तिक ताप (Critical Temperature):
"वह न्यूनतम ताप जिसके ऊपर किसी गैस को द्रवित नहीं किया जा सकता है, चाहे दाब कितना ही अधिक क्यों न हो, क्रान्तिक ताप (Critical temperature) कहलाता है।"
→ अधिशोषण समतापी (Adsorption Isotherm):
अधिशोषक द्वारा अधिशोषित गैस की मात्रा में स्थिर ताप पर दाब के साथ परिवर्तन एक वक्र के माध्यम से व्यक्त किया जा सकता है, जिसे हम अधिशोषण समतापी (Adsorption isotherm) कहते हैं।
→ फ्रॉयन्डलिक समतापी वक्र समीकरण (FreundlichAdsorption Isotherm Curve equation):
log\(\frac{x}{m}\) = log k + \(\frac{1}{n}\)logP

→ समांगी उत्प्रेरण (Homogeneous catalysis):
जब अभिकारक, उत्पाद एवं उत्प्रेरक समान प्रावस्था में होते हैं तो इसे समांगी उत्प्रेरण (Homogeneous catalysis) कहते हैं। उदाहरणार्थ-SO2, का ऑक्सीकरण (Oxidation of SO2)-सीस कक्ष विधि (Lead chamber process) में SO2 का ऑक्सीकरण समांगी उत्प्रेरण का उदाहरण है।
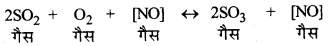
→ विषमांगी उत्प्रेरण (Heterogeneous Catalysis):
जब उत्प्रेरकों एवं अभिकारकों की प्रावस्था भिन्न-भिन्न होती है तो इसे विषमांगी उत्प्रेरण (Heterogeneous catalysis) कहते हैं। उदाहरण-SO2, का ऑक्सीकरण (Oxidation of SO2)-Pt की उपस्थिति में SO2, का SO3, में ऑक्सीकरण एक विषमांगी उत्प्रेरण का उदाहरण है।
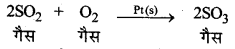
→ धनात्मक उत्प्रेरक (Positive Catalyst):
वे उत्प्रेरक जो रासायनिक अभिक्रिया के वेग को बढ़ा देते हैं, धनात्मक उत्प्रेरक कहलाते हैं। उदाहरण-पोटैशियम क्लोरेट के तापीय अपघटन में MnO2, धनात्मक उत्प्रेरक का कार्य करता है।
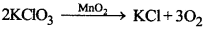
→ ऋणात्मक उत्प्रेरक (Negative Catalyst):
वे उत्प्रेरक जो रासायनिक अभिक्रिया के वेग को कम कर देते हैं, ऋणात्मक उत्प्रेरक कहलाते हैं। उदाहरण-ग्लिसरॉल की उपस्थिति में हाइड्रोजन परॉक्साइड की अपघटन की दर कम हो जाती है। यही कारण है कि H2O2 को संग्रहीत करने के लिए उसमें कुछ मात्रा में ग्लिसरॉल डाल दिया जाता है।
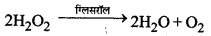
→ स्वतः उत्प्रेरक (Auto Catalyst):
जब किसी रासायनिक क्रिया में बना उत्पाद स्वयं उस अभिक्रिया के लिये उत्प्रेरक का कार्य करता है अर्थात् अभिक्रिया के वेग को बढ़ा देता है तो वह पदार्थ स्वतः उत्प्रेरक (Auto catalyst) कहलाता है। उदाहरण-ऐस्टर का जल-अपघटन प्रारम्भ में मन्दगति से होता है तथा कुछ समय पश्चात् अपघटन का वेग बढ़ जाता है क्योंकि यहाँ ऐस्टर के जल-अपघटन से प्राप्त ऐसीटिक एसिड अभिक्रिया में स्वतः उत्प्रेरक का कार्य करता है।
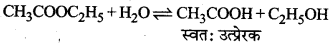
→ उत्प्रेरक विष (Catalytic Poison or Inhibitor):
वे बाहरी पदार्थ जिनकी उपस्थिति में उत्प्रेरक की अभिक्रियाशीलता एवं सक्रियता कम या नष्ट हो जाती है, उत्प्रेरक विष कहलाते हैं।
→ उत्प्रेरक वर्धक (Catalytic Promoters):
जब कोई बाहरी पदार्थ किसी उत्प्रेरण क्रिया में प्रयुक्त उत्प्रेरक की उत्प्रेरण सक्रियता को बढ़ा देते हैं, किन्तु स्वयं अभिक्रिया के लिए उत्प्रेरक नहीं होते हैं, ऐसे पदार्थ उत्प्रेरक उत्साहक या उत्प्रेरक वर्धक कहलाते हैं।
→ कोलॉइडी विलयन (Colloidal Solution):
इस विलयन में कणों का आकार 1nm से 1000 nm के मध्य का होता है। इसमें दो प्रावस्थायें होती हैं
- परिक्षिप्त प्रावस्था,
- परिक्षेपण माध्यम।

→ धनात्मक कोलॉइड (Positive Colloids):
ऐसे कोलॉइडी विलयन जिनमें परिक्षिप्त प्रावस्था (Dispersed Phase) के कणों पर धनावेश होता है, धनात्मक कोलॉइड कहलाते हैं।
उदाहरण-धातु हाइड्रॉक्साइड Al (OH)3, Fe(OH)3 आदि।
→ ऋणात्मक कोलॉइड (Negative Colloids):
ऐसे कोलॉइडी विलयन जिनमें परिक्षिप्त प्रावस्था (Dispersed Phase) के कणों पर ऋणावेश होता है, ऋणात्मक कोलॉइड कहलाते हैं।
उदाहरण-धातुओं जैसे Au, Ag, Cu, Pt, Fe आदि के कोलॉइडी विलयन, ASS3 का कोलॉइडी विलयन, स्टार्च, मिट्टी, Cds आदि।
→ द्रव-स्नेही कोलॉइड (Lyophilic colloids):
वे कोलॉइड जिनमें परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य लगाव अधिक होता है। द्रव-स्नेही कोलॉइड कहलाते हैं।
→ द्रव-विरोधी कोलॉइड (Lyophobic colloids):
वे कोलॉइड जिनमें परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य लगाव बहुत कम होता है। द्रव-विरोधी कोलॉइड कहलाते हैं।
→ क्रान्तिक मिसेल सान्द्रता (Critical Micelle Concentration CMC):
वह सान्द्रता, जिससे कम सान्द्रता पर पदार्थ विद्युत्-अपघट्य के समान तथा जिससे अधिक सान्द्रता पर वह कोलॉइड की तरह व्यवहार करता है, क्रान्तिक मिसेल सान्द्रता कहलाती है।
→ क्रॉफ्ट ताप (Kraft Temperature):
वह ताप जिस पर हम CMC को निकालते हैं, क्राफ्ट ताप कहलाता है।
→ मिसेल (Micelle):
किसी पदार्थ के विलयन की सान्द्रता CMC से अधिक करने पर उनके आयनों से मिलकर बना समुच्चय मिसेल (Micelle) कहलाता है। एक मिसेल में उपस्थित कणों की संख्या को उसकी समुच्चय संख्या (Aggregation Number) कहा जाता है।
→ पेप्टीकरण (Peptization):
"किसी अवक्षेप को विद्युत् अपघट्य की थोड़ी सी मात्रा की उपस्थिति में परिक्षेपण माध्यम के साथ हिलाकर कोलॉइडी सॉल में परिवर्तित करने वाला प्रक्रम पेप्टन या पेप्टीकरण कहलाता है।"
→ अपोहन (Dialysis):
ग्राहम ने कोलॉइडी पदार्थों को क्रिस्टलाभ पदार्थों से पृथक् करने के लिए एक उपकरण बनाया जिसको अपोहक या डाइलाइजर कहते हैं।
→ विद्युत् अपोहन (Electrodialysis):
अपोहन का प्रक्रम अत्यन्त मन्द गति का होता है। यदि अशुद्ध कोलॉइडी विलयन में विलेय पदार्थ केवल विद्युत्-अपघट्य हो तो इसे. विद्युत् क्षेत्र लगाकर तेज किया जा सकता है। इस प्रक्रम को विद्युत् अपोहन कहते हैं।
→ टिण्डल प्रभाव (Tyndall Effect):
किसी सॉल में से प्रकाश पुंज प्रवाहित करके, उसे प्रकाश की दिशा के लम्बवत् देखने पर सॉल में प्रकाश पुंज का मार्ग चमकता हुआ दिखाई देता है। यह परिघटना टिण्डल प्रभाव कहलाती है।

→ ब्राउनी गति (Brownian Movement):
जब कोलॉइडी विलयन का निरीक्षण अति सूक्ष्मदर्शी से किया जाता है तो कोलॉइडी कण टेढ़े-मेढ़े (zig-zig) चलते हुए दिखाई देते हैं। ये कण हमेशा तीव्र गति से चलते रहते हैं। कोलॉइडी कणों का तीव्र गति से टेढे-मेढ़े चलना ब्राउनी गति (Brownian Movement) कहलाता है। चूँकि इस गति का निरीक्षण सर्वप्रथम रॉबर्ट ब्राउन ने किया था इसलिए इसे ब्राउनी गति कहते हैं।
→ जीटा विभव (Zeta Potential):
दो विपरीत आवेश के स्तरों के पास-पास आने के फलस्वरूप एक विभवान्तर उत्पन्न हो जाता है, जिसे विद्युत् गतिक विभव या जीटा विभव कहते हैं।
→ विद्युत् कण-संचलन (Electrophoresis):
कोलॉइडी कण विद्युत् आवेशित होते हैं। विद्युत् क्षेत्र में ये कण विपरीत आवेश वाले इलेक्ट्रोड की ओर गमन करते हैं। विद्युत् क्षेत्र के प्रभाव में कोलॉइडी कणों का एक अथवा दूसरे इलेक्ट्रोड की ओर अभिगमन विद्युत् कण-संचलन (Electrophoresis) कहलाता है।
→ पायसीकर्मक (Emulsifying Agent):
तेल एवं जल के इमल्शन अस्थायी होते हैं और कभी-कभी रख देने पर दो परतों में अलग हो जाते हैं। इमल्शन के स्थायित्व के लिए सामान्यतः एक तीसरा घटक मिलाते हैं इसे पायसीकर्मक (EmulsifyingAgent) कहते हैं। '
→ अन्य महत्वपूर्ण बिन्दु (Other Important Points)
- अधिशोषण एक पृष्ठीय परिघटना है, जबकि अवशोषण नहीं।
- भौतिक अधिशोषण बहुपरतीय तथा रसोवशोषण एकल परतीय घटना होती है।
- अधिशोषण की ऊर्जा रसोवशोषण के लिये अधिक परन्तु भौतिक अधिशोषण के लिये कम होती है।
- क्षेत्रीय सतह पर किसी गैस के अधिशोषण के लिये फ्रॉयन्डलिक अधिशोषण समतापी निम्न है
\(\frac{x}{m}\) = k p1/n - फ्रॉयन्डलिक अधिशोषण समतापी वक्र समीकरण
log\(\frac{x}{m}\) = logk + \(\frac{1}{n}\)logP - लैंगम्यूर अधिशोषण समतापी के लिये गणितीय व्यंजक
\(\frac{x}{m}=\frac{a c}{1+b c}\) - उत्प्रेरक किसी भी अभिक्रिया की सक्रियण ऊर्जा को घटाकर ही अभिक्रिया वेग को बढ़ाते हैं।
- उत्प्रेरक वर्धकों का कार्य उत्प्रेरक की क्षमता बढ़ाना होता है।
- उत्प्रेरक विष अभिक्रिया में उपस्थित उत्प्रेरक की क्षमता को कम या नष्ट कर देते हैं।
- जिओलाइट एक प्रकार का आकार चयनात्मक उत्प्रेरक होता है।
- कोलॉइड एक पदार्थ नहीं है परन्तु यह पदार्थ की एक अवस्था होती
- कोलॉइडी सॉल के कण का आकार 103 से 105 pm होता है।
- पायस (emulsions), पायसीकारकों (emulsifiers) की उपस्थिति के कारण अधिक स्थायी होते हैं।
- साबुन से धोने की क्रिया, तेल और पानी के बीच पायसीकारक से सम्बन्धित है।
- कोलॉइडी कणों का एक साथ एकत्र हो जाना स्कंदन (Coagulation) कहलाता है।
- कोलॉइडी कणों पर उपस्थित आवेश की प्रकृति को विद्युत् कण संचलन (Electrophoresis) के द्वारा जाना जा सकता है।
- परिक्षेपित प्रावस्था के कण अनियमित रूप से (Zig-Zag) गति करते हैं। यह गति ब्राउनी गति कहलाती है।
- अपोहन (Dialysis) की प्रक्रिया द्वारा कोलॉइड सॉल से विद्युत् अपघट्य की अधिकता को कम कर सकते हैं।

- RBSE Class 12 Chemistry Notes Chapter 16 दैनिक जीवन में रसायन
- RBSE Class 12 Chemistry Notes Chapter 15 बहुलक
- RBSE Class 12 Chemistry Notes Chapter 14 जैव-अणु
- RBSE Class 12 Chemistry Notes Chapter 13 ऐमीन
- RBSE Class 12 Chemistry Notes Chapter 12 ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
- RBSE Class 12 Chemistry Notes Chapter 11 ऐल्कोहॉल, फीनॉल एवं ईथर
- RBSE Class 12 Chemistry Notes Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
- RBSE Class 12 Chemistry Notes Chapter 9 उपसहसंयोजन यौगिक
- RBSE Class 12 Chemistry Notes Chapter 8 d- एवं f-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम