RBSE Class 12 Chemistry Important Questions Chapter 9 उपसहसंयोजन यौगिक
Rajasthan Board RBSE Class 12 Chemistry Important Questions Chapter 9 उपसहसंयोजन यौगिक Important Questions and Answers.
Rajasthan Board RBSE Solutions for Class 12 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 12. Students can also read RBSE Class 12 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 12 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 12 Chemistry Chapter 9 Important Questions उपसहसंयोजन यौगिक
बहुविकल्पीय प्रश्न:
प्रश्न 1.
[CO(en)2Cl2]Cl में CO की समन्वय संख्या है:
(i) 3
(ii) 4
(iii) 5
(iv) 6
उत्तर:
(iv) 6
प्रश्न 2.
[Cr(H2O)5 Cl]Cl2 आयन में Cr की संयोजकता होती है:
(i) 3
(ii) 1
(iii) 6
(iv) 5
उत्तर:
(i) 3

प्रश्न 3.
[CO(NH3)4 Cl]Q2 में CO की ऑक्सीकरण अवस्था है:
(i) +1
(ii) +2
(iii) +3
(iv) +4
उत्तर:
(iii) +3
प्रश्न 4.
हैटरोलैप्टिक संकर है:
(i) [Fe(CN)6]4-
(ii) [CO(NH3)5SO4]+
(iii) [Hgl4]2-
(iv) [CO(NH3)6]3+
उत्तर:
(ii) [CO(NH3)5SO4]+
प्रश्न 5.
निम्नलिखित में से कौन-सा आयन उपसहसंयोजन यौगिक नहीं बनाता है?
(i) Na+
(ii) cr2+
(iii) CO2+
(iv) Cr3+
उत्तर:
(i) Na+
प्रश्न 6.
कौन-सा धनायन अमोनिया के साथ ऐमीन संकुल नहीं बनाता है?
(i) Ag+
(ii) Al3+
(iii) Cd2+
(iv) Cu2+
उत्तर:
(ii) Al3+
प्रश्न 7.
[Pt(NH3)2Cl2] यौगिक के त्रिविम समावयवियों की संख्या है:
(i) 1
(ii) 2
(iii) 4
(iv) 3
उत्तर:
(ii) 2
प्रश्न 8.
जटिल यौगिक [Fe(H2O)5NO]SO4 में Fe के अयुग्मित इलेक्ट्रॉनों की संख्यष्ट है:
(i) 2
(ii) 3
(iii) 4
(iv) इनमें से कोई नहीं
उत्तर:
(i) 2
प्रश्न 9.
[CO(NH3)4 Cl2] Br2 एवं [CO(NH3)4 Br2] Cl2 का युगल दर्शाएगा
(i) बंधनी समावयवता
(ii) हाइड्रेट समावयवता
(iii) आयनन समावयवता
(iv) उपसहसंयोजन समावयवता
उत्तर:
(iii) आयनन समावयवता
प्रश्न 10.
[CO(en)2 (NO2)Cl]NO2 एवं [CO(en)2(NO2)2]Cl किस प्रकार के समावयवी हैं?
(i) आयनन
(ii) उपसहसंयोजन
(iii) बहुलीकरण
(iv) हाइड्रेट।
उत्तर:
(i) आयनन
प्रश्न 11.
संकुल [Cr(H2O)6]CI3 तथा [Cr(H2O)5Cl]Cl2 H2O निम्नांकित समावयवता का उदाहरण है:
(i) बन्धन समावयवता
(ii) आयनन समावयवता
(iii) सहसंयोजन समावयवता
(iv) हाइड्रेट समावयवता।
उत्तर:
(iv) हाइड्रेट समावयवता।
प्रश्न 12.
डाइक्लोरोडाइऐमीनप्लैटिनम (II) संकुल का सूत्र है:
(i) Pt[Cl2(NH3)2]
(ii) Pt[R(NH2)2]Cl2
(iii) [PtCl2(NH3)2]
(iv) [PtR(NH2)2]Cl2
उत्तर:
(ii) Pt[R(NH2)2]Cl2
प्रश्न 13.
संकुल [CO(NH3)5Cl] Cl2 से विलयन में कितने आयन उत्पन्न होते हैं?
(i) 4
(ii) 2
(iii) 3
(iv) 5
उत्तर:
(ii) 2
प्रश्न 14.
समावयवियों [CO(NH3)6]Cl2 तथा [CO(NH3)5 Cl]Cl2 का युग्म निरूपित करता है:
(i) आयन समावयवता
(ii) बन्धनी समावयवता
(iii) सहसंयोजन समावयवता
(iv) त्रिविम समावयवता।
उत्तर:
(iv) त्रिविम समावयवता।
प्रश्न 15.
COCl3.5NH3 जल में विलेय होकर क्लोराइड आयन देता है:
(i) 2
(ii) 3
(iii) 1
(4) एक भी नहीं।
उत्तर:
(i) 2

प्रश्न 16.
[MnCl4]2- में संकरण है:
(i) sp
(ii) dsp2
(iii) sp3
(iv) sp3d.
उत्तर:
(iii) sp3
प्रश्न 17.
[Fe(CN)6]4 में अयुग्मित इलेक्ट्रॉन संख्या है:
(i) 4
(ii) 2
(iii) 1
(iv) शून्य।
उत्तर:
(iv) शून्य।
प्रश्न 18.
IUPAC पद्धति के अनुसार [CO(NH3)3 (H2O)2Cl]Cl2 का नाम है:
(i) डाइएक्वाक्लोरोडाइऐमीन कोबाल्ट (III) क्लोराइड
(ii) ट्राइऐमीनडाइएक्वाक्लोरो कोबाल्ट (III) क्लोराइड
(iii) क्लोरोडाइऐमीनडाइएक्वा कोबाल्ट (III) क्लोराइड
(iv) डाइऐमीनडाइएक्वाक्लोरो कोबाल्ट (II) क्लोराइड।
उत्तर:
(ii) ट्राइऐमीनडाइएक्वाक्लोरो कोबाल्ट (III) क्लोराइड
प्रश्न 19.
परमाणुओं का कोई समूह लिगैण्ड की तरह व्यवहार कर सकता है, यदि वह।
(i) छोटा अणु हो
(ii) ऋणावेशित आयन हो
(iii) अयुग्मित इलेक्ट्रॉन युग्म रखता हो
(iv) धनावेशित आयन हो।
उत्तर:
(iii) अयुग्मित इलेक्ट्रॉन युग्म रखता हो
प्रश्न 20.
निम्न में से किस संकुल में fac-mer समावयता सम्बन्ध है।
(i) [M(AB)3]
(ii) [M(A4)B2]
(iii) [M(AA)6]
(iv) [M(AB)6]
उत्तर:
(iii) [M(AA)6]
अति लघु उत्तरीय प्रश्न:
प्रश्न 1.
[Fe(C2O4)3]- में केन्द्रीय धातु आयन की उपसहसंयोजकता (समन्वय संख्या) ज्ञात कीजिए।
उत्तर:
समन्वय संख्या = 6
प्रश्न 2.
K2SO4.Al2(SO4)3. 24H2O के जलीय विलयन में उपस्थित आयनों के नाम लिखिए।
उत्तर:
K2SO4.Al2(SO4)3. 24H2O के जलीय विलयन में K+, Al3+ व SO2-4 आयन उपस्थित होते हैं।

प्रश्न 3.
संकुल [Fe(CN)6]4- की आवेश संख्या ज्ञात कीजिए।
उत्तर:
[Fe(CN)6]4- की आवेश संख्या = Fe2+ आयन पर आवेश + (6 x CN- आयन पर आवेश)
= 2 + 6 x (-1)
= -4
प्रश्न 4.
[Cu(NH3)4]SO4 में Cu की ऑक्सीकरण संख्या ज्ञात कीजिए।
उत्तर:
माना Cu की ऑक्सीकरण संख्या x है
X + 4(0) + 1(-2) = 0
x - 2 = 0
x = + 2
प्रश्न 5.
VBT के आधार पर [FeF6]3- संकुल आयन की संरचना एवं चुम्बकीय प्रकृति बताइए।
उत्तर:
sp3 d2 प्रकार का संकरण, अष्टफलकीय संरचना, अनुचुम्बकीय प्रकृति।
प्रश्न 6.
प्रभावी परमाणु क्रमांक क्या है? उदाहरण द्वारा समझाइए।
उत्तर:
प्रभावी परमाणु क्रमांक - [केन्द्रीय धातु का परमाणु क्रमांक-ऑक्सीकरण संख्या + 2 x उपसहसंयोजन संख्या]
उदाहरण: [CO(CNYO] - में CO का प्रभावी परमाणु क्रमांक = (27 - 3 + 2 x 6) = 36
प्रश्न 7.
[Fe(CN)6]3- में आयरन का प्रभावी परमाणु क्रमांक ज्ञात कीजिए। (Fe का परमाणु क्रमांक = 26)
उत्तर:
[Fe(CN)6]3- में आयरन का प्रभावी परमाणु क्रमांक = [26 - 3 + 2(6)] = 35
प्रश्न 8.
IUPAC मानदण्डों का उपयोग करते हुए निम्नलिखित संकुलों के सूत्र लिखिए।
(a) हेक्साएक्वाक्रोमियम (III) क्लोराइड
(b) सोडियम ट्राइऑक्सैलेटोफेरेट (III)
उत्तर:
(a) [Cr(H2O)6]Cl3,
(b) Na3[Fe(C2O4)3]।
प्रश्न 9.
IUPAC नियमों का प्रयोग करते हुए निम्न के नाम लिखिए।
(i) CO(NH3)4 (H2O)2 Cl3
(ii) Fe4[(Fe(CN)6]3
उत्तर:
(i) टेट्राऐम्मीनडाइऐक्वा कोबाल्ट (III ) क्लोराइड
(ii) Iron (III) हेक्सासायनिडोफरेट (II)
प्रश्न 10.
IUPAC मानदण्डों का उपयोग करते हुए निम्न के नाम लिखिए।
K3[CO(NO3)6], [Fe(H2O)6]Cl3
उत्तर:
(i) पोटैशियम ट्राइहेक्सा नाइट्रोकोबाल्ट, (II),
(ii) हेक्साऐक्वारेट (III) ट्राइक्लोराइड।
प्रश्न 11.
निम्नलिखित संकुल यौगिको के IUPAC में नाम दीजिये।
(a) [CO(en)3]+3
(b) K2 [Zn(OH)4]
उत्तर:
(a) [CO(en)3]+3 – ट्रिस (एथिलीन डाइएमीन) कोबाल्ट (III) आयन।
(b) K2 [Zn(OH)4] – पोटैशियम टेट्राहाइड्रोक्सो जिंकेट (II)

प्रश्न 12.
[Ni (CO)4] में NI की ऑक्सीकरण अवस्था लिखिए।
उत्तर:
शून्य
प्रश्न 13.
उभयदन्ती लिगैण्ड को परिभाषित कीजिए।
उत्तर:
वह लिगैण्ड, जो दो भिन्न परमाणुओं द्वारा जुड़ सकता है, उभयदन्ती लिगैण्ड कहलाता है।
जैसे - CN तथा NC
प्रश्न 14.
द्विदन्तुक लिगैण्ड का एक उदाहरण लिखिए।
उत्तर:
en ( एथिलीन डाइएमीन)।
प्रश्न 15.
निम्नलिखित संकुल यौगिक का IUPAC नाम लिखिए।
K3 [ Fe (C2O4)3]
उत्तर:
पोटेशियम ट्राईआक्सेलेटोफेरेट (III)
प्रश्न 16.
निम्न समावयवियों के युग्मों के द्वारा कौन-सी समावयवता प्रदर्शित होती है?
(i) [Pt(OH)2(NH3)4]SO4 तथा Pt (SO4) (NH3)4] (OH)2
(ii) [Cu(NH3)4] [PtCl4] तथा [Pt (NH3)4] [CuCl4]
उत्तर:
(i) आयनन समावयवता,
(ii) उपसहसंयोजन समावयवता।
प्रश्न 17.
निम्नलिखित संकुल यौगिक का IUPAC नाम लिखिए। [Cr(en)3]Cl3
उत्तर:
ट्रिस (एथेन 1, 2 डाइऐमीन) क्रोमियम (III ) क्लोराइड
प्रश्न 18.
सिस (समपक्ष) [CO(en)2 Cl2] के दोनों प्रतिबिम्बी रूप दर्शाइए।
उत्तर:
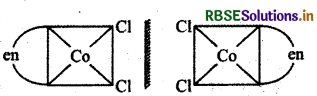
प्रश्न 19.
Ni2+ आयन का चुम्बकीय आघूर्ण ज्ञात कीजिए।
उत्तर:
28Ni -3d8 4s2 → Ni2+ 3d8 4s0
अयुग्मित e- की संख्या

n = 2
चुम्बकीय आघूर्ण μ = \(\sqrt{n(n+2)}\) = \(\sqrt{2(2+2)}\)
μ = 32.83 BM
प्रश्न 20.
[Mn2(CO)12] का IUPAC नाम लिखिए।
उत्तर:
डोडिकार्बोनिल डाइमैंगनीज (0).
प्रश्न 21.
(i) कॉम्प्लेक्स [Cr(H2O)6]Cl3 द्वारा किस प्रकार की समावयवता दिखाई जाती है।
(ii) यदि ∆o >P हो तो क्रिस्टल क्षेत्र सिद्धान्त के आधार पर आयन के लिये इलेक्ट्रॉनिक विन्यास लिखिये।
उत्तर:
(i) हाइड्रेट समावयवता
(ii) (t2g)4 (eg)0
प्रश्न 22.
[Fe(NH3)2(CN)4]- के ज्यामितीय समावयवों को लिखिए।
उत्तर:
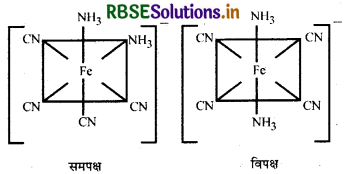
प्रश्न 23.
निम्न जलीय विलयन में कौन-से आयन देंगे:
(1) KCl.MgCl2.6H2O
(2) FeSO4 (NH4)2SO4.6H2O
(3) [Ag(NH3)2]Cl
(4) [Cu(H2O)4]SO4
(5) K2SO4 Al2 (SO4)3.24H2O
उत्तर:
- KCl.MgCl2.6H2O एक द्विक लवण है। इसका जलीय विलयन बनाने पर यह K+, CI-, Mg2+ आयनों को देगा।
- FeSO4 (NH4)2SO4.6H2O एक द्विक लवण है। इसका जलीय विलयन बनाने पर यह Fe2+, NH4+, तथा SO42- आयनों को देगा।
- [Ag(NH3)2]Cl एक संकुल यौगिक है अत: जलीय विलयन में यह केवल दो आयों को अर्थात् [Ag(NH3)2]+ तथा Cl- को ही देगा।
- [Cu(H2O)4]SO4 एक संकुल यौगिक है अत: जलीय विलयन में यह केवल दो आयनों को अर्थात् [Cu(H2O)4]2+ तथा SO42- को ही देगा।
- K2SO4 Al2(SO4)3.24H2O एक द्विक लवण है। इसका जलीय विलयन बनाने पर यह K+, SO42- तथा Al3+ आयनों को देगा।
प्रश्न 24.
दो या तीन वाक्यों में निम्न का कारण दीजिए:
[CuCl4]2- स्थायी है जबकि [Cul4]2- स्थायी नहीं है।"
उत्तर:
[CuCl4]2- तथा [CuCl4]2- दोनों में ही Cu2+ आयन उपस्थित हैं परन्तु केवल आयोडाइड आयन, Cu2+ को क्यूप्रस आयोडाइड (Cu2I2) तथा I में अपचयित कर देता है। इस कारण [CuCl4]2- एक स्थायी संकुल नहीं है जबकि [CuCl4]2- एक स्थायी संकुल है।

प्रश्न 25.
Ni2+ आयन के द्वारा निर्मित सभी अष्टफलकीय संकुल बाह्य कक्षक संकुल होते हैं, क्यों?
उत्तर:
Ni(28): 3d8 4s2
Ni2+ का विन्यास :
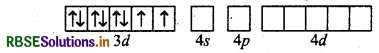
प्रबल क्षेत्र लिगैण्ड की उपस्थिति में इलेक्ट्रॉनों का युग्मन करने पर केवल एक 3d-कक्षक ही संकरण के लिए प्राप्त हो पायेगा। इस कारण आन्तरिक कक्षक संकुल के बनने की सम्भावना खत्म हो जाती है क्योंकि इसमें d2sp3 संकरण पाया जाता है। अत: Ni2+ आयन केवल बाह्य कक्षक संकुल ही बना पाता है जिसका संकरण sp3d2 होता है।
प्रश्न 26.
निम्नलिखित लिगैंडों का एकदंतुक, द्विदंतक ........... और में वर्गीकरण कीजिए।
(i) en
(ii) CN
(iii) acac
(iv) dmg
उत्तर:
(i) द्विदंतुक
(ii) एकदंतुक
(iii) द्विदंतुक
(iv) द्विदंतुक
लघु उत्तरीय प्रश्न:
प्रश्न 1.
निम्नलिखित संकुलों में केन्द्रीय धातु आयन की ऑक्सीकरण अवस्था एवं उपसहसंयोजन संख्या दीजिए।
(अ) [CO(en)3]3+
(ब) K4[Fe(CN)6]
उत्तर:
(अ) संकुल [CO(en)3]3+ में केन्द्रीय धातु आयन (CO3+) की ऑक्सीकरण अवस्था + 3 तथा उपसमायोजन संख्या 6 है क्योंकि en (एथिलीन डाइएमीन) एक उदासीन द्विदन्तुक लिगैड है।
(ब) संकुल K4[Fe(Cn)6] में केन्द्रीय धातु आयन (Fe+2) की ऑक्सीकरण अवस्था + 2 तथा समन्वयी संख्या 6 है क्योंकि CN एक ऋणात्मक एकदन्तुक लिगड है।
प्रश्न 2.
(a) K3[Fe(C2O4)3] संकुल का IUPAC नाम लिखिए।
(b) संयोजकता बन्ध सिद्धान्त के आधार पर, संकुल आयन की ज्यामिति एवं चुम्बकीय प्रकृति लिखिए।
उत्तर:
(a) K3[Fe(C2O4)3] संकुल का IUPAC नाम पोटैशियम ट्राइआक्सैलेटो फेरेट (III) है।
(b) संयोजकता बन्ध सिद्धान्त के आधार पर [NiC14]2- संकुल आयन में sp3 संकरण होता है अत: इसकी ज्यामिति चतुष्फलकीय होती है तथा N22+ में 3d कसकों में दो अयुग्मित इलेक्ट्रान उपस्थिति होने के कारण अनुचुम्बकीय होता है। Ni2+ में 3d कक्षकों में दो अयुग्मित इलेक्ट्रान उपस्थित होने के कारण अनुचुम्बकीय होता है।

प्रश्न 3.
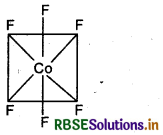
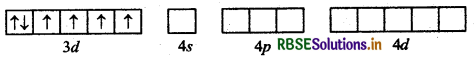
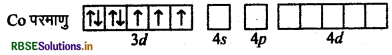
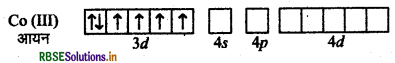
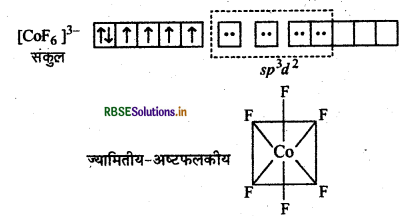
संयोजकता बन्ध सिद्धान्त के आधार पर संकुल (COF6)3- की ऑक्सीकरण अवस्था, संस्करण, ज्यामिति एवं चुम्बकीय प्रकृति समझाइये।
उत्तर:
संकुल - [COF6]3-
कोबाल्ट [Z = 27] का बाह्य इलेक्ट्रॉनिक विन्यास 3d7 4s2 है।
CO की ऑक्सीकरण अवस्था
⇒ x + 6 (-1) = -3
= x = -3 + 6
= x = +3
अत: CO की ऑक्सीकरण अवस्था + 3 है।
F- के दुर्बल लिगैण्ड क्षेत्र के कारण CO3+ के 3d कक्षकों में इलेक्ट्रॉनों का युग्मन नहीं हो पाता है।
इसलिए CO3+ की sp3d2 संकरित अवस्था होगी।
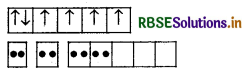
CO परमाणु
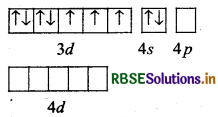
CO (III) आयन
[COF6]3- संकुल
ज्यामितीय-अष्टफलकीय
प्रश्न 4.
लिगैण्ड क्या है? दो उदाहरण भी दीजिए।
उत्तर:
वह आण्विक अथवा रासायनिक स्पीशीज जो संकर यौगिक में केन्द्रीय धातु परमाणु अथवा आयन से स्थायी रूप से जुड़ी होती है, लिगैण्ड कहलाती है।
उदाहरणार्थ: K4 [ Fe(CN)6] में CN- आयन लिगैण्ड है क्योंकि यह संकर में केन्द्रीय Fe2+ आयन से सीधे जुड़ा है। [Cu(NH3)4] 2+ एक अन्य संकर आयन है जिसमें Cu2+ आयन चार NH3 लिगैण्ड से जुड़ा हुआ है।
प्रश्न 5.
IUPAC नियमों का प्रयोग करते हुए निम्न के नाम लिखिए।
(i) [CU(NH3)4]SO4
(ii) [Cr(Cl)H2O)5]Cl
(iii) [CO(CO3(NH3)5]Cl
(iv) K3[Fe(CN)5NO] 2H2O
(V) [Pt(NH3)6]Cl4
(vi) K2[Ni(CN)4]
(vii) K3 [Cr(C2O4)3]
(viii) [CO(NH3)4]Cl(SO4)
(ix) Ca2 [Fe(CN)6]
उत्तर:
(i) टेट्राऐम्मीन कॉपर (II) सल्फेट
(ii) पेन्टा ऐक्चा क्लोरिडो क्रोमियम (III ) क्लोराइड
(iii) पेन्टाऐम्मीन कार्बोनेटो कोबाल्ट (III) क्लोराइड
(iv) पोटैशियम पेन्टसायनोनाइट्रोसिलफॅरेट (II) डाइहाइड्रेट
(v) हेक्साऐम्मीन प्लेटिनम (IV) क्लोराइड
(vi) पोटैशियम टेट्रासायनोंनिकिलेट (II)
(vii) पोटैशियम ट्राइ (ऑक्सैलेटो) क्रोमेट (III)
(viii) टेट्राऐम्मीन क्लोराइडो कोबाल्ट (III) सल्फेट
(ix) कैल्सियम हेक्सा सायनोफैरेट (II)
प्रश्न 6.
(a) यद्यपि (NiCl4]2- और [Ni(CO)4) दोनों में sp3 संकरण होता है फिर भी [NICl4]2- अनुचुम्बकीय है और [Ni(CO)4] प्रतिचुम्बकीय है। कारण दीजिए। (NI का परमाणु क्रमांक = 28)
(b) क्रिस्टल क्षेत्र सिद्धान्त के आधार पर d5 का इलेक्ट्रॉनिक विन्यास लिखिए जबकि
(i) ∆0 < P और,
(ii) ∆g > P
उत्तर:
(a) Ni का परमाणु क्रमांक = 28
इलेक्ट्रॉनिक विन्यास = 3d8 4s2
[NiCl4]2 में Ni की ऑक्सीकरण अवस्था +2 है।
∴ Ni (II) का उत्तेजित अवस्था में इलेक्ट्रॉनिक विन्यास 3d8 4s0 है।
d-कक्षक में दो अयुग्मित इलेक्ट्रॉन होने के कारण अनुचुम्बकीय है। जबकि [Ni(CO)4] में Ni की ऑक्सीकरण अवस्था शून्य (0) है। Ni (0) आद्य अवस्था
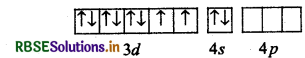
Ni(0) : उत्तेजित अवस्था
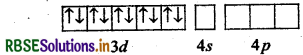
CO एक प्रबल क्षेत्र लिगैण्ड है अत: यह इलेक्ट्रॉनों का युग्मन करता है।
Ni(CO)4]:
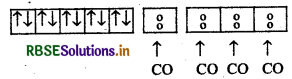
अत: d कक्षक में अयुग्मित इलेक्ट्रॉन न होने के कारण प्रतिचुम्बकीय
(b) का इलेक्ट्रॉन विन्यास
(i) ∆0 < P हो तो
d5 का इलेक्ट्रॉनिक विन्यास t2g3 eg2
(ii) ∆0 > P हो तो
d5 का इलेक्ट्रॉनिक विन्यास t2g5 eg0
प्रश्न 7.
(a) संकुल [CO(NH3)5 Cl] SO4 किस प्रकार की समावयवता प्रदर्शित करता है?
(b) संकुल [COF6]3- में संकरण और अयुग्मित इलेक्ट्रॉनों की संख्या लिखिए। (CO का परमाणु क्रमांक 27)
उत्तर:
(a) संकुल [CO (NH3)5 Cl] SO4 आयनन समावयवता प्रदर्शित करता है।
[CO(NH3)5 SO4]Cl तथा [CO(NH3)5Cl]SO4
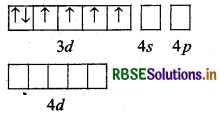
(b) [COF6]3- यहाँ कोबाल्ट का परमाणु क्रमांक 27 है, तथा इलेक्ट्रॉनिक विन्यास 3d7 4s2 है। यहाँ पर कोबाल्ट की ऑक्सीकरण संख्या + 3 है।
CO (27) आद्य अवस्था
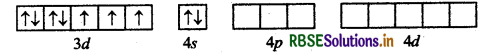
CO (III) आद्य अवस्था
CO (III): उत्तेजित अवस्था
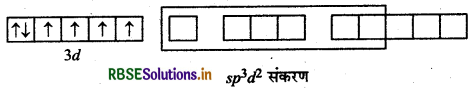
संकरण = sp3d
अयुग्मित इलेक्ट्रॉनों की संख्या = 4

प्रश्न 8.
IUPAC मानदण्डों का उपयोग करते हुए निम्नलिखित के सूत्र लिखिए
(i) हेक्साऐम्मीनकोबाल्ट (III) सल्फेट
(ii) पोटैशियम दाइऑक्सैलेटोक्रोमेट (III)
उत्तर:
(i) [CO(NH3)6]SO4,
(ii) K3[Cr(C2O4)3]।
प्रश्न 9.
कार्बोनिल संकुल में सह क्रियाशीलता आबंधन अन्योन्य क्रिया की संरचना बनाइए।
उत्तर:
धातु कार्बोनिल संकुल में सह क्रियाशीलता आबंधन अन्योन्य क्रिया
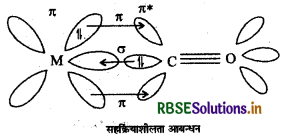
प्रश्न 10.
निम्न में से होमोलेप्टिक एवं हेटरोलेप्टिक संकुल वाले यौगिकों को अलग-अलग कीजिए।
(i) K4[F3(CN)6]
(ii) K2[Zn(OH)4]
(iii) [CO(NH3)5(CO3)]Cl
(iv) [Pt(NH3)2(NO2)Cl]
उत्तर:
(i) K4[F3(CN)6]- होमोलेप्टिक
(ii) K2[Zn(OH)4] = होमोलेप्टिक
(iii) [CO(NH3)5(CO3)]Cl = हेटरोलेप्टिक
(iv) [Pt(NH3)2(NO2)Cl] = हेटरोलेप्टिक
प्रश्न 11.
[Ti(H2O)6]3+ संकुल के बैंगनी रंग की व्याख्या क्रिस्टल क्षेत्र सिद्धान्त के आधार पर कीजिए।
उत्तर:
[Ti(H2O)6]3+ संकुल में धातु परमाणु Ti छ: लिगैण्डों से घिरा हुआ है, अत: यह एक अष्टफलकीय संकुल है। धातु आयन का इलेक्ट्रॉनिक विन्यास है।
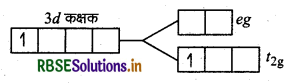
d-कक्षक का एक इलेक्ट्रॉन निम्नतम ऊर्जा अवस्था t2g में है। यह हरे पीले रंग के प्रकाश की आवृत्ति का अवशोषण करके उच्च ऊर्जा अवस्था में चला जाता है। इस कारण संकुल बैंगनी रंग का दिखाई देता है। गर्म करने पर लिगैण्ड जल का अणु बाहर निकल जाते है और यह रंगहीन हो जाता है। क्योंकि लिगैण्ड की अनुपस्थिति में क्रिस्टल क्षेत्र विपाटन नहीं होता है।
प्रश्न 12.
(a) Cr(H2O)4Br2]Cl के आयनन समावयव का सूत्र दीजिये।
(b) VBT के आधार पर [(Ni(CN)4]2-आयन निम्मचक्रण संकुल यौगिक बनाता है। समझाइये।
उत्तर:
(a) Cr(H2O)4Br2]Cl का आयनन समावयव होगा: [Cr(H2O)4BrCI]Br
(b) [Ni(CN4)]2- में Ni का ऑक्सीकरण अंक = + 2 एवं उप सहसंयोजन संख्या = 4 है।
Ni+2 का विन्यास = [Ar]3d8 4s0 4p0
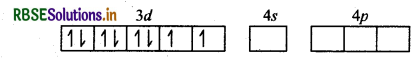
VBT के अनुसार CN- एक प्रबल क्षेत्र लिगेण्ड है जो Ni2+ आयन के अयुग्मित व-इलेक्ट्रॉनों का युग्मन कर देता है एवं एक d-कक्षक खाली हो जाती है।

अत: यह निम्न चक्रण संकुल यौगिक बनता है। संकुल में अयुग्मित इलेक्ट्रॉन नहीं होने के कारण यह प्रतिचुम्बकीय व्यवहार प्रदर्शित करता है।
प्रश्न 13.
उभयदंती लिगैण्ड का एक उदाहरण देकर बताइये कि यह उभयदंती क्यों कहलाता है?
उत्तर:
वह लिगैण्ड जिसमें दो प्रकार के दाता परमाणु उपस्थित हों परन्तु एक समय में केवल एक ही दाता परमाणु केन्द्रीय धातु परमाणु से उपसहसंयोजक बन्ध से बन्धित हो, उभयदन्ती लिगैण्ड कहलाता है।
M ← N = N
सायनाइड लिगैण्ड जिसमें C दाता परमाणु है।
M ← N \(\overline{\bar{\rightarrow}}\) C
आइसो सायनाइड लिगैण्ड जिसमें N दाता परमाणु है।

प्रश्न 14.
(i) निम्नलिखित यौगिकों में केन्द्रीय घातु आयनों की उपसहसंयोजन संख्या ज्ञात कीजिए।
(1) [Cr(NH3)4]SO4
(2) K[Au(CN)2]
(3) [Cr(en)3]3+
(4) [CO(EDTA)-1
(5) [Cr(ox) (dien) Cl]
उत्तर:
- [Cr(NH3)4]SO4 , में Cr की उपसहसंयोजन संख्या 4 है।
- K[Au(CN)2] में Au की उपसहसंयोजन संख्या 2 है।
- [Cr(en)3]3+ में Cr की उपसहसंयोजन संख्या 6 है।
- [CO(EDTA)-1 में CO की उपसहसंयोजन संख्या 6 है।
- [Cr(ox) (dien) Cl] में Cr की उपसहसंयोजन संख्या 6 है।
प्रश्न 15.
प्रत्येक का एक उदाहरण देकर समझाइये
(i) होमोलेप्टिक संकुल
(ii) हेटरोलेप्टिक संकुल
(iii) किलेट लिगैण्ड
(iv) कैंसर उपचार में प्रयुक्त संकुल।
उत्तर:
(i) होमोलेप्टिक संकुल (Homoleptic Complex): ऐसे संकुल जिनमें धातु परमाणु केवल एक प्रकार के दाता समूह से जुड़े रहते हैं। होमोलेप्टिक संकुल कहलाते हैं। उदाहरण: [CO(NH3)6]3+
(ii) हेटूोलेप्टिक संकुल (Heteroleptic Complex): ऐसे संकुल जिनमें धातु परमाणु एक से अधिक प्रकार के दाता समूहों से जुड़े रहते हैं, हेट्रोलेप्टिक संकुल कहलाते हैं। उदाहरण: [CO(NH3)4Cl2]+
(iii) कीलेट लिगैण्ड (Chelate Ligand): जब एक द्विदंतुक अथवा बहुदंतुक धातु परमाणु/आयन से अपने दो या दो से अधिक दाता परमाणुओं का प्रयोग उपसहसंयोजक बन्ध के किये करता है तो एक वलय प्राप्त होती है जिसे कीलेट वलय और लिगैण्ड को कोलेट लिगैण्ड कहते हैं।
उदाहरण: एथिलीन डाइएमीन (en), ऑक्सलेटो आयन (ox) आदि।
(iv) कैंसर उपचार में प्रयुक्त संकुल: [Pt(NH3)2]Cl2 संकुल यौगिक को समपस-प्लैटिन (Cis-platin) कहते हैं। यह एंटी ट्यूमर कर्मक के रूप में कैंसर के उपचार में काम आता है।
प्रश्न 16.
संकुल यौगिक K3[Fe(C2O4)3] में केन्द्रीय धातु परमाणु की ऑक्सीकरण संख्या एवं उपसहसंयोजन संख्या लिखिए।
उत्तर:
K3[Fe(C2O4)3] में Fe की ऑक्सीकरण अवस्था:
K3[Fe(C2O4)3] + 3K+ → [Fe(C2O4)3]3-
Fe का ऑक्सीकरण अंक x मान लेते हैं
x + 3(-2) = -3
x - 6 = -3
x = +6 - 3 = +3
उपसहसंयोजन संख्या = 6 क्योंकि यहाँ तीन द्विदंतुक लिगैण्ड C2O42- हैं।

प्रश्न 17.
(i) वर्नर सिद्धान्त द्वारा प्रस्ताविक धातु आयनों की प्राथमिक एवं द्वितीयक संयोजकता की परिभाषा लिखिये।।
(ii) ICO(NH3)6]Cl3 में CO की प्राथमिक एवं द्वितीयक संयोजकता लिखिये।
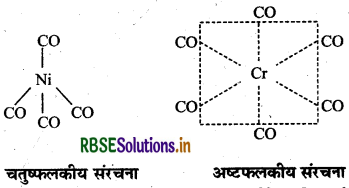
(iii) NI(CO)4 एवं Cr(CO)6 का संरचनात्मक सूत्र लिखिये।
उत्तर:
(वर्नर सिद्धान्त के अनुसार प्राथमिक संयोजकता आयनिक होती है और ऋणायनों में सन्तुष्ट रहती है जबकि द्वितीयक संयोजकता अतः आयनिक होती है। यह उदासीन अणुओं या ऋणायनों में सन्तुष्ट रहती है। यह उपसह संयोजन संख्या के बराबर होती है। इसे बड़े कोष्ठक में रखकर प्रदर्शित करते है जबकि प्राथमिक संयोजकता कोष्ठक से बाहर होती है। द्वितीयक संयोजकता का मान धातु के लिये निश्चित होता है।
(ii) [CO(NH3)6]Cl3 में प्राथमिक संयोजकता 3 है एवं द्वितीयक संयोजकता 6 है।
(iii) संरचनात्मक सूत्र
प्रश्न 18.
IUPAC नियमों का प्रयोग करते हुए निम्न के नाम लिखिए।
(i) K3[CO(C2O4)3]
(ii) [Ni(CO)4]
(iii) [Zn(NH3)3]Cl2
(iv) k4[Fe(CN)6]
(v) K3[Al(C2O4)3]
(vi) K[PtBr3(NH3)]
(vii) Ag[(NH3)2] [Ag(CN)2]
(viii) K2[Hgl4]
(ix) Na[Ag(CN)2]
उत्तर:
(i) पोटैशियम ट्राइ(ऑक्सैलेटो)कोबाल्ट (III)
(ii) टेट्राकार्बोनिलनिकिल (0)
(iii) टेट्राऐम्मीन जिंक (II) क्लोराइड
(iv) पोटैशियम हेक्सासायनोफैरेट (II)
(v) पोटैशियम ट्राइऑक्सेलेटोऐलुमिनेट (III)
(vi) पोटैशियम ऐम्मीनट्राइब्रोमाइडो प्लैटिनेट (III)
(vii) डाइऐम्मीन सिल्वर (1) डाइसायनो अर्जेन्टेट (1)
(viii) पोटैशियम टेट्रा आयोडो मरक्यूरेट (II)
(ix) सोडियम डाइ सायनो अर्जेन्टेट (1)
प्रश्न 19.
आवेश के आधार पर लिगण्डों को किस प्रकार वर्गीकृत किया जा सकता है? उदाहरण देते हुए समझाइए।
उत्तर:
आवेश के आधार पर लिगेण्ड निम्नलिखित तीन प्रकार के होते हैं।
- धनात्मक लिगण्ड-धनावश वाले लिगेण्ड धनात्मक लिगेण्ड कहलाते हैं। ये संकर में बहुत कम पाये जाते हैं। उदाहरणार्थ: NO+, NH+4, NH+3
- ऋणात्मक लिगेण्ड-ऋणावेश वाले लिगेण्ड ऋणात्मक लिगेण्ड कहलाते हैं। ये ऋणात्मक स्पीशीज होती हैं जिनमें एक या अधिक इलेक्ट्रॉनों के एकाकी युग्म पाये जाते हैं। उदाहरणार्थ: F- Cl-, Br-, CN- आदि।
- उदासीन लिगण्ड-ऐसे लिगण्डों पर कोई आवेश नहीं होती ह और ये प्रायः आण्विक स्पीशीज होती हैं जिनमें एक या एक से अधिक इलेक्ट्रॉनों के एकाकी युग्म उपस्थित रहते हैं। उदाहरणार्थ: H2O, NH3, CO, NO आदि।
प्रश्न 20.
निम्नलिखित संकुलों में केन्द्रीय धातु परमाणु की ऑक्सीकरण अवस्था ज्ञात कीजिए।
(i) K3[Fe(C2O4)3]
(ii) [Fe(CN)6]3-
उत्तर:
(i) K3[Fe(C2O4)3] → 3K+ [Fe(C2O4)3]3-
संकुल आयन [Fe(C2O4)3]3- में Fe की ऑक्सीकरण अवस्था x मान लेते हैं
x + 3(-2) = -3
x - 6 = -3
x = + 6 - 3
x = +3
अत: इस संकुल में Fe की ऑक्सीकरण अवस्था + 3 है।
(ii) [Fe(CN6)]3-
x + 6(-1) = -3
x = 6 - 3
x = +3
इसमें Fe की ऑक्सीकरण अवस्था + 3 है।
प्रश्न 21.
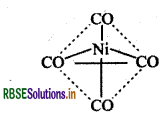
sp3, dsp2 कक्षक प्रयुक्त करने वाले संकुलों की ज्यामितीय आकृति क्या होगी, प्रत्येक का एक उदाहरण दीजिए?
उत्तर:
sp3 कक्षक प्रयुक्त करने वाले संकुलों की ज्यामिति चतुष्फलकीय होती है।
उदाहरण:
[Ni(CO)4]:
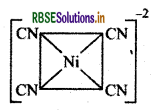
dsp2 कक्षक प्रयुक्त करने वाले संकुलों की ज्यामिति वर्ग समतलीय होती है
उदाहरण: [Ni(CN)4]2-
प्रश्न 22.
निम्नलिखित संकुलों की ऑक्सीकरण संख्या ज्ञात कीजिए।
(i) [Fe(EDTA)]-
(ii) [Pd(H2O)2(ONO)2I2]
(iii) [CO(NH3)5Cl]2+
(iv) K4[Fe(CN)6]
उत्तर:
(i) [Fe(EDTA)]-
x + (-4) x 1
x = 3 - 1
∴ x = +3 Fe की आँ. सं. = + 3
(ii) [Pd(H2O)2(ONO)2I2]
x + 2 x 0 + 2 x (-1) + 2 x (-1) = 0
x + (-2) + (-2) =0
x - 4 = 0
∴ x = +4 Pd की ऑ. सं. = + 4
(iii) [CO(NH3)5Cl]2+
x + 5 x 0 + (-1) = +2
∴ x = +3
CO की ऑ. सं. = +3
(iv) K4[Fe(CN)6]
4 x (+1) + x + 6 x (-1)= 0
+4 + x - 6 = 0
∴ x = +2 Fe की ऑ. संख्या = + 2

प्रश्न 23.
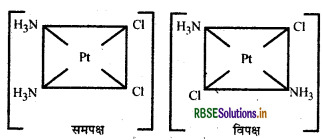
निम्न के ज्यामितीय समावयव बनाइए:
(i) [Pt(NH3)2Cl2]
(ii) [CO(OX)2 Br2]3-
उत्तर:
(i) [Pt(NH3)2Cl2]
(ii) [CO(OX)2 Br2]3-
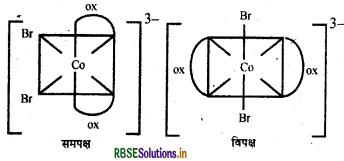
प्रश्न 24.
द्विक लवण एवं संकुल में अन्तर समझाते हुए प्रत्येक का एक-एक उदाहरण दीजिये।
उत्तर:
|
द्विक लवण |
संकुल यौगिक |
|
1. इसका अस्तित्व सिर्फ ठोस अवस्था में होता है। |
1. ये ठोस एवं विलयन दोनों अवस्थाओं में होते है। |
|
2. इनका निर्माण दो साधारण लवणों के सममोलर अनुपात में मिलाने से होता है। |
2. इनका निर्माण दो साधारण लवणों को सममोलर अनुपात में मिलाने से हो भी सकता है और नहीं भी। |
|
3. ये जलीय विलयन में दो धनायान एवं एक ऋणायन देते है। |
3. ये दो आयनों में बदलते है। |
|
4. इनमें धातु आयन अपनी सामान्य संयोजकता प्रदर्शित करते है। |
4. इनमें धातु की संयोजकता भिन्न होती है। |
|
5. इनके गुण उपस्थित संघटक आयनों के गुण होते है। उदा KCl MgCl2 6H2O K2SO4 Al2(SO4)3 24H2O |
5. जलीय आयनों के गुण उपस्थित संघटकों के गुणों में भिन्न होते है। उदा K4[Fe(CN)6] [CO(NH3)6]Cl3 |
प्रश्न 25.
निम्न में से धनायनिक, ऋणायनिक तथा उदासीन संकर यौगिकों को छाँटिए।
K2[HgI4], [CO(NH3)6]Cl3, K4[Fe(CN)6], [Ni(CO)4], [Pt(NH3)Cl2], [Fe(H2O)6]Cl3
उत्तर:
धनायनिक संकर यौगिक = [CO(NH3)6]Cl3, [Fe(H2O)6]Cl3
ऋणायनिक संकर यौगिक = K2[HgI4], K4[Fe(CN)6]
उदासीन संकर यौगिक = [Ni(CO)4], [Pt(NH3)Cl2]
प्रश्न 26.
क्रिस्टल क्षेत्र सिद्धान्त के अनुसार बताइए कि [Fe2(H2O)6]3+ प्रबल अनुचुम्बकीय संकुल है जबकि [Fe(CN)6]3- दुर्बल अनुचुम्बकीय संकुल है।
उत्तर:
[Fe2(H2O)6]3+ इस संकुल में H2O एक दुर्बल क्षेत्र लिगैण्ड है। इस कारण [Fe2(H2O)6]3+ एक उच्च चक्रण संकुल होगा। दुर्बल क्षेत्र लिगैण्ड की उपस्थिति के कारण CFSE का मान युग्मन ऊर्जा (P) से कम होगा अर्थात् CFSE < P (युग्मन ऊर्जा) होगी। [Fe2(H2O)6]3+ में Fe की ऑक्सीकरण संख्या (+ 3) है, इस कारण इसका विन्यास 305 होगा। अत:
d5 विन्यास के लिए अष्टफलकीय संकुल में,
(t2g) (eg)2 अर्थात्
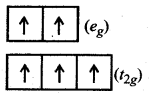
इसका अर्थ है कि [Fe2(H2O)6]3+ में अयुग्मित इलेक्ट्रॉनों की संख्या 5है।
इस कारण [Fe2(H2O)6]3+ एक प्रबल अनुचुम्बकत्व वाला संकुल है।
[Fe(CN)6]3- इस संकुल में CN एक प्रबल क्षेत्र लिगैण्ड है। इस कारण [Fe(CN)6]3- एक निम्न चक्रण संकुल होगा। प्रबल क्षेत्र लिगैण्ड की उपस्थिति के कारण CFSE का मान युग्मन ऊर्जा (P) की तुलना में अधिक होगा अर्थात् CFSE > P (युग्मन ऊर्जा) होगी। [Fe(CN)6]3- में Fe की ऑक्सीकरण संख्या (+ 3) है, इस कारण इसका विन्यास 34 होगा। अत:
विन्यास के लिए, अष्टफलकीय संकुल में d5
(t2g)5 (eg)0 अर्थात्
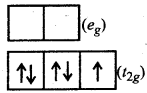
इसका अर्थ यह है कि [Fe(CN)6]3- में अयुग्मित इलेक्ट्रॉनों की संख्या केवल एक है। इस कारण [Fe(CN)6]3- संकुल एक दुर्बल अनुचुम्बकीय संकुल है।
प्रश्न 27.
[Ni(CN)4]2- प्रतिचुम्बकीय है जबकि [NICl4]2- अनुचुम्बकीय है, क्यों?
उत्तर:
[Ni(CN)4]2- में Ni की ऑक्सीकरण संख्या (+2) है।
Ni (II) आद्य अवस्था
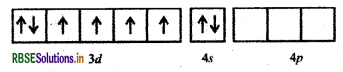
Ni (II) आद्य अवस्था
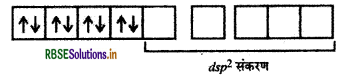
CN- एक प्रबल क्षेत्र लिगैण्ड है अतः यह इलेक्ट्रॉनों का युग्मन करता है।
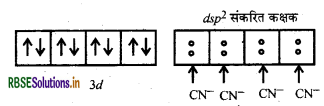
[Ni(CN)4]2- में सभी इलेक्ट्रॉन युग्मित हैं अतः यहाँ पर इसकी प्रकृति प्रतिचुम्बकीय है।
[NiCl4]2- में Ni की ऑक्सीकरण संख्या +2 है।
Ni (II) आद्य अवस्था
Cl- एक दुर्बल क्षेत्र लिगैण्ड है अतः यह इलेक्ट्रॉनों का युग्मन नहीं करता है।
[NiCl4]2-
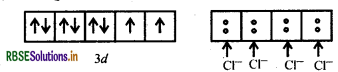
यहाँ दो अयुग्मित इलेक्ट्रॉनों की उपस्थिति के कारण यह संकुल अनुचुम्बकीय है।
प्रश्न 28.
संयोजकता बन्ध सिद्धान्त के अनुसार निम्न उपसहसंयोजन स्पीशीज में बन्ध की प्रकृति बताइए।
(i) [Fe(CN)6]4-
(ii) [FeF6]3-
(iii) [CO(C2O4)3]3-
(iv) [COF6]3-
उत्तर:
(i) d2sp3, अष्टफलकीय, प्रतिचुम्बकीय
(ii) sp3d2, अष्टफलकीय, अनुचुम्बकीय
(iii) d2sp3, अष्टफलकीय, प्रतिचुम्बकीय
(iv) sp3d2, अष्टफलकीय, अनुचुम्बकीय चुम्बकाय है।

प्रश्न 29.
निम्नलिखित लिगैण्डों के नाम लिखिए।
OH-, H2O, NH3, NH2, CH2, NH2 - CH2 NH2 CH3COO-, CN-, NCS-
उत्तर:
OH- ⇒ हाइड्रॉक्सो
H2O ⇒ एक्वा
NH3 ⇒ ऐम्मीन
NH2 ⇒ एमिडो
CH2NH2 - CH2NH2 ⇒ एथीलिन डाइएमीन
CH3COO - ⇒ एसीटेटो
CN- ⇒ सायनो
NCS- ⇒ थायोसायनेटो
प्रश्न 30.
(i) बन्धनी तथा आयनन समावयवता को परिभाषित कीजिए।
(ii) [(CO(NH3)6] [(Cr(CN)6] तथा (Cr(NH3)6 [(CO(CN)6] किस प्रकार की समावयवता दर्शाते है नाम लिखिए।
(iii) [Ti(H2O)6]3+ में इलेक्ट्रॉन का संक्रमण दर्शाने वाला चित्र बनाइए।
(iv) [Ti(H2O)6]3+ में इलेक्ट्रॉन के संक्रमण से धातु संकुल पर क्या प्रभाव पड़ता है।
उत्तर:
(i) बन्धनी या बन्धन समावयवता: ऐसे उपसहसंयोजक यौगिक, जिनमें एक दन्तुक उभयदन्ती लिगैण्ड हों अर्थात् वे लिगैण्ड जो केन्द्रीय धातु परमाणु/आयन से दो दाता परमाणुओं द्वारा उपसहसंयोजक बन्ध को बना सकें, बन्धनी समावयवी (linkage isomers) कहलाते हैं तथा यह परिघटना बन्धनी समावयवता (linkage isomerism) कहलाती है।
बन्धनी समावयता: ऐसे उपसहसंयोजक यौगिक, जिनमें एक दन्तुक उभयदन्ती लिगैण्ड हों अर्थात् वे लिगैण्ड जो केन्द्रीय धातु परमाणु/आयन से दो दाता परमाणुओं द्वार उपसहसंयोजक बन्ध को बना सकें, बन्धनी समावयवी (linkage isomers) कहलाते हैं तथा यह परिघटना बन्धनी समावयवता (linkage isomerism) कहलाती है। उदाहरण :

आयनन समावयता: ऐसे उपसहसंयोजक यौगिक जिनका अणु सूत्र समान होता है परन्तु जलीय विलयन में पृथक्-पृथक् आयन देते हैं। आयनन समावयवी कहलाते हैं।
उदाहरण:
[CO(NH)3)5 Br]SO4(aq) तथा [CO(NH3)5 SO4]Br
(ii) [(CO(NH3)6] [Cr(CN)6] तथा [Cr(NH3)6] [(CO(CN)6] उपसहसंयोजन समानयवता प्रदर्शित करते हैं।
(iii) [Ti(H2O)6]3+ में Ti+3 आयन का 3d1 4s0 विन्यास होता है जिसमें -4 संक्रमण के कारण एक इलेक्ट्रॉन t2g से eg में (t2g1 eg0 → t2g0 eg1) चला जाता है।
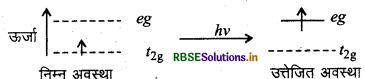
(iv) [Ti(H2O)6]+3 संकुल हरे पीले रंग के प्रकाश की आवृत्ति का अवशोषण करके उत्तेजित अवस्था में चला जाता है और संकल बैंगनी रंग का दिखाई देता है।
प्रश्न 31.
वर्नर सिद्धान्त द्वारा प्रस्तावित धातु आयनो की प्राथमिक तथा द्वित्तीयक सयोजकता की परिभाषा लिखिए।
उत्तर:
प्राथमिक संयोजकता (Primary or Principal Valency): प्राथमिक संयोजकताएँ सामान्य रूप से आयनिक होती हैं। यह सदैव ऋणात्मक आयनों द्वारा ही सन्तुष्ट होती हैं। संकुल यौगिकों में इसके द्वारा बने बन्ध को बिन्दुकित रेखा (dotted line) द्वारा दशति हैं। इस बन्धन के टूटने से आयन बनते हैं। आजकल प्राथमिक संयोजकता का तात्पर्य ऑक्सीकरण संख्या से है।
द्वितीयक संयोजकता (Secondary or Auxiliary Valency): द्वितीयक संयोजकताएँ अन-आयनीय होती हैं। ये उदासीन अणुओं अथवा ऋणात्मक आयनों द्वारा सन्तुष्ट होती हैं। द्वितीयक संयोजकता उपसहसंयोजन संख्या के बराबर होती है। इसका मान किसी धातु के लिए निश्चित होता है। द्वितीयक संयोजकता द्वारा बने बन्ध को ठोस रेखा (solid line) द्वारा प्रदर्शित करते हैं। इस बन्ध के टूटने पर आयन नहीं बनते हैं।
निबन्धात्मक प्रश्न:
प्रश्न 1.
[Ni(CN)4]2- आयन का स्वच्छ आकृति चित्र एवं केन्द्रीय परमाणु की सकरण अवस्था को समझाइए।
उत्तर:
[Ni(CN)4]2- यहाँ निकिल का परमाणु क्रमांक 28 है तथा इलेक्ट्रॉनिक विन्यास 3d84s2 है। यहाँ इस संकुल में निकिल की ऑक्सीकरण संख्या + 2 है।
Ni (28) : आद्य अवस्था
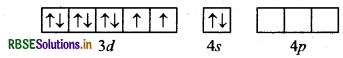
Ni (II) : आद्य अवस्था
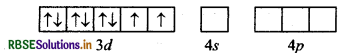
Ni(II) : उत्तेजित अवस्था
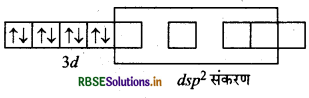
(जब लिगैण्ड धातु के साथ उपसहसंयोजक बन्ध बनाने के लिए आते हैं)।
[Ni(CN)4]2-
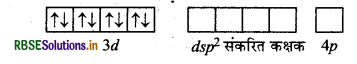
[Ni(CN)4]2-
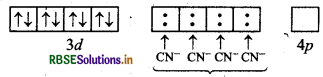
यहाँ चार CN- आयन से चार एकाकी इलेक्ट्रॉन युग्म प्रदान होने पर चार उपसहसंयोजक बन्ध बनते हैं।
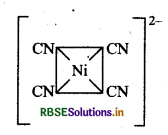
आकृति: वर्ग समतलीय।
रंग: यहाँ अयुग्मित इलेक्ट्रॉनों की अनुपस्थिति के कारण यह रंगहीन संकुल है।
चुम्बकीय गुण: यह एक प्रतिचुम्बकीय संकुल है; क्योंकि यहाँ कोई भी अयुग्मित इलेक्ट्रॉन नहीं है।
नोट: CN के प्रबल लिगैण्ड क्षेत्र के कारण यहाँ Ni2+ के 3d-कक्षकों में इलेक्ट्रॉनों का युग्मन हो जाता है तथा 3d का एक कक्षकं संकरण के लिए रिक्त हो जाता है। इस कारण यह एक आन्तरिक कक्षक (निम्न चक्रण) संकुल है।

प्रश्न 2.
संयोजकता आबन्ध सिद्धान्त (VBT) की मुख्य अवधारणाएँ क्या हैं? निकिल कार्बोनिल आयन की संरचना तथा चुम्बकीय व्यवहार को इस सिद्धान्त के आधार पर समझाइए।
उत्तर:
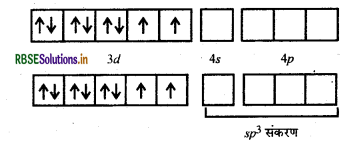
[Ni(CO)4]- यहाँ निकिल का परमाणु क्रमांक 28 है तथा इलेक्ट्रॉनिक विन्यास 3d84s2 है। यहाँ इस संकुल में निकिल की ऑक्सीकरण संख्या शून्य है।
Ni (28): आद्य अवस्था
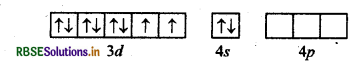
Ni (0) : आद्य अवस्था
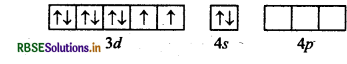
Ni (0) : उत्तेजित अवस्था,
(जब लिगैण्ड धातु के साथ उपसहसंयोजक बन्ध बनाने के लिए आते हैं)।
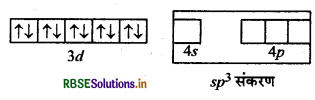
[Ni(CO)4]:
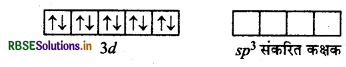
[Ni(CO)4]:
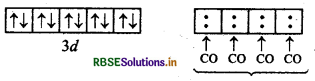
यहाँ चार CO अणु से चार एकाकी इलेक्ट्रॉन युग्म प्रदान होने पर चार उपसहसंयोजक बन्ध बनते हैं।
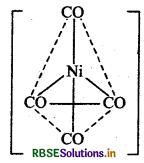
आकृति: चतुष्फलकीय
रंग: रंगहीन, क्योंकि अयुग्मित इलेक्ट्रॉन अनुपस्थित होते हैं।
चुम्बकीय गुण: प्रतिचुम्बकीय, क्योंकि अयुग्मित इलेक्ट्रॉन अनुपस्थित होते हैं।
नोट: CO लिगैण्ड के प्रबल लिगैण्ड क्षेत्र के कारण यहाँ Ni के 3d-कक्षों में इलेक्ट्रॉनों का युग्मन हो जाता है तथा 4 के कक्षक संकरण में भाग लेते हैं। यह एक निम्न चक्रण संकुल है।
प्रश्न 3.
क्रिस्टल क्षेत्र सिद्धान्त के आधार पर निम्नलिखित संकुलों में अयुग्मित इलेक्ट्रॉनों की संख्या बताइए तथा इनका विन्यास लिखिए
(i) [FeCl4]- (चतुष्फलकीय)
(ii) [NiCl4]2- (चतुष्फलकीय)
(iii) [Cr(en)3]3+ (अष्टफलकीय)।
उत्तर:
(i) [FeCl4]- इस संकुल में Cl- एक दुर्बल क्षेत्र लिगैण्ड है अत: यह उच्च चक्रण प्रकार का संकुल है। उच्च चक्रण संकुल होने के कारण यहाँ पर CFSE <P (युग्मन ऊर्जा) होगी।
[FeCl4]- में, Fe की ऑक्सीकरण संख्या (+ 3) है इसलिए यह 15 प्रकार का आयन है।
अतः d5 विन्यास के लिए चतुष्फलकीय संकुल में
(eg)2 (t2g) अर्थात् 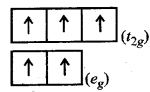
यहाँ कुल 5 अयुग्मित इलेक्ट्रॉन उपस्थित हैं।
(ii) [NiCl4]2- इस संकुल में c एक दुर्बल क्षेत्र लिगैण्ड है। अत: [NiCl4]2- एक उच्च चक्रण संकुल है। उच्च चक्रण संकुल होने के कारण यहाँ पर CFSE < P(युग्मन ऊर्जा) होगी। [NiCl4]2- में Ni की ऑक्सीकरण संख्या +2 है तो यह d प्रकार का आयन है।
अत: d8 विन्यास के लिए चतुष्फलकीय संकुल में
अर्थात्
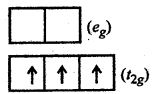
यहाँ कुल 2 अयुग्मित इलेक्ट्रॉन उपस्थित हैं।
(iii) [Cr(en)3]3+ इस संकुल में (en) एक प्रबल क्षेत्र लिगैण्ड है अत: [Cr(en)3]3+ एक निम्न चक्रण संकुल है। निम्न चक्रण संकुल होने के कारण यहाँ पर CFSE > P(युग्मन ऊर्जा) होगी।[Cr(en)3]3+ में cr की ऑक्सीकरण संख्या (+ 3) है तो यह प्रकार का आयन है।
अतः विन्यास के लिए, अष्टफलकीय संकुल में,
अर्थात्
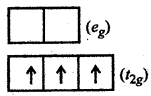
यहाँ [Cr(en)3]3+ संकुल में क्रिस्टल क्षेत्र सिद्धान्त के अनुसार कुल 3 अयुग्मित इलेक्ट्रॉन हैं।

प्रश्न 4.
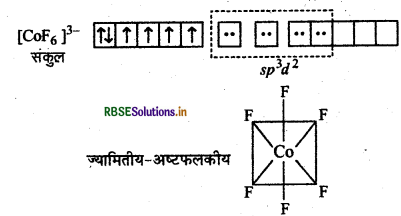
संयोजकता बन्ध सिद्धान्त के आधार पर संकुल [COF6]3- की ऑक्सीकरण अवस्था, संकरण, ज्यामिति एवं चुम्बकीय प्रकृति को समझाइए।
उत्तर:
संकुल [COF6]3-
कोबाल्ट [Z = 27] का बाह्य इलेक्ट्रॉनिक विन्यास 3d74s2 है।
CO की ऑक्सीकरण अवस्था = x + 6(-1) = -3
x = -3 + 6
x = +3
अत: CO की ऑक्सीकरण अवस्था +3 है।
F के दुर्बल लिगैण्ड क्षेत्र के कारण CO3+ के 3d कक्षों में इलेक्ट्रॉनों का युग्मन नहीं हो पाता है। इसलिए CO3+ की sp3d2 संकरित अवस्था होगी।
CO परमाणु
CO (III) आयन
[COF6]3-
प्रश्न 5.
संकर यौगिकों में निम्न में से प्रत्येक को उदाहरण सहित समझाइए
1. आयनन समावयवता तथा
2. हाइड्रेट समावयवता।
अथवा
उपसहसंयोजन यौगिकों की संरचना समावयवता की व्याख्या उचित उदाहरण के साथ कीजिए।
उत्तर:
1. आयनन समावयवता-जब सहसंयोजक यौगिकों के अणुसूत्र समान होते हैं परन्तु वह भिन्न आयनन व्यवहार प्रदर्शित करते हैं तथा विलयन में भिन्न आयन प्रदान करते हैं तो इसे आयनन समावयवता कहते हैं। आयनन समावयवता, उपसहसंयोजन तथा आयनन मण्डल के मध्य समूहों के विनिमय के कारण होती है।
उदाहरणार्थ: CO(NH3)5 (Br)(SO4) सूत्र वाले दो आयनिक समावयवी निम्न है
[COBr(NH3)5]SO4 [CO(SO4)(NH3)5]Br पेन्टाऐम्मीनेब्रोमोकोबाल्ट (III) सल्फेट पेटाऐम्मीनसल्फेट कोबाल्ट (III) (लाल बैंगनी)
2. हाइड्रेट समावयवता: जल के अणु लिगैण्ड की भाँति तथा क्रिस्टलीकरण जल दोनों की भाँति व्यवहार प्रदर्शित कर सकते हैं। जब दो योगिक इस प्रकार की भिन्नता प्रदर्शित करते हैं तो उन्हें हाइड्रेट समावयवी कहते हैं तथा इस घटना को हाइड्रेट समावयवता कहते हैं।
उदाहरणार्थ:
CrCl3 .6H2O सूत्र के निम्नलिखित तीन हाइड्रेट समावयवी ज्ञात है
[Cr(H2O)6]Cl3 हेक्साऐक्ताक्रोमियम (II) क्लोराइड (बैंगनी)
[Cr(H2O)5CI]Cl2.H2O पेन्टाऐक्वाक्लोरिडोक्रोमियम (III) क्लोराइड मोनोहाइड्रेट (नीला - हरा)
[Cr(H2O)4Cl2]CI.2H2O टेट्राऐक्वाडाइक्लोरिडोक्रोमियम (III) क्लोराइड डाइहाइड्रेट (गाढ़ा -हरा )

प्रश्न 6.
ग्नि संकर यौगिकों के सन्दर्भ में ज्यामितीय समावयवता को समझाइए
1. [PECI2(NH3)2],
2. [CO(NH3)2 Cl2] तथा
3. [ Pt (gly)2] अथवा
सिस समावयवता और ट्रांस समावयवता की परिभाषा बताइए।
उत्तर:
जब समान समूह केन्द्रीय धातु परमाणु के एक ही ओर स्थित होते हैं तो उसे सिस समावयवी तथा जब विपरीत और स्थित होते हैं तो उसे ट्रांस समावयवी कहते हैं।
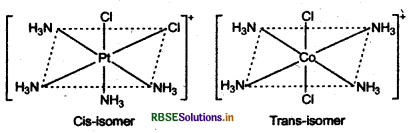
1. [ PtCl2 (NH3)2] के सिस एवं ट्रांस रूप नीचे चित्र में दर्शाए गए
2. [CO(NH3)2 Cl2] के सिस एवं ट्रांस रूप नीचे चित्र में दर्शाए गए है:
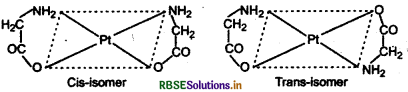
3. [ Pt (gly)2] के सिस एवं ट्रांस रूप नीचे चित्र में दर्शाए गए हैं:
प्रश्न 7.
क्रिस्टल क्षेत्र सिद्धान्त (CFT) को समझाइए। अष्टफलकीय व चतुष्फलकीय संकुल यौगिकों में 4-कक्षकों को विपाटन स्पष्ट कीजिए।
अथवा
अष्टफलकीय क्रिस्टल क्षेत्र में 4-कक्षकों के विपाटन को दशौन हेतु चित्र बनाइए।
उत्तर:
इस सिद्धान्त का प्रतिपादन बेथे (H. Bethe) ने 1929 में किया था। यह सिद्धान्त संकुल यौगिकों के निर्माण तथा उनके चुम्बकीय गुण या स्पेक्ट्रा की सफलतापूर्वक व्याख्या करता है। इस सिद्धान्त के मुख्य अभिगृहीत (Postulates) निम्न हैं:
- किसी संकुल के केन्द्रीय धातु आयन तथा उसे घेरे हुए लिगैण्डों को आवेश बिन्दु (Point charge) माना जाता है।
- केन्द्रीय धातु परमाणु/आयन तथा लिगैण्डों के मध्य बनने वाला बन्ध पूर्णतः वैद्युत संयोजी (electrovalent) या आयनिक (ionic) होता है।
- धातु आयन व लिगैण्ड के मध्य वैद्युत आकर्षण धातु आयन पर धनावेश तथा लिगैण्डों पर उपस्थित ऋणावेशित क्षेत्र के कारण होता है। यदि लिगैण्ड उदासीन जैसे: HO, NH3 हैं तो वे द्विध्रुव (dipole) की भाँति व्यवहार करते हैं। इसमें इन लिगैण्डों का ऋणात्मक सिरा धातु आयन की ओर विन्यासित (oriented) रहता है।
- केन्द्रीय धातु आयन में उपस्थित इलेक्ट्रॉनों एवं लिगैण्ड के इलेक्ट्रॉनों के मध्य प्रतिकर्षण बल (repulsive interaction) भी होता है।
- किसी विलगित गैसीय धातु परमाणु/आयन के पाँचों d-कक्षकों की ऊर्जा का मान बराबर होता है, अर्थात् ये अपभ्रष्ट (degenerate) अवस्था में होते हैं। यह अपभ्रष्ट अवस्था तब तक बनी रहती है जब तक कि धातु परमाणु/आयन के चारों ओर ऋणावेश का एक गोलीयतः सममित क्षेत्र रहता है। परन्तु किसी संकुल में जब यह ऋणावेशित क्षेत्र लिगैण्डों के कारण (या तो ऋणायन या किसी द्विध्रुवीय अणु के ऋणात्मक भाग, जैसे-NH, या H2O होता है तो असममित हो जाता है और d-कक्षकों की अपभ्रष्टता (degeneracy) समाप्त हो जाती है।
- इसके परिणामस्वरूप d-कक्षकों का विपाटन हो जाता है। यह विपाटन (splitting) क्रिस्टल क्षेत्र की प्रकृति पर निर्भर करता है।
- विपाटन के फलस्वरूप समभ्रंश d-कक्षक निम्न दो भागों में टूट जाते हैं।
- t2g कक्षक (इसमें तीन कक्षक dX dYZ dXZ होते हैं)।
- eg कक्षक (इसमें दो कक्षकdx2 - y2 तथा dz2 होते हैं)।
- यहाँ पर वे d-कक्षक जो लिगैण्ड की दिशा में होते हैं उनकी ऊर्जा बढ़ जाती है तथा वेd-कक्षक जो लिगैण्ड की दिशा में नहीं होते हैं उनकी ऊर्जा घट जाती है। यह घटना क्रिस्टल फील्ड विघटन या विभाजन या विपाटन (crystal field splitting) कहलाती है। क्रिस्टल क्षेत्र विपाटन के फलस्वरूप ऊर्जा में जो भी कमी आती है उसे क्रिस्टल क्षेत्र स्थायीकरण ऊर्जा (crystal field splitting energy, CFSE) कहते हैं।
क्रिस्टल क्षेत्र विपाटन संकुल यौगिक की ज्यामिति के अनुसार अलग-अलग प्रकार से होता है।
(क) अष्टफलकीय उपसहसंयोजन समूहों में क्रिस्टल क्षेत्र विपाटन (Crystal Field Splitting in Octahedral Coordination Entities)
किसी अष्टफलकीय उपसहसंयोजन सत्ता में धातु परमाणु/आयन छः लिगैण्डों के द्वारा घिरा रहता है। इस उपसहसंयोजन सत्ता में धातु के
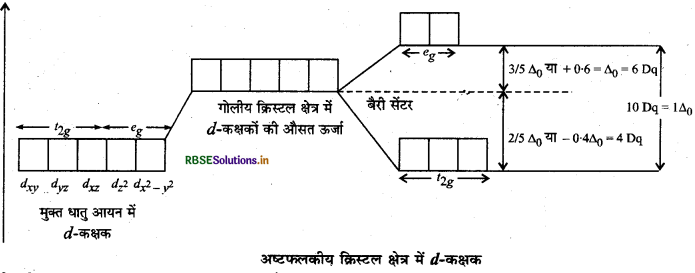
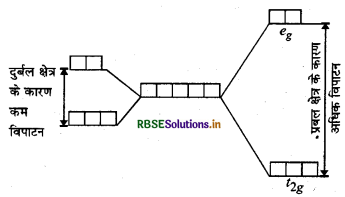
क्रिस्टल क्षेत्र विपाटन, ∆° (crystal field splitting) लिगैण्ड तथा धातु आयनों पर विद्यमान आवेश से उत्पन्न क्षेत्र पर भी निर्भर करता है। यदि लिगैण्ड प्रबल क्षेत्र उत्पन्न करते हैं तो ऐसी स्थिति में विपाटन अधिक होता है और यदि लिगैण्ड दुर्बल क्षेत्र उत्पन्न करते हैं तो ऐसी स्थिति में विपाटन कम होता है।
कक्षकों के इलेक्ट्रॉनों तथा लिगैण्डों के इलेक्ट्रॉनों (या ऋणावेश) के मध्य प्रतिकर्षण उत्पन्न होता है। जब धातु का d-कक्षक लिगैण्ड से दूर न होकर सीधा निर्दिष्ट होता है तो वहाँ पर प्रतिकर्षण अधिक होता है। इस प्रकार dx2- y2 तथा dz2 कक्षक जो कि लिगैण्ड की दिशा वाले अक्षों पर निर्दिष्ट हैं, अधिक प्रतिकर्षण बल को अनुभव करते हैं एवं इस प्रतिकर्षण के कारण उनकी ऊर्जा में वृद्धि हो जाती है। धातु के dxy तथा dyz कक्षक, जो कि अक्षों के मध्य निर्दिष्ट होते हैं, की ऊर्जा गोलीय क्रिस्टल क्षेत्र की औसत ऊर्जा की तुलना में कम हो जाती है।
इस प्रकार अष्टफलकीय संकुल में लिगैण्ड इलेक्ट्रॉन एवं धातु के इलेक्ट्रॉन के मध्य प्रतिकर्षण के कारण d-कक्षकों की अपभ्रष्टता (degeneracy) हट जाती है तथा तीन कम ऊर्जा वाले 12 कक्षक तथा दो उच्च ऊर्जा वाले, कक्षकों के दो समुच्चय बन जाते हैं। अतः समान ऊर्जा वाले कक्षकों का लिगैण्डों की ज्यामिति के कारण दो समुच्चयों में विपाटन क्रिस्टल क्षेत्र विपाटन (crystal field splitting) कहलाता है। यहाँ दो समुच्चयों में ऊर्जा के अन्तर को ∆° [यहाँ अष्टफलकीय (octahedral) को प्रदर्शित करता है) से दर्शाते हैं।

प्रश्न 9.
क्रिस्टल क्षेत्र सिद्धान्त की सहायता से [ Fe(H2O6)]2+ एवं [Fe(CN)6]4- की तुलनात्मक विवेचना कीजिए।
उत्तर:
क्रिस्टल क्षेत्र सिद्धान्त के अनुसार [Fe(H2O)6]+2 एवं [Fe(CN)6]4- दोनों संकुल अष्टफलकीय संकुल है। अष्टफलकीय संकुलों में d कक्षकों का लिगैण्डों की उपस्थिति में विपाटन। बढ़ जाती है।
t2g व eg में होता है। जिसमें t2g की ऊर्जा घट जाती है व की ऊर्जा eg यहाँ पर CN - एक प्रबल लिगैण्ड है जबकि H2O दुर्बल लिगैण्ड है इस कारण CN- की उपस्थिति में का युग्मन हो जाता है लेकिन H2O की उपस्थिति में नहीं होता है।
Fe2+ का इलेक्ट्रॉनिक विन्यास 3d6 4s0 होता है।
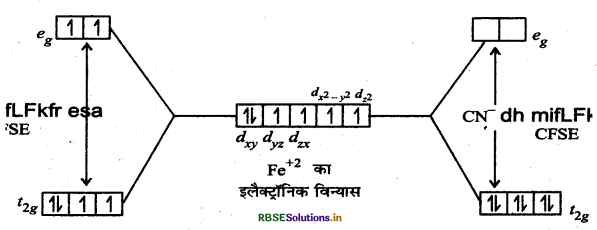
अर्थात् H2O की उपस्थिति में Fe2+ का इलेक्ट्रॉनिक विन्यास (t2g)4 , (eg) 2 होता है जो उच्च चक्रण, बाह्य कक्षक संकुल बनाता है।
जबकि CN- की उपस्थिति में Fe2+ का इलेक्ट्रॉनिक विन्यास (t2g)6 (eg)o होता है जो निम्न चक्रण, आन्तरिक कक्षक संकुल बनाता है।
विभिन्न प्रतियोगी परीक्षाओं में पूछे गये प्रश्न:
बहुविकल्पीय प्रश्न:
प्रश्न 1.
क्रिस्टल क्षेत्र सिद्धान्त के आधार पर K4[Fe(CN)6] में केन्द्रीय परमाणु का सही इलेक्ट्रॉनिक विन्यास क्या होगा?
(a) e4 t22
(b) t42e2g
(c) t62g e0g
(d) e3 t32
उत्तर:
(c) t62g e0g
प्रश्न 2.
संकुल [COCl2(en)2] द्वारा प्रदर्शित समावयवता का प्रकार है:
(a) आयनन समावयवता
(b) उपसहसंयोजन समावयवता
(c) ज्यामितीय समावयवता
(d) बंधनी समावयवता
उत्तर:
(c) ज्यामितीय समावयवता

प्रश्न 3.
[Ni(CO)4] संकुल की ज्यामिति एवं चुम्बकीय गुण हैं:
(a) वर्ग समतली ज्यामिति एवं अनुचुम्बकीय
(b) चतुष्फलकीय ज्यामिति एवं प्रतिचुम्बकीय
(c) वर्ग समतली ज्यामिति एवं प्रतिचुम्बकीय
(d) चतुष्फलकीय ज्यामिति एवं अनुचुम्बकीय
उत्तर:
(b) चतुष्फलकीय ज्यामिति एवं प्रतिचुम्बकीय
प्रश्न 4.
आयरन कार्बोनिल, Fe(CO)5 है:
(a) त्रिकेन्द्रक
(b) एककेन्द्रक
(c) चतुष्ककेन्द्रक
(d) द्विकेन्द्रक
उत्तर:
(b) एककेन्द्रक
प्रश्न 5.
CO3+ के संकुलों के लिए दृश्य क्षेत्र में अवशोषण तरंगदैर्ध्य का बढ़ता हुआ सही क्रम है:
(a) [CO(en)3]3+. [CO(NH3)6]3+, [CO(H2O)6]]3+
(b) [CO(H2O)6]3+, [CO(en)3]3+, [CO(NH3)6]3+
(c) [CO(H2O)6]3+, [CO(NH3)6]3+ , [CO(en)3]3+
(d) [CO(NH3)6]3+, [CO(en)3]3+ [CO(H2O)6]3+
उत्तर:
(a) [CO(en)3]3+. [CO(NH3)6]3+, [CO(H2O)6]]3+
प्रश्न 6.
संकुलों COCl3 .6NH3, COCl3 .5NH3, COCl3. 4NH3 को आधिक्य में AgNO3 के साथ क्रिया करवाने पर स्टॉइकियोमेट्री AgCl बनने का सही क्रम क्रमशः है:
(a) 1AgCl, 3AgCl, 2AgCl
(b) 3AgCl, 1AgCl, 2AgCl
(c) 3AgCl, 2AgCl, 1AgCl
(d) 2AgCl, 3AgCl, 1AgCl
उत्तर:
(c) 3AgCl, 2AgCl, 1AgCl
प्रश्न 7.
सिग्मा आबंधित कार्बधात्विक यौगिक का उदाहरण है:
(a) रुथिनोसीन
(b) ग्रीन्यार अभिकर्मक
(c) फेरोसीन
(d) कोबाल्टोसीन
उत्तर:
(b) ग्रीन्यार अभिकर्मक

प्रश्न 8.
[Mn(CN)6]3- के लिए सही कथन बताइए:
(a) यह sp3d2 संकरित तथा अष्टफलकीय है
(b) यह sp3d2 संकरित तथा चतुष्फलकीय है
(c) यह d2 sp3 संकरित तथा अष्टफलकीय है
(d) यह dsp2 संकरित तथा वग समतलीय है
उत्तर:
(c) यह d2 sp3 संकरित तथा अष्टफलकीय है
प्रश्न 9.
निम्न स्पीशीज के लिए ट्रांस-प्रभाव का बढ़ता हुआ सही क्रम है:
(a) Br- > CN- > NH3 > CHE
(b) CN- > Br > C6H5 > NH3
(C) NH3 > CN > Br > CH5
(d) CN- > C6H5 > Br > NH3
उत्तर:
(d) CN- > C6H5 > Br > NH3
प्रश्न 10.
निम्न में से किसके उच्च चक्रण संकुलों में यान-टेलर प्रभाव दृश्य नहीं है?
(a) d4
(b) d9
(c) d7
(d) d8
उत्तर:
(d) d8
प्रश्न 11.
निम्नलिखित में से किसकी C - O आबंध लम्बाई अधिकतम हैं? (मुक्त C - O आबंध लम्बाई CO में 1.128 A है।)।
(a) [Fe(CO)4] 2-
(b) [Mn(CO)6]+
(c) Ni(CO)4
(d) [CO(CO)4]-
उत्तर:
(a) [Fe(CO)4] 2-

- RBSE Class 12 Chemistry Notes Chapter 16 दैनिक जीवन में रसायन
- RBSE Class 12 Chemistry Notes Chapter 15 बहुलक
- RBSE Class 12 Chemistry Notes Chapter 14 जैव-अणु
- RBSE Class 12 Chemistry Notes Chapter 13 ऐमीन
- RBSE Class 12 Chemistry Notes Chapter 12 ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
- RBSE Class 12 Chemistry Notes Chapter 11 ऐल्कोहॉल, फीनॉल एवं ईथर
- RBSE Class 12 Chemistry Notes Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
- RBSE Class 12 Chemistry Notes Chapter 9 उपसहसंयोजन यौगिक
- RBSE Class 12 Chemistry Notes Chapter 8 d- एवं f-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम