RBSE Class 12 Chemistry Important Questions Chapter 8 d- एवं f-ब्लॉक के तत्व
Rajasthan Board RBSE Class 12 Chemistry Important Questions Chapter 8 d- एवं f-ब्लॉक के तत्व Important Questions and Answers.
RBSE Class 12 Chemistry Chapter 8 Important Questions d- एवं f-ब्लॉक के तत्व
बहुविकल्पीय प्रश्न:
प्रश्न 1.
एक संक्रमण धातु की अधिकतम ऑक्सीकरण अवस्था प्राप्त करने में कौन-से इलेक्ट्रॉन मुक्त होते हैं?
(i) ns इलेक्ट्रॉन
(ii) (n + 1) d इलेक्ट्रॉन
(iii) (n - 1) d इलेक्ट्रॉन
(iv) ns + (n - 1) d इलेक्ट्रॉन
उत्तर:
(iv) ns + (n - 1) d इलेक्ट्रॉन
प्रश्न 2.
संक्रमण धातु जो परिवर्ती ऑक्सीकरण अवस्था नहीं प्रदर्शित करता है
(i) Ti
(ii) v
(iii) Fe
(iv) Zn
उत्तर:
(iv) Zn

प्रश्न 3.
निम्नलिखित में अनुचुम्बकीय यौगिक हैं।
(i) CuCl
(ii) AgNO3
(iii) FeSO4
(iv) ZnCl2
उत्तर:
(ii) AgNO3
प्रश्न 4.
निम्नलिखित आयनों में अनुचुम्बकीय आयन कौन-सा नहीं है?
(Ni = 28, N = 30, Cu = 29, Mn = 25)
(i) Ni++
(ii) Zn++
(iii) Cu+
(iv) Mn++
उत्तर:
(ii) Zn++
प्रश्न 5.
निम्न में अनुचुम्बकीय आयन है।
(i) Zn2+
(ii) Ni2+
(iii) Cu+
(iv) Ag+
उत्तर:
(ii) Ni2+
प्रश्न 6.
निम्न में से रंगहीन आयन है।
(i) Cu+
(ii) Cu2+
(iii) Ni2+
(iv) Fe3+
उत्तर:
(i) Cu+
प्रश्न 7.
निम्न तत्वों में लैन्थेनाइड तत्व है।
(i) Ra
(ii) Ce
(iii) Ac
(iv) Zr
उत्तर:
(ii) Ce

प्रश्न 8.
लैन्थेनाइडों का सामान्य बाह्यतम इलेक्ट्रॉनिक विन्यास है।
(i) 4f1-14 5d° 6s2
(ii) 4f20-14 5d0-2 6s2
(iii) 4f0-14 5d1 6s2
(iv) 4f0-14 5d1 6s2
उत्तर:
(ii) 4f20-14 5d0-2 6s2
प्रश्न 9.
संक्रमण तत्वों में 4d श्रेणी का तत्व है।
(i) 37A
(ii) 47B
(iii) 57C
(iv) 30Di
उत्तर:
(ii) 47B
प्रश्न 10.
कौन-सा तत्व d-ब्लॉक तत्व तो है किन्तु संक्रमण धातु नहीं है?
(i) Zn
(ii) Cu
(iii) Cr
(iv) Mn
उत्तर:
(i) Zn
प्रश्न 11.
निम्न में से प्रतिचुम्बकीय है।
(i) Cu2+
(ii) zn2+
(iii) cr2+
(iv) Ti+2
उत्तर:
(ii) zn2+
प्रश्न 12.
निम्नलिखित में से किसका प्रथम आयनन विभव अधिकतम है?
(i) Ti
(ii) Mn
(iii) Fe
(iv) Ni
उत्तर:
(iii) Fe

प्रश्न 13.
किस आयन में समस्त इलेक्ट्रॉन e(-) युग्मित अवस्था में है?
(i) Cr+2
(ii) Cu+2
(iii) Cu+1
(iv) Ni+2
उत्तर:
(ii) Cu+2
प्रश्न 14.
संक्रमण श्रेणी धातुओं का विशिष्ट गुण है।
(i) ये परिवर्ती ऑक्सीकरण अवस्था प्रदर्शित करती हैं
(ii) ये सभी धातु उत्प्रेरक का कार्य करती हैं
(iii) ये रंगीन यौगिक बनाती हैं
(iv) उपर्युक्त सभी
उत्तर:
(iv) उपर्युक्त सभी
प्रश्न 15.
संक्रमण तत्व संकुल यौगिक बनाते हैं, क्योंकि।
(i) रिक्त कक्षकों की उपलब्धता होती है।
(ii) धातु आयनों का आकार छोटा होता है।
(iii) परिवर्तनीय ऑक्सीकरण अवस्था होती है।
(iv) उपर्युक्त सभी
उत्तर:
(iv) उपर्युक्त सभी
प्रश्न 16.
दुर्लभ मृदा तत्व हैं।
(i) क्षारीय मृदा तत्व
(ii) क्षारीय तत्व
(iii) संक्रमण श्रेणी के तत्व
(iv) लैन्थेनाइड
उत्तर:
(iv) लैन्थेनाइड
प्रश्न 17.
Mn+ (परमाणु क्रमांक =25) में उपस्थित कुल अयुग्मित इलेक्ट्रॉनों की संख्या है
(i) 2
(ii) 7
(iii) 3
(iv) 5
उत्तर:
(iv) 5

प्रश्न 18.
निम्नलिखित संक्रमण तत्वों में से किसके द्वारा अधिकतम ऑक्सीकरण अवस्थाएँ प्रदर्शित की जाती हैं?
(i) Sc (Z = 21)
(ii) Cr (Z = 24)
(iii) Mn (Z = 25)
(iv) Fe (Z = 26)
उत्तर:
(iii) Mn (Z = 25)
अति लघु उत्तरीय प्रश्न:
प्रश्न 1.
संक्रमण तत्वों की परमाणु त्रिज्याएँ किसी श्रेणी में किस कार परिवर्तित होती है?
उत्तर:
सामान्यतः एक विशिष्ट श्रेणी से सम्बन्धित संक्रमण तत्वों । परमाणु त्रिज्याएँ परमाणु क्रमांक के बढ़ने के साथ घटती जाती हैं। त्येक श्रेणी के अन्त में परमाणु त्रिज्याओं में थोड़ी वृद्धि देखने को लती है। समूह में नीचे की ओर जाने पर संक्रमण तत्वों की परमाणु ज्याओं में वृद्धि होती है। द्वितीय और तृतीय संक्रमण श्रेणी के तत्वों ने परमाणु त्रिज्याएँ लगभग समान रहती हैं।
प्रश्न 2.
संक्रमण तत्व धात्विक लक्षण क्यों प्रदर्शित करते हैं?
उत्तर:
संक्रमण तत्व धात्विक लक्षण प्रदर्शित करते हैं क्योंकि नकी आयनन ऊर्जाएँ निम्न होती हैं तथा। उनके बाह्यतम कोश में अनेक क्त कक्षक भी उपस्थित होते हैं। ये कारक उनमें धात्विक आबन्धों के र्माण में सहायता करते हैं।

प्रश्न 3.
विलयन में Cu आयन रंगहीन जबकि Cu2+ आयन गीन होते हैं। क्यों?
उत्तर:
Cu+ - 1s2, 2s2, 2p6, 3s2, 3p10,4s0, चूँकि सभी इलेक्ट्रॉन ग्मित हैं इसलिए Cu+ आयन रंगहीन है। Cu2+ आयन में एक अयुग्मित लेक्ट्रॉन है इसलिए यह नीले रंग का है।
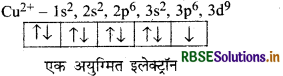
प्रश्न 4.
आन्तरिक (अन्तः) संक्रमण तत्व क्या हैं?
उत्तर:
जिन तत्वों में विभेदी इलेक्ट्रॉन (n – 2) f - कक्षकों में प्रवेश रता है वे तत्व आन्तरिक (अन्तः) संक्रमण तत्व कहलाते हैं। ये तत्व वर्त सारणी में एक अलग ब्लॉक, f - ब्लॉक का निर्माण करते हैं; अतः हें f - ब्लॉक के तत्व भी कहते हैं।
प्रश्न 5.
Ni2+ का चुम्बकीय आघूर्ण ज्ञात कीजिए।
उत्तर:
Ni का परमाणु क्रमांक = 26
Ni2+ का इलेक्ट्रॉनिक विन्यास = 1s2, 2s2, 2p6, 3s2 3p6, 3d8, 4s0
अयुग्मित इलेक्ट्रॉनों की संख्या (n) = 2
चुम्बकीय आघूर्ण (μ) = \(\sqrt{n(n+2)}\)
μ = \(\sqrt{2(2+2)}\)
μ = \(\sqrt{8}\) = 2.76 B.M
प्रश्न 6.
एक परायूरेनियम तत्व का नाम एवं प्रतीक लिखिए।
उत्तर:
प्लूटोनियम (Pu)
प्रश्न 7.
लेन्थेनाइडों की सामान्य ऑक्सीकरण अवस्था लिखिए।
उत्तर:
सभी लेन्थेनाइड् तत्व + 3 ऑक्सीकरण अवस्था प्रदर्शित करते हैं।
प्रश्न 8.
संक्रमण तत्वों को d - ब्लॉक तत्व क्यों कहा जाता है?
उत्तर:
क्योंकि इनमें अन्तिम इलेक्ट्रॉन (n - 1)d कक्षक में प्रवेश करता है।

प्रश्न 9.
परमाणु क्रमांक 24 का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
24Cr → 1s2, 2s2 2p6, 3s2 3p6 4s1 3d5
प्रश्न 10.
संक्रमण तत्व परिवर्ती ऑक्सीकरण अवस्था क्यों प्रदर्शित करते हैं?
उत्तर:
संक्रमण तत्व परिवर्ती ऑक्सीकरण अवस्था प्रदर्शित करते हैं क्योंकि ns तथा (n - 1)d कक्षकों में आबन्ध निर्माण के लिए इलेक्ट्रॉन उपस्थित होते हैं।
प्रश्न 11.
Cu प्रतिचुम्बकीय है जबकि Cu2+ अनुचुम्बकीय है, क्यों?
उत्तर:
Cu+ में कोई अयुग्मित इलेक्ट्रॉन नहीं है, अत: यह प्रतिचुम्बकीय है, जबकि Cu2+ में अयुग्मित इलेक्ट्रॉन है, अत: यह अनुचुम्बकीय है।
प्रश्न 12.
Cu2+ अनुचुम्बकीय व Zn2+ प्रतिचुम्बकीय है, क्यों?
उत्तर:
Cu2+ में अयुग्मित इलेक्ट्रॉन होते हैं जबकि Zn2+ में नहीं।
प्रश्न 13.
संक्रमण तत्व अच्छे उत्प्रेरक क्यों होते हैं?
उत्तर:
छोटे आकार एवं अधिक प्रभावी नाभिकीय आवेश के कारण इनमें जटिल यौगिक बनाने की प्रवृत्ति अधिक होती है। इस कारण संक्रमण तत्व अच्छे उत्प्रेरक होते हैं।

प्रश्न 14.
Zn परिवर्ती संयोजकता प्रदर्शित नहीं करता है, क्यों?
उत्तर:
Zn2+ आयन में बाह्य कोश (4s) से दो इलेक्ट्रॉन निकल जाने के बाद 3d - उपकोश पूर्ण भरित स्थिति में आ जाता है। इस कारण यह परिवर्ती संयोजकता को प्रदर्शित नहीं करता है।
प्रश्न 15.
आवर्त सारणी में वर्ग-6 के तत्त्वों की दो महत्त्वपूर्ण ऑक्सीकरण अवस्थाएँ क्या हैं?
उत्तर:
+ 3 तथा + 6.
प्रश्न 16.
संक्रमण तत्वों का सामान्य इलेक्ट्रॉनिक विन्यास क्या हैं?
उत्तर:
(n - 1)d1-10 ns1 - 2
प्रश्न 17.
संक्रमण तत्व और उनके यौगिक उत्प्रेरक की भाँति कार्य करते हैं। कारण दीजिए।
उत्तर:
संक्रमण धातुएँ तथा इनके अनेक यौगिक अच्छे उत्प्रेरक होते हैं क्योंकि इनमें परिवर्तनशील संयोजकता (ऑक्सीकरण अंक) तथा संकुल यौगिक बनाने का गुण पाया जाता है जिसमें अयुग्मित इलेक्ट्रॉन प्रयुक्त होते हैं।
प्रश्न 18.
Cr2+ एक प्रबल अपचायक है क्यों, कारण दीजिए।
उत्तर:
Cr2+ एक प्रबल अपचायक है क्योंकि Cr2+ से Cr3+ बनने में का 4 में परिवर्तन हो जाता है। इनका 13 विन्यास अधिक स्थायी हैं।
प्रश्न 19.
जलीय विलयन में Sc3+ रंगहीन होता है जबकि Ti+ रंगीन। कारण दीजिए।
उत्तर:
Sc3+ आयन का बाह्यतम इलेक्ट्रानिक विन्यास 300 है जिसमें कोई अयुग्मित इलेक्ट्रॉन नहीं है। अत: इसमें इलेक्ट्रॉन का उत्तेजन सम्भव नहीं हैं। इसलिए रंगहीन है। जबकि Ti3+ का इलेक्ट्रॉनिक विन्यास 3d है। जिसमें एक अयुग्मित इलेक्ट्रान होने के कारण उत्तेजन सम्भव है इसलिए Ti3+ आयन रंगीन है।
प्रश्न 20.
3d श्रेणी में मैंगनीज अधिकतम संख्या में ऑक्सीकरण अवस्थाएँ दर्शाता है। कारण दीजिए।
उत्तर:
मैग्निज अपने यौगिकों में बड़ी संख्या में ऑक्सीकरण अवस्थायें प्रदर्शित करता है।
Mn के इलेक्ट्रॉनिक विन्यास 3d5 4s2 होता है।
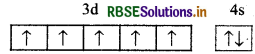
अतःd कक्षकों में अधिकतम पाँच अयुग्मित इलेक्ट्रॉन उपस्थित होने के कारण, यह [+ 2 + 3, + 4, + 5, + 6, + 7] अधिकतम ऑक्सीकरण अवस्थाएँ प्रदर्शित करता है।
प्रश्न 21.
Mn3+/Mn2+ युग्म के लिए E का मान Cr3+/Cr2+ के मान से बहुत अधिक धनात्मक होता है। कारण दीजिए।
उत्तर:
Mn+3/Mn2+ युग्म, Cr3+/Cr2+ के मान से अधिक धनात्मक होता है क्योंकि Mn2+ का विन्यास 3d5 अधिक स्थायी होता है।

प्रश्न 22.
जलीय विलयन में T4+ रंगहीन है जबकि V4+ रंगीन है। कारण दीजिए।
उत्तर:
22Ti - [Ar] 3d24s2
Ti4+ - [Ar] 3d0 4s0
अत: Ti4+ आयन में पूर्ण भरे कक्षकों के अत्यधिक स्थायित्व होने के कारण यह दृश्य प्रकाश को अवशोषित नहीं कर पाता अत: Ti4+ आयन रंगहीन होता है। जबकि v+ का विन्यास [Ar] 3d1 4S0 होता है। d-कक्षक में अयुग्मित इलेक्ट्रॉन होने के कारण V2+ रंगीन है।
प्रश्न 23.
Zn, Cd, एवं Hg तत्वों को संक्रमण तत्व नहीं माना जाता है क्यों?
उत्तर:
Zn, Cd एवं Hg तत्वों को सामान्य इलेक्ट्रॉनिक विन्यास d10s2 होता है तथा ये अपनी + 2 ऑक्सीकरण अवस्था में d10 4s0 विन्यास रखते है। इस प्रकार -कक्षक पूर्ण भरा होने के कारण इन्हें संक्रमण तत्व
नहीं माना गया है।
प्रश्न 24.
Cr2+ (जलीय) आयन के चुम्बकीय आघूर्ण की गणना कीजिए।
उत्तर:
Cr का परमाणु क्रमांक Z = 24 है।
इसका इलेक्ट्रॉनिक विन्यास [Ar] 3d5 4s1 होता है।
Cr2+ का विन्यास 3d4 4s0 है।
चुम्बकीय आघूर्ण = \(\sqrt{n(n+2)}\)यहाँ x = 4 है।
अतः = \(\sqrt{4(4+2)}\)
= 4.89 BM
प्रश्न 25.
कॉपर की कणन एन्थैल्पी की अपेक्षा आयरन की कणन एन्थैल्पी उच्चतर होती है। कारण दीजिए।
उत्तर:
Fe का इलेक्ट्रॉनिक विन्यास 3d64s2
Cu का इलेक्ट्रॉनिक विन्यास 3d104s1
आयरन के परमाणु में परमाणु की अपेक्षा बड़ी संख्या में अयुग्मित इलेक्ट्रॉन होते हैं।
अतः प्रबल अन्तरापरमाण्विक अन्योन्य क्रिया होती है। अतः प्रबल आबन्ध के फलस्वरूप आयरन की कणन एन्थैल्पी का मान उच्चतर होता हैं।

प्रश्न 26.
वाष्पशील धातुओं के उदाहरण लिखिए।
उत्तर:
Zn, Cd, Hg वाष्पशील धातुएँ हैं; क्योंकि इनका गलनांक व क्वथनांक कम होता है।
प्रश्न 27.
परमाणु क्रमांक 25 वाले तत्व के द्विसंयोजी आयन के लिए अनुचुम्बकत्व की गणना कीजिए।
उत्तर:
25Mn = 3d6 4s2
Mn2+ = 3ds या 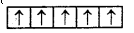
अर्थात् 5 अयुग्मित इलेक्ट्रॉन
चुम्बकीय आघूर्ण (u) \(=\sqrt{n(n+2)}\) BM
= \(\sqrt{5(5+2)}\) BM
= 5.92 BM
प्रश्न 28.
Mn उच्च ऑक्सीकरण अवस्था में ऑक्साइड Mn2O7 बनाता है, फ्लुओराइड MnF7 नहीं।
उत्तर:
ऑक्साइड में ऑक्सीजन की धातुओं के साथ बहुआबन्ध बनाने की क्षमता, फ्लुओराइड में उपस्थित फ्लुओरीन की तुलना में अधिक होती है। इस कारण Mn उच्च ऑक्सीकरण अवस्था में ऑक्साइड Mn2O7 बनाता है, फ्लोराइड MnF7 नहीं।
प्रश्न 29.
निम्न ऑक्साइडों में कौन-सा ऑक्साइड आयनिक है।
TiO2, Mn2O7 CrO3, V2O5
उत्तर:
TiO2 ऑक्साइड आयनिक है।
प्रश्न 30.
निम्न में से सहसंयोजक ऑक्साइड है:
Mn2O7, SC2O3, TiO2, TiO
उत्तर:
उपर्युक्त में Mn2O7 सहसंयोजक ऑक्साइड है।
प्रश्न 31.
जलयोजित Zn+ आयन रंगहीन होता है। क्यों?
उत्तर:
Zn2+ का विन्यास [Ar]3d10 4s0 होता है। इसके पास अयुग्मित इलेक्ट्रॉन नहीं होते हैं। इसलिए यह दृश्य प्रकाश को अवशोषित नहीं कर पाता है। अत: जलयोजित Zn2+ आयन रंगहीन होता है।
प्रश्न 32.
क्रोमेट आयन की आकृति किस प्रकार की होती है? इसकी संरचना बनाइये।
उत्तर:
क्रोमेट आयन (CrO42-) की आकृति समचतुष्फलकीय होती
क्रोमियम sp3 संकरण अवस्था दर्शाता है।
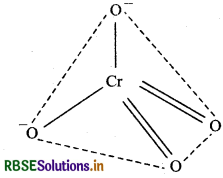
प्रश्न 33.
सिल्वर परमाणु की मूल अवस्था में पूर्ण भरे d-कक्षक (4d10) है, फिर भी यह एक संक्रमण तत्त्व है; क्यों?
उत्तर:
Ag का इलेक्ट्रॉनिक विन्यास [Kr] 4d10 4s1 है। सिल्वर पने यौगिकों के साथ + 1 ऑक्सीकरण अवस्था प्रदर्शितम करत है, परन्तु ऑक्सीकरण अवस्था में Ag का इलेक्ट्रॉनिक विन्यास 4d9 4s0 होने के रण d-कक्षक पूर्ण भरा नहीं है। इसलिए Ag को संक्रमण तत्व माना है।
प्रश्न 34.
Ce (लैन्थेनॉइड तत्व) Ce4+ ऑक्सीकरण अवस्था र्शित करता है, क्यों ?
उत्तर:
क्योंकि Ce4+ में 4f0 विन्यास पाया जाता है, जो कि अधिक यी होता है। इस कारण Ce (+ 4) ऑक्सीकरण अवस्था दर्शाता है।

प्रश्न 35.
Tb (लैन्थेनॉइड तत्व) Tb4+ ऑक्सीकरण अवस्था र्शित करता है, क्यों ?
उत्तर:
क्योंकि Tb4+ में 4f7 विन्यास पाया जाता है, जो कि अधिक यी होता है। इस कारण Tb (+ 4) ऑक्सीकरण अवस्था दर्शाता है।
प्रश्न 36.
Eu (यूरोपियम) Eu2+ तथा Yb (इटर्बियम) Yb2+ क्सीकरण अवस्था प्रदर्शित करते हैं, क्यों?
उत्तर:
Eu (यूरोपियम) Eu2+ ऑक्सीकरण अवस्था प्रदर्शित करता क्योंकि यह 4f7 इलेक्ट्रॉनिक विन्यास प्राप्त कर लेता है जबकि Yb टर्बियम) Yb2+ ऑक्सीकरण अवस्था प्रदर्शित करते हैं; क्योंकि यह 4 इलेक्ट्रॉनिक विन्यास प्राप्त कर लेता है।
प्रश्न 37.
Lu (OH)3 की अपेक्षा La (OH)3 ज्यादा क्षारीय है।
उत्तर:
Lu (OH)3 की अपेक्षा La(OH)3 ज्यादा क्षारीय होता है; कि La लैन्थेनॉइड आकुंचन के कारण पहले वाले अर्थात् Lu की ना में ज्यादा सहसंयोजी लक्षण वाला होता है। इसमें OH- आयन की स्त होती हैं। Lu(OH)3 ज्यादा कठिन है तथा La(OH)3 की अपेक्षा कम दीय है।
प्रश्न 38.
ऐक्टिनॉइड का सामान्य इलेक्ट्रॉनिक विन्यास क्या हैं?
उत्तर:
5f1 - 14. 6d0 - 1 7s2
प्रश्न 39.
लैन्थेनॉइड-ब्लॉक तत्व क्यों कहलाते हैं?
उत्तर:
क्योंकि लैन्थेनॉइडों में अन्तिम इलेक्ट्रॉन f-उपकोश में प्रवेश ता है इसलिए इसे f-ब्लॉक तत्व कहते हैं।
प्रश्न 40.
लैन्थेनॉइड श्रेणी में किस त्रिसंयोजी आयन का आकार सबसे अधिक होता है?
उत्तर:
La3+
प्रश्न 41.
लैन्थेनॉइड का बाह्य इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
4f1-14 5d0-1 6s2

प्रश्न 42.
लैन्थेनॉइड श्रेणी में त्रिसंयोजी धनायनों के आकार परमाणु क्रमांक बढ़ने के साथ धीरे-धीरे घटते जाते हैं। इस प्रभाव को क्या कहते हैं?
उत्तर:
लैन्थेनॉइड आकुंचन।
प्रश्न 43.
प्रत्येक युग्म में से अधिक स्थायी आयन बताइए।
(i) Cu2+ तथा Cu+
(ii) Fe2+ तथा Fe3+
(iii) Ni2+ तथा Pt2+
(iv) Ni4+ तथा Pt4+
उत्तर:
(i) Cu2+, (ii) Fe3+, (iii) Ni2+, (iv) Pt4+
प्रश्न 44.
Fe2+ की तुलना में Fe3+ अधिक स्थायी क्यों है?
उत्तर:
Fe3+ अधिक स्थायी है, क्योंकि इसका स्थायी इलेक्ट्रॉनिक विन्यास है तथा इसकी जलयोजन ऊर्जा भी उच्च होती है।
प्रश्न 45.
d-ब्लॉक के तत्वों को संक्रमण तत्व क्यों कहा जाता है?
उत्तर:
d-ब्लॉक के तत्वों के गुण s-ब्लॉक तथा p-ब्लॉक के तत्वों के मध्यवर्ती होते हैं। इसी कारण इन्हें आवर्त सारणी में s-ब्लॉक तथा p ब्लॉक के मध्य रखा गया है। अतः इन्हें संक्रमण तत्व कहा जाता है।
प्रश्न 46.
V2O5 उत्प्रेरक की भाँति कार्य करता है, क्यों?
उत्तर:
V2O5 में वैनेडियम (V) कई ऑक्सीकरण अवस्थाएँ प्रदर्शित करता है।
प्रश्न 47.
निम्न ऑक्साइडों के क्षारीय गुणों को बढ़ते क्रम में व्यवस्थित कीजिए।
MnO, MnO2, Mn2O7
उत्तर:
Mn2O7 < MnO2 < MnO.
प्रश्न 48.
Cu+ के द्वारा प्रदर्शित की जाने वाली असमानुपातन अभिक्रिया लिखिए।
अथवा
Cu+ जलीय विलयन में अस्थायी है। क्यों?
उत्तर:
Cu (I) लवण जल में अपघटित हो जाता है। यहाँ Cu (I) कॉपर धातु तथा दूसरा Cu(II) में परिवर्तित हो जाता है
2Cu+ → Cu + Cu2+
उपर्युक्त अभिक्रिया असमानुपातन अभिक्रिया होती है क्योंकि यहाँ ( + 1) ऑक्सीकरण अवस्था तथा ( + 2) व (0) ऑक्सीकरण अवस्थाओं को प्रदर्शित करती हैं।
प्रश्न 49.
ऐक्टिनॉइड आंकुचन को समझाइए।
उत्तर:
5f श्रेणी के तत्वों (Ac से Lr) को बाँये से दाँये चलने पर उनके आकार में क्रमिक रूप से कमी आती है। क्योंकि 5f कक्षकों का परिरक्षण प्रभाव बहुत कम होता है जो नाभिकीय आवेश बढ़ने के कारण उत्पन्न आकर्षण बल को सन्तुलित नहीं कर पाता हैं जिसके कारण आकार में कमी आती है। इसे ऐक्टिनॉइड आकुंचन कहते हैं।
प्रश्न 50.
लेन्थेनॉइड संकुचन की तुलना में एक तत्व से दूसरे तत्व क मध्य ऐक्टिनॉइड संकुचन अधिक होता है? कारण दीजिये।
उत्तर:
लेन्थेनॉइड संकुचन में 4f उपकोश उपस्थित होता है जबकि रेक्टिनॉइड संकुचन में 5f उपकोश होता है। 5f इलेक्ट्रॉन्स में 4f इलेक्ट्रॉन्स की तुलना में परिरक्षण प्रभाव बहुत कम होता है। अतः ऐक्टिनॉइड संकुचन लेन्थेनॉइड संकुचन से अधिक होता है।
लघु उत्तरीय प्रश्न:
प्रश्न 1.
(i) आयरन (II) आयन तथा (ii) टिन (II) आयन पर अम्लीकृत डाइक्रोमेट (Cr2O72-) विलयन की ऑक्सीकारक क्रिया दर्शाने के लिए सन्तुलित आयनिक समीकरण लिखिए।
उत्तर:
(i) आयरन (II) आयन का आक्सीकरण फेरस आयन, करिक आयन में परिवर्तित हो जाता है।
Cr2O72- + 6Fe2+ + 14H+ → 6Fe3+ + 2Cr 3+ + 7H2O
(i) टिन (II) आयन का आक्सीकरण स्टैनस आयन का आक्सीकरण टैनिक आयन में हो जाता है।
Cr2O72- + 14H+ + 3Sn2+ → 2Cr3+ + 3Sn4+ + 7H2O
प्रश्न 2.
लैन्थेनॉइड संकुचन क्या है? इसे समझाइए।
उत्तर:
4d-श्रेणी से 5d-श्रेणी में जाने से पूर्व 14 इलेक्ट्रॉन 4/ उपकोश लैन्थेनॉइड) में भरते हैं। इसलिए परमाणु क्रमांक बढ़ने से नाभिकीय भावेश में वृद्धि हो जाती है लेकिन 4f कक्षकों का परिरक्षण प्रभाव दुर्बल होने के कारण परिणामी रूप से, भावी नाभिकीय आवेश में वृद्धि होती है। इसलिए 4d-से 5d-श्रेणी में जाने पर आकार बढ़ता नहीं है, अपितु ट जाता है। इसे ही लैन्थेनॉइड संकुचन कहते हैं।

प्रश्न 3.
कारण दीजिए:
(अ) संक्रमण तत्वों की 3d श्रेणी में Mn अधिकतम ऑक्सीकरण स्वस्था दर्शाता है।
(ब) Cr+2 तथा Mn+3 दोनों का विन्यास है परन्तु Cr+2 उपचायक और Mn+3 ऑक्सीकरण है।
उत्तर:
(अ) संक्रमण तत्वों की 3d श्रेणी में Mn में इलेक्ट्रॉन 3d व 5 उपकोशों में पाये जाते हैं। जिनकी ऊर्जा लगभग बराबर होती है तथा 3d5 4s2 इलेक्ट्रॉन पाये जाते हैं। जिन्हें परमाणु से बाहर निकालने के लिए म ऊर्जा की आवश्यकता होती है (युग्मन ऊर्जा के कारण)। इसलिए in 3d श्रेणी में अधिकतम +7 ऑक्सीकरण अवस्था दर्शाता है।
(ब) Cr2+ व Mn3+ दोनों का विन्यास एकसमान d4 है लेकिन In+3 आकार में Cr+2 से छोटा होता है इस कारण Mn+3 की विद्युत् एणता ज्यादा होती है व Cr2+ की कम इसलिए Cr2+ अपचायक की तरह था Mn3+ ऑक्सीकारक की तरह व्यवहार करता है।
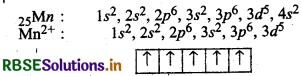
प्रश्न 4.
Mn3+ आयन की अपेक्षा Mn2+ आयन अधिक स्थायी ते हैं। क्यों?
उत्तर:
हम जानते हैं कि आधे और पूरे भरे हुए ऑर्बिटल अधिक थायी होते हैं। Mn2+ में 3d पर पाँच इलेक्ट्रॉन हैं जोकि आधा भरा हुआ । इसलिए Mn3+ आयन की अपेक्षा Mn2+ आयन अधिक स्थायी होते
आधा भरा हआ उपकोश अधिक स्थायी
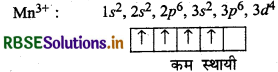
प्रश्न 5.
आयतनात्मक विश्लेषण में पोटैशियम परमैंगनेट विलयन को अम्लीकृत करने के लिए तनु सल्फ्यूरिक अम्ल के स्थान पर HNO3 का प्रयोग क्यों नहीं किया जाता है?
उत्तर:
आयतनात्मक विश्लेषण में KMnO4 विलयन को अम्लीकृत करने के लिए dil. H2SO4 का प्रयोग किया जाता है न कि HNO3 का क्योंकि HNO3, स्वयं ऑक्सीकारक है और आंशिक रूप से अपचायक को ऑक्सीकृत कर देता है।
2KMnO4 + 3H2SO4 → K2SO4 + 2MnSO4 + 3K2O + 5[0]
Reducing agent + [0] → Oxidised product
प्रश्न 6.
ऐक्टिनाइड्स क्या हैं? इन्हें ऐक्टिनाइड्स क्यों कहा जाता है? इनके प्रमुख उपयोग लिखिए।
उत्तर:
आन्तरिक अंक्रमण तत्त्व अथवा ब्लिॉक तत्त्वों की दो श्रेणियाँ होती हैं।
- लैन्थेनाइड श्रेणी तथा
- ऐक्टिनाइड श्रेणी।
ऐक्टिनाइड श्रेणी में थोरियम से लेकर लॉरेन्शियम तक के चौदह तत्त्वों को ऐक्टिनाइड्स कहा जाता है। ये तत्त्व आवर्त सारणी में ऐक्टिनियम का अनुसरण करते हैं तथा भौतिक व रासायनिक गुणों में उससे समानता भी प्रकट करते हैं। इसलिए इन्हें ऐक्टिनाइड्स कहा जाता है।
ऐक्टिनाइडों के उपयोग:
- यूरेनियम तथा प्लूटोनियम का मुख्य उपयोग नाभिकीय रिएक्टर से परमाणु ऊर्जा उत्पादन में ईंधन के रूप में किया जाता है। प्लूटोनियम का उपयोग परमपाणु हथियार बनाने में भी किया जाता है।
- थोरियम ऑक्साइड का उपयोग चमकने वाले गैस मेन्टल के निर्माण में होता है।
- यूरिनियम के लवणों का उपयोग हरे रंग के काँच के निर्माण में होता है।
- थोरियम लवण का उपयोग आजकल कैंसर के उपचार में होता है।
प्रश्न 7.
1. संक्रमण तत्व अन्तराकाशी योगिक क्यों बनाते हैं?
2. लैन्थेनाइड तत्वों में बाँयी से दायीं ओर जाने पर परमाण्विक त्रिज्याएँ घटती हैं। समझाइए।
उत्तर:
- संक्रमण तत्वों के अन्तराकाशों में छोटे आकार के अधातु परमाणु आ जाते हैं तो ऐसे यौगिक अन्तराकाशी यौगिक कहते हैं। संक्रमण तत्वों में रिक्त d-कक्षक एवं अयुग्मित e- होने के कारण ये अन्तराकाशी यौगिक बनाते हैं।
- क्योंकि परमाणु क्रमांक बठने पर नाभिकीय आवेश में वृद्धि होती है, जिससे आकार में कमी आती है और परमाणु त्रिज्याएँ घटती हैं।
प्रश्न 9.
संक्रमण तत्त्वों में जटिल यौगिक बनाने की प्रवृत्ति अधिक क्यों होती है?
उत्तर:
संक्रमण तत्त्वों में जटिन यौगिक बनाने की प्रवृत्ति निम्नलिखित कारणों से अधिक होती हैं।
- धातु आयनों का छोटा आकार
- धातु आयनों का उच्च नाभिकीय आवेश
- लीगैण्ड द्वारा प्रदान किये गये इलेक्टॉनों के एकाकी युग्मों को ग्रहण करने के लिए उपयुक्त ऊर्जा के रिक्त d-कक्षकों की प्राप्यता।
प्रश्न 10.
ऐक्टिनाइड्स व लैन्थेनाइड्स में मुख्य समानताएँ बताइए।
उत्तर:
चूंकि लैन्थेनाइड्स तथा ऐक्टिनाइड्स दोनों में ही इलेक्ट्रॉन (n - 2) f - उपकोश में प्रवेश पाता है तथा दोनों के ही बाह्य इलेक्ट्रॉनिक विन्यास लगभग समान हैं, अतः ये गुणों में समानताएँ प्रदर्शित करते हैं।
इनकी मुख्य समानताएँ निम्नलिखित हैं:
- दोनों में ही (n-2) f - कक्षक में इलेक्ट्रान प्रवेश करता है।
- दोनों की प्रमुख ऑक्सीकरण अवस्था +3 है।
- परमाणु क्रमांक बढ़ने पर दोनों ही परमाणविक तथा आयनिक आकारों में कमी प्रदर्शित करते हैं (लैन्थेनाइँड संकुचन तथा ऐक्टिनॉइड संकुचन)।
- दोनों ही अधिक क्रियाशील तथा प्रबल विद्युत धनात्मक हैं।
- दोनों ही चुम्बकीय गुण प्रदर्शित करते हैं।
प्रश्न 11.
लैन्थेनाइड्स व ऐक्टिनाइड्स में अन्तर/असमानताएँ बताइए।
उत्तर:
लैन्थेनाइड्स व ऐक्टिनाइड्स में निम्नलिखित अन्तर/असमानताएं हैं।

प्रश्न 12.
लैन्थेनाइड व ऐक्टिनाइड श्रेणियों का सामान्य इलेक्ट्रॉनिक विन्यास लिखिए। या अन्तः संक्रमण तत्त्वों के सामान्य इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
लैन्थेनाइड्स के इलेक्ट्रॉनिक विन्यास निश्चित रूप से ज्ञात नहीं हैं। अधिकांश तत्त्वों में विभेदी इलेक्ट्रॉन 4f-उपकोश में प्रवेश करता है; अतः इन तत्त्वों का सैद्धान्तिक इलेक्ट्रॉनिक विन्यास [Xe] 4fo 5d1 6s2 प्रकार का होता है। ऐक्टिनाइड्स के इलेक्ट्रॉनिक विन्यासों को [Rn] 5fl - 14 6d 0 - 1 7s2 (अपवाद थोरियम को छोड़कर) के रूप में प्रकट किया जा सकता है।
प्रश्न 13.
पायरोलुसाइट अयस्क (MnO2) से KMnO4 के विरचन से सम्बद्ध सन्तुलित रासायनिक समीकरणों को लिखिए।
उत्तर:
चूर्णित पायरोल्यूसाइट वायु की उपस्थिति या किसी ऑक्सीकारक, जैसे-पोटैशियम नाइट्रेट या पोटैशियम क्लोरेट की उपस्थिति में पोटैश्यिम हाइड्रॉक्साइड या पोटैशियम कार्बोनेट के साथ अभिक्रिया करता है तो हरे रंग के पोटैशियम मैंगनेट का निर्माण होता है।

हरे विलयन में से क्लोरीन या ओजोन या कार्बन डाइ-ऑक्साइड की धारा प्रवाहित करने पर मैंगनेट का परिवर्तन परमैंगनेट में हो जाता है।

प्रश्न 14.
(अ) मिश्र-धातु में प्रयुक्त अधिकतम संगठन वाली दो धातुओं के नाम लिखिए।
(ब) v2+ हेतु चुम्बकीय आघूर्ण का नाम परिकलित कीजिए।
उत्तर:
(अ) मिश्र-धातु में अधिकतम मात्रा में 44% नियोडियम तथा 40% सिरियम धातु प्रयुक्त होती है।
(ब) v2+ का इलेक्ट्रॉनिक विन्यास 3d3 होता है।
अयुग्मित इलेक्ट्रॉनों की संख्या (n) = 3
चुम्बकीय आघूर्ण μ = \(\sqrt{n(n+2)}\)
= \(\sqrt{3(3+2)}\)
= 3.87 B.M.
प्रश्न 15.
निम्न के कारण लिखिए।
(i) मैंगनीज (Z = 25) की तृतीय आयनन ऊर्जा अनापेक्षित रूप से उच्च होती है।
(ii) जलीय विलयन में Ti (Z = 22) की सर्वाधिक स्थायी ऑक्सीकरण अवस्था + 4 होती है।
उत्तर:
(i) मैंगनीज जिसका परमाणु क्रमांक 25 है, का इलेक्ट्रॉनिक विन्यास [Ar] 4s2 3d5 है, जबकि दो इलेक्ट्रॉनों के निकल जाने के बाद Mn का इलेक्ट्रॉनिक विन्यास Mn2+ = [Ar] 3d5 रह जाता है अर्थात् d. कक्षक अर्द्धपूरित होकर स्थायी विन्यास प्राप्त कर लेता है। अतः तृतीय इलेक्ट्रॉन को Mn2+ से निकालने के लिए अत्यधिक उच्च ऊर्जा की आवश्यकता होती है। यही कारण है कि Mn की तृतीय आयनन ऊर्जा अनापेक्षित रूप से उच्च होती है।
(ii) Ti (Z = 22) का इलेक्ट्रॉनिक विन्यास [Ar] 3d2 4s2 होता है। चार इलेक्ट्रॉनों के निकल जाने के बाद विन्यास स्थायी उत्कृष्ट गैस आर्गन के समान हो जाता है; अतः Ti की +4 ऑक्सीकरण अवस्था सर्वाधिक स्थायी होती है।

प्रश्न 16.
निम्नलिखित प्रेक्षणों को स्पष्ट कीजिए।
(i) d - श्रेणी के तत्व-श्रेणी के तत्वों की तुलना में अधिक संख्या में ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं।
(ii) Cu+ लवण रंगहीन जबकि Cu2+ लवण रंगीन होते हैं।
उत्तर:
(i) d - श्रेणी में अयुग्मित इलेक्ट्रॉनों की संख्या अधिक होती है जो कि आबन्ध निर्माण में भाग लेते हैं। इसका कारण कम प्रभावी नाभिकीय आवेश होता है। इस कारण से d-ब्लॉक के तत्व अधिक संख्या में ऑक्सीकरण संख्या प्रदर्शित करते हैं। वहीं f-ब्लॉक के तत्वों में f-कक्षकों के दुर्बल परिरक्षण प्रभाव के कारण नाभिकीय आवेश अधिक प्रभावी हो जाता है तथा आबन्ध निर्माण में कम इलेक्ट्रॉन भाग लेते हैं, इस कारण f- श्रेणी के तत्व कम मात्रा में
ऑक्सीकरण अवस्थाएँ प्रदर्शित करते हैं।
(ii) Cu+ आयन में अयुग्मित इलेक्ट्रॉन नहीं होते हैं, इस कारण इसमें d-d संक्रमण नहीं होता है। फलस्वरूप Cu+ आयन व इसके लवण रंगहीन होते हैं जबकि Cu2+ आयन में अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं, इस कारण did संक्रमण आसानी से होता है और Cu2+ आयन रंगीन हो जाते हैं। इन आयनों का व इनके लवणों का रंग नीला होता है।
प्रश्न 17.
कारण बताइए:
(i) निर्जल कॉपर सल्फेट सफेद है, परन्तु हाइड्रेटेड कॉपर सल्फेट नीला है।
(ii) Zn2+ आयनों के लवण सफेद, परन्तु Cu2+ के नीले होते हैं।
उत्तर:
(i) हाइड्रेटेड कॉपर सल्फेट में [Cu (H2O)4]2+ आयन पाया जाता है जो कि नीले रंग का होता है तथा यहाँ Cu2+ आयन मुक्त होता है जबकि निर्जल कॉपर सल्फेट में Cuआयन मुक्त नहीं होता है, इस . कारण यह सफेद रंग का होता है।
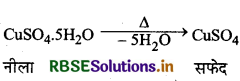
(ii) Zn2+ आयनों के लवण सफेद किन्तु Cu2+ के नीले होते हैं क्योंकि Zn2+ आयनों में d-कक्षक पूर्ण रूप से भरे होते हैं; अतः यहाँ d - d संक्रमण सम्भव नहीं होता है। जबकि Cu2+ आयनों में अयुग्मित इलेक्ट्रॉन की उपस्थिति के कारण d-d संक्रमण सम्भव है। इस कारण ये संक्रमण के लिए दृश्य प्रकाश से लाल रंग के प्रकाश को शोषित कर लेते हैं तथा नीले रंग के प्रकाश को उत्सर्जित करते हैं जिससे ये नीले रंग के दिखाई देते हैं।
प्रश्न 18.
निम्न आयनों का चुम्बकीय आघूर्ण ज्ञात कीजिए:
(i) M2+ आयन (Z = 29)
(ii) Cr2+ (जलीय). आयन
उत्तर:
(i) M2+ आयन (Z = 29) कॉपर का आयन है; क्योंकि Cu का परमाणु क्रमांक 29 होता है।
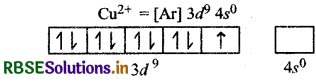
अयुग्मित इलेक्ट्रॉनों की संख्या (n) = 1
चुम्बकीय आघूर्ण (M) = \(\sqrt{n(n+2)}\)
= \(\sqrt{1(1+2)}\)
= 1.732 B.M.
(ii) Cr2+ आयन का इलेक्ट्रॉनिक विन्यास
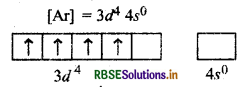
चुत्बकीय आघूर्ण μ = \(\sqrt{n(n+2)}\)
= \(\sqrt{4(4+2)}\)
= \(\sqrt{4 \times 6}\)
= 4.89 B.M.
प्रश्न 19.
संक्रमण तत्त्व परिवर्ती ऑक्सीकरण अवस्था का प्रदर्शन क्यों करते हैं?
उत्तर:
संक्रमण तत्वों का सामान्य इलेक्ट्रॉनिक विन्यास (n - 1)d1 - 10 ns1 - 2 हैं। (n - 1) d - कक्षकों तथा ns-कक्षकों की ऊर्जाओं में अधिक अन्तर नहीं होता है अत: संक्रमण तत्त्वों में, (n - 1)d तथा ns दोनों कक्षकों के आबन्ध निर्माण के लिए उपलब्ध रहती हैं। +1 तथा +2 ऑक्सीकरण अवस्थाओं में ns - कक्षकों के साथ (n - 1) d - इलेक्ट्रॉनों का भी योगदान होता है। उत्तेजित अवस्था में (n - 1) d. इलेक्ट्रॉन आबन्ध निर्माण में भाग लेने के लिए स्वतन्त्र हो जाते हैं तथा परमाणु विभिन्न ऑक्सीकरण अवस्थाएँ प्रदर्शित करने के योग्य हो जाता है। उदाहरण के लिए, Sc का बाह्य इलेक्ट्रॉनिक विन्साय 3d1 4s2 है। जब यह केवल 4s इलेक्ट्रॉनों का उपयोग करता हैं तो + 2 ऑक्सीकरण अवस्था प्रदर्शित करता है, परन्तु जब यह दोनों 4s - इलेक्ट्रॉनों के साथ एक 3d - इलेक्ट्रॉन का भी उपयोग करता है तो + 3 ऑक्सीकरण अवस्था प्रदर्शित करता है।
प्रश्न 20.
Lu (OH)3 की अपेक्षा La (OH)3 ज्यादा क्षारीय है, क्यों?
उत्तर:
Lu (OH)3 की अपेक्षा La(OH)3 ज्यादा क्षारीय होता है क्योंकि La लैन्थेनॉइड आकुंचन के कारण पहले वाले अर्थात् Lu की तुलना में ज्यादा सहसंयोजी लक्षण वाला होता है। इसमें OH- आयन की मुक्ति होती है। Lu(OH)3 ज्यादा कठिन है तथा La(OH)3 की अपेक्षा कम क्षारीय है।

प्रश्न 21.
क्या होता है जब।
(i) अम्लीकृत पोटैशियम परमैंगनेट आयन विलयन में एक ऑक्सेलेट आयन से अभिक्रिया करता है?
(ii) एक आयोडाइड आयन का विलयन अम्लीकृत डाइक्रोमेट आयन से अभिक्रिया करता है?
उत्तर:
(i) अम्लीकृत पोटैशियम परमैंगनेट की ऑक्सेलेट आयन से क्रिया
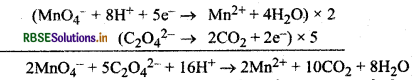
(ii) अम्लीकृत डाइक्रोमेट आयन की आयोडाइड आयन से क्रिया
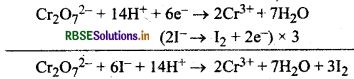
प्रश्न 22.
(i) [Ti(H2O)6]3+ रंगीन है जबकि [Sc(H2O)6]3+ रंगहीन है, क्यों?
(ii) संक्रमण धातुएँ आसानी से मिश्रधातु बनाती हैं, क्यों?
उत्तर:
(i) [Ti(H2O)6]3+, Ti3+ आयन में अयुग्मित इलेक्ट्रॉनों की उपस्थिति के कारण रंगीन है। ये अयुग्मित इलेक्ट्रॉन d - d संक्रमण प्रदर्शित करते हैं और रंगीन दिखने लगते हैं। जबकि [Sc(H2O)6]3+, Sc3+ में अयुग्मित इलेक्ट्रॉनों की अनुपस्थिति के कारण रंगहीन हैं।
(ii) संक्रमण धातुएँ आसानी से मिश्र धातुएँ बनाती हैं क्योंकि सभी . संक्रमण धातुओं के आकार लगभग समान होते हैं। अतः क्रिस्टल जालक में एक धातु दूसरी धातु को सरलता से विस्थापित करके स्थान ग्रहण कर सकती है और मिश्रधातु बन जाती है।
प्रश्न 23.
संक्रमण तत्व या -ब्लॉक तत्व कम क्रियाशील होते हैं, क्यों?
उत्तर:
संक्रमण तत्वों का सामान्य इलेक्ट्रॉनिक विन्यास है - (n - 1)d1 - 10 ns1 - 2 चूँकि d-उपकोश में स्थित इलेक्ट्रॉन बाह्यतम उपकोश में उपस्थित इलेक्ट्रॉनों को नाभिकीय आवेश से प्रभावी रूप से परिरक्षित नहीं कर पाते। इस कारण बाह्यतम कोश के इलेक्ट्रॉन परमाणु क्रमांक में वृद्धि के साथ अधिक दृढ़ता से बँध जाते हैं। इस प्रकार संक्रमण श्रेणी में इलेक्ट्रॉन को निकालने के लिए आवश्यक ऊर्जा का मान बढ़ जाता है। इस कारण उनकी आयनन ऊर्जा भी बढ़ जाती है। चूँकि बन्ध बनाने में (n - 1)d तथा ns दोनों उपकोश भाग लेते हैं अतः संक्रमण तत्वों की कणन एन्थैल्पी भी अधिक होती है तथा इनके गलनांक भी उच्च होते उच्च कणन एन्थैल्पी, उच्च ऊर्ध्वपातन एन्थैल्पी, उच्च गलनांक तथा उच्च आयनन एन्थैल्पी के कारण इन तत्वों की क्रियाशीलता कम होती हैं।
निबन्धात्मक प्रश्न:
प्रश्न 1.
संक्रमण तत्त्व क्या हैं? इनकी विशेषताओं को लिखिए।
या
संक्रमण तत्त्वों के अनुचुम्बकीय लक्षण को स्पष्ट कीजिए।
उत्तर:
वे तत्त्व जिनमें अन्तिम इलेक्ट्रॉन बाह्य कोश से पहले वाले कोश के पाँच d-कक्षक में से किसी भी एक कक्ष में प्रवेश करता है, 3d d-ब्लॉक के तत्त्व कहलाते हैं। इनमें विभेदी इलेक्ट्रॉन (n-1) -कक्षकों तक में प्रवेश पाता है। चूँकि इन तत्त्वों के गुण -ब्लॉक तथा p-ब्लॉक के तत्त्वों के गुणों के मध्यवर्ती होते हैं अतः इन्हें संक्रमण तत्त्व भी कहते हैं।
विशेषताएँ-संक्रमण तत्त्वों की विशेषताएँ निम्नलिखित हैं।
- इलेक्ट्रॉनिक विन्यास: संक्रमण तत्त्वों में बाह्यकोश से पिछले कोश के d ऑर्बिटलों में इलेक्ट्रॉन भर इसके बाह्यतम दो कोशों का विन्यास इस प्रकार होता है (n − 1)s2 (n − 1)p6 (n - 1)dl - 10 ns1 or 2 4s1 nso
- परिवर्ती ऑक्सीकरण अवस्थाएँ: d - ब्लॉक (संक्रमण) तत्त्वों में ns ऑर्बिटल और (n - 1)d ऑर्बिल दोनों के इलेक्ट्रॉन रासायनिक बन्ध बनाने में भाग लेते हैं। इसलिए संक्रमण तत्त्व परिवर्ती ऑक्सीकरण सात अवस्था प्रदर्शित करते हैं।
- उत्प्रेरक गुण: संक्रमण धातु और उनके यौगिकों में उत्प्रेरकीय गुण होते हैं। यह गुण उनकी परिवर्ती संयोजकता एवं उनके पृष्ठ पर उपस्थित मुक्त संयोजकताओं के कारण होता है।
- रंगीन आयन व रंगीन यौगिक बनाने की प्रवृत्ति: संक्रमण तत्त्वों में d ऑर्बिटल आंशिक रूप से भरे होने के कारण ये रंगीन आयन व रंगीन यौगिक बनाते हैं।
- आयनन विभव में परिवर्तन: संक्रमण धातुओं के प्रथम आयनन विभव दीर्घ आवर्गों में स्थित s-ब्लॉक और p ब्लॉक तत्त्वों के आयनन उन विभवों के बीच के हैं। प्रथम संक्रमण श्रेणी में तत्त्वों के प्रथम आयनन विभवों के मान 6 से 10 eV के मध्य है। किसी संक्रमण धातु परमाणु के कार उत्तरोत्तर (successive) आयनन विभव कम से बढ़ते हैं। संक्रमण धातु क्षार धातुओं (उपवर्ग IA) और क्षारीय मृदा-धातुओं (उपवर्ग IIA) से कम धन विद्युत होने के कारण आयनिक और सहसंयोजक दोनों प्रकार के यौगिक बनाते हैं।
- चुम्बकीय लक्षण: अनेक संक्रमध्स तत्त्व उनके यौगिक अनुचुम्बकीय हैं। इसका कारण उनमें (n - 1)d कक्षकों में अयुग्मित इलेक्ट्रॉनों की उपस्थिति है। किसी संक्रमण श्रेणी में बायें से दायें जाने पर जैसे-जैसे अयुग्मि इलेक्ट्रॉनों की संख्या एक से पाँच तक बढ़ती है, संक्रमण धातु आयन में अनुचुम्बकीय लक्षण बढ़ता है। अधिकतम अनुचुम्बकीय लक्षण श्रेणी के बीच में पाया जाता है और आगे जाने पर अनुचुम्बकीय लक्षण अयुग्मित इलेक्ट्रॉनों की संख्या कम होने से घटता है। वे संक्रमण धातु अथवा आयन जिनमें इलेक्ट्रॉन युग्मित होते हैं, प्रतिचुम्बकीय होते हैं।
प्रश्न 2.
संक्रमण तत्त्वों को वर्गीकृत कीजिए तथा आवर्त सारणी में इनका स्थान निर्धारित कीजिए।
उत्तर:
संक्रमण तत्त्वों का वर्गीकरण-संक्रमण तत्त्वों का वर्गीकरण (n - 1) d-कक्षकों के आधार पर किया गया है। इस आधार पर संक्रमण तत्त्वों को चार श्रेणियों में विभाजित किया गया है जिन्हें संक्रमण श्रेणियाँ (transition series) कहते हैं। प्रत्येक श्रेणी (n - 1) d -कक्षक में इलेक्ट्रॉन-प्रवेश के क्रम के अनुसार है। ये संक्रमण श्रेणियाँ (transition series) कहते हैं। प्रत्येक श्रेणी (n - 1) d - कक्षक में इलेक्ट्रॉन-प्रवेश के क्रम के अनुसार है।
ये संक्रमण श्रेणियाँ निम्नलिखित हैं।
- प्रथम संक्रमण श्रेणी अथवा 3d-श्रेणी-इस श्रेणी में इलेक्ट्रॉन 3d-कक्षक में प्रवेश पाता है। इस श्रेणी में Sc(Z = 21) से Zn (Z = 30) तक 10 तत्त्व हैं। ये तत्त्व आवर्त सारणी के चतुर्थ आवर्त में स्थित हैं।
- द्वितीय संक्रमण श्रेणी अथवा 4d-श्रेणी-इस श्रेणी में इलेक्ट्रॉन 4d-कक्षक में प्रवेश पाता है। इस श्रेणी में 10 तत्त्व Y(Z = 39) से Cd (Z = 48) हैं। ये तत्त्व आवर्त सारणी के पाँचवे आवर्त में स्थित हैं।
- तृतीय संक्रमण श्रेणी अथवा 5d-श्रेणी-इस श्रेणी में इलेक्ट्रॉन 5d-कक्षक में प्रवेश पाता है। इस श्रेणी में 10 तत्त्व La (Z = 57) तथा Hf (Z = 72) से Hg (Z = 80) हैं। ये तत्त्व आवर्त सारणी के छठे आवर्त में स्थित हैं।
- चतुर्थ संक्रमण श्रेणी अथवा 6d-श्रेणी-इस श्रेणी में इलेक्ट्रॉन 6d-कक्षक में प्रवेश पाता है। इस श्रेणी में 10 तत्त्व Ac (Z = 89) तथा Rf (2 - 104) से कॉपरनिसियम (Z = 112) हैं। ये तत्त्व आवर्त सारणी के सातवें आवर्त में स्थित हैं।
आवर्त सारणी में स्थिति-आवर्त सारणी में संक्रमण तत्त्व (dब्लॉक तत्त्व) समूह 2 तथा समूह 13 के मध्य स्थित हैं। d-ब्लॉक तत्त्व - ब्लॉक तथा p-ब्लॉकों के मध्य स्थित हैं। d-ब्लॉक तत्वों को संक्रमण की संज्ञा इसी कारण ही प्रदान की गई है। S-ब्लॉक के तत्त्व अत्यधिक विद्युत धनात्मक होते हैं तथा आयनिक यौगिकों के निर्माण की प्रवृत्ति प्रदर्शित करते हैं। इसके विपरीत p-ब्लॉक के तत्त्व विद्युत ऋणात्मक होते हैं और इनमें सहसंयोजी यौगिकों को बनाने की प्रवृत्ति होती है। d-ब्लॉक तत्त्व इन दोनों के मध्य एक संक्रमण व्यवहार प्रदर्शित करते हैं अर्थात् उनका व्यवहार अत्यधिक विघुत धनात्मक s-ब्लॉक तत्त्वों तथा अत्यन्त दुर्बल रूप से विद्युत धनात्मक p-ब्लॉक तत्त्वों के मध्य का होता है। इस कारण ही d-ब्लॉक तत्त्वों को संक्रमण तत्त्व (transition elements) कहा जाता है।

प्रश्न 3.
लैन्थेनॉइडों के सामान्य अभिलक्षणों का वर्णन कीजिए।
उत्तर:
(i) भौतिक गुण (Physical Properties): सभी लैन्थेनॉइड धातु होते हैं। ये चाँदी की तरह श्वेत व नरम धातुएँ हैं और ये वायु में तुरन्त बदरंग हो जाती हैं। ये ऊष्मा और विद्युत् के अच्छे चालक होते हैं। इन धातुओं के घनत्व अत्यधिक होते हैं। इनके घनत्व 6 - 77 g/cm3 से लेकर 9.74 g/cm3 के मध्य होते हैं। इन तत्वों का घनत्व परमाणु क्रमांक के बढ़ने पर बढ़ता जाता है। इनके गलनांक काफी उच्च होते हैं। ये 1000 K से 1200K के मध्य पिघलते हैं। सेमेरियम (Sm) का गलनांक 1623K होता है।
(ii) आयनन एन्थैल्पी (Ionisation Enthalphy): लैन्थेनॉयडों की प्रथम आयनन एन्थैल्पियों का मान 600 kJ mol-I के आस-पास होता है। द्वितीय आयन एन्थैल्पी का मान लगभग 1200 kJmol-1 है, जो कैल्शियम के समतुल्य है।कम आयनन विभव होने के कारण ये तत्व अत्यधिक धनविद्युती होते हैं अतः ये ठण्डे व गर्म दोनों प्रकार के जल से हाइड्रोजन गैस को मुक्त करते हैं। यद्यपि ठण्डे जल के साथ इन तत्वों की अभिक्रिया धीमी परन्तु गर्म जल के साथ अत्यधिक तीव्र होती है।
(iii) मानक अपचयन विभव (Standard reduction potential): इन तत्वों के मानक अपचयन विभव का मान -2.2V से - 2.47 के मध्य होता है। यहाँ Eu एक अपवाद है। इसके मानक अपचयन विभव का मान –2.0V होता है।
(iv) रंग (Colour): लैन्थेनॉइडों के अधिकतर आयन रंगीन होते हैं। इन आयनों का रंग - कक्षकों के संक्रमण के कारण होता है। ऐसे आयन जिनमें एक भी इलेक्ट्रॉन अयुग्मित नहीं होता है रंगहीन होते हैं, जैसे - La3+ (4s0), Lu3+ (4f14) ऐसे आयन जिनमें अयुग्मित इलेक्ट्रॉन होते हैं प्रायः रंगीन होते हैं।

अपवाद (Exception): धनायन, जैसे - Ce3+ (4f1) और Yb3+ (4f13) आदि रंगहीन होते हैं यद्यपि इनमें अयुग्मित -इलेक्ट्रॉन उपस्थित होते हैं। इनकी व्याख्या करना असम्भव है।
(v) चुम्बकीय गुण (Magnetic Properties): ऐसे आयन जिनमें अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं वे प्रायः अनुचुम्बकीय प्रकृति के होते है।
(vi) रासायनिक अभिक्रियाशीलता (Chemical Reactivity)लैन्थेनॉइड तत्वों (Ln) में प्रथम तीन आयनन ऊर्जाओं के मान का योग काफी कम होता है, अत: ये तत्व आयनिक होते हैं तथा इनकी स्थायी अवस्था + 3 ऑक्सीकरण अवस्था होती है। लैन्थेनॉइडों का रसायन भी Ln3+ आयनों पर आधारित होता है।
(a) अपचायक गुण (Reducing Property) लैन्थेनॉइड तीव्र गति से अपने तीन इलेक्ट्रॉन त्यागकर ऑक्सीकृत हो जाते हैं तथा प्रबल अपचायक के समान व्यवहार करते हैं।
Ln → Ln3+ + 3e-
(b) विद्युत धनी प्रकृति (Electro-positive Nature): शीघ्रता से इलेक्ट्रॉन त्यागने की प्रकृति इनकी प्रबल विद्युत् धनी प्रकृति अथवा धात्विक प्रवृत्ति को प्रदर्शित करती है।
(c) जल से अभिक्रिया (Reaction with water): लैन्थेनॉइड जल से अभिक्रिया करके हाइड्रोजन गैस मुक्त करते हैं। ठण्डे जल से इनकी क्रिया मन्द गति से जबकि गर्म जल से तीव्र गति से होती है।
2Ln + H2O + 2Ln(OH)3 + 3H2↑
हाइड्रॉक्साइडों की क्षारकता Ce से Lu तक घटती है।
(d) ऑक्सीजन के साथ अभिक्रिया (Reaction with Oxygen)लैन्थेनॉइड वायुमण्डलीय ऑक्सीजन से अभिक्रिया करके ऑक्साइड बनाते हैं।
2Ln + 3O2 + 2Ln3O3
(e) हाइड्रोजन से अभिक्रिया (Reaction with Hydrogen): 300 से 400°C तक गर्म करने पर ये हाइड्रोजन के साथ अभिक्रिया करते हैं तथा अरससमीकरणमितीय (non - stoichiometric) प्रकार के LnH2 तथा LnH1 प्रकार के हाइड्राइड बनाते हैं।
(f) हैलोजेनों के साथ अभिक्रिया (Reaction with Halogens): लैन्थेनॉइड हैलोजेनों के साथ क्रिया करके ट्राइहैलाइड बनाते हैं।
3Ln + 3X2 → 2LnX3
(g) अधातुओं के साथ अभिक्रिया (Reaction with Nonmetals): लैन्थेनॉइड उच्च ताप पर कार्बन, नाइट्रोजन, सल्फर आदि के साथ द्विअंगी यौगिक (Binary Compounds) बनाते हैं।
प्रश्न 4.
लैन्थेनॉइड संकुचन क्या है? इसके प्रभावों का वर्णन जिए।
उत्तर:
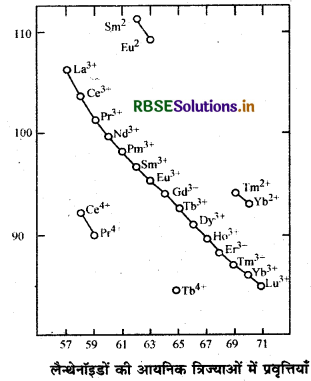
लैन्थेनॉइड श्रेणी में लैन्थेनम से ल्यूटीशियम तक के तत्वों की परमाणु त्रिज्या में कुछ अपवादों को छोड़कर कमी होती है। इसी प्रकार + 3 ऑक्सीकरण अवस्था में La3+ से Lu3+ तक आयनिक त्रिज्या में निरन्तर कमी होती है। इसे लैन्थेनॉइड संकुचन (Lanthanoid contraction) कहते हैं।
लैन्थेनॉइड संकुचन के कारण (Causes of Lanthanoid Contraction): लैन्थेनॉइड श्रेणी में परमाणु क्रमांक बढ़ने के साथ-साथ प्रत्येक पद पर नाभिकीय आवेश में एक इकाई की वृद्धि होती है एवं साथ ही पूर्व उपान्त्य कोश (prepenultimate shell) के 4f -कक्षकों में एक इलेक्ट्रॉन जुड़ता है, एवं परमाणु का बाह्य इलेक्ट्रॉनिक विन्यास सामान्यतः 5s25p66s2 बना रहता है।
f -कक्षकों की आकृति एवं विस्तार के कारण एक 4f -इलेक्ट्रॉन दूसरे 4f-इलेक्ट्रॉन को अपूर्ण रूप से ही परिरक्षित (shield) कर पाता है। अतः श्रेणी में परमाणु क्रमांक के बढ़ने पर प्रत्येक पद के लिए 4f -कक्षकों में उपस्थित इलेक्ट्रॉनों पर अपेक्षाकृत प्रभावी नाभिकीय आवेश में थोड़ी-थोड़ी वृद्धि होती जाती है, इस प्रकार 4f उपकोश के आकार में कुछ कमी आती है एवं इसका प्रभाव यह होता है कि बाह्य कोशों के इलेक्ट्रॉन अभ्र, पूर्ववर्ती तत्व की तुलना में थोड़ा सिक्ड़ जाते हैं तथा परमाण्वीय त्रिज्या में कमी आ जाती है। यद्यपि त्रिज्या में बहुत कम ही कमी आती है। लैन्थेनॉइड के 14 तत्वों अर्थात् Ce से Lu तक यह कमी केवल 15pm है।
लैन्थेनॉइड संकुचन के प्रभाव (Effects of Lanthanoid Contraction):
- लैन्थेनॉइड संकुचन के प्रभाव से लैन्थेनॉइड तत्वों के क्षारकीय गुण में क्रमशः कमी होती जाती है। इस गुण में क्रमिक परिवर्तन का उपयोग इनके पृथक्करण के लिए किया जाता है। यहाँ पर Ce(OH)3 प्रबल क्षारीय एवं LU(OH)3 दुर्बल क्षारीय होता है।
- लैन्थेनॉइड संकुचन के कारण, इस श्रेणी के बाद के तत्वों Hf, Ta, W आदि) की परमाणु त्रिज्याएँ, द्वितीय संक्रमण श्रेणी में स्थित संगत तत्वों (क्रमशः Zr, Nb, Mo आदि) की आयनिक त्रिज्याओं के एकदम बराबर हो जाती हैं। इसके फलस्वरूप आवर्त सारणी में अत्यन्त निकट समानता वाले Zr - Hf, Nb-Ta तथा Mo -W जैसे जुड़वां तत्व पाये जाते हैं।
- लैन्थेनॉइड संकुचन के कारण ही तृतीय संक्रमण-श्रेणी के तत्वों के क्षारकीय गुण प्रथम और द्वितीय संक्रमण श्रेणियों के तत्वों से कम, किन्तु आयनन ऊर्जाएँ अपेक्षाकृत अधिक उच्च (High) होती हैं।
प्रश्न 5.
लैन्थेनॉइड तत्वों के प्रमुख उपयोग लिखिए।
उत्तर:(i) भौतिक गुण (Physical Properties): सभी लैन्थेनॉइड धातु होते हैं। ये चाँदी की तरह श्वेत व नरम धातुएँ हैं और ये वायु में तुरन्त बदरंग हो जाती हैं। ये ऊष्मा और विद्युत् के अच्छे चालक होते हैं। इन धातुओं के घनत्व अत्यधिक होते हैं। इनके घनत्व 6 - 77 g/cm3 से लेकर 9.74 g/cm3 के मध्य होते हैं। इन तत्वों का घनत्व परमाणु क्रमांक के बढ़ने पर बढ़ता जाता है। इनके गलनांक काफी उच्च होते हैं। ये 1000 K से 1200K के मध्य पिघलते हैं। सेमेरियम (Sm) का गलनांक 1623K होता है।
(ii) आयनन एन्थैल्पी (Ionisation Enthalphy): लैन्थेनॉयडों की प्रथम आयनन एन्थैल्पियों का मान 600 kJ mol-I के आस-पास होता है। द्वितीय आयन एन्थैल्पी का मान लगभग 1200 kJmol-1 है, जो कैल्शियम के समतुल्य है।कम आयनन विभव होने के कारण ये तत्व अत्यधिक धनविद्युती होते हैं अतः ये ठण्डे व गर्म दोनों प्रकार के जल से हाइड्रोजन गैस को मुक्त करते हैं। यद्यपि ठण्डे जल के साथ इन तत्वों की अभिक्रिया धीमी परन्तु गर्म जल के साथ अत्यधिक तीव्र होती है।
(iii) मानक अपचयन विभव (Standard reduction potential): इन तत्वों के मानक अपचयन विभव का मान -2.2V से - 2.47 के मध्य होता है। यहाँ Eu एक अपवाद है। इसके मानक अपचयन विभव का मान –2.0V होता है।
(iv) रंग (Colour): लैन्थेनॉइडों के अधिकतर आयन रंगीन होते हैं। इन आयनों का रंग - कक्षकों के संक्रमण के कारण होता है। ऐसे आयन जिनमें एक भी इलेक्ट्रॉन अयुग्मित नहीं होता है रंगहीन होते हैं, जैसे - La3+ (4s0), Lu3+ (4f14) ऐसे आयन जिनमें अयुग्मित इलेक्ट्रॉन होते हैं प्रायः रंगीन होते हैं।

अपवाद (Exception): धनायन, जैसे - Ce3+ (4f1) और Yb3+ (4f13) आदि रंगहीन होते हैं यद्यपि इनमें अयुग्मित -इलेक्ट्रॉन उपस्थित होते हैं। इनकी व्याख्या करना असम्भव है।
(v) चुम्बकीय गुण (Magnetic Properties): ऐसे आयन जिनमें अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं वे प्रायः अनुचुम्बकीय प्रकृति के होते है।
(vi) रासायनिक अभिक्रियाशीलता (Chemical Reactivity)लैन्थेनॉइड तत्वों (Ln) में प्रथम तीन आयनन ऊर्जाओं के मान का योग काफी कम होता है, अत: ये तत्व आयनिक होते हैं तथा इनकी स्थायी अवस्था + 3 ऑक्सीकरण अवस्था होती है। लैन्थेनॉइडों का रसायन भी Ln3+ आयनों पर आधारित होता है।
- (a) अपचायक गुण (Reducing Property) लैन्थेनॉइड तीव्र गति से अपने तीन इलेक्ट्रॉन त्यागकर ऑक्सीकृत हो जाते हैं तथा प्रबल अपचायक के समान व्यवहार करते हैं। Ln → Ln3+ + 3e-
- विद्युत धनी प्रकृति (Electro-positive Nature): शीघ्रता से इलेक्ट्रॉन त्यागने की प्रकृति इनकी प्रबल विद्युत् धनी प्रकृति अथवा धात्विक प्रवृत्ति को प्रदर्शित करती है।
- जल से अभिक्रिया (Reaction with water): लैन्थेनॉइड जल से अभिक्रिया करके हाइड्रोजन गैस मुक्त करते हैं। ठण्डे जल से इनकी क्रिया मन्द गति से जबकि गर्म जल से तीव्र गति से होती है। 2Ln + H2O + 2Ln(OH)3 + 3H2↑
- हाइड्रॉक्साइडों की क्षारकता Ce से Lu तक घटती है।
- ऑक्सीजन के साथ अभिक्रिया (Reaction with Oxygen)लैन्थेनॉइड वायुमण्डलीय ऑक्सीजन से अभिक्रिया करके ऑक्साइड बनाते हैं। 2Ln + 3O2 + 2Ln3O3
- हाइड्रोजन से अभिक्रिया (Reaction with Hydrogen): 300 से 400°C तक गर्म करने पर ये हाइड्रोजन के साथ अभिक्रिया करते हैं तथा अरससमीकरणमितीय (non - stoichiometric) प्रकार के LnH2 तथा LnH1 प्रकार के हाइड्राइड बनाते हैं।हैलोजेनों के साथ अभिक्रिया (Reaction with Halogens): लैन्थेनॉइड हैलोजेनों के साथ क्रिया करके ट्राइहैलाइड बनाते हैं। 3Ln + 3X2 → 2LnX3
- अधातुओं के साथ अभिक्रिया (Reaction with Nonmetals): लैन्थेनॉइड उच्च ताप पर कार्बन, नाइट्रोजन, सल्फर आदि के साथ द्विअंगी यौगिक (Binary Compounds) बनाते हैं।

प्रश्न 6.
ऐक्टिनॉइड तत्वों के सामान्य अभिलक्षण लिखिए।
उत्तर:
(i) भौतिक गुण (Physical Properties): सभी ऐक्टिनॉइड धातुएँ चाँदी की तरह चमकती हैं। इनके गलनांक उच्च होते हैं। परन्तु गलनांकों के मान संक्रमण धातुओं के गलनांकों की तुलना में कम होते हैं। इनके घनत्व उच्च होते हैं।
(ii) आयनों के रंग (Colour of Ions): ऐक्टिनॉइडों के आयन सामान्यतः रंगीन होते हैं। इनके आयनों का रंग इनमें उपस्थित 5f इलेक्ट्रॉनों की संख्या पर निर्भर करते हैं। ऐसे आयन, जिनके 5f -उपकोशों में एक भी इलेक्ट्रॉन नहीं होता 5f0 या यह अर्द्धभरित 5f7 होता है, तो वे रंगहीन होते हैं। 5f -उपकोश में 2 से 6 तक इलेक्ट्रॉन रखने वाले आयन क्रिस्टल रूप में तथा जलीय विलयन दोनों में रंगीन होते हैं। रंगों का कारण f - f संक्रमण है।
(iii) चुम्बकीय गुण (Magnetic Properties): ऐक्टिनॉइडों के अधिकतर आयनों में अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं जिसके कारण इनका व्यवहार अनुचुम्बकीय होता है। इनके अनुचुम्बकत्व का मान केवल चक्रण सूत्र (only spin formula) से निकाल सकते हैं।
μ = \(\sqrt{n(n+2)}\) BM
(iv) संकुल निर्माण (Complex Formation): ऐक्टिनॉइडों की संकुल बनाने की प्रकृति लैन्थेनॉइडों से अधिक होती है। इसका कारण उनके आयनों पर अधिक आवेश एवं उनका छोटा आकार होता है। संकुल निर्माण करने की प्रवृत्ति इन आयनों में निम्न प्रकार से है:
M4+ > MO22+ > M3+ > MO2+
(v) रासायनिक गुण (Chemical Properties): कम आयनन विभव के मान एवं उच्च धनविद्युती गुण के कारण ऐक्टिनॉइडों की रासायनिक अभिक्रिया तीव्र होती हैं। ऐक्टिनॉइड अत्यधिक अभिक्रियाशील धातुएँ हैं, विशेषकर जब वे सूक्ष्म विभाजित हों। इन पर उबलते हुए जल की क्रिया से ऑक्साइड तथा हाइड्राइड का मिश्रण प्राप्त होता है और अधिकांश अधातुओं से संयोजन सामान्य ताप पर होता है। HCl सभी धातुओं को प्रभावित करता है, परन्तु अधिकतर धातुएँ नाइट्रिक अम्ल द्वारा, अल्प प्रभावित होती हैं। इसका कारण यह है कि इन धातुओं पर ऑक्साइड की संरक्षी सतह बन जाती है। क्षारों का इन धातुओं पर कोई प्रभाव नहीं पड़ता। ऐक्टिनॉइडों के लगभग सभी तत्व रेडियोऐक्टिव होते हैं।
प्रश्न 7.
लैन्थेनॉइड तथा ऐक्टिनॉइड तत्वों में विभिन्न समानताओं सूचीबद्ध कीजिए।
उत्तर:
(i) भौतिक गुण (Physical Properties): सभी ऐक्टिनॉइड धातुएँ चाँदी की तरह चमकती हैं। इनके गलनांक उच्च होते हैं। परन्तु गलनांकों के मान संक्रमण धातुओं के गलनांकों की तुलना में कम होते हैं। इनके घनत्व उच्च होते हैं।
(ii) आयनों के रंग (Colour of Ions): ऐक्टिनॉइडों के आयन सामान्यतः रंगीन होते हैं। इनके आयनों का रंग इनमें उपस्थित 5f इलेक्ट्रॉनों की संख्या पर निर्भर करते हैं। ऐसे आयन, जिनके 5f -उपकोशों में एक भी इलेक्ट्रॉन नहीं होता 5f0 या यह अर्द्धभरित 5f7 होता है, तो वे रंगहीन होते हैं। 5f -उपकोश में 2 से 6 तक इलेक्ट्रॉन रखने वाले आयन क्रिस्टल रूप में तथा जलीय विलयन दोनों में रंगीन होते हैं। रंगों का कारण f - f संक्रमण है।
(iii) चुम्बकीय गुण (Magnetic Properties): ऐक्टिनॉइडों के अधिकतर आयनों में अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं जिसके कारण इनका व्यवहार अनुचुम्बकीय होता है। इनके अनुचुम्बकत्व का मान केवल चक्रण सूत्र (only spin formula) से निकाल सकते हैं।
μ = \(\sqrt{n(n+2)}\) BM
(iv) संकुल निर्माण (Complex Formation): ऐक्टिनॉइडों की संकुल बनाने की प्रकृति लैन्थेनॉइडों से अधिक होती है। इसका कारण उनके आयनों पर अधिक आवेश एवं उनका छोटा आकार होता है। संकुल निर्माण करने की प्रवृत्ति इन आयनों में निम्न प्रकार से है:
M4+ > MO22+ > M3+ > MO2+
(v) रासायनिक गुण (Chemical Properties): कम आयनन विभव के मान एवं उच्च धनविद्युती गुण के कारण ऐक्टिनॉइडों की रासायनिक अभिक्रिया तीव्र होती हैं। ऐक्टिनॉइड अत्यधिक अभिक्रियाशील धातुएँ हैं, विशेषकर जब वे सूक्ष्म विभाजित हों। इन पर उबलते हुए जल की क्रिया से ऑक्साइड तथा हाइड्राइड का मिश्रण प्राप्त होता है और अधिकांश अधातुओं से संयोजन सामान्य ताप पर होता है। HCl सभी धातुओं को प्रभावित करता है, परन्तु अधिकतर धातुएँ नाइट्रिक अम्ल द्वारा, अल्प प्रभावित होती हैं। इसका कारण यह है कि इन धातुओं पर ऑक्साइड की संरक्षी सतह बन जाती है। क्षारों का इन धातुओं पर कोई प्रभाव नहीं पड़ता। ऐक्टिनॉइडों के लगभग सभी तत्व रेडियोऐक्टिव होते हैं।
प्रतियोगी परीक्षा में पूछे जाने वाले प्रश्न:
बहुविकल्पीय प्रश्न:
प्रश्न 1.
मैंगनेट तथा परमैंगनेट आयन जिस कारण से चतुष्फलकीय है, वह
(a) π - आबन्धन में मैगनीज़ के d - कक्षक के साथ ऑक्सीजन के d - कथक का अतिव्यापन होता है।
(b) π - -आबन्धन में मैंगनीज़ के d-अक्षक के साथ ऑक्सीजन के p - कक्षक का अतिव्यापन होता है।
(c) π - आबन्धन नहीं है।
(d) π - आबन्धन में मैंगनीज़ के p - कक्षक के साक्ष ऑक्सीजन के p - कक्षक का अतिव्यापन होता है।
उत्तर:
(c) π - आबन्धन नहीं है।
प्रश्न 2.
निम्नलिखित में से कौन-सा आयन d-d संक्रमण दर्शाता है तथा साथ ही अनुचुम्बकत्व भी?
(a) MnO4-
(b) Cr2O72-
(c) CrO42-
(d) MnO42-
उत्तर:
(c) CrO42-

प्रश्न 3.
कॉलम I में दिए गए धातु आयनों को कॉलम II में दिए गए आयनों के चक्रण चुम्बकीय आधूणों से मिलाइए तथा सही संकेत को निर्दिष्ट कीजिए।
कॉलम-I
A. CO3+
B. Cr3+
C. Fe3+
D. Ni2+
कॉलम-II
(i) \(\sqrt{8}\) B.M
(ii) \(\sqrt{35}\) B.M
(iii) \(\sqrt{3}\) B.M
(iv) imm B.M
(v) im B.M
A B C D
(a) (iv) (i) (ii) (iii)
(b) (i) (ii) (ii) (iv)
(c) (iv) (v) (i) (i)
(d) (iii) (v) (i) (ii)
उत्तर:
(b) (i) (ii) (ii) (iv)
प्रश्न 4.
HgCl2 एवं I2 दोनों को I- आयन युक्त जल में घोलन पर बनने वाली स्पीशीज़ युग्म हैं:
(a) HgI2, I-3
(b) HgI2, I-
(c) HgI42-, I3
(d) Hg2I2, I-
उत्तर:
(b) HgI2, I-
प्रश्न 5.
उस गैस का नाम बताइए जो कि अम्लीकृत KMnO के विलयन को आसानी से रंगहीन कर देती है:
(a) CO2
(b) SO2
(c) NO2
(d) P2O5
उत्तर:
(a) CO2
प्रश्न 6.
ऐक्टिनॉयडों में ऑक्सीकरण अवस्था का परास अधिक होने का कारण है
(a) ऐक्टिनॉयडों की रेडियोऐक्टिव प्रकृति
(b) ऐक्टिनॉयड आंकुचन
(c) 5f, 6d तथा 7s स्तरों की समतुल्य ऊर्जा
(d) 4f एवं 5d स्तरों की ऊर्जाएँ आस-पास में।
उत्तर:
(c) 5f, 6d तथा 7s स्तरों की समतुल्य ऊर्जा
प्रश्न 7.
निम्न कथनों में से कौन-सा लैंथेनॉन के संदर्भ में गलत है?
(a) सभी लैंथेनॉन, ऐल्युमीनियम की अपेक्षा अत्यधिक क्रियाशील हैं।
(b) आयतनी विश्लेषण में ऑक्सीकारक के रूप में Ce (+4) विलयनों का वृहद् रूप में उपयोग किया जाता है।
(c) यूरोपियम +2 ऑक्सीकरण अवस्था दर्शाता है।
(d) Pr से Lu तक आयनिक त्रिज्या के घटाने के साथ क्षारकता घटती है।
उत्तर:
(b) आयतनी विश्लेषण में ऑक्सीकारक के रूप में Ce (+4) विलयनों का वृहद् रूप में उपयोग किया जाता है।
प्रश्न 8.
निम्नलिखित में से कौन-सा कथन सत्य है जब SO2 को अम्लीय K2Cr2O7 के विलयन में से पास किया जाता है?
(a) SO2 अपचयित होता है।
(b) हरा Cr2(SO4)3 बनता है।
(c) विलयन नीला पड़ जाता है।
(d) विलयन रंगहीन हो जाता है।
उत्तर:
(c) विलयन नीला पड़ जाता है।
प्रश्न 9.
Eu (प.स. 63), Gd ( प.स. 64) और Tb (प.स. 65) के इलेक्ट्रॉनिक विन्यास है:
(a) [Xe] 4f6 5d1 6s2,[Xe]4f7 5d1 6s2 और [Xe] 4f8 5d1 6s2
(b) [Xe]4f7 5d1 6s2, Xe]4f7 5d1 6s2 और [Xe]4f8 6s2
(c) [Xe] 4f7 5d1 6s2,[Xe] 4f8 6s2 और [Xe] 4f8 5d1 6s2
(d) [Xe] 4f6 5d1 6s2,[Xe]4f7 5d1 6s2 और [Xe]4f9 6s2
उत्तर:
(d) [Xe] 4f6 5d1 6s2,[Xe]4f7 5d1 6s2 और [Xe]4f9 6s2

प्रश्न 10.
निम्नलिखित में से d - कक्षकों के किस युग्म में इलेक्ट्रॉन घनत्व अक्षों के अनुदिश है?
(a) dxy dx2 - y2
(b) d2Z dxz
(c) dXZ, dYZ
(d) dZ2', dX2- Y2
उत्तर:
(d) dZ2', dX2- Y2
