RBSE Class 12 Chemistry Important Questions Chapter 7 p-ब्लॉक के तत्व
Rajasthan Board RBSE Class 12 Chemistry Important Questions Chapter 7 p-ब्लॉक के तत्व Important Questions and Answers.
Rajasthan Board RBSE Solutions for Class 12 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 12. Students can also read RBSE Class 12 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 12 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 12 Chemistry Chapter 7 Important Questions p-ब्लॉक के तत्व
बहुविकल्पीय प्रश्न:
प्रश्न 1.
निम्नलिखित में सर्वाधिक स्थायी है:
(1) ASH3
(2) SbH3
(3) PH3
(4) NH3
उत्तर:
(4) NH3
प्रश्न 2.
सफेद फॉस्फोरस को किस द्रव में रखते हैं?
(1) जल
(2) केरोसीन
(3) एथिल ऐल्कोहॉल
(4) क्लोरोफॉर्म
उत्तर:
(1) जल

प्रश्न 3.
निम्नलिखित में से किसकी अभिक्रिया से फॉस्फोरस से फॉस्फीन बनाया जाता है?
(1) HCl
(2) NaOH
(3) CO2
(4) CO2
उत्तर:
(2) NaOH
प्रश्न 4.
अमोनिया और फॉस्फीन गैसों के कौन-से निम्नलिखित गुण में भिन्नता है?
(1) अणु संरचनाओं में
(2) क्लोरीन के साथ अभिक्रियाओं में
(3) अपचायक गुण में
(4) वायु में जलने में
उत्तर:
(3) अपचायक गुण में
प्रश्न 5.
SO2 अणु में सल्फर परमाणु का संकरण है:
(1) sp
(2) sp2
(3) sp3
(4) sp3d2
उत्तर:
(2) sp2
प्रश्न 6.
प्रबल विद्युत ऋणात्मक हैलोजन है:
(1) F2
(2) Cl2
(3) Br2
(4) I2
उत्तर:
(1) F2
प्रश्न 7.
सर्वाधिक इलेक्ट्रॉन बन्धुता वाला तत्व है:
(1) N
(2) O
(3) Cl
(4) F
उत्तर:
(3) Cl
प्रश्न 8.
F, CI, Br तथा I तत्वों के इलेक्ट्रॉन बन्धुता का सही क्रम है:
(1) Cl > F > Br > I
(2) I > Br > CI > F
(3) F > Br > Cl > I
(4) F > CI > Br > I
उत्तर:
(1) Cl > F > Br > I

प्रश्न 9.
निम्न में से कौन-सा कथन सही है?
(1) NO2 नाइट्रिक अम्ल का ऐनहाइड्राइड है
(2) CO फॉर्मिक अम्ल का ऐनहाइड्राइड है
(3) Cl2O3 हाइपोक्लोरस अम्ल का ऐनहाइड्राइड है
(4) Cl2O7 परक्लोरिक अम्ल का ऐनहाइड्राइड है
उत्तर:
(4) Cl2O7 परक्लोरिक अम्ल का ऐनहाइड्राइड है
प्रश्न 10.
निम्न में से विस्फोटक है:
(1) Hg2Cl2
(2) PCl3
(3) NCI3
(4) SbCl3
उत्तर:
(3) NCI3
प्रश्न 11.
क्लोरीन का प्रबलतम ऑक्सी अम्ल है:
(1) HCIO2
(2) HCIO4
(3) HCIO
(4) HCIO3
उत्तर:
(2) HCIO4
प्रश्न 12.
निष्क्रिय गैसों की खोज का श्रेय जाता है:
(1) रैले को
(2) विलियम रैमसे को
(3) जॉनसन को
(4) डेवार को
उत्तर:
(1) रैले को
प्रश्न 13.
वायुमण्डल में सर्वाधिक पायी जाने वाली गैस है:
(1) हीलियम
(2) निऑन
(3) आर्गन
(4) क्रिप्टन
उत्तर:
(3) आर्गन
प्रश्न 14.
निम्न में से कौन-सी गैस वायुयानों के टायरों में भरी जाती है?
(1) H
(2) He
(3) Np
(4) Ar
उत्तर:
(2) He

प्रश्न 15.
हीलियम का मुख्य स्रोत है:
(1) वायु
(2) मोनाजाइट रेत
(3) रेडियम
(4) इनमें से कोई नहीं।
उत्तर:
(2) मोनाजाइट रेत
प्रश्न 16.
वायुमण्डल में पायी जाने वाली अक्रिय गैस है:
(1) He तथा Ne
(2) He, Ne तथा Ar
(3) He, Ne, Ar तथा Kr
(4) Rn को छोड़कर सभी
उत्तर:
(4) Rn को छोड़कर सभी
अति लघु उत्तरीय प्रश्न:
प्रश्न 1.
अमोनिया की क्लोरीन से क्या अभिक्रिया होती है?
उत्तर:
अमोनिया की क्लोरीन से अभिक्रिया निम्नलिखित दो प्रकार से होती है:
1. जब अमोनिया आधिक्य में होती है तो N2 तथा NH4Cl प्राप्त होते
8NH3 + 3Cl2 →N2↑+ 6 NH4Cl
2. जब क्लोरीन आधिक्य में होती है तो NCl3 तथा HCl प्राप्त होते
NH3 + 3 Cl2 → NCl3 + 3 HCl
प्रश्न 2.
H3PO3 की क्षारकता क्या होती है और क्यों?
उत्तर:
H3PO3 दो - OH समूह उपस्थित होने के कारण यह द्विक्षारकीय अम्ल है।
प्रश्न 3.
रासायनिक समीकरण द्वारा समझाइए-क्या होता है जब बुझा हुआ चूना, CI2 से क्रिया करता है?
उत्तर:
2 Ca(OH)2 + 2Cl2 → CaCl2 + Ca (OCI2) + 2H2O

प्रश्न 4.
रासायनिक समीकरण द्वारा समझाइए-क्या होता है जब श्वेत फास्फोरस को अत्यंत उच्च दाब तथा 473 K ताप पर गर्म किया जाता है।
उत्तर:
श्वेत फॉस्फोरस को 473 K ताप तथा उच्च दाब पर गर्म करते हैं तो 8-काला फॉस्फोरस बनता हैं। यह वायु में 673 K तक नहीं जलता।
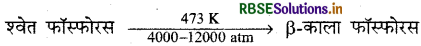
प्रश्न 5.
निम्नलिखित अभिक्रिया को पूर्ण कीजिए।
2NaOH (ठण्डा व तनु) + Cl2 →
उत्तर:
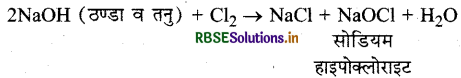
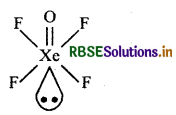
प्रश्न 6.
XeOF4 की संरचना बनाइए।
उत्तर:
प्रश्न 7.
वर्ग - 16 के तत्वों का सामान्य इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
वर्ग - 16 के तत्वों का सामान्य इलेक्ट्रॉनिक विन्यास ns2 np4 होता है जहाँ n = 2 - 6
प्रश्न 8.
एक अभिक्रिया लिखिए जिसमें ओजोन अपचायक हो रन्तु स्वयं भी अपचयित होती है?
उत्तर:
ओजोन हाइड्रोजन परॉक्साइड को जल में अपचयित करती और स्वयं भी अपचयित हो जाती है।
H2O2 + O3 → 2O2↑ + H2O
प्रश्न 9.
सल्फर के किन्हीं चार ऑक्सी अम्लों के नाम लिखिए।
उत्तर:
- H2SO4 (सल्फयूरिक अम्ल)
- H2S2O7 (डाइसल्फ्यूरिक अम्ल)
- H2SO3 (थायोसल्फ्यूरिक अम्ल)
- H2S2O6 (डाइथायोनिक अम्ल)
प्रश्न 10.
निम्नलिखित अभिक्रिया को पूर्ण कीजिए:
XeF4 + O2F2
उत्तर:
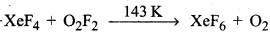
प्रश्न 11.
हीलियम को गोताखोरी के उपकरणों में उपयोग क्यों या जाता है?
उत्तर:
हीलियम की रुधिर में कम विलेयता के कारण इसे जाखोरी के उपकरणों में उपयोग करते हैं। यह ऑक्सीजन के तनुकारी रूप में उपयोग की जाती है।
प्रश्न 12.
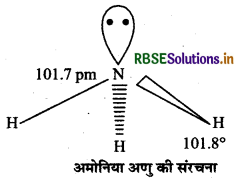
अमोनिया में नाइट्रोजन परमाणु की संकरित अवस्था लिखिए।
उत्तर:
sp3 संकरित अवस्था।

प्रश्न 13.
क्लोरीन की इलेक्ट्रान लब्धि एंथैल्पी का मान, फ्लुओरीन से अधिक होता है क्यों, समझाइए।
उत्तर:
फ्लुओरीन की इलेक्ट्रॉन बन्धुता क्लोरीन से कम होती है। इसका कारण इसका छोटा आकार है, जिसके कारण इसके बाह्यतम कक्ष में इलेक्ट्रॉन घनत्व अधिक होता है और इलेक्ट्रॉन-इलेक्ट्रॉन प्रतिकर्षण के कारण अतिरिक्त इलेक्ट्रॉन कठिनता से जुड़ता है।
प्रश्न 14.
HCIO3 की संरचना बनाइए।
उत्तर:
HCIO3 की संरचना निम्न है।
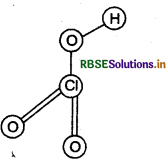
प्रश्न 15.
क्या होता है जब कार्बन सान्द्र H2S4 से अभिक्रिया करता है? रासायनिक समीकरण दीजिए।
उत्तर:
जब कार्बन सान्द्र H2SO4 से अभिक्रिया करता है तब कार्बन डाइ-आक्साइड एवं सल्फर डाइ-ऑक्साइड बनते हैं।
C(s) + 2H2SO4(l) → CO2 (g) + 2SO2(g) + 2H2O(l)
प्रश्न 16.
रासायनिक समीकरण देते हुए SO2 की विरंजक क्रिया का कारण समझाइए।
उत्तर:
SO2 अपचयन के आधार पर विरंजक गुण व्यक्त करती है।
SO2 + 2H2O → H2SO4 + 2[H]
रंगीन पदार्थ + [H] → रंगहीन पदार्थ

प्रश्न 17.
जल की अपेक्षा आयोडीन, KI विलयन में क्यों अधिक विलेय है?
उत्तर:
जल के द्वारा आयोडीन का. बिल्कुल भी अपघटन नहीं होता है जबकि आयोडीन KI विलयन में घुलकर भूरे रंग का पोटैशियम ट्राइआयोडाइड (KI3) संकर यौगिक बनाती है।'
KI + I2 → KI3
प्रश्न 18.
सामान्य ताप एवं दाब पर ब्रोमीन एक द्रव है जबकि आयोडीन ठोस। कारण स्पष्ट कीजिए।
उत्तर:
आयोडीन का अणुभार तथा आकार दोनों ब्रोमीन से अधिक हैं चूँकि आयोडीन अणु के मध्य लगने वाला आणविक आकर्षण बल ब्रोमीन की तुलना में अधिक है, इसलिए आयोडीन ठोस तथा ब्रोमीन द्रव है।
प्रश्न 19.
हैलोजनों के दो ऑक्सी अम्लों के संरचना सूत्र लिखिए।
उत्तर:
हैलोजनों के दो ऑक्सी अम्लों के संरचना सूत्र निम्नवत् है:
- क्लोरस अम्ल
- हेलिक अम्ल
प्रश्न 20.
HCl का क्वथनांक HF से कम क्यों होता है?
उत्तर:
हाइड्रोजन हैलाइडों के क्वथनांक HCl से HI तक बढ़ते हैं। HF का क्वथनांक अन्तराअणुक हाइड्रोजन आबन्धन के कारण अपसामान्य रूप से इन सबसे उच्च है।
प्रश्न 21.
XeF6 की संरचना बनाइए।
उत्तर:
XeF6 की संरचना निम्न प्रकार है।
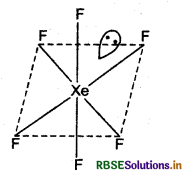
प्रश्न 22.
क्या होता है जब सल्फर सान्द्र H2SO4 से अभिक्रिया करता है? रासायनिक समीकरण लिखिए।
उत्तर:
सल्फर की सान्द्र H2SO4 से अभिक्रिया द्वारा सल्फर का ऑक्सीकरण होकर SO2 गैस बनती है।
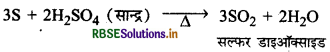
प्रश्न 23.
नाइट्रिक अम्ल में नाइट्रोजन की ऑक्सीकरण अवस्था लिखिए।
उत्तर:
HNO3 में नाइट्रोजन की ऑक्सीकरण अवस्था
1 + x -2(3) = 0
अतः नाइट्रोजन की ऑक्सीकरण अवस्था + 5 है।
प्रश्न 24.
हैलोजन यौगिकों की तुलना में अंतराहैलोजन यौगिक अधिक क्रियाशील क्यों होते हैं? समझाइए।
उत्तर:
विद्युत ऋणात्मकता में अंतर होने के कारण अतरा हैलोजन यौगिकों की बन्ध ऊर्जा कम हो जाती है और वे अधिक क्रियाशील हो जाते हैं।

प्रश्न 25.
फॉस्फोरस के अपररूप लिखिए।
उत्तर:
फॉस्फोरस के तीन मुख्य अपररूप निम्नवत् हैं।
- सफेद या पीला फॉस्फोरस
- लाल फॉस्फोरस
- काला फॉस्फोरस
प्रश्न 26.
अक्रिय गैसों की इलेक्ट्रॉन बन्धुता शून्य क्यों होती है?
उत्तर:
क्योंकि इनके अन्दर और बाहर के सभी कोश पूर्ण रूप से भरे होते हैं।
प्रश्न 27.
उत्कृष्ट गैसे क्या होती हैं? उत्कृष्ट गैसों के नाम लिखिए।
उत्तर:
आवर्त सारणी में शून्य वर्ग के तत्वों को उत्कृष्ट गैसें कहते हैं, क्योंकि ये तत्व रासायनिक रूप से अक्रिय होते हैं। हीलियम, आर्गन, निऑन, रेडॉन, क्रिप्टॉन तथा जीनॉन उत्कृष्ट गैसें हैं।
प्रश्न 28.
रेडॉन की खोज किसने की? इसका किस रोग के उपचार में उपयोग किया जाता है?
उत्तर:
रेडॉन (Rn) की खोजन डॉर्न ने की थी। इसका प्रयोग कैंसर के उपचार में किया जाता है।
प्रश्न 29.
क्लीवाइट खनिज में कौन-सी अक्रिय गैस पाई जाती है? इस गैस का एक उपयोग लिखिए।
उत्तर:
क्लीवाइट खनिज में हीलियम गैस पाई जाती है। यह गैस वायुयान के टायरों में भरी जाती है।
प्रश्न 30.
उत्कृष्ट गैसें अक्रिय क्यों होती हैं? इनके द्वारा बनाये गये दो यौगिकों के सूत्र लिखिए।
उत्तर:
उत्कृष्ट या अक्रिय गैसों के सभी कक्ष पूर्णतया भरे होने के कारण ये संतृप्त होती हैं और इसी कारण रासायनिक रूप से क्रिया में भाग नहीं लेते हैं। इनके द्वारा बनाये गये दो यौगिक क्रमश: WHe2 व Ar6H2O हैं।

प्रश्न 31.
उत्कृष्ट गैसों के आयनन विभव के मान ऊँचे होते हैं? समझाइए।
उत्तर:
उत्कृष्ट गैसों के उच्च आयनन विभव इनके छोटे आकार के कारण होते हैं।
प्रश्न 32.
He और Ne फ्लोरीन के साथ यौगिक नहीं बनाते हैं क्यों?
उत्तर:
He और Ne फ्लोरीन के साथ यौगिक न बनाने के प्रमुख कारण निम्नलिखित हैं।
- छोटा आकार,
- d कक्षक की अनुपस्थिति,
- उच्च आयनन ऊर्जा।
प्रश्न 33.
ब्रॉडी ओजोनाइजर का नामांकित चित्र बनाइए।
उत्तर:
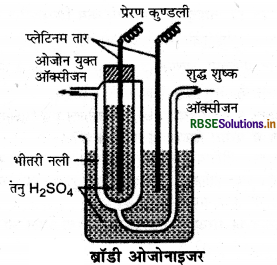
प्रश्न 34.
रासायनिक समीकरण द्वारा समझाइए क्या होता है जब श्वेत फास्फोरस को अतयंत उच्च दाब तथा 473 K ताप पर गर्म किया जाता है।
उत्तर:
श्वेत फॉस्फोरस को 473 K ताप तथा उच्च दाब पर गर्म ते हैं तो B-काला फास्फोरस बनता है यह वायु में 673 K तक नहीं

प्रश्न 35.
निम्न समीकरण को पूर्ण करें:
C2H5OH + PCl5 →
उत्तर:
C2H5OH + PCl5 → C2H5Cl + HCl + POCl3
प्रश्न 36.
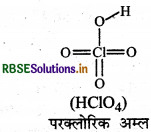
निम्नलिखित की संरचनाएँ खींचिए
(a) H2S2O7
(b) HCIO4
उत्तर:
(a) H2S2O7 की संरचना निम्न है
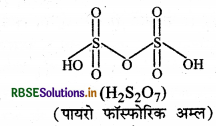
(b) HCIO4 की संरचना निम्न है
प्रश्न 37.
निम्नलिखित अभिक्रियाओं को पूर्ण कीजिए:
1. PbS(s) + O3 →
2. XeF6 + NaF →
उत्तर:
- Pbs + 4O3 → PbSO4 + 4O2
- XeF6 + NaF → Na + [XeF7]

प्रश्न 38.
XeO3 की संरचना बनाइए।
उत्तर:
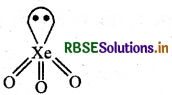
प्रश्न 39.
निम्नलिखित समीकरणों को पूर्ण एवं संतुलित कीजिए।
(a) S + H2SO4 (सान्द्र) →
(b) PCl3 + H2O →
उत्तर:
(a) S + H2SO4 (सान्द्र) → 3SO2 + 2H2Oसल्फर डाईऑक्साइड
(b) PCl3 + 3H2O → H3PO3 फास्फोरस अम्ल + 3HCl
प्रश्न 40.
हवाई जहाज के टायरों को फुलाने के लिए हीलियम गैस को क्यों भरा जाता है?
उत्तर:
हाइड्रोजन के बाद हीलियम ही सबसे हल्की तथा अज्वलनशील गैस है। इस कारण से हवाई जहाज के टायरों को फुलाने के लिए हीलियम गैस को भरा जाता है।
प्रश्न 41.
हीलियम तथा निऑन फ्लुओरीन से क्रिया नहीं करती हैं, क्यों?
उत्तर:
हीलियम का इलेक्ट्रॉनिक विन्यास 1S2 तथा निऑन का इलेक्ट्रॉनिक विन्यास 1S22S22P6 होता है। इसमें कोई भी अयुग्मित इलेक्ट्रॉन नहीं है और न ही रिक्त d-उपकोश है। इनकी आयनन ऊर्जा भी काफी अधिक होती है इस कारण ये जीनॉन के समान उत्तेजित अवस्था में नहीं जा पाते हैं और फ्लु ओरीन से क्रिया नहीं करते हैं।
प्रश्न 42.
समूह-16 के तत्वों को कैल्कोजेन क्यों कहा जाता है?
उत्तर:
कैल्कोजेन (Chalcogen) का अर्थ है 'अयस्क बनाने वाले। समूह-16 के ऊपर के चार तत्व (O, S, Se, Te) कैल्कोजेन कहलाते हैं क्योंकि ये अयस्क के रूप में पाये जाते हैं। अयस्क मुख्यत: ऑक्साइड, सल्फाइड, सल्फेट, सिलेनाइड तथा टेल्यूराइड के रूप में भू-पर्पटी में उपस्थित होते हैं।
प्रश्न 43.
फॉस्फोरस के सभी ऑक्सीअम्ल जल में समान शक्ति क्यों दर्शाते हैं?
उत्तर:
H3PO4 H3PO3 आदि सभी में P पर आबन्धित P = 0 बन्ध के ऑक्सीजन परमाणुओं की संख्या समान होती है। इस कारण P - 0बन्ध का प्रेरण प्रभाव 0 - H बन्ध के आयनन को समान रूप से प्रभावित करता है। परिणामस्वरूप फॉस्फोरस के सभी ऑक्सीअम्ल जल में समान शक्ति दर्शाते हैं।

प्रश्न 44.
NF3 एक स्थायी यौगिक है जबकि NCl3 व NI3 विस्फोटक हैं, क्यों ?
उत्तर:
NF2 का जल अपघटन नहीं होता है क्योंकि N तथा F दोनों में ही बाह्य कोश में रिक्त d-उपकोश नहीं होते, जबकि NCl3 व NI3 दोनों का जल अपघटन विस्फोट के साथ होता है क्योंकि Cl व I दोनों के बाह्य कोश में रिक्त d-उपकोश उपस्थित होते हैं।
प्रश्न 45.
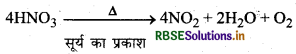
सूर्य के प्रकाश में सान्द्र HNO3 का रंग पीला क्यों हो जाता है?
उत्तर:
सूर्य के प्रकाश में सान्द्र HNO3 आंशिक रूप से विघटित होकर NO2 देता है। यह NO2, HNO3 में घुल जाता है और पीला रंग देता है।
प्रश्न 46.
पीले फॉस्फोरस की अपेक्षा लाल फॉस्फोरस का घनत्व अधिक होता है तथा रासायनिक रूप से यह कम क्रियाशील है, क्यों?
उत्तर:
लाल फॉस्फोरस P4 चतुष्फलकीय अणु की श्रृंखला के रूप में रहता है जो आपस में जुड़ी होती है, पीले फॉस्फोरस में P4 के स्वतन्त्र चतुष्फलकीय अणु रहते हैं जो कि दुर्बल वान्डरवाल्स बलों से जुड़े होते हैं। इस कारण से ही लाल फॉस्फोरस रासायनिक रूप से कम क्रियाशील होता है।
प्रश्न 47.
H3PO3 की क्षारकता क्या होती है और क्यों?
उत्तर:
H3PO3 में दो - OH समूह उपस्थित होने के कारण यह द्विक्षारकीय अम्ल है।
प्रश्न 48.
नाइट्रिक ऑक्साइड (NO) अनुचुम्बकीय क्यों होता है?
उत्तर:
NO में कुल 15 इलेक्ट्रॉन होते हैं। अतः इसमें एक अयुग्मित इलेक्ट्रॉन का होना आवश्यक है जिसके कारण NO अनुचुम्बकीय होता
प्रश्न 49.
H3PO2 की संरचना के आधार पर आप इसका अपचायक व्यवहार कैसे स्पष्ट करेंगे?
या
अम्ल H3PO2 की क्षारकता क्या है? और क्यों?
उत्तर:
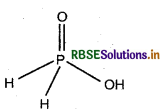
H3PO2 में दो H परमाणु P परमाणु से सीधे आबन्धित रहते हैं जो कि इस अम्ल को अपचायक गण देते हैं। चूँकि H3PO2 में केवल एक ही - OH समूह उपस्थित है अतः यह एक क्षारकीय है।
प्रश्न 50.
PCl3 नमी में धूम्र देता है, क्यों?
उत्तर:
PCl3 नमी की उपस्थिति में जल अपघटित होकर HCl की धूम्र देता है।
PCl3 + 3H2O → H3PO3 + 3HCl

प्रश्न 51.
PH3 का क्वथनांक NH3 से कम क्यों होता है?
उत्तर:
NH3 में हाइड्रोजन बन्ध की उपस्थिति के कारण NH3 का क्वथनांक अधिक होता है। PH3 में हाइड्रोजन बन्ध नहीं पाया जाता है। इस कारण इसका क्वथनांक कम होता है।
प्रश्न 52.
नाइट्रोजन के अणु कम क्रियाशील क्यों होते हैं?
उत्तर:
नाइट्रोजन में त्रिआबन्ध की उपस्थिति के कारण आबन्ध वियोजन ऐन्थैल्पी अत्यन्त उच्च (941.4 kJ/mol) होती है इस कारण नाइट्रोजन के अणु कम क्रियाशील होते हैं।
प्रश्न 53.
हीलियम तथा ऑक्सीजन का मिश्रण गोताखोरों द्वारा श्वसन में प्रयोग किया जाता है, क्यों?
उत्तर:
हीलियम की विलेयता उच्च दाब पर भी रक्त में काफी कम होती है। अतः हीलियम तथा ऑक्सीजन (80 : 20) का मिश्रण गोताखोर श्वसन के लिये प्रयोग करते हैं।

प्रश्न 54.
परऑक्सो डाइ-सल्फ्यूरिक अम्ल की संरचना बनाइये।
उत्तर:
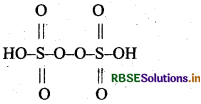
परऑक्सो डाइसल्फ्यूरिक अम्ल H2S2O8
प्रश्न 55.
H2S या H2O में से किसका आबन्ध कोण अधिक होता है तथा क्यों?
उत्तर:
H2O का आबन्ध कोंण अधिक होता है क्योंकि सल्फर की तुलना में ऑक्सीजन परमाणु अधिक विद्युत् ऋणात्मक तथा आकार में छोटा होता है। जिसके परिणामस्वरूप ऑक्सीजन पर इलेक्ट्रॉन घनत्व प्रति इकाई आयतन अधिक होता है और H2O अधिक ध्रुवी हो जाता है।
प्रश्न 56.
सान्द्र H2SO4 का प्रयोग H2S को सुखाने में नहीं किया जाता है, क्यों?
उत्तर:
सान्द्र H2SO4, H2S का ऑक्सीकरण सल्फर में कर देता है, इसलिये इसका प्रयोग H2S को सुखाने में नहीं किया जाता है।
H2SO4 + H2S → 2H2O + SO2 + S
प्रश्न 57.
क्या होता है जब ओजोन हाइड्रोजन परॉक्साइड से क्रिया करती है?
उत्तर:
ओजोन हाइड्रोजन परॉक्साइड से क्रिया करके ऑक्सीजन गैस को मुक्त करती है।
O3+ H2O2 → 2O2↑+ H2O
प्रश्न 58.
कमरे के ताप पर H2O द्रव है जबकि H2S गैस, क्यों?
उत्तर:
सल्फर की तुलना में ऑक्सीजन परमाणु का आकार छोटा एवं विद्युत् ऋणात्मकता अधिक होती है, जिसके कारण H2O हाइड्रोजन बन्ध का निर्माण करता है और H2O के अणु एक-दूसरे से जुड़े रहते हैं। इस कारण H2O द्रव अवस्था में पाया जाता है। H2S में हाइड्रोजन बन्ध की अनुपस्थिति के कारण यह गैस अवस्था में होता है।
प्रश्न 59.
NO2 द्विलयीकरण (demerisation) क्यों होती है?
उत्तर:
NO2 में संयोजकता इलेक्ट्रॉनों की संख्या विषम होती है जिसके कारण यह एक प्रारूपी विषम इलेक्ट्रॉन अणु के समान व्यवहार करती है। द्विलयन (dimerise) होने पर यह एक स्थायी N2O4 अणु में परिवर्तित हो जाती है, जिसमें इलेक्ट्रॉनों की संख्या सम होती है।

प्रश्न 60.
क्या होता है जब H2SO4 की क्रिया PCl5 के साथ करायी जाती है?
उत्तर:
H2SO4 की क्रिया PCl5 के साथ होने पर सल्फ्यू राइल क्लोराइड़ बनता है।

प्रश्न 61.
लाल फॉस्फोरस एवं सफेद फॉस्फोरस को आपस में कैसे पृथक् करेंगे?
उत्तर:
लाल तथा सफेद फॉस्फोरस के मिश्रण को NaOH के साथ उबालने पर सफेद फॉस्फोरस NaOH के साथ क्रिया करता है तथा सोडियम हाइपोफॉस्फाइट (NaH2PO2) के रूप में परिवर्तित होकर विलयन में चला जाता है। जबकि लाल फॉस्फोरस NaOH के साथ क्रिया नहीं करता, अतः इसे छानकर अलग कर लिया जाता है।
प्रश्न 62.
आर्थोफॉस्फोरिक अम्ल एक शर्बती द्रव के रूप में क्यों पाया जाता है?
उत्तर:
आर्थोफॉस्फोरिक अम्ल (H3PO4) में तीन OH समूह होते हैं। ये विस्तृत हाइड्रोजन बन्ध बनाते हैं। हाइड्रोजन बन्ध बनने के कारण यह एक शर्बती द्रव के रूप में पाया जाता है। प्रश्न 63.
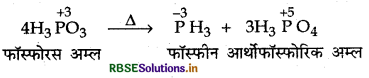
H3PO3 की असमानुपातन अभिक्रिया दीजिये।
उत्तर:
H3PO3 की असमानुपातन अभिक्रिया
अम्ल लघु उत्तरीय प्रश्न:
प्रश्न 1.
निम्नलिखित के लिए कारण दीजिए:
(a) डाइऑक्सीजन एक गैस है जबकि सल्फर एक ठोस है।
(b) जेट विमानों से उत्सर्जित NO(g) ओजोन परत का मंद गति से क्षरण कर रही है।
(c) शुद्ध हैलोजनों की अपेक्षा अंतरा-हैलोजन अधिक अभिक्रियाशील हैं।
उत्तर:
(a) ऑक्सीजन का छोटा आकार एवं अधिक विद्युत ऋणात्मकता होने के कारण यह द्विपरमाण्वीय अणु (diatomic molecule) के रूप में रहती है। जबकि सल्फर के अणु में आठ परमाणु होते हैं जोकि एक वलय (ring) के रूप में रहते हैं। ऑक्सीजन में d-कक्षकों की अनुपस्थिति के कारण यह pπ - pπ बन्ध बनाती है जो कि सल्फर में d-कक्षकों की उपस्थिति के कारण dπ - pπ बन्ध के रूप में होता है। अत: ऑक्सीजन छोटे आकार व अधिक अतिव्यापन के कारण गैस रूप में जबकि सल्फर d-कक्षकों के बन्ध बनाने में भाग लेने के कारण कम अतिव्यापन कर ठोस के रूप में रहता है।
(b) सुपरसोनिक जेट विमानों के निकास तन्त्र से उत्सर्जित नाइट्रोजन ऑक्साइड ऊपरी वायुमण्डल में ओजोन परत की सान्द्रता में मन्द गति से क्षरण कर रहे हैं।
NO + O3 → NO2 + O2
(c) अन्तरा हैलोजन यौगिक हैलोजनों (F के अतिरिक्त) की अपेक्षा अधिक क्रियाशील होते हैं क्योंकि इनमें उपस्थित A - X बन्ध हैलोजन अणु X2 में उपस्थित X - X बन्ध की अपेक्षा दुर्बल होते हैं।

प्रश्न 2.
ऑक्सीजन का अणुसूत्र O2 होता है जबकि सल्फर का S8 क्यों?
उत्तर:
ऑक्सीजन का आकार छोटा एवं उच्च विद्युतऋणता के कारण यह pπ - pπ बहुलबन्ध का निर्माण करती है। इस कारण यह द्विपरमाणुक अणु (O) के रूप में होता है। जबकि सल्फर का आकार बड़ा तथा कम विद्युत ऋणता के कारण pπ - pπ बहुल बन्ध का निर्माण नहीं करता है तथा अपने d-कक्षकों की सहायता से एकल बन्ध का . निर्माण करता है। चूँकि S - S बन्ध ऊर्जा कम होती है। इसके कारण यह शृंखलन करके Sg अणु के रूप में पाया जाता है।
हम जानते हैं कि क्लोरीन की तुलना में फ्लुओरीन की इलेक्ट्रॉन बन्धुता व वियोजन ऊष्मा कम होती है। जबकि फ्लुरीन का आकार छोटा होने के कारण F की जलयोजन ऊष्मा अन्य हैलाइड आयनों की तुलना में अधिक होती है। इसी कारण F2 की ऑक्सीकरण क्षमता Cl2 से अधिक होती है।
प्रश्न 9.
हैलोजन समूह के तत्वों को निम्न के बढ़ते क्रम में व्यवस्थित कीजिए।
(i) परमाणु त्रिज्या के आधार पर
उत्तर : F < Cl < Br <I (परमाणु त्रिज्या)
(ii) इलेक्ट्रॉन बन्धुता के आधार पर
उत्तर : I < Br < F < Cl (इलेक्ट्रॉन बन्धुता)
(iii) विद्युत् ऋणात्मकता के आधार पर
उत्तर : I < Br < Cl < F (विद्युत् ऋणात्मकता)
(iv) ऑक्सीकरण क्षमता के आधार पर
उत्तर : I, < Br < Cl, < F(ऑक्सीकरण क्षमता)
(v) बन्ध ऊर्जा के आधार पर
उत्तर : I2 < F2 < Br> < Cl2 (बन्ध ऊर्जा)
(vi) हैलाइड आयनों की अपचायक क्षमता के आधार पर।
उत्तर : F < C < Br < I (हैलाइड आयनों की अपचायक क्षमता)
(vii) हाइड्रो हैलोजन अम्लों के क्वथनांक के आधार पर।
उत्तर : HCI < HBr < HI < HF (क्वथनांक)
(viii) हाइड्रो हैलोजन अम्लों की अम्लीय प्रबलता के आधार पर।
उत्तर : HF < HCl < HBr < HI (अम्लीय प्रबलता)
(ix) हैलोजन के ऑक्सी-अम्लों की अम्लीय प्रबलता के आधार पर।
उत्तर : HOI < HOBr < HOCI (अम्लीय प्रबलता)
(x) हैलोजन की विभिन्न ऑक्सीकरण अवस्था में ऑक्सी अम्लों की अम्लीय प्रबलता के आधार पर।
उत्तरं : HCIO < HCIO) < HCIO3 < HCIOA (अम्लीय प्रबलता)
(xi) HOCI, HCIO2, HCIO3, HCIOA के बढ़ते हुए तापीय स्थायित्व के आधार पर।
उत्तर : HCIO < HCIO2 <HCIO3 <HCIOA (तापीय स्थायित्व)
(xii) हैलोजन की क्रियाशीलता के आधार पर।
उत्तर : I2 < Br2 < Cl2 < F2 (क्रियाशीलता)
(xiii) हैलाइड आयनों के आकार के आधार पर
उत्तर : F< CF < Br < I-(आकार)
प्रश्न 10.
निम्न का कारण बतायें:
(i) जलीय विलयन में HCl की तुलना में HF एक दुर्बल अम्ल हैं।
(ii) क्लोरीन के द्वारा फूलों का विरंजन स्थायी होता है, परन्तु SO2 द्वारा विरंजन अस्थायी होता है। .
उत्तर:
(i) क्लोरीन परमाणु की तुलना में फ्लुओरीन परमाणु का आकार छोटा होता है, इस कारण H - F आबन्ध की वियोजन ऊर्जा H - Cl आबन्ध की वियोजन ऊर्जा की तुलना में अधिक होती है। अतः जल में H - CL आबन्ध आसानी से टूट जाता है। इस कारण जलीय. विलयन में HCl की तुलना में HF एक दुर्बल अम्ल है।
(ii) क्लोरीन की विरंजन क्रिया ऑक्सीकरण के द्वारा होती है जबकि यही क्रिया. SO2 अपचयन द्वारा होती है। अपचयन द्वारा होने वाला विरंजन अस्थायी होता है क्योंकि जब विरंजित रंगहीन पदार्थ वायु में रखा
जाता है तो यह ऑक्सीकृत होकर पुनः रंगीन हो जाता है।
इस कारण Cl2 द्वारा विरंजन स्थायी होता है, जबकि SO2 द्वारा विरंजन अस्थायी होता है।
क्लोरीन द्वारा विरंजन
Cl2 + H2O → 2HCl + [O]
रंगीन पदार्थ + [O] → रंगहीन पदार्थ।
SO2 द्वारा विरंजन
SO2 + 2H2O → H2SO4 + 2 [H]
रंगीन पदार्थ + [H] → रंगहीन

प्रश्न 11.
(अ) क्लोरीन की गरम व सान्द्र NaOH विलयन से अभिक्रिया की समीकरण लिखिए।
(ब) PCI के पाँचों बन्ध समतुल्य क्यों नहीं हैं? समझाइए।
उत्तर:
क्लोरीन की सान्द्र NaOH व गर्म विलयन से अभिक्रिया कराने पर सोडियम क्लोराइड (NaCl) तथा सोडियम क्लोरेट (NaClO3) प्राप्त होते हैं।
3Cl2 + 6NaOH → 5NaCl + NaClO3 + 3H2O
(ब) PCl5 के पाँच बन्धों में से तीन निरक्षीय बन्ध समान हैं जबकि दो अक्षीय बन्धों की बन्ध लम्बाई अधिक होती है क्योंकि निरक्षीय बन्ध युग्मों की अपेक्षा अक्षीय बन्ध युग्मों पर प्रतिकर्षण अधिक होता है। PCl5 की त्रिकोणीय द्विपिरैमिडी संरचना होती है (sp3d संकरण)।

प्रश्न 12.
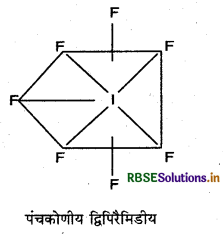
निम्न की संरचना दीजिए:
(i) IF3
(ii) CIF5
(iii) IF7
उत्तर:
(i) IF3
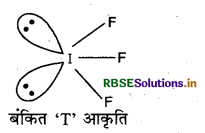
(ii) CIF5
(iii) IF7
प्रश्न 13.
सभी उत्कृष्ट गैसों में से जीनॉन जल में सबसे अधिक विलेय क्यों होती है?
उत्तर:
जल में उत्कृष्ट गैसों की विलेयता परमाणु क्रमांक की वृद्धि के साथ बढ़ती जाती है चूँकि जीनॉन का परमाणु क्रमांक सर्वाधिक है अतः यह जल में सबसे अधिक विलेय होती है।
प्रश्न 14.
उत्कृष्ट गैसें अक्रिय होती हैं, क्यों?
उत्तर:
उत्कृष्ट गैसों की संयोजी कक्षा का विन्यास पूर्ण होता है जिसके कारण ये अधिक स्थायी होती हैं। इसके साथ-साथ इनकी आयनन ऊर्जा अधिकतम तथा इलेक्ट्रॉन बन्धुता शून्य होती है। इस कारण से उत्कृष्ट गैसें अक्रिय होती हैं।
प्रश्न 15.
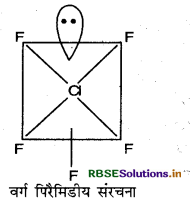
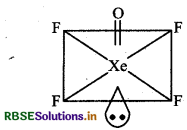
निम्नलिखित अणुओं की आकृति खीचिए।
(a) XeOF4
(b) BrF3
(c) XeF4
उत्तर:
(a) XeOF4 की आकृति निम्न है।
संकरण: sp3d2
ज्यामिती: वर्ग पिरैमिडीय
(b) BrF3 की आकृति निम्न है।
संकरण: sp3d
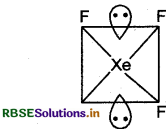
ज्यमिती: त्रिभुजीय द्विपिरैमिडीय
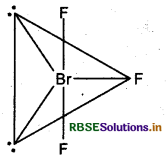
(c) XeF4 की आकृति निम्न है
संकरण: sp3d.
ज्यामिती: वर्ग समतलीय
प्रश्न 16.
निम्नलिखित के कारण दीजिए।
(a) फ्लुओरीन केवल एक ऑक्सोअम्ल बनाती है।
(b) उत्कृष्ट गैसों के क्वथनांक He से Rn तक बढ़ते हैं।
उत्तर:
(a) फ्लुओरीन केवल एक ऑक्सोअम्ल बनाती है क्योंकि फ्लोओरीन का आकार छोटा, उच्च विद्युत ऋणता तथा संयोजीकोश में d-कक्षकों अनुपस्थिति होने के कारण यह केवल एक ऑक्सी अम्ल बनाती है।
(b) उत्कृष्ट गेसों के एक परमाणण्वीय अणुओं के मध्य अति दुर्बल अन्तरा आण्विक आकर्षण बल अर्थात् वान्डर वाल्स बलों की उपस्थिति के कारण इनके गलनांक एवं क्वथनांकों के मान बहुत कम होते हैं। जैसे-जैसे समूह में परमाण्वीय भार बढ़ता जाता है, वैसे-वैसे वान्डर वालस आकर्षण बल भी बढ़ता जाता है और इसकी कारण क्वथनांक He से Rn तक बढ़ते हैं।

प्रश्न 17.
निम्नलिखित रासायनिक अभिक्रियाओं को पूर्ण कीजिएं।
(a) MnO2 + 4 HCl +
(b) XeF6 + KF →
(c) I- (aq) + H+ (aq) O3 (g) →
उत्तर:
(a) MnO2 + 4 HCl → MnCl2 + Cl2 + H2O
(b) XeF6 + KF → K + [XeF7]-
(c) 2I- (aq) + H+ (aq) + 2O3(g) → 2OH- + I2 + 2O2
प्रश्न 18.
ओजोन की मर्करी, शुष्क आयोडीन तथा स्टैनस क्लोराइड से अभिक्रिया का रासायनिक समीकरण लिखिए।
उत्तर:
1. ओजोन की मर्करी से अभिक्रिया का समीकरण
2Hg + O3 → Hg2O + O2
मर्करी ओजोन मयूरस ऑक्साइड
2. ओजोन की शुष्क आयोडीन से अभिक्रिया का समीकरण

3. ओजोन की स्टैनल क्लोराइंड से अभिक्रिया का समीकरण

प्रश्न 19.
'सल्फर के अपररूप' पर टिप्पणी लिखिए।
उत्तर:
आयनन ऐन्धैल्पी (Ionisation Enthalpy): समूह-15 के तत्वों की आयनन ऐन्थैल्पी का मान समूह-14 के संगत तत्वों की अपेक्षा अधिक होता है क्योंकि आवर्त सारणी में बायें से दायें जाने पर प्रभावी नाभिकीय आवेश का मान बढ़ता जाता है फलस्वरूप आकार ब छोटा हो जाता है और बाह्यतम इलेक्ट्रॉन पर नाभिक का आकर्षण बल बढ़ जाता है। इस कारण से आयनन ऐन्थैल्पी का मान बढ़ जाता है।
समूह-15 के तर्त्वों की प्रथम आयनन ऐन्थैल्पी का मान समूह- 16 के संगत तत्वों की अपेक्षा भी अधिक होता है, इसका कारण यह है कि समूह-15 के तत्वों में p - उपकोश आधा भरा होता है P3 जो कि एक स्थायी विन्यास है, जिसमें इलेक्ट्रॉन निकालने के लिये अधिक ऊर्जा की आवश्यकता होती है।
समूह-14<स सूह-15 > समूह-16 (प्रथम आयनन ऐन्थैल्पी) समूह-15 में, विभिन्न आयनन एन्थैल्पियों का आपेक्षित क्रम निम्न होता है:

प्रश्न 20.
सल्फर डाइऑक्साइड के निर्माण की प्रयोगशाला विधि का वर्णन कीजिए। इसके ऑक्सीकारक और अपचायक गुण देते हुए इसके उपयोग भी दीजिए।
उत्तर:
N > P > As > Sb > Bi ( विद्युत् - ॠणात्मकता)

प्रश्न 21.
क्लोरीन, ब्रोमीन तथा आयोडीन के फ्लुओरीन से बने किन्हींचार अन्तरा हैलाजन यौगिकों के बनाने का रासायनिक समीकरण दीजिए।
उत्तर:
अन्तरा हैलोजन यौगिक दो भिन्न हैलोजनों के सीधे संयोग द्वारा या निम्न अन्तरा हैलोजन यौगिक की हैलोजन से क्रिया द्वारा बनाए जाते हैं।

IF5 + F2 → IF7
XXn है। (जहाँ n = 3 से 7 तक)
IF को छोड़कर सभी XX' प्रकार के अन्तराहैलोजन यौगिक बनाये गए हैं।
AB3 प्रकार के क्लोरीन तथा, फ्लोरीन के अन्तरा हैलोजन यौगिक
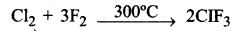
प्रश्न 22.
आवर्त सारणी में अक्रिय गैसों के स्थान की विवेचना।
उत्तर:
आवर्त सारणी में अक्रिय ..सों की दायीं ओर शून्य समूह (वर्ग-18) में रखा गया है। इन तत्वों को इनके गुणों में समानता होने के कारण एक साथ रखा गया है। He को छोड़कर सभी अक्रिय गैसों के बाह्य कोश में 8 इलेक्ट्रॉन होते हैं। रेडॉन को छोड़कर सभी अक्रिय गैसें वायुमण्डल में मौजूद हैं। आन्तरिक और बाह्य सभी कोश पूर्ण होने के कारण ये रासायनिक रूप से निष्क्रिय होती हैं। अतः इन्हें अक्रिय गैस कहा जाता है।
प्रश्न 23.
निम्नलिखित समीकरणों को पूर्ण एवं सन्तुलित कीजिए।
(a) C + H2SO4 (सान्द्र)
(b) XeF2 + PF5 →
उत्तर:
(a) C + 2H2SO4 (सान्द्र) → 2SO2 + 2H2O + CO2
(b) XeF2 + PF5 → [XeF] + [PF6]-
प्रश्न 24.
निम्नलिखित अभिक्रियाओं से सम्बद्ध सन्तुलित रासायनिक समीकरण लिखिए।
(a) फ्लुओरीन गैस जल से अभिक्रिया करती है।
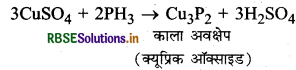
(b) फॉस्फीन गैस कॉपर सल्फेट विलयन में अवशोषित की जाती है।
उत्तर:
(a) फ्लुओरीन जल के साथ ठण्डे तथा अँधेरे में क्रिया कर 0, तथा 0, का मिश्रण देती है।
2F2 + 2H2O → 4HF + O2
3F2 + 3H2O → 6HF + O3
(b) फास्फीन गैस कॉपर सल्फेट विलयन में अवशोषित होकर काला अवक्षेप बनाती है।
प्रश्न 25.
आप कैसे प्राप्त करेंगे:
(i) सफेद फॉस्फोरस से फॉस्फीन?
(ii) फॉस्फोरिक अम्ल से मेटाफॉस्फोरिक अम्ल?
(iii) फॉस्फोरस से फॉस्फोरिक अम्ल?
उत्तर:
(i) सफेद फॉस्फोरस से फॉस्फीन-सफेद फॉस्फोरस को कॉस्टिक सोडा के 30% विलयन के साथ अक्रिय गैस की उपस्थिति में गर्म करने पर फॉस्फीन बनती है।

(ii) फॉस्फोरिक अम्ल से मेटाफॉस्फोरिक अम्ल- H3PO4 को गर्म करने पर पहले पायरोफॉस्फोरिक अम्ल बनता है और बाद में मेटाफॉस्फोरिक अम्ल बनता है।

(iii) फॉस्फोरस से फॉस्फोरिक अम्ल: फॉस्फोरस को सान्द्र HNO3 के साथ गर्म करने पर फॉस्फोरिक अम्ल प्राप्त होता है।
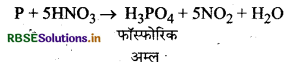
प्रश्न 26.
निम्न की संरचना दीजिए।
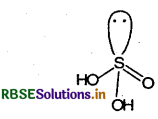
(i) सल्फ्यू रस अम्ल (H2SO3)
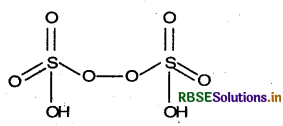
(ii) परऑक्सोडाइसल्फ्यूरिक अम्ल (H2S2O8)
उत्तर:
(i) सल्फ्यू रस अम्ल (H2SO3)
(ii) परऑक्सोडाइसल्फ्यूरिक अम्ल (H2S2O8)

प्रश्न 27.
निम्न अभिक्रियाओं को पूर्ण व सन्तुलित कीजिए।
(i) SO2 + MnO4- + H2O →
या क्या होता है जब SO2 गैस को Fe(III) लवण के विलयन में से गुजारा जाता है।
(ii) Fe3+ + SO2 + H2O →
उत्तर:

प्रश्न 28.
निम्नलिखित में से प्रत्येक के लिये उपयुक्त कारण देते हुए उनका स्पष्टीकरण कीजिए:
1. NF3 एक ऊष्माक्षेपी यौगिक है जबकि NCl3 नहीं है।
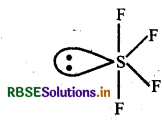
2. SF4 में सभी आबन्ध समतुल्य नहीं हैं।
उत्तर:
- NF3 में N -F बन्ध क्षमता F - F बन्ध की अपेक्षा अधिक है। अतः यह एक ऊष्माक्षेपी यौगिक है, परन्तु NCl3 में N - Cl बन्ध क्षमता Cl - Cl बन्ध की अपेक्षा कम है। अत: NCl के बनने में ऊष्मा दी जाती है।
- SF4 में सल्फर का संकरण spd है। इसकी संरचना त्रिकोणीय द्वि-पिरैमिडी संरचना एवं सी-सॉ (See-saw) ज्यामिती होती है। इसके कारण सभी आबन्ध समतुल्य नहीं हैं।
प्रश्न 29.
(अ) वर्ग 15 के ऊपर से तीसरे तत्व का नाम एवं इलेक्ट्रॉनिक विन्यास लिखिए।
(ब) अमोनिया अणु की संरचना बताइए।
(स) NH3 लुइस क्षारक की तरह व्यवहार करती है। क्यों?
(द) तनु एवं सान्द्र HNO3 की Zn के साथ अभिक्रिया के समीकरण दीजिए।
उत्तर:
(अ) आर्सेनिक (As)
परमाणु क्रमांक - 33
इलेक्ट्रॉनिक विन्यास = [Ar] 3d10, 4s2, 4p3
(ब)
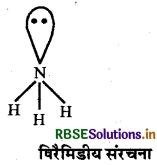
(स) NH3 के पास एक एकाकी युग्म उपस्थित होता है जिसे वह आसानी से दान कर सकती है। यही कारण है कि यह लुईस क्षारक की तरह व्यवहार करती है।
(द) (i) 4Zn + 10 HNO3 → 4Zn(NO3)2 + 5H2O + NO
(ii) Zn + 4HNO3 → Zn(NO3)2 + 2H2O + 2NO2
प्रश्न 30.
क्या कारण है कि:
(i) अम्लीय K2Cr2O7 से भीगा कागज SO2 के द्वारा हरा हो जाता
(ii) चीनी सान्द्र H2SO4 मिलाने पर काली पड़ जाती है?
उत्तर:
(i) अम्लीय K2Cr2O7 का, SO2 के द्वारा क्रोमियम सल्फेट में अपचयन हो जाता है जो कि हरे रंग का होता है।
3SO2 + K2Cr2O7 + H2SO4 → K2SO4 + Cr2(SO4)3 + H2O
(ii) सान्द्र H2SO4 निर्जलीकारक होने के कारण चीनी में से जल के समस्त अणुओं को निकाल देता है और कार्बन शेष रह जाता है जो कि काले रंग का होता है अत: चीनी काली पड़ जाती है।

प्रश्न 31.
निम्न के कारण बताएँ:
(i) SF6 ज्ञात है परन्तु SCl6 नहीं।
(ii) SF6 गैसीय विद्युत् कुचालक के रूप में प्रयुक्त होती है।
उत्तर:
(i) फ्लुओरीन एक प्रबल विद्युत् ऋणात्मक तत्व तथा एक प्रबल ऑक्सीकारक तत्व होता है जोकि सल्फर को इसकी+ 6 ऑक्सीकरण अवस्था तक ऑक्सीकृत कर देता है। इस कारण SF6 ज्ञात यौगिक है। क्लोरीन एक दुर्बल ऑक्सीकारक होने के कारण सल्फर को इसके + 4 ऑक्सीकरण अवस्था तक.ही ऑक्सीकृत कर पाता है। इस कारण SCl6 ज्ञात यौगिक नहीं है।
(ii) SF6 अर्थात् सल्फर हेक्साफ्लुओराइड साधारण ताप पर एक रंगहीन, गन्धहीन एवं अविषैली हौस है। कमरे के ताप पर यह ऊष्मीय रूप से स्थायी एवं रासायनिक रूप से अक्रिय होती है। इसकी अक्रियाशीलता तथा. आन्तरिक विसर्जन को संकुचित करने की उच्च प्रवृत्ति के कारण इसे उच्च वोल्टता वाले जेनरेटर्स (High voltage generators) तथा गैसीय विद्युत् कुचालक के रूप में प्रयोग किया जाता है।
प्रश्न 32.
सम्पर्क विधि में SO2 का SO3 में परिवर्तन करने के लये अनुकूल परिस्थितियों को स्पष्ट करिये।
उत्तर:
सम्पर्क विधि में SO2 का SO3 में परिवर्तन की अभिक्रिया नम्न है:
2SO2 + O2 → 2SO3 ∆H = -ve
लॉ-शातेलिये के नियमानुसार,
चूँकि अभिक्रिया ऊष्माक्षेपी है अतः कम ताप अभिक्रिया के लिये अनुकूल है। अभिक्रिया में उत्पाद के मोल कम हो रहे हैं अतः उच्च दाब पर अभिक्रिया आसानी से SO3 का अधिक निर्माण करेगी। उत्प्रेरक की उपस्थिति भी अभिक्रिया की गति को तीव्र करने में व अधिक उत्पाद बनाने में सहयोगी है।

प्रश्न 33.
निम्न के कारण बताएँ:
1. ओजोन, ऑक्सीजन से अधिक क्रियाशील है।
2. ऑक्सीजन अणु अनुचुम्बकीय होता है पर ओजोन अणु पतिचुम्बकीय।
उत्तर:
- ओजोन के निर्माण के दौरान, ऊर्जा अवशोषित होती है अतः इसकी ऊर्जा अधिक होती है। अर्थात् यह एक ऊष्माशोषी यौगिक है, जो कम स्थायी होता है। इसलिये यह अधिक क्रियाशील होता है।
- ऑक्सीजन अणु में दो अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं जिसके . कारण यह अनुचुम्बकीय (Paramagnetic) हो जाता है। ओजोन में कोई भी अयुग्मित इलेक्ट्रॉन उपस्थित नहीं होता है अत: यह एक प्रतिचुम्बकीय पौगिक है।
प्रश्न 34.
1. सिलेनियम की तुलना में सल्फर में श्रृंखलन की प्रवृत्ति अधिक होती है।
2. SF6 जल अपघटन के प्रति अक्रियाशील होता है।
उत्तर:
- सल्फर से सिलेनियम तक जाने पर परमाणु का आकार बढ़ता जाता है इस कारण से E - E बन्ध की सामर्थ्य घटती जाती है। चूंकि Se का आकार S से ज्यादा बड़ा होता है अत: Se - Se बन्ध की तुलना में S - S बन्ध अधिक प्रबल होता है जिसके फलस्वरूप सिलेनियम की तुलना में सल्फर की श्रृंखलन प्रवृत्ति अधिक हो जाती है।
- SF6 अर्थात् सल्फर हेक्साफ्लुओराइड में सल्फर त्रिविमीय रूप से छः फ्लोरीन परमाणुओं के द्वारा रक्षित होता है, इसलिये यह जल के अणुओं को सल्फर परमाणु पर आक्रमण नहीं करने देता। फ्लुओरीन परमाणु के पास H2O अणुओं द्वारा दान किये गये इलेक्ट्रॉनों को ग्रहण करने के लिये व-कक्षक नहीं होते हैं। अत: SF6 जल अपघटित नहीं होता है।
प्रश्न 35.
कारण बताएँ:
(i) सल्फर 119°C पर दव में बदल जाता है परन्तु 160°C तक पुनः गर्म करने पर यह गाढ़ा द्रव (viscous) हो जाता है।
(ii) H2S में H - S बन्ध, जल में H - Oबन्ध की अपेक्षा दुर्बल होता है।
उत्तर:
(i) पिघला हुआ सल्फर 119°C पर S8 के रूप में रहता है जो कि एक वलय (ring) संरचना है। ये वलय (rings) एक-दूसरे के ऊपर घूर्णित (roll) रहती हैं। 160°C पर तथा इससे ऊपर गर्म करने पर ये वलय (ring) टूट जाती हैं और सल्फर की श्रृंखलाएँ एक-दूसरे के ऊपर अधिक नजदीक आ जाती हैं। जिसके कारण यह गाढ़ा द्रव (viscous liquid) बन जाता है।
(ii) सल्फर परमाणु का आकार ऑक्सीजन परमाणु की तुलना में अपेक्षाकृत बड़ा होता है जिससे H2S के निर्माण के दौरान H तथा S में अतिव्यापन कम हो जाता है और H - S बन्ध दुर्बल बनता है। जबकि जल में ऑक्सीजन परमाणु का आकार छोटा तथा विद्युत् ऋणात्मकता अधिक होती है अतः अतिव्यापन भी ज्यादा होता है। इस कारण जल में H - 0 बन्ध ज्यादा मजबूत होता है।
प्रश्न 36.
(a) NH3 का द्विधुवी आघूर्ण NF3 अणु के द्विधुवी आघूर्ण से ज्यादा क्यों होता है?
(b) H2SO3 की संरचना बनाइए।
उत्तर:
(a) NH3 में N-परमाणु हाइड्रोजन से अधिक विद्युत् ऋणात्मक होने के कारण नाइट्रोजन, ऋणात्मक द्विध्रुव बनाता है और एकाकी इलेक्ट्रॉन युग्म का आघूर्ण, N - H बन्धों के परिणामी आघूर्ण में जुड़ जाता है। जबकि NF3 अणु में नाइट्रोजन धनात्मक द्विध्रुव बनाता है और एकाकी इलेक्ट्रॉन युग्म का आघूर्ण, N - F बन्धों के परिणामी आघूर्णों को आंशिक रूप से घटाकर कम कर देता है। इस कारण NH3
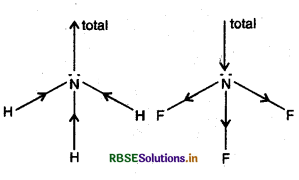
के तत्व 345 का द्विध्रुवी आघूर्ण NF3 अणु के द्विध्रुवी आघूर्ण से ज्यादा होता है।
(b) H2SO3 की संरचना
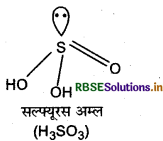
प्रश्न 37.
निम्न के कारण बतायें:
(i) बिस्मथ पंचसंयोजी अवस्था में एक प्रबल ऑक्सीकारक होता
(ii) नाइट्रिक ऑक्साइड (NO) गैसीय अवस्था में अनुचुम्बकीय, परन्तु द्रव तथा ठोस अवस्था में प्रतिचुम्बकीय है।
उत्तर:
(i) समह में नीचे होने के कारण बिस्मथ (Bi) में अक्रिय युग्म प्रभाव अत्यन्त प्रभावपूर्ण होता है। इसलिये इसकी +3 ऑक्सीकरण अवस्था +5 ऑक्सीकरण अवस्था की तुलना में अधिक स्थायी होती है। इस कारण बिस्मथ अपनी पंचसंयोजी अवस्था में आसानी से दो इलेक्ट्रॉनों को ग्रहण करके त्रिसंयोजी अवस्था में अपचयित हो जाता है। Bi अपनी -5 ऑक्सीकरण अवस्था में एक प्रबल ऑक्सीकारक होता है।
Bi+5 + 2e → Bi+3
(ii) NO में इलेक्ट्रॉनों की संख्या विषम (11 संयोजी इलेक्ट्रॉन) होती है। इस कारण गैसीय अवस्था में यह अनुचुम्बकीय (Paramagnetic) होता है। ठोस एवं द्रव अवस्थाओं में यह द्विलकीकृत हो जाता है जिसके कारण इन अवस्थाओं में यह प्रतिचुम्बकीय (diamagnetic) होता है।
प्रश्न 38.
(a) निम्नलिखित को उनके अपचायक लक्षण के घटते इए क्रम में व्यवस्थित कीजिए:
HF, HCL, HBr, HI
(b) निम्नलिखित अभिक्रिया को पूर्ण कीजिए।
Xe + SbFs →
उत्तर:
(a) अपचायक के घटते क्रम में
HF < HCl < HBr < HI
(b) XeF4 + SbF5 → [XeF3] + [SbF6]-
प्रश्न 39.
भूरी वलय परीक्षण क्या है? समझाइए।
या
NO3- आयन के वलय परीक्षण में Fe2+ आयन नाइट्रेट आयन को नाइट्रिक ऑक्साइड में अपचयित कर देता है। जो कि Fe2+(aq) भायनों के साथ संयोजित होकर एक भूरा संकुल बनाता है। इस भूरी बलय परीक्षण के दौरान होने वाली रासायनिक अभिक्रियाओं को लखें।
उत्तर:
भूरी वलय परीक्षण (Brown Ring Test):
यह नाइट्रेटों के लये सुपरिचित परीक्षण है। इस परीक्षण में सामान्यतया नाइट्रेट आयन क्त जलीय विलयन में तनु फेरस सल्फेट विलयन मिलाने के पश्चात् सावधानीपूर्वक परखनली की दीवार के सहारे सान्द्र सल्फ्यूरिक अम्ल को मिलाया जाता है। विलयन तथा सल्फ्यूरिक अम्ल के अन्तरापृष्ठ पर एक भूरी वलय बनती है जो कि नाइट्रेट आयनों की उपस्थिति का संकेत देती है। परीक्षण के दौरान निम्न अभिक्रिया होती है
- 2NaNO3 + H2SO4 → Na2SO4 + 2HNO3
- 6FeSO4 + 3H2SO4 + 2HNO3 → 3Fe2(SO4)3 + 2NO + 4H2O
- FeSO4 +NO → FeSO4.NO (भूरा वलय)
निबन्धात्मक प्रश्न:
प्रश्न 1.
अमोनिया तथा फॉस्फीन बनाने की प्रयोगशाला विधि का रासायनिक समीकरण लिखिए तथा सफेद फॉस्फोरस की क्लोरीन से अभिक्रिया का रासायनिक समीकरण भी लिखिए।
उत्तर:
अमोनिया गैस बनाने की प्रयोगशाला विधि का रासायनिक समीकरण-प्रयोगशाला में अमोनिया गैस अमोनियम क्लोराइड को बुझे हुए चूने के साथ गर्म करके बनायी जाती है।
2NH4Cl + Ca(OH)2 → CaCl + 2NH3 + 2H2O
फॉस्फीन गैस बनाने की प्रयोगशाला विधि का रासायनिक समीकरण: प्रयोगशाला में फॉस्फीन गैस वायु की अनुपस्थिति में सफेद फॉस्फोरस को सान्द्र कास्टिक सोडा विलयन के साथ गर्म करके बनायी जाती है।

सफेद फॉस्फोरस की क्लोरीन से अभिक्रिया का रासायनिक समीकरण: सफेद फॉस्फोरस साधारण ताप पर क्लोरीन गैस में स्वतः जलने लगता है।
P4 + 6Cl2 → 4PCl3
P4 + 10Cl2 → 4PCl5

प्रश्न 2.
फॉस्फीन बनाने की प्रयोगशाला विधि का सचित्र वर्णन कीजिए। इसके दो गुण एवं उपयोग लिखिए।
उत्तर:
प्रयोगशाला में फॉस्फीन को सान्द्र सोडियम हाइड्रॉक्साइड को अक्रिय वातावरण में सफेद फॉस्फोरस के साथ उबालकर प्राप्त करते
P4 + 3NaOH + 3H2O → 3NaH2PO2 + PH3
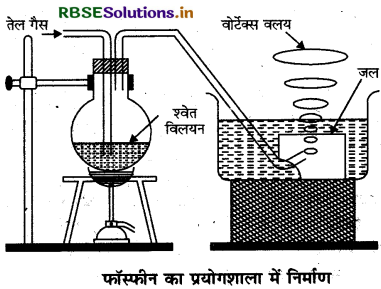
इसके दो प्रमुख गुण निम्नवत हैं:
- यह वायु से भारी तथा जल में अल्प विलेय होती है।
- यह विषैली प्रकृति की होती है।
इसके दो प्रमुख उपयोग निम्न हैं:
- इसका उपयोग धातुओं के फॉस्फाइड बनाने में किया जाता है।
- इसका उपयोग समुद्री यात्राओं में होम्ज सिग्नल के लिए किया जाता है।
प्रश्न 3.
डाइऑक्सीजन के विरचन की प्रमुख विधियाँ तथा इसके रासायनिक गुण एवं उपयोग लिखिए।
उत्तर:
वायुमण्डल में सबसे अधिक मात्रा में 78 % भाग नाइट्रोजन पायी जाती है। फॉस्फोरस के अतिरिक्त अन्य सभी तत्व प्रकृति में प्रचुर मात्रा में प्राप्त नहीं होते हैं।
फॉस्फोरस का भू-पर्पटी में पाये जाने वाले तत्वों में दसवाँ स्थान है। भू-पर्पटी के खनिजों में नाइट्रोजन, सोडियम नाइट्रेट NaNO3 या (चिली साल्टपीटर या चिली शोरा) तथा पोटैशियम नाइट्रेट KNO3 या (इण्डियन साल्टपीटर) के रूप में पाया जाता है। जीवों एवं वनस्पतियों में नाइट्रोजन प्रोटीन के रूप में पाया जाता है। फॉस्फोरस ऐपेटाइट वर्ग के खनिजों Ca9(PO4)6 . CaX2 (यहाँ X = F, Cl या OH) उदाहरणफ्लुओरोऐपेटाइट Ca9(PO4)6 CaF2 में मिलता है जो फॉस्फेट चट्टानों के मुख्य घटक होते हैं। फॉस्फोरस प्रोटीन, दूध व अण्डों में मिलता है।
इसके अलावा कुछ यौगिकों जैसे-सोडियम नाइट्रेट (चिली साल्टपीटर), अमोनिया, अमोनियम यौगिक व कुछ उर्वरकों जैसे-यूरिया तथा फॉस्फेट उर्वरकों में भी नाइट्रोजन होता है।
कुछ खनिज निम्न प्रकार हैं जिनमें फॉस्फोरस पाया जाता है:
- हाइड्रॉक्सी ऐपेटाइट - 3Ca3(PO4)2 . Ca(OH)2
- फ्लुओर ऐपेटाइट - 3Ca3(PO4)2 . CaF2
- क्लोरऐपेटाइट- 3Ca3(PO4)2. CaCl2
- फॉस्फोराइट- Ca3(PO4)2
प्रश्न 4.
सीमेन्स और हाल्सके ओजोनाइजर द्वारा ओजोन के निर्माण का सचित्र वर्णन कीजिए तथा पोटैशियम फैरोसायनाइड और स्टेनस क्लोराइड पर इसकी अभिक्रियाओं के रासायनिक समीकरण लिखिए।
उत्तर:
वर्ग में ऊपर से नीचे आने पर अर्थात् परमाणु क्रमांक बढ़ने के साथ-साथ परमाणु त्रिज्या बढ़ती है क्योंकि कोशों की संख्या बढ़ती जाती है।
N < P < As < Sb < Bi (परमाणु त्रिज्या) समूह -15 के तत्वों की परमाण्वीय त्रिज्या, समूह -14 के संगत तत्वों की अपेक्षा छोटी होती है क्योंकि आवर्त में बायें से दायें जाने पर प्रभावी नाभिकीय आवेश बढ़ता जाता है।आयनिक त्रिज्या के मान में भी ऊपर से नीचे जाने पर क्रमशः वृद्धि होती है, यह किसी एक विशेष अवस्था में होती है। (अर्थात् या तो सभी धनायन हों या फिर सभी ऋणायन हों)
N3- < P3- < As3- < Sb3- < Bi3- (आयनिक त्रिज्या)
ओजोन की पोटैशियम फैरोसायनाइड से अभिक्रिया: ओजोन पोटैशियम फैरोसायनाड को पोटैशियम फैरीसायनाइड में ऑक्सीकृत करती है।
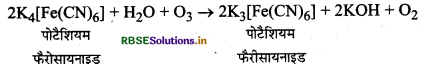
ओजोन की स्टेनस क्लोराइड से अभिक्रिया: यह स्टैनस क्लोराइड को स्टैनिक क्लोराइड में ऑक्सीकृत करती है।
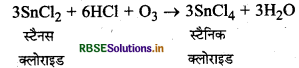

प्रश्न 5.
सीसा कक्ष विधि द्वारा सल्फ्यूरिक अम्ल के निर्माण का सचित्र वर्णन कीजिए। संयंत्र के प्रत्येक भाग में होने वाली रासायनिक अभिक्रियाओं के रासायनिक समीकरण भी दीजिए।
उत्तर:
सीसा कक्ष विधि द्वारा सल्फ्यूरिक अम्ल का निर्माण करने में सल्फर डाइऑक्साइड, वायु और नाइट्रिक ऑक्साइड (उत्प्रेरक) मिश्रण के भाग से क्रिया कराने पर सल्फ्यूरिक अम्ल प्राप्त होता है।

सल्फ्यूरिक अम्ल का निर्माण करने में प्रयुक्त संयंत्र एवं होने वाली रासायनिक अभिक्रियाओं के रासायनिक समीकरण
ऑक्सीकरण अवस्थाएँ (Oxidation State): वर्ग-15 के तत्वों की सामान्य ऑक्सीकरण अवस्थाएँ - 3, + 3 तथा + 5 हैं। परमाणु आकार तथा धातु गुणों में वृद्धि के कारण वर्ग में नीचे की ओर जाने पर -3 ऑक्सीकरण अवस्था प्रदर्शित करने की प्रवृत्ति घटती है। इसी कारण संभवत Bi का कोई भी ऐसा यौगिक ज्ञात नहीं हैं जिसमें Bi की ऑक्सीकरण अवस्था -3 हो। नाइट्रोजन के छोटे आकार तथा उच्च विद्युत ऋणता के कारण यह - 3 ऑक्सीकरण अवस्था दर्शाता है। वर्ग में ऊपर से नीचे की ओर जाने पर +5 ऑक्सीकरण अवस्था का स्थायित्व घटता है।
बिस्मथ (V) का एकमात्र यौगिक BiF5 है। वर्ग में नीचे की ओर + 5 ऑक्सीकरण अवस्था के स्थायित्व में कमी तथा + 3 ऑक्सीकरण अवस्था (अक्रिय युगल प्रभाव के कारण) के स्थायित्व में वृद्धि होती है। + 5 ऑक्सीकरण अवस्था के अलावा ऑक्सीकरण के साथ अभिक्रिया करने पर नाइट्रोजन + 1,+ 2,+ 4 ऑक्सीकरण अवस्थाएँ भी प्रदर्शित करती है। फास्फोरस के कुछ ऑक्सी अम्लों में + 1 तथा + 4 ऑक्सीकरण अवस्था दर्शाता है।
नाइट्रोजन के संयोजीकोश में रिक्त कक्षक नहीं होने के कारण इसकी अधिकतम संयोजकता 4 होती है। जबकि शेष सभी सदस्यों के संयोजकता कोश में रिक्त या पूर्ण भरे d-कक्षक उपलब्ध होने के कारण उनकी संयोजकताएँ 4 से भी अधिक हो सकती हैं। जैसे PCl5, PF6, AsF6 आदि।
अक्रिय युग्म प्रभाव: p -ब्लॉक वर्ग के भारी तत्वों में s उपकोश में उपस्थित इलेक्ट्रॉन युग्म की क्रियाशीलता कम हो जाती है अतः यह बन्ध बनाने में भाग नहीं लेता। इसे अक्रिय युग्म प्रभाव कहते हैं।
नाइट्रोजन में असमानुपात: नाइट्रोजन कई ऑक्सीकरण अवस्थाओं को प्रदर्शित करता है। इसी प्रकार फॉस्फोरस की लगभग सभी मध्यवर्ती ऑक्सीकरण अवस्थाएँ क्षार व अम्ल दोनों में + 5 और - 3 ऑक्सीकरण अवस्थाओं में असमानुपातित हो जाती हैं हालांकि आर्सेनिक ऐन्टिमनी और बिस्मथ की + 3 ऑक्सीकरण अवस्था असमानुपातन के सन्दर्भ में बहुत अधिक स्थायी हो जाती है।
प्रश्न 6.
सल्फ्यूरिक अम्ल एक ऑक्सीकारक एवं निर्जलीकारक है। इसके एक-एक उदाहरण दीजिए।
उत्तर:
ऑक्सीकरण अवस्थाएँ (Oxidation State): वर्ग-15 के तत्वों की सामान्य ऑक्सीकरण अवस्थाएँ - 3, + 3 तथा + 5 हैं। परमाणु आकार तथा धातु गुणों में वृद्धि के कारण वर्ग में नीचे की ओर जाने पर -3 ऑक्सीकरण अवस्था प्रदर्शित करने की प्रवृत्ति घटती है। इसी कारण संभवत Bi का कोई भी ऐसा यौगिक ज्ञात नहीं हैं जिसमें Bi की ऑक्सीकरण अवस्था -3 हो। नाइट्रोजन के छोटे आकार तथा उच्च विद्युत ऋणता के कारण यह - 3 ऑक्सीकरण अवस्था दर्शाता है। वर्ग में ऊपर से नीचे की ओर जाने पर +5 ऑक्सीकरण अवस्था का स्थायित्व घटता है।
बिस्मथ (V) का एकमात्र यौगिक BiF5 है। वर्ग में नीचे की ओर + 5 ऑक्सीकरण अवस्था के स्थायित्व में कमी तथा + 3 ऑक्सीकरण अवस्था (अक्रिय युगल प्रभाव के कारण) के स्थायित्व में वृद्धि होती है। + 5 ऑक्सीकरण अवस्था के अलावा ऑक्सीकरण के साथ अभिक्रिया करने पर नाइट्रोजन + 1,+ 2,+ 4 ऑक्सीकरण अवस्थाएँ भी प्रदर्शित करती है। फास्फोरस के कुछ ऑक्सी अम्लों में + 1 तथा + 4 ऑक्सीकरण अवस्था दर्शाता है।
नाइट्रोजन के संयोजीकोश में रिक्त कक्षक नहीं होने के कारण इसकी अधिकतम संयोजकता 4 होती है। जबकि शेष सभी सदस्यों के संयोजकता कोश में रिक्त या पूर्ण भरे d-कक्षक उपलब्ध होने के कारण उनकी संयोजकताएँ 4 से भी अधिक हो सकती हैं। जैसे PCl5, PF6, AsF6 आदि।
अक्रिय युग्म प्रभाव: p -ब्लॉक वर्ग के भारी तत्वों में s उपकोश में उपस्थित इलेक्ट्रॉन युग्म की क्रियाशीलता कम हो जाती है अतः यह बन्ध बनाने में भाग नहीं लेता। इसे अक्रिय युग्म प्रभाव कहते हैं।
नाइट्रोजन में असमानुपात: नाइट्रोजन कई ऑक्सीकरण अवस्थाओं को प्रदर्शित करता है। इसी प्रकार फॉस्फोरस की लगभग सभी मध्यवर्ती ऑक्सीकरण अवस्थाएँ क्षार व अम्ल दोनों में + 5 और - 3 ऑक्सीकरण अवस्थाओं में असमानुपातित हो जाती हैं हालांकि आर्सेनिक ऐन्टिमनी और बिस्मथ की + 3 ऑक्सीकरण अवस्था असमानुपातन के सन्दर्भ में बहुत अधिक स्थायी हो जाती है।
प्रश्न 7.
इलेक्ट्रॉनिक विन्यास के आधार पर नाइट्रोजन वर्ग (पाँचवें वर्ग) के तत्वों की आवर्त सारणी में स्थिति की विवेचना कीजिए।
उत्तर:
इन तत्वों के बाह्या संयोजी कोश का इलेक्ट्रॉनिक विन्यास ns2 np3 होता है। इनके संयोजी कोश में 5 इलेक्ट्रॉन होते हैं।
तत्वों का विन्यास निम्न प्रकार है:
वर्ग में ऊपर से नीचे आने पर अर्थात् परमाणु क्रमांक बढ़ने के साथ-साथ परमाणु त्रिज्या बढ़ती है क्योंकि कोशों की संख्या बढ़ती जाती है।
N < P < As < Sb < Bi (परमाणु त्रिज्या)
समूह - 15 के तत्वों की परमाण्वीय त्रिज्या, समूह - 14 के संगत तत्वों की अपेक्षा छोटी होती है क्योंकि आवर्त में बायें से दायें जाने पर प्रभावी नाभिकीय आवेश बढ़ता जाता है।
आयनिक त्रिज्या के मान में भी ऊपर से नीचे जाने पर क्रमशः वृद्धि होती है, यह किसी एक विशेष अवस्था में होती है। (अर्थात् या तो सभी धनायन हों या फिर सभी ऋणायन हों)
N3- < P3- < As3- < Sb3- < Bi3 ( आयनिक त्रिज्या)
आयनन ऐनैल्पी (Iontuation Enthalpy):
समूह - 15 के तत्वों की आयनन ऐन्थैल्पी कां मान समूह - 14 के संगत तत्वों की अपेक्षा अधिक होता है क्योंकि आवर्त सारणी में बायें से दायें जाने पर प्रभावी नाभिकीय आवेश का मान बढ़ता जाता है फलस्वरूप आकार ब्बेटा हो जाता है और बाह्यतम इलेक्ट्रॉन पर नाभिक का आकर्षण बल बढ़ जाता है। इस कारण से आयनन ऐन्थैल्पी का मान बढ़ जाता है।
समूह - 15 के तत्त्वों की प्रथम आयनन ऐन्थैल्पी का मान समूह - 16 के संगत तत्वों की अपेक्षा भी अधिक होता है, इसका कारण यह है कि समूह - 15 के तत्वों में p - उपकोश आधा भरा होता है P3 जो कि एक स्थायी विन्यास है, जिसमें इलेक्ट्रॉन निकालने के लिये अधिक ऊर्जा की आवश्यकता होती है।
समूह - 14 < समूह - 15 > समूह - 16 (प्रथम आयनन ऐन्थैल्पी) समूह - 15 में, विभिन्न आयनन एन्थैल्पियों का आपेक्षित क्रम निम्न होता है:

विद्युत्-त्रणात्मकता (Blectronegativity): समूह में नीचे आने पर विद्युत्-ऋणात्मकता का मान धीरे-धीरे घटता ज़ाता है क्योंकि परमाण्वीय त्रिज्या का मान बढ़ता जाता है।
N > P > As > Sb > Bi ( विद्युत् - ऋणात्मकता)
भौतिक गुण (Physical Properties) समूह 15 के तत्वों के भौतिक गुण निम्नवत् है
(1) भौतिक अवस्था (Physical State): इस वर्ग में नाइट्रोजन गैस अवस्था में, फॉस्फोरस मोम सदृश ठोस, जो कि वाष्पशील ठोस है, तथा शेष सभी तत्व ठोस होते हैं।
(2) धात्विक गुण (Metallie Character): समूह में ऊपर से नीचे आने पर आयनन ऐन्थैल्पी का मान घटता जाता है जिससे इलेक्ट्रॉन सुगमता से पृथक् किये जा सकते हैं। इस कारण विद्युत्धनी गुण (electropositive character) बढ़ता है अर्थात् धात्विक गुण बढ़ता जाता है।
N < P < As < Sb < Bi (धात्विक गुण) अधातु उप-धातु धातु
(3) गलनांक एवं क्वथनांक (Melting and Boiling Points): N से As तक गलनांक बढ़ता है परन्तु Sb एवं Bi पर कम होता है। नीचे जा पर गलंनाक का मान इस कारण बढ़ता है क्योंकि परमाणु द्रव्यमान बढ़ता है। Sb एवं Bi के गलनांक के मान में कमी का कारण अक्रिय युग्म प्रभाव है। अक्रिय युग्म प्रभाव (Inert pair effect) के कारण ये पाँच के स्थान पर केवल तीन ही सह-संयोजक बन्ध बना पाते हैं जिस कारण परमाणुओं के मध्य अन्तरा आण्विक: आकर्षण बल कम हो जाता है और गलनांक भी कम हो जाता है।
N < P < As > Sb > Bi (गलनांक) नीचे आने पर क्वथनांक के मान में नियमित वृद्धि होती है।
N < P < As < Sb < Bi (क्व थनांक)
(4) घनत्व (Density) वर्ग में नीचे जाने पर घनत्व बढ़ता जाता है।
(5) श्रृंखलन (Catenation): इस समूह में केवल तीन तत्व अर्थात् N, P एवं As ही श्रृंखलन के गुण को प्रदर्शित करते हैं। जिसमें फ़ॉस्फोरस की प्रकृति सबसे ज्यादा शृंखलन प्रदर्शित करने की होती है क्योंकि फ़ॉस्फोरस की बन्ध ऊर्जा सबसे अधिक होती है।
शृंखलन प्रवृत्ति α बन्ध ऊर्जा
(9 अपररूपता-नाइट्रोजन तथा विस्मथ के अलावा सभी तत्वों में अपररूपता का गुण पाया जाता है।
रासायनिक गुण (Chemical Properties):
ऑक्सीकरण अवस्थाएँ (Oxidation State): वर्ग - 15 के तत्वों की सामान्य ऑक्सीकरण अवस्थाएँ -3, +3 तथा + 5 हैं। परमाणु आकार तथा धातु गुणों में वृद्धि के कारण वर्ग में नीचे की ओर जाने पर -3 ऑक्सीकरण अवस्था प्रदर्शित करने की प्रवृत्ति घटती है। इसी कारण संभवत Bi का कोई भी ऐसा यौगिक ज्ञात नहीं हैं जिसमें Bi की ऑक्सीकरण अवस्था -3 हो। नाइट्रोजन के छोटे आकार तथा उच्च विद्युत ऋणता के कारण यह -3 ऑक्सीकरण अवस्था दर्शाता है। वर्ग में ऊपर से नीचे की ओर जाने पर +5 ऑक्सीकरण अवस्था का स्थायित्व घटता है।
बिस्मथ (V) का एकमात्र यौगिक BIF है। वर्ग में नीचे की ओर +5 ऑक्सीकरण अवस्था के स्थायित्व में कमी तथा +3 ऑक्सीकरण अवस्था (अक्रिय युगल प्रभाव के कारण) के स्थायित्व में वृद्धि होती है। +5 ऑक्सीकरण अवस्था के अलावा ऑक्सीकरण के साथ अभिक्रिया करने पर नाइट्रोजन + 1, +2, +4 ऑक्सीकरण अवस्थाएँ भी प्रदर्शित करती है। फास्फोरस के कुछ ऑक्सी अम्लों में +1 तथा +4 ऑक्सीकरण अवस्था दर्शाता है।
नाइट्रोजन के संयोजीकोश में रिक्त कक्षक नहीं होने के कारण इसकी अधिकतम संयोजकता 4 होती है। जबकि शेष सभी सदस्यों के संयोजकता कोश में रिक्त या पूर्ण भरे d-कक्षक उपलब्ध होने के कारण उनकी संयोजकताएँ 4 से भी अधिक हो सकती हैं। जैसे PCl5, PF6, AsF6 आदि।
अक्रिय युग्म प्रभाव: p -ब्लॉक वर्ग के भारी तत्वों में s उपकोश में उपस्थित इलेक्ट्रॉन युग्म की क्रियाशीलता कम हो जाती है अतः यह बन्ध बनाने में भाग नहीं लेता। इसे अक्रिय युग्म प्रभाव कहते हैं।
नाइट्रोजन में असमानुपात: नाइट्रोजन कई ऑक्सीकरण अवस्थाओं को प्रदर्शित करता है। इसी प्रकार फॉस्फोरस की लगभग सभी मध्यवर्ती ऑक्सीकरण अवस्थाएँ क्षार व अम्ल दोनों में + 5 और - 3 ऑक्सीकरण अवस्थाओं में असमानुपातित हो जाती हैं हालांकि आर्सेनिक ऐन्टिमनी और बिस्मथ की + 3 ऑक्सीकरण अवस्था असमानुपातन के सन्दर्भ में बहुत अधिक स्थायी हो जाती है।

प्रश्न 8.
हेबर विधि द्वारा अमोनिया के औद्योगिक निर्माण का नामांकित चित्र सहित वर्णन कीजिए। इसके दो प्रमुख गुण एवं दो उपयोग लिखिए। इस विधि में ला-शातेलिए नियम का क्या महत्व है?
उत्तर:
अमोनिया नाइट्रोजन का एक महत्वपूर्ण यौगिक है, वातावरण में यह अति सूक्ष्म मात्राओं में वायु तथा मिट्टी में उपस्थित रहती है। सार्वजनिक मूत्र स्थलों तथा मवेशियों के रहने के स्थानों पर अमोनिया की गन्ध को महसूस किया जा सकता है।
NH2CONH2 + 2H2O → (NH4)2CO3 + 2NH3 + H2O + CO2
मृदा में अमोनिया, अमोनियम क्लोराइड तथा अमोनियम सल्फेट के रूप में पायी जाती है। अत्यधिक मात्रा में अमोनिया कुछ उपग्रहों, जैसे-ज्यूपिटर या वृहस्पति तथा शनि पर पायी जाती है।
विरचन (Preparation):
(1) प्रयोगशाला विधि (Laboratory Method): प्रयोगशाला में अमोनियम लवण की कास्टिक सोड़ा (NaOH) या कैल्शियम हाइड्रोक्साइड [Ca(OH)2] से क्रिया कराने पर अमोनिया प्राप्त होती है।

(2) यूरिया केजल अपघटन से (By Hydrolysis of Urea): यूरिया का जल अपघटन कराने पर अमोनियम कार्बोनेट बनता है जो कि पुनः अपघटित होकर अमोनिया बनाता है।
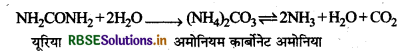
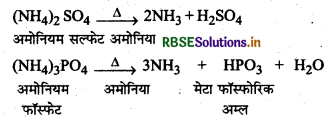
(3) कुछ अमोनियम लवणों को गर्म करके (By Heating Some Ammonium Salts): अवाष्पशील अम्लों जैसे सल्फ्यूरिक अम्ल व फॉस्फोरिक अम्ल के कुछ अमोनियम लवणों को तीव्र रूप से गर्म करने पर अमोनिया निकलती है।
(4) अमोनिया का औद्योगिक निर्माण (हेबर प्रक्रम) [Industrial Preparation of Ammonia (Haber Process)]

अमोनिया की अधिक मात्रा प्राप्त करने की शर्ते: ला-शातेलिये सिद्धान्त के अनुसार,
- N2 तथा H2 की सान्द्रता उच्च करने पर अधिक अमोनिया प्राप्त होगी।
- चूँकि अभिक्रिया ऊष्माक्षेपी है अत: कम ताप (700K) अधिक अमोनिया उत्पादन के लिये उपयुक्त है।
- उच्च दाब अर्थात् 200 - 900 atm अधिक अमोनिया उत्पादन के लिये उपयुक्त है।
- थोड़ी सी मात्रा K2O तथा Al2O3 युक्त आयरन ऑक्साइड जैसे उत्प्रेरक उपयोगी हैं।
- उत्पादन की दर को बढ़ाने के लिये अमोनिया को समय-समय पर निकालते रहना चाहिए।

विधि (Method): अमोनिया के निर्माण के लिये आवश्यक हाइड्रोजन को जल के विद्युत् अपघटन से प्राप्त करते हैं। नाइट्रोजन को दवित वायु के प्रभाजी आसवन से प्राप्त करते हैं। इन गैसों को अशुद्धियों से मुक्त कराकर लगभग 200 atm पर प्रवाहित करते हैं। अब इन गैसों को उत्प्रेरक व वर्द्धक युक्त उत्प्रेरक कक्ष में प्रवाहित करते हैं। कक्ष का ताप लगभग 700 K रखा जाता है। अभिक्रिया के फलस्वरूप अमोनिया गैस बनती है तथा अभिक्रिया ऊष्माक्षेपी होने के कारण, इसमें उत्पन्न ऊष्मा का उपयोग ताप को नियन्त्रित करने में किया जाता है। अत: कक्ष को दोबारा गर्म करने की आवश्यकता नहीं पड़ती है।
उत्प्रेरक कक्ष से निकली गैसों में 15 से 20% अमोनिया तथा अनअभिकृत डाइ-नाइट्रोजन व डाइ-ऑक्सीजन गैसें भी होती हैं। इन गैसों के मिश्रण को एक संघनन पाइप (condensation pipe) में से गुजारते हैं। जहाँ अमोनिया गैस तो द्रवित हो जाती है जबकि डाइ-नाइट्रोजन व डाइ-ऑक्सीजन गैस द्रवित नहीं होती है। इन गैसों को वापस संचरित करते हैं तथा ये आने वाले ताजे गैसीय मिश्रण में मिलकर पुन: अमोनिया के निर्माण में प्रयुक्त हो जाती हैं। अभिक्रिया में 700K ताप पर थोड़ी मात्रा में एल्यूमिनियम आक्साइड युक्त आयरन ऑक्साइड को उत्प्रेरक के रूप में प्रयोग करने पर शीघ्र ही साम्य स्थापित हो जाता है।
अमोनिया गैस को शुष्क करना (Drying ofAmmonia Gas) प्रयोगशाला या फिर औद्योगिक विधि से बनाई गई अमोनिया गैस नम होती है। नम अमोनिया गैस को चूने (CaO), पर प्रवाहित कर शुष्क किया जाता है। अमोनिया गैस सान्द्र सल्फ्यूरिक अम्ल, निर्जल कैल्शियम क्लोराइड या फॉस्फोरस पेन्टा ऑक्साइड द्वारा शुष्क नहीं की जा सकती है, क्योंकि यह उनसे अभिक्रिया करती है।
अमोनिया के भौतिक गुण (Physical Properties ofAmmonia)
(i) अमोनिया एक विशेष तीक्ष्ण गंध वाली रंगहीन गैस है। इसको सूंघने से आँखों में आँसू आ जाते हैं।
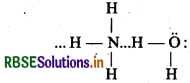
(ii) यह जल में अत्यधिक विलेय होती है। इसकी विलेयता का कारण हाइड्रोजन बंध है।
(iii) यह गैस वायु से हल्की होती है।
(iv) यह आसानी से द्रवीभूत की जा सकती है क्योंकि इसका वाष्पदाब काफी उच्च होता है।
(v) इसका हिमांक तथा क्वथनांक क्रमशः 1984 तथा 239.7K है।
(vi) अमोनिया गैस जल में अत्यधिक विलेय है।
OH- आयन जल में बनाने के कारण इसका जलीय विलयन दुर्बलतः क्षारीय होता है। यह H+ आयन ग्रहण करने के कारण ब्रान्स्टेड लौरी के अनुसार क्षारीय है।
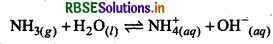
प्रश्न 9.
डीकन विधि द्वारा क्लोरीन के औद्योगिक निर्माण का सचित्र वर्णन कीजिए। इसकी अमोनिया के साथ अभिक्रिया लिखिए।
आवश्यक रासायनिक समीकरण भी लिखिए।
उत्तर:
डीकन विधि या HCl से क्लोरीन के निर्माण की विधि इस विधि में HCl का ऑक्सीकरण क्यूप्रस क्लोराइड (उत्प्रेरक) की उपस्थित में वायु की ऑक्सीजन द्वारा निम्न प्रकार किया जाता है
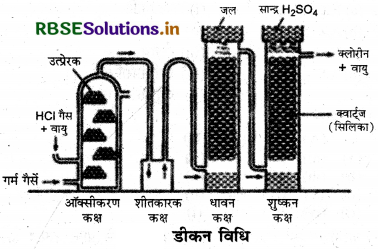
उत्प्रेरक कक्ष में झाँबा पत्थर क्यूप्रस क्लोराइड विलयन में भिगोकर रख देते हैं तथा ताप 450°C कर देते हैं। HC1 तथा वायु का मिश्रण 4 : 1 के अनुपात में लेकर उत्प्रेरक कक्ष में प्रवाहित किया जाता है। यहाँ क्लोरीन बनती है, पर इसमें HCl, N2, O2 तथा जल-वाष्प मिले हाते हैं। इस मिश्रण को स्क्रबर में प्रवाहित करके HCl हटा देते हैं। दूसरे कक्ष में प्रवाहित करने पर सान्द्र H2SO4 द्वारा जल-वाष्प पृथक् कर देते हैं। इस प्रकार N2 O2 मिश्रित क्लोरीन प्राप्त होती है। उत्प्रेरक की क्रिया निम्न प्रकार होती है।
2Cu2Cl2 + O2 → 2Cu2OCl2
2HCl + Cu2OCl2 → 2CuCl2 + H2O
रासायनिक अभिक्रियाएँ:
1. यह सोडियम आर्सेनाईट को सोडियम आर्सिनेट में ऑक्सीकृत कर देती है।
Na3AsO3 + H2O + Cl2 → Na3AsO4 + 2HCl
2. क्लोरीन गर्म चूने के पानी के साथ कैल्सियम क्लोराइड तथा कैल्सियम क्लोरेट बनाती है।
6Ca(OH)2 + 6Cl2 → 5CaCl2 + Ca(CIO3)2 + 6H2O
ऑक्सीकरण गुण-यह H2S को सल्फर में ऑक्सीकृत कर देती
H2S + Cl2 → 2HCl + S ↑
NH3 से अभिक्रिया:
NH3 + 3Cl2 → NCl3 + 3HCl

प्रश्न 10.
प्रयोगशाला में हाइड्रोक्लोरिक अम्ल के विरचन की विधि, प्रमुख रासायनिक गुण तथा उपयोग का वर्णन कीजिए।
उत्तर:
1772 में डेनियल रदरफोर्ड (Daniel Rutherford) ने नाइट्रोजन की खोज की थी। यह आण्विक अवस्था में द्विपरमाणुक अणु (N2) के रूप में पायी जाती है, जिसमें परमाणु परस्पर त्रिआबन्ध से जुड़े imm होते हैं।
निर्माण (Preparation):
(i) व्यावसायिक उत्पादन (Commercial Production ): N2 का व्यावसायिक उत्पादन वायु के द्रवीकरण एवं प्रभाजी आसवन से किया जाता है। हवा में नाइट्रोजन की प्रतिशत मात्रा 78% होती है। द्रवीकरण के पश्चात् प्रभाजी आसवन करने पर पहले द्रव नाइट्रोजन (क्वथनांक 77.2K ) आसवित होती है तथा आसवन फ्लास्क में ऑक्सीजन (क्वथनांक 90K) शेष रह जाती है।
(ii) प्रयोगशाला विधि (Laboratory Method):
(a) अमोनियम नाइट्राइट के तापीय अपघटन के द्वारा (By Thermal Decomposition of Ammonium nitrite)
पहले अमोनियम क्लोराइड के जलीय विलयन की अभिक्रिया सोडियम नाइट्राइट के साथ करायी जाती है। उसके बाद अमोनियम नाइट्राइट का तापीय अपघटन किया जाता है।
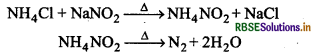
(b) अमोनियम डाइक्रोमेट के तापीय अपघटन से (Thermal Decomposition of Ammonium dichromate): जब अमोनियम डाइक्रोमेट को गर्म किया जाता है तो डाइ नाइट्रोजन निकलती है।
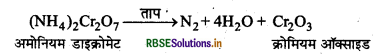
(c) ऐजाइडों के तापीय अपघटन से (By Thermal Decomposition of Azides): बेरियम ऐजाइड तथा सोडियम ऐजाइड को गर्म करने पर यह अपघटित होकर शुद्ध डाइ- नाइट्रोजन बनाता है।
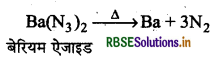
भौतिक एवं रासायनिक गुण (Physical and Chemical Properties):
(A) भौतिक गुण (Physical Properties):
- यह एक रंगहीन, गंधहीन, स्वादहीन तथा अविषैली गैस है।
- नाइट्रोजन परमाणु के दो समस्थानिक 14N तथा 15N होते हैं।
- इसकी जल में विलेयता काफी कम होती है। (23.2 cm3/L जल, 273K ताप तथा 1 bar दाब पर)
- डाइ-नाइट्रोजन के वातावरण में जन्तुओं को रखने से वे डाई-ऑक्सीजन की अनुपलब्धता तथा दम घुटने से मर जाते हैं।
- इसका गलनांक 63.2K तथा क्वथनांक 77K होता है।
- आण्विक कक्षक सिद्धान्त (Molecular orbital theory) के अनुसार डाई नाइट्रोजन का व्यवहार प्रतिचुम्बकीय होता है।
इसका (M.O.) इलेक्ट्रॉनिक विन्यास निम्न प्रकार है।
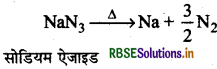
(B) रासायनिक गुण (Chemical Properties)
(i) धातुओं से क्रिया (Reaction with metals): N= Nबन्ध की उच्च बन्ध ऐन्थैल्पी के कारण डाइ-नाइट्रोजन कमरे के ताप पर काफी अक्रिय है। यद्यपि ताप में वृद्धि के साथ क्रियाशीलता तेजी से बढ़ती है। उच्च ताप पर यह सीधे धातुओं के साथ संयुक्त होकर आयनिक नाइट्राइड बनाती है। जैसे
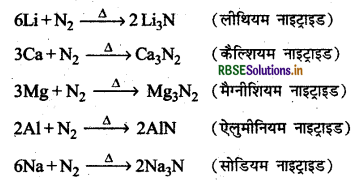
(ii) अधातुओं से क्रिया (Reaction with Non-metals): कुछ विशिष्ट परिस्थितियों में ही नाइट्रोजन अधातुओं से क्रिया करती है तथा सह-संयोजक नाइट्राइड बनते हैं।
उदाहरण:
(a) हाइड्रोजन से क्रिया (हेबर विधि)-यह उत्प्रेरक की उपस्थिति में लगभग 773K ताप पर हाइड्रोजन के साथ संयोजित होकर अमोनिया बनाती है।
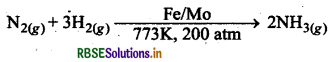
∆H°= -46.1 RJ/mol
(b) ऑक्सीजन से क्रिया: N2 केवल अत्यधिक उच्च ताप (लगभग 2000 K) पर डाइ-ऑक्सीजन से संयोग करके नाइट्रिक ऑक्साइड, NO बनाती है।

डाइनाइट्रोजन के उपयोग (Uses of Dinitrogen)
- अमोनिया तथा नाइट्रोजन युक्त अन्य औद्योगिक रसायनों के निर्माण में।
- अक्रिय वातावरण उत्पन्न करने में (लोहा और स्टील उद्योग में)
- द्रव नाइट्रोजन का उपयोग जैविक पदार्थों एवं खाद्य सामग्री के लिये प्रशीतक के रूप में और क्रायो सर्जरी में किया जाता है।
- यह विद्युत् बल्बों में भरने के काम आती है, कुछ धातुकर्म प्रक्रमों में यह निष्क्रिय वातावरण बनाने में प्रयुक्त होती है।
प्रश्न 11.
विरंजक चूर्ण क्या है? विरंजक चूर्ण के निर्माण की विधि का वर्णन नामांकित चित्र के साथ कीजिए तथा इसका एक ऑक्सीकारक गुण भी लिखिए।
उत्तर:
यह एक मिश्रित लवण है जिसको कैल्सियम क्लोरोहाइपो क्लोराट भी कहते हैं। विरंजक चूर्ण के एक अणु में एक कैल्सियम आयन (Ca2+), एक क्लोराइड आयन (Cl-) तथा एक हाइपोक्लोराइट आयन (OCl-) होते हैं, जिसको Ca2+ (Cl-) (OCl-) रूप में भी व्यक्त कर सकते हैं। विरंजक चूर्ण का निर्माण बैचमान विधि द्वारा किया जाता है। इसके अन्तर्गत शुष्क बुझे हुए चूने पर क्लोरीन की अभिक्रिया करायी जाती है। 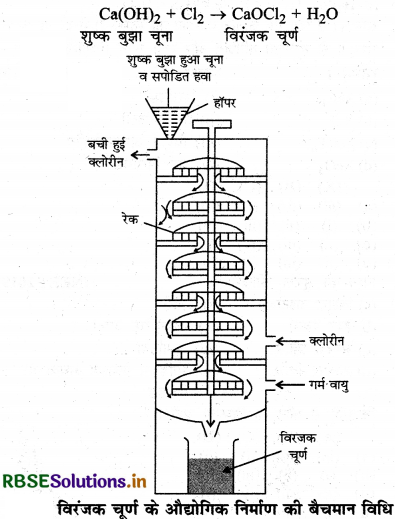
विधि: यह विधि विरंजक चूर्ण (CaOCl2) बनाने की आधुनिक विधि है। इसमें लोहे का बना हुआ एक टॉवर होता है जिसमें खाने बने होते हैं। संयंत्र के ऊपरी भाग से हॉपर द्वारा बुझा हुआ चूना [Ca(OH2)] डाला जाता है। टॉवर में नीचे से गर्म वायु और क्लोरीन की धारा प्रवाहित की जाती है। Ca(OH)2 व Cl2 गैस की क्रिया से विरंजक चूर्ण बनता है, जिसे संयंत्र के निचले भाग से बाहर निकाल लेते हैं। व्यर्थ गैसें संयंत्र के ऊपरी भाग से बाहर निकल जाती है।
ऑक्सीकारक गुण:
यह तनु अम्ल की अभिक्रिया से ऑक्सीजन देता है, अतः यह एक ऑक्सीकारक है।
1. यह PbO को PbO2 में ऑक्सीकृत कर देता है।
2CaOCl2 + 2PbO → 2CaCl + 2PbO2
2. यह अम्लीय माध्यम में KI को I2 में ऑक्सीकृत कर देता है।
CaOCl2 + 2CH3COOH + 2KI → (CH3COO)2Ca + 2KCI + I2 + H2O
विगत वर्षों में प्रतियोगी परीक्षा में पूछे गए प्रश्न:
बहुविकल्पीय प्रश्न:
प्रश्न 1.
H2E (E = O, S, Se, Te तथा PO) के लिए तापीय स्थायित्व का सही क्रम है।
(a) H2Se < H2Te < H2PO < H2O < H2S
(b) H2S < H2O< H2Se < H2Te < H2PO
(c) H2O < H2S < H2Se < H2Te < H2PO
(d) H2PO < H2Te < H2Se < H2S < H2O
उत्तर:
(d) H2PO < H2Te < H2Se < H2S < H2O

प्रश्न 2.
स्तम्भ - I में दिए गए जीनॉन यौगिकों का स्तम्भ - II में दी गई उनकी संरचना से सुमेलित कीजिये और सही कोड निर्धारित कीजिए।
स्तम्भ - I
(a) XeF4
(b) XeF6
(c) XeOF4
(d) XeO3
स्तम्भ - II
(i) पिरामिडी
(ii) वर्ग समतली
(iii) विकृत अष्टफलकीय
(iv) वर्ग पिरामिडी
(A) (B) (C) (D)
(a) (iii) (iv) (i) (ii)
(b) (i) (ii) (iii) (iv)
(c) (i) (iii) (iv) (i)
(d) (ii) (iii) (i) (iv)
उत्तर:
(c) (i) (iii) (iv) (i)
प्रश्न 3.
निम्न को सुमेल कीजिये।
(a) विशुद्ध नाइट्रोजन
(b) हैबर प्रक्रम
(c) सम्पर्क प्रक्रम
(d) डीकल विधि
(i) क्लोरीन
(ii) सल्फ्यूरिक अम्ल
(iii) अमोनिया
(iv) सोडियम ऐजाइड अथवा बेरियम
ऐजाइड
निम्न में से कौन-सा विकल्प सही है?
(A) (B), (C) (D)
(a) (ii) (iv) (i) (ii)
(b) (i) (i) (iii) (iv)
(c) (ii) (ii) (iv) (i)
(d) (ii) (iii) (i) (iv)
उत्तर:
(a) विशुद्ध नाइट्रोजन
प्रश्न 4.
निम्न में से PCl5 से सम्बन्धित गलत कथन को पहचानिए
(a) PCl5 अणु अनभिक्रियाशील है।
(b) तीन मध्यवर्ती P - Cl आबन्ध एक दूसरे से 120° का कोण बनाते हैं
(c) दो अक्षीय P - Cl आबन्ध एक दूसरे से 180° का कोण बनाते हैं
(d) अक्षीय P - CI आबन्ध, मध्यवर्ती P - Cl आबन्ध की तुलना में लम्बे होते हैं
उत्तर:
(a) PCl5 अणु अनभिक्रियाशील है।
प्रश्न 5.
हैलोजनों के लिए निम्नलिखित में से कौन-सा कथन सत्य नहीं है?
(a) फ्लुओरीन के अलावा सभी धनात्मक ऑक्सीकरण अवस्थाएँ. दर्शाते हैं
(b) सभी ऑक्सीकारक अभिकर्मक हैं
(c) सभी एकल क्षारीय ऑक्सी अम्ल बनाते हैं
(d) क्लोरीन की सर्वाधिक इलेक्ट्रॉन ग्रहण एन्थैल्पी है
उत्तर:
(b) सभी ऑक्सीकारक अभिकर्मक हैं

प्रश्न 6.
निम्न में से कौन-से आयन युग्म में दोनों स्पीशीज में S - S आबंध हैं?
(a) S2O72- S2O2-3
(b) S4O62- S2O32-
(c) S2O72-, S2O82-
(d) S4O2-6, S2O2-7
उत्तर:
(b) S4O62- S2O32-
प्रश्न 7.
स्तम्भ - I के अंतराहैलोजन यौगिकों को इनके स्तम्भ - II में ज्यामिती से मिलान का सही संकेत है
स्तम्भ - I
(a) XX'
(b) XX'3
(c) XX'5
(d) XX'7
स्तम्भ - II
(i) T - आकृति
(ii) पंचकोणीय द्विपिरामिडी
(iii) रेखीय
(iv) वर्ग पिरामिडी
(v) चतुष्फलकीय संकेत
(A) (B) (C) (D)
(a) (iii) (iv) (i) (ii)
(b) (iii) (i) (iv) (ii)
(c) (v) (iv) (iii) (ii)
(d) (iv) (ii) (ii) (i)
उत्तर:
(b) (iii) (i) (iv) (ii)
प्रश्न 8.
नाइट्रोजन की CaC2 के साथ अभिक्रिया से प्राप्त उत्पाद है:
(a) CaCN2
(b) CaCN
(c) CaCN
(d) Ca2CN
उत्तर:
(d) Ca2CN
प्रश्न 9.
निम्न में से कौन-सा कथन दिए गये अम्लों के लिए सही है?
(a) फॉस्फिनिक अम्ल द्विप्रोटी अम्ल है जबकि फॉस्फोनिक अम्ल एक प्रोटी अम्ल है
(b) फॉस्फिनिक अम्ल एक प्रोटी अम्ल है जबकि फॉस्फोनिक अम्ल द्विप्रोटी है
(c) दोनों त्रिप्रोटी अम्ल हैं
(d) दोनों द्विप्रोटी अम्ल नहीं हैं।
उत्तर:
(d) दोनों द्विप्रोटी अम्ल नहीं हैं।

प्रश्न 10.
H3PO2 के प्रबल अपचायक गुण का कारण है:
(a) एक-OH समूह एवं दो P – H आबंधों की उपस्थिति
(b) फॉस्फोरस को उच्च इलेक्ट्रॉन लब्धि ऐन्थैल्पी
(c) फॉस्फोरस की उच्च ऑक्सीकरण अवस्था
(d) दो-OH समूहों व एक P - H आबन्ध की उपस्थिति
उत्तर:
(d) दो-OH समूहों व एक P - H आबन्ध की उपस्थिति

- RBSE Class 12 Chemistry Notes Chapter 16 दैनिक जीवन में रसायन
- RBSE Class 12 Chemistry Notes Chapter 15 बहुलक
- RBSE Class 12 Chemistry Notes Chapter 14 जैव-अणु
- RBSE Class 12 Chemistry Notes Chapter 13 ऐमीन
- RBSE Class 12 Chemistry Notes Chapter 12 ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
- RBSE Class 12 Chemistry Notes Chapter 11 ऐल्कोहॉल, फीनॉल एवं ईथर
- RBSE Class 12 Chemistry Notes Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
- RBSE Class 12 Chemistry Notes Chapter 9 उपसहसंयोजन यौगिक
- RBSE Class 12 Chemistry Notes Chapter 8 d- एवं f-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम