RBSE Class 12 Chemistry Important Questions Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम
Rajasthan Board RBSE Class 12 Chemistry Important Questions Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम Important Questions and Answers.
RBSE Class 12 Chemistry Chapter 6 Important Questions तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम
बहुविकल्पीय प्रश्न:
प्रश्न 1.
निम्नलिखित में से कौन-सा अयस्क नहीं है?
(i) आयरन पाइराइट
(ii) हॉर्न सिल्वर
(iii) मैलेकाइट
(iv) पिग आयरन
उत्तर:
(iv) पिग आयरन
प्रश्न 2.
कौन से अयस्क का सान्द्रण फेन प्लवन विधि द्वारा किया जाता है?
(i) कार्बोनेट
(ii) सल्फाइड
(iii) ऑक्साइड
(iv) फॉस्फेट
उत्तर:
(ii) सल्फाइड

प्रश्न 3.
लौह अयस्कों का सान्द्रण किया जाता है:
(i) गुरुत्व पृथक्करण विधि द्वारा
(ii) फेन प्लवन विधि द्वारा
(iii) चुम्बकीय पृथक्करण विधि द्वारा
(iv) अमलगम विधि द्वारा
उत्तर:
(ii) फेन प्लवन विधि द्वारा
प्रश्न 4.
निम्नलिखित में से कौन-सा क्षारीय गालक नहीं है?
(i) CaCO3
(ii) CaO
(iii) SiO2
(iv) MgO
उत्तर:
(iii) SiO2
प्रश्न 5.
वात्या भट्टी में आयरन ऑक्साइड अपचयित होता है:
(i) SiO2 द्वारा
(ii) C द्वारा
(iii) CO द्वारा
(iv) CaCO3
उत्तर:
(iii) CO द्वारा
प्रश्न 6.
भर्जन किया जाता है:
(i) ऑक्साइड अयस्क में
(ii) सिलिकेट अयस्क में
(iii) सल्फाइड अयस्क में
(iv) कार्बोनेट अयस्क में।
उत्तर:
(iii) सल्फाइड अयस्क में

प्रश्न 7.
फफोलेदार ताँबा क्या होता है:
(i) शुद्ध कॉपर
(ii) कॉपर का अयस्क
(iii) कॉपर की मिश्र धातु
(iv) कॉपर जिसमें 2% अशुद्धि हो।
उत्तर:
(iv) कॉपर जिसमें 2% अशुद्धि हो।
प्रश्न 8.
मैट में मुख्यतः होता है:
(i) FeS
(ii) Cus
(iii) Cus + Fes
(iv) Cus + Fes
उत्तर:
(iii) Cus + Fes
प्रश्न 9.
कॉपर. का प्रमुख अयस्क है:
(i) कॉपर ग्लान्स
(ii) क्यूप्राइट
(iii) चैलको पायराइट
(iv) मैलाकाइट।
उत्तर:
(iii) चैलको पायराइट
प्रश्न 10.
Cu2O और Cu2S के मिश्रण को गर्म करने पर प्राप्त होगा
(i) Cu2SO3
(ii) CuO + Cus
(iii) Cu + SO3
(iv) Cu + SO2
उत्तर:
(iv) Cu + SO2

प्रश्न 11.
हेमेटाइट द्वारा आयरन के निर्माण में लाइम स्टोनं का कार्य है:
(i) धातुमल की तरह
(ii) अशुद्धि की तरह
(iii) गालक की तरह
(iv) अपचायक की तरह।
उत्तर:
(iii) गालक की तरह
प्रश्न 12.
सबसे अशुद्ध आयरन का रूप है:
(i) कास्ट आयरन
(ii) पिटवाँ लोहा
(iii) इस्पात
(iv) ये सभी।
उत्तर:
(i) कास्ट आयरन
प्रश्न 13.
फूल्स गोल्ड नाम का उपयोग ऐसे खनिज के लिए करते हैं जो सोने की तरह चमकता है। यह है:
(i) आयरन पायराइट
(ii) काँपर पायराइट
(iii) सिनेबार
(iv) कैडमियम सल्फाइड।
उत्तर:
(i) आयरन पायराइट
प्रश्न 14.
कोई खनिज अयस्क कहलाता है यदि धातु:
(i) इससे उत्पन्न की जा सके
(ii) उत्पन्न न की जा सके
(iii) इससे लाभदायक रूप से प्राप्त की जा सकती है
(iv) बहुत महँगी हो।
उत्तर:
(iii) इससे लाभदायक रूप से प्राप्त की जा सकती है
प्रश्न 15.
पाइराइट से कॉपर के निष्कर्षण के दौरान प्राप्त धातुमल मुख्यतः बना होता है:
(i) Cu2S
(ii) FeSiO3
(iii) CuSiO3
(iv) SiO2
उत्तर:
(i) Cu2S
अति लघु उत्तरीय प्रश्न:
प्रश्न 1.
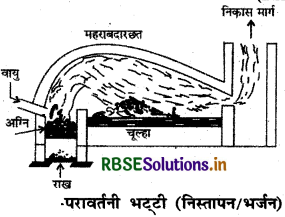
परावर्तनी भट्टी का नामाकिंत चित्र बनाइए।
उत्तर:
प्रश्न 2.
हाइड्रो-धातुकर्म (Hydrometallurgy) क्या होती है?
या
चाँदी का निष्कर्षण सायनाइड विधि द्वारा किस प्रकार करते हैं?
उत्तर:
हाइड्रो-धातुकर्म (Hydrometallurgy): इस विधि में धातु की क्रिया एक रासायनिक यौगिक या अभिकर्मक से कराने पर एक विलेय संकुल बनता है जो कि किसी एक अधिक धनविद्युती धातु द्वारा विस्थापित हो जाता है और हमें शुद्ध धातु प्राप्त हो जाती है।
4Ag + 8NaCN + O2 + 2H2O → 4Na[Ag(CN)2] + 4NaOH 2Na[Ag(CN)2] + Zn → Nan[Zn(CN)4] + 2Ag
प्रश्न 3.
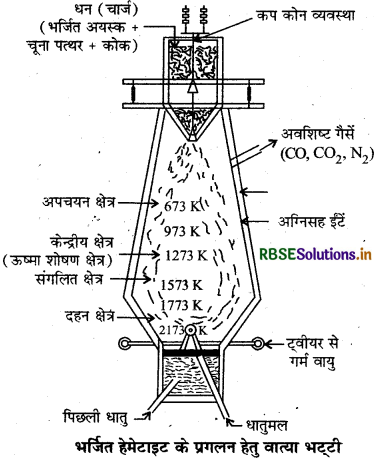
वात्याभट्टी का स्वच्छ एवं नामांकित चित्र बनाइए।
उत्तर:
प्रश्न 4.
बॉक्साइट अयस्क के उपस्थित दो अशुद्धियों के नाम लिखिए।
उत्तर:
Fe2O3 तथा SiO2

प्रश्न 5.
निकिल धातु के शोधन में मॉण्ड प्रक्रम से सम्बन्धित। रासायनिक अभिक्रियाएँ लिखिए।
उत्तर:
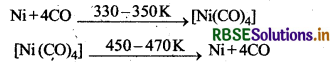
प्रश्न 6.
कॉपर के धातुकर्म में सिलिका की क्या भूमिका है?
उत्तर:
FeS व FeO अथवा गैंग को धातुमल में परिवर्तित करने के लिये कॉपर सिलिका में सिलिका SiO2 को मिलाया जाता है।
प्रश्न 7.
झाग प्लवन विधि में निम्न पदों के उदाहरण दीजिए
1. झाग कारक
2. प्लवनकारक/संग्राही
3. फेन स्थायीकारक
4. सक्रियकारक
5. अवनमक (डिप्रेशर)
उत्तर
- झागकारक (Frothing agents): चीड़ का तेल, यूकेलिप्टस का तेल, कपूर का तेल, क्रेओसोलिक अम्ल।
- प्वलनकारक/संग्राहक (Floating Agents/Collectors): सोडियम ऐथिल जेन्थेट।
- फेन स्थायीकारक (Forth Stabilisers): क्रीसॉल, ऐनिलीन।
- सक्रियकारक (Activators): सोडियम सल्फाइड तथा कॉपर सल्फेट।
- अवनमक (Depressants): सोडियम सायनाइड, सोडियम कार्बोनेट।
प्रश्न 8.
निस्तापन एवं भर्जन में कोई दो अन्तर लिखिए।
उत्तर:
|
निस्तापन |
भर्जन |
|
1. यह प्रक्रिया वायु की अनुपस्थिति में होती है |
1. यह वायु की उपस्थति में होती है। |
|
2. छोटे-छोटे अणुओं का निष्कासन होता है। किन्तु कोई रासायनिक परिवर्तन नहीं होता है। |
2. रासायनिक परिवर्तन होते हैं। जैसे - आक्सीकरण |
प्रश्न 9.
बॉक्साइट अयस्क में उपस्थित किन्हीं दो अशुद्धियों के नाम लिखिए।
उत्तर:
सिलिका (SiO2) व आयरन ऑक्साइड (Fe2O3)।
प्रश्न 10.
निकल धातु शोधन के मॉन्ड प्रक्रम से सम्बन्धित रासायनिक अधिक्रियाएँ लिखिए।
उत्तर:
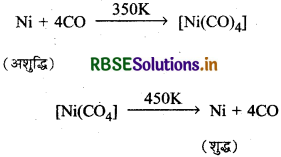
प्रश्न 11.
मण्डल परिष्क्रमण प्रक्रम का नामांकित चित्र बनाइए। यह विधि मुख्य रूप से किसमें उपयोगी है?
उत्तर:
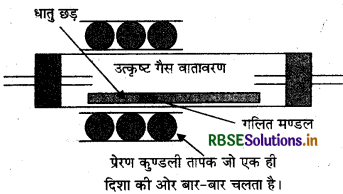
मंडल परिष्करण विधि मुख्य रूप से अर्द्ध चालक व उच्च: शुद्धता वाली धातुओं Ge, Si, B, Ga, In के उत्पादन में प्रयक्त होती है।
प्रश्न 12.
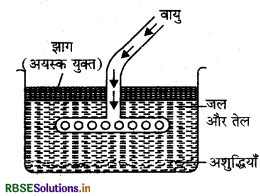
झाग प्लवन विधि का नामांकित चित्र बनाइए।
उत्तर:
अयस्क के सान्द्रण की झाग प्लवन विधि का नामांकित चित्र निम्न है।
प्रश्न 13.
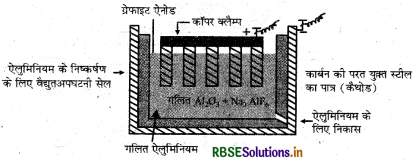
ऐलुमीनियम के निष्कर्षण के लिए प्रयुक्त विद्युत अपघटनी सैल का स्वच्छ नामांकित चित्र बनाइए।
उत्तर:
चित्र-हॉल-हेराल्ट प्रक्रम से गलित ऐलुमिना का विद्युत् अपघटन सेल।

प्रश्न 14.
लोहे के प्रमुख अयस्कों के नाम तथा सूत्र लिखिए।
उत्तर:
- ऑक्साइड अयस्क-लाल हेमेटाइट (Fe2O3.2H2O), मैग्नेटाइट (Fe3O4)
- जलीय ऑक्साइड अयस्क-भूरा हेमेटाइट या लिमोनाइट (Fe2O3, .3H2O)
- कार्बोनेट अयस्क-सिडेराइट (FeCO3)
- सल्फाइड अयस्क-आयरन पाइराइट (FeS2), कॉपर आयरन पाइराइट या कैल्को पाइराइट (CuFeS2)
प्रश्न 15.
कॉपर के दो प्रमुख अयस्कों के नाम तथा सूत्र लिखिए।
उत्तर:
कॉपर के दो प्रमुख अयस्क क्यूप्राइट (Cu2O) व कॉपर पायराइट (CuFeS2) हैं।
प्रश्न 16.
ऐजुराइट तथा सिडेराइट अयस्कों का सूत्र लिखिए।
उत्तर:
ऐजुराइट - 2CuCO3 Cu(OH)2, सिडेराइट (FeCO3)
प्रश्न 17.
ऐलुनाइट अयस्क का संगठन लिखिए।
उत्तर:
K2SO,AI (SA)3,4AI(OH)3
प्रश्न 18.
किन्हीं दो सल्फाइड अयस्कों के नाम लिखिए।
उत्तर:
1. अर्जेण्टाइट (Ag2S)
2. कैल्कोपायराइट (CuFeS2)
प्रश्न 19.
ऐलुमिनियम के दो प्रमुख अयस्कों के नाम तथा सूत्र लिखिए।
उत्तर:
ऐलुमिनियम के दो प्रमुख अयस्क हैं:
1. बॉक्साइट Al2O3, 2H2O
2. क्रायोलाइट Na3AIF6
प्रश्न 20.
अयस्क किसे कहते हैं? अयस्क तथा खनिज में क्या अन्तर है?
उत्तर:
खनिज: पृथ्वी में धातु तथा उनके यौगिक जिस रूप में मिलते हैं, वे खनिज कहलाते हैं; जैसे-रॉक साल्ट (rock salt), NaCl आदि।
अयस्क: पृथ्वी में धातु तथा उनके यौगिक जिस रूप में मिलते हैं, वे खनिज कहलाते हैं; जैसे-लोहे का अयस्क हेमेटाइट, Fe2O : 2H2O है। अतः सभी अयस्क खनिज होते हैं, परन्तु सभी खनिज अयस्क नहीं होते हैं।
प्रश्न 21.
फेन प्लवन विधि में अवनमक की क्या भूमिका होती है।
उत्तर:
दो सल्फाइड अयस्कों को पृथक् करने के लिए अवनमक का उपयोग किया जाता है।
जैसे-जिंक ब्लेंड (ZnS) तथा गेलेना (PbS) को पृथक करने के लिए अवनमक के रूप में सोडियम सायनाइड (NaCN) का प्रयोग किया जाता है। NaCN, Zns के साथ मिलकर एक संकुल Na2[Zn (CN)A] बनाता है जो कि जल में घुलनशील होता है। यह संकुल Zns. की सतह पर बनता है तथा फेन के साथ नहीं जाता। इस परिस्थिति में केवल Pbs फेन बनाता है तथा इस प्रकार ZnS अयस्क से पृथक् हो जाता है।

प्रश्न 22.
धातुमल क्या होता है ? समझाइए।
उत्तर:
धातुमल (Slag): गालक अगलनीय अशुद्धियों के साथ क्रिया करके जो अविलेय हल्का यौगिक बनाते हैं, उसे धातुमल कहते हैं। यह प्रायः पिघली धातु के ऊपर तैरता है। उदाहरण: Cao (गालक) सिलिका (SiOS) गैंग के साथ धातुमल (Slag) बनाता है।
CaO + SIO2 → CaSiO3
प्रश्न 23.
अयस्क के उदाहरण लिखिए।
उत्तर:
सल्फाइड अयस्क
- सिल्वर ग्लांस - Ag2S
- कॉपर पाइराइट - CuFeS2.
ऑक्साइड अयस्क:
- बॉक्साइ: AlO3. 2H2O
- हेमेटाइट: Fe2O3.2H2O.
प्रश्न 24.
गैंग या आधात्री किसे कहते हैं?
उत्तर:
अयस्कों एवं खनिजों में पाये जाने वाले मिट्टी, कंकड़, पत्थर आदि अनावश्यक पदार्थ गैंग कहलाते हैं।
प्रश्न 25.
धातु के निष्कर्षण में कार्बन द्वारा अपचयन विधि को क्या कहते हैं?
उत्तर:
प्रगलन।
प्रश्न 26.
प्रगलन में कोक व गालक का प्रयोग क्यों करते हैं?
उत्तर:
कोक का प्रयोग ऑक्साइड अयस्क का अपचयन करने के लए करते हैं, जबकि गालक का प्रयोग गैंग को धातुमल में परिवर्तित करने के लिए करते हैं।
प्रश्न 27.
गालक क्या होते हैं?
उत्तर:
वे पदार्थ जो कि गैंग को धातुमल में परिवर्तित कर देते हैं, पालक कहलाते हैं।
प्रश्न 28.
किसी एक अम्लीय व क्षारीय गालक का उदाहरण दीजिए।
उत्तर:
अम्लीय गालक: SiO2
क्षारीय गालक: CaO
प्रश्न 29.
ब्लिस्टर (फफोलेदार) कॉपर क्या है?
उत्तर:
कॉपर के निष्कर्षण में बेसेमरीकरण के पश्चात् प्राप्त होने वाले पिघले कॉपर को धीरे-धीरे ठण्डा करते हैं। ठण्डा करने पर उसमें उपस्थित SO2 गैस की अशुद्धि पृथक् होती है जिससे उसकी सतह पर कफोले से पड़ जाते हैं जिसे फफोलेदार
ताँबा या ब्लिस्टर कॉपर कहते हैं।

प्रश्न 30.
सज्जीकरण किसे कहते हैं?
उत्तर:
सज्जीकरण (Benefication): अवांछित पदार्थों जैसे रेत, ले आदि का अयस्कों से निष्कासन सज्जीकरण कहलाता है।
प्रश्न 31.
वाष्प प्रावस्था परिष्करण में आवश्यक दो दशायें लखिए।
उत्तर:
- उपलब्ध अभिकर्मक के साथ धातु वाष्पशील यौगिकों को बनाती हो।
- वाष्पशील पदार्थ आसानी से विघटित हो सकता हो जिससे धातु भासानी से पुनः प्राप्त की जा सके।
प्रश्न 32.
निम्न कोटि के कॉपर अयस्कों की सहायता से कॉपर कैसे प्राप्त की जा सकती है?
उत्तर:
निम्न कोटि अयस्कों से कॉपर का निष्कर्षण हाइड्रोधातुकर्म द्वारा करते हैं। इसे अम्ल के उपयोग से निक्षालित करते हैं।
CU2+(aq) + H2(g) → Cu(s) + 2H+(aq)
CU2+(aq) + Fe(s) → Cu(s) + Fe2+(aq)
प्रश्न 33.
जिंक ऑक्साइड के दो उपयोग लिखिए।
उत्तर:
- सफेद वर्णक (pigment) के रूप में
- क्रीम पाउडर और टूथपेस्ट बनाने में
प्रश्न 34.
कॉपर के किसी एक मिश्र-धातु का संघटन तथा . पयोग लिखिए।
उत्तर:
पीतल: Cu(80%) और Zn (20%) उपयोग-इसका उपयोग बर्तन बनाने में किया जाता है।'
प्रश्न 35.
अमलगम तथा मिश्रधातु में क्या अन्तर है?
उत्तर:
दो या दो से अधिक धातुओं या अधातु के समांग मिश्रण को धातु संकर या मिश्रधातु कहते हैं। ये प्रायः ठोस होते हैं। यदि मिश्रधातु में एक धातु मर्करी हो तो इसे अमलगम कहते हैं। ये प्रायः द्रव होती हैं।
प्रश्न 36.
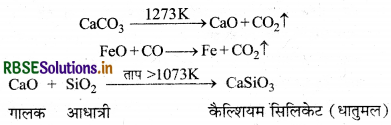
लोहे के निष्कर्षण के दौरान वात्या भट्टी में चूने का पत्थर क्यों डालते हैं? समझाइए।
उत्तर:
लोहे के निष्कर्षण के दौरान वात्या भट्टी में मिलाया गया चूना पत्थर (CaCO3) गालक काय कार्य करता है। यह सिलिम (SiO2) से संयोग करके धातुमल (Casion) कैल्सियम सिलिकेट बनाता है।
प्रश्न 37.
प्रगलन में कोक और गालक का प्रयोग क्यों किया जाता है? व्याख्या कीजिए।
उत्तर:
प्रगलन में कोक तथा गालक के प्रयोग से अयस्क के निस्तापन से प्राप्त ऑक्साइड को कोक अपचयित करता है, जिससे गलित धातु प्राप्त हो जाती है और अपद्रव्य गालक से क्रिया करके धातुमल के रूप में अलग हो जाते हैं। इससे अयस्क का गलनांक भी कम हो जाता है।
प्रश्न 38.
स्टेनलेस स्टील का संगठन तथा उपयोग लिखिए।
उत्तर:
Fe - (74%), Ni - (8%) एवं Cr (18%)
उपयोग: बर्तन, मूर्तियाँ, बॉल बेयरिंग तथा शल्प चिकित्सा के औजार बनाने में।
प्रश्न 39.
क्रायोलाइट का सूत्र लिखिए। इसका उपयोग किस धातुकर्म में होता है?
उत्तर:
क्रायोलाइट का सूत्र NaF है। यह ऐलुमिनियम के धातुकर्म में प्रयुक्त होता है।
प्रश्न 40.
भर्जन किसे कहते हैं? उदाहरण देकर समझाइए।
उत्तर:
वह क्रिया जिनमें अयस्क को वायु की उपस्थिति में उसके गलनाक से नीचे गर्म किया जाता है, भर्जन कहलाती है। इस क्रिया में वाष्पशील अशुद्धियाँ ऑक्साइडों के रूप में पृथक् हो जाती हैं। और सल्फाइड अयस्क ऑक्साइड में बदल जाता है।
S + O2 → SO2↑
4As + 3O2 → 2As2O3 ↑
2Zns + 3O2 → 2ZnO + 2SO2↑
प्रश्न 41.
फ्लुओरस्पार का सूत्र लिखिए। इसका ऐलुमिनियम के निष्कर्षण में क्या उपयोग है?
उत्तर:
फ्लूओरस्पार का सूत्र CaF3 है। ऐलुमिनियम के निष्कर्षण में इसका उपयोग तरलता बढ़ाने के लिए किया जाता है।
प्रश्न 42.
ऐलुमिना के वैद्युत-अपघटन में क्रायोलाइट का उपयोग समझाइए।
उत्तर:
क्रायोलाइट ऐलुमिना का गलनांक को कम करता है तथा ऐलुमिना के वैद्युत-अपघटन में सहायता करता है क्योंकि शुद्ध ऐलुमिना विद्युत कुचालक है परन्तु क्रायोलाइट की सहायता से यह वैद्युत सुचालक हो जाता है।
लघु उत्तरीय प्रश्न:
प्रश्न 1.
निस्तापन तथा भर्जन को उदाहरण सहित समझाइए।
उत्तर:
निस्तापन: वायु की अनुपस्थिति में सांद्रित अयस्क को उसके गलनांक से कम ताप पर गर्म करना निस्तापन कहलाता है। यह ऑक्साइड, कार्बोनेट व जलयोजित ऑक्साइड अयस्क के लिए किया जाता है।
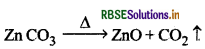
भर्जन: वायु की उपस्थिति में सांद्रित सल्फाइड अयस्क को गर्म करना भर्जन कहलाता है। इस प्रक्रम में अयस्क से गंधक तथा आर्सेनिक की अशुद्धियाँ दूर हो जाती हैं।
2CU2S + 3O2 → 2CU2O + 2SO2↑
प्रश्न 2.
विद्युत अपघटनी विधि से ताँबे का शोधन कैसे किया जाता है? आवश्यक समीकरण की सहायता से समझाइए।
उत्तर:
ताँबे के शोधन की इस विधि में अशुद्ध ताँबे का ऐनोड तथा शुद्ध ताँबे का कैथोड बनाया जाता है। सैल में उसी ताँबे के ही किसी उपयुक्त लवण जैसे कॉपर सल्फेट (Cusox) के अम्लीय विलयन को वैद्युत अपघट्य के रूप में प्रयुक्त किया जाता है। वैद्युत-अपघटन से शुद्ध कॉपर (ताँबा) ऐनोड से कैथोड की ओर जाकर उस पर निक्षेपित हो जाता है।
अभिक्रियाएँ:
ऐनोड पर Cu → Cu2+ + 2e-
कैथोड पर Cu2+ + 2e → Cu

प्रश्न 3.
ऐलुमीनियम के निष्कर्षण के लिए विद्युत् अपघटनी सेल का नामांकित चित्र बनाइए तथा इसमें होने वाली सम्पूर्ण अभिक्रिया लिखिए।
उत्तर:
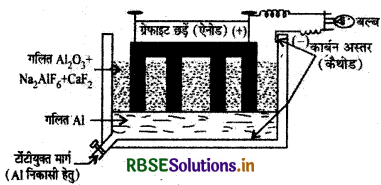
अभिक्रियाएँ (Reactions):
(1) प्रथम अवधारणा के अनुसार

या
2C + O2 → 2CO
2CO + O2 → 2CO2
(2) द्वितीय अवधारणा के अनुसार

कैथोड पर Al3+ + 3e → Al(l)
ऐनोड पर F- → F + e-
2Al2O3 + 3C → 4Al + 3CO2
प्रश्न 4.
ऐलुमिनो-थर्मिक विधि क्या है? इसके उपयोग लिखिए।
उत्तर:
धातुओं के ऑक्साइडों को ऐलुमिनियम चूर्ण के साथ उच्च ताप पर गर्म करने से धातुएँ प्राप्त होती हैं। यह क्रिया ऊष्माक्षेपी है तथा इसको एलुमिनोथर्मिक विधि कहते हैं।
3CO3O4 + 8Al → 9CO + 4Al2O3
3Mn3O4 + 8Al → 9Mn + 4Al2O3
इस विधि का उपयोग CO, Mn और Cr धातुओं के निषकर्षण और थर्माइट वेल्डिंग में किया जाता है।
प्रश्न 5.
लीचिंग क्या है? एक उदाहरण द्वारा समझाइए।
उत्तर:
यह विधि रासायनिक परिवर्तन पर आधारित है। इसके अन्तर्गत बारीक पिसे अयस्क को उचित अभिकर्मक के साथ क्रिया कराते हैं। जिससे विलयन की अवस्था में परिवर्तन आ जाता है तथा अशुद्धियाँ ठोस अवस्था में रह जाती हैं।
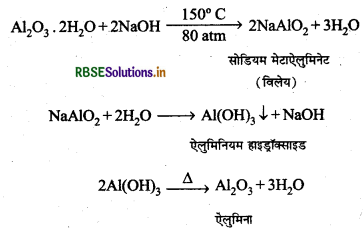
उदाहरण: बॉक्साइट अयस्क को सान्द्रण करने के लिए Al2O3 . 2H2O की क्रिया NaOH से कराने पर NaAlO2 बन जाता है जो जल में विलेय है और अशुद्धियाँ: जैसे - सिलिका, Fe2O3 नीचे ठोस के रूप में अवक्षिप्त हो जाती हैं।
Al2O3 2H2O + 2NaOH → 2NaAlO2 + 3H2O
NaAlO2 + 2H2O → Al(OH)3 + NaOH
प्रश्न 6.
ढलवाँलोहा, पिटवाँ लोहा तथा इस्पात में अन्तर लिखिए।
उत्तर:
ढलवाँ लोहा: इसमें लगभग 93 से 94% Fe, 2 से 4%C तथा शेष Si, P. तथा MD की अशद्धियाँ होती हैं।
पिटवाँ लोहा: इसमें 98.8% से 99.9% Fe और 0.1 से 0.25%C तथा शेष Si, P और Mn की अशुद्धियाँ होती हैं।
इस्पात: इसमें 98 से 99.8% Fe और 0.25 से 1.5%C होता है।
प्रश्न 7.
फेरिक क्लोराइड के दो रासायनिक गुण लिखिए।
उत्तर:
1. जल-अपघटन पर यह HCI उत्पन्न करता है, अतः इसका जलीय विलयन अम्लीय प्रकृति का होता है।
FeCl3 + 3H2O → Fe(OH)3 + 3HCl
2. पोटैशियम फेरोसायनाइड विलयन के साथ यह नीले रंग का फेरिक फेरोसायनाइड (प्रशियन ब्लू) बनाता है।
4Fe2Cl3 + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3 + 12KCl
प्रश्न 8.
Al(OH)3 उभयधर्मी है, समझाइए।
उत्तर:
AI(OH)3 उभयधर्मी है क्योंकि यह अम्लों व अपने से प्रबल क्षारों के साथ क्रिया करके लवण व जल बनाता है।
उदाहरणार्थ:
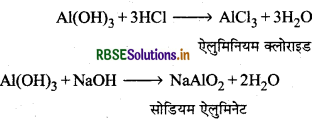
प्रश्न 9.
लोहे के प्रमुख अयस्कों के नाम तथा सूत्र लिखिए।
उत्तर:
- ऑक्साइड अयस्क-लाल हेमेटाइट (Fe2O3 . 2H2O), मैग्नेटाइट (Fe3O4)
- जलीय ऑक्साइड अयस्क-भूरा हेमेटाइट या लिमोनाइट (Fe2O3 ,3H2O)
- कार्बोनेट अयस्क-सिडेराइट (FeCO3)
- सल्फाइड अयस्क-आयरन पाइराइट (FeS2), कॉपर आयरन पाइराइट या कैल्को पाइराइट (CuFes2)
प्रश्न 10.
फेन प्लवन विधि द्वारा किन अयस्कों का सान्द्रण किया जाता है। इस विधि का वर्णन कीजिए।
उत्तर:
यह विधि अयस्क तथा आधात्री (gangue) की किसी द्रव से भीगने की प्रवृत्ति पर निर्भर करती है। इस विधि में बारीक पिसे हुए अयस्क को जल तथा तेल के मिश्रण में डालकर वायु प्रवाहित की जाती है। अशुद्ध अयस्क तेल के साथ झाग (फेन) बनाकर ऊपर तैरने लगता है और अपद्रव्य नीचे बैठ जाते हैं। इस विधि में चीड़ का तेल (pine oil) या क्रीओसेट तेल (creosate oil) काम में लाया जाता है। सल्फाइड अयस्कों का सान्द्रण इसी विधि से किया जाता है।
प्रश्न 11.
निस्तापन किसे कहते हैं? उदाहरण देकर समझाइए।
उत्तर:
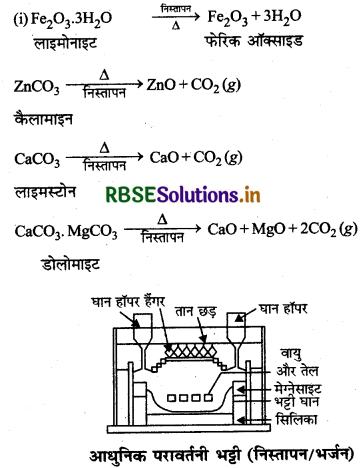
वह क्रिया जिसमें अयस्क को इतना गर्म करते हैं कि वह पिघले नहीं तथा अयस्क से गैसीय पदार्थ या वाष्पशील पदार्थ पृथक् हो जाते हैं, निस्तापन कहलाती है। गैस निकलने पर अयस्क सरन्ध्र (porous) हो जाता है; जैसे-कार्बोनेट अयस्क गर्म होकर ऑक्साइड अयस्क तथा CO2 में बदल जाता है। ZnCO3 → ZnO + CO2↑

प्रश्न 12.
गालक किसे कहते हैं? उदाहरण सहित समझाइए।
उत्तर:
गालक: गालक उस पदार्थ को कहते हैं जो अयस्क में उपस्थित अगलनीय अशुद्धियों के साथ उच्च ताप पर क्रिया करके इनको आसानी से गलाकर पृथक् होने वाले पदार्थों के रूप में दूर कर देते हैं। अशुद्धियों की गालक से क्रिया के फलस्वरूप बने गलनीय पदार्थ को धातुमल कहा जाता है। धातुमल, धातु से हल्का होने के कारण उसके' ऊपर एक अलग पर्त के रूप में तैरने लगता है जिसको अलग कर लेते हैं। गालक दो प्रकार के होते हैं।
- अम्लीय गालक: जैसे - SiO2 यह क्षारीय अशुद्धियों; जैसे - CaO FeO आदि को दूर करता है।
- क्षारीय गालक; जैसे - चूने का पत्थर (CaCO3)। यह अम्लीय अशुद्धियों; जैसे - SiO2 P2O5 को दूर करता है।
प्रश्न 13.
अम्लीय गालक क्या है? धातुकर्म में इसकी क्या उपयोगिता है? एक उदाहरण देकर समझाइए।
उत्तर:
वे गालक जो क्षारीय अशुद्धियों से क्रिया करके धातुमल बनाते हैं, अम्लीय गालक कहलाते हैं। सिलिका (SiO2) तथा बोरेक्स प्रमुख अम्लीय गालक हैं।

उदाहरणार्थ: FeO में SiO2 मिलाने पर FeSiO3 धातुमल प्राप्त होता है।
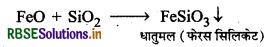
प्रश्न 14.
प्रगलन क्या है? उदाहरण देकर स्पष्ट कीजिए।
या
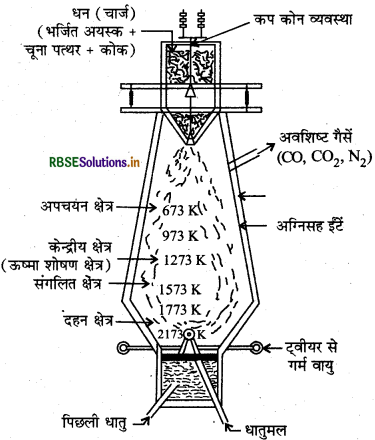
प्रगलन में किस भट्टी का प्रयोग करते हैं? इसका नामांकिक चित्र बनाइए।
उत्तर:
अयस्क में उचित गालक मिलाकर मिश्रण को उच्च ताप पर लगाने की क्रिया को प्रगलन कहते हैं। इस क्रिया में अयस्क का गलित धातु में अपचयन हो जाता है अथवा धातुयुक्त पदार्थ पिघल जाता है। गालक अयस्क में उपस्थित अपद्रव्य से क्रिया करके धातुमल बनाता है जिसे अलग कर लेते हैं। इसमें वात्या भट्ठी का प्रयोग करते हैं।
लोहा तथा ताँबा धातुओं के निष्कर्षण में वात्या भट्ठी का उपयोग होता है। तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम
उदाहरणार्थ:
कॉपर पाइराइट से कॉपर का निष्कर्षण वात्या भट्ठी में प्रगलन द्वारा किया जाता है। इसमें निम्नलिखित अभिक्रियाएँ होती हैं
Cu2O + Fes → Cu2S + FeO
2 Fes + 3O2 → 2FeO + 2SO2↑
FeO + SiO2 → FeSiO3
प्रश्न 15.
परावर्तनी भट्टी का नामांकित चित्र दीजिए और संक्षेप में इसकी कार्य-विधि का वर्णन कीजिए।
उत्तर:
भर्जन क्रिया परावर्तनी भट्ठी में करायी जाती है। इस भट्ठी में ईंधन अलग स्थान पर जलाया जाता है। तथा गर्म किये जाने वाले अयस्क को सीधे ज्वाला के सम्पर्क में नहीं आने देते हैं। यह केवल गर्म गैसों के सम्पर्क में आकर गर्म होता है। इस प्रक्रम में गर्म किये जाने वाला पदार्थ भट्टी तल (hearth) पर रखा जाता है और ईंधनं अग्नि स्थान (fire place) में जलाया जाता है। इसका उपयोग ऑक्सीकरण तथा अपचयन दोनों प्रकार के प्रक्रमों में करते हैं। इस भट्टी का प्रयोग ताँबा, लेड, टिन आदि धातुओं के धातुकर्म में किया जाता है।
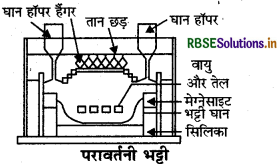
प्रश्न 16.
सिलिका युक्त बॉक्साइट का शोधन किस प्रकार किया जाता है? रासायनिक समीकरण भी दीजिए।
या
सपॅक की विधि द्वारा ऐलुमिना का शोधन कैसे करेंगे?
उत्तर:
जब बॉक्साइट में SiO2 की अशुद्धि अधिकता में होती है, सबसपॅक की विधि का प्रयोग किया जाता है। इस विधि में बॉक्साइट मेंकार्बन का चूर्ण मिलाकर मिश्रण को 1800°C तक गर्म करके इसमें नाइट्रोजन प्रवाहित की जाती है जिससे ऐलुमिनियम नाइट्राइड (AIN) बनता है तथा सिलिका अपचयित होकर वाष्पशील सिलिकॉन में परिवर्तित हो जाती है।
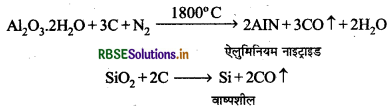
इस प्रकार प्राप्त ऐलुमिनियम नाइट्राइड को पानी के साथ गर्म करने पर इसका जल-अपघटन हो जाता है। जिससे ऐलुमिनियम हाइड्रॉक्साइड का अवक्षेप प्राप्त होता है। इस अवक्षेप को जल से धोकर सुखाकर तेज गर्म करने पर निर्जल ऐलुमिना प्राप्त होता है।

प्रश्न 17.
जब बॉक्साइट अयस्क में फेरिक ऑक्साइड की अशुद्धि अधिक होती है तथा जब सिलिका की अशुद्धि अधिक होती है तो बॉक्साइट से ऐलुमिना प्राप्त करने की विधि का नाम तथा रासायनिक समीकरण लिखिए।
उत्तर:
बॉक्साइट अयस्क में फेरिक ऑक्साइड भी अशुद्धि अधिक होने पर इससे एलुमिना प्राप्त करने के लिए बेयर विधि का प्रयोग किया जाता है।
बॉक्साइट अयस्क में सिलिका की अशुद्धि अधिक होने पर इससे ऐलुमिना प्राप्त करने के लिए सम्पर्क विधि का प्रयोग किया जाता है।
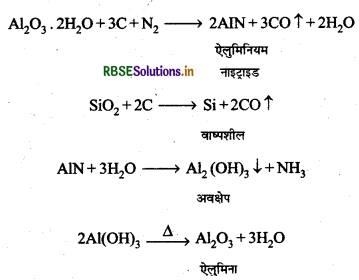
प्रश्न 18.
विद्युत् अपघटनी विधि से ताँबे का शोधन कैसे किया जाता है। आवश्यक समीकरण की सहायता से समझाइए।
उत्तर:
सान्द्रित अयस्कों से अशोधित धातुओं का निष्कर्षण (Extraction of Crude Metals from Concentrated Ores)
सान्द्रण के द्वारा प्राप्त अयस्क से धातु का निष्कर्षण अयस्क की प्रकृति एवं उसके साथ उपस्थित अपद्रव्यों पर निर्भर करता है।
सान्द्रित अयस्क से धातुओं का पृथक्करण दो मुख्य पदों में होता है:
(क) सान्द्रित अयस्क का आक्साइड में परिवर्तन
(ख) आक्साइड का धातु में अपचयन
(क) सान्द्रित अयस्कों का ऑक्साइड में परिवर्तन (Conversion of Concentrated Ores into Oxides)
(1) निस्तापन (Calcination): सान्द्रित अयस्क को उसके गलनांक के नीचे उच्च ताप पर गरम करने की क्रिया निस्तापन कहलाती है। निस्तापन के दौरान इस प्रकार परिवर्तन होते हैं:
- अयस्क से नमी खत्म हो जाती है।
- धातु कार्बोनेट एवं धातु हाइड्रॉक्साइड, धातु ऑक्साइडों में परिवर्तित हो जाते हैं।
- सभी अधातुएँ वाष्पशील ऑक्साइड में परिवर्तित हो जाती हैं।
- अयस्क संरन्ध्र (Porous) हो जाता है।
(ख) ऑक्साइड का धातु में अपचयन (Reduction of Oxides into Metals): धातु ऑक्साइड के अपचयन में प्रायः इसे दूसरे पदार्थ जैसे C या CO के साथ गरम किया जाता है जो अपचायक का कार्य करता है। अपचायक धातु ऑक्साइड की ऑक्सीजन के साथ संयोग करते हैं तथा ऑक्साइड धातु में अपचयित हो जाता है।
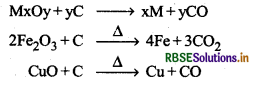
सामान्यत: धातु ऑक्साइड, कोक तथा गालक (flux) को मिलाकर मिश्रण को उच्च ताप पर वात्या भट्टी (Blast furnace) में गर्म करते हैं। कोक अपचायक का कार्य करता है तथा अयस्क को गलित धातु में परिवर्तित कर देता है। गालक अयस्क में उपस्थित अगलनीय (infusible) अशुंद्धियों से क्रिया करके गलनीय (fusible) पदार्थ में बदलते हैं जिसे धातुमल (slag) कहते हैं। इस प्रकार ऑक्साइड, धातु में अपचयित हो जाता है।

प्रश्न 19.
ऐलिंघम आरेख की सहायता से हेमेटाइट अयस्क के अपचयन में ऊष्मागतिकी सिद्धान्त की व्याख्या कीजिए।
उत्तर:
ऐलिंघम आरेख की सहायता से हेमेटाइट के अपचयन की व्याख्या (Explanation for the Reduction of Haematite with the Help of Elingham Diagram): आयरन के निष्कर्षण में कोक का प्रयोग होता है अर्थात् वात्या भट्टी में फेरिक ऑक्साइड का अपचयन कोक द्वारा होता है। एलिंघम आलेख से विदित होता है कि कार्बन तथा आयरन के ऑक्साइड का निर्माण लगभग 1073 K पर होता है।
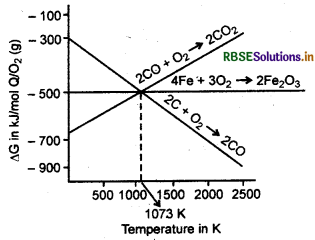
अपचयन का ऐलिंघम आरेख अपचयन की व्याख्या हम निम्न प्रकार कर सकते हैं:
1. ऐलिंघम आरेख से यह जानकारी मिलती है कि Fe2O3 के निर्माण की मानक गिब्स ऊर्जा (∆G°), CO से के निर्माण के लिये आवश्यक मानक गिब्स ऊर्जा (∆G°) अधिक है। इसका अर्थ यह है कि 1073 K से कम ताप पर हेमेटाइट Fe2O3 कार्बन मोनो-ऑक्साइड से (CO) अपचयित हो जायेगा।
2. 1073 K के ऊपर Fe2O3 के निर्माण की मानक मुक्त ऊर्जा, कोक से CO के निर्माण के लिये मानक मुक्त ऊर्जा (AG°) के मान से अधिक है, अतः 1073 K ताप से अधिक ताप पर हेमेटाइट (Fe2O3) कोक के द्वारा अपचयित होता है।
Fe2O3(s) + 3C(s) → 2Fe(s) + 3CO(g)
कोक अतः वात्या भट्टी में Fe2O3 का अपचयन कोक के द्वारा हो जाता है, जब तापमान 1073 K से अधिक हो। यदि तापमान 1073 K से कम हो तो Fe2O3 CO के द्वारा अपचयित होता है।
प्रश्न 20.
कॉपर ऑक्साइड के अपचयन में सिलिका का अस्तर क्यों लगाया जाता है? इसमें होने वाली अभिक्रियाओं के समीकरण लिखिए। परिवर्तन का नामांकित चित्र बनाइए।
उत्तर:
सिलिका का अस्तर गालक (flux) का कार्य करता है, जो FeO की अशुद्धियों को धातुमल (slag) में परिवर्तित कर देता है।

बेसेमर परिवर्तक में निम्नलिखित अभिक्रियाएँ होती हैं
2Cu2S + 3O2 → 2Cu2O + 2SO2
Cu2S + 2Cu2O → 6Cu + SO2↑
निबन्धात्मक प्रश्न:
प्रश्न 1.
सल्फाइड अयस्क से धातु (कॉपर) निष्कर्षण की विधि का वर्णन कीजिए। सम्बन्धित रासायनिक समीकरण भी दीजिए।
या
कॉपर पायराइट से ताँबे के निष्कर्षण की विधि का वर्णन कीजिए। सम्बन्धित रासायनिक समीकरण लिखिए। प्राप्त धातु को किस प्रकार शुद्ध करेंगे?
उत्तर:
एलिंघम आरेख का उपयोग धातुओं के निष्कर्षण में किया जाता है। (क) आयरन (लोहे) का इसके ऑक्साइड अयस्क से निष्कर्षण (Extraction of Iron from its Oxide Ore) आयरन ऐलुमीनियम के पश्चात् भूपर्पटी में सर्वाधिक पायी जाने वाली धातु है। इसकी उपलब्धता 5.1% है।
(i) अयस्क (Ores): आयरन के कुछ प्रमुख अयस्क निम्नवत् हैं:
- हेमेटाइट - Fe2O3 (मुख्य)
- लिमोनाइट - 2Fe2O3 3H2O
- आयरन पायराइट - FeS2
- सिडेराइट - FeCO3
- मैग्नेटाइट - Fe3O4
(2) निष्कर्षण (Extraction): सर्वप्रथम हेमेटाइट (FeO3) अयस्क को जो क्रशर में पीसकर इसका सान्द्रण चुम्बकीय पृथक्करण विधि (Magnetic Separation Method) द्वारा करते हैं। जिससे अचुम्बकीय प्रकृति की अशुद्धियाँ (आधात्री) पृथक् हो जाती हैं। सांद्रण के पश्चात आयरन के ऑक्साइड अयस्कों (Fe2O3, Fe3O4) के मिश्रण से जल को हटाने, कार्बोनेटों का अपघटन करने तथा सल्फाइड को ऑक्सीकृत करने के लिए इनका निस्तापन किया जाता है। इसके पश्चात वाय के आधिक्य (ऑक्सीजन) की उपस्थिति में अयस्क का भर्जन परावर्तनी भटटी में कराते हैं जिससे PS तथा As आदि की अशुद्धियाँ उनके वाष्पशील ऑक्साइडों के रूप में अयस्क से पृथक हो जाती हैं तथा इस दौरान FeO का परिवर्तन Fe2O3 में हो जाता है।
4FeO + O2 → 2Fe2O3
(3) प्रगलन (Smelting): भर्जित अयस्क में चूना पत्थर तथा कोक मिलाकर वात्या भट्टी (धमन भट्टी) में ऊपर से डाल देते हैं। यहाँ ऑक्साइड धातु में अपचित हो जाता है। इसे प्रगलन (Smelting) कहते हैं। भट्टी के ट्वीयरों (Tuyers) द्वारा गरम हवा की धारा तेजी से प्रवाहित की जाती है। इस भाग का तापमान सबसे अधिक होता है। यह लगभग 2170 K होता है। गर्म वायु से कोक का दहन होकर ऊष्मा उत्पन्न होती है एवं CO2 बनती है।
C + O2 → CO2 + ऊर्जा
CO2 गैस ऊपर की ओर अगले खण्ड में पहुँचती है जहाँ अपचयित होकर CO बनाती है, इस खण्ड का ताप कम होता है यह लगभग 1570 K होता है तथा ऊपर से डाला जाने वाला आयरन के आक्साइड (Fe2O3 तथा Fe5O4) विभिन्न पदों में FeO में अपचयित हो जाते हैं।
वात्या भट्टी में आयरन ऑक्साइडों का अपचयन विभिन्न ताप परिसरों में होता है। वात्या भट्टी के विभिन्न क्षेत्र निम्न प्रकार हैं तथा उनमें होने वाली हैं-अभिक्रियाओं के आधार पर भट्टी को चार भागों में विभाजित किया गया है। ये क्षेत्र निम्न हैं
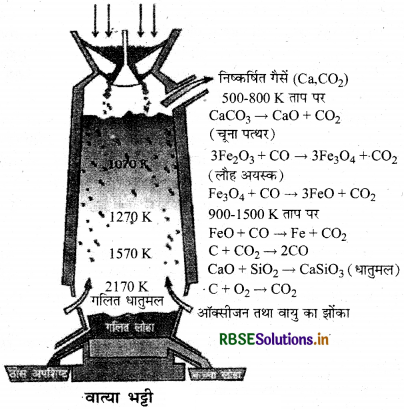
(i) अपचयन क्षेत्र (673 K - 973 K लगभग):
यहाँ Fe2O3 पहले Fe3O4 में अपचित होता है तथा बाद में FeO में
3 Fe5O3 + CO → 2Fe3O4 + CO2 .......... (3)
Fe3O4 + 4CO → 3Fe + 4CO2
Fe2O3 + CO → 2FeO + CO2
यह लोहा सरन्ध्र एवं ठोस होता है जिसे स्पंजी लोहा (spongy iron) कहते हैं।
(ii) केन्द्रीय क्षेत्र (ऊष्माशोषण क्षेत्र): (1173K - 1473K लगभग)
(iii) संगालित क्षेत्र (1373K - 1573K लगभग)
इस क्षेत्र में स्पंजी लोहा पिघलता है तथा C, P, Si आदि का अवशोषण कर लेता है।
CO + C → 2CO2 ∆H = + 163 kJ
(iv) दहन क्षेत्र (1173K - 2173K लगभग)
C + O2 → 2CO2 ∆H = - 395.5kJ
कोक वायु कार्बन डाइऑक्साइड
FeO + C → Fe + CO

प्रश्न 2.
गोल्ड (Au) के निष्कर्षण एवं शोधन की विधि का वर्णन कीजिए।
उत्तर:
गोल्ड का शुद्धिकरण: गोल्ड का शुद्धिकरण निम्न विधियों द्वारा किया जाता है:
1. क्वार्टेशन विधि: इस विधि द्वारा कॉपर व सिल्वर की अशुद्धियों को हटाया जाता है। यह विधि इस तथ्य पर आधारित है कि कॉपर व सिल्वर सल्फ्यूरिक व नाइट्रिक अम्लों में घुल जाते हैं, जबकि गोल्ड इन अम्लों के द्वारा प्रभावित नहीं होता। यदि अशुद्ध नमूने में गोल्ड 30% से अधिक है तो कॉपर व सिल्वर भी इन अम्लों के द्वारा प्रभावित नहीं होते। अतः इन अम्लों से अभिक्रिया करने से पहले नमूने को सिल्वर की आवश्यक मात्रा के साथ गलाते हैं जिससे नमूने में गोल्ड की प्रतिशत मात्रा 25% तक घट जाए। इसीलिए इसे क्वॉर्टेशन विधि कहते हैं। परिणामी मिश्र धातु को सान्द्र H2SO4 के साथ प्रतिकृत करते हैं जिससे कॉपर व सिल्वर सल्फेटों के रूप में विलयन में आ जाते हैं, जबकि गोल्ड शेष रह जाता है। इस प्रकार से प्राप्त गोल्ड को बोरेक्स व KNO3 के साथ गलित करते हैं जिससे शुद्ध गोल्ड प्राप्त हो जाता है।
Cu + 2H2SO4 → CuSO4 + 2H2O + SO2
2Ag + 2H2SO4 → Ag2SO4 + 2H2O + SO2
(ii) विद्युत अपघटनी विधि गोल्ड का शुद्धिकरण विद्युत अपघटनी विधि के द्वारा भी किया जा सकता है। इस विधि में गोल्ड क्लोराइड के विलयन जिसमें 10 - 20% HCl होता है का विद्युत-अपघटन किया जाता है। अशुद्ध गोल्ड ऐनोड के रूप में तथा शुद्ध गोल्ड कैथोड के रूप में व किया जाता है। शुद्ध गोल्ड कैथोड पर एकत्रित हो जाता है, जबकि बने सिल्वर कलोराइड को कीचड़ (mud) के रूप में हटा दिया जाता है।
प्रश्न 3.
सिल्वर (Ag) के निष्कर्षण की किसी एक विधि का र्णन कीजिए। या सायनाइड प्रक्रम द्वारा चाँदी प्राप्त करने की विधि था आवश्यक रासायनिक समीकरण लिखिए।
उत्तर:
सिल्वर धातु अत्यधिक क्रियाशील न होने के कारण प्रकृति i मुक्त तथा संयुक्त दोनों अवस्थाओं में पाई जाती है। इसके निष्कर्षण की विधि निम्नवत् है:
1. सान्द्रण: इसके सल्फाइड अयस्क को बाल मिल (Ball mill) में हीन पीसकर इसका झाग प्लवन विधि से सान्द्रण किया जाता है। एक क में जल भरकर उसमें थोड़ा-सा चीड़ का तेल और थोड़ा-सा टैशियम एथिल जैन्थेट मिलाकर उसमें महीन पिसा हुआ सल्फाइड यस्क डालकर वायु की तेज धारा द्वारा विलोडित करते हैं। सल्फाइड ग्यस्क झाग के रूप में द्रव के सतह के ऊपर तैरने लगता है और भारी नशुद्धियाँ टैंक की पेंदी में बैठ जाती हैं। फेन को अलग करके सुखाकर
स लिया जाता है।
2. सायनाइड से अभिक्रिया: पिसे हुए सान्द्रित सल्फाइड अयस्क को एक छिद्रयुक्त पेंदी के टैंक में भर देते हैं। इस टैंक के भीतर किरमिच का अस्तर लगा होता है। अब अयस्क में 0.4 से 0.6% सोडियम गायनाइड का घोल मिलाकर हवा की तेज धारा प्रवाहित करते हैं और इस मश्रण को तीव्रता से हिलाया जाता है। ऐसा करने से सल्फाइड अयस्क उपस्थित सिल्वर, सायनाइड से क्रिया करके विलेयशील सोडियम आइसायनोअर्जेन्टेट (1) संकर लवण बनाता है।
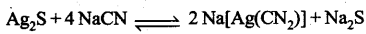
सोडियम सल्फाइड वायु के द्वारा सोडियम सल्फेट में ऑक्सीकृत जाता है।
4Na2S + 5O2 + 2H2O → 2Na2SO4 + 4NaOH + 2S
सोडियम डाइसायनोअर्जेन्टेट (1) विलयन टैंक की पेंदी से टपकता हता है जिसको एकत्रित करके फिर टैंक में डाल दिया जाता है। इस क्रया को तीन-चार बार दोहराया जाता है जिससे सोडियम डाइसायनोअर्जेन्टेट (1) का सान्द्र विल्यन प्राप्त हो जाता है।
3. सिल्वर का अवक्षेपण-सान्द्र डाइसायनोअर्जेन्टेट (1) विलयन को अवक्षेपण कक्षों में से प्रवाहित करते हैं। इन कक्षों में जिंक धातु की गेलन रखीं होती है जो डाइसायानोअर्जेन्टेट (1) विलयन से सिल्वर को तिस्थापित करके सिल्वर का काला अवक्षेप देता है और इस प्रकार सेप्त विलयन को छानकर सिल्वर का काला अवक्षेप पृथक कर लेते हैं।
2Na[Ag(CN)2] + Zn → Na2[Zn(CN)4] + 2Ag↓
सिल्वर को ऐलुमिनियम पाउडर द्वारा भी अवक्षेपित कराया जाता ऐलुमिनियम का उपयोग करने से सीधा ही सोडियम सायनाइड प्राप्त जाता है।
Al + 3Na[Ag(CN)2] + 4NaOH → 3Ag + 6NaCN + NaAlO2 + 2H2O
जिंक द्वारा अवक्षेपण करने में जो जिंक सायनाइड संकर बनता है ह बचे हुए सल्फाइड अयस्क को भी डाइसायनोअर्जेन्टेट (1) में रिवर्तित कर सकता है और इसप्रकार सायनाइड की हानि नहीं होती।
Ag2S + Na2[Zn(CN)4] → 2Na[Ag(CN)2] + Zns
प्रश्न 4.
हूप विधि द्वारा ऐलूमिनियम धातु के शोधन का वर्णन कीजिए।
उत्तर:ऊष्मागतिकी सिद्धान्त के अनुसार पायरोधातुकर्म (Pyrometallurgy) अर्थात् उच्च ताप कम क्रियाशील धातुओं के ऑक्साइडों के अपचयन में अत्यधिक उपयोगी होता है किन्तु अधिक क्रियाशील धातुओं जैसे-ऐलुमीनियम Al, मैग्नीशियम Mg, सोडियम Na आदि के लिए उपयोगी नहीं होता है क्योंकि ये धातुएँ स्वतः प्रबल अपच्चायक होती है। इनके मानक अपचयन विभव E° के मान उच्च ऋणात्मक होते हैं। अतः ऐसी धातुओं के गलित लवण का अपचयन विद्युत् अपघटन द्वारा किया जा सकता है।
इसे मानक गिब्स मुक्त ऊर्जा समीकरण से समझाया जा सकता है:
\(\Delta G^{\circ}=-n F E^{\circ}\)
जहाँ n = अपचयन के दौरान स्थानान्तरित इलेक्ट्रॉनों की संख्या
E° = निकाय के रेडॉक्स युग्म का इलेक्ट्रोड विभव
F = प्रवाहित आवेश का परिमाण F = 96500C लगभग
अधिक क्रियाशील धातुओं के इलेक्ट्रोड विभव के उच्च ऋणात्मक मानों के कारण ∆G के संगत मान धनात्मक हो जाते हैं।
अतः उपर्युक्त धातुओं का पृथक्करण कराने के लिए अशुद्ध गलित धातु विलयनों का विद्युत् अपघटनी अपचयन कराया जाता है। विलयन में उपस्थित सक्रिय धातु धनायनों का अपचयन होता है तथा ये कैथोड पर निक्षेपित (Deposit) हो जाती हैं।
उत्पादित या प्राप्त धातु की क्रियाशीलता (reactivity) के आधार पर उपयुक्त पदार्थों के इलेक्ट्रोडों का प्रयोग किया जाता है। जिससे कि रेडॉक्स युग्म का इलेक्ट्रोड विभव E° धनात्मक हो जाए एवं परिणामस्वरूप ∆G के ऋणात्मक हो जाने से अधिक क्रियाशील धातु विलयन में तथा कम क्रियाशील धातु विलयन से बाहर निकल जाती है।
उदाहरणार्थ:
CU2+ (aq) + Fe(s) → CU(s) + Fe2+(aq)
दूसरे शब्दों में यह कह सकते हैं कि विद्युत् रासायनिक श्रेणी में ऊपर स्थित धातुएँ अपने से नीचे स्थिर धातु को उसके विलयन में से विस्थापित कर देती हैं।
ऐल्यूमीनियम का उत्पादन: हॉल-हैराउल्ट प्रक्रम (Production of Aluminium-Hall-Heroult's Process)
ऐल्यूमीनियम को शुद्ध ऐलुमिना Al2O3 में क्रायोलाइट NA3IF6 या कैल्शियम फ्लोराइड CaF2 मिलाकर विलयन का विद्युत अपघटन करके प्राप्त किया जाता है।
शुद्ध ऐलुमिना में क्रायोलाइट मिलाने के निम्न कारण हैं:
- यह विद्युत-अपघट्य के गलनांक को कम कर देता है।
- यह चालकता में वृद्धि कर देता है।
- यह संक्षारण की समस्या को दूर कर देता है।
इस प्रक्रमं में,
- कैथोड: कार्बन की परत युक्स स्टील का पात्र जो कि लोहे के टेंक पर होती है।
- ऐनोड: ग्रेफाइट की छड़
- वैद्युत अपघट्य - ऐलुमिना + क्रायोलाइट + फ्लोरस्पार
वैद्युत अपघटन के दौरान ऐल्यूमीनियम धातु कैथोड पर एकत्र हो जाती है तथा ऑक्सीजन गैस ऐनोड पर एकत्र होती है, जहाँ ऐनोड पर ऑक्सीजन गैस् कार्बन से क्रिया करके CO तथा CO2 बनाती है। इस प्रकार ऐल्यूमीनियम के प्रत्येक किलोग्राम के उत्पादन के लिए कार्बन ऐनोड का लगभग 0.5 किलोग्राम कार्बन जल जाता है। इस कारण समय-समय पर ऐनोड को बदलने की आवश्यकता होती है। प्रक्रम के दौरान होने वाली अभिक्रियाएँ निम्नवत हैं।
कैथोड: Al3+ (गलित) + 3e- → Al(1)
ऐनोड: CS + O2- (गलित) → CO(g) + 2e-
प्रश्न 5.
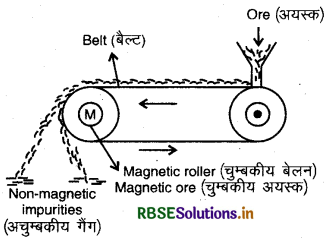
अयस्कों का सान्द्रण क्यों आवश्यक है? चुम्बकीय पृथक्करण विधि से क्या तात्पर्य है?
उत्तर:
चुम्बकीय पृथक्करण विधि (Magnetic Separation Method): यह विधि पदार्थ के चुम्बकीय गुणों की भिन्नता पर निर्भर होती है। इस विधि में चुम्बकीय पृथक्कारी (Magnetic separater) का प्रयोग करते हैं, जिसमें एक चमड़े की पट्टी (belt), दो बेलनों (rollers) पर घूमती है। दो बेलनों में से एक बेलन चुम्बकीय होता है। अयस्क को पट्टी के एक सिरे पर डालते हैं। पट्टी घूमती हुई चुम्बकीय बेलन की ओर जाती है, जहाँ चुम्बकीय पदार्थ आकर्षित होकर चुम्बक के नजदीक एकत्र होते हैं तथा अचुम्बकीय पदार्थ दूर एकत्र हो जाते हैं। इस प्रकार हमें दो अलग-अलग ढेर प्राप्त होते हैं।
प्रश्न 6.
ढलवाँ लोहे का उसके अयस्क से निष्कर्षण की विधि का वर्णन कीजिए। इस निष्कर्षण में प्रयुक्त होने वाली भट्टी के प्रमुख क्षेत्रों में होने वाली अभिक्रियाओं को लिखिए।
या
लोहे का उदाहरण देते हुए प्रगलन की प्रक्रिया की भट्टी का चित्र एवं रासायनिक समीकरण द्वारा समझाइए।
उत्तर:
एलिंघम आरेख का उपयोग धातुओं के निष्कर्षण में किया जाता है। (क) आयरन (लोहे) का इसके ऑक्साइड अयस्क से निष्कर्षण (Extraction of Iron from its Oxide Ore) आयरन ऐलुमीनियम के पश्चात् भूपर्पटी में सर्वाधिक पायी जाने वाली धातु है। इसकी उपलब्धता 5.1% है।
(i) अयस्क (Ores): आयरन के कुछ प्रमुख अयस्क निम्नवत् हैं:
- हेमेटाइट - Fe2O3 (मुख्य)
- लिमोनाइट - 2Fe2O3 3H2O
- आयरन पायराइट - FeS2
- सिडेराइट - FeCO3
- मैग्नेटाइट - Fe3O4
(2) निष्कर्षण (Extraction): सर्वप्रथम हेमेटाइट (FeO3) अयस्क को जो क्रशर में पीसकर इसका सान्द्रण चुम्बकीय पृथक्करण विधि (Magnetic Separation Method) द्वारा करते हैं। जिससे अचुम्बकीय प्रकृति की अशुद्धियाँ (आधात्री) पृथक् हो जाती हैं। सांद्रण के पश्चात आयरन के ऑक्साइड अयस्कों (Fe2O3, Fe3O4) के मिश्रण से जल को हटाने, कार्बोनेटों का अपघटन करने तथा सल्फाइड को ऑक्सीकृत करने के लिए इनका निस्तापन किया जाता है। इसके पश्चात वाय के आधिक्य (ऑक्सीजन) की उपस्थिति में अयस्क का भर्जन परावर्तनी भटटी में कराते हैं जिससे PS तथा As आदि की अशुद्धियाँ उनके वाष्पशील ऑक्साइडों के रूप में अयस्क से पृथक हो जाती हैं तथा इस दौरान FeO का परिवर्तन Fe2O3 में हो जाता है।
4FeO + O2 → 2Fe2O3
(3) प्रगलन (Smelting): भर्जित अयस्क में चूना पत्थर तथा कोक मिलाकर वात्या भट्टी (धमन भट्टी) में ऊपर से डाल देते हैं। यहाँ ऑक्साइड धातु में अपचित हो जाता है। इसे प्रगलन (Smelting) कहते हैं। भट्टी के ट्वीयरों (Tuyers) द्वारा गरम हवा की धारा तेजी से प्रवाहित की जाती है। इस भाग का तापमान सबसे अधिक होता है। यह लगभग 2170 K होता है। गर्म वायु से कोक का दहन होकर ऊष्मा उत्पन्न होती है एवं CO2 बनती है।
C + O2 → CO2 + ऊर्जा
CO2 गैस ऊपर की ओर अगले खण्ड में पहुँचती है जहाँ अपचयित होकर CO बनाती है, इस खण्ड का ताप कम होता है यह लगभग 1570 K होता है तथा ऊपर से डाला जाने वाला आयरन के आक्साइड (Fe2O3 तथा Fe5O4) विभिन्न पदों में FeO में अपचयित हो जाते हैं।
वात्या भट्टी में आयरन ऑक्साइडों का अपचयन विभिन्न ताप परिसरों में होता है। वात्या भट्टी के विभिन्न क्षेत्र निम्न प्रकार हैं तथा उनमें होने वाली हैं-अभिक्रियाओं के आधार पर भट्टी को चार भागों में विभाजित किया गया है। ये क्षेत्र निम्न हैं

(i) अपचयन क्षेत्र (673 K - 973 K लगभग):
यहाँ Fe2O3 पहले Fe3O4 में अपचित होता है तथा बाद में FeO में
3 Fe5O3 + CO → 2Fe3O4 + CO2 .......... (3)
Fe3O4 + 4CO → 3Fe + 4CO2
Fe2O3 + CO → 2FeO + CO2
यह लोहा सरन्ध्र एवं ठोस होता है जिसे स्पंजी लोहा (spongy iron) कहते हैं।
(ii) केन्द्रीय क्षेत्र (ऊष्माशोषण क्षेत्र): (1173K - 1473K लगभग)

(iii) संगालित क्षेत्र (1373K - 1573K लगभग)
इस क्षेत्र में स्पंजी लोहा पिघलता है तथा C, P, Si आदि का अवशोषण कर लेता है।
CO + C → 2CO2 ∆H = + 163 kJ
(iv) दहन क्षेत्र (1173K - 2173K लगभग)
C + O2 → 2CO2 ∆H = - 395.5kJ
कोक वायु कार्बन डाइऑक्साइड
FeO + C → Fe + CO

प्रश्न 7.
उष्मागतिकी के आधार पर आयन ऑक्साइड के अपचयन की व्याख्या कीजिए।
उत्तर:
एलिंघम आरेख का उपयोग धातुओं के निष्कर्षण में किया जाता है। (क) आयरन (लोहे) का इसके ऑक्साइड अयस्क से निष्कर्षण (Extraction of Iron from its Oxide Ore) आयरन ऐलुमीनियम के पश्चात् भूपर्पटी में सर्वाधिक पायी जाने वाली धातु है। इसकी उपलब्धता 5.1% है।
(i) अयस्क (Ores): आयरन के कुछ प्रमुख अयस्क निम्नवत् हैं:
- हेमेटाइट - Fe2O3 (मुख्य)
- लिमोनाइट - 2Fe2O3 3H2O
- आयरन पायराइट - FeS2
- सिडेराइट - FeCO3
- मैग्नेटाइट - Fe3O4
(2) निष्कर्षण (Extraction): सर्वप्रथम हेमेटाइट (FeO3) अयस्क को जो क्रशर में पीसकर इसका सान्द्रण चुम्बकीय पृथक्करण विधि (Magnetic Separation Method) द्वारा करते हैं। जिससे अचुम्बकीय प्रकृति की अशुद्धियाँ (आधात्री) पृथक् हो जाती हैं। सांद्रण के पश्चात आयरन के ऑक्साइड अयस्कों (Fe2O3, Fe3O4) के मिश्रण से जल को हटाने, कार्बोनेटों का अपघटन करने तथा सल्फाइड को ऑक्सीकृत करने के लिए इनका निस्तापन किया जाता है। इसके पश्चात वाय के आधिक्य (ऑक्सीजन) की उपस्थिति में अयस्क का भर्जन परावर्तनी भटटी में कराते हैं जिससे PS तथा As आदि की अशुद्धियाँ उनके वाष्पशील ऑक्साइडों के रूप में अयस्क से पृथक हो जाती हैं तथा इस दौरान FeO का परिवर्तन Fe2O3 में हो जाता है।
4FeO + O2 → 2Fe2O3
(3) प्रगलन (Smelting): भर्जित अयस्क में चूना पत्थर तथा कोक मिलाकर वात्या भट्टी (धमन भट्टी) में ऊपर से डाल देते हैं। यहाँ ऑक्साइड धातु में अपचित हो जाता है। इसे प्रगलन (Smelting) कहते हैं। भट्टी के ट्वीयरों (Tuyers) द्वारा गरम हवा की धारा तेजी से प्रवाहित की जाती है। इस भाग का तापमान सबसे अधिक होता है। यह लगभग 2170 K होता है। गर्म वायु से कोक का दहन होकर ऊष्मा उत्पन्न होती है एवं CO2 बनती है।
C + O2 → CO2 + ऊर्जा
CO2 गैस ऊपर की ओर अगले खण्ड में पहुँचती है जहाँ अपचयित होकर CO बनाती है, इस खण्ड का ताप कम होता है यह लगभग 1570 K होता है तथा ऊपर से डाला जाने वाला आयरन के आक्साइड (Fe2O3 तथा Fe5O4) विभिन्न पदों में FeO में अपचयित हो जाते हैं।
वात्या भट्टी में आयरन ऑक्साइडों का अपचयन विभिन्न ताप परिसरों में होता है। वात्या भट्टी के विभिन्न क्षेत्र निम्न प्रकार हैं तथा उनमें होने वाली हैं-अभिक्रियाओं के आधार पर भट्टी को चार भागों में विभाजित किया गया है। ये क्षेत्र निम्न हैं

(i) अपचयन क्षेत्र (673 K - 973 K लगभग):
यहाँ Fe2O3 पहले Fe3O4 में अपचित होता है तथा बाद में FeO में
3 Fe5O3 + CO → 2Fe3O4 + CO2 .......... (3)
Fe3O4 + 4CO → 3Fe + 4CO2
Fe2O3 + CO → 2FeO + CO2
यह लोहा सरन्ध्र एवं ठोस होता है जिसे स्पंजी लोहा (spongy iron) कहते हैं।
(ii) केन्द्रीय क्षेत्र (ऊष्माशोषण क्षेत्र): (1173K - 1473K लगभग)

(iii) संगालित क्षेत्र (1373K - 1573K लगभग)
इस क्षेत्र में स्पंजी लोहा पिघलता है तथा C, P, Si आदि का अवशोषण कर लेता है।
CO + C → 2CO2 ∆H = + 163 kJ
(iv) दहन क्षेत्र (1173K - 2173K लगभग)
C + O2 → 2CO2 ∆H = - 395.5kJ
कोक वायु कार्बन डाइऑक्साइड
FeO + C → Fe + CO
विमिन्न प्रतियोगी परीद्वाओं में पढठे गये प्रटनन:
प्रश्न 1.
निम्न में से कौन मैलेकाइट है:
(a) Cu CO2, Cu(OH)2
(b) CuFeS2
(c) Cu(OH)2
(d) FeSO
उत्तर:
(a) Cu CO2, Cu(OH)2
प्रश्न 2.
एलिघम आरेख को ध्यान में रखते हुए निम्नलिखित में से कौन-सी धातु का उपयोग एलुमिना के अपचयन में किया जाता
(a) Mg
(b) Zn
(c) Fe
(d) Cu
उत्तर:
(a) Mg

प्रश्न 3.
सोने एवं चाँदी के निष्कर्षण में CN आयन से निक्षालन होता है। चाँदी को बाद में पुनः प्राप्त इसके द्वारा किया जाता हैं
(a) द्रवगलन परिष्करण
(b) आसवन
(c) मडंल परिष्करण
(d) Zn से विस्तापन
उत्तर:
(d) Zn से विस्तापन
प्रश्न 4.
स्तम्भ I के उल्लेख को स्तम्भ II के उल्लेख से मिलायें। सही संकेत पद्धति है
स्तम्भ I
A सायनाइड प्रक्रम
B फेन प्लवन विधि
C विद्युत् अपघटनी अपचयन
D मण्डल परिष्करण
स्तम्भ II
(1) अतिशुद्ध Ge
(ii) Zns का प्रसाधन
(iii) Al का निष्कर्षण
(iv) Au का निष्कर्षण
(v) Ni का शोधन
(A) (B) (C) (D)
(a) (iv) (ii) (ii) (i)
(b) (ii) (iii) (i) (iv)
(c) (i) (ii) (ii) (iv)
(d) (iii) (iv) (v) (i)
उत्तर:
(b) (ii) (iii) (i) (iv)
प्रश्न 5.
सल्फाइड अयस्कों से कॉपर के निष्कर्षण में धातु को प्राप्त करने के लिए अन्ततः क्यूप्रस ऑक्साइड का अपचयन किसके साथ होता है?
(a) आयरन (II) सल्फाइड
(b) कार्बन मोनो ऑक्साइड
(c) कॉपर (1) सल्फाइड
(d) सल्फर डाइ ऑक्साइड।
उत्तर:
(a) आयरन (II) सल्फाइड
प्रश्न 6.
निम्न में से किस धातु का निष्कर्षण विद्युत् अपघटनी विधि द्वारा किया जाता है?
(a) Cu
(b) AI
(c) Fe
(d) Ag
उत्तर:
(b) AI
प्रश्न 7.
निम्न में से कौन-सा धात्विक ऑक्साइड कार्बन के द्वारा धात को अपचयित नहीं कर सकता है?
(a) Al2O3
(b) PbO
(c) ZnO
(d) Fe2O3
उत्तर:
(d) Fe2O3
प्रश्न 8.
निम्नलिखित में से कौन-सा लोहे का खनिज हैं?
(a) मैलाकाइट
(b) केसीटेराइट
(c) पायरोलुसाइट
(d) मैग्नेटाइट।
उत्तर:
(a) मैलाकाइट
प्रश्न 9.
ऐलुमिना (Al2O3) से ऐलुमीनियम का निष्कर्षण निम्न में से किस गलित मिश्रण के विद्युत् अपघटन द्वारा किया जाता है?
(a) Al2O3 + HF + NaAIF4
(b) Al2O3 + CaF2 + NaAIF4
(c) Al2O3 + Na3AIF6 + CaF2
(d) Al2O3 + KF + Na3AIF6
उत्तर:
(b) Al2O3 + CaF2 + NaAIF4

प्रश्न 10.
निम्न में से उस धातु की पहचान कीजिए जिसमें एक अवयव के रूप में अधातु उपस्थित है:
(a) इन्वार
(b) स्टील
(c) वैल मेटल
(d) ब्रान्ज (कॉसा)।
उत्तर:
(c) वैल मेटल
