RBSE Class 12 Chemistry Important Questions Chapter 5 पृष्ठ रसायन
Rajasthan Board RBSE Class 12 Chemistry Important Questions Chapter 5 पृष्ठ रसायन Important Questions and Answers.
Rajasthan Board RBSE Solutions for Class 12 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 12. Students can also read RBSE Class 12 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 12 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 12 Chemistry Chapter 5 Important Questions पृष्ठ रसायन
बहुविकल्पीय प्रश्न:
प्रश्न 1.
निम्नलिखित में कौन प्राकृतिक कोलॉइड नहीं है?
(i) रक्त
(ii) शर्करा
(iii) NaCl
(iv) RCOONa
उत्तर:
(iv) RCOONa

प्रश्न 2.
औषधियाँ किस अवस्था में सर्वाधिक प्रभावी होती हैं?
(i) कोलॉइड
(ii) ठोस
(iii) विलयन
(iv) इनमें से कोई नहीं
उत्तर:
(i) कोलॉइड
प्रश्न 3.
क्रिस्टलाभ, कोलॉइड से भिन्न है:
(i) वैद्युतीय व्यवहार में
(ii) कणों की प्रकृति में
(iii) कणों के आकार में
(iv) विलेयता में
उत्तर:
(iii) कणों के आकार में
प्रश्न 4.
कोलॉइडों को शुद्ध करने की विधि है:
(i) पेप्टीकरण:
(ii) स्कन्दन
(iii) अपोहन
(iv) ब्रेडिंग की आर्क विधि
उत्तर:
(iii) अपोहन
प्रश्न 5.
ब्राउनियन का कारण है:
(i) द्रव अवस्था में तापमान का उतार-चढ़ाव
(ii) कणों का आकार
(iii) परिक्षेपण माध्यम के अणुओं का कोलॉइड कणों पर संघात
(iv) कोलॉइडी कणों पर आवेश का आकर्षण व प्रतिकर्षण
उत्तर:
(ii) कणों का आकार
प्रश्न 6.
कोहरा निम्न कोलॉइडी अवस्था का उदाहरण है:
(i) SO2
(ii) NO
(iii) AS2O3
(iv) H3PO4
उत्तर:
(i) SO2
प्रश्न 7.
निम्न में कौन-सा कथन उत्प्रेरक के लिए सही नहीं है?
(i) गैस में द्रव परिक्षिप्त
(ii) गैस में गैस परिक्षिप्त
(iii) गैस में ठोस परिक्षिप्त
(iv) द्रव में ठोस परिक्षिप्त
उत्तर:
(iii) गैस में ठोस परिक्षिप्त
प्रश्न 8.
प्लेटिनम उत्प्रेरक के लिए निम्नलिखित में से कौन विष का कार्य करता है?
(i) यह अभिक्रिया के अन्त में अपरिवर्तित रहता है।
(ii) उत्क्रमणीय अभिक्रिया में यह साम्य को परिवर्तित नहीं करता है।
(iii) यह अभिक्रिया को प्रारम्भ कर सकता है।
(iv) कभी - कभी उत्प्रेरक अभिक्रियाओं के लिए बहुत विशिष्ट होते हैं।
उत्तर:
(iii) यह अभिक्रिया को प्रारम्भ कर सकता है।

प्रश्न 9.
अभिक्रिया 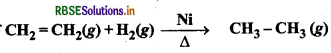 में NI उदाहरण है:
में NI उदाहरण है:
(i) विषमांग उत्प्रेरक का
(ii) समांग उत्प्रेरक का
(iii) ऋणात्मक उत्प्रेरक का
(iv) स्व-उत्प्रेरक का
उत्तर:
(i) विषमांग उत्प्रेरक का
प्रश्न 10.
किसी विलायक में परिक्षिप्त पदार्थ के कणों का आकार 50A से 2000 A की परास में है। विलयन होगा:
(i) निलम्बन
(ii) वास्तविक विलयन
(iii) कोलॉइडी विलयन
(iv) संतृप्त विलयन
उत्तर:
(iii) कोलॉइडी विलयन
प्रश्न 11.
झाग या फेन किस प्रकार का कोलॉइडी विलयन है?
(i) गैस में द्रव
(ii) द्रव में गैस
(iii) द्रव में द्रव
(iv) गैस में ठोस
उत्तर:
(ii) द्रव में गैस
प्रश्न 12.
अम्लीय KMnO4 द्वारा ऑक्सैलिक अम्ल के ऑक्सीकरण में उत्प्रेरक होता है:
(i) MnO4-
(ii) KMnO4
(iii) H+
(iv) Mn2+
उत्तर:
(iv) Mn2+
प्रश्न 13.
जल गैस से मेथिल ऐल्कोहॉल के निर्माण में प्रयोग किया जाने वाला उत्प्रेरक है।
(i) CuO + NiO + Cr2O3
(ii) CuO + ZnO + Cr2O3
(iii) Al2O3 +CuO
(iv) CuO + Fe2O3
उत्तर:
(ii) CuO + ZnO + Cr2O3
प्रश्न 14.
झाग या फेन किस प्रकार का कोलॉइडी विलयन है?
(i) गैस में द्रव
(ii) द्रव में गैस
(iii) द्रव में द्रव
(iv) गैस में ठोस
उत्तर:
(ii) द्रव में गैस

प्रश्न 15.
जब वायु परिक्षेपण माध्यम होती है तो बना हुआ सॉल कहलाता
(i) एल्कोसॉल
(ii) हाइड्रोसॉल
(iii) बेन्जोसॉल
(iv) एरोसॉल
उत्तर:
(iv) एरोसॉल
प्रश्न 16.
किसी विलायक में परिक्षिप्त पदार्थ के कणों का आकार 50A से 2000 A की परास में है। विलयन होगा:
(i) निलम्बन
(ii) वास्तविक विलयन
(iii) कोलॉइडी विलयन
(iv) संतृप्त विलयन
उत्तर:
(iii) कोलॉइडी विलयन
प्रश्न 17.
निम्नलिखित प्रकार के उत्प्रेरणों में से किसे अधिशोषण सिद्धान्त द्वारा स्पष्ट किया जा सकता है?
(i) समांगी उत्प्रेरण
(ii) विषमांगी उत्प्रेरण
(iii) एन्जाइम उत्प्रेरण
(iv) अम्ल-क्षार उत्प्रेरण
उत्तर:
(ii) विषमांगी उत्प्रेरण
प्रश्न 18.
रासायनिक अभिक्रिया 2KCIO3 + [MnO2] → 2KCl + 3O2 + [MnO2]। उदाहरण है:
(i) समांग उत्प्रेरण का
(ii) विषमांग उत्प्रेरण का
(iii) ऋणात्मक उत्प्रेरण का
(iv) प्रेरित उत्प्रेरण का
उत्तर:
(i) समांग उत्प्रेरण का
प्रश्न 19.
पदार्थ जो उत्प्रेरक की क्रियाशीलता को नष्ट अथवा कम कर देता है, कहलाता है
(i) ऋणात्मक उत्प्रेरक
(ii) मंदक
(iii) वर्धक
(iv) उत्प्रेरक विष
उत्तर:
(iv) उत्प्रेरक विष
प्रश्न 20.
आर्सेनियस सल्फाइड के कोलॉइडी विलयन के स्कन्दन में सबसे प्रभावी विलयन है
(i) Nacl
(ii) Na2SO4
(iii) Na2PO4
(iv) BaCl2
उत्तर:
(iv) BaCl2
अति लघु उत्तरीय प्रश्न:
प्रश्न 1.
अधिशोषण को परिभाषित कीजिए।
उत्तर:
पदार्थ का सूक्षम विभाजित अवस्था में ठोस अथवा द्रव की सतह पर संचित होना अधिशोषण कहलाता है?
प्रश्न 2.
रासायनिक अधिशोषण की परिभाषा लिखिए।
उत्तर:
जब अधिशोष्य अधिशोषण के साथ रासायनिक बन्ध बनाकर बन्धित होता है, तब इसे रासायनिक अधिशोषण कहते हैं।

प्रश्न 3.
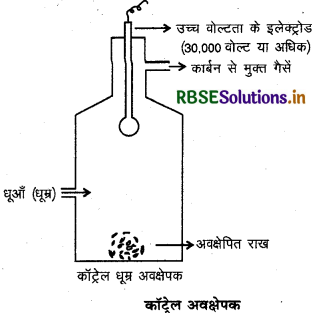
कॉट्रेल धूम्र अवक्षेपक का नामांकित चित्र बनाइए।
उत्तर:
प्रश्न 4.
आकाश का रंग नीला क्यो दिखाई देता है?
उत्तर:
वायुमण्डल में धूल व जल में असंख्य सूक्ष्मकण उपस्थित होते हैं। ये कण प्रकाश का प्रकीर्णन करते हैं। ये कण मुख्यतः नीले रंग के प्रकाश का प्रकीर्णन करते हैं क्योंकि इस प्रकाश का तरंगदैर्ध्य सबसे कम होती जबकि अन्य रंगों का प्रकाश अवशोषित हो जाता है अतः आकाश का रंग नीला दिखाई देता है।
प्रश्न 5.
जल के शुद्धिकरण हेतु फिटकरी क्यों मिलाते हैं?
उत्तर:
अशुद्ध जल में मिट्टी के कण, जीवाणु आदि उपस्थित होते हैं। ये कण ऋणावेशित होते हैं। जल से इन अशुद्धियों को पृथक करने के लिए जल में फिटकरी मिलाते हैं। फिटकरी विलयन में उपस्थित AI3+ आयन जल में उपस्थित ऋणावेशित अशुद्धियों को उदासीन करके अवक्षेपित कर देते हैं। स्वच्छ जल को निथारकर अलग कर लिया जाता है।
प्रश्न 6.
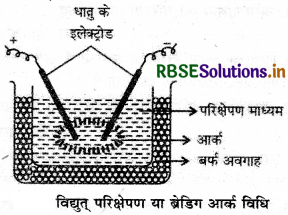
कोलॉइडी विलायन बनाने की विद्युतीय परिक्षेपण विधि का नामाकिंत चित्र बनाइए।
उत्तर:
कोलाइडी विलयन बनाने की विद्युतीय परिक्षेपण विधि का चित्र निम्न प्रकार है।
प्रश्न 7.
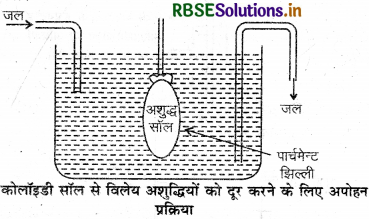
कोलाइडी विलयनों के शुद्धिकरण की अपोहन विधि का नामांकित चित्र बनाइए।
उत्तर:
प्रश्न 8.
कोलॉइडी विलयनों के शुद्धिकरण की वैद्युत अपोहन विधि का नामांकित चित्र बनाइये।
उत्तर:
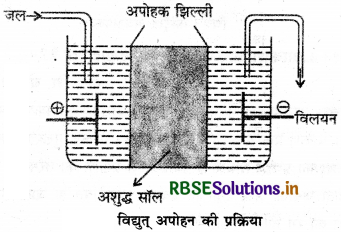
प्रश्न 9.
एल्कोहॉल को पैट्रोल में परिवर्तित करने वाले जिओलाइट उत्प्रेरक का नाम लिखिए।
उत्तर:
ZSM - 5 का उपयोग करते हैं।
प्रश्न 10.
'पेप्टीकरण' पद को परिभाषित कीजिए।
उत्तर:
पेप्टीकरण: किसी ताजा बने हुए अवक्षेप को उपयुक्त विद्युत अपघट्य की सहायता से कोलॉइडी विलयन में परिवर्तित करने की क्रिया को पेप्टीकरण कहते हैं।
प्रश्न 11.
जब एक प्रकाश किरण पुंज को किसी कोलॉइडी विलयन में से गुजारा जाता है तो क्या विशेषता देखी जाती है?
उत्तर:
टिण्डल प्रभाव दिखाई देता है।

प्रश्न 12.
कोलॉइडी विलयन किसे कहते हैं?
उत्तर:
ऐसे विलयन जिसकी दो प्रावस्थाएँ, परिक्षिप्त प्रावस्था एवं: परिक्षेपण माध्यम होती हैं तथा इनमें कणों का आकार 1 nm से 1000 nm के मध्य का होता है, कोलॉइडी विलयन कहलाते हैं।
प्रश्न 13.
जलयोजित फेरिक ऑक्साइड एवं आर्सेनिक सल्फाइड सॉल को मिश्रित करने पर क्या होता है?
उत्तर:
स्कन्दन
प्रश्न 14.
अधिशोषण एवं अवशोषण में दो अंतर लिखिए।
उत्तर:
|
अधिशोषण |
अवशोषण |
|
अधिशोषण केवल सतह पर ही होता है। |
अवशोषण में एक अवशोषित पदार्थ दूसरे पदार्थ में समान रूप से फैल जाता है। |
|
अधिशोषण प्रारम्भ में तेजी से तथा उसके बाद धीरे होता जाता है। |
अवशोषण समान वेग से होता है। |
प्रश्न 15.
विषमांगी उत्प्रेरण की कोई एक रासायनिक अभिक्रिया लिखिए।
उत्तर:
विषमांगी उत्प्रेरण का रासायनिक समीकरण निम्न है
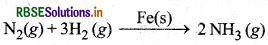
प्रश्न 16.
भौतिक अधिशोषण एवं रासायनिक अधिशोषण में दो अन्तर लिखिए।
उत्तर:
|
भौतिक अधिशोषण |
रासायनिक अधिशोषण |
|
1. इसमें अधिशोष्य तथा अधिशोषक के मध्य दुर्बल वाण्डर वाल्स आकर्षण बल होते हैं। |
1. इसमें अंधिशोष्य तथा अधिशोषण के मध्य प्रबल रासायनिक बन्ध : होते हैं। |
|
2. यह कम ताप पर होता है तथा ताप में वृद्धि के साथ कम होता है। |
2. यह उच्च ताप पर होता है। |
प्रश्न 17.
क्या होता है जब कोलॉइडी विलयन में विद्युत धारा प्रवाहित की जाती है?
उत्तर:
जब कोलॉइडी विलयन में विद्युत धारा प्रवाहित की जाती है जब कोलॉइड कण विपरीत आवेशित इलेक्ट्रोड की ओर गति करते हैं तथा अनावेशित हो जाते हैं। यह गति वैद्युत कण संचलन (Electro phoresis) कहलाती है।
प्रश्न 18.
जिलेटिन की स्वर्ण संख्या 0.005 है। इसका क्या तात्पर्य
उत्तर:
इसका तात्पर्य है कि जिलेटिन की 0.005 मिलीग्राम मात्रा 10 मिली गोल्ड के कोलॉइडी विलयन का NaCl के 10% सान्द्रता के 1 मिली विलयन द्वारा स्कन्दन रोकती है।
प्रश्न 19.
पेप्टीकरण की क्रिया को एक उदाहरण द्वारा समझाइए।
उत्तर:
पेप्टीकरण-पेप्टीकरण की विधि स्कन्दन के विपरीत है। इसमें ताजे बने हुए अवक्षेप को किसी वैद्युत-अपघटय के तनु विलयन के साथ हिलाने पर कोलॉइडी विलयन प्राप्त होता है; जैसे-फेरिक हाइड्रॉक्साइड के ताजे अवक्षेप में फेरिक क्लोराइड का विलयन मिलाने पर लाल रंग का Fe(OH)3 का कोलॉइडी विलयन बनता है।

प्रश्न 20.
कासियस-पर्पिल क्या है? आप इसे कैसे प्राप्त करेंगे?
उत्तर:
ऑरिक क्लोराइड विलयन का स्टैनस क्लोराइड विलयन द्वारा अपचयन करने पर बैंगनी रंग का गोल्ड सॉल बनता है, जिसे कासियस-पर्पिल कहते हैं।
2AUCl3 + 3SnCl2 → 2Au + 3SnCl4
SnCl2 + 2H2O → SnO2 + 4HCl
प्रश्न 21.
गोल्ड सॉल बनाने की ब्रेडिग आर्क विधि का वर्णन कीजिए।
उत्तर:
इस विधि में परिक्षेपण तथा संघनन दोनों क्रियाएँ होती हैं। धातु (गोल्ड) के दो इलेक्ट्रोडों को NaOH की अल्प मात्रा युक्त ठण्डे जल (परिक्षेपण माध्यम) में डुबोकर धातु इलेक्ट्रोडों के बीच विद्युत आर्क उत्पन्न किया जाता है जिससे धातु वाष्पित होती है और ठण्डा करने पर कोलॉइड आकार के कणों में परिवर्तित हो जाती है जिससे गोल्ड सॉल बन जाता है।
प्रश्न 22.
नैनो पदार्थ किसे कहते हैं?
उत्तर:
ऐसे पदार्थ जिनका आकार 1 से 100 nm (अर्थात् 1 से 100 nm पैमाने) के अन्तर्गत होता है, नैनो पदार्थ कहलाते हैं।
प्रश्न 23.
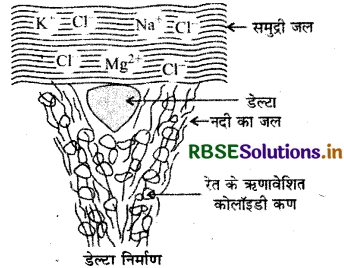
नदी तथा समुद्र के मिलन बिन्दु पर डेल्टा बनने का कारण बताइए।
उत्तर:
नदी के जल में मिट्टी, रेत आदि कोलॉइडी विलयन के रूप में उपस्थित रहते है, क्योंकि जल में रेत (SiO2) परिक्षिप्त रहता है, जबकि समुद्री जल में NaCl जैसे लवण विलेय रहते हैं, जो वैद्युत-अपघटय हैं। इन जलों के मिलन बिन्दु पर समुद्र के NaCl द्वारा नदी के कोलॉइड कणों का स्कन्दन (अवक्षेपण) हो जाता है, जिससे मिट्टी, रेत आदि एकत्र होकर डेल्टा का निर्माण कर देता है।
प्रश्न 24.
द्रव-स्नेही तथा द्रव-विरोधी कोलॉइडों में कौन अधिक स्थायी है? दोनों के एक-एक उदाहरण दीजिए।
उत्तर:
द्रव - स्नेही कोलॉइड अधिक स्थायी होते हैं। द्रव-स्नेही कोलॉइड के उदाहरण: गोंद, जिलेटिन आदि । द्रव - विरोधी कोलॉइड फेरिक हाइड्रॉक्साइड Fe (OH)3 सॉल हैं।
प्रश्न 25.
द्रव स्नेही सॉल, द्रव विरोधी सॉल से अधिक स्थायी क्यों होते हैं? समझाइए।
उत्तर:
द्रव स्नेही सॉल में परिक्षिप्त प्रावस्था और परिक्षेपण माध्यम के अणुओं के मध्य आकर्षण, द्रव विरोधी सॉल की अपेक्षा बहुत अधिक होता है इसलिए द्रव स्नेही सॉल, द्रव विरोधी सॉल की तुलना में अधिक स्थायी होते हैं।
प्रश्न 26.
सूक्ष्म विभाजित अवस्था में उत्प्रेरक, ठोस अवस्था से अधिक क्रियाशील क्यों होते हैं? समझाइए।
उत्तर:
इसका कारण है कि उत्प्रेरक के जितने अधिक टुकड़े होंगे उतनी ही मुक्त संयोजकताएँ अधिक बढ़ेगी, जिनके कारण उसकी कार्यक्षमता अधिक होगी।
प्रश्न 27.
एन्जाइम उत्प्रेरकों तथा साधारण उत्प्रेरकों में क्या अन्तर है? एक उदाहरण देकर समझाइए।
उत्तर:
एन्जाइम उत्प्रेरक अभिक्रिया के लिए ताप का एक परिसर होता है जिस पर इनकी क्रियाशीलता अधिकतम होती है। सामान्यतः यह 25 - 35°C के मध्य है। 70°C पर ये निष्क्रिय हो जाते हैं। साधारण उत्प्रेरकों की क्रियाशीलता 70°C के ऊपर ही प्रभावशाली होती है; जैसे - Al2O3 के लिए अनुकूलतम ताप 250°C है।
प्रश्न 28.
ऋणात्मक उत्प्रेरक पर टिप्पणी लिखिए।
या
ऋणात्मक उत्प्रेरण क्या है?
उत्तर:
जब उत्प्रेरक रासायनिक अभिक्रिया की गति को घटाता है, तो यह घटना ऋणात्मक उत्प्रेरण कहलाती है तथा यह उत्प्रेरक ऋणात्मक उत्प्रेरक कहलाता है।
उदाहरणार्थ: सोडियम सल्फाइट का वायु द्वारा ऑक्सीकरण ग्लिसरीन की उपस्थिति में रुक जाता है; अतः इस अभिक्रिया में ग्लिसरीन ऋणात्मक उत्प्रेरक है।

प्रश्न 29.
आप उत्प्रेरक उत्साहक (वर्धक) से क्या समझते हैं? एक उदाहरण द्वारा स्पष्ट कीजिए।
उत्तर:
वे बाहरी पदार्थ जो किसी उत्प्रेरण क्रिया में प्रयुक्त उत्प्रेरक. की उत्प्रेरण को बढ़ा देते हैं, किन्तु स्वयं अभिक्रिया के लिए उत्प्रेरक नहीं होते हैं, उत्प्रेरक वर्धक कहलाते हैं।
उदाहरणार्थ: तेलों के हाइड्रोजनीकरण में Ni उत्प्रेरक के लिए Cu उत्प्रेरक वर्धक है।
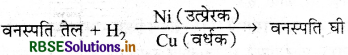
प्रश्न 30.
गैस मास्क में किसका प्रयोग किया जाता है?
उत्तर:
गैस मास्क में सक्रियित चारकोल या अधिशोषकों के मिश्रण का प्रयोग किया जाता है।

प्रश्न 31.
चीनी के विलयन को रंगहीन करने में किसका प्रयोग करते हैं?
उत्तर:
जन्तु चारकोल (Animal charcoal) का।
प्रश्न 32.
किसी वैद्युत-अपघट्य का ऊर्णन मान क्या है? समझाइए।
उत्तर:
किसी आयन का मिली मोल में वह कम-से-कम सान्द्रण जो एक लीटर सॉल को स्कन्दित करने हेतु पर्याप्त हो, उसका ऊर्णन मान कहलाता है। जितनी कम मात्रा किसी वैद्युत-अपघट्य की आवश्यक होती है, उतनी ही अधिक उसकी स्कन्दन शक्ति होती है।
अतः

प्रश्न 33.
पेट्रोल का अपस्फोटन कम करने के लिए कौन-सा रासायनिक पदार्थ काम में लेते हैं?
उत्तर:
टेट्राएथिल लैड (TEL)
प्रश्न 34.
जिओलाइट का सामान्य सूत्र लिखिए।
उत्तर:
Mn[(Al2O3)x (SiO2)y]2 mH2O
प्रश्न 35.
एन्जाइमों के लिए उत्प्रेरक विष का कार्य करने वाले किन्हीं दो उदाहरणों को लिखिए।
उत्तर:
- HCN (हाइड्रोजन सायनाइड)
- CS2 (कार्बन डाइसल्फाइड)।
प्रश्न 36.
अतिसूक्ष्म निस्यन्दन क्या होता है?
उत्तर:
अतिसूक्ष्म निस्यन्दन: इस प्रक्रम में विशेष रूप से निर्मित निस्यन्दक द्वारा, जो कि कोलॉइडी कणों के अतिरिक्त अन्य सभी के लिए पारगम्य होता है, कोलॉइडी विलयन में उपस्थित विलायकों एवं घुलनशील. विलेयों को पृथक् करते हैं।
प्रश्न 37.
कोलॉडियन क्या होता है?
उत्तर:
कोलॉडियन ऐल्कोहॉल व ईथर के मिश्रण में नाइट्रोसेलुलोस का 4% विलयन होता है।
प्रश्न 38.
सॉल के स्कन्दन के कारण लिखिए।
उत्तर:
- विद्युत् अपघट्य मिलाने पर।
- दो विपरीत आवेश वाले सॉल को मिलाने पर।
- उबालने पर।
- विद्युत् कण-संचलन द्वारा।
प्रश्न 39.
स्कन्दन रोकने का क्या उपाय है? बताइए।
उत्तर:
स्कन्दन को रोकने हेतु कोलॉइडी कणों का आकार घटा दिया जाता है या फिर इसमें द्रव-स्नेही कोलॉइड या रक्षी कोलॉइड की मात्रा बढ़ा दी जाती है।
प्रश्न 40.
फोटोग्राफी में जिलेटिन किस प्रकार का कार्य करता है?
उत्तर:
फोटोग्राफी में जिलेटिन रक्षक कोलॉइड का कार्य करता है।
प्रश्न 41.
आर्जिरॉल तथा प्रोटौर्जिरॉल किस तत्व के कोलॉइडी विलयन हैं?
उत्तर:
दोनों ही सिल्वर के कोलॉइडी. विलयन हैं।
प्रश्न 42.
ऐल्कोसॉल क्या होता है?
उत्तर:
वह सॉल जिसमें परिक्षेपण माध्यम ऐल्कोहॉल होता है, 'ऐल्कोसॉल कहलाता है।

प्रश्न 43.
'पेप्टीकरणं' पद को परिभाषित कीजिए।
उत्तर:
पेप्टीकरण: किसी ताजा बने हुए अवक्षेप को उपयुक्त विद्युत् अपघट्य की सहायता से कोलॉइडी विलयन में परिवर्तित करने की क्रिया को पेप्टीकरण कहते हैं।
प्रश्न 44.
विशोषण की प्रक्रिया ताप तथा दाब द्वारा किस प्रकार प्रभावित होती है?
उत्तर:
ताप बढ़ाने पर एवं दाब कम करने पर विशोषण की प्रक्रिया बढ़ जाती है।
प्रश्न 45.
अधिशोषक का विशिष्ट क्षेत्रफल (specific area) किसे कहते हैं?
उत्तर:
1 g अधिशोषक के पृष्ठीय क्षेत्रफल को अधिशोषक का विशिष्ट क्षेत्रफल कहते हैं।
प्रश्न 46.
नमी को नियन्त्रित करने के लिये किस अधिशोषक का प्रयोग करते हैं?
उत्तर:
नमी के नियन्त्रण के लिये सिलिका जेल या ऐलुमिना का प्रयोग करते हैं।
प्रश्न 47.
जल की कठोरता को दूर करने के लिए किस अधिशोषक का प्रयोग करते हैं?
उत्तर:
इसके लिये जिओलाइट का प्रयोग करते हैं। यह जल में कठोरता उत्पन्न करने वाले आयन, जैसे Ca2+ तथा Mg2+ आयनों का अधिशोषण करता है।
प्रश्न 48.
अधिशोषण के कौन-कौन से घटक होते हैं?
उत्तर:
अधिशोषण के दो घटक होते हैं
- अधिशोष्य (Adsorbate),
- अधिशोषक (Adsorbent)।
प्रश्न 49.
विशोषण क्या होता है?
उत्तर:
विशोषण (Desorption): किसी अधिशोषित पदार्थ को अधिशोषक के पृष्ठ से हटाने की परिघटना विशोषण कहलाती है।

प्रश्न 50.
अधिधारण (Occlusion) क्या है?
उत्तर:
सूक्ष्म विभाजित धातुओं के पृष्ठ पर गैसों का अधिशोषण 'अधिधारण' कहलाता है।
प्रश्न 51.
दूध किस प्रकार का कोलॉइडी विलयन है?
उत्तर:
जल में वसा प्रकार का पायस।
प्रश्न 52.
दव-विरोधी कोलॉइड उत्क्रमणीय है अथवा अनुत्क्रमणीय।
उत्तर:
अनुत्क्रमणीय।
प्रश्न 53.
ऐरोसॉल क्या है?
उत्तर:
जब ठोस कण गैसीय परिक्षेपण माध्यम में परिक्षिप्त होते हैं, तब ऐरोसॉल का निर्माण होता है।
प्रश्न 54.
वृहद् अणुक कोलॉइड, बहुआण्विक कोलॉइड तथा संगुणित कोलॉइड के दो-दो उदाहरण दीजिए।
उत्तर:
वृहद् अणुक कोलॉइड-स्टार्च, प्रोटीन। बहुआण्विक कोलॉइड-कोलॉइडी सल्फर, कोलॉइडी गोल्ड। संगुणित कोलॉइड-साबुन, डिटरजेन्ट।
प्रश्न 55.
इमल्सीकारक क्या होते हैं?
उत्तर:
इमल्शन को स्थायी बनाने के लिए काम में आने वाले पदार्थ इमल्सीकारक कहलाते हैं।
प्रश्न 56.
जिलेटिन व गोंद की स्वर्ण संख्या 0.005 तथा 0.10 है। इन रक्षी कोलॉइड में किसकी रक्षण क्षमता अधिक है?
उत्तर:
जिस रक्षी कोलॉइड की स्वर्ण संख्या जितनी कम होती है उतनी ही अधिक उसकी रक्षण क्षमता होती है। अतः जिलेटिन की रक्षण क्षमता अधिक होती है।
प्रश्न 57.
फ्रॉयन्डलिक समतापी वक्र का व्यंजक लिखिए।
उत्तर:
\(\log \frac{x}{m}=\log k+\frac{1}{n} \log \mathrm{P}\)
यहाँ X अधिशोषण की मात्रा, P = दाब, k व n नियतांक हैं।
लघु उत्तरीय प्रश्न:
प्रश्न 1.
रक्षी कोलॉइड क्या हैं? एक उदाहरण दीजिए।
उत्तर:
जब किसी द्रव-विरोधी कोलॉइडी विलयन में वैद्युत अपघट्य का विलयन मिलाने से पूर्व स्नेही कोलॉइडी विलयन की कुछ मात्रा को डाला जाता है, तो द्रव - विरोधी कोलॉइड का स्कन्दन रुक जाता है अर्थात् उसका स्थायित्व बढ़ जाता है। यह प्रक्रम रक्षण (protection) कहलाता है । वे द्रव - स्नेही कोलॉइड, जिन्हें डालने पर द्रव - विरोधी कोलॉइडों का स्कन्दन से स्थायित्व बढ़ जाता है, रक्षी कोलॉइड कहलाते हैं और इस प्रकार प्राप्त द्रव - विरोधी कोलॉइडी विलयन, रक्षित (रक्षी) कोलॉइड कहलाते हैं: जैसे- गोल्ड के कोलॉइडी विलयन में यदि सोडियम क्लोराइड को विलयन मिला दिया जाए तो यह स्कन्दित हो जाता है, किन्तु इस कोलॉइडी विलयन में यदि जिलेटिन की अल्प मात्रा डाल दी जाए तो NaCl विलयन द्वारा स्कन्दन रुक जाता है। इस प्रकार जिलेटिन. यहाँ एक रक्षी कोलॉइड के रूप में कार्य करता है।

प्रश्न 2.
स्वर्ण संख्या या स्वर्णाक की परिभाषा दीजिए।
उत्तर:
रक्षी कोलॉइड की शक्ति को स्वर्ण संख्या ( gold number) से व्यक्त किया जाता है। स्वर्ण संख्या की परिभाषा निम्न प्रकार से दी जाती है किसी द्रव - स्नेही कोलॉइड की स्वर्ण संख्या उसका mg में वह मात्रा है जो गोल्ड सॉल के 10ml में उपस्थित होने पर 10% NaCl विलयन के 1 mL को डालने पर सॉल के लाल रंग से नीले रंग में परिवर्तित होने को रोकने के लिए पर्याप्त होती है।" स्वर्ण संख्या, रक्षी सॉल की शक्ति व्यक्त करने का प्रतीक है। स्वर्ण संख्या जितनी अधिक होगी, सॉल की स्कन्दन शक्ति उतनी ही कम होगी। कम स्वर्ण संख्या होने पर सॉल की स्कन्दन शक्ति अधिक होगी।
प्रश्न 3.
अधिशोषण, अधिशोष्य तथा अधिशोषक से आप क्या समझते हैं?
उत्तर:
अधिशोषण - किसी ठोस अथवा द्रव के पृष्ठ द्वारा किसी पदार्थ के अणुओं को आकर्षित और धारित करने की परिघटना जिसके कारण अणुओं की पृष्ठ पर सान्द्रता में वृद्धि हो जाती है, अधिशोषण कहलाती है। पृष्ठस्सायनशा अधिशोष्य-अणुक स्पीशीज या पदार्थ जो कि पृष्ठ पर सान्द्रित या संचित होता है, अधिशोष्य कहलाता है। अधिशोषक-अणुक स्पीशीज या पदार्थ जिसके पृष्ठ पर अधिशोषण होता है, अधिकशोषक कहलाता है। अधिशोषक-यह पदार्थ जिसके पृष्ठ या सतह पर किसी पदार्थ के. अणु, परमाणु अथवा आयनिक स्पीशीज का अधिशोषण होता है, अधिाशोषक (Adsorbent) कहलाता है।
प्रश्न 4.
क्लोरोफॉर्म को रंगीन बोतलों में रखा जाता है तथा उसमें कुछ मात्रा एथिल ऐल्कोहॉल की भी मिलायी जाती है, क्यों?
उत्तर:
क्लोरोफॉर्म को रंगीन बोतल में ऊपर तक भरकर इसलिए रखते हैं जिससे प्रकाश और वायु अन्दर नहीं पहुँच सके, अन्यथा क्लोरोफॉर्म धीरे-धीरे ऑक्सीकृत होकर फॉस्जीन गैस बनाता है जो बहुत तेज विष है। क्लोरोफॉर्म में 1% एथिल ऐल्कोहॉल ऋणात्मक उत्प्रेरक के रूप में डालते हैं। एथिल ऐल्कोहॉल की उपस्थिति से वायु द्वारा क्लोरोफॉर्म के ऑक्सीकरण की गति अत्यन्त धीमी पड़ जाती है।

प्रश्न 5.
समांग तथा विषमांग उत्प्रेरण को एक-एक उदाहरण देकर समझाइए।
उत्तर:
समांग उत्प्रेरण-जब अभिकारक तथा उत्प्रेरक एक ही प्रावस्था में होते हैं, तब इस अवस्था को समांग उत्प्रेरण कहते हैं। जैसे
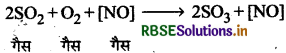
विषमांग उत्प्रेरण-जब उत्प्रेरक तथा अभिकारक भिन्न प्रावस्था में होते हैं तब यह अवस्था विषमांग उत्प्रेरण कहलाती है। जैसे
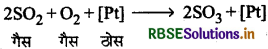
प्रश्न 6.
स्वः उत्प्रेरण को उदाहरण सहित स्पष्ट कीजिए।
उत्तर:
ऐसी अभिक्रिया जिसमें अभिक्रिया के फलस्वरूप बना कोई पदार्थ स्वयं उत्प्रेरक का कार्य करने लगता है, स्वः उत्प्रेरक कहलाता है तथा इस घटना को स्वः उत्प्रेरण कहते हैं।
उदाहरणार्थ: एथिल ऐसीटेट के जल-अपघटन के फलस्वरूप बना ऐसीटिक अम्ल स्वः उत्प्रेरक बन जाता है।

प्रश्न 7.
प्रेरित उत्प्रेरण को एक उदाहरण द्वारा समझाइए।
उत्तर:
प्रेरित उत्प्रेरण: जब कोई क्रियाशील पदार्थ अक्रियाशील . पदार्थ के साथ समान रूप में क्रिया हेतु प्रेरित करके उसको क्रियाशील बना देता है, तो वह क्रियाशील पदार्थ प्रेरित उत्प्रेरक कहलाता है, और यह घटना प्रेरित उत्प्रेरण कहलाती है।
उदाहरणर्थ: सोडियम सल्फाइट (Na2SO3) वायु से ऑक्सीकृत हो जाता है, परन्तु सोडियम आर्सेनाइट (Na3AsO3) ऑक्सीकृत नहीं होता है। दोनों को साथ मिलाने पर दोनों ही ऑक्सीकृत हो जाते हैं; क्योंकि सोडियम सल्फाइट का ऑक्सीकरण, सोडियम आसेंनाइट के ऑक्सीकरण को उत्प्रेरित कर देता है; अतः यहाँ सोडियम सल्फाइट प्रेरित उत्प्रेरक का कार्य करता है।

प्रश्न 8.
समझाइए कि AS2S3 के कोलॉइडी कण ऋणावेशित क्यों होते हैं?
उत्तर:
आर्सेनियस ऑक्साइड और हाइड्रोजन सल्फाइड की अभिक्रिया से बने आर्सेनियस सल्फाइड के कण विलयन से अल्फाइड आयनों को पृष्ठ पर अधिशोषित करके ऋणावेशित हो जाते हैं। सल्फाइड आयन (S2) प्राथमिक अधिशोषित स्तर और हाइड्रोजन आयन (H+) द्वितीयक विसरित स्तर बनाते हैं।
[AS2S3]S2 2H+ इसलिए AS2S3 के कोलॉइडी कण ऋणावेशित हो जाते हैं।
प्रश्न 9.
द्रव-स्नेही और द्रव-विरोधी कोलॉइड किसे कहते हैं? प्रत्येक को एक-एक उदाहरण सहित समझाइए।
उत्तर:
- द्रव-स्नेही कोलॉइड: वे कोलॉइडी पदार्थ जो विलायक के सम्पर्क में आकर तुरन्त कोलॉइडी कणों में विभाजित होकर कोलॉइडी विलयन बनाते हैं, द्रव-स्नेही कोलॉइड कहलाते हैं। इनको अवक्षेपित करने के बाद फिर से द्रव के सम्पर्क में लाकर सुगमता से कोलॉइडी विलयन बनाया जा सकता है। इस विशेष गुण के आधार पर इन्हें उत्क्रमणीय कोलॉइड (reversible colloids) कहते हैं। उदाहरणार्थ-जिलेटिन, स्टार्च, गोंद, प्रोटीन आदि।
- द्रव-विरोधी कोलॉइड: वे कोलॉइडी पदार्थ जो विलायक के सम्पर्क में आने पर सरलता से कोलॉइडी विलयन नहीं बनाते हैं, द्रव-विरोधी कोलॉइड कहलाते हैं। इन्हें अवक्षेपित करने के बाद, फिर से कोलॉइडी विलयन में परिवर्तित करना प्रायः कठिन है। अतः ये अनुक्रमणीय कोलॉइड (irreversible colloids) कहलाते हैं। उदाहरणार्थ-धात्विक या धातु ऑक्साइड,धात्विक हाइड्रॉक्साइड [Fe(OH)3] धातु सल्फाइड (AS2S3) आदि।
प्रश्न 10.
शहर के एक फैक्टरी को प्रदुषण बोर्ड प्रतिबन्धित कर देता है। क्योकि फैक्टरी के स्वामी ने चिमनी पर कोष्ठ नहीं लगाया।
(अ) इस कोष्ठ का नाम लिखिए जिसको फैक्टरी स्वामी ने नहीं लगाया था।
(ब) उपरोक्त कोष्ठ का स्वच्छ नामांकित चित्र बनाइए।
उत्तर:
- आकाश का नीला रंग (Blue Coloúr of Sky): हवा में जल के साथ निलम्बित धूल के कण हमारी आँखों तक पहुँचने वाले प्रकाश को प्रकीर्णित कर देते हैं। इसी कारण आकाश का रंग नीला दिखाई देता है।
- कोहरा एवं धुन्ध (Fog and Mist): जब हवा की बहुत बड़ी मात्रा जिसमें धूल के कण होते हैं, अपने ओसांक से नीचे ठण्डी हो जाती है तो हवा की नमी इन कणों पर संघनित हो जाती है और बिन्दुक (droples) बना लेती है। ये बिन्दुक कोलॉइडी प्रकृति के होने के कारण हवा में धुन्ध या कोहरे के रूप में तैरते रहते हैं।
- प्राकृतिक वर्षा (Natural Rain): बादल हवा में निलम्बित जल के बिन्दुकों से बने ऐरोसॉल होते हैं। ऊपरी वायुमण्डल में संघनन के कारण जल के कोलॉइडी बिन्दुक और बड़े होते जाते हैं, जब तक कि वे बरसात के रूप में नीचे न आ जाएँ। इस प्रकार प्राकृतिक वर्षा होती है। कभी-कभी दो विपरीत आवेशित बादलों के मिलने से भी वर्षा होती है।
- कृत्रिम वर्षा (Artificial Rain): कृत्रिम बरसात करने के लिए विद्युतीकृत धूल को बादलों के ऊपर फेंककर या बादलों के विपरीत आवेश वाले सॉल को वायुयानों की सहायता से स्प्रे किया जाता है।
- खाद्य सामग्री (Food Materials): दूध, मक्खन, हलवा, आइसक्रीम, फलों का रस आदि किसी-न-किसी रूप में कोलॉइड होते हैं।
- रुधिर (Blood): रुधिर भी एक प्रकार का कोलॉइडी विलयन है। यह ऐल्बुमिनॉइड पदार्थ का कोलॉइडी विलयन है। रक्तस्ताव को रोकने के लिए हम लोग फिटकरी एवं फेरिक क्लोराइड के विलयन का प्रयोग करते हैं, क्योंकि ये विद्युत अपघट्य का कार्य करते हैं और रुधिर का स्कन्दन करके उसे थक्के में परिवर्तित कर देते हैं, जिससे खून बहना बन्द हो जाता है।
- मृदाएँ (Soils): उर्वरा मृदाएँ कोलॉइडी प्रकृति की होती हैं जिनमें ह्यूमस, रक्षक कोलॉइड की तरह कार्य करता है। कोलॉइडी प्रकृति के कारण मृदाएँ नमी एवं पोषक पदार्थों को अधिशोषित करती हैं।
- डेल्टा का निर्माण (Formation of Deita): नदी के जल में रेत के कण तथा अनेकों पदार्थ निलम्बित अवस्था में पाए जाते हैं। जब नदी का जल समुद्र के जल के सम्पर्क में आता है तब समुद्र जल में उपस्थित अनेकों विद्युत् अपघट्य (Electrolytes) नदी के जल में उपस्थित कोलॉइडी कणों का अवक्षेपण कर स्कन्दित कर देते हैं। ये पदार्थ नदी तथा समुंद्र के संगम स्थल पर संग्रहित होकर डेल्टा का रूप धारण कर लेते हैं।
प्रश्न 11.
(अ) सॉल के स्कंदन मान की परिभाषा दीजिये।
(ब) निम्नलिखित आयनों को उनके स्कंदन मानों के आधार पर बढ़ते क्रम में व्यवस्थित कीजिए।
PO43-, Cl-, SO42-
उत्तर:
(अ) स्कन्दन- किसी सक्रिय आयन युक्त विद्युत अपघट्य की उपस्थिति में कोलॉइड कणों का अवक्षेपण स्कन्दन कहलाता है।
(ब) आयनों को उनके स्कंदन मानों के आधार पर बढ़ते क्रम में व्यवस्थत करना।
PO43-, Cl-, SO42-

प्रश्न 12.
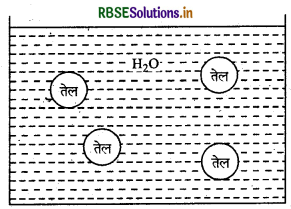
(अ) 'वेनीशिंग क्रीम' किस प्रकार का पायस है। इसका उचित नाम लिखिए।
(ब) उपरोक्त पायस का स्वच्छ व नामांकित चित्र बनाइए।
उत्तर:
(अ) वे इमल्शन जिनमें तेल परिक्षिप्त प्रावस्था के रूप में व जल परिक्षेपण माध्यम के रूप में हो तेल - जल इमल्शन कहलाते हैं।
उदाहरण - दूध, वेनिशिंग क्रीम आदि।
(ब)
प्रश्न 13.
विलयन प्रावस्था से अधिशोषण को समझाइए । इसके लिए आवश्यक फ्रायन्डलिक समीकरण लिखिए।
उत्तर:
जब कोई ठोस विलयन के सम्पर्क में आता है तो वह विलयन में उपस्थित पदार्थ का अधिशोषण कर लेता है। इसे विलयन प्रावस्था में अधिशोषण कहते हैं।
उदाहरण: ऐसीटिक अम्ल के जलीय विलयन को चारकोल के साथ हिलाने पर अम्ल की कुछ मात्रा चारकोल द्वारा अधिशोषित हो जाती है।
विलयन प्रावस्था में अधिशोषण के लिए फ्रॉयन्डलिक समीकरण: विलयनों से अधिशोषण के लिए फ्रॉयन्डलिक समीकरण में शब के स्थान पर विलयन की सान्द्रता ली जाती है।
स्थिर ताप पर अधिशोषण की मात्रा निम्न समीकरण द्वारा दी जाती है।
\(\frac{x}{m}=k \mathrm{C}^{1 / n}\)
यहाँ x = विलेय की अधिशोषित मात्रा, m = अधिशोषक की मात्रा, - अधिशोषण पूर्ण होने पर सान्द्रता है, जिसे साम्य सान्द्रता कहते हैं । n तथा k = स्थिरांक हैं।
प्रश्न 14.
(अ) टिण्डल प्रभाव को चित्र की सहायता से समझाइए।
(ब) वैद्युत कण संचलन को नामांकित चित्र सहित समझाइए।
उत्तर:
(अ) टिण्डल प्रभाव-यदि वास्तविक विलयन से भरे बीकर से प्रकाश पुंज गुजारें तो प्रकाश पुंज का पथ दिखाई नहीं देता है, परन्तु प्रकाश पुंज को कोलॉइडी विलयन युक्त बीकर में से गुजारें तो प्रकाश पुंज पथ दिखाई देता है। इस परिघटना का सर्वप्रथम टिण्डल ने अध्ययन किया। इस कारण इसे टिण्डल प्रभाव कहते हैं। अतः वह परिघटना जिसमें प्रकाश पुंज का कोलॅइडी कणों द्वारा प्रकीर्णन होता है तथा पुन्ज का पथ दिखाई देता है, उसे टिण्डल प्रभाव कहते हैं।
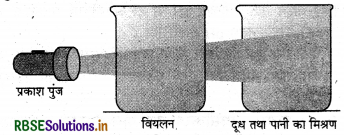
कोलॉइडी कण आपतित प्रकाश का अवशोषण करते हैं, उसके बाद इसके कुछ भाग का इन कणों द्वारा प्रकीर्णन होता है। प्रकीर्णित प्रकाश की तीव्रता आपतित प्रकाश के तल के समकोण पर होती है अतः पथ दिखाई देता है तथा टिण्डल कोन का निर्माण होता है। वास्तविक विलयन के कणों का आकार बहुत छोटा होता है, इस कारण ये प्रकाश पुंज का प्रकीर्णन नहीं करते हैं। अत: वास्तविक विलयन टिण्डल प्रभाव प्रदर्शित नहीं करते हैं।
(ब) वैद्युतकण संचलन विधि का नामांकित चित्र
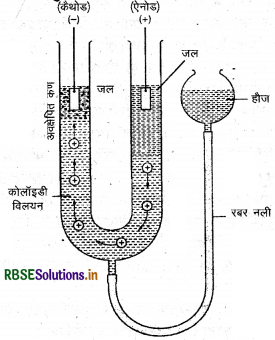
प्रश्न 15.
एन्जाइम उत्प्रेरक और अन्य (साधारण) उत्प्रेरकों में क्या अन्तर है? प्रत्येक को एक उदाहरण देकर समझाइए।
उत्तर:
एन्जाइम उत्प्रेरक एवं अन्य (साधारण) उत्प्रेरकों में अन्तर (Differences between Enzyme Catalyst and Simple Catalyst)
|
एन्जाइम उत्प्रेरक |
अन्य उत्प्रेरक |
|
1. ये उच्च अणु भार वाले नाइट्रोजन युक्त जाटि कार्बनिक यौगिक होते हैं। |
1. ये तत्व या अकार्बनिक यौगिक होते हैं। इनका अणु भार कम होता है। |
|
2. ये जल में कोलॉइडी विलयन बनाते हैं और विद्युत्-अपघट्य की उपस्थिति में इनकी क्रिया- शीलता नष्ट हो जाती है। |
2. ये ऐसा नहीं करते। |
|
3. इनकी क्रियाशीलता पराबैंगनी किरणों से नष्ट हो जाती है। |
3. इनकी क्रियाशीलता पर पराबैंगनी किरणों का कोई प्रभाव नही पड़ता । |
|
4. ये प्राय: जीवित वनस्पति या जन्तु कोशिकाओं में पाए जाते हैं। |
4. ये प्रायः निर्जीव पदार्थों में पाए जाते हैं। |
|
5. ये उत्क्रमणीय क्रिया को किसी भी दिशा में उत्प्रेरित कर सकते हैं। |
5. ये दोनों ओर समान रूप से उत्प्रेरित करते हैं। |
|
6. एन्जाइम उत्प्रेरक अभिक्रिया के लिए एक ताप का परिसर होता है जिस पर इनकी क्रियाशीलता अधिकतम होती है। सामान्यतः यह 25° - 35° C के मध्य होता है। 70° C पर ये निष्क्रिय हो जाते हैं। |
6. इनकी क्रियाशीलता 70 C के ऊपर ही प्रभावशाली होती है; जैसे- Al2O3 के लिए अनुकूलतम ताप 250 C है। |
प्रश्न 16.
एन्जाइम उत्प्रेरक क्या होते हैं? किन्हीं दो के नाम लिखिए।
उत्तर:
एन्जाइम (Enzyme): ये नाइट्रोजन युक्त जटिल कार्बनिक यौगिक हैं जो कि जीव-जन्तुओं की जीवित कोशिकाओं में पाये जाते हैं। ये जीव-जन्तुओं में होने वाली रासायनिक अभिक्रियाओं के लिए उत्प्रेरक का कार्य करते हैं अतः इन्हें जीव-रासायनिक उत्प्रेरक (Bio-chemical catalyst) भी कहा जाता है।
उदाहरण: इन्वर्टेस, जाइमेस, माल्टेस आदि।
प्रश्न 17.
धनात्मक एवं ऋणात्मक अधिशोषण क्या होता है? समझाइए।
उत्तर:
- धनात्मक अधिशोषण (Positive Adsorption): जब अधिशोषक के पृष्ठ पर अधिशोष्य की सान्द्रता इसके स्थूल में सान्द्रता से अधिक होती है, तब यह धनात्मक अधिशोषण कहलाता है। उदाहरण: H2 गैस का Ni की सतह पर अधिशोषण।
- ऋणात्मक अधिशोषण (Negative Adsorption): जब अधिशोषक के पृष्ठ पर अधिशोष्य की सान्द्रता इसके स्थूल में सान्द्रता से कम होती है, तब यह ऋणात्मक अधिशोषण कहलाता है। उदाहरण: विलयन के पृष्ठ पर विलयन की सान्द्रता इसके स्थूल में सान्द्रता से कम होती है।
प्रश्न 18.
हार्डी व शुल्जे का नियम लिखिए।
उत्तर:
हार्डी शुल्जे नियम- अधिक मात्रा में विद्युत्-अपघट्य मिलाकर किसी कोलॉइड विलयन की स्कन्दन (अवक्षेपण) क्रिया के लिए हार्डी शुल्जे (Hardy Schulze) ने निम्नलिखित दो नियम दिए, जिन्हें हार्डी शुल्जे नियम कहते हैं।
- कोलॉइडी विलयन के स्कन्दन के लिए मिलाए गए विद्युत्-अपघट्य के वे आयन सक्रिय होते है, जिनका आवेश कोलॉइडी कणों के आवेश के विपरीत होता है।
- सॉल को स्कन्दित करने वाले आयन की शक्ति आयन की संयोजकता पर निर्भर करती है। अधिक संयोजकता वाले आयनों की स्कन्दन क्षमता अधिक होती है अर्थात् हाडी शुल्जे नियम के अनुसार
" आयनों की स्कन्दन शक्ति आयन की संयोजकता बढ़ने के साथ बढ़ती है।" यदि As2S 3 सॉल में NaCl, BaCl तथा AlCl3 विद्युत अपघट्य अलग-अलग मिलाएँ, तो इसमें Na+, Ba2+ तथा AI3+ आयन, ऋणावेशित As2S3 सॉल को अवक्षेपित कर देते हैं। हार्डी शुल्जे नियम के अनुसार अधिक संयोजकता वाला आयन अधिक स्कन्दन करता है। अत: AI3+, Ba2+ तथा Na
= आयनों की स्कन्दन क्षमता का क्रम निम्नलिखित होगा
Al3+ > Ba2+ > Na+
अतः इन आयनों से As2S3 के समान मात्रा में अवक्षेपण में NaCl, BaCl तथा AlCl3 की मात्रा का निम्नलिखित क्रम होगा
NaCl > BaCl2 > AlCl3
अर्थात् इतनी ही मात्रा में As2S3 अवक्षेपण के लिए NaCl की मात्रा से अधिक और BaCl, की मात्रा AlCl3 से अधिक लेनी होगी । इसी प्रकार धनावेशित सॉल के प्रति ऋणायनों की स्कन्दन शक्ति निम्न क्रम में घटती है
[Fe(CN)6]4 > PO43- > SO42- > Cl-

प्रश्न 19.
निम्नलिखित प्रश्नों के उत्तर दीजिए।
(अ) द्रव स्नेही एवं द्रव विरोधी कोलॉइड में कोई दो अन्तर लिखिए ।
(ब) वैद्युतकणसंचलन को परिभाषित कीजिए।
(स) क्या होता है जब प्रकाश पुंज को लाइड़ी विलयन में से गुजरता है।
उत्तर:
|
द्रव स्नेही कोलॉइड |
द्रव विरोधी कोलॉइड |
|
(i) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्य के बीच आर्कषण बल पाया जाता है। |
(i) इसमें दोनों के बीच निम्न आर्कषण बल पाया जाता है। |
|
(ii) इन्हे आसानी से बनाया जा सकता है। |
(ii) इन्हे आसानी से नहीं बनाया जा सकता है। इन्हें विशेष विधियों द्वारा बनाया जा सकता है। |
(ब) वैद्युत कण संचलन (Electrophoresis) : कोलॉइडी कण विद्युत आवेशित होते हैं। विद्युत क्षेत्र में वे कण विपरीत आवेश वाले इलेक्ट्रोड की ओर गमन करते हैं। विद्युत क्षेत्र के प्रभाव में कोलॉइडी कणों का एक अथवा दूसरे इलेक्ट्रोड की ओर आभिगमन वैद्युत कण संचलन (Electrophoresis) कहलाता हैं।
(स) जब प्रकाश किरण पुंज कोलॉइडी विलयन से गमन करता है तब कोलॉइडी कण प्रकाश का प्रकीर्णन कर देते है, जिससे उसका मार्ग प्रदीप्त हो जाता है। कोलॉइडी विलयनों द्वारा प्रकाश का प्रकीर्णन टिण्डल प्रभाव (Tyndall Effect) कहलाता है।
प्रश्न 20.
एन्जाइम उत्प्रेरण की विषेषताएँ लिखिए।
उत्तर:
विशेषताएँ:
- एन्जाइम अति विशिष्ट होते हैं।
- ये साम्यावस्था को परिवर्तित नहीं करते हैं।
- क्योंकि ये कोलॉइडी प्रकृति के होते हैं अतः इनकी क्रियाशीलता अधिक होती है।
- एन्जाइम एक निश्चित pH पर ही अधिकतम सक्रियता प्रदर्शित करते हैं। इसे अनुकूलतम pH कहते हैं।
- एन्जाइम एक विशिष्ट ताप पर अधिकतम सक्रियता प्रदर्शित करते हैं। यह ताप अनुकूलतम ताप कहलाता है। यह ताप 25° - 35° के मध्य होता है।
प्रश्न 21.
पायस, पायसीकरण तथा पायसीकारक को समझाइए। पायसों का निर्माण कैसे होता है?
उत्तर:
पायस: द्रव के द्रव में परिक्षेपण को पायस कहते हैं। इसे निम्न प्रकार परिभाषित किया जा सकता है जब परिक्षेपण माध्यम एवं परिक्षिप्त प्रावस्था दोनों ही द्रव हों तो इन दोनों प्रावस्थाओं से बने कोलॉइडी विलयन को पायस कहा जाता है।
पायसों का निर्माण: दो द्रवों को प्रबल रूप से मिश्रित करके पायस बनाये जा सकते हैं। दो द्रवों को मिश्रित करने के लिये उच्च गति की मिश्रण मशीन (high speed mixing machine) या अल्ट्रासोनिक वाइब्रेटर (Ultrasonic vibrator) का प्रयोग किया जाता है। इस प्रक्रम को पायसीकरण (emulsification) कहते हैं। चूंकि पायसों को बनाने में प्रयुक्त दोनों द्रव एक-दूसरे में अमिश्रणीय होते हैं अतः पायस को बनाने में एक स्थायीकारक की आवश्यकता होती है, जिसे पायसीकारक (emulsifier) कहा जाता है। पायसीकारक को घटक द्रवों के साथ मिलाया जाता है। o/w प्रकार के पायस के लिए प्रमुख पायसीकारक प्रोटीन, गोंद, प्राकृतिक एवं संश्लेषित साबुन आदि हैं जबकि w/o प्रकार के पायस के लएि वसीय अम्लों के भारी धातुओं के लवण, लंबी श्रृंखला वाले ऐल्कोहॉल, काजल (lamp black) आदि प्रमुख पायसीकारक हैं।
प्रश्न 22.
परिक्षिप्त प्रावस्था तथा परिक्षेपण माध्यम को परिभाषित कीजिए।
उत्तर:
वह पदार्थ जो कोलॉइडी कणों के रूप में परिक्षेपण माध्यम में वितरित रहता है, परिक्षिप्त प्रावस्था का निर्माण करता है जबकि वह माध्यम जिसमें पदार्थ कोलॉइडी कणों के रूप में वितरित रहता है, परिक्षेपण माध्यम कहलाता है। अतः कोलॉइडी विलयन = परिक्षिप्त प्रावस्था + परिक्षेपण माध्यम
प्रश्न 23.
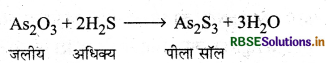
आर्सेनियस सल्फाइड का शुद्ध कोलॉइडी विलयन किस प्रकार प्राप्त किया जाता है? समीकरण भी दीजिए।
उत्तर:
आर्सेनियस सल्फाइड का सॉल उभय-अपघटन विधि से तैयार किया जाता है। आर्सेनियस ऑक्साइड (AS2O3) के ठण्डे जलीय विलयन में धीरे-धीरे H2S गैस आधिक्य में प्रवाहित करने से आर्सेनियस सल्फाइड (As2S3) का पीला सॉल प्राप्त होता है।
प्रश्न 24.
द्रव-विरोधी सॉल बनाने की संघनन विधि का वर्णन कीजिए।
उत्तर:
संघनन विधि में पदार्थ के लघु अणुओं या आयनों को विभिन्न भौतिक और रासायनिक विधियों द्वारा परस्पर संयुक्त कराकर कोलॉइडी साइज के कण बनाये जाते हैं। एक प्रमुख संघनन विधि ऑक्सीकरण विधि है।
उदाहरणार्थ: हाइड्रोजन सल्फाइड गैस (H2S) के जलीय विलयन का सल्फर डाइऑक्साइड द्वारा ऑक्सीकरण करके सल्फर का कोलॉइडी विलयन (सल्फर सॉल) बनाया जा सकता है।
2H2S + SO2 → 3 + 2H2O
प्रश्न 25.
आर्सेनियस सल्फाइडे सॉल में फेरिक हाइड्रॉक्साइड का सॉल मिलाने पर दोनों का अवक्षेपण हो जाता है। समझाइए क्यों?
उत्तर:
दो विपरीत आवेशित द्रव-विरोधी सॉलों को परस्पर उचित अनुपात में मिलाने पर दोनों सॉल एक-दूसरे को अवक्षेपित कर देते हैं। इसे सॉलों का पारस्परिक स्कन्दन कहते हैं। इसीलिए ऋणावेशित आर्सेनियस सल्फाइड सॉल और धनावेशित फेरिक हाइड्रॉक्साइड सॉल को मिलाने पर आर्सेनियस सल्फाइड तथा फेरिक हाइड्रॉक्साइड दोनों कोलॉइड एक साथ अवक्षेपित या स्कन्दित हो जाते हैं।

प्रश्न 26.
वास्तविक विलयन तथा कोलॉइडी विलयन में विभेद कीजिए।
उत्तर:
वास्तविक विलयन-यह एक समांग तन्त्र है जिसमें विलेय तथा विलायक के कणों का आकार बराबर होता है। इन कणों का व्यास 10.7 सेमी से भी कम होता है। इन्हें अति सूक्ष्मदर्शी (Ultra microscope) द्वारा भी नहीं देखा जा सकता। - कोलॉइडी विलयन-यह एक विषमांग तन्त्र है, कोलॉइडी विलयन में भिन्न-भिन्न व्यासों के कण उपस्थित होते हैं। इस विलयन में विलेय के कणों का व्यास 10.4 से 10.7 सेमी होता है और विलायक के कणों का व्यास 10.7 से 10.8 सेमी होता है, जिन्हें अति सूक्ष्मदशी द्वारा देखा जा सकता है।
प्रश्न 27.
धुएँ से कार्बन के कणों को किस प्रकार पृथक करते हैं?
उत्तर:
धुएँ को कार्बन के कोलॉइडी कणों से मुक्त करने के लिए कॉट्रेल धुआँ अवक्षेपक प्रयुक्त किया जाता है। इस अवक्षेपक में एक स्तम्भ में धातु का एक गोला लटका रहता है जिसे उच्च वोल्टता पर धनावेशित किया जाता है। धुएँ को अवक्षेपक में से प्रवाहित करने पर उसमें उपस्थित कार्बन के ऋणावेशित कोलॉइडी कण धनावेशित गोले के सम्पर्क में आकर निरावेशित हो जाते हैं और विद्युत उदासीन कण एक-दूसरे से मिलकर अवक्षेप के रूप में नीचे बैठ जाते हैं तथा । कार्बन-कणों से मुक्त वायु बाहर निकल जाती है।
निबन्धात्मक प्रश्न:
प्रश्न 1.
अधिशोषण कितने प्रकार का होता है? भौतिक तथा रासायनिक अधिशोषण में प्रमुख अन्तर लिखिए।
उत्तर:
अधिशोष्य तथा अधिशोषक के मध्य आकर्षण बलों के आधार पर अधिशोषण दो प्रकार का होता है
- भौतिक अधिशोषण या वाण्डरवाल्स अधिशोषण (Physical Adsorption or van der Waal's Adsorption)
- रासायनिक अधिशोषण या रसोवशोषण या लैंगम्यूर अधिशोषण (Chemical Adsorption or Chemisorption or Langmuir Adsorption)
1. भौतिक अधिशोषण या वाण्डरवाल्स अधिशोषण (Physical Adsorption or vander Waal's Adsorption):
जब अधिशोषक की सतह पर अधिशोष्य भौतिक बलों (वाण्डर वाल्स बलों) द्वारा बंधित होते हैं तो यह भौतिक अधिशोषण (Physical Adsorption) या वाण्डर वाल्स अधिशोषण (vander Waal's Adsorption) कहलाता है। वाण्डरवाल्स बन्ध काफी दुर्बल होते हैं अतः ताप वृद्धि के साथ या फिर दाब बढ़ाने पर ये बन्ध टूट जाते हैं तथा भौतिक अधिशोषण उत्क्रमित (reserved) हो जाता है। भौतिक अधिशोषण से उष्मा परिवर्तन बहुत कम होता है। इसका मान 20 - 40 kJ mol-1 के मध्य परिवर्तित होता है। इसकी प्रकृति विशिष्ट (specific) नहीं होती है अर्थात् भौतिक अधिशोषण अविशिष्ट प्रकृति (Non-specific nature) का होता है। भौतिक अधिशोषण सभी अवस्थाओं में तीव्रगति से होता है।
2. रासायनिक अधिशोषण या रसोवशोषण या लैंगम्यूर अधि(Chemical Adsorption or Chemisorption or Langmuir Adsorption)
जब अधिशोषक की सतह पर अधिशोष्य प्रबल रासायनिक बन्धों द्वारा बन्धित होते हैं तो यह रासायनिक अधिशोषण (Chemical Adsorption) या रसोवशोषण (Chemisorption) या लैंगम्यूर अधिशोषण (Langmuir Adsorption) कहलाता है। रासायनिक अधिशोषण में अधिशोष्य अधिशोषक की सतह पर अभिक्रिया करके एक प्रकार का यौगिक बनाता है, जिसे पृष्ठ यौगिक (Surface compound) कहते हैं। उदाहरणार्थ-टंगस्टन अथवा कार्बन की सतह पर ऑक्सीजन के अधिशोषण के पश्चात् टंगस्टन ऑक्साइड एवं कार्बन डाइ-ऑक्साइड अथवा कार्बन मोनो ऑक्साइड का निर्माण होता है। रासायनिक अधिशोषण में ऊष्मा परिवर्तन अधिक होता है। इसका मान 80 - 240 KJ mol-1 के मध्य परिवर्तित होता है। रासायनिक अधिशोषण एक अनुत्क्रमणीय तथा अति विशिष्ट प्रक्रम होता है।
भौतिक अधिशोषण के अभिलक्षण (Properties of Physical Adsorption):
(1) अविशिष्ट प्रकृति (विशिष्टता की कमी) (Non-specific Nature): इस प्रकार का अधिशोषण वाण्डरवाल्स बंध के कारण उत्पन्न होता है जो कि विशिष्ट प्रकृति का नहीं होता है अर्थात् किसी भी ठोस अवशोषक के पृष्ठ पर कोई भी गैस अधिशोषित हो सकती है, अत: भौतिक अधिशोषण अविशिष्ट प्रकृति (non - specific nature) का होता है।
(2) अधिशोष्य की प्रकृति (Nature of adsorbate)-चूँकि भौतिक अधिशोषण विशिष्ट प्रकृति का नहीं होता है अतः कोई भी गैस अधिशोषक की सतह पर अधिशोषित हो सकती है। जो गैस आसानी से द्रवित (उच्च क्रतिक तापों वाली) हो जाती है वह ठोस अधिशोषक की सतह पर भौतिक अधिशोषण आसानी से कर लेती है।
उदाहरणार्थ:
- H2, O2, N2 की अपेक्षा NH3, HCI, CO2 आदि आसानी से अधिशोषित होती हैं।
- 1 ग्राम सक्रियत चारकोल, मेथेन (क्रान्तिक ताप 190K) की अपेक्षा अधिक SO (क्रान्तिक ताप 630 K) को अधिशोषित करता है। अधिशोष्य की प्रकृति का निर्धारण क्रान्तिक ताप (Critical temperature) के आधार पर करते हैं।
"वह न्यूनतम ताप जिसके ऊपर किसी गैस को द्रवित नहीं किया जा सकता है, चाहे दाब कितना ही अधिक क्यों न हो, क्रान्तिक ताप (Critical temperature) कहलाता है।"
(3) उत्क्रमणीय प्रकृति (Reversible Nature): भौतिक अधिशोषण की प्रकृति उत्क्रमणीय होती है गैस का ठोस पर अधिशोषण उत्क्रमणीय होता है।
imm
दाब बढ़ाने पर अधिक गैस अधिशोषित होती है क्योंकि इससे गैस का आयतन कम होता है, और दाब घटाकर गैस को निकाला जा सकता है। अधिशोषण प्रक्रम उष्माक्षेपी होने के कारण भौतिक अधिशोषण निम्न ताप पर आसानी से होता है और ताप बढ़ाने पर घटता है।
(4) अधिशोषक की प्रकृति (Nature of Adsorbent ): अधिशोषण का परिणाम अधिशोषक के पृष्ठीय क्षेत्रफल के बढ़ने के साथ बढ़ता है। अतः महीन चूर्णित धातुएँ एवं सरंध्र पदार्थ जिनका पृष्ठीय क्षेत्रफल अधिक होता है, अच्छे अधिशोषक होते हैं कुछ अच्छे अधिशोषक, जैसे- जान्तव चारकोल, सिलिका जेल, ऐल्युमिना आदि में पृष्ठ क्षेत्रफल अधिक सरन्ध्र होता है, जिसके कारण इन पर अधिशोषण बहुत ही आसानी से होता है।
(5) अधिशोषण की एन्थैल्पी (Enthalpy of adsorption ): भौतिक अधिशोषण कमजोर वाण्डर वॉल्स बलों के द्वारा उत्पन्न होता है। इस कारण इस प्रकार के अधिशोषण की एन्थैल्पी कम होती है। इसका मान लगभग 20 - 40 kJ mol के लगभग होता है।
(6) अधिशोषक का सक्रियण (Activation of the adsorbent ): अधिशोषक का सक्रियण किसी अधिशोषक की अधिशोषण क्षमता में वृद्धि को दर्शाता है, जिसके लिये उसकी सतह का पृष्ठ क्षेत्रफल बढ़ाया जाता है। इसके साथ-साथ प्रति इकाई क्षेत्रफल पर छिद्रों या मुक्त रिक्तियों की संख्या बढ़ायी जाती है। इन रिक्तियों को सक्रिय केन्द्र (Active centres) कहते हैं।
अधिशोषण की क्षमता को निम्न प्रकार बढ़ाया जा सकता है
- अधिशोषक की अधिशोषक क्षमता को रासायनिक क्रिया के द्वारा बढ़ाया जा सकता है।
- अधिशोषक को सूक्ष्म विभाजित करने पर इसकी अधिशोषण क्षमता बढ़ जाती है।
- अधिशोषकों को तेज गर्म भाप के साथ गर्म करने पर इसके बन्द सरन्ध्र खुल जाते हैं और इससे इसकी अधिशोषण क्षमता बढ़ जाती है।
रासायनिक अभिशोषण (रसोवशोषण) के अभिलक्षण (Charactheristics of Chemical Adsorption or Chemisorption)
रसोवशोषण के मुख्य अभिलक्षण निम्न प्रकार है:
- विशिष्ट प्रकृति (Specific nature): रासायनिक अधिशोषण विशिष्ट प्रकृति का होता है क्योंकि यहाँ अधिशोषक व अधिशोष्य के मध्य रासायनिक बन्ध बनता है। उदाहरण के लिये, धातु की सतह पर ऑक्सीजन अधिशोषित होकर ऑक्साइड बनाती है तथा हाइड्रोजन धातु की सतह पर अधिशोषित होकर हाइड्रॉइड का निर्माण करती है।
- अनुत्क्रमणीय प्रकृति (Irreversible nature): यह एक प्रकार का अनुत्क्रमणीय प्रकृति वाला अधिशोषण होता है। रसोवशोषण तब तक उत्क्रमणीय नहीं होता है जब तक कि अधिशोषक एवं अधिशोष्य के बीच बना बन्धन टूटे। इस रासायनिक बन्ध को तोड़ने के लिये एक निश्चित मात्रा की ऊर्जा की आवश्यकता होती है। अत: रसोवशोषण अनुत्क्रमणीय होता है।
- पृष्ठीय क्षेत्रफल (Surface area): अधिशोषक का पृष्ठीय क्षेत्रफल जितना अधिक होगा, रसोवशोषण उतना ही अधिक होता है।
- अधिशोषण की एन्थैल्पी (Enthalpy of adsorption): रासायनिक अधिशोषण की एन्थैल्पी बहुत ही उच्च होती है क्योंकि इसमें रासायनिक बन्ध उपस्थित होता है। इसका मान लगभग 80 - 240k mor होता है।
- आण्विक परत की प्रकृति (Nature of molecular layer): चूंकि अधिशोषक एवं अधिशोष्य के मध्य में रासायनिक बन्ध होता है अतः बन्ध निर्माण में अधिशोष्य की मात्र एक परत सम्मिलित होती है। अत: इनकी प्रकृति एकल परत की होती है।
प्रश्न 2.
फ्रॉयंडलिक अधिशोषण समतापी का वर्णन कीजिए।
उत्तर:
अधिशोषक द्वारा अधिशोषित गैस की मात्रा में स्थिर ताप पर दाब के साथ परिवर्तन एक वक्र के माध्यम से व्यक्त किया जा सकता है जिसे हम अधिशोषण समतापी (Adsorption Isotherm ) कहते हैं।
फ्रॉयंडलिक अधिशोषण समतापी (Freundlich Adsorption Isotherm ) फ्रॉयंडलिक ने 1909 में ठोस अधिशोषक के इकाई द्रव्यमान द्वारा एक निश्चित ताप पर अधिशोषित गैस की मात्रा एवं दाब के मध्य एक सम्बन्ध स्थापित किया। इसके अनुसार दाब बढ़ाने पर अधिशोषण की मात्रा बढ़ जाती है। जब अर्थात् अधिशोषण की मात्रा अधिकतम होती है तब वह दाब साम्यावस्थिक दाब कहलाता है। साम्यावस्थिक दाब पर अधिशोषण अधिकतम होता है तथा और अधिक दाब बढ़ाने पर भी अधिशोषण की मात्रा नहीं बढ़ती है। यहाँ अधिशोषण का मान नियत हो जाता है।
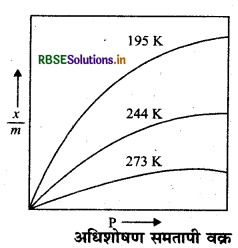
कम दाब पर (At low pressure) कम दाब पर वक्र लगभग एक सीधी रेखा होती है अर्थात्
\(\begin{aligned} &\frac{x}{m} \propto p^1 \\ &\frac{x}{m}=k p^1 \end{aligned}\)
अधिक दाब पर (At high pressure) उच्च दाब पर x/m का मान लगभग स्थिर हो जाता है। अर्थात्
\(\frac{x}{m} \propto p^0\)
था
\(\frac{x}{m}=k p^0\)
मध्यम दाब पर (At intermediate pressure) मध्यम दाब पर x/ms का मान दाब की घात पर निर्भर करता है।
\(\frac{x}{m} \propto p^{1 / n}\)
यहाँ x > 1
\(\frac{x}{m}=k p^{1 / n}\)
उपर्युक्त समीकरण का log लेने पर,
\(\log \frac{x}{m}=\log k+\frac{1}{n} \log p\)
उपर्युक्त समीकरण फ्रॉयन्डलिक समतापी वन समीकरण कहलाता फ्रॉयन्डलिक समतापी वक़ की वैधता, आलेख में log: कोy. अक्ष (कोटि) एवं logp को x-अक्ष (भुज) पर लेकर प्रमाणित की जा सकती है। यदि यह एक सीधी रेखा आती है तो फ्रॉयन्डलिक समतापी वक्र प्रमाणित है अन्यथा नहीं।
सीधी रेखा का ढाल - का मान देता है। -अक्ष पर अन्त:खण्ड - logk का मान देता है।
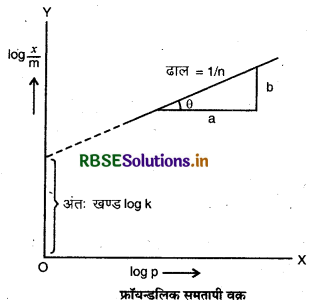
फ्रॉयडलिक समतापी वक्र यह भी जानेंप्रायोगिक समतापी सदैव उच्च दाब पर संतृप्तता की ओर अभिगमन करते प्रतीत होते हैं। इसे फ्रॉयन्डलिक समतापी वक्र से नहीं समझाया जा सकता, अत: यह उच्च दाब पर असफल हो जाता है।

प्रश्न 3.
अधिशोषण के प्रमुख अनुप्रयोग बताइए।
उत्तर:
- उच्च निर्वात् उत्पन्न करने में (In Production of High Vacuum): अत्यधिक उच्च निर्वात् उत्पन्न करने के लिए निर्वात् पम्प द्वारा निर्वातित पात्र से लेशमात्र वायु, चारकोल पर अधिशोषित करके निकाली जा सकती है।
- गैस मास्क में (In Gas Mask): वह मास्क, जिसमें सक्रियित चारकोल या अधिशोषकों का मिश्रण होता है गैस मास्क कहलाता है। इसका उपयोग कोयले की खानों में साँस लेते समय, विषैली गैसों, जैसे CO CH4 आदि को अधिशोषित करने के लिए किया जाता है। अतः ये मास्क साँस लेने के लिए वायु को शुद्ध करने में सहायक होते हैं।
- आर्द्रता पर नियन्त्रण में (In the Control on Humidity): सिलिका जेल एवं ऐलुमिनियम जेल का उपयोग नमी को दूर करने में एवं आर्द्रता को नियन्त्रित करने के लिए किया जाता है।
- विलयनों से रंगीन पदार्थों को हटाने में (In the removal of Colouring Materials from Solutions): जान्तव चारकोल विलयनों की रंगीन अशुद्धियों को अधिशोषित करके रंगों को हटा देता है।
- विषमांगी उत्प्रेरण (Heterogeneous Catalysis): उत्प्रेरक की ठोस सतह पर अभिकारकों का अधिशोषण अभिक्रिया की दर बढ़ा देता है। औद्योगिक महत्व की ऐसी कई गैसीय अभिक्रियाएँ हैं, जिनमें ठोस उत्प्रेरकों का होना आवश्यक है। अमोनिया के उत्पादन में लोहे का उत्प्रेरक की तरह उपयोग, H2O4 का सम्पर्क प्रक्रम से उत्पादन, तेलों के हाइड्रोजनीकरण में सूक्ष्म विभाजित Ni का उपयोग, विषमांगी उत्प्रेरण के उदाहरण हैं।
- अक्रिय गैसों का पृथक्करण (Separation of Inert Gases): गैसों के चारकोल द्वारा अधिशोषण की मात्रा में भिन्नता होने के कारण मिश्रण में से अक्रिय गैसों को नारियल चारकोल पर, विभिन्न तापों पर, अधिशोषित करके पृथक् किया जा सकता है।
- झाग प्लवन प्रक्रम में (In Froth Floatation Process): चीड़ के तेल तथा झाग कारक का उपयोग करके एक निम्न श्रेणी के सल्फाइड अयस्क को सिलिका जेल एवं अन्य मृदा पदार्थों से पृथक् कर . सान्द्रित किया जा सकता है। क्योंकि ये अशुद्धियाँ चीड़ के तेल तथा झाग कारक में संग्रहीत हो जाती हैं।
- व्याधियों के उपचार में (In Treatment of Diseases): अनेक औषधियाँ कीटाणुओं को अधिशोषण द्वारा मारने में प्रयुक्त होती हैं।
- वर्णलेखिकीय विश्लेषण में (In Chromatographic Anslysis): अधिशोषण की परिघटना पर आधारित वर्णलेखिकीय विश्लेषण के विश्लेषिक एवं औद्योगिक क्षेत्रों में अनेक उपयोग हैं।
- अधिशोषण सूचक में (In Adsorption Indicators): कुछ अवक्षेपों की सतहें, जैसे-सिल्वर हैलाइड, इओसिन, फ्लुओरोसीन आदि जैसे कुछ रंजकों को अवशोषित कर सकती हैं तथा इस प्रकार आयतनात्मक विश्लेषण के अन्तिम बिन्दु पर अभिलाक्षणिक रंग प्रदान करती है।
- कपड़े को रंगने में (In Dyeing Cloth): रंग बन्धक (Mordant) जैसे-फिटकरी को कपड़ा रंगने में प्रयोग करते हैं। ये रंजक के कणों को अधिशोषित कर लेते हैं, अन्यथा रंजक के कण कपड़े पर नहीं चिपकते हैं।
- शुष्क स्नेहक के रूप में (As a Dry Lubricant): ग्रेफाइट, टैल्क आदि का उपयोग शुष्क स्नेहक के रूप में किया जाता है।
- गुणात्मक विश्लेषण में (In Qualitative Analysis): धनायनों के (भास्मिक मूलकों के) गुणात्मक विश्लेषण में अधिशोषण सिद्धान्त का उपयोग होता है। ऐलुमिनियम All3 धनायन के निश्चयात्मक परीक्षण के लिए लेक परीक्षण (Lake test) काम में लेते हैं।
प्रश्न 4.
समांगी उत्प्रेरण की क्रियाविधि का माध्यमिक यौगिक सिद्धान्त दीजिए।
उत्तर:
1. समांगी उप्रेरण (Homogeneous Catalysis): जब अभिकारक, उत्पाद तथा उत्प्रेरक की भौतिक अवस्था समान प्रकार की होती है तब उत्प्रेरण समांगी उत्प्रेरण (Homogeneous catalysis) कहलाता है।
उदाहरण: (i) सीस कक्ष विधि (Lead chamber method) में SO2 का ऑक्सीकरण समांगी उत्प्रेरण का उदाहरण है, क्योंकि अभिकारक (SO2 तथा O2) तथा उत्प्रेरक (NO) की भौतिक अवस्था समान (गैस) होती है।
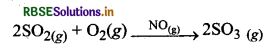
(ii) हाइड्रोक्लोरिक अम्ल द्वारा प्रदत्त H+ आयनों से मेथिल ऐसौटेट का जल-अपघटन उत्प्रेरित होता है। यह भी एक समांगी उत्प्रेरण का उदाहरण है।
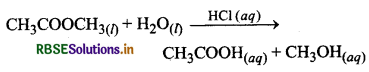
यहाँ सभी अभिक्रियकों की प्रावस्था समान है।
(ii) शर्करा का जल-अपघटन, सल्फ्यू रिक अम्ल द्वारा प्रदत्त H+ आयनों से उत्प्रेरित होता है।
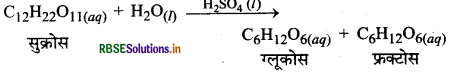
यहाँ सभी अभिकारक समान प्रावस्था में हैं, अत: यह एक समांगी उत्प्रेरण का उदाहरण है।
(2) विषमांगी उत्प्रेरण (Heterogeneous Catalysis): जब उत्प्रेरकों एवं अभिकारकों की प्रावस्था भिन्न-भिन्न होती है तो इसे विषमांगी उत्प्रेरण (Heterogeneous catalysis) कहते हैं।
उदाहरण:
(i) SO2 का ऑक्सीकरण (Oxidation of SO2): Pt की उपस्थिति में SO2 का SO2 में ऑक्सीकरण एक विषमांगी उत्प्रेरण का उदाहरण है।
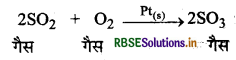
यहाँ सभी अभिकारक गैसीय प्रावस्था में हैं एवं उत्प्ररेक ठोस में है।
(ii) हेबर प्रक्रम (Haber's Process): इस प्रक्रम में सूक्ष्म विभाजित लोहे की उपस्थिति में अमोनिया, नाइट्रोजन तथा हाइड्रोजन गैस के द्वारा बनती है।
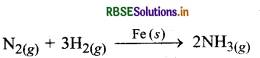
यहाँ सभी अभिकारक गैसीय प्रावस्था में हैं एवं उत्प्रेरक ठोस प्रावस्था में है।
(iii) ऑस्टवाल्ड प्रक्रम (Ostwald's Process): इस विधि में अमोनिया का नाइट्रिक ऑक्साइड में ऑक्सीकरण प्लैटिनम गेज की उपस्थिति में होता है।
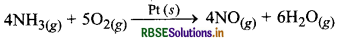
यहाँ उत्प्रेरक ठोस प्रावस्था एवं अभिकारक गैसीय प्रावस्था में उपस्थित हैं।
(iv) वनस्पति तेलों का हाइड्रोजनीकरण (Hydrogenation of Vanaspati Oil): सूक्ष्म विभाजित निकिल उत्प्रेरक की उपस्थिति में वनस्पति तेलों का हाइड्रोजनीकरण होता है तथा वनस्पति घी का निर्माण होता है।
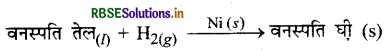
यहाँ एक अभिकारक द्रव तथा एक गैसीय प्रावस्था में है एवं उत्प्रेरक ठोस प्रावस्था में है।
प्रश्न 5.
पायस कितने प्रकार के होते हैं? प्रत्येक का उल्लेख कीजिए।
उत्तर:
जब किसी कोलॉइडी विलयन में परिक्षिप्त प्रावस्था तथा परिक्षेपण माध्यम दोनों ही द्रव अवस्था में हों तो इस प्रकार के सॉल को इमल्शन कहते हैं। यहाँ पर सूक्ष्म विभाजित द्रव की बूँदों का दूसरे द्रव में परिक्षेपण होता है।
जब दो अमिश्रणीय या आंशिक मिश्रणीय द्रवों के मिश्रण को हिलाया जाता है तो एक द्रव में दूसरे द्रव का अपरिष्कृत परिक्षेपण प्राप्त होता है। इसे इमल्शनं या पायस कहते हैं। इनमें एक जल अवश्य होता है। यह निम्न प्रकार का होता है।
- तेल का जल में परिक्षेपण (OW प्रकार)
- जल का तेल में परिक्षेपण ( WO प्रकार)
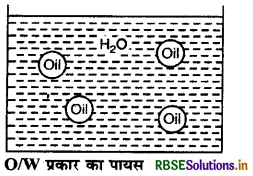
(i) तेल का जल में परिक्षेपण (Oil in Water dispersion): इस प्रकार के इमल्शन में तेल की छोटी-छोटी बूँदें (परिक्षिप्त प्रावस्था) जल (परिक्षेपण माध्यम ) में वितरित रहती हैं। इसे OW से प्रदर्शित करते हैं। उदाहरण-दूध, वैनिशिंग क्रीम आदि।
(ii) जल का तेल में परिक्षेपण (Water in Oil dispersion): इस प्रकार के इमल्शन में जल की छोटी-छोटी बूँदें (परिक्षिप्त प्रावस्था) तेल (परिक्षेपण माध्यम) में वितरित रहती हैं। इसे WO से प्रदर्शित करते हैं। उदाहरण-कोल्ड क्रीम, मक्खन, कॉड लीवर ऑयल आदि।
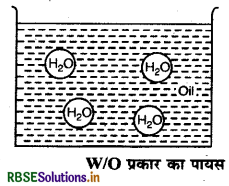
प्रश्न 6.
एन्जाइम उत्प्रेरण क्या है? इनके सामान्य लक्षणों का उल्लेख कीजिए।
उत्तर:
एन्जाइम जटिल नाइट्रोजनी कार्बनिक यौगिक हैं। ये जीवित पौधों एवं जन्तुओं द्वारा उत्पन्न किये जाते हैं। ये उच्च अणु द्रव्यमान वाले प्रोटीन अणु होते हैं। ये जल में कोलॉइडी विलयन बनाते हैं तथा बहुत ही प्रभावी उत्प्रेरक होते हैं।
एन्जाइम विशेष रूप से प्राकृतिक प्रक्रमों से सम्बन्धित अभिक्रियाओं को उत्प्रेरित करते हैं। इन्हें जैव रासायनिक उत्प्रेरक (Biochemical catalyst) भी कहा जाता है तथा उत्प्रेरण की परिघटना, जैव रासायनिक उत्प्रेरण (Biochemical catalysis) कहलाती है। प्रयोगशाला में पहला संश्लेषित एन्जाइम 1969 में निर्मित किया गया था।
एण्जाइम उत्रेटण के उदाहंटण (Examples of Enzyme Catalysis):
(1) यूरिया का अपघटन (Decomposition of Urea): यूरिएज एन्जाइम की उपस्थिति में यूरिया, अमोनिया एवं CO2 में अपघटित हो जाती है।
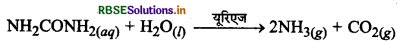
(2) दूध का दही में परिवर्तन (Conversion of Milk into Curd): यह एन्जाइम के द्वारा होने वाली अभिक्रिया है जो दही में उपस्थित लैक्टोबैसिलस जीवाणुओं द्वारा होती है।
(3) माल्टोस का ग्लूकोस में परिवर्तन (Conversion of Maltose into Glucose): माल्टेज नामक एन्जाइम की उपस्थिति में माल्टोस ग्लूकोस में परिवर्तित हो जाता है।
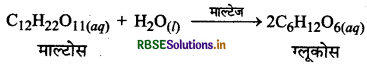
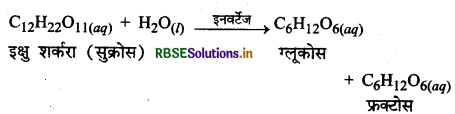
(4) इक्षु-शर्करा (सुक्रोस) का प्रतिलोमन (Inversion of Cane Sugar): इन्वर्टेज एन्जाइम इक्षु-शर्करा (सुक्रोस) को ग्लूकोस एवं फ्रक्टोस में परिवर्तित कर देता है।
(5) ग्लूकोस का एथिल ऐल्कोहॉल में परिवर्तन (Conversion of Glucose into Ethyl alcohol): जाइमेज नामक एन्जाइम की उपस्थिति में ग्लूकोस, एथिल ऐल्कोहॉल एवं CO2 में परिवर्तित हो जाता है।
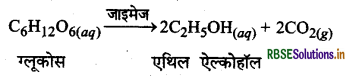
(6) प्रोटीन का पेप्टाइड में परिवर्तन (Conversion of Proteins into Peptides): आमाशय में पेप्सिन एन्जाइम प्रोटीनों को पेप्टाइडों में परिवर्तित कर देता है जबकि आँत में अग्न्याशय से स्रावित ट्रिप्सिन एन्जाइम प्रोटीनों को जल-अपघटन द्वारा ऐमीनो अम्ल में परिवर्तित करता है।
(7) स्टार्च का माल्टोस में परिवर्तन (Conversion of Starch into Maltose): डायस्टेज नामक एन्जाइम स्टार्च को माल्टोस में परिवर्तित कर देता है।

(8) एथिल ऐल्कोहॉल का एसीटिक अम्ल में परिवर्तन (Conversion of Ethyl Alcohol into Acetic Acid) माइकोडर्मा एसीती की उपस्थिति में एथिल ऐल्कोहॉल एसीटिक अम्ल में परिवर्तित हो जाता है।


प्रश्न 7.
कोलॉइडी विलयनों (सॉल) के शुद्धिकरण की अतिसूक्ष्म निस्यन्दन विधि को समझाइए।
उत्तर:
Particles): कोलॉइडी कणों पर हमेशा विद्युत आवेश रहता है। विलयन के सभी कोलॉइडी कणों पर आवेश की प्रकृति समान होती है। यह प्रकृति धनात्मक या ऋणात्मक हो सकती है। कुछ सामान्य सॉल पर आवेश निम्न प्रकार होते हैं।
|
धनात्मक आवेशित सॉल |
ऋणात्मक आवेशित सॉल |
|
1. जलयोजित धात्विक ऑक्साइड; जैसे Al2O3 H2O, CrO3, H2O तथा FeSO4 H2O |
1. धातुएँ; जैसे-कॉपर, सिल्वर, गोल्ड सॉल। |
|
2. क्षारकीय रंजक पदार्थ; जैसे मेथिलीन नील (Methylene Blue) सॉल। |
2 धात्विक सल्फाइड; जैसे As2S3, Sb2S3, Cds सॉल। |
|
3. हीमोग्लोबिन (रक्त)। |
3. अम्लीय रंजक पदार्थ; जैसे इओसिन, कांगों रेड सॉल। |
|
4. ऑक्साइड; जैसे - TiO2 सॉल। |
4. स्टार्च, गोंद, जिलेटिन, मृत्तिका (Clay), चारकोल इत्यादि के सॉल। |
सॉल कणों पर आवेश निम्न कारणों से होता है
- धातुओं के वैद्युत परिक्षेण धातुओं के वैद्युत परिक्षेपण के समय सॉल के कणों द्वारा इलेक्ट्रॉन प्रगहण (capture) विलयन से आयनों का अधिमान्य अधिशोषण एवं विद्युतीय दोहरी परत बनने के कारण सॉल कणों पर आवेश उत्पन्न होता है।
- आयनों का वरणात्मक अधिशोषण सॉल कण धनात्मक या ऋणात्मक आयनों के वरणात्मक (अधिमान्य) अधिशोषण द्वारा धनात्मक या ऋणात्मक आवेश ग्रहण कर लेते हैं। परिक्षेपण माध्यम में दो या अधिक आयन उपस्थित होने पर कोलॉइडी कणों द्वारा उस आयन का वरणात्मक (अधिमान्य) अधिशोषण होता है जो कोलॉइड में भी उपस्थित होता है। अर्थात समआयन (उभयनिष्ठ) है।
उदाहरण (i) जब सिल्वर नाइट्रेट के अत्यधिक तनु विलयन को पोटैशियम आयोडाइड के अत्यधिक तनु वियलन में मिलाया जाता है, तब अवक्षेपित सिल्वर आयोडाइड परिक्षेपण माध्यम में से आयोडाइड आयनों को अधिशोषित करके ऋण-आवेशित कोलॉइडी सॉल बनाता है। लेकिन जब KI विलयन को AgNO3 विलयन में मिलया जाता है तो परिक्षेपण माध्यम से Ag+ आयनों के अधिशोषण के कारण धन है। 
(ii) जब गर्म जल के आधिक्य में FeCl3 मिलाया जाये तो Fe3+ आयनो के अधिशोषण से धन आवेशित जलयोजित फैरिक ऑक्साइड का सॉल बनता है। लेकिन यदि फेरिक क्लोराइड को NaOH विलयन में मिलाया जाये तो OH आयनों के अधिशोषण के साथ एक ऋण-आवेशित सॉल प्राप्त होता है।
वरणात्मक (अधिमान्य) अधिशोषण द्वारा पृष्ठ पर धन या ऋण आवेश ग्रहण कर लेने के पश्चात् कोलॉइडी कणों की सतह माध्यम में से प्रतिआयनों को आकर्षित करती है जिससे आयनों की दूसरी परत बनती है।
जीटा विभव या वैद्युत गतिक विभव (Zeeta potential or electro kinetic potential): कोलॉइडी कणों के चारों ओर विपरीत आवेश की दो परतों का संयोजन हेल्महोल्स विद्युतीय दोहरी परत कलाता है। आधुनिक सिद्धान्त के अनुसार आयनों की प्रथम परत दृढ़तापूर्वक बँधी रहती है, जिसे स्थित परत या प्रथम परत कहते हैं, जबकि दूसरी परत गतिशील होती है जिसे विसरित परत कहते हैं। आवेशों का पृथक्करण विभव का आधार होता है, अत: स्थिर एवं विसरित भागों पर विपरीत चिह्न के आवेशों के कारण दोनों परतों के मध्य विभवान्तर उतपन्न हो जाता है। वैसे ही जैसे कि संधारित्र में विभवान्तर उत्पन्न होता है। विपरीत आवेशों वाली स्थिर एवं विसरित परतों के मध्य यह विभवान्तर वैद्युत गति विभव या जीटा विभव कहलाता है।
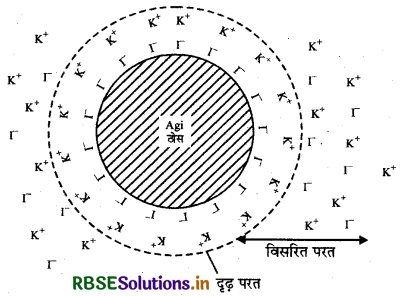
जब दो अघुलनशील कणों (अवक्षेप) पर दोहरी परत न हो तो वह एक दूसरे के बहुत पास आ सकते हैं और तब आकर्षी वान्डर वाल्स बल उन्हें खींच कर साथ ले आते हैं। जब कणों पर दोहरी परत होती है, तो ये कण एक दूसरे से बहुत दूर तक विकर्षित हो जाते हैं। विकर्षण उन्हे पास-पास नहीं आने देता। वह परिक्षप्त रहते हैं और कोलॉइड स्थायित्व प्राप्त कर लेता है। सॉल में और अधिक वैद्युत् अपघट्य मिलाने से विसरित दोहरी परत कमजोर हो जाती है। जिसके कारण जीटा विभव कम हो जाता है। इससे कणों के मध्य स्थित वैद्युत् प्रतिकर्षण अत्यधिक कम हो जाता है तथा कोलाइड अवक्षेपित हो जाता है। यही कारण है कोलॉइड विपरीत आवेश वाले ऑयनों के प्रति विशेष रूप से संवेदी होते हैं।
प्रश्न 8.
मिसेल बनने की क्रिया विधि को समझाइए।
उत्तर:
(i) बहुआण्विक या आण्विक कोलॉइड (Multi molecular or Molecular Colloids):विलीन करने पर किसी पदार्थ के बहुत से परमाणु या लघु अणु एकत्रित होकर पुंज जैसी ऐसी स्पीशीज बनाते हैं जिनका आकार कोलॉइडी सीमा (व्यास - 1 nm) में होता है। इस प्रकार प्राप्त स्पीशीज बहुआण्विक कोलॉइड कहलाती है।
उदाहरण: गोल्ड सॉल, सिल्वर सॉल, सल्फर सॉल, ऐल्बुमिन, सिलिकॉन्स इत्यादि के कोलॉइडी विलयन।
(वृहदाण्विक कोलॉइड (Macromolecular Collolds): वृहदाणु उचित विलायों में ऐसे विलयन बनाते हैं जिनमें अणुओं का आकार कोलॉइडी सीमा में होता है। ये काफी स्थायी होते हैं और यथार्थ विलयनों के समान होते हैं। प्राकृतिक रूप से पाये जाने वाले पदार्थ प्रायः इसके उदाहरण हैं।
उदाहरण: स्टार्च, सेलुलोस, प्रोटीन और एन्जाइम एवं मानव निर्मित वृहदाणु पॉलीथीन, नायलॉन, पॉलीस्टायरीन, संश्लेषित रबर आदि।
(iii) संगुणित कोलॉइड अथवा मिसिलर कोलॉइड अथवा सहचारी कोलॉइड (Associated Colloid or Miceller Colloid or Micelle Colloid): कुछ पदार्थ ऐसे होते हैं जो कम सान्द्रताओं पर सामान्य प्रबल विद्युत अपघट्य के समान व्यवहार करते हैं परन्तु उच्च सान्द्रताओं पर कों का पुंज बनने के कारण कोलॉइड के समान व्यवहार करते हैं। इस प्रकार पुंजित कण मिसेल कहलाते हैं। ये कण आपस में संसजक बलों (Cohesive Forces) अथवा वाण्डर वाल्स बलों (van der Waal's Forces) के द्वारा जुड़े होते हैं। इन्हें सहचारी कोलॉइड भी कहते हैं।
उदाहरण: साबुन, डिटरजेण्ट आदि।
साबुन (सोडियम स्टीयरेट) कम सान्द्रता में जलीय विलयन में निम्न प्रकार आयनित हो जाता है:
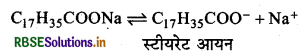
स्टीयरेट आयन परन्तु उच्च 'सान्द्रता की उपस्थिति में ये आयन संगुणित होकर कोलॉइडी कणों का आकार ग्रहण कर कोलॉइडी विलयन का निर्माण कर देते हैं। संगुणन से बने कणों को मिसेल (Micelle) कहते हैं। मिसेल का निर्माण विलयन में पदार्थ की एक निश्चित सान्द्रता के ऊपर होता है जिसे क्रान्तिक मिसेल सान्द्रता (Critical Micelle Concentration, CMC) कहते हैं। साबुन के लिए CMC का मान 10 - 3 - 10 mol L-I होता है। पृथक-पृथक मिसेल के लिए CMC का मान पृथक्-पृथक् होता है।
मिसेल निर्माण की क्रियाविधि (Mechanism of Micelle Formation): साबुन (सोडियम स्टीयरेट) में मिसेल का निर्माण निम्नवत् होता है
सर्वप्रथम सोडियम स्टीएरेट अणुओं का जल में आयनन होता है।
आयनन से प्राप्त ऋणायनों को हम इस प्रकार लिख सकते हैं
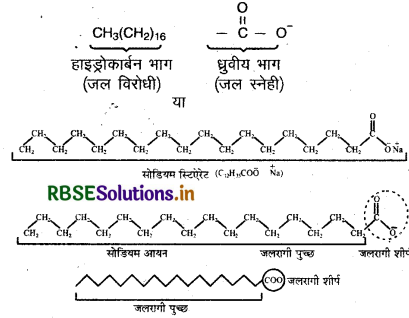
यहाँ हाइड्रोकार्बन भाग अर्थात् C17 H35 इस कण की पूँछ (Tail) तथा ध्रुवीय भाग (-C00) सिर (Head) कहलाता है। इस प्रकार अणुओं का द्रव-स्नेही तथा द्रव-विरोधी भाग परस्पर जुड़कर एक व्यवस्थित रूप में इकट्ठे होकर मिसेल का निर्माण करते हैं। सोडियम स्टिएरेट की एक मिसेल में लगभग 70 से 100 ऐसे आयन होते हैं।
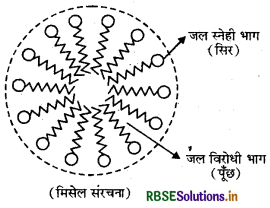
इस प्रकार साबुन से प्राप्त मिसेल की बाह्य सतह पर ऋणावेशित भाग होता है जिस कारण ये मिसेल ऋणावेशित होती हैं। समान आवेश के कारण ये मिसेल तन्त्र स्थायी होते हैं।
इसी प्रकार अपमार्जकों जैसे सोडियम लॉरिल सल्फेट, CH3(CH2)11 SO-4 Na+ में लंबी हाइड्रोकार्बन शृंखला सहित - SO4- ध्रुवीय समूह है, अत: मिसेल बनने की क्रियाविधि साबुनों के समान ही है।
साबुनों की शोधन क्रिया (Cleansing Action of Soap): मिसेल में एक जल-विरोधी हाइड्रोकार्बन का केन्द्रीय कोड होता है। साबुन के द्वारा शोधन क्रिया में साबुन के अणु तेल की बूंदों के चारों ओर इस प्रकार से मिसेल बनाते हैं कि स्टिएरेट आयन का जल-विरागी भाग बूंदों के अन्दर होता है एवं जलरागी भाग चिकनाई की बूंदों के बाहर काँटों की तरह निकला रहता है। चूंकि ध्रुवीय समूह जल से अन्योन्यक्रिया कर सकते हैं अतः स्टिएरेट आयनों से घिरी हुई तेल की बूंदै जल में खिंच जाती हैं एवं गन्दगी सतह से हट जाती है।
इस प्रकार साबुन तेलों एवं वसाओं का पायसीकरण (Emulsification) करके धुलाई में सहायता करता है। छोटी गोलियों के चारों ओर का ऋण आवेशित आवरण उन्हें एक साथ आकर पुंज बनाने से रोकता है।

प्रश्न 9.
विषमांगी उत्प्रेरण का अधिशोषण सिद्धान्त दीजिए ।
उत्तर:
(2) विषमांगी उत्र्रेरण (Heterogeneous Catalysis): जब उत्प्रेरकों एवं अभिकारकों की प्रावस्था भिन्न-भिन्न होती है तो इसे विषमांगी उत्प्रेरण (Heterogeneous catalysis) कहते हैं।
उदाहरण: (i) SO2 का ऑक्सीकरण (Oxidation of SO2 ): Pt की उपस्थिति में SO2 का SO3 में ऑक्सीकरण एक विषमांगी उत्प्रेरण का उदाहरण हैं।
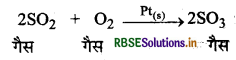
यहाँ सभी अभिकारक गैसीय प्रावस्था में हैं एवं उत्प्ररेक ठोस में है।
(ii) हेबर प्रक्रम (Haber's Process): इस प्रक्रम में सूक्ष्म विभाजित लोहे की उपस्थिति में अमोनिया, नाइट्रोजन तथा हाइड्रोजन गैस के द्वारा बनती है।
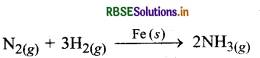
यहाँ सभी अभिकारक गैसीय प्रावस्था में हैं एवं उत्प्रेरक डोस प्रावस्था में है।
(iii) ऑस्टवाल्ड प्रक्रम (Ostwald's Process): इस विधि में अमोनिया का नाइट्रिक ऑक्साइड में ऑक्सीकरण प्लैटिनम गेज की उपस्थिति में होता है।
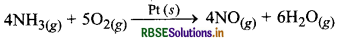
यहाँ उत्प्रेरक ठोस प्रावस्था एवं अभिकारक गैसीय प्रावस्था में उपस्थित हैं।
(iv) वनस्पति तेलों का हाइड्रोजनीकरण (Hydrogenation of Vanaspati Oil): सूक्ष्म विभाजित निकिल उत्प्रेरक की उपस्थिति में वनस्पति तेलों का हाइड्रोजनीकरण होता है तथा वनस्पति घी का निर्माण होता है।
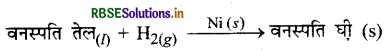
यहाँ एक अभिकारक द्रव तथा एक गैसीय प्रावस्था में है एवं उत्प्रेरक ठोस प्रावस्था में है।

प्रश्न 10.
कोलॉइडी विलयन बनाने की रासायनिक विधियों का वर्णन कीजिए।
उत्तर:
कोलॉइड बनाने की विधियाँ निम्न हैं:
(i) उभय अपघटन (Double Decomposition): यह अधिकतर सल्फाइड सॉल बनाने में प्रयुक्त होता है। जब धातु के लवणों के ठण्डे तथा तनु विलयन में H2 प्रवाहित की जाती है तो धातु सल्फाइड का सॉल प्राप्त होता है।
उदाहरंण:

(ii) जलं-अपघटन (Hydrolysis): इस विधि के द्वारा भारी धातुओं के ऑक्साइड तथा हाइड्रॉक्साइड सॉल प्राप्त किये जाते हैं।
उदाहरण:

इसी प्रकार AlOH3 Cr(OH)3 आदि का सॉल भी प्राप्त किया जाता है।
(iii) ऑक्सीकरण (Oxidation): इसके द्वारा अधातुओं का कोलॉइडी विलयन बनाया जाता है।
उदाहरण:

(iv) अपचयन (Reduction): कुछ धातुओं के सॉल उनके लवणों के जलीय विलयन का अपचयन कर बनाये जाते हैं।
उदाहरण:

गोल्ड (iii) क्लोराइड AUCl3 के विलयन को SnCl2 से अपचयन कराने पर Au का कोलॉइडी विलयन बनता है यह कासियस पर्पिल (Cassius purple) कहलाता है।
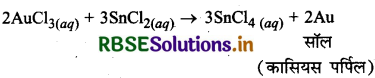
प्रश्न 11.
कोलॉइडी कणों पर आवेश उत्पात्ति के कारण समझाइए
उत्तर:
वैद्युत कण-संचलन (Electrophoresis): जैसा हम जानते हैं कि कोलॉइडी कण विद्युत आवेशित होते हैं। विद्युत क्षेत्र में ये कण विपरीत आवेश वाले इलेक्ट्रोड की ओर गमन करते हैं। विद्युत क्षेत्र के प्रभाव में कोलॉइडी कणों का एक अथवा दूसरे इलेक्ट्रोड की ओर अभिगमन वैद्युत कण-संचलन (Electrophoresis) कहलाता है।
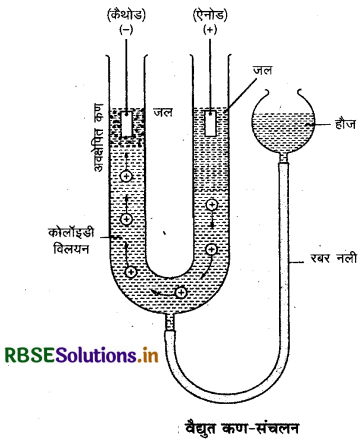
कोलॉइडी कणों पर जब विद्युत धनावेश होता है तो ये ऋणाग्र (cathode) की ओर अभिगमन करते हैं। इस अभिगमन प्रक्रिया को धनकण-संचलन (Cataphoresis) कहा जाता है और यदि कोलॉइडी कणों पर ऋणावेश होता है तो ये धनाग्र (Anode) की ओर अभिगमन करते हैं। इस प्रकार के अभिगमन को ऋणकण-संचलन (Anaphoresis) कहा जाता है। वैद्युत कण संचलन का उपयोग कोलॉइडी विलयनों के कणों पर आवेश ज्ञात करने में किया जाता है। यदि किसी उपर्युक्त प्रकार से वैद्युत कण संचलन (electrophoresis) अर्थात् कणों की गति रोकी जाती है तो यह देखा जाता है कि परिक्षेपण माध्यम विद्युत क्षेत्र में गति करना प्रारम्भ कर देता है। इस परिघटना को वैद्युत परासरण (electro - osmosis) कहा जाता है।
प्रश्न 12.
कोलॉइडों के प्रमुख अनुप्रयोग लिखिए।
उत्तर:
- आकाश का नीला रंग (Blue Coloúr of Sky): हवा में जल के साथ निलम्बित धूल के कण हमारी आँखों तक पहुँचने वाले प्रकाश को प्रकीर्णित कर देते हैं। इसी कारण आकाश का रंग नीला दिखाई देता है।
- कोहरा एवं धुन्ध (Fog and Mist): जब हवा की बहुत बड़ी मात्रा जिसमें धूल के कण होते हैं, अपने ओसांक से नीचे ठण्डी हो जाती है तो हवा की नमी इन कणों पर संघनित हो जाती है और बिन्दुक (droples) बना लेती है। ये बिन्दुक कोलॉइडी प्रकृति के होने के कारण हवा में धुन्ध या कोहरे के रूप में तैरते रहते हैं।
- प्राकृतिक वर्षा (Natural Rain): बादल हवा में निलम्बित जल के बिन्दुकों से बने ऐरोसॉल होते हैं। ऊपरी वायुमण्डल में संघनन के कारण जल के कोलॉइडी बिन्दुक और बड़े होते जाते हैं, जब तक कि वे बरसात के रूप में नीचे न आ जाएँ। इस प्रकार प्राकृतिक वर्षा होती है। कभी-कभी दो विपरीत आवेशित बादलों के मिलने से भी वर्षा होती है।
- कृत्रिम वर्षा (Artificial Rain): कृत्रिम बरसात करने के लिए विद्युतीकृत धूल को बादलों के ऊपर फेंककर या बादलों के विपरीत आवेश वाले सॉल को वायुयानों की सहायता से स्प्रे किया जाता है।
- खाद्य सामग्री (Food Materials): दूध, मक्खन, हलवा, आइसक्रीम, फलों का रस आदि किसी-न-किसी रूप में कोलॉइड होते हैं।
- रुधिर (Blood): रुधिर भी एक प्रकार का कोलॉइडी विलयन है। यह ऐल्बुमिनॉइड पदार्थ का कोलॉइडी विलयन है। रक्तस्ताव को रोकने के लिए हम लोग फिटकरी एवं फेरिक क्लोराइड के विलयन का प्रयोग करते हैं, क्योंकि ये विद्युत अपघट्य का कार्य करते हैं और रुधिर का स्कन्दन करके उसे थक्के में परिवर्तित कर देते हैं, जिससे खून बहना बन्द हो जाता है।
- मृदाएँ (Soils): उर्वरा मृदाएँ कोलॉइडी प्रकृति की होती हैं जिनमें ह्यूमस, रक्षक कोलॉइड की तरह कार्य करता है। कोलॉइडी प्रकृति के कारण मृदाएँ नमी एवं पोषक पदार्थों को अधिशोषित करती हैं।
- डेल्टा का निर्माण (Formation of Deita): नदी के जल में रेत के कण तथा अनेकों पदार्थ निलम्बित अवस्था में पाए जाते हैं। जब नदी का जल समुद्र के जल के सम्पर्क में आता है तब समुद्र जल में उपस्थित अनेकों विद्युत् अपघट्य (Electrolytes) नदी के जल में उपस्थित कोलॉइडी कणों का अवक्षेपण कर स्कन्दित कर देते हैं। ये पदार्थ नदी तथा समुंद्र के संगम स्थल पर संग्रहित होकर डेल्टा का रूप धारण कर लेते हैं।

विभिन्न प्रतियोगी परीक्षाओं में पूछे गए प्रश्न:
प्रश्न 1.
निम्न में से कौन-से एक गुण में से भौतिक अधिशोषण और रासायनिक अधिशोषण एक-दूसरे के समान है?
(a) आकर्षण बल
(b) अधिशोषण की ऐन्थैल्पी
(c) तापक्रम प्रभाव
(d) सतही क्षेत्रफल प्रभाव
(e) अधिशोषण परतों की संख्या
उत्तर:
(d) सतही क्षेत्रफल प्रभाव
प्रश्न 2.
समीकरण \(\frac{\mathrm{P}}{x}=\frac{1}{k^{\prime}}+\frac{\mathrm{P}}{k^{\prime \prime}}\)
(a) गिब्स अधिशोषण समतापी
(b) फ्रॉयंडलिक अधिशोषण समतापी
(c) लैंगम्यूर अधिशोषण समतापी
(d) BET समीकरण
उत्तर:
(c) लैंगम्यूर अधिशोषण समतापी

प्रश्न 3.
फ्रायंडलिक अधिशोषण समतापी के अनुसार, ठोस अधिशोषक के प्रति इकाई भार अधिशोषित गैस की मात्रा सीधे दाब के साथ परिवर्तित है, तब " का मान है
(a) 0
(b) 3
(c) 2
(d) 1
उत्तर:
(d) 1
प्रश्न 4.
निम्नलिखित लक्षणों में कौन-सा पद अधिशोषण से सम्बन्धित
(a) ∆G ऋणात्मक लेकिन ∆H तथा ∆S धनात्मक होते हैं।
(b) ∆G ∆H एवं ∆S सभी ऋणात्मक होते हैं।
(c) ∆G एवं ∆H ऋणात्मक, लेकिन ∆S धनात्मक होता है।
(d) ∆G तथा ∆S ऋणात्मक, लेकिन ∆H धनात्मक होता है।
उत्तर:
(b) ∆G ∆H एवं ∆S सभी ऋणात्मक होते हैं।
प्रश्न 5.
कोहरा निम्न कोलॉइडी तन्त्र का उदाहरण है।
(a) गैस में द्रव परिक्षिप्त
(b) गैस में गैस परिक्षिप्त।
(c) गैस में ठोस परिक्षिप्त
(d) द्रव में गैस परिक्षिप्त।
उत्तर:
(a) गैस में द्रव परिक्षिप्त
प्रश्न 6.
AS2S3 के स्कंदन में प्रयुक्त विद्युत् अपघट्यों के स्कंदन मान मिली मोल प्रति लीटर में नीचे दिए गए हैं
I.(NaCl) = 52
II.(BaCl) = 0.69
III.(MgSO4) = 0.22
इनकी स्कंदन शक्ति का सही क्रम है।
(a) II >> II
(b) I > II > III
(c) II > I > III
(d) III > III
उत्तर:
(d) III > III
प्रश्न 7.
बुझे चूने का पानी में निलम्बन कहलाता है।
(a) बुझे चूने का जलीय विलयन
(b) चूने का पानी
(c) अनबुझा चूना
(d) दूधिया चूना।
उत्तर:
(d) दूधिया चूना।
प्रश्न 8.
किस विलयन के मिश्रण से ऋण आवेशित कोलॉइड़ी [AgI]I- सॉल का निर्माण होता है?
(a) 0.1 MAgNO3 का 50 mL + 0.1 MKI का 50 mL
(b) 1 MAgNO3 का 50 mL + 1.5 MKI का 50 mL
(c) 1 MAgNO का 50 mL + 2 MKI का 50 mL
(d) 2 MAgNO का '50 mL + 1.5 M KI का 50 mL
उत्तर:
(b) 1 MAgNO3 का 50 mL + 1.5 MKI का 50 mL

प्रश्न 9.
निम्नलिखित में से कौन से गुण पर आयन की स्कंदन क्षमता निर्भर करती है?
(a) आयन के आवेश परिमाण एवं आवेश चिन्ह दोनों पर
(b) केवल आयन के आकार पर
(c) केवल आयन के आवेश परिमाण पर
(d) केवल आयन के आवेश चिन्ह पर
उत्तर:
(a) आयन के आवेश परिमाण एवं आवेश चिन्ह दोनों पर
प्रश्न 10.
निम्न में से कौन का कथन सही नहीं है?
(a) उत्प्रेरक किसी भी अभिक्रिया को प्रारम्भ नहीं करता है।
(b) अभिक्रिया के साम्यवस्था में उत्प्रेरक की उपस्थित में साम्यवस्था स्थिरांक का मान परिवर्तित होता है।
(c) एन्जाइम मुख्यतः जैव रसायनिक अभिक्रियाओं को उत्प्रेरित करते हैं।
(d) सह-एन्जाइम, एन्जाइम की उत्प्रेरण क्रियाशीलता को बढ़ाते
उत्तर:
(b) अभिक्रिया के साम्यवस्था में उत्प्रेरक की उपस्थित में साम्यवस्था स्थिरांक का मान परिवर्तित होता है।

- RBSE Class 12 Chemistry Notes Chapter 16 दैनिक जीवन में रसायन
- RBSE Class 12 Chemistry Notes Chapter 15 बहुलक
- RBSE Class 12 Chemistry Notes Chapter 14 जैव-अणु
- RBSE Class 12 Chemistry Notes Chapter 13 ऐमीन
- RBSE Class 12 Chemistry Notes Chapter 12 ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
- RBSE Class 12 Chemistry Notes Chapter 11 ऐल्कोहॉल, फीनॉल एवं ईथर
- RBSE Class 12 Chemistry Notes Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
- RBSE Class 12 Chemistry Notes Chapter 9 उपसहसंयोजन यौगिक
- RBSE Class 12 Chemistry Notes Chapter 8 d- एवं f-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम