RBSE Class 12 Chemistry Important Questions Chapter 4 रासायनिक बलगतिकी
Rajasthan Board RBSE Class 12 Chemistry Important Questions Chapter 4 रासायनिक बलगतिकी Important Questions and Answers.
Rajasthan Board RBSE Solutions for Class 12 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 12. Students can also read RBSE Class 12 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 12 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 12 Chemistry Chapter 4 Important Questions रासायनिक बलगतिकी
बहुविकल्पीय प्रश्न:
प्रश्न 1.
\(\frac{d x}{d t}\) α [a]° की अभिक्रिया की कोटि है:
(i) शून्य
(ii) प्रथम
(iii) द्वितीय
(iv) इनमें से कोई नहीं
उत्तर:
(i) शून्य

प्रश्न 2.
शून्य कोटि अभिक्रिया के दर-नियतांक का मात्रक है:
(i) L s-1 सेकण्ड-1
(ii) L mol-1 s-1 सेकण्ड
(iii) mol s-1 सेकण्ड
(iv) mol s-1 सेकण्ड-1
उत्तर:
(iii) mol s-1 सेकण्ड
प्रश्न 3.
शून्य कोटि की अभिक्रिया के लिए निम्नलिखित में से कौन-सा सूत्र सही है?
(i) t1/2 α a
(ii) t1/2 α 1/a
(iii) t1/2 α 1/a2
(iv) t1/2 α a°
उत्तर:
(iv) t1/2 α a°
प्रश्न 4.
प्रथम कोटि की अभिक्रिया के वेग नियतांक का मात्रक है:
(i) mol L-1 s-1
(ii) L mol-1 s-1
(iii) s-1
(iv) mol L-1
उत्तर:
(i) mol L-1 s-1
प्रश्न 5.
प्रथम कोटि की अभिक्रिया के लिए वेग स्थिरांक तथा अर्द्ध आयुकाल में सम्बन्ध है:
(i) \(k=\frac{0.6932}{t_{1 / 2}}\)
(ii) \(k=\frac{t_{1 / 2}}{0.6932}\)
(iii) t1/2 = 0.6932k
(iv) t1/2 = \(\frac{k}{0.6932}\)
उत्तर:
(i) \(k=\frac{0.6932}{t_{1 / 2}}\)
प्रश्न 6.
प्रथम कोटि की एक अभिक्रिया 72 मिनट 75% पूर्ण होती है। कब आंधी (50%) अभिक्रिया पूर्ण हुई?
(i) 36 मिनट में
(ii) 48 मिनट में
(iii) 52 मिनट में
(iv) 144 मिनट में
उत्तर:
(i) 36 मिनट में
प्रश्न 7.
यदि किसी प्रथम कोटि की अभिक्रिया का 90%, 90 मिनट में पूर्ण हुआ हो, तो इसके 50% पूर्ण होने में लगने वाला समय होगा (log 2 = 30.30)
(i) 30 मिनट
(ii) 36 मिनट
(iii) 50 मिनट
(iv) 27 मिनट
उत्तर:
(iv) 27 मिनट
प्रश्न 8.
प्रथम कोटि की अभिक्रिया के 90% पूर्ण होने में लगने वाला समय लगभग होता है:
(i) अर्द्धआयु का 2.2 गुना
(ii) अर्द्धआयु का 4.4 गुना
(iii) अर्द्धआयु का 3.3 गुना
(iv) अर्द्धआयु का 1.1 गुना
उत्तर:
(i) अर्द्धआयु का 2.2 गुना

प्रश्न 9.
निम्नलिखित में कौन-सी अभिक्रिया आभासी एकाणुक है?
(i) CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
(ii) CH3COOCH3 + H2O → CH2COOH + CH3OH
(iii) 2 FeCl3 + SnCl2 → 2FeCl2 + SnCl4
(iv) H2 + Cl2 → 2HCl
उत्तर:
(i) CH3COOC2H5 + NaOH → CH3COONa + C2H5OH
प्रश्न 10.
प्रथम कोटि की अभिक्रिया में अर्द्ध भाग के पूर्ण होने में लगा समय (t1/2)
(i) उसकी प्रारम्भिक सान्द्रता पर निर्भर करता है।
(ii) उसकी प्रारम्भिक सान्द्रता के व्युत्क्रमानुपाती है।
(iii) उसकी प्रारम्भिक सान्द्रता पर निर्भर नहीं करता है।
(iv) उसकी प्रारम्भिक सान्द्रता के वर्गमूल पर निर्भर करता है।
उत्तर:
(iii) उसकी प्रारम्भिक सान्द्रता पर निर्भर नहीं करता है।
अति लघु उत्तरीय प्रश्न:
प्रश्न 1.
शून्य कोटि अभिक्रिया के लिए अर्द्ध आयुकाल का सूत्र लिखिए।
उत्तर:
अर्द्ध आयुकाल = \(\frac{a}{2 k_0}\)
जहाँ
a = प्रारम्भिक सान्द्रता
ko = वेगस्थिरांक
प्रश्न 2.
अर्द्ध आयुकाल किसे कहते हैं?
उत्तर:
किसी रासायनिक अभिक्रिया में अभिकारकों की सान्द्रता को आधा विघटित होने में लगा समय अर्द्धआयुकाल कहलाता है।

प्रश्न 3.
वेग स्थिरांक किसे कहते हैं?
उत्तर:
स्थिर ताप पर किसी अभिक्रिया का वेग स्थिरांक वह वेग है जब सभी कारकों की सांद्रता एक इकाई हो।
प्रश्न 4.
अभिक्रिया  की अणुसंख्यता एवं कोटि में सम्बन्ध लिखिए।
की अणुसंख्यता एवं कोटि में सम्बन्ध लिखिए।
उत्तर:
अणुसंख्या = 2
कोटि = 1 अतः अणुसंख्यता कोटि की दुगुनी है।
प्रश्न 5.
अभिक्रिया का औसत वेग ज्ञात करने का सूत्र लिखिए।
उत्तर:
एक निश्चित समयान्तराल में अभिक्रिया वेग, औसत वेग कहलता है

= \(-\frac{\Delta C}{\Delta t}\)
प्रश्न 6.
प्रथम कोटि की अभिक्रिया के लिये वेग स्थिरांक k का मान = 5.5 x 10-14 S-1 पाया गया। इस अभिक्रिया की अर्द्ध-आयु की गणना कीजिए।
उत्तर:
प्रथम कोटि की अभिक्रिया की अर्द्ध-आयु
\(t_{1 / 2}=\frac{0.693}{k}\)
\(=\frac{0.693}{5.5 \times 10^{-14}}\)
∴ t1/2 = 0.126 x 1014s.
प्रश्न 7.
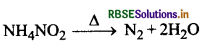
प्रथम कोटि अभिक्रिया की परिभाषा लिखिए।
उत्तर:
वे अभिक्रियाएँ जिनमें अभिक्रिया का वेग अभिकारक की ता के प्रथम घात के अनुक्रमानुपाती होता है। प्रथम कोटि की क्रियाएँ कहलाती हैं। जैसे-अमोनियम नाइट्रेट के जलीय विलयन का विघटन खये।
प्रश्न 8.
द्वितीय कोटि की अभिक्रिया हेतु वेग नियतांक की इकाई
उत्तर:
mol-1 L S-1
प्रश्न 9.
निम्न अभिक्रियाओं की कोटि बताइये
(अ) कृत्रिम नाभिकीय क्षय।
(ब) उच्च दाब पर गैसीय अमोनिया का तप्त Pt सतह पर जन।
(स) ऐथीन का हाइड्रोजनन Pt की उपस्थिति में।
(द) N2O5 का अपघटन
उत्तर:
(अ) प्रथम कोटि अभिक्रिया।
(ब) शून्य कोटि अभिक्रिया।
(स) शून्य कोटि अभिक्रिया।
(द) प्रथम कोटि अभिक्रिया।
प्रश्न 10.
अभिक्रिया के वेग तथा वेग व्यंजक में अन्तर बताएँ।
उत्तर:
|
अभिक्रिया का वेग |
वेग व्यंजक |
|
मह किसी भी अभिकारक या उत्पाद की सान्द्रता में समय के साथ परिवर्तन है। |
1. यह वह अभिक्रिया का वेग है जब प्रत्येक अभिकारक की सान्द्रता एक हो। |
|
गह अभिकारक की सान्द्रता पर नेर्भर करता है। |
2. यह अभिकारक की सान्द्रता पर निर्भर नहीं करता है। |
|
रसका मात्रक सदैव mol-1 s-1 या mol-1 s-1 होता है। |
3. इसका मात्रक अभिक्रिया की कोटि पर निर्भर करता है। |
प्रश्न 11.
एक रासायनिक अभिक्रिया का वेग नियताक 1.72 x 4 S-1 है। अभिक्रिया की कोटि ज्ञात कीजिए।
उत्तर:
प्रथम (इसे हम वेग स्थिरांक की इकाई के आधार पर कालते हैं।)
प्रश्न 12.
शून्य कोटि और प्रथम कोटि अभिक्रियाओं का एक-एक हरण दें।
उत्तर:
शून्य कोटि अभिक्रिया
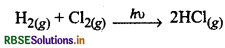
वेग = K[H2]° [CI2]
प्रथम कोटि अभिक्रिया,
N2O5 → 2NO2 + 5O2
वेग = k[N2O5]

प्रश्न 13.
किसी अभिक्रिया के लिए वेग स्थिरांक की इकाई S-1 है। अभिक्रिया की कोटि क्या होगी?
उत्तर:
अभिक्रिया प्रथम कोटि की है।
प्रश्न 14.
अभिक्रिया 2A + B → उत्पाद हेतु अवकलन वेग समीकरण लिखिए।
उत्तर:
अभिक्रिया 2A + B → उत्पाद
अभिक्रिया वेग
= \(-\frac{1}{2} \frac{d[\mathrm{~A}]}{d t}=-\frac{d[\mathrm{~B}]}{d t}\)
= K[A]2[B]
यहाँ K = वेग स्थिरांक है।
प्रश्न 15.
प्रथम कोटि की अभिक्रिया का अर्द्ध-आयु काल 10 s है। इसके वेग स्थिरांक की गणना कीजिए।
उत्तर:
प्रथम कोटि की अभिक्रिया के लिए
अर्द्ध-आयु काल t1/2 = \(\frac{0.693}{K}\)
K = वेग स्थिरांक,
t1/2 = अर्द्ध-आयु काल = 10 s
= \(\frac{0.693}{10 \mathrm{~s}}\)
= 0.0693 S-1
= 6.93 x 10-2 S-1
प्रश्न 16.
अभिक्रिया की आण्विकता को परिभाषित कीजिए।
उत्तर:
किसी प्राथमिक अभिक्रिया में भाग लेने वाले अभिकारक (परमाणु, अणु अथवा आयन) जो एक साथ संघट्ट करके अभिक्रिया करते हैं, की संख्या को उस अभिक्रिया की आण्विकता कहते हैं।
प्रश्न 17.
किसी रासायनिक अभिक्रिया के लिए अर्द्धायु की परिभाषा लिखिए।
उत्तर:
किसी रासायनिक अभिक्रिया में अभिकारक के आधे भाग को उत्पाद में परिवर्तित करने में जितना समय लगता है उसे उस अभिक्रिया का अर्द्धआयुकाल या अर्धायु कहते हैं। इसे t1/2 से व्यक्त करते हैं।
प्रश्न 18.
प्रकाश रासायनिक अभिक्रियाओं की कोटि क्या होती है?
उत्तर:
शून्य।
प्रश्न 19.
(अ) अभिक्रिया की अणु संख्यता को परिभाषित कीजिए।
(ब) संघट्ट सिद्धान्त के अनुसार, उन दो कारकों के नाम लिखिए, ताप बढ़ाने पर अभिक्रिया के वेग को बढ़ाते हैं।
उत्तर:
(अ) "अभिक्रिया के किसी पद में भाग लेने वाले भेकर्मकों के अणुओं की कुल संख्या अभिक्रिया की आण्विकता अभिक्रिया की अणुसंख्यता (Molecularity of reaction) कहलाती " इसका मान सदैव पूर्णांक होता है।"
(ब) (i) संघट्ट आवृत्ति में वृद्धि
(ii) प्रभावी संघट्ट में वृद्धि
प्रश्न 20.
प्रकाश रासायनिक अभिक्रियाओं की कोटि क्या होती हैं।
उत्तर:
शून्य।

प्रश्न 21.
(अ) अभिक्रिया की कोटि की परिभाषा लिखिए।
(ब) संघट्ट सिद्धान्त के अनुसार, किसी रासायनिक अभिक्रिया दो मुख्य अवरोधकों के नाम लिखिए।
उत्तर:
(अ) "किसी अभिक्रिया में भाग लेने वाले अभिकारक गुओं की वह संख्या जिनकी सान्द्रता में नापने योग्य परिवर्तन होता तथा जो अभिक्रिया के वेग को निर्धारित करती है, अभिक्रिया की टि कहलाती है।"
(ब) (i) ऊर्जा अवरोध
(ii) अभिविन्यास अवरोध।
प्रश्न 22.
अभिक्रिया की कोटि एवं अणुसंख्यता में कोई दो अन्तर खिए।
उत्तर:
|
अंभिकया दी प्रारि |
एममफलया बते आणिखका |
|
यह भिन्नात्मक संख्या हो सकती है। |
1. यह सदैव एक पूर्ण संख्या है। |
|
यह शून्य हो सकती है। |
2. यह कभी भी शून्य नहीं होती है। |
|
अभिक्रिया की कोटि उन अणुओं की संख्या है जिनकी सान्द्रताएँ अभिक्रिया के वेग को निर्धारित करती हैं। |
3. यह अभिक्रिया में भाग लेने वृ वाले अभिकारकों की संख्या है। |
|
इसे हम प्रयोगों द्वारा निकालते हैं। |
4. यह अभिकारकों की संख्या गिनकर निकाली जाती है। |
प्रश्न 23.
निम्न अभिक्रिया की कोटि ओर वेग स्थिरांक की इकाई खिए।
उत्तर:
अभिक्रिया की कोटि शून्य तथा वेग स्थिरांक की इकाई Mol L-1 s-1
प्रश्न 24.
कारण सहित बताइए कि निम्न में अभिक्रिया की कोटि होगी?
2FeCl3 + SnCl2 → SnCl4 + 2FeCl2
उत्तर:
अभिक्रिया तृतीय कोटि की है, क्योंकि तृतीय कोटि की अभिक्रिया में अभिकारक पदार्थ के तीन अणुओं का सान्द्रण समय के साथ-साथ परिवर्तित होता है अर्थात् इनका वेग अभिकारक के तीन अणुओं के सान्द्रण के रूप में व्यक्त होता है।
प्रश्न 25.
वेग स्थिरांक तथा साम्य स्थिरांक में अन्तर स्पष्ट कीजिए।
उत्तर:
वेग स्थिरांक अभिकारक पदार्थों की इकाई सान्द्रता पर होने वाली अभिक्रिया की गति को कहते हैं। जबकि साम्य स्थिरांक उत्क्रमणीय अभिक्रिया में अग्र अभिक्रिया के वेग स्थिरांक तथा विपरीत क्रिया के साम्य स्थिरांक का अनुपात होता है।
प्रश्न 26.
तापीय गुणांक क्या है? अभिक्रिया के वेग से इसका सम्बन्ध बताइए।
उत्तर:
तापीय गुणांक 10°C अन्तर के दो भिन्न तापों पर वेग स्थिरांकों के अनुपात के बराबर होता है।
वेग स्थिरांक का तापीय गुणांक = 
यह प्राप्त मान 2 और 3 से मध्य में होता है।
प्रश्न 27.
प्रथम कोटि की अभिक्रिया के वेग स्थिरांक की इकाई ज्ञात कीजिए।
उत्तर:
प्रथम कोटि की अभिक्रिया का वेग समीकरण = k [A]1
k = की इकाई = 
= \(\frac{\mathrm{mol} / \mathrm{L} / \mathrm{s}}{\mathrm{mol} / \mathrm{L}}\) = S-1
प्रश्न 28.
आरेनियस का समीकरण दीजिए।
उत्तर:
k = Ae-Ea/RT, जहाँ E, सक्रियण ऊर्जा, R गैसीय स्थिरांक, T परमताप, k वेग स्थिरांक, A आवृत्ति गुणांक।

प्रश्न 29.
एक अभिक्रिया A + B उत्पाद, के लिए वेग नियमा r = K [A] [B] से दिया गया है। अभिक्रिया की कोटि क्या है?
उत्तर:
r = k[A]1/2 [B]2
अभिक्रिया की कोटि = 1/2 + 2 = 5/2
प्रश्न 32.
प्रथम कोटि की अभिक्रिया के लिए समय तथा सान्द्रता के मध्य ग्राफ खींचिए।
उत्तर:
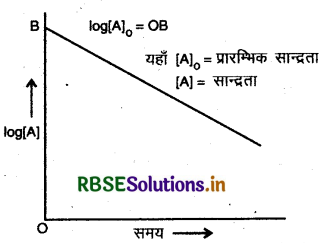
उपर्युक्त ग्राफ प्रथम कोटि की अभिक्रिया के लिए है।
प्रश्न 31.
समीकरण 2N2O5 → 2N2O4 + O2 हेतु यदि अर्द्ध आयु काल 6.93 सेकण्ड है तो दर नियतांक ज्ञात कीजिये।
उत्तर:
अर्द्ध-आयु काल t1/2 = \(\frac{0.693}{\mathrm{~K}}\)
\(\mathrm{K}=\frac{0.693}{t_{1 / 2}}\)
= \(\frac{0.693}{6.93}\)
= 0.1 s
प्रश्न 32.
किसी पदार्थ A की सान्द्रता दोगुनी होने पर इसके वियोजन की दर चार गुनी हो जाती है, इस अभिक्रिया की कोटि क्या है?
उत्तर:
वेग नियमानुसार,
वेग = K[A]n
r = k[A]n ....... (1)
4r = k[2A]n ......... (2)
समी. (2) को समी. (1) से भाग देने पर,
या
4 = (2)n
या
(2)2 = (2)n
अतः n = 2
अर्थात् अभिक्रिया की कोटि 2 है।
प्रश्न 33.
अभिक्रिया के वेग को परिभाषित कीजिए।
उत्तर:
इकाई समय में किसी अभिकारक या उत्पाद की सान्द्रता में परिवर्तन को अभिक्रिया का वेग कहते हैं।
प्रश्न 34.
एक प्रथम कोटि अभिक्रिया के लिए वेग स्थिरांक का मान 0.693 x 10-15 पाया गया तो इस अभिक्रिया का अर्द्धआयु काल ज्ञात कीजिए।
उत्तर:
वेग स्थिरांक (k) = 0.693 x 10-14 s-1
अर्द्ध-आयु काल (t1/2) = ?
अर्द्ध-आयु काल (t1/2) = \(\frac{0.693}{k}=\frac{0.693}{0.693 \times 10^{-14}}\)
अर्द्ध-आयु काल = 1014 s

प्रश्न 35.
आहेनियस समीकरण के आधार पर In K एवं 1/r के मध्य आरेख बनाइये।
उत्तर:
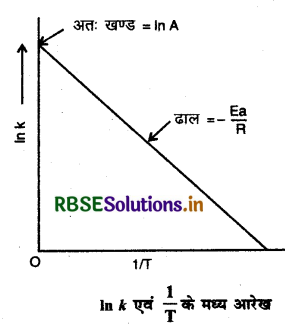
प्रश्न 36.
अभिक्रिया की कुल कोटि का परिकलन कीजिए जिसका वेग नियम है वेग = k[NH3]5/2 [O2]1/2
उत्तर:
अभिक्रिया की कोटि = \(\frac{5}{2}+\frac{1}{2}\)
प्रश्न 37.
(a) किसी रासायनिक अभिक्रि के वेग को प्रभावित करने वाले दो कारकों को लिखिए।
(b) संघट्टों के प्रभावी संघट्ट होने के लिए दो परिस्थितियाँ लिखिए।
उत्तर:
(a) रासायनिक अभिक्रिया के वेग को प्रभावित करने वाले दो कारक निम्न है।
- ताप का प्रभाव
- अभिकारकों की प्रकृति
(b) संघट्टों के प्रभावी संघट्ट होने के लिए दो परिस्थितियाँ निम्न है
- टक्करें सही दिशा में आमने-सामने होनी चाहिए।
- संघट्ट से उत्पन्न होने वाली ऊर्जा देहली ऊर्जा के बराबर या उससे अधिक होनी चाहिए।
लघु उत्तरीय प्रश्न:
प्रश्न 1.
(अ) आरेख में चिन्हित (क) एवं (ख) किसे दर्शाते हैं? नाम लिखिये। (ब) आरेख में चिन्हित केवल (क) की परिभाषा दीजिये।
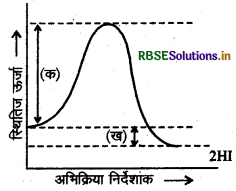
उत्तर:
(अ) आरेख में (क) अभिकारकों की सक्रियण ऊर्जा है तथा (ख) ऊर्जा परिवर्तन (AH) है जो अभिकारकों एवं उत्पादों की ऊर्जा में अंतर को बताता है।
(ब) सक्रियण ऊर्जा-अभिकारकों से सक्रियत संकुल (मध्यवर्ती) के निर्माण के लिये आवश्यक ऊर्जा सक्रियण ऊर्जा (EA) कहलाती है। फिर यह संकुल (मध्यवर्ती) उत्पाद में परिवर्तित होता है।
प्रश्न 2.
अभिक्रिया वेग एवं विशिष्ट अभिक्रिया वेग में विभेद कीजिए।
उत्तर:
अभिक्रिया वेग (Rate of reaction): इकाई समय में किसी अभिकारक अथवा उत्पाद की सान्द्रता में आये परिवर्तन को अभिक्रिया का वेग कहते हैं। इसका मात्रक mol L min-1 होता है।
अभिक्रिया वेग = \(\pm \frac{\Delta \mathrm{C}}{\Delta t}\)
विशिष्ट अभिक्रिया वेग:
किसी अभिक्रिया का वह वेग जब सभी अभिकारकों की सान्द्रता ईकाई होती है, उसे विशिष्ट अभिक्रिया का वेग कहते हैं। माना अभिक्रिया
aA + bB + cC → उत्पाद
वेग =K[A] [B] [C]
जब [A] = [B] = [C] = 1M तो
वेग = K
यही विशिष्ट अभिक्रिया का वेग है।
प्रश्न 3.
अभिक्रिया का वेग स्थिरांक क्या है?
उत्तर:
यदि किसी रासायनिक अभिक्रिया में किसी क्षण अभिकारक का आण्विक सान्द्रण C हो, तो उस समय अभिक्रिया का वेग ),
सान्द्रण C के समानुपाती होता हैं,
अर्थात् ? \(\frac{d x}{d t} \propto \mathrm{C}^{\prime}\) या \(\frac{d x}{d t}\) =Kc
जहाँ, K एक स्थिरांक है, जिस वेग स्थिरांक कहते हैं। अब यदि C = 1 तो 4 =K
अतः स्थिर ताप पर अभिकारक पदार्थ के इकाई सान्द्रण पर होने वाले अभिक्रिया के वेग को उसे अभिक्रिया का वेग स्थिरांक कहते हैं।

प्रश्न 4.
1. अभिक्रिया को वेग क्या है?
2. अभिक्रिया की तात्क्षणिक दर को परिभाषित कीजिए।
उत्तर:
1. वह दर, जिस पर समय के साथ-साथ अभिकारक पदार्थों का सान्द्रण परिवर्तित होता है, अभिक्रिया का वेग कहलाता है।"
यदि सूक्ष्म अन्तराल dt में अभिकारक के dx मोल उत्पाद में
परिवर्तित होते हों तो अभिक्रिया का वेग = \(\frac{d x}{d t}\)
यदि अन्तराल dt में अभिकारक के dc मोल शेष रहते हों तो अभिक्रिया का वेग = \(\frac{d[c]}{d t}\)
2. किसी निश्चित क्षण पर किसी एक अभिकारक अथवा उत्पाद के सान्द्रता परिवर्तन की दर (अथवा इकाई समय में सान्द्रता परिवर्तन) उस क्षण पर अभिक्रिया की दर अर्थात् अभिक्रिया की तात्क्षणिक दर कहलाती है।
वास्तव में; तात्क्षणिक दर लघुतम सम्भव समय अन्तराल (जब At शून्य की ओर अग्रसर हो) के दौरान औसत दर होती है। यदि किसी लघुपत समय अन्तराल dt में होने वाला लघुतम सान्द्रता परिवर्तन dr है तो
तात्क्षणिक वेग = \(\frac{d x}{d t}\)
प्रश्न 5.
वेग नियम को परिभाषित कीजिए।
उत्तर:
वह गणितीय व्यंजक जो अभिकारकों की मोलर सान्द्रता पर अभिक्रिया के वेग की प्रायोगिक निर्भरता को व्यक्त करता है, वेग नियम कहलाता है। यदि एक सामान्य अभिक्रिया
aA + bB → उत्पाद
का वेग A की सान्द्रता की घात p तथा B की सान्द्रता की घात व पर निर्भर करता है, तो
वेग = k[A]p [B]q
जहाँ k वेग स्थिरांक.अथवा दर स्थिरांक है। उपर्युक्त समीकरण को ही वेग नियम कहते है।
प्रश्न 6.
वेग नियम और द्रव्य अनुपाती क्रिया के नियम में क्या अन्तर है?
उत्तर:
वेग नियम के अनुसार, अभिक्रिया का वेग उन सान्द्रता पदों पर निर्भर करता है, जिन पर अभिक्रिया, का वेग वास्तव में निर्भर करता हैं (प्रयोगों द्वारा ज्ञात) जबकि द्रव्य अनुपाती क्रिया का नियम सन्तुलित रासायनिक समीकरण की स्टॉइकियोमीट्री पर आधारित है।
उदाहरणार्थ: किसी सामान्य अभिक्रिया aA + bB → उत्पाद के लिए,
वेग नियम के अनुसार, वेग = K[A]a [B]b
जबकि द्रव्य अनुपाती क्रिया नियम के अनुसार, वेग = k[A]a [B]bB
प्रश्न 7.
रासायनिक अभिक्रिया में 10°C ताप वृद्धि से वेग स्थिरांक में लगभग दोगुनी वृद्धि हो जाती है। नामांकित वितरण वक्र से समझायें।
उत्तर:
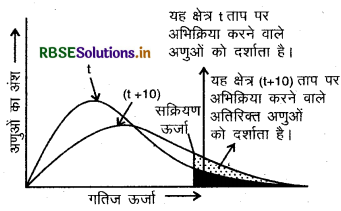
अभिक्रिया वेग की ताप पर निर्भरता दर्शाता हुआ वितरण वक्र किसी पदार्थ के तापमान में वृद्धि द्वारा सक्रियण ऊर्जा से अधिक ऊर्जा प्राप्त संघट्ट करने वाले अणुओं की संख्या के मान में वृद्धि होती जैसा कि चित्र से स्पष्ट है कि वक्र में (t + 10) ताप पर सक्रियण ऊर्जा या इससे अधिक ऊर्जा प्राप्त अणुओं को प्रदर्शित करने वाला क्षेत्रफल लगभग दोगुना हो जाता है अतः अभिक्रिया वेग दोगुना हो जाता
प्रश्न 8.
शून्य कोटि की अभिक्रिया से आप क्या समझते हैं? उदाहरण द्वारा समझाइए। इसके वेग स्थिरांक को व्यंजक लिखिए।
या
कारण सहित बताइए कि निम्न रासायनिक अभिक्रिया किस कोटि की है?

उत्तर:
शून्य कोटि की अभिक्रिया-वह अभिक्रिया जिसकी प्रगति में अभिकारक के किसी भी अणु का सान्द्रण परिवर्तित नहीं होता है अर्थात् जिसका वेग अभिकारक के सान्द्रण पर निर्भर नहीं करता है, शून्य कोटि की अभिक्रिया कहलाती है।
A → B + C
यदि इसका वेग α[A]° हो, तो यह शून्य कोटि की अभिक्रिया होगी। उदाहरणार्थ-सूर्य के प्रकाश की उपस्थिति में H2 व Cl2 का संयोग

शून्य कोटि के वेग स्थिरांक का व्यंजक-शून्य कोटि की अभिक्रिया के वेग स्थिरांक का व्यंजक x = kt है। जहाँ x अभिकारक A की वह मात्रा है जो 1 समय में अभिक्रिया करती है और है अभिक्रिया का वेग स्थिरांक है।
प्रश्न 9.
प्रथम कोटि की अभिक्रिया से आप क्या समझते हैं? उदाहरण द्वारा समझाइए।
या
प्रथम कोटि की अभिक्रिया के लक्षण लिखिए।
उत्तर:
प्रथम कोटि की अभिक्रिया-वह अभिक्रिया जिसका वेग केवल एक अभिकारक की सान्द्रता के अनुक्रमानुपाती होता है, प्रथम कोटि की अभिक्रिया कहलाती है। उदाहरणार्थ-निम्नलिखित अभिक्रिया में केवल शक्कर के अणुओं की सान्द्रता परिवर्तित होती है; अतः यह प्रथम कोटि की अभिक्रिया है। .

प्रथम कोटि की अभिक्रिया का समीकरण निम्नलिखित है:
\(k=\frac{2.303}{t} \log 10 \frac{a}{a-x}\)
जहाँ a अभिकारक की प्रारम्भिक सान्द्रता तथा (a - x) समय । पर सान्द्रता है। लक्षण
- प्रथम कोटि की अभिक्रिया के वेग स्थिरांक k का मान अभिकारक की सान्द्रता की इकाई पर निर्भर नहीं करता। यह केवल समय की इकाई पर निर्भर करता है।
- इस अभिक्रिया के लिए log (a - x) और है के मध्य ग्राफ खींचने पर एक सरल रेखा प्राप्त होती है। जिसका ढाल im है।
- प्रथम कोटि की अभिक्रिया का अर्द्ध-आयुकाल अभिकारकों के प्रारम्भिक सान्द्रण पर निर्भर नहीं करता।
- अभिक्रिया के पूर्ण होने में अनन्त समय लगता है।
- अभिकारक की सान्द्रता n गुना बढ़ने पर अभिक्रिया का वेग भी n गुना बढ़ जाता है।
प्रश्न 10.
अभिक्रिया की कोटि और आण्विकता को समझाइए।
या
अभिक्रिया की कोटि को समझाते हुए निम्न अभिक्रिया की कोटि कारण सहित बताइए।
या कारण सहित अभिक्रिया,
CH3COOC2H5 + NaOH - CH3COONa + C2H5OH की कोटि बताइए।
उत्तर:
आणविकता-किसी रासायनिक अभिक्रिया में भाग लेने वाले अभिकारक अणुओं की न्यूनतम संख्या को अभिक्रिया की आणविकता कहते हैं।
उदाहरणार्थ:
(i) अमोनियम नाइट्राइट को गर्म कने पर होने वाली अभिक्रिया में अमोनियम नाइट्राइट का एक अणु भाग लेता है अतः उसकी आणविकता एक है।
NH4NO2 → 2H2O + N2 ↑
(ii) NaOH द्वारा एथिल ऐसीटेट के जल-अपघटन की अभिक्रिया की आणविकता 2 है, क्योंकि इसमें दोनों अभिकारकों का एक-एक अणु भाग लेता है।
CH3COOC2H5 + NaOH CH3COONa + C2H5OH
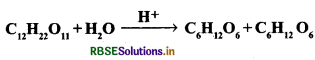
कोटि: किसी रासायनिक अभिक्रिया में भाग लेने वाले पदार्थों के अणुओं की वह संख्या जिनका सान्द्रण अभिक्रिया की प्रगति में परिवर्तित होता है, अभिक्रिया की कोटि कहलाती है।
उदाहरणार्थ: CH3COOC2H5 + NaOH → CH3COONa + С2Н5ОН
उपर्युक्त अभिक्रिया में दोनों अभिकारकों के एक-एक अणु की सान्द्रता प्रभावित हो रही है; अतः यह द्वितीय कोटि की अभिक्रिया है परन्तु अभिक्रिया
C12H22O11 + H2O → C6H12O6 + C6H12O6 में केवल C12H22O11 की सान्द्रता में परिवर्तन होने पर अभिक्रिया का वेग परिवर्तित होता है। जल (H2O) की सान्द्रता में परिवर्तन का वेग पर कोई प्रभाव नहीं होता है। अतः अभिक्रिया की कोटि एक है।
प्रश्न 11.
सक्रियण ऊर्जा क्या होती है? किसी अभिक्रिया का वेग सक्रियण ऊर्जा के मान को कैसे प्रभावित करता है?
उत्तर:
ऊर्जा अवरोध को पार करके उत्पाद बनाने के लिए देहली ऊर्जा से कम ऊर्जा युक्त अभिकारक अणुओं को जितनी ऊर्जा की और आवश्यकता होती है उसे अभिक्रिया की सक्रियण ऊर्जा कहते हैं।
अतः सक्रियण ऊर्जा = देहली ऊर्जा - अभिकारक अणुओं की औसत ऊर्जा
En = Ethreshold - EReactants
प्रत्येक अभिक्रिया के लिए सक्रियण ऊर्जा का मान निश्चित होता है किसी अभिक्रिया के लिए जब सक्रियण ऊर्जा का मान कम होता है तो अधिक संख्या में अणु ऊर्जा अवरोध को पार करके उत्पाद बना सकते हैं। इस प्रकार की अभिक्रियाओं के वेग अधिक होते हैं। सक्रियण ऊर्जा के उच्च मान युक्त अभिक्रियाओं के वेग कम होते हैं। अतः तीव्र अभिक्रियाओं के लिए सक्रियण ऊर्जा कम होती है। मन्द अभिक्रियाओं के लिए सक्रियण ऊर्जा अधिक होती है।

प्रश्न 12.
आभासी एकाणुक अभिक्रिया को उदाहरण द्वारा समझाइए।
उत्तर:
वह अभिक्रिया जिसकी कोटि एक हो परन्तु आण्विकता एक न हो, आभासी एकाणुक क्रिया कहलाती है।
उदाहरणार्थ:
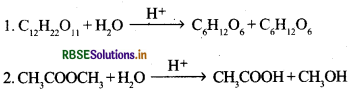
इन दोनों अभिक्रियाओं की कोटि एक है; क्योंकि H2O के सान्द्रण में कोई परिवर्तन नहीं होता, जबकि इनकी आणविकता दो है। अतः ये आभासी एकाणुक अभिक्रियाएँ हैं।
प्रश्न 13.
दर्शाइए कि प्रथम कोटि की अभिक्रिया में अर्द्ध-आय अभिकारक की सान्द्रता पर निर्भर नहीं करती है।
उत्तर:
माना कि t = t1/2 तथा [A]
= [A]o/2
अतः प्रथम कोटि के लिए,
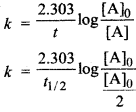
मान रखने पर,
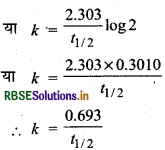
अतः प्रथम कोटि की अभिक्रिया हेतु अर्द्ध-आयु सान्द्रता पर निर्भर नहीं करती है।
प्रश्न 14.
वेग स्थिरांक पर ताप का क्या प्रभाव पड़ता है ? ताप के इस प्रभाव को मात्रात्मक रूप में कैसे प्रदर्शित कर सकते हैं?
उत्तर:
किसी रासायनिक अभिक्रिया का ताप 10°C बढ़ाने पर वेग स्थिरांक के मान में दोगुनी वृद्धि होती है।
आहेनियस ने ताप एवं वेग स्थिरांक के मध्य में निम्न सम्बन्ध स्थापित किया
k'= Ae-E./RT
यहाँ A = आवृत्ति गुणक या आर्हेनियस गुणक या पूर्व चरघातांकी गुणक।
R = गैस नियतांक
E = सक्रियण ऊर्जा
T= ताप
k = वेग नियतांक।
प्रश्न 15.
एक अभिक्रिया 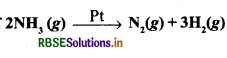
दर =k
1. इस अभिक्रिया की कोटि और आण्विकता लिखिए।
2. k की यूनिट लिखिए।
उत्तर:
- अभिक्रिया की कोटि = शून्य आण्विकता = 2
- k की यूनिट = mol L-1 s-1 है।
प्रश्न 16.
किसी अभिक्रिया R → P के लिये विशा ने R की सान्द्रता एवं समय के मध्य एक ग्राफ खींचा। इस ग्राफ के आधार पर निम्नलिखित प्रश्नों के उत्तर दीजिए।
1. अभिक्रिया की कोटि की प्रागुक्ति कीजिए।
2. वक्र का ढाल क्या इंगित करता है?
3. वेग स्थिरांक की इकाई क्या है?
उत्तर:
- अभिक्रिया R → P की कोटि शून्य होगी।
- वक्र का ढाल यह प्रदर्शित करता है समय बढ़ने के साथ-साथ अभिकारक की प्रारम्भिक सान्द्रता कम होती जाती है।
- वेग स्थिरांक की ईकाई mol L-1 s-1 है।
निबन्धात्मक प्रश्न:
प्रश्न 1.
रासायनिक अभिक्रिया का वेग किसे कहते हैं? अभिक्रिया का वेग एवं स्टाइक्रियोमितीय गुणांक में सम्बन्ध को समझाइए।
उत्तर:
जब कोई रासायनिक अभिक्रिया होती है तो अभिक्रिया के फलस्वरूप अभिकारकों की सान्द्रता घटती है एवं उत्पाद की सान्द्रता में वृद्धि होती है। अतः “एकांक समय में किसी अभिकारक अथवा उत्पाद की सान्द्रता में परिवर्तन को अभिक्रिया का वेग कहते हैं।"
इसका मात्रक mol L-1 s-1 या mol L-1 mm-1 होता है। यह दो प्रकार का होता है
- औसत वेग,
- तात्कालिक वेग।
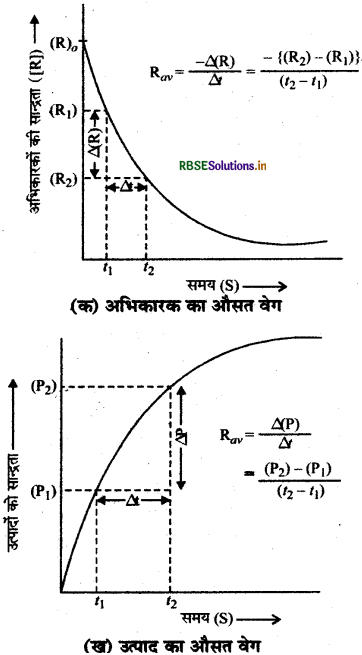
(1) औसत वेग (Average Rate):
किसी रासायनिक अभिक्रिया में उपस्थित अभिकारक या उत्पाद की सान्द्रता में प्रति इकाई समय में होने वाले परिवर्तन को उस अभिक्रिया का औसत वेग (Average Rate) कहते हैं। माना कि
R (अभिकारक) → P (उत्पाद)
यदि समय t1 एवं t2 पर अभिकारक (R) एवं उत्पाद (P) की सान्द्रताएं क्रमयाः [R] एवं [P] तथा [R.] एवं [P] हो तब समय में परिवर्तन ∆t = t2 - t1
अभिकारक की सान्द्रता में परिवर्तन ∆R = [R2 - [R1]
उत्पाद की सान्द्रता में परिवर्तन ∆P = [P2] - [P1]
अभिक्रिया का औसत वेग = 

अभिकारक के लिए औसत वेग (R में ह्यस होने की दर) 
= \(-\frac{\Delta[\mathrm{R}]}{\Delta t}\)
अभिकारक तथा उत्पाद की सान्द्रताओं में समय के साथ परिवर्तन का आलेख निम्न प्रकार है

= \(+\frac{\Delta[\dot{\mathrm{P}}]}{\Delta t}\)
प्रश्न 2.
रासायनिक अभिक्रिया का सघट्ट सिन्धात को समझाइए।
उत्तर:
उत्प्रेरक वह पदार्थ है जिसमें स्वयं स्थायी रासायनिक परविर्तन हुए बिना यह अभिक्रिया के वेग को बढ़ाता या घटाता है, जो उत्प्रेरक की प्रकृति पर निर्भर करता है।
उदाहरण के लिए, MnO2 निम्न अभिक्रिया के उत्प्रेरित कर वेग में वृद्धि करता है। जिसे धनात्मक उत्प्रेरक कहते हैं।
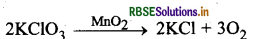
धनात्मक उत्प्रेरक अभिक्रिया की सक्रियण ऊर्जा को कम कर देता है जिससे निम्न ऊर्जा स्तर में उपस्थित अभिकारक के अणु भी उत्पाद बनाने लगते हैं और अभिक्रिया का वेग बढ़ जाता है।
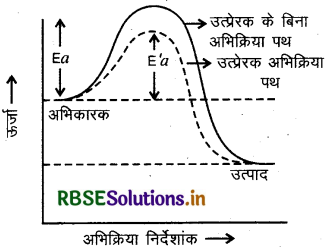
जब मिलाया गया उत्प्रेरक पदार्थ अभिक्रिया की दर को कम करता है तो उसे ऋणात्मक उत्प्रेरक या निरोधक कहते हैं। ऋणात्मक उत्प्रेरक अभिक्रिया के लिए सक्रियण ऊर्जा का मान बढ़ा देते हैं जिससे अभिक्रिया का वेग कम हो जाता है।
अतः उत्प्रेरक, अभिक्रिया की गिब्ज ऊर्जा, ∆G में बदलाव नहीं करता। वह स्वतः प्रवर्तित अभिक्रियाओं को उत्प्रेरित करता है परंतु स्वतः अप्रवर्तित अभिक्रया को उत्प्रेरित नहीं करता उत्प्रेरक अग्र एवं प्रतीप अभिक्रिया को समान रूप से उत्प्रेरित कर, शीर्घ ही साम्य स्थापित करता है।

प्रश्न 3.
अभिक्रिया के वेग को प्रवावित करके वाले कारकों को समझाओं।
उत्तर:
अभिक्रिया का वेग प्रायोगिक परिस्थितियों पर निर्भर करता है। किसी भी रासायनिक अभिक्रिया को प्रभावित करने वाले मुख्य कारक निम्न हैं-
(1) अभिकारकों का सान्द्रण (Concentration of Reactants): द्रव्य. अनुपाती क्रिया के नियमानुसार, "अभिक्रिया का वेग, अभिकारकों की सान्द्रता के गुणनफल के समानुपाती होता है अर्थात् अभिकारकों की सान्द्रता में वृद्धि करने. से अभिक्रिया का वेग बढ़ जाता है परन्तु शून्य कोटि की अभिक्रिया के सान्द्रण परिवर्तन का अभिक्रिया के वेग पर कोई प्रभाव नहीं पड़ता है।"
उदाहरणार्थ: अभिक्रिया PC3 + Cl2 → PCl5 में यदि PCl3 या Cl2 का सान्द्रण बढ़ा दिया जाये तो अभिक्रिया का वेग भी बढ़ जाता है।
(2) अभिकारकों की प्रकृति (Nature of Reactants): अभिक्रिया का वेग अभिकारकों की प्रकृति पर निर्भर करता है। अभिक्रिया के दौरान अभिकारकों में उपस्थित बन्ध टूटते हैं, जबकि उत्पादों में नये बन्धों का निर्माण होता है। यदि अभिक्रिया में टूटने वाले बन्धों की संख्या अधिक होती है तो यह अभिक्रिया मन्द गति से होती है। इसी प्रकार यदि टूटने वाले बन्धों की संख्या कम होती है तो अभिक्रिया तीव्र गति से सम्पन्न होती है।
उदाहरणार्थ: आयनिक अभिक्रिया जलीय माध्यम में तीव्र गति से होती है क्योंकि जलीय माध्यम में आयन मुक्त अवस्था में आ जाते हैं तथा वे तीव्रता से अभिक्रिया करते हैं। वहीं दूसरी ओर आण्विक अभिक्रियाओं की गति या वेग मन्द होता है।
(3) ताप का प्रभाव (Effect of Temperature ): जब अभिक्रिया के ताप में वृद्धि हो जाती है तो अभिकारक के अणुओं की गतिज ऊर्जा बढ़ जाती है जिससे अभिक्रिया का वेग बढ़ जाता है। यह माना जाता है कि 10°C ताप बढ़ाने पर अभिक्रिया का वेग सामान्य से दोगुना हो जाता है। 25°C तथा 35°C ताप पर अभिक्रिया के वेग नियतांकों का अनुपात, ताप गुणांक (Temperature Coefficient) कहलाता है, जिसका मान लगभग 2 से 3 होता है।
अतः

\(=\frac{k_{35^{\circ} \mathrm{C}}}{k_{25^{\circ} \mathrm{C}}}\)
(4) उत्प्रेरक का प्रभाव (Effect of Catalyst): उत्प्रेरक अभिक्रिया में अपरिवर्तित रहते हैं परन्तु इनकी उपस्थिति में अभिक्रिया का वेग बढ़ या घट जाता है जो कि उत्प्रेरक की प्रकृति पर निर्भर करता है। धनात्मक उत्प्रेरक अभिक्रिया की सक्रियण ऊर्जा को कम कर देता है जिससे निम्न ऊर्जा स्तर में उपस्थित अभिकारक के अणु भी उत्पाद बनाने लगते हैं और अभिक्रिया का वेग बढ़ जाता है।
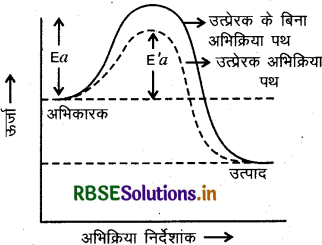
Ea = उत्प्रेरक की अनुपस्थिति में सक्रियण ऊर्जा
Ea = उत्प्रेरक की अनुपस्थिति में सक्रियण ऊर्जा
प्रश्न 4.
शून्यकोटि एवं प्रथम कोटि अभिक्रिया के लिए अर्द्धआयु काल की ज्ञात करने के लिए व्यजंक स्थापित कीजिए।
उत्तर:
अभिक्रिया में अभिकारक के आधे भाग को उत्पाद में परिवर्तित करने में जितना समय लगता है उसे उस अभिक्रिया का अर्द्ध-आयु काल या अर्धायु कहते हैं। इसे " से प्रदर्शित करते हैं।
(A) शून्य कोटि की अभिक्रिया के लिए अर्द्ध-आयु काल (Half life period for zero order reaction): शून्य कोटि की अभिक्रिया के लिए,
\(k=\frac{[\mathrm{A}]_0-[\mathrm{A}]}{t}\)
यहाँ पर 1 = t1/2 तथा
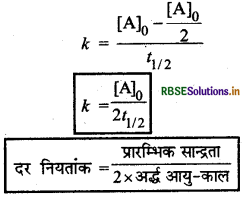
अत: शून्य कोटि की अभिक्रिया में अर्द्ध-आयु काल अभिकारक की प्रारम्भिक सान्द्रता के समानुपाती होता है अर्थात् प्रारम्भिक सान्द्रता पर निर्भर करता है।
(B) प्रथम कोटि की अभिक्रिया के लिए अर्द्ध-आयु काल (Half life period for first order reaction): प्रथम कोटि की अभिक्रिया के लिये,
\(k=\frac{2.303}{t} \log \frac{[\mathrm{A}]_0}{[\mathrm{~A}]}\)
यदि \(\mathrm{A}=\frac{[\mathrm{A}]_0}{2}\) तथा t = t1/2 तो

अतः प्रथम कोटि की अभिक्रिया का अर्द्ध-आयु काल अभिकारक की प्रारम्भिक सान्द्रता पर निर्भर नहीं करता है। प्रथम कोटि की अभिक्रिया में अर्द्ध-आयु काल की गणना वेग स्थिरांक से एवं वेग स्थिरांक की गणना अर्द्ध-आयु काल से की जा सकती है।
(C) nth कोटि की अभिक्रिया के लिए अर्द्ध-आयु काल (Half life period for nth order of reaction): nth कोटि की अभिक्रिया के लिये अर्द्ध-आयु काल (t1/2) निम्न व्यंजक द्वारा दिया जा सकता है
\(t_{1 / 2} \propto \frac{1}{(a)^{n-1}}\)
यहाँ a अभिकारक की प्रारम्भिक सान्द्रता है।
इसी तरह एक अभिक्रिया के लिए n अर्द्ध-आयु काल के पश्चात् बचे पदार्थ को निम्न सूत्र से ज्ञात कर सकते हैं
n अर्द्ध-आयु काल के बाद बचा पदार्थ = \(\frac{a}{(2)^n}\)
\(t_{1 / 2} \propto \frac{1}{(a)^{n-1}}\) की सहायता से निकाले गये अर्द्ध आयुकाल एवं
प्रारम्भिक सान्द्रता में निम्न प्रकार का सम्बन्ध होगा:
(i) शून्य कोटि की अभिक्रिया के लिये,
t1/2 « [A]o (यहाँ [A]o = प्रारम्भिक सान्द्रता)
(ii) प्रथम कोटि की अभिक्रिया के लिये,
\(t_{1 / 2} \propto \frac{1}{[\mathrm{~A}]_0^0}\)
अर्थात् अर्द्ध-आयु काल सान्द्रता पर निर्भर नहीं करता है।
(iii) द्वितीय कोटि की अभिक्रिया के लिये,
\(t_{1 / 2} \propto \frac{1}{[\mathrm{~A}]_0}\)
(iv) तृतीय कोटि की अभिक्रिया के लिये,
\(t_{1 / 2} \propto \frac{1}{[\mathrm{~A}]_0^2}\)
प्रश्न 5.
(i) शून्य कोटि अभिक्रिया के लिये समाकलित वेगव्यंजक का सूत्र स्थापित कीजिए।
(ii) एक शून्य कोटि अभिक्रिया के लिये अर्द्ध-आयु काल ज्ञात कीजिए जब इस अभिक्रिया का वेग स्थिरांक k = 3.7 x 10-14 molL-1 s-1 हो एवं अभिकारक की प्रारम्भिक सान्द्रता 0.074 mol L-1 हों।
(ii) सक्रियण ऊर्जा पर उत्प्रेरक के प्रभाव को दर्शाने वाले आरेख बनाइये।
उत्तर:
शून्य कोटि की अभिक्रिया के लिए समाकलित वेग समीकरण की व्युत्पत्ति (Derivation of Integrated Rate Expression for Zero Order Reaction)
A → उत्पाद
t = 0 समय पर,
सान्द्रता = [A]°
t = t समय पर,
सान्द्रता = [A]
शून्य कोटि की अभिक्रिया के लिए,
वेग = k [A]° ....(1)
वेग नियम या दर व्यंजक
वेग = \(\frac{-d[\mathrm{~A}]}{d t}\) .....(2)
चूँकि समीकरण (1) तथा समीकरण (2) दोनों ही दर को बताते हैं, अतः
\(\begin{aligned} k[\mathrm{~A}]^0 &=\frac{d[\mathrm{~A}]}{d t} \\ k &=-\frac{d[\mathrm{~A}]}{d t} \end{aligned}\)
- kdt =d [A] ......... (3)
समीकरण (3) का समाकलन करने पर,
- ∫kdt = ∫d[A]
[A] = -kt + C
यहाँ C = समाकलन स्थिरांक है।
यदि t= 0 तथा [A] = [A] तो इन मानों को समीकरण (4) में रखने पर,
[A] = - k x 0+C
[A] =C
C का मान समीकरण (4) में रखने पर,
[A] = - kt + [A]
kt = [A], - [A] ,
\(k=\frac{[\mathrm{A}]_0-[\mathrm{A}]}{t}\)

समय माना कि प्रारम्भिक सान्द्रता [A] = a mol L-1 है तथा t समय पश्चात् सान्द्रता [A] = (a - x) mol L-1 हो तो
kt = a - ( a - x )
kt = a - a + x
kt = x
k = \(\frac{x}{t}\)
समीकरण (5) तथा (6) शून्य कोटि की अभिक्रिया के लिए एकीकृत या समाकलित दर व्यंजक हैं।
(ii) वेग स्थिरांक (k) = 3.7 x 10-14 L-1 s-1
प्रारम्भिक सान्द्रता [A] = 0.074mol L-1
अर्द्ध-आयु काल (t1/2) = ?
\(t_{1 / 2}=\frac{[\mathrm{A}]_0}{2 k}=\frac{0.074}{2 \times 3.7 \times 10^{-4}}\)
\(\frac{0.074}{7 \cdot 4 \times 10^{-4}}=\frac{74 \times 10^{-3}}{74 \times 10^{-5}}\)
अर्द्ध-आयु काल = 1 x 102 s
(iii) अभिक्रिया का वेग प्रायोगिक परिस्थितियों पर निर्भर करता है। किसी भी रासायनिक अभिक्रिया को प्रभावित करने वाले मुख्य कारक निम्न हैं:
(1) अभिकारकों का सान्द्रण (Concentration of Reactants): द्रव्य. अनुपाती क्रिया के नियमानुसार, "अभिक्रिया का वेग, अभिकारकों की सान्द्रता के गुणनफल के समानुपाती होता है अर्थात् अभिकारकों की सान्द्रता में वृद्धि करने. से अभिक्रिया का वेग बढ़ जाता है परन्तु शून्य कोटि की अभिक्रिया के सान्द्रण परिवर्तन का अभिक्रिया के वेग पर कोई प्रभाव नहीं पड़ता है।"
उदाहरणार्थ: अभिक्रिया PC3 + Cl2 → PCl5 में यदि PCl3 या Cl2 का सान्द्रण बढ़ा दिया जाये तो अभिक्रिया का वेग भी बढ़ जाता है।
(2) अभिकारकों की प्रकृति (Nature of Reactants): अभिक्रिया का वेग अभिकारकों की प्रकृति पर निर्भर करता है। अभिक्रिया के दौरान अभिकारकों में उपस्थित बन्ध टूटते हैं, जबकि उत्पादों में नये बन्धों का निर्माण होता है। यदि अभिक्रिया में टूटने वाले बन्धों की संख्या अधिक होती है तो यह अभिक्रिया मन्द गति से होती है। इसी प्रकार यदि टूटने वाले बन्धों की संख्या कम होती है तो अभिक्रिया तीव्र गति से सम्पन्न होती है।
उदाहरणार्थ: आयनिक अभिक्रिया जलीय माध्यम में तीव्र गति से होती है क्योंकि जलीय माध्यम में आयन मुक्त अवस्था में आ जाते हैं तथा वे तीव्रता से अभिक्रिया करते हैं। वहीं दूसरी ओर आण्विक अभिक्रियाओं की गति या वेग मन्द होता है।
(3) ताप का प्रभाव (Effect of Temperature ): जब अभिक्रिया के ताप में वृद्धि हो जाती है तो अभिकारक के अणुओं की गतिज ऊर्जा बढ़ जाती है जिससे अभिक्रिया का वेग बढ़ जाता है। यह माना जाता है कि 10°C ताप बढ़ाने पर अभिक्रिया का वेग सामान्य से दोगुना हो जाता है। 25°C तथा 35°C ताप पर अभिक्रिया के वेग नियतांकों का अनुपात, ताप गुणांक (Temperature Coefficient) कहलाता है, जिसका मान लगभग 2 से 3 होता है।
अतः,
\(=\frac{k_{35^{\circ} \mathrm{C}}}{k_{25^{\circ} \mathrm{C}}}\)
(4) उत्प्रेरक का प्रभाव (Effect of Catalyst): उत्प्रेरक अभिक्रिया में अपरिवर्तित रहते हैं परन्तु इनकी उपस्थिति में अभिक्रिया का वेग बढ़ या घट जाता है जो कि उत्प्रेरक की प्रकृति पर निर्भर करता है। धनात्मक उत्प्रेरक अभिक्रिया की सक्रियण ऊर्जा को कम कर देता है जिससे निम्न ऊर्जा स्तर में उपस्थित अभिकारक के अणु भी उत्पाद बनाने लगते हैं और अभिक्रिया का वेग बढ़ जाता है।

Ea = उत्प्रेरक की अनुपस्थिति में सक्रियण ऊर्जा
Ea = उत्प्रेरक की अनुपस्थिति में सक्रियण ऊर्जा
प्रश्न 6.
(i) प्रथम कोटि की अभिक्रिया के लिये समाकलित वेग व्यंजक का सूत्र स्थापित कीजिए।
(ii) एक ऊष्माक्षेपी अभिक्रिया के लिये स्थितिज ऊर्जा एवं अभिक्रिया निर्देशांक के मध्य आरेख बनाइये जिसमें क्रियाकारक व उत्पाद के लिये सक्रियण ऊर्जा, सक्रियत संकर व स्थितिज ऊर्जा को दर्शाया गया हो?
उत्तर:
(i) प्रथम कोटि की अभिक्रिया के लिये समाकलित वेग व्यंजक
A→ उत्पाद
t = 0 समय पर, सान्द्रता = [A]o
t = t समय पर, सान्द्रता = [A]
प्रथम कोटि की अभिक्रिया के लिए,
वेग = k [A] ........(1)
वेग = \(\frac{d[\mathrm{~A}]}{d t}\)
चूँकि दोनों समीकरण अर्थात् समीकरण (1) तथा (2) दोनों ही दर को बताते हैं, अतः
\(k[\mathrm{~A}]=-\frac{d[\mathrm{~A}]}{d t}\)
⇒ \(k d t=-\frac{d[\mathrm{~A}]}{[\mathrm{A}]}\) ............ (3)
समीकरण (3) का समाकलन करने पर,
\(\int k d t=-\int \frac{d[\mathrm{~A}]}{[\mathrm{A}]}\)
जहाँ C = समाकलन स्थिरांक है।
यदि t = 0 तथा [A] = [A], तबइनमानों को समीकरण (4) में रखने पर,
- In [A]o = k x 0 + C
= - In [A]o =C
C का मान समीकरण (4) में रखने पर
- In [A] = kt – In [A]
In [A]o - In [A] = kt
⇒ \(\text { In } \frac{[\mathrm{A}]_0}{[\mathrm{~A}]}=k t\)
⇒ \(k=\frac{1}{t} \ln \frac{[\mathrm{A}]_0}{[\mathrm{~A}]}\)
यदि In = 2:303 log तो
⇒ \(k=\frac{1}{t} 2.303 \log \frac{[\mathrm{A}]_0}{[\mathrm{~A}]}\)
⇒ \(k=\frac{2 \cdot 303}{t} \log \frac{[\mathrm{A}]_0}{[\mathrm{~A}]}\)

यदि [A]o = a तथा [A] = a - x तो,
\(k=\frac{2 \cdot 303}{t} \log \frac{a}{(a-x)}\)
(ii) ऊष्माक्षेपी अभिक्रिया के लिए ऊर्जा चित्र (Energy Profile for Exothermic Reaction):
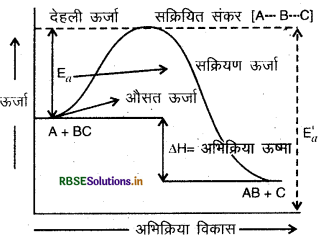
अतः देहली ऊर्जा = सक्रियण ऊर्जा + अभिकारक की ऊर्जा
प्रश्न 7.
अभिक्रिया के वेग पर उत्प्रेरक की उपस्थिति का क्या प्रभाव पड़ता है?
उत्तर:
उत्प्रेरक का प्रभाव (Effect of Catalyst): उत्प्रेरक वह पदार्थ है जो स्वयं स्थायी रूप से परिवर्तित हुए बिना अभिक्रिया के वेग को परिवर्तित कर देता है। उदाहरणार्थ: MnO2 निम्नांकित अभिक्रिया को उत्प्रेरित कर वेग में महत्त्वपूर्ण वृद्धि करता है।
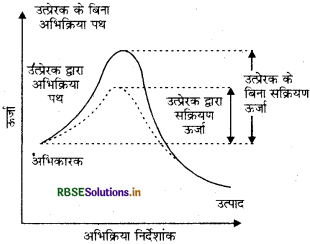
उत्प्रेरक की क्रिया को मध्यवर्ती संकुल सिद्धान्त से समझा जा सकता है। इस सिद्धान्त के अनुसार उत्प्रेरक रासायनिक अभिक्रिया में भाग लेकर अभिकारकों के साथ अस्थायी बन्ध बनाती है जो कि मध्यवर्ती संकुल में परिणत होता है। इसका अस्तित्व क्षणिक होता है तथा यह वियोजित होकर उत्पाद एवं उत्प्रेरक देता है। यह विश्वास किया जाता है कि उत्प्रेरक एक वैकल्पिक पथ अथवा क्रियाविधि से अभिकारकों वे उत्पादों के मध्य सक्रियण ऊर्जा कम करके एवं इस प्रकार ऊर्जा अवरोध में कमी करके अभिक्रिया सम्पन्न करता है जैसा कि चित्र में दर्शाया गया है। आरेनिअस समीकरण से यह स्पष्ट है कि सक्रियण ऊर्जा का मान जितना कम होगा अभिक्रिया को वेग उतना अधिक होगा।
उत्प्रेरक की लघु मात्रा अभिकारकों की दीर्घ मात्रा को उत्प्रेरित कर सकती है। उत्प्रेरक अभिक्रिया की गिब्ज ऊर्जा, ∆G में बदलाव नहीं करता। यह स्वत:प्रवर्तित (spontaneous) अभिक्रियाओं को उत्प्रेरित करता है, परन्तु स्वत:अप्रवर्तित अभिक्रिया को उत्प्रेरित नहीं करता। यह भी पाया गया है कि उत्प्रेरक किसी अभिक्रिया के साम्य स्थिरांक में परिवर्तन नहीं करता, किन्तु यह साम्य को शीघ्र स्थापित करने में सहायता करता है। यह अग्र एवं प्रतीत दोनों अभिक्रियाओं को समान रूप से उत्प्रेरित करता है जिससे साम्यावस्था अपरिवर्तित रहती है, परन्तु शीघ्र स्थापित हो जाती हैं।
आंकिक प्रश्न:
प्रश्न 1.
प्लेटिनम की सतह पर NH3 का विघटन शून्य कोटि की अभिक्रिया है। यदि इस अभिक्रिया का वेग स्थिरांक (k) 4 x 10-3 m s-1 है, तो NH3 की प्रारम्भिक सांद्रता 0.1 M से घटकर 0.064 M होने में कितना समय लगेगा?
उत्तर:
प्लेटिनम सतह पर NH3 का विघटन शून्य कोटि की अभिक्रिया है।
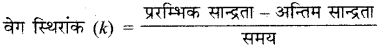

= 0.009 x 103 s
= 9s.
प्रश्न 2.
प्रथम कोटि की अभिक्रिया के लिए वेग स्थिरांक 60 s-1 है। अभिकारक को अपनी प्रारम्भिक सान्द्रता से घट कर 1/16 वाँ भाग रह जाने में कितना समय लगेगा?
उत्तर:
प्रथम कोटि की अभिक्रिया के लिए,
\(t=\frac{2 \cdot 303}{k} \log \frac{[\mathrm{A}]_0}{[\mathrm{~A}]}\)
चूँकि प्रश्नानुसार, अभिकारक प्रारम्भिक सान्द्रता का केवल 1/16 भाग रह जाता है।
अतः [A] = [A]1/16

t = 4.62 x 10-25

प्रश्न 3.
H2O2 के प्रथम कोटि विघटन के दर स्थिरांक के लिये निम्न समीकरण दिया जाता है:
\(\log k=14.2-\frac{1.0 \times 10^4 \mathrm{~K}}{T}\)
इस अभिक्रिया के लिये Ea और दर स्थिरांक k को परिकलित कीजिए अगर इसकी अर्द्ध-आयु 200 मिनट हो। (दिया गया : R = 8.314JK-1 mol-1)
उत्तर:
दिया गया है:
\(\log \mathrm{K}=14.2-\frac{1.0 \times 10^4 \mathrm{~K}}{\mathrm{~T}}\)
अतः अरिनियस समीकरण के अनुसार:
InK = InA - \(\frac{\mathrm{E}_a}{\mathrm{RT}}\)
समी. (1) व (2) की तुलना करने पर
\(\frac{\mathrm{E}_a}{\mathrm{R}}\) = 1.0 x 104
Ea = 1.0 x 104 x 8.314
= 8.314 x 104 J K-I mol-1
तथा
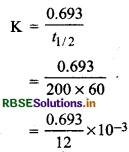
= 0.05775 x 10-3
= 5.77 x 105
प्रश्न 4.
एक प्रथम कोटि की अभिक्रिया में 20% वियोजन होने में 40 मिनट लगते हैं। अर्धायु की गणना कीजिए।
(log10 = 1, log, 2 = 0.3010)
उत्तर:
प्रथम कोटि के लिए,

= 124.08 min
प्रश्न 5.
प्लेटिनम की सतह पर अमोनिया के अपघटन से हाइड्रोजन एवं नाइट्रोजन गैसें प्राप्त होती हैं। शून्य कोटि की इस अभिक्रिया का वेग स्थिरांक 1.5 x 104 mol s-1 है तब N2 एवं H2 के बनने का वेग ज्ञात कीजिए।
उत्तर:
(नोट: शून्य कोटि अभिक्रिया के वेग स्थिरांक का मात्रक mol L-1 s-1 होता है। mol L-1 को मोलरता 'M' के पदों में भी व्यक्त किया जा सकता है।)
अमोनिया का विघटन निम्नवत् होता है:
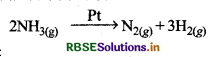
अमोनिया के विघटन की दर
\(k=-\frac{1}{2} \frac{d\left[\mathrm{NH}_3\right]}{d t}\)
= 1.5 x 10-4 Ms-1
नाइट्रोजन के बनने की दर
\(\frac{d\left[\mathrm{~N}_2\right]}{d t}=-\frac{1}{2} \frac{d\left[\mathrm{NH}_3\right]}{d t}\) = 1.5 x 10-4 Ms-1
हाइड्रोजन बनने की दर
\(\frac{1}{3} \frac{d\left[\mathrm{H}_2\right]}{d t}=-\frac{1}{2} \frac{d\left[\mathrm{NH}_3\right]}{d t}\)
= 1.5 x 10-4 Ms-1
⇒ \(\frac{d\left[\mathrm{H}_2\right]}{d t}\)
= 3 x 1.5 x 10-4 Ms-1
= 4.5 x 10-4 M s-1
प्रश्न 6.
एक प्रथम कोटि की अभिक्रिया में 25% वियोजन होने में 25 मिनट लगते हैं। t1/2 की गणना कीजिए।
[दिया गया है : log 2 = 0.3010, log 3 = 0.4771, log 4 = 0.6021]
उत्तर:प्रथम कोटि के लिए,

= 124.08 min
प्रश्न 7.
A → B अभिक्रिया के लिए, अभिकारक की सांद्रता 0.05 M से 20 मिनट में परिवर्तित होकर 0.03 M हो जाती है। औसत वेग की गणना सेकंड तथा मिनट दोनों इकाइयों में कीजिए।
उत्तर:

= \(-\left[\frac{0.05-0.03}{20}\right]\)
=
औसत वेग = 0.001 molL-1 min-1
औसत वेग = \(\frac{0.001}{1200}\)
औसत वेग = 1.66 x 10-6 mol L-1 s-1
प्रश्न 8.
प्रथम कोटि अभिक्रिया की अर्द्धयु काल 10 sec. है, तो इसके वेग स्थिरांक की गणना कीजिए।
उत्तर:
प्रथम कोटि अभिक्रिया की अर्धायु काल
\(t_{1 / 2}=\frac{0.693}{k}\)
यहाँ k = वेग स्थिरांक
t1/2 = 10 sec.
वेगांस्थरांक
\(k=\frac{0.693}{t_{1 / 2}}\)
= \(\frac{0.693}{10 \mathrm{sec}}\)
= 0.0693 s-1

प्रश्न 9.
दर्शाइए कि प्रथम कोटि की अभिक्रिया में 99% अभिक्रिया पूर्ण होने में लगा समय 90% अभिक्रिया पूर्ण होने में लगने वाले समय से दोगुना होता है।
उत्तर:
99% अभिक्रिया पूर्ण होने में लगा समय,

समी. (1) में (2) को भाग देने पर,
\(\frac{t_{99 \%}}{t_{90 \%}}=\frac{\left(\frac{2 \cdot 303}{k}\right) \times 2}{\frac{2 \cdot 303}{k}}\)
अतः सिद्ध हुआ कि प्रथम कोटि की अभिक्रिया में 99% अभिक्रिया पूर्ण होने में लगा समय 90% अभिक्रिया पूर्ण होने में लगने वाले समय से. दोगुना होता है।
प्रश्न 10.
दर्शाइए कि प्रथम कोटि अभिक्रिया के लिए 75% पूर्ण होने में लगा समय अर्द्ध-आयु का दोगुना होता है।
उत्तर:
75% अर्थात् तीन-चौथाई अभिक्रिया पूर्ण होने में लगा समय
\(t_{3 / 4}=\frac{2 \cdot 303}{k} \log \frac{[\mathrm{A}]_0}{[\mathrm{~A}]}\)
[A] = a - x = a - 3/4 a
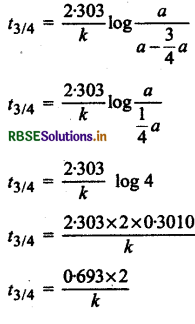
∴ हम जानते हैं कि अर्द्ध-आयु काल t1/2 = \(\frac{0.693}{k}\)
t3/4 = t1/2 x 2 ........... (2)
t3/4 = 2 x अर्द्ध-आयु
प्रश्न 11.
किसी प्रथम कोटि की अभिक्रिया को 50% पूर्ण होने के लिए 300K पर 40 मिनट लगते हैं और 320 K पर 20 मिनट लगते हैं। अभिक्रिया की सक्रियण ऊर्जा परिकलित कीजिए।
(दिया गया है. : log 2 = 0.3010; log 4 = 0.6021, R = 8.314 JK-1 mol-1)
उत्तर:
प्रथम कोटि अभिक्रिया के लिए
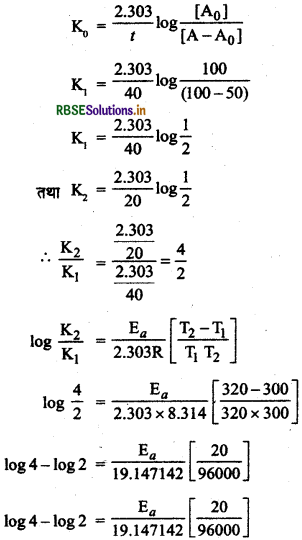

Ea = t 27662.65 J/mol
Ea = 27.662 KJ/mol
प्रश्न 12.
एक प्रथम कोटि की अभिक्रिया में 20% वियोजन होने में 40 मिनट लगते हैं। t1/2 की गणना कीजिए।
उत्तर:

k = 0.0575 x [log10 - log (2)3]
k = 0.575 [1 - 3 log2]
k = 0.575 [1 - 3 x 0.3010]
k = 0.575 x 0.097
= 5.55 x 10-3
अर्धायु
\(\left(t_{1 / 2}\right)=\frac{0.693}{k}\)
= \(\frac{0.693}{5.55 \times 10^{-3}}\) = 0.1248 x 10-3
= 124.8 मिनट
प्रश्न 13.
किसी अभिक्रिया में A → उत्पाद के लिए k = 2.0 x 10-2 s-1 है। यदि A की प्रारम्भिक सान्द्रता 1.0 mol L-1 हो तो 100s के पश्चात् इसकी सान्द्रता क्या रह जायेगी?
उत्तर:
k = 2.0 x 10-2 s-1
[A]o = 1.0 mol L-1
t = 100s
[A] = ?
अतः
\(k=\frac{2 \cdot 303}{t} \log \frac{[\mathrm{A}]_0}{[\mathrm{~A}]}\)
या 2.0 x 10-2 \(=\frac{2.303}{100}\) [log10 - log[A]]
या
\(-\log [A]=\frac{2.0 \times 10^{-2} \times 100}{2.303}\)
या
- log [A] =0.8684
log [A] = - 0.8684
[A] = Antilog (-0.8684)
[A] = Antilog \((\overline{1} \cdot 1316)\)
[A] = 0.1354 mol L-1
अतः 100 s के पश्चात् सान्द्रता 0.1354 mol L-1 रह जायेगी।

प्रश्न 14.
एक प्रथम कोटि की अभिक्रिया का 50% (आधा भाग) 10 मिनट में समाप्त होता है। इस अभिक्रिया का 99% भाग कितने समय में पूरा होगा?
उत्तर:
प्रथम कोटि की वेग-अभिक्रिया का समीकरण
\(k=\frac{2303}{t} \log _{10}\left(\frac{a}{a-x}\right)\)
प्रश्नानुसार,
t = 10 मिनट तथा x = a/2
∴ वेग स्थिरांक k = 2303/10 x log \(\left(\frac{a}{a-a / 2}\right)\)
= 2303/10 x log2
= 2.303 x 0.30102
= 0.06932 प्रति मिनट
पुनः अभिक्रिया के 99% भाग पूरा होने में लगे समय के लिए अभिक्रिया के समीकरण से
\(k=\frac{2303}{t} \log \left(\frac{a}{a-\frac{99 a}{100}}\right)\)
या
\(t=\frac{2.303}{0.06932} \log (100)=\frac{2.303}{0.06932} \times 2\)
= 66.45 मिनट अतः अभीष्ट समय 66.45 मिनट है।
प्रश्न 15.
एक यौगिक के 1 मोल से प्रारम्भ करने पर यह ज्ञात हुआ कि 1 घण्टे में अभिक्रिया तीन-चौथाई पूर्ण हो जाती है। वेग स्थिरांक की गणना कीजिए यदि अभिक्रिया प्रथम कोटि का अनुसरण करती
उत्तर:
प्रथम कोटि की अभिक्रिया के लिए, है।
k = \(\frac{2.303}{t} \log \frac{a}{a-x}\)
a = 1 मोल, a - x = 1 - 3/4 = 1/4 मोल
t =1 घण्टा
\(k=\frac{2.303}{1} \log \frac{1}{\frac{1}{4}}\) = 2.303 log 4
= 1.386 प्रति घण्टा
प्रश्न 16.
एक प्रथम कोटि की अभिक्रिया 10 मिनट में 20% पूरी हो जाती है। अभिक्रिया के 75% पूरा होने में कितना समय लगेगा?
उत्तर:
प्रथम कोटि की अभिक्रिया का समीकरण
\(k=\frac{2.303}{t} \log _{10}\left(\frac{a}{a-x}\right)\)
प्रश्नानुसार, t = 10 मिनट, x = \(\frac{20 a}{100}\)
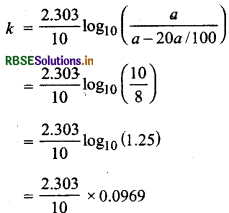
= 0.0223 प्रति मिनट
पुनः अभिक्रिया के 75% पूरा होने में लगे समय के लिए अभिक्रिया के समीकरण से

= 62.18 मिनट
प्रश्न 17.
एक प्रथम कोटि की अभिक्रिया के लिए अर्द्ध-आयु 69.3 सेकण्ड है। इस अभिक्रिया के लिए वेग स्थिरांक की गणना कीजिए।
उत्तर:
प्रथम कोटि की अभिक्रिया के लिए,
\(k=\frac{0.6932}{t_{1 / 2}}=\frac{0.6932}{69.3}=10^{-2} \mathrm{~s}^1\)
प्रश्न 18.
प्रथम कोटि की एक अभिक्रिया में 50 सेकण्ड में पदार्थ की सान्द्रता प्रारम्भिक सान्द्रता की आधी रह जाती है। इसके वेग स्थिरांक की गणना कीजिए।
उत्तर:
प्रथम कोटि की अभिक्रिया के लिए,
\(k=\frac{0.6932}{t_{1 / 2}}=\frac{0.6932}{50}=\frac{6.932}{5} \times 10^{-2}\)
= 1.38 x 10-2 s-1
प्रश्न 19.
किसी प्रथम कोटि की अभिक्रिया का वेग स्थिरांक 7 x 10-4 प्रति सेकण्ड है। अपनी प्रारम्भिक सान्द्रता के 1/4 तक कम होने के लिए अभिकारक द्वारा लिए गए समय की गणना कीजिए। [log.2 = 0.3010]
उत्तर:
प्रथम कोटि की अभिक्रिया का वेग स्थिरांक
\(k=\frac{2.303}{t} \log _{10} \frac{a}{1-x}\)
k = 7 x 10-4 s-1
मान अभिकारक की प्रारम्भिक सान्द्रता = a
अत: अभिकारक की शेष मात्रा a - x = a/4
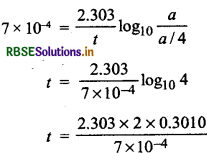
0.198 x 10 = 1.98 x 103 s

प्रश्न 20.
प्रथम कोटि की अभिक्रिया के वेग स्थिरांक का सूत्र लिखिए। किसी अभिक्रिया में अभिकारक के सान्द्रण में 20 मिनट में 20% तथा 40 मिनट में 40% की कमी होती है। अभिक्रिया की कोटि की गणना कीजिए। प्रथम कोटि की अभिक्रिया के लिए वेग स्थिरांक का व्यंजक लिखिए।
उत्तर:
प्रथम कोटि की अभिक्रिया के लिए वेग स्थिरांक का सूत्र
\(k=\frac{2.303}{t} \log \frac{a}{a-x}\)
जहाँ, k, = वेग स्थिरांक, t = लगा समय, a = प्रारम्भिक मात्रा, a - x
= बची हुई मात्रा प्रथम कोटि की अभिक्रिया के लिए k = x/t
1. यदि t = 20% t = 20 मिनट,x = 20
k1 = \(\frac{20}{20}\) mol L-1 min-1
2. यदि 1 = 40% t = 40 मिनट, x = 40
k2 = \(\frac{40}{40}\) = 1 mol L-1 min-1 k, तथा k, बराबर हैं। अतः अभिक्रिया शून्य कोटि की होगी।
प्रश्न 21.
प्रथम कोटि की अभिक्रिया के वेग स्थिरांक के लिए व्यंजक लिखिए तथा सन्निहित पदों को समझाइए। दर्शाइए कि प्रथम कोटि की अभिक्रिया का अर्द्ध-आयुकाल अभिकारकों के प्रारम्भिक सान्द्रण पर निर्भर नहीं करता है।
उत्तर:
प्रथम कोटि की अभिक्रिया के लिए k = 2.303/t 1og10 \(\frac{a}{a-x}\)
जहाँ t = समय, a = अभिकारक का प्रारम्भिक सान्द्रण तथा (a - x), t समय बाद सान्द्रण है।
अभिक्रिया में आधा सान्द्रण समाप्त होने के लिए,
परिवर्तित सान्द्रण (x) = 0.5 a, t = t1/2 (अर्द्ध-आयुकाल)

उपर्युक्त समीकरण में सान्द्रण का कोई पर नहीं है; अतः प्रथम कोटि की अभिक्रिया का अर्द्ध-आयुकाल अभिकारक के प्रारम्भिक सान्द्रण पर निर्भर नहीं करता है।
प्रश्न 22.
सिद्ध कीजिए कि प्रथम कोटि की अभिक्रिया को 3/4 पूर्ण करने में लगा समय, अर्द्ध-क्रिया को पूर्ण करने में लगे समय का दोगुना होता है।
उत्तर:
प्रथम कोटि की अभिक्रिया का समीकरण
\(k=\frac{2.303}{t} \log \frac{a}{a-x}\)
माना प्रारम्भिक मात्रा 100 है। x = 75
\(k=\frac{2.303}{t_{3 / 4}} \log \frac{100}{25}\)
या \(t_{3 / 4}=\frac{2.303}{k} \log 4\) ........ (i)
इसी प्राकर, \(t_{1 / 2}=\frac{2.303}{k} \log 2\) .......... (ii)
समी. (i) को समी. (ii) से भाग देने पर,

अभिक्रिया का 3/4 भाग पूर्ण करने में लगा समय = 2 x अर्द्ध-आयु
प्रश्न 23.
प्रथम कोटि की एक अभिक्रिया में यदि कोई पदार्थ अपनी प्रारम्भिक मात्रा का 100 मिनट में आधा रह जाता है तो बताइए कि कितने समय में यह अपनी प्रारम्भिक मात्रा का एक-चौथाई रह जायेगा?
उत्तर:
दिया गया है, t1/2 = 100 min
\(k=\frac{0.6932}{100}\)
माना प्रारम्भिक मात्रा a है
t समय पश्चात् बची हुर्द मात्रा (a - x) = a/4
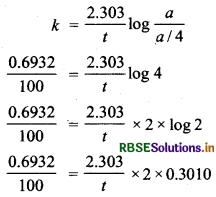
t = 200 min
प्रश्न 24.
एक प्रथम कोटि की अभिक्रिया का अद्ध-आयुकाल 60 मिनट है। कितने समय में अभिक्रिया 90% पूर्ण हो जायेगा?
उत्तर:
प्रथम कोटि की अभिक्रिया का समीकरण
\(k=\frac{2.303}{t} \log \frac{a}{a-x}\)
प्रश्नानुसार, t = 60 मिनट
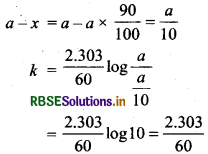
= 199 min 60

प्रश्न 25.
एक प्रथम कोटि की अभिक्रिया का आधा भाग (50%) 10 मिनट में पूर्ण होता है। इस अभिक्रिया का 80% भाग कितने समय में पूर्ण होगा?
उत्तर:
प्रथम कोटि की अभिक्रिया के लिए \(k=\frac{0.6932}{t_{1 / 2}}\)
\(k=\frac{0.6932}{10}\)
= 6.932 x 10-2 min-1
मान पदार्थ की प्रारम्भिक मात्रा a है।
t समय पश्चात् बची हुई मात्रा a - x = a - 8a = 0.2a
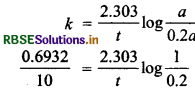
t = 23.03 min.
प्रश्न 26.
एक प्रथम कोटि की अभिक्रिया में विशिष्ट अभिक्रिया वेग का मान 4.2 x 10-2 s-1 है। 5 g अभिकारक को 2.5 g में परिवर्तित होने में कितना समय लगेगा?
उत्तर:
दिया है:
k = 4.2 x 10-2 s-1
[A]o = 5g
[A] = 2.5g

∴ t = 0.165 x 102
= 16.5s
प्रश्न 27.
अभिक्रिया A→ B की अभिक्रिया दर दुगुनी हो जाती है जब A की सान्द्रता को चार गुना बढ़ाया जाता है। अभिक्रिया की कोटि बताइए।
उत्तर:
माना कि अभिक्रिया की कोटि n है।
अतः r1 = K[A]n ........ (1)
2r1 = K[4A]n ........ (2)
समीकरण (2) में समीकरण (1) का भाग देने पर
2 = 4n
अत: 2n = 1
2 = (2)2n
अभिक्रिया की कोटि = 1/2
प्रश्न 28.
अभिक्रिया 2N2O5(g) → 2NO2(g) + O2(g) का अध्ययन किया गया एवं निम्नलिखित आँकड़े प्राप्त हुए
अभिक्रिया के लिये.
(i) कोटि,
(ii) वेग नियम,
(iii) वेग स्थिरांक ज्ञात कीजिए।
उत्तर:
माना कि अभिक्रिया की कोटि = n
वेग α [N2O5]n
(34 x 10-5) α (1.13 x 10-2)n ......... (i)
(25 x 10-5) α (0.84 x 10-2)n .......... (ii)
समीकरण (i) को समीकरण (ii) से भाग देने पर,
\(\frac{34 \times 10^{-5}}{25 \times 10^{-5}}=\frac{\left(1.13 \times 10^{-2}\right)^n}{\left(0.84 \times 10^{-2}\right)^n}\)
1.36 = (1.36)n
(1.36)1 = (1.36)n
(i) अभिक्रिया की कोटि =1
(ii) वेग स्थिरांक, k = = [N2O5]
(iii) 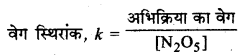
= \(\frac{18 \times 10^{-5}}{0.62 \times 10^{-2}}\)
= 0.029 min-1
विभिन्न प्रतियोगी परीक्षाओं में पूछे गये:
प्रश्न 1.
प्रथम कोटि अभिक्रिया के लिए यदि वेग नियतांक k हो, तो अभिक्रिया के 99% को पूरा करने के लिए आवश्यक समय (t) इसके द्वारा दिया जाएगा:
(a) t = 2.3030/k
(b) t = 0.693/k
(c) t = 6.906/k
(d) t = 4.6.6/k
उत्तर:
(d) t = 4.6.6/k

प्रश्न 2.
रासायनिक अभिक्रिया,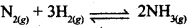 के लिए सही विकल्प है:
के लिए सही विकल्प है:
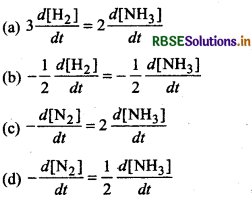
उत्तर:
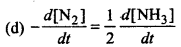
प्रश्न 3.
जब अभिकारक की प्रारम्भिक सान्द्रता को दुगुना किया जाता है, तो शून्य कोटि अभिक्रिया के लिए अर्ध-आयु काल:
(a) तिगुना होता है
(b) दुगुना होता है
(c) आधा होता है
(d) अपरिवर्तित रहता है
उत्तर:
(b) दुगुना होता है
प्रश्न 4.
एक प्रथम कोटि का विशिष्ट अभिक्रिया वेग 10-2 s-1 है। 20 g अभिकारक के 5 g तक होने में कितना समय लगेगा?
(a) 238.65
(b) 138.6s
(c) 346.5s
(d) 693.05
उत्तर:
(b) 138.6s
प्रश्न 5.
एक काल्पलिक अभिक्रिया, x2 + Y2 → 2XY की क्रियाविधि नीचे दी गई है:
(i) x2 → x + x (द्रुत)
(ii) x + Y2 = XY + Y (धीमी)
(iii) x + Y → xY (द्रुत)
अभिक्रिया की समग्र (कुल) कोटि होगी:
(a)1
(b) 2
(c) 0
(d) 1.5
उत्तर:
(d) 1.5
प्रश्न 6.
प्रथम कोटि एवं द्वितीय कोटि अभिक्रियाओं में सही विभिन्नता है:
(a) प्रथम कोटि की अभिक्रिया को उत्प्रेरित किया जा सकता है; द्वितीय कोटि की अभिक्रिया को उत्प्रेरित नहीं किया जा सकता है।
(b) प्रथम कोटि की अभिक्रिया की अर्थ-आयु [A]0 पर निर्भर नहीं है; द्वितीय कोटि की अभिक्रिया की अर्ध-आयु [A]0 पर निर्भर
(c) प्रथम कोटि की अभिक्रिया का वेग अभिकारक की सान्द्रताओं पर निर्भर नहीं करता है; द्वितीय कोटि की अभिक्रिया का वेग अभिकारक की सान्द्रताओं पर निर्भर करता है।
(d) प्रथम कोटि की अभिक्रिया का वेग अभिकारक की सान्द्रताओं पर निर्भर करता है; द्वितीय कोटि की अभिक्रिया का वेग अभिकारक की सान्द्रताओं पर निर्भर नहीं करता है
उत्तर:
(b) प्रथम कोटि की अभिक्रिया की अर्थ-आयु [A]0 पर निर्भर नहीं है; द्वितीय कोटि की अभिक्रिया की अर्ध-आयु [A]0 पर निर्भर
प्रश्न 7.
H2O2 का विघटन एक प्रथम-कोटि की अभिक्रिया है। पचास मिनट में इस प्रकार के विघटन में H2O2 की सान्द्रता घटकर 0.5 से 0.125 M हो जाती है। जब H2O2 की सान्द्रता 0.5 M पहुँचती है, तो O2 के बनने की दर होगी
(a) 6.93 x 10-4 mol min-1
(b) 2.66 L min-1 STP पर
(c) 1.34 x 10-2 mol min-1
(d) 6.93 x 10-2 mol min-1
उत्तर:
(d) 6.93 x 10-2 mol min-1
प्रश्न 8.
किसी रासायनिक अभिक्रिया में उत्प्रेरक के योग से निम्नलिखित में से कोन-सी मात्रा बदलती है?
(a) एन्ट्रॉपी
(b) आंतरिक ऊर्जा
(c) ऐन्थैल्पी
(d) सक्रियण ऊर्जा।
उत्तर:
(a) एन्ट्रॉपी
प्रश्न 9.
प्रकाश रासायनिक तुल्यांक के नियमानुसार अवशोशित ऊर्जा (erg/ mol में) को दर्शाया जाएगा। (h = 6.62 x 10-27 erg, c = 3 x 101 cm s-1, N, = 6.02 x 1023 mol-1)
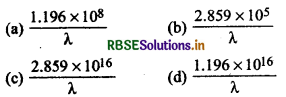
उत्तर:
\(\text { (b) } \frac{2.859 \times 10^5}{\lambda}\)
प्रश्न 10.
एक क्रिया दो घण्टे में 50% तथा 4 घण्टे में 75% पूर्ण होती है। तब अभिक्रिया की कोटि है:
(a) 1
(b) 2.
(c) 3
(d) 0
उत्तर:
(a) 1

- RBSE Class 12 Chemistry Notes Chapter 16 दैनिक जीवन में रसायन
- RBSE Class 12 Chemistry Notes Chapter 15 बहुलक
- RBSE Class 12 Chemistry Notes Chapter 14 जैव-अणु
- RBSE Class 12 Chemistry Notes Chapter 13 ऐमीन
- RBSE Class 12 Chemistry Notes Chapter 12 ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
- RBSE Class 12 Chemistry Notes Chapter 11 ऐल्कोहॉल, फीनॉल एवं ईथर
- RBSE Class 12 Chemistry Notes Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
- RBSE Class 12 Chemistry Notes Chapter 9 उपसहसंयोजन यौगिक
- RBSE Class 12 Chemistry Notes Chapter 8 d- एवं f-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम