RBSE Class 12 Chemistry Important Questions Chapter 3 वैद्युत रसायन
Rajasthan Board RBSE Class 12 Chemistry Important Questions Chapter 3 वैद्युत रसायन Important Questions and Answers.
Rajasthan Board RBSE Solutions for Class 12 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 12. Students can also read RBSE Class 12 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 12 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 12 Chemistry Chapter 3 Important Questions वैद्युत रसायन
बहुविकल्पीय प्रश्न:
प्रश्न 1.
Mg, Cu, Na तथा Au की सक्रियता का सही क्रम है:
(1) Au > Cu > Mg > Na
(2) Mg > Cu> Au > Na
(3) Na > Mg > Cu>Au
(4) Cu> Mg > Na > Au
उत्तर:
(3) Na > Mg > Cu>Au
प्रश्न 2.
चार धातुओं A,B, C, D के मानक इलेक्ट्रोड विभव (E0) क्रमशः + 1.5 V, - 20V,+ 0.34V तथा - 0.76 V हैं। इन धातुओं की घटती हुई सक्रियता का क्रम है:
(1) A >C > D > B
(2) A > B > D >C
(3) B > D > C >A
(4) D > A > B > C
उत्तर:
(3) B > D > C >A

प्रश्न 3.
A, B और C तत्वों का मानक अपचयन विभव क्रमशः + 0.68 V, - 0.50 V और - 2.5 V है। उनकी अपचयन शक्ति का क्रम है:
(1) A > B >C
(2) A > C > B
(3) C > B > A
(4) B > C > A
उत्तर:
(2) A > C > B
प्रश्न 4.
धातु जो हाइड्रोक्लोरिक अम्ल से H, विस्थापित नहीं कर सकती है, वह है:
(1) Zn
(2) Cu
(3) Mg
(4) Al
उत्तर:
(2) Cu
प्रश्न 5.
निम्न में कौन-सी अभिक्रिया सम्भव नहीं है?
(1) Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
(2) CaO + H2 > Ca + H2O
(3) CUO + H2→ Cu + H2O
(4) Fe + H2SO4 → FeSO4 + H2↑
उत्तर:
(2) CaO + H2 > Ca + H2O
प्रश्न 6.
अच्छे चालकत्व विलयन वाले पदार्थ हैं:
(1) दुर्बल वैद्युत अपघटय
(2) प्रबल वैद्युत अपघटय
(3) विद्युत अपघटय
(4) उत्प्रेरक
उत्तर:
(2) प्रबल वैद्युत अपघटय
प्रश्न 7.
N/50 KCl विलयन की 25°C पर विशिष्ट चालकता 0.002765 mho cm-1 सेमी-1 है। यदि विलयन सहित सेल का प्रतिरोध 400 ohm तो सेल स्थिरांक होगा:
(1) 0.553 cm-1
(2) 1.106 cm-1
(3) 2.212 cm-1
(4) इनमें से कोई नहीं
उत्तर:
(2) 1.106 cm-1
प्रश्न 8.
जल के विद्युत अपघटन में बनी ऑक्सीजन और हाइड्रोजन का भारात्मक अनुपात है:
(1) 2 : 1
(2) 8 : 1
(3) 16:1
(4) 1 : 4
उत्तर:
(1) 2 : 1
प्रश्न 9.
हाइड्रोजन-ऑक्सीजन ईंधने सेल में नेट अभिक्रिया सम्पन्न होती
(1) 2H2 (g) + 4OH- (aq) → 4H2O(l) + 4e-
(2) O2(g) + 2H2O(l) → 2e- + 4OH- (aq)
(3) 2H2 (g) + O2(g) → 2H2O(l)
(4) इनमें से कोई नहीं
उत्तर:
(3) 2H2 (g) + O2(g) → 2H2O(l)

प्रश्न 10.
सीसा संचायक सेल को आवेशित करने पर:
(1) PbO2 घुलता है
(2) लेड इलेक्ट्रोड पर PbSO4 जमता है
(3) H2SO4 पुनः बनता है ।
(4) अम्ल की मात्रा घटती है
उत्तर:
(2) लेड इलेक्ट्रोड पर PbSO4 जमता है
प्रश्न 11.
तत्वों A, B, C तथा D के मानक अपचयन विभव क्रमश: 2.90, + 1.50, - 0.74 तथा + 0.34 वोल्ट हैं। इनमें सर्वाधिक प्रबल ऑक्सीकारक है:
(1) A
(2) B
(3) C
(4) D
उत्तर:
(2) B
प्रश्न 12.
धातुं जो सरलता से ऑक्सीकृत हो जाती है:
(1) Cu
(2) Ag
(3) AI
(4) At
उत्तर:
(3) AI
प्रश्न 13.
चार धातुओं A, B, C तथा D के मानक ऑक्सीकरण इलेक्ट्रोड विभव क्रमशः + 1.5 वोल्ट, - 20 वोल्ट, + 0.84 वोल्ट तथा - 0.36 वोल्ट हैं। इन धातुओं की बढ़ती सक्रियता का क्रम है
(1) A < B < C < D
(2) D < C < B < A
(3) A < C < D < B
(4) B < C < D < A
उत्तर:
(3) A < C < D < B

प्रश्न 14.
निम्न में कौन-सा ऑक्साइड हाइड्रोजन द्वारा अपचयित होगा?
(1) Na2O
(2) MgO
(3) Al2O3
(4) Ag2O
उत्तर:
(4) Ag2O
प्रश्न 15.
प्रबलतम अपचायक है:
(1) Li
(2) Na
(3) K
(4) CS
उत्तर:
(1) Li
प्रश्न 16.
लेड संचायक बैटरी में:
(1) कैथोड पर PbO2, PbSO4 में अपचयित होता है
(2) ऐनोड पर Pb का PbSO4 में ऑक्सीकरण होता है
(3) दोनों इलेक्ट्रोड H2SO4 के एक ही जलीय विलयन में डूबे हुए हैं
(4) उपरोक्त सभी सही हैं
उत्तर:
(4) उपरोक्त सभी सही हैं
प्रश्न 17.
प्रथम कोटि अभिक्रिया के लिए log k एवं i/T में ग्राफ खींचते हैं, तो एक सरल रेखा प्राप्त होती है। प्राप्त रेखा की प्रवणता (ढाल) होगी:

उत्तर:
\(\text { (2) }-\frac{E_a}{2.303 R}\)
प्रश्न 18.
ताप में थोड़ी वृद्धि कर से अभिक्रिया का वेग तीव्रता से बढ़ता है, क्योंकि:
(1) सक्रियता अभिकारकों की संख्या में वृद्धि हो जाती है
(2) संघट्टों की संख्या बढ़ जाती है
(3) मुक्त पथ की लम्बाई बढ़ जाती है
(4) अभिक्रिया ऊष्मा बढ़ जाती है
उत्तर:
(3) मुक्त पथ की लम्बाई बढ़ जाती है
प्रश्न 19.
ईंधन सेल में:
(1) रासायनिक ऊर्जा, वैद्युत ऊर्जा में परिवर्तित होती है
(2) ईंधन की दहन ऊर्जा को रासायनिक ऊर्जा में परिवर्तित किया जाता है
(3) ईंधन की दहन ऊर्जा को वैद्युत ऊर्जा में परिवर्तित किया जाता है
(4) वैद्युत ऊर्जा को रासायनिक ऊर्जा में परिवर्तित किया जाता है
उत्तर:
(1) रासायनिक ऊर्जा, वैद्युत ऊर्जा में परिवर्तित होती है

प्रश्न 20.
शुष्क लैक्लांशे सेल में कैथोड होता है:
(1) जिक पात्र
(2) MnO2
(3) ग्रेफाइट. छड़
(4) NH4Cl
उत्तर:
(3) ग्रेफाइट. छड़
अति लघु उत्तरीय प्रश्न:
प्रश्न 1.
कैडमियम-निकैल संचायक सेल में ऐनोड पर होने वाली अभिकिया का रासायनिक समीकरण लिखिए।
उत्तर:
कैडमियम-निकैल संचायक सेल में ऐनोड पर निम्नलिखित अभिक्रिया होती है
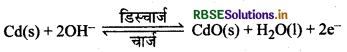
प्रश्न 2.
वैद्युत अपघटन का फैराडे का प्रथम नियम लिखिए।
उत्तर:
वैद्युत अपघटन की क्रिया में किसी इलेक्ट्रॉड पर पदार्थ की एकत्रित हुई अथवा मुक्त हुई मात्रा उस विलयन में प्रवाहित की गई विद्युत की मात्रा के समानुपाती होती है। इसे वैद्युत अपघटन का फैराडे का प्रथम नियम कहते हैं।
प्रश्न 3.
विद्युत अपघट्यों के चालकत्व को प्रभावित करने वाले कोई दो कारक लिखिए।
उत्तर:
- ताप,
- विलयन की सान्द्रता।
प्रश्न 4.
संक्षारण एक वैद्युत रासायनिक परिघटना है। समझाइए।
उत्तर:
लोहे पर जंग लगने के उदाहरण द्वारा संक्षारण के विद्युत् रासायनिक सिद्धान्त को समझ सकते हैं। लौह धात की सतह पर उपस्थित जल की बूंदों में वायुमण्डल से ऑक्सीजन और CO2 गैस घुल जाती है।
CO2 + H2O : H2CO3 यहाँ अशुद्ध आयरन कैथोड का तथा शुद्ध आयरन ऐनोड का कार्य करता है एवं सतह पर उपस्थित जलीय विलयन जिसमें O2 तथा CO2 घुली हुई हैं, विद्युत्-अपघट्य का कार्य करता है। इस प्रकार लोहे की सतह पर एक विद्युत्-रासायनिक सेल का निर्माण हो जाता है।
सेल में होने वाली अभिक्रियाएँ निम्न हैं:
ऐनोड पर: लोहे का ऑक्सीकरण होता है और Fe2+ आयन विलयन में चले जाते हैं।
Fe : Fe2+ + 2e- (ऑक्सीकरण)
कैथोड पर: 2H2O + 2e : H2 + OH- (अपचयन)
Fe2+ + 2OH- → Fe(OH)2
प्रश्न 5.
क्या हम CuSO4 विलयन को लोहे के पात्र में भण्डारण कर सकते है? समझाये।
उत्तर:
नहीं। क्योंकि Fe का इलेक्ट्रोड विभव Cu के इलेक्ट्रोड विभव से अधिक है। इस कारण Fe, CuSO4 से Cu को विस्थापित कर देता है।
Fe + CuSO4 → FeSO4 + Cu
प्रश्न 6.
कम सुनाई देने वाले व्यक्तियों के श्रवण यंत्र के लिए किस प्रकार का सैल प्रयुक्त होता है?
उत्तर:
श्रवण यंत्र में मर्करी सैल प्रयुक्त होता है।
प्रश्न 7.
मोलर चालकता का सूत्र लिखिए।
उत्तर:
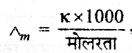
मोलरता r = विशिष्ट चालकता
Λm = मोलर चालकता

प्रश्न 8.
दुर्बल विद्युत्-अपघट्य के लिए मोलर चालकता एवं सीमान्त मोलर चालकता में सम्बन्ध लिखिए।
उत्तर:
\(\alpha=\frac{\wedge_m}{\wedge_m^0}\)
जहाँ = मोलर चालकता
यहाँ
Λm = सीमान्त मोलर चालकता
α = वियोजन की मात्रा
प्रश्न 9.
कोलराउश का नियम व एक अनुप्रयोग लिखें।
अथवा
आयनों के स्वतन्त्र अभिगमन सम्बन्धी कोलराउश नियम लिखें।
उत्तर:
कोलराश का नियम-इस नियम के अनुसार, "अनन्त तनुता पर किसी विद्युत् अपघट्य की मोलर चालकता उसके धनायनों तथा ऋणायनों की मोलर चालकताओं के योग के बराबर होती है।"
Λm = v + A∞ + v- Λ∞
यहाँ v+ तथा v- धनायनों तथा ऋणायनों की संख्या।
Λ∞+ तथा Λ∞- धनायनों तथा ऋणायनों की आयनिक चालकता।
अनप्रयोग: इसकी सहायता से वियोजन की मात्रा, a(degree of dissociation) का परिकलन कर सकते हैं।
\(\alpha=\frac{\Lambda_m^c}{\Lambda_m^0}\)
प्रश्न 10.
लौह धातु के संक्षारण को रोकने के उत्सर्ग इलेक्ट्रोड हेतु प्रयुक्त धातु का नाम लिखिए। बताइये कि यह संक्षारण को किस प्रकार रोकता है?
उत्तर:
संक्षारण को रोकने में Zn या Mg का प्रयोग करते हैं। Zn की परत चढ़ाने से Fe की अपेक्षा Zn का ऑक्सीकरण होता है। जिंक सक्रिय होने के कारण इलेक्ट्रॉन त्यागता है, Fe इलेक्ट्रॉन नहीं त्यागता जिससे Fe पर जंग नहीं लगता है।
प्रश्न 11.
चालकता को परिभाषित कीजिए।
उत्तर:
चालकता-चालकता उस विलयन का चालकत्व है जो 1cm के दो इलेक्ट्रोडों, जिनके बीच की दूरी 1cm हो के मध्य भरा हुआ हो। चूंकि इस विलयन का आयतन 1cm3 या 1mL होता है अतः संक्षेप में 1cm3 या 1mL विलयन का चालकत्व विलयन की चालकता कहलाती हैं।

प्रश्न 12.
मानक हाइड्रोजन इलेक्ट्रोड का नामांकित चित्र बनाइए।
उत्तर:
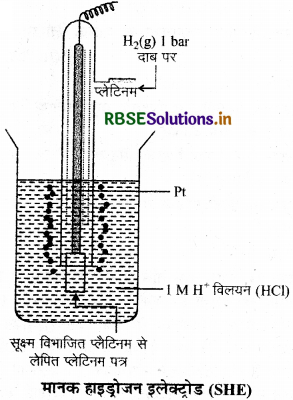
प्रश्न 13.
प्रतिरोधकता का (SI) मात्रक लिखिए।
उत्तर:
ओम मीटर ( Ωm)।
प्रश्न 14.
Mg2+ व C- आयनों की सीमान्त मोलर चालकता क्रमश: 106.0 s.cm.mol-1 तथा 76.3 s.cm.mo1 है। MgCl2 की सीमान्त मोलर चालकता ज्ञात कीजिए।
उत्तर:
λ°m(MgCl) = λ°(Mg2+) + λ°(Cl-)
= 106.0 + 2(76.3)
= 106.0 + 152.6
= 258.6 s.cm2 mol-1
प्रश्न 15.
डेनियल सेल में इलेक्ट्रोडों पर होने वाली ऑक्सीकरण एवं अपचयन की अर्द्ध अभिक्रियाएँ लिखिए।
उत्तर:
इलेक्ट्रोडों पर होने वाली अभिक्रियाएँ
ऑक्सीकरण अर्द्ध अभिक्रिया
Zn - → Zn2+ + 2e- (ऐनोड पर)
अपचयन अर्द्ध-अभिक्रिया
Cu+2 + 2e- → Cu (कैथोड पर)
प्रश्न 16.
सीसा संचायक सेल में ऐनोड पर होने वाली अर्द्धसेल अभिक्रिया लिखिए।
उत्तर:
PbS + SO-24 (aq) → PbSO4 (s) + 2e-
प्रश्न 17.
क्या हम CuSO4 के विलयन को लोहे के पात्र में भण्डारण कर सकते हैं? समझाइए।
उत्तर:
नहीं, विद्युत रासायनिक श्रेणी में Cu2+, Fe2+ से ऊपर है। लोहे की सक्रियता ताँबे से अधिक है, दूसरे शब्दों में Fe, CuSO4 से अभिक्रिया कर FeSO4 व Cu देता है।

प्रश्न 18.
मोलर चालकता का मात्रक लिखिए।
उत्तर:
Ω-1 cm-1 mo1-1
प्रश्न 19.
गैल्वेनी सेल में लवण सेतु बनाने के लिए प्रयुक्त किसी एक लवण का नाम दीजिए।
उत्तर:
गैल्वेनी सेल में लवण सेतु बनाने के लिए प्रयुक्त एक लवण पोटैशियम क्लोराइड है।
प्रश्न 20.
छोटी घड़ियों में काम आने वाले एक सेल का नाम लिखिए।
उत्तर:
मर्करी सेल।
प्रश्न 21.
जिंक तथा ताँबे में से एक अम्लों से हाइड्रोजन गैस विस्थापित नहीं करता है। क्यों?
उत्तर:
वैद्युत रासायनिक श्रेणी में जिंक हाइड्रोजन से ऊपर तथा ताँबा हाइड्रोजन से नीचे स्थित है जिसके कारण जिंक हाइड्रोजन से अधिक अपचायक है और ताँबा कम अपचायक है। इसीलिए जिंक अम्लों से हाइड्रोजन को विस्थापित करता है परन्तु, ताँबा नहीं करता है।
प्रश्न 22.
यद्यपि विद्युत रासायनिक श्रेणी में ऐलुमिनियम हाइड्रोजन से ऊपर है किन्तु यह वायु और जल में स्थायी है। क्यों?
उत्तर:
विद्युत रासायनिक श्रेणी में ऐलुमिनियम हाइड्रोजन से ऊपर है किन्तु यह वायु और जल में स्थायी है क्योंकि यह गर्म जल या जलवायु के साथ उच्च ताप पर क्रिया करता है और साधारण ताप पर जल के साथ इसकी क्रिया मन्द होती है।

प्रश्न 23.
Mg, Zn, Cu,Ag में से किस तत्व की अम्ल से अभिक्रिया होने पर हाइड्रोजन गैस विमुक्त होती है?
उत्तर:
Mg तथा Zn अम्ल से अभिक्रिया करके H, गैस विमुक्त करते हैं क्योंकि विद्युत रासायनिक श्रेणी में Mg तथा Zn का स्थान हाइड्रोजन से ऊपर है अर्थात् Mg तथा Zn की अपचायक क्षमता हाइड्रोजन से अधिक है।
प्रश्न 24.
कॉपर सल्फेट के विलयन में लोहे की कील डालने पर क्या होगा?
उत्तर:
कॉपर सल्फेट के विलयन में लोहे की कील डालने पर लोहे की कील के ऊपर कॉपर की परत चढ़ जायेगी, क्योंकि कॉपर की सक्रियता लोहे से कम होती है।
प्रश्न 25.
किसी सेल के विद्युत वाहक बल से क्या तात्पर्य है?
उत्तर:
किसी सेल के इलेक्ट्रोडों के इलेक्ट्रोड विभवों में वह अन्तर, जब सेल से परिपथ में कोई विद्युत धारा नहीं बहती है, सेल को विद्युत वाहक बल कहलाता है।

प्रश्न 26.
विशिष्ट चालकता से क्या तात्पर्य है? इसका मात्रक क्या है?
उत्तर:
किसी चालक के विशिष्ट प्रतिरोध के व्युत्क्रम को उस चालक की विशिष्ट चालकता (या केवल चालकता) कहते हैं। इसे ग्रीक अक्षर K (कप्पा, kappa) से निरूपित किया जाता है।
\(\kappa=\frac{1}{\rho}\)
विशिष्ट चालकता के मात्रक ओम-10-1 cm-1 या S सेमी-1 हैं।
प्रश्न 27.
एक विद्युत अपघटय विलयन की मोलर चालकता को परिभाषित कीजिए तथा उसके मात्रक लिखिए।
उत्तर:
किसी विलयन के एक निश्चित आयतन में उपस्थित एक विद्युत अपघटय पदार्थ के एक मोल द्वारा उपलब्ध कराये गये आयनों की चालकता को मोलर चालकता कहते हैं। इसे A से प्रदर्शित करते हैं। मोलर चालकता के मात्रक Ω-1 cm2 mol-1 या S cm2 mol-1 हैं।
प्रश्न 28.
मोलर चालकता तथा तुल्यांक चालकता में क्या सम्बन्ध लिखिए।
उत्तर:
मोलर चालकता तथा तुल्यांक चालकता में निम्नलिखित सम्बन्ध है
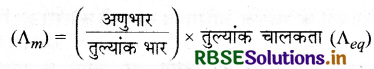
प्रश्न 29.
विद्युत अपघटन की क्रियाविधि उपयुक्त उदाहरण सहित समझाइए।
उत्तर:
किसी विद्युत अपघट्य का विद्युत धारा द्वारा अपघटन विद्युत अपघटन कहलाता है। उदाहरणार्थ-गलित सोडियम क्लोराइड में विद्युत धारा प्रवाहित करने पर यह सोडियम और क्लोरीन में अपघटित हो जाता है।


प्रश्न 30.
फैराडे का विद्युत अपघटन का द्वितीय नियम लिखिए।
उत्तर:
इस नियम के अनुसार, जब श्रेणीक्रम में जुड़े विभिन्न विद्युत अपघट्यों के विलयनों में समान मात्रा में विद्युत प्रवाहित की जाती है, तो इलेक्ट्रोडों पर मुक्त (या एकत्रित) पदार्थों के द्रव्यमान उनके तुल्यांक भारों के समानुपाती होते हैं।
अर्थात् W1 = E1, W2 = E2,
\(\frac{\mathrm{W}_1}{\mathrm{E}_1}=\frac{\mathrm{W}_2}{\mathrm{E}_2}\)
प्रश्न 31.
विद्युत लेपन को उदाहरण द्वारा संक्षेप में समझाइए।
उत्तर:
विद्युत अपघटन द्वारा कम सक्रिय धातु की कलई अधिक सक्रिय धातु पर चढ़ाई जाती है। इस प्रक्रिया को विद्युत लेपन कहते हैं। धातुओं की होने वाली अवांछनीय संक्षारण क्रिया को विद्युत लेपन द्वारा रोका जाता है।
उदाहरणार्थ: लोहे की चादर पर जिंक या टिन का लेप किया जाता है। क्योंकि जिंक या टिन की सक्रियता लोहे से कम है।
प्रश्न 32.
गर्म करने पर HgO अपघटित हो जाता है परन्तु MgO नहीं। क्यों?
उत्तर:
जो धातु विद्युत रासायनिक श्रेणी में Cu से नीचे हैं उनके ऑक्साइड कम स्थायी होते हैं और वे गर्म करने पर आसानी से अपघटित हो जाते हैं।
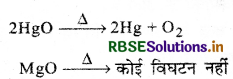
प्रश्न 33.
क्या कारण है कि गलित कैल्शियम हाइड्राइड का विद्युत अपघटन करने पर हाइड्रोजन ऐनोड़ पर मुक्त होती है? समझाइए।
उत्तर:
गलित CaH2 में हाइड्रोजन हाइड्राइड आयन H के रूप में रहता है और विद्युत अपघटन करने पर H को ऑक्सीकरण होता है।
CaH2 → Ca2+ + 2H-
2H → H2 + 2e- (ऐनोड)
लघु उत्तरीय प्रश्न:
प्रश्न 1.
लौह धातु के संक्षारण को रोकने के उत्सर्ग इलेक्ट्रोड हेतु प्रयुक्त धातु का नाम लिखिए। बताइये कि यह संक्षारण को किस प्रकार रोकता है?
उत्तर:
संक्षारण को रोकने में Zn या Mg का प्रयोग करते हैं। Zn की परत चढ़ाने से Fe की अपेक्षा Zn का ऑक्सीकरण होता है। जिंक क्रिय होने के कारण इलेक्ट्रॉन त्यागता है, Fe इलेक्ट्रॉन नहीं त्यागता जससे Fe पर जंग नहीं लगता है।

प्रश्न 2.
(अ) 'मानक हाइड्रोजन इलैक्ट्रोड' का नामांकित चित्र नाइए।
(ब) ईंधन सेल, अन्य सेलों की तुलना में श्रेष्ठ होते हैं। कोई दो कारण दीजिए।
उत्तर:
(अ)

(ब) (i) इसके द्वारा किसी प्रकार के हानिकारक सह-उत्पाद नहीं नते हैं। अतः इससे किसी भी प्रकार का प्रदूषण नहीं होता है।
(ii) इसमें साधारण बैटरी की भाँति इलेक्ट्रोड पदार्थ को बदला नहीं जाता है। अत: यह एक प्रकार से ईंधन की सतत् आपूर्ति करते हैं। इस कारण ईंधन सेल अन्तरिक्ष यानों में प्रयुक्त होते हैं।
प्रश्न 3.
विद्युत् चालन के आधार पर अचालक एवं अर्द्धचालक को समझाये।
उत्तर:
- अचालक (Insulator): ऐसे पदार्थ जो विद्युत् का चालन हीं करते हैं अर्थात विद्युत् धारा का स्थानान्तरण नहीं करते हैं, अचालक Insulators) कहलाते हैं। जैसे- प्लास्टिक, चीनी मिट्टी आदि।
- अर्द्धचालक (Semiconductors): ऐसे पदार्थ जिनकी चालकता वालकों एवं अचालकों के मध्य की होती है, अर्द्धचालक कहलाते हैं। उदाहरण-सिलिकॉन, डोपित सिलिकॉन, गैलियम आर्सेनाइड आदि।
प्रश्न 4.
(अ) डेनियल सेल का नामांकित चित्र बनाइये।
(ब) इलेक्ट्रोडों पर होने वाली ऑक्सीकरण एवं अपचयन की भर्द्ध अभिक्रियाएँ लिखिए।
(स) इस सेल के लिये नेस्ट समीकरण का गणितीय रूप लिखिये।
उत्तर:
(अ) डेनियल सेल का नामांकित चित्र निम्न है:
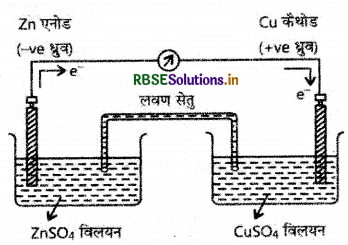
(ब) Zn- → Zn2+ + 2e (ऑक्सीकरण)
Cu2+ + 2e- → Zn2+ + Cu (अपचयन)
Zn + Cu2+ → Zn2+ + Cu (सेल अभिक्रिया)
(स) नेस्ट समीकरण Ecel = (ECU2+/CU - EZn2+/Zn ) \(+\frac{0 \cdot 059}{2} \log \frac{[\mathrm{Zn}]\left[\mathrm{Cu}^{2+}\right]}{\left[\mathrm{Zn}^{2+}\right][\mathrm{Cu}]}\)
प्रश्न 5.
Zn तथा Fe, कॉपर सल्फेट (CuSO4) में Cu को विस्थापित कर सकते हैं, परन्तु Pt और Ag नहीं करते। कारण स्पष्ट कीजिए।
या
Zn, CuSO4 विलयन से कॉपर को विस्थापित कर सकता है जबकि सोना (Ag) ऐसा नहीं कर सकता है। क्यों?
उत्तर:
कम इलेक्ट्रोड विभव वाली धातु अधिक इलेक्ट्रोड विभव वाली धातु को उसके लवण के विलयन में से प्रतिस्थापित कर देती है। विद्युत रासायनिक श्रेणी में नीचे की ओर चलने पर इलेक्ट्रोड विभव कम होता जाता है। चूँकि विद्युत रासायनिक श्रेणी में Zn तथा Fe धातुएँ Cu से नीचे स्थित हैं अतः इनका इलेक्ट्रोड विभव Cu से कम होता है और ये Cu को उसके लवण विलयन CuSO4 में से विस्थापित कर देती हैं, जबकि Pt और Ag का स्थान विद्युत रासायनिक श्रेणी में Cu से ऊपर होता है जिसके कारण इनका इलेक्ट्रोड विभव Cu से अधिक होता है। इसी कारण से ये Cu को इसके लवण विलयन में से विस्थापित नहीं कर पाती हैं।

प्रश्न 6.
सिल्वर नाइट्रेट के घोल में कॉपर की छड़ डालने पर घोले नीला क्यों हो जाता है?
उत्तर:
वैद्युत रासायनिक श्रेणी का प्रत्येक तत्व अपने से नीचे स्थित तत्वों को उसके विलयन से विस्थापित कर सकता है। श्रेणी में Cu का स्थान Ag से ऊपर है, अतः यह AgNO3 से निम्नलिखित क्रिया होगी
Cu + 2AgNO3 → Cu2+ + 2NO3- + 2Ag
इस प्रकार विलयन में क्यूप्रिंक आयन (Cu2+) विद्यमान होने से विलयन का रंग नीला हो जायेगा।
प्रश्न 7.
विद्युत अपघटनी सेल तथा गैल्वेनी सेल में अन्तर स्पष्ट कीजिए।
उत्तर:
|
विद्युत अपघटनी सेल |
गैल्वेनी सेल |
|
1. विद्युत धारा प्रवाहित होने से रासायनिक परिवर्तन होता है। |
रासायनिक परिवर्तन होने से विद्युत धारा प्रवाहित होती है। |
|
2. विद्युत ऊर्जा रासायनिक ऊर्जा में परिवर्तित होती है। |
रासायनिक ऊर्जा विद्युत ऊर्जा में परिवर्तित होती है। |
|
3. आयन दोनों इलेक्ट्रोडों पर मुक्त होते हैं। |
आयन केवल कैथोड पर मुक्त होते हैं। |
|
4. दोनों इलेक्ट्रोड एक कक्ष में रखे होते हैं। |
इलेक्ट्रोड अलग-अलग कक्ष में रखे जाते हैं। |
प्रश्न 8.
निम्नलिखित को कारण सहित समझाइए
1. क्लोरीन KI विलयन से I2 को विस्थापित कर देती हैं परन्तु I2 KBr विलयन से ब्रोमीन को विस्थापित नहीं करती है। क्यों?
2. Hg + H2SO4 → HgSO4 + H2 उपर्युक्त अभिक्रिया सम्भव नहीं है।
उत्तर:
1. Cl2 की ऑक्सीकारक क्षमता आयोडीन से अधिक है इसलिए Cl2 KI विलयन से आयोडीन को विस्थापित कर देती है।
2KI + Cl2 → 2KCI + I2
I2 की ऑक्सीकारक क्षमता ब्रोमीन से कम है इसलिए I2 KBr विलयन से ब्रोमीन को विस्थापित नहीं कर पाती है।
2KBr + I2 → कोई अभिक्रिया नहीं
2. Hg विद्युत रासायनिक श्रेणी में हाइड्रोजन से नीचे है इसलिए Hg, H2SO4 से हाइड्रोजन को विस्थापित नहीं कर पाती है।
Hg + H2SO4 → कोई अभिक्रिया नहीं

प्रश्न 9.
वैद्युत रासायनिक श्रेणी किसे कहते हैं? इसके प्रमुख लक्षण तथा दो प्रमुख उपयोग लिखिए।
उत्तर:
वैद्युत रासायनिक श्रेणी-विभिन्न धातुओं तथा अधातुओं के मानक इलेक्ट्रोड विभवों (अपचयन विभव) को बढ़ते हुए क्रम में रखने पर जो श्रेणी प्राप्त होती है, उसे वैद्युत रासायनिक श्रेणी कहते हैं।
वैद्युत रासायनिक श्रेणी के लक्षण:
- श्रेणी में ऊपर से नीचे की ओर जाने पर तत्वों की अपचयन क्षमता घटती है, जबकि नीचे से ऊपर जाने पर अपचयन क्षमता बढ़ती है।
- हाइड्रोजन से ऊपर के सभी तत्व अम्लों से अभिक्रिया करके हाइड्रोजन गैस मुक्त करते हैं, जबकि नीचे वाले तत्व अम्लों से अभिक्रिया करके हाइड्रोजन गैस मुक्त नहीं करते।
- हाइड्रोजन से ऊपर के सभी तत्व जल य भाप के साथ क्रिया करके H2 गैस देते हैं।
- जिस तत्व का अपचयन विभव जितना अधिक होता है, वह उतना ही प्रबल ऑक्सीकारक होता है।
- जिस तत्व का अपचयन विभव जितना कम होता है, वह उतना ही प्रबल अपचायक होता है।
- श्रेणी का ऊपर वाला तत्व नीचे वाले तत्व को उसके विलयन से विस्थापित कर देता है।
उपयोग: वैद्युत रासायनिक श्रेणी के दो उपयोग निम्नवत् हैं
- किसी सेल के मानक वैद्युत वाहक बल का निर्धारण करने में,
- धातुओं की क्रियाशीलता की तुलना करने में।
प्रश्न 10.
मानक इलेक्ट्रोड विभव क्या है? इलेक्ट्रोड विभव (E) और मानक इलेक्ट्रोड विभव (E) में सम्बन्ध लिखिए।
या
टिप्पणी लिखिए-नेनस्ट समीकरण।
उत्तर:
मानकं इलेक्ट्रोड विभव-किसी धातु की छड़ को 25°C पर एक मोलर धातु आयन सान्द्रता के विलयन में डुबाने पर धातु और विलयन के मध्य जो विभवान्तर उत्पन्न होता है उसे धातु का मानक इलेक्ट्रोड विभव (E°) कहते हैं। इलेक्ट्रोड विभव (E) और मानक इलेक्ट्रोड विभव (E°) में सम्बन्ध माना एक इलेक्ट्रोड अभिक्रिया इस प्रकार है

नेनस्ट के अनुसार, किसी ताप T पर धातु इलेक्ट्रोड M | Mn+ के विभव E और विलयन में धातु आयनों की सान्द्रता [Mn+] में निम्नलिखित सम्बन्ध होता है।
\(\mathrm{E}=\mathrm{E}^{\circ}-\frac{2303 \mathrm{RT}}{n \mathrm{~F}} \log _{10} \frac{1}{\left[\mathrm{M}^{n+}\right]}\)
इसे नेर्नस्ट समीकरण भी कहते हैं।
जहाँ E° धातु का मानक इलेक्ट्रोड विभव (volt में), R गैस नियतांक (R = 8.312 JK-1 mol-1), T पर ताप (केल्विन में), F फैराडे नियतांक (F = 96,485 C mol-1),n इलेक्ट्रोड अभिक्रिया में भाग लेने वाले इलेक्ट्रॉनों के मोलों की संख्या तथा [Mn+] विलयन में धातु आयनों की सक्रियता (activity) अथवा mol L-1 में व्यक्त सान्द्रता है।
प्रश्न 11.
इलेक्ट्रोड विभव किसे कहते हैं? इसका मान किन-किन कारकों पर निर्भर करता है?
उत्तर:
जब किसी धातु (इलेक्ट्रोड) को उसी धातु के किसी लवण विलयन में रखा जाता है तो धातु तथा विलयन के सम्पर्क स्थल पर वैद्युत द्विक-स्तर (electrical double layer) उत्पन्न हो जाता है जिसके फलस्वरूप धातु तथा विलयन के मध्य विभवान्तर उत्पन्न हो जाता है जिसे इलेक्ट्रोड विभव (electrode potential) कहते हैं। इसे E° से प्रकट करते हैं और इसे वोल्ट में मापा जाता है। उदाहरणार्थ-जब कॉपर की छड़, कॉपर सल्फेट के विलयन में डुबोई जाती है तो कॉपर की छड़ विलयन के सापेक्ष ऋणावेशित हो जाती है जिससे कॉपर धातु और कॉपर
आयनों के मध्य विभवान्तर उत्पन्न हो जाता है।
Cu (s) ⇌ Cu2+ + 2e
इस विभवान्तर को कॉपर इलेक्ट्रोड का विभव कहते हैं।
इलेक्ट्रोड विभव निम्नलिखित कारकों पर निर्भर करता है:
- चालक की प्रकृति-जिस इलेक्ट्रोड की चालकता अधिक होगी वह उतना ही अधिक इलेक्ट्रोड विभव उत्पन्न करता है।
- धात्विक आयन की विलयन में सान्द्रता-सान्द्रता बढ़ाने पर इलेक्ट्रोड विभव को मान घटता है, क्योंकि सान्द्रता बढ़ाने पर आयनन घट जाता है, फलस्वरूप चालकता कम हो जाती है।
- तापक्रम-इलेक्ट्रोड विभव का मान ताप पर भी निर्भर करता है जो ताप बढ़ाने पर आयन बढ़ जाने के कारण बढ़ता है।
प्रश्न 12.
रेडॉक्स विभव किसे कहते हैं?
उत्तर:
जब सेल में आक्सीकरण तथा अपचयन अभिक्रिया होती है जो धातु और विलयन के मध्य स्थापित विभवान्तर को रेडॉस विभव कहते हैं; जैसे

यदि इस प्रकार के सेल का विभव E हो तो ऑक्सीकारक की सान्द्रता (O) तथा अपचायक की सान्द्रता (Red) में 25°C पर निम्नलिखित सम्बन्ध होता है।
\(\mathrm{E}=\mathrm{E}+\frac{0.0591}{n} \log _{10} \frac{\left[\mathrm{O}_x\right]}{[\text { Red }]}\)
जहाँ, E° रेडॉक्स विभव है और n ऑक्सीकारक (OX) द्वारा ग्रहण किये गये इलेक्ट्रॉनों की संख्या है। जिन्हें ऑक्सीकारक ग्रहण करके अपने संगत अपचायक में बदल देता है।
प्रश्न 13.
ईंधन सेलों का महत्व लिखिए।
उत्तर:
ईंधन सेलों का महत्व (Importance of Fuel Cells)
- इसके द्वारा किसी प्रकार के हानिकारक सह-उत्पाद नहीं बनते हैं अतः इससे किसी भी प्रकार का प्रदूषण नहीं होता है।
- इसमें साधारण बैटरी की भाँति इलेक्ट्रोड पदार्थ को बदला नहीं जाता है। अतः यह एक प्रकार से ईंधन की सतत् आपूर्ति करते हैं। इस कारण ईंधन सेल अन्तरिक्ष यानों में प्रयुक्त होते हैं।
- इसकी दक्षता काफी उच्च होती है। यह लगभग 60 - 70% दक्ष होते हैं।
प्रश्न 14.
संक्षारण क्या है? समझाइए।
उत्तर:
संक्षारण: जब एक धातु को किसी विशिष्ट वातावरण में रखा जाता है तो वह वातावरण से क्रिया कर सकती है जिसके फलस्वरूप उसकी सतह कलुषित (deteriorate) हो सकती है। इस घटना को संक्षारण (corrosion) कहते हैं। अधिकांश धातुएँ वायुमण्डल में रखे जाने पर किसी न किसी रूप में प्रभावित होती हैं। वायुमण्डल में उपस्थित गैसें धातु से मन्द गति से क्रिया कर उसकी सतह को कलुषित कर देती हैं।
इससे धातुएँ अपनी विशिष्ट चमक खो देती हैं। कुछ धातुओं की शक्ति हो जाती है और वे दुर्बल तथा भंगुर (brittle)। हो जाती हैं। चाँदी की चमक का कम होना (tarnishing of silver), लोहे पर जंग लगना (rusting on iron), ताँबे या कॉसे पर हरी परत का जमा होना आदि। संक्षारण के कुछ सामान्य उदाहरण हैं। संक्षारण को निम्न प्रकार से परिभाषित किया जा सकता है। किसी निश्चित वातावरण की मन्द किन्तु स्वतः प्रवर्तित क्रिया द्वारा धातुओं की सतह के कुलषित (deteriorate) होने की प्रक्रिया को संक्षारण कहा जाता है।
प्रश्न 15.
इन्वर्टर एवं वाहनों में प्रयुक्त होने वाली बैटरी का संक्षिप्त वर्णन कर एनोड एवं कैथोड पर होने वाली अभिक्रियाओं का समीकरण लिखिए।
उत्तर:
इन्वर्टर एवं वाहनों में प्रयुक्त होने वाली बैटरी सीसा संचायक सेल होते हैं। सीसा संचायक सैल में एनोड Pb का बना होता है। कैथोड के रूप में Pb - Sb की जाली में PbO2 का महीन चूर्ण भरा होता है। विद्युत अपघट्य तनु H2SO4(38%) जिसका घनत्व 1.30g cm-3 होता है। उपयोग में लेते हैं। एक सैल से 2 वोल्ट विद्युत प्राप्त होती है। इस प्रकार के अनेक सैल श्रेणीक्रम में जोड़कर 6, 12 वोल्ट की बैटरी प्राप्त करते हैं। जोकि वाहनों और इन्वर्टर में प्रयुक्त होती है।
अभिक्रियाएँ एनोड पर:
Pb + SO2-4 → PbSO4 + 2e-(ऑक्सीकरण)
कैथोड पर:
PbO2 + SO2-4 + 4H+ + 2e- → PbSO4 + 2H2O (अपचयन)
चार्जिंग के दौरान विपरीत अभिक्रियाएँ होती हैं।

प्रश्न 16.
H2 तथा O2 का उपयोग करने वाली ईंधन सेल का स्वच्छ एवं नामांकित चित्र बनाइए। इसमें इलेक्ट्रोड अभिक्रियाओं के समीकरण लिखिए। ईंधन सेल का एक उपयोग भी दीजिए।
उत्तर:
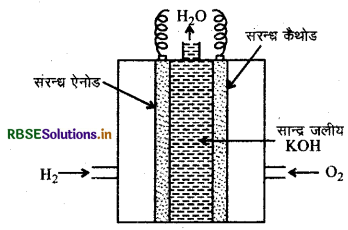
इलेक्ट्रोड अभिक्रियाएँ
एनोड पर
2H2(g) + 4OH-(aq) → 4H2O (l) + 4e
कैथोड पर
O2(g) + 2H2O(l) + 4e + 2H2O (l)
उपयोग:
अंतरिक्ष यानों में विद्युत ऊर्जा और दूरदर्शन प्रसारण केन्द्रों में ऊर्जा प्राप्ति के लिए।
प्रश्न 17.
लोहा, कॉपर सल्फेट विलयन से कॉपर विस्थापित , करता है परन्तु Pt नहीं, क्यों?
उत्तर:
Fe का इलेक्ट्रोड विभव Cu के इलेक्ट्रोड विभव से अधिक है, इस कारण Fe, CuSO4 से Cu को विस्थापित कर देता है जबकि Pt का इलेक्ट्रोड विभव Cu से कम है, इस कारण Pt, CuSO4 से Cu का विस्थापन नहीं कर पाता है।
CuSO4 + Fe → FeSO4 + Cu
CuSO4 + Pt → अभिक्रिया नहीं
प्रश्न 18.
विद्युत् वाहक बल तथा विभवान्तर में अन्तर स्पष्ट कीजिए।
उत्तर:
|
विद्युत् वाहक बल |
विभवान्तर |
|
(1) जब किसी परिपथ में कोई विद्युत् धारा प्रवाहित नहीं होती है उस समय दोनों इलेक्ट्रोडों के बीच का विभवान्तर विद्युत् वाहक बल कहलाता है। |
(1) यह दोनों इलेक्ट्रोडों के इलेक्ट्रोड विभव अन्तर होता है जब यह धारा परिपथ में से होकर प्रवाहित करता है। |
|
(2) यह सेल में स्थायी धारा के प्रवाह के लिए उत्तरदायी होता |
(2) यह सेल में स्थायी धारा के प्रवाह के लिए उत्तरदायी नहीं होता है। |
|
(3) इसे विभवमापी से मापते हैं जबकि परिपथ में विद्युत् धारा प्रवाहित नहीं होती। |
(3) इसे वोल्टमीटर से मापते हैं। |
|
(4) यह एक गैल्वैनिक सेल द्वारा प्रदर्शित अधिकतम वोल्टता है। |
(4) यह सदैव सेल के अधिकतम वोल्टेज से कम होता है। |
|
(5) यह किसी गैल्वैनिक सेल से प्राप्य अधिकतम कार्य होता है। |
(5) विभवान्तर से परिकलित कार्य सेल से प्राप्य अधिकतम कार्य से कम होता है। |
प्रश्न 19.
कॉपर सल्फेट के विलयन में जिंक डालने पर विलयन का नीला रंग गायब क्यों हो जाता है? समीकरण लिखिए।
उत्तर:
विद्युत् रासायनिक श्रेणी में ऊपर वाले तत्व नीचे स्थित तत्वों को उसके विलयन में विस्थापित कर सकते हैं अर्थात् जब कॉपर सल्फेट के विलयन में जिंक डालते हैं तो जिंक विद्युत् रासायनिक श्रेणी में ऊपर ने के कारण कॉपर सल्फेट के विलयन से कॉपर को विस्थापित कर ता है। परिणामस्वरूप विलयन का नीला रंग गायब हो जाता है।
अभिक्रिया के दौरान होने वाला समीकरण निम्न है।
CuSO4 + Zn → ZnSO4 + Cu
विस्तृत उत्तरीय प्रश्न:
प्रश्न 1.
निम्न पर टिप्पणी लिखिए।
(i) मर्करी सैल
(ii) Ni - Cd सचायंक सैल
उत्तर:
प्राथमिक बैटरियाँ (Primary Batteries):
प्राथमिक बैटरियों में अभिक्रिया केवल एक बार होती है तथा कुछ समय के प्रयोग के बाद बैटरी निष्क्रिय हो जाती हैं एवं पुनः प्रयोग में नहीं लाई जा सकती हैं। ये निम्न प्रकार की होती हैंं।
(1) शष्क सेल (Dry Cell): इसका आविष्कार लेक्लांशे ने किया था, अत: इसे लेक्लांशे सेल भी कहते हैं। ये सामान्य रूप से ट्रांजिस्टरों एवं घड़ियों में प्रयोग में लाये जाते हैं। इस सेल में जिंक का एक पात्र होता है जो ऐनोड का कार्य करता है तथा कार्बन ग्रेफाइट की छड़ जो चारों ओर से मैंगनीज डाइ-ऑक्साइड के चूर्ण तथा कार्बन से घिरी रहती है, कैथोड का कार्य करती है। - इलेक्ट्रोडों के बीच का स्थान अमोनियम क्लोराइड (NH4CI) एवं जिंक क्लोराइड (ZnCl2) के नम पेस्ट से भरा रहता है। इसमें इलेक्ट्रोड अभिक्रियाएँ जटिल होती हैं, परन्तु इन्हें संक्षेप रूप से निम्नलिखित प्रकार से लिखा जा सकता है
ऐनोड, Zn(s) → Zn2+ + 2e-
कैथोड, MnO2 + NH4+ + → MnO(OH) + NH3
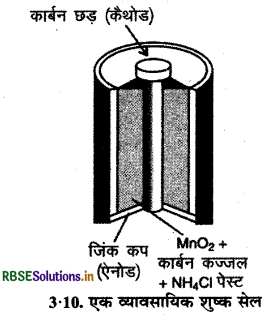
कैथोड की अभिक्रिया में मैंगनीज + 4 से + 3 ऑक्सीकरण अवस्था में अपचयित हो जाता है। अभिक्रिया में उत्पन्न अमोनिया Zn2+ के साथ संकुल [Zn(NH3)4]2+ बनाती है। सेल का विभव लगभग 1.5 V होता है।
शुष्क सेल की आयु अधिक नहीं होती है। चूंकि NH4Cl अम्लीय होने के कारण जिंक पात्र को संक्षारित कर देता है चाहे सेल का प्रयोग न किया जा रहा हो।
(ii) मर्करी सेल (Mercury Cell): मकरी सेल का उपयोग श्रवण यन्त्र, घड़ियों आदि जैसी विद्युत् की कम मात्रा की आवश्यकता वाली युक्तियों में किया जाता है। इसमें जिंक-मर्करी अमलगम ऐनोड का तथा HgO एवं कार्बन का पेस्ट कैथोड का कार्य करता है। KOH एवं ZnO का पेस्ट विद्युत्-अपघट्य होता है। सेल की इलेक्ट्रोड अभिक्रियाएँ नीचे दी गई हैं
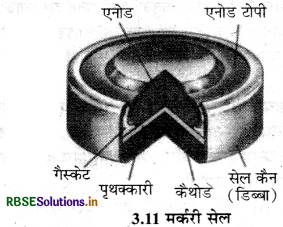
ऐनोड : Zn(Hg) + 2OH- → ZnO (s) + H2O + 2e-
कैथोड : HgO + H2O + 2e- → Hg(l) + 2OH-
सम्पूर्ण सेल अभिक्रिया निम्नांकित प्रकार से निरूपित की जाती है
Zn(Hg) + HgO(s) → Zn + 2Hg(l)
सेल विभव लगभग 1.35 V होता है तथा सम्पूर्ण कार्य अवधि में स्थिर रहता है; क्योंकि सम्पूर्ण सेल अभिक्रिया में कोई भी ऐसा आयन नहीं है जिसकी सान्द्रता विलयन में होने के कारण सेल की सम्पूर्ण कार्य अवधि में सेल विभव परिवर्तित हो सकता हो।
द्वितीयक या संचायक बैटरियाँ (Secondary or Storage Batteries):
ये उत्क्रमणीय गैल्वैनिक सेल हैं। इनमें उच्च ऊर्जा युक्त पदार्थ शीघ्र अभिक्रिया करके विद्युत् धारा व्युत्पन्न करते हैं और अक्रिय हो जाते हैं।
इन पदार्थों को बाह्य स्रोतों के द्वारा पुनः सक्रिय बना लिया जाता है और यह पदार्थ सेल में पुनः प्रयुक्त कर लिये जाते हैं। अर्थात् इन सेलों को पुनः आवेशित (Recharge) किया जा सकता है। एक अच्छी एवं संचायक बैटरी कई बार डिस्चार्ज एवं चार्ज के चक्र से गुजर सकती है।
इसके मुख्य उदाहरण निम्न हैं:
(i) लैड संचायक सैल (Lead Storage Cell): इसमें ऐनोड लैड का बना होता है तथा कैथोड PbO2 से भरे हुए लैड के ग्रिड होते हैं। 38% H2SO4 विद्युत् अपघट्य होता है। इसमें निम्नलिखित अभिक्रियाएँ होती हैं
ऐनोड:
Pb(s) + SO2-4(aq) → PbSO4(s) + 2e
कैथोड:
PbO2(aq) + SO2-4(aq) + 4H+ (aq) + 2e- → PbSO4(s) + 2H2O(l)
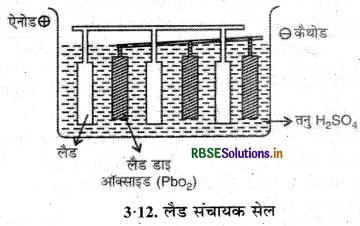
इस प्रकार कैथोड व ऐनोड की सम्पूर्ण अभिक्रिया निम्न है:
Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(s) + 2H2O(l)
सेल आरेख निम्न प्रकार होगा:
Pb | PbSO4 || H2SO4(aq) | PbO2 | Pb
सेल अभिक्रिया से स्पष्ट है कि जब सेल कार्य करता है तो प्रत्येक इलेक्ट्रॉड पर PbSO4 बनता है तथा H2SO4 का घनत्व कम होने लगता है और पुनः चार्ज किये जाने की आवश्यकता होती है।
उचित विभव की विद्युतधारा विपरीत दिशा में प्रवाहित कर इसे पुनः चार्ज किया जा सकता है जिससे एनोड पर पुन: लेड जमा हो जाता है और कैथोड पर PbO2 जमा हो जाता है। अपघट्य H2SO4 का घनत्व पुनः बढ़ जाता है। चार्ज करते समय सेल अभिक्रिया निम्न होती है
2PbSO4(s) + 2H2O → Pb(s) + PbO2 + 2H2SO4
अत: चार्जिग के दौरान यह विद्युत अपघटनी सेल बन जाता है।
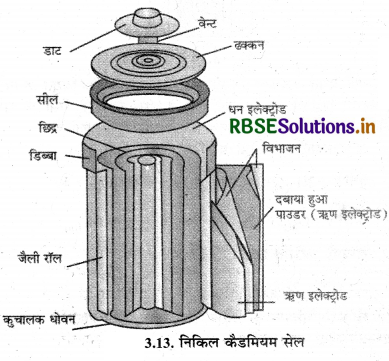
(ii) निकिल-कैडमियम संचायक सेल (Nickel Cadmium Storage Cell): यह एक महत्वपूर्ण संचायक सेल है जिसकी कार्य अवधि लैड संचायक बैटरी से अधिक होती है परन्तु इसमें लगने वाली लागत अधिक है। इसकी डिस्चार्ज अभिक्रिया निम्न प्रकार होती
Cd(S) + 2Ni(OH)3(S) → CdO(s) + 2 Ni(OH)2(s) + H2O(l)
प्रश्न 2.
ईधन सैल का सचित्र वर्णन कीजिए।
उत्तर:
ये प्राथमिक सेलों की तरह ही होते हैं। इसमें ईंधन का दहन होता है तथा उसमें से उत्पन्न रासायनिक ऊर्जा को विद्युत् ऊर्जा में परिवर्तित किया जाता है। इन सेलों को इस प्रकार बनाया जाता है कि इनमें ईंधन लगातार भरा जा सके जिससे कि विद्युत् धारा निरन्तर प्राप्त होती रहे। ऐसे गेल्वेनी सेल जिनमें H2 CH4 CH3OH एवं C2H5OH आदि जैसे ईधनों की दहन ऊर्जा को सीधे ही विद्युत ऊर्जा में परिवर्तित किया जाता है, ईधन सेल कहते हैं।
सर्वप्रथम बैकान ने एक सेल बनाया जिसमें उन्होंने ईधन के रूप में H2O2 लिया था। इस बैकान सेल भी कहते हैं। इस सेल में कार्बन के सरन्ध्र (Porous) इलेक्ट्राड होते हैं। इन इलेक्ट्रोडो की अभिक्रिया दर बढ़ाने के लिए सूक्ष्म विभाजित प्लेटिनम (Pt) या पैलेडियम (Pd) धातु उत्प्रेरक को इलेक्ट्रोडो में समावेशित किया जाता है।
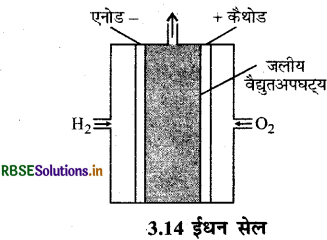
यहाँ विद्युत-अपघट्य इलेक्ट्रोडों के मध्य भरा होता है। विद्युत्-अपघट्य KOH या NaOH का विलयन होता है। H2 तथा O2 गैसों के सरंध्र इलेक्ट्रोडों में से विद्युत्-अपघट्य विलयन में भेजा जाता है।
अभिक्रियाएँ, इलेक्ट्रोडों पर निम्न प्रकार होती हैं:
ऐनोड: 2H2(g) + 4OH- (aq) → 4H2O(l) + 4e-
कैथोड: O2(g) + 2H2O(l) + 4e → 4OH-(aq)
सम्पूर्ण अभिक्रिया:
2H2(g) + O2(g) → 2H2O(l)
चूँकि अभिक्रिया के दौरान ईंधन खर्च होता रहता है अतः इसे बार-बार भरते रहना चाहिए।
ईंधन सेल की विशेषताएँ
- ईंधन की लगातार पूर्ति करने पर लगातार विद्युत् धारा प्राप्त होती है इसलिए सेल की आयु लम्बी होती है।
- ये सेल प्रदूषण रहित होते हैं।
- इनकी दक्षता लगभग 75-80% होती है।
- इस ईंधन सेल का प्रयोग सर्वप्रथम अन्तरिक्ष कार्यक्रम में अपोलो यान को विद्युत् ऊर्जा प्रदान करने के लिए किया गया था। यहाँ H2 तथा O2 परस्पर द्रव H2O बनाते हैं। इस जल वाष्प को संघनित कर उसका प्रयोग अन्तरिक्ष यात्रियों के पेयजल के रूप में किया जाता है।

प्रश्न 3.
सक्षारण से बचाव हेतु विधियों का वर्णन कीजिए।
उत्तर:
संक्षारण से बचाव-संक्षारण से बचाव की कुछ प्रमुख वधियाँ निम्न हैं।
- अवरोध रक्षण लोहे को जंग लगने से बचाने के लिए इस वधि का काफी उपयोग किया जाता है। इस विधि में धातु सतह तथा
- युमण्डलीय वायु के मध्य एक उपयुक्त अवरोध का निर्माण किया जाता । इससे धातु सतह वायु जल तथा कार्बन डाइऑक्साइड की क्रिया से
- ची रहती है और संक्षारित नहीं होती है। अवरोध रक्षण निम्न में से कसी भी विधि द्वारा किया जा सकता है।
- धातु की सतह पर तेल या ग्रीस केलेपन द्वारा-लोहे की सतह र तेल या ग्रीस (grease) की एक पतली फिल्म बनाकर उसे जंग गने से बचाया जा सकता है। लोहे के औजारों तथा मशीनी भागों machinery parts) को इसी प्रकार जंग लगने से बचाया जाता है।
- धातु सतह पर पेंट के लेपन द्वारा-धातु सतह पर किसी पेंट paint), एनामिल (enamel) आदि का एक पतली परत के रूप में लेपन रने से धातु संक्षारित होने से बच जाती है।
- धातु पर कुछ विशिष्ट रसायनों के लेपन द्वारा-लोहे की सतह पर FePO4 या अन्य किसी उपयुक्त रसायन का लेप कर उसे जंग लगने से बचाया जा सकता है। रसायन की पतली अविलेय परत लोहे को वायु तथा नमी के सम्पर्क से बचाकर इस पर जंग नहीं लगने देती
- धातु पर असंक्षारतीय धातुओं की परत द्वारा-किसी असंक्षारणीय धातु जैसे-निकिल, क्रोमियम आदि की एक पतली परत को किसी धातु पर चढ़ाकर भी उसकी संक्षारण से रक्षा की जा सकती है। जैसे, लोहे पर. निकिल या क्रोमियम की एक पतली परत द्वारा लोहे. को जंग लगने से बचाया जा सकता है।
2. बलिदानी रक्षण-इस विधि में धातु का रक्षण उसकी सतह पर लेपित एक अन्य अधिक सक्रिय धातु के बलिदान द्वारा किया जाता है। जब एक धातु की सतह को एक अधिक सक्रिय धातु से आवृत कर दिया जाता है, तो अधिक सक्रिय धातु प्रथम धातु की तुलना में वरीयता से इलेक्ट्रॉन त्याग कर आयनिक अवस्था में परिवर्तित होती रहती है। इससे अधिक सक्रिय धातु धीरे-धीरे उपभोगित होती रहती है और प्रथम धातु की संक्षारण से रक्षा करती है। जब तक अधिक सक्रिय धातु संक्षारणीय धातु की सतह पर स्थित होती है तब तक प्रथम धातु-संक्षारण से बची रहती है।
प्रश्न 4.
संक्षारण को प्रभावित करने वाले कारकों को समझाइए।
उत्तर:
संक्षारण को प्रभावित करने वाले कारक: धातुओं का संक्षारण अनेक कारकों पर निर्भर करता है। इनमें से कुछ प्रमुख कारक निम्न हैं
1. धातु की क्रियाशीलता: अधिक क्रियाशील धातु के संक्षारण की सम्भावना किसी अन्य कम क्रियाशील धातु की तुलना में अधिक होती है। उदाहरणार्थ-लोहा अपने से कम क्रियाशील धातु चाँदी की तुलना में अधिक तेजी से संक्षारित होता है। किसी धातु की क्रियाशीलता उसकी विद्युत धनात्मक प्रकृति पर निर्भर करती है। धातु की विद्युत धनात्मक प्रकृति जितनी अधिक होगी, वह उतनी ही अधिक क्रियाशील होगी। इस प्रकार धातुएँ जैस-Na, Ca, Mg, AI, Zn आदि शीघ्रता से संक्षारित होती हैं।
2. धातु में अशुद्धियों की उपस्थिति: शुद्ध धातुएँ प्रायः अधिक संक्षारित नहीं होती हैं। एक धातु में अन्य अशुद्ध धातुओं की उपस्थिति उस धातु में संक्षारण को प्रेरित करती है। इसका कारण यह है कि कम विद्युत धनात्मक अशुद्ध धातुएँ ग्राही धातु के साथ गैल्वेनिक सेलों का निर्माण करती हैं जिससे ग्राही धातु संक्षारित हो जाती है।
3. जल में विद्युतटयों की उपस्थिति: जल में विद्युत अवघटय पदार्थों की उपस्थिति संक्षारण की दर में वृद्धि करती है। उदाहरणार्थ-लोहे का संक्षारण आसुत जल की तुलना में समुद्री जल में अधिक सीमा तक होता है, क्योंकि समुद्री जल में अनेक विद्युत अपघटय जैसे NaCl, KCl आदि घुले रहते हैं।
4. वायु में क्रियाशील गैसों की उपस्थिति: वायु में उपस्थित क्रियाशील गैसें; जैसे - CO2 SO2 NO2 आदि जल में घुलकर अम्लों का निर्माण करती हैं, जो विद्युत-अपघटयों का कार्य करते हैं एवं संक्षारण प्रक्रिया को त्वरित करते हैं।
प्रश्न 5.
साम्यावस्था पर डेनियल सेल के लिए नेन्स्ट समीकरण लिखिए एवं E° (सेल) तथा साम्य स्थिरांक (K) में सम्बन्ध व्युत्पन्न कीजिए।
उत्तर:
यदि डेनियल सेल में परिपथ को बन्द कर दिया जाये तो निम्न अभिक्रिया होती है
Zn(g) + Cu(aq) → Zn(aq) + Cu(s)
जैसे-जैसे समय गुजरता है Zn2+ आयनों की सान्द्रता बढ़ती जाती है जबकि Cu+ आयनों की सान्द्रता घटती जाती है। इसी समय सेल की। वोल्टता, जिसे वोल्टमीटर से पढ़ा जा सकता है, घटती है तथा कुछ समय पश्चात् Cu2 एवं zn+ आयनों की सान्द्रता स्थिर हो जाती है एवं वोल्टमीटर शून्य दर्शाता है अर्थात इस समय अभिक्रिया साम्य अवस्था में आ जाती। है। इस साम्यावस्था के लिये नेस्ट समीकरण निम्न प्रकार होगा:
\(\mathrm{E}_{\text {cell }}=\mathrm{E}_{\text {cell }}^{\circ}-\frac{2.303 R T}{n F} \log _{10} \frac{\left[\mathrm{Zn}^{2+}\right]}{\left[\mathrm{Cu}^{2+}\right]}\) ............ (i)
अतः Eel = \(\mathrm{E}_{\text {cell }}=\mathrm{E}_{\text {cell }}^{\circ}-\frac{2.303 R T}{n E} \log _{10} K_c\) ............... (ii)
साम्यावस्था में डेनियल सेल का EMF (Ecell) शून्य हो जाता है। अर्थात् Ecell = 0, अतः सभी (ii) से
\(\mathrm{E}_{\text {cell. }}^{\circ}=-\frac{2.303 R T}{n F} \log _{10} K_c\) ........... (iii)
गैस नियतांक R = 8.314JK-1 mol-1 फैराडे स्थिरांक F = 96500C/ mol 25°C पर T = 273 + 25 = 288K,सभी (iii) में रखने पर
\(\mathrm{E}_{\text {cell }}^{\circ}=\frac{0.0591}{n} \log _{10} K_c\)
यदि हमें सेल के मानक इलेक्ट्रोड विभव का मान ज्ञात है तो हम साम्य स्थिरांक K के मान को ज्ञात कर सकते हैं।
प्रश्न 6.
लोहे में संक्षारण प्रक्रिया को समझाते हुए स्पष्ट कीजिए कि जंग लगने से लोहा भारी क्यों हो जाता है?
अथवा
लोहे के जंग लगने की सम्पूर्ण रासायनिक अभिक्रिया लिखें।
अथवा
संक्षारणं एक वैद्युत रासायनिक परिघटना है। समझाइये।
उत्तर:
संक्षारणका विधुत-रासायनिकसिद्धान्त (Electrochemi cal Theory of Corrosion):
लोहे पर जंग लगने के उदाहरण द्वारा संक्षारण के विद्युत्-रासायनिक सिद्धान्त को समझ सकते हैं। लौह धातु की सतह पर उपस्थित जल की बूंदों में वायुमण्डल से ऑक्सीजन और CO2 गैस घुल जाती है।
CO2 + H2O → H2CO3
यहाँ अशुद्ध आयरन कैथोड का तथा शुद्ध आयरन ऐनोड का कार्य करता है एवं सतह पर उपस्थित जलीय विलयन जिसमें O2 तथा CO2 घुली हुई हैं, विद्युत्-अपघट्य का कार्य करता है। इस प्रकार लोहे की सतह पर एक विद्युत-रासायनिक सेल का निर्माण हो जाता है। सेल में होने वाली अभिक्रियाएँ निम्न हैं
ऐनोड पर: लोहे का ऑक्सीकरण होता है और Fe2+ आयन विलयन में चले जाते हैं।
Fe → Fe2+ + 2e- (ऑक्सीकरण)
कैथोड अभिक्रिया: 2H2O + 2e- → H2 + 2OH- (अपचयन)
फेरस आयन (Fe2+) हाइड्रॉक्साइड से क्रिया करके फेरस हाइड्रॉक्साइड बनाता है।
Fe2+ + 2OH- → Fe(OH)2
Fe (OH)2 वायु द्वारा Fe (OH)3 में आक्सीकृत हो जाता है। Fe2+ आयन लोहे की सतह पर वायुमण्डलीय ऑक्सीजन द्वारा ऑक्सीकृत होकर फेरिक ऑक्साइड बनाते हैं जिसे जंग कहते हैं।
4Fe2+ + O2 + 4H2O → 2Fe2O3 + 8H+
Fe2O3 + xH2O → Fe2O3 . xH2O
जंग लगने से लोहा, आयरन ऑक्साइड में परिवर्तित हो जाता है जो कि भारी होता है। इस कारण जंग लगने से लोहा भारी हो जाता है।
प्रश्न 7.
निम्न सेलों की संरचना तथा कार्य प्रणाली का वर्णन कीजिए।
1. शुष्ट सेल तथा
2. मर्करी सेल।
उत्तर:
प्राथमिक बैटरियाँ (Primary Batteries):
प्राथमिक बैटरियों में अभिक्रिया केवल एक बार होती है तथा कुछ समय के प्रयोग के बाद बैटरी निष्क्रिय हो जाती हैं एवं पुनः प्रयोग में नहीं लाई जा सकती हैं। ये निम्न प्रकार की होती हैंं।
(1) शष्क सेल (Dry Cell): इसका आविष्कार लेक्लांशे ने किया था, अत: इसे लेक्लांशे सेल भी कहते हैं। ये सामान्य रूप से ट्रांजिस्टरों एवं घड़ियों में प्रयोग में लाये जाते हैं। इस सेल में जिंक का एक पात्र होता है जो ऐनोड का कार्य करता है तथा कार्बन ग्रेफाइट की छड़ जो चारों ओर से मैंगनीज डाइ-ऑक्साइड के चूर्ण तथा कार्बन से घिरी रहती है, कैथोड का कार्य करती है। - इलेक्ट्रोडों के बीच का स्थान अमोनियम क्लोराइड (NH4CI) एवं जिंक क्लोराइड (ZnCl2) के नम पेस्ट से भरा रहता है। इसमें इलेक्ट्रोड अभिक्रियाएँ जटिल होती हैं, परन्तु इन्हें संक्षेप रूप से निम्नलिखित प्रकार से लिखा जा सकता है
ऐनोड, Zn(s) → Zn2+ + 2e-
कैथोड, MnO2 + NH4+ + → MnO(OH) + NH3

कैथोड की अभिक्रिया में मैंगनीज + 4 से + 3 ऑक्सीकरण अवस्था में अपचयित हो जाता है। अभिक्रिया में उत्पन्न अमोनिया Zn2+ के साथ संकुल [Zn(NH3)4]2+ बनाती है। सेल का विभव लगभग 1.5 V होता है।
शुष्क सेल की आयु अधिक नहीं होती है। चूंकि NH4Cl अम्लीय होने के कारण जिंक पात्र को संक्षारित कर देता है चाहे सेल का प्रयोग न किया जा रहा हो।
प्रश्न 8.
एक लेड संचायक बैटरी की संरचना तथा कार्य प्रणाली का वर्णन कीजिए। इस बैटरी के पुनः आवेशन में निहित अभिक्रियाओं को लिखिए।
या
किसी व्यापारिक सेल का वर्णन कीजिए।
या
सीमा संचायल सेल का संक्षिप्त वर्णन करते हुए इसके ऐनोड और कैथोड पर होने वाली अभिक्रियाएं लिखिए।
उत्तर:
लेड संचायक बैटरी-यह सबसे अधिक प्रयोग की जाने वाली संचायक बैटरी है। इसका उपयोग सभी स्वचालित वाहनों, जैसे-कार, बस आदि में तथा घरेलू ऊर्जा स्त्रोतों (power inverters) में किया जाता है। इसमें अनेक लेड संचायक सेल (lead storage cells) श्रेणीक्रम में व्यवस्थित होते हैं।
संरचना एवं कार्यव्रणाली के लिए अनुच्छेद 3.6.2 का अध्ययन करें।

प्रश्न 9.
कोलराश के नियम की सहायता से आप ऐसीटिक. अम्ल की अनन्त तनुता पर मोलर चालकता किसी प्रकार ज्ञात करेंगे?
उत्तर:
कोलराउश के नियम की सहायता से किसी दुर्बल विद्युत अपघटय की अन्तर तनुता पर मोलर चालकता का निर्धारण आसानी से किया जा सकता है। जैसे - CH3COOH के लिए ∆∞M का मान निम्न प्रकार से प्राप्त किया जा सकता है
कोलराउश के नियम के अनुसार,
Λ∞m (CH3COOH) = Λ∞H + + Λ∞CH3COO- ........... (i)
यदि H+ आयन तथा CH3COO आयन के लिए अनन्त तनुता पर मोलर चालकताओं के मान ज्ञात हैं। तो उपर्युक्त समीकरण की सहायता से CHCOOH के लिए ∆∞M का मान आसानी से ज्ञात किया जा सकता है। यदि आयनिक चालकताएँ ज्ञात नहीं है तो निम्न परोक्ष विधि का प्रयोग किया जाता है परोक्ष विधि में तीन (या अधिक) ऐसे प्रबल विद्युत अपघटयों का चुनाव किया जाता है जिनक ∆∞M के मानों के योग/अन्तर से विचाराधीन दुर्बल विद्युत अपघटय के का मान प्राप्त किया जा सके जैसे - CH3COOH के Am के मान को निर्धारित करने के लिए HCl, CH3COONa तथा NaCl का चुनाव किया जाता है और इनके ∆∞M के मानों को बहिर्वेशन विधि द्वारा ज्ञात कर लिया जाता है। कोलराउश के नियम के अनुसार,
Λ∞m (HCI) = Λ∞H + + Λ∞ Cl-
Λ∞m (CH3COONa) = Λ∞CH3COO- + Λ∞Na+
Λ∞m(NaCl) = Λ∞Na+ + Λ∞ Cl- ....... (iv)
समीकरण (ii) व (iii) के योग में से समीकरण (iv) को घटाने पर
Λ∞m (HCI) + Λ∞m (CH3COONa) + Λ∞m(NaCl) = (Λ∞H + + Λ∞ Cl-) + (Λ∞CH3COO- + Λ∞Na+) + (Λ∞Na+ + Λ∞ Cl-)
= (Λ∞H+ + Λ∞CH3COO- ) = Λ∞m (CH3COOH)
इस प्रकार,
HCI, CH3COONa तथा NaCl के ∆∞M के मान ज्ञात होने पर उपयुक्त समी. की सहायता से CH3COOH के लिए ∆∞M की गणना की जा सकती है।
इस प्रकार,
Λ∞m (NH4OH) = Λ∞m (NH4CI) + Λ∞m (NaOH) - Λ∞m (NaCl)
आंकिक प्रश्न:
प्रश्न 1.
(a) अभिक्रिया
Mg + Cu2+(aq) → Mg (aq) + Cu(s) के लिये A,G परिकलित करें। (दिया गया है, E = +2.71V IF = 96500C mol-1)
(b) अपोलो अंतरिक्ष प्रोग्राम के लिये विद्युत् शक्ति उपलब्ध कराने के लिये प्रयुक्त सेल के प्रकार का नाम लिखिये।
उत्तर:
(a) ∆G° = - nFE cell
= - 2 x 96500 x 2.71
= - 523030 Jmol-1
= - 523.03 k J mol-1
(b) ईंधन सेल।
प्रश्न 2.
एकचालकता सेल के प्रत्येक इलेक्ट्रोड का क्षेत्रफल 4.5 cm एवं उनके बीच की दूरी 1.5 cm है। भरे गये लवण के 0.2 M विलयन का प्रतिरोध 25 ohm है। सेल का सेल स्थिरांक और विलयन
की आण्विक चालकता ज्ञात कीजिए।
उत्तर:
= 1.5cm
A = 4.5 cm
सेल स्थिरांक (G*) = l/A
= \(\frac{1: 5}{4 \cdot 5}\)
= 0.333 cm-1
विशिष्ट चालकता (K) = \(\frac{1}{R} \times G^*\)
= -1/5 x 0.333
= 0.0133 ohm-1 cm-1
आण्विक चालकता (Λm) = 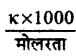
= \(\frac{0.0133 \times 1000}{0.2}\)
= 66.5 ohm-1 cm2 mol-1
प्रश्न 3.
अनन्त तनुता पर Nal, CH3COONa (CH3COO)2 Mg की मोलर चालकता क्रमश: 13.5, 10.2 तथा 18.50 Sm2 mol-1 है। अनन्त तनुता पर Mg L2 की मोलर चालकता क्या है?
उत्तर:
MgI2 = Mg2+ + 2I-
Λ∞m(Mgl2) = Λ∞mMg2+ + 2Λ∞I-
इस समीकरण में 2 मोल Λ∞Na+ तथा 2 मोल Λ∞CH3OCOO- को जोड़ने पर तथा घटाने पर
Λ∞m(MgI2) = Λ∞Mg + 2Λ∞I- + 2 Λ∞Na+ - 2Λ∞Na+ + 2Λ∞CH3COO- - 2Λ∞CH3COO
= (2Λ∞CH3COO- + Λ∞Mg2+) + (2Λ∞Na++ 2Λ∞I-) - (2Λ∞Na+ + 2Λ∞CH3COO-)
= Λ∞m [(CH3COO)2Mg] + 2 Λ∞M (Nal)- 2 Λ∞M (CH3COONa)
= 18.5 + 2 x 13.5 - 2 x 10.2
= 185 + 27 - 20.4
= 25.1 Sm2 mol-1

प्रश्न 4.
0.001 moL-1 एसिटिक अम्ल की चालकता 5 x 10-5 Scm-1 है। यदि एसिटिक अम्ल के Λm 0 का मान 250 Scm2 mol-1 हो, तो इसके वियोजन स्थिरांक का मान ज्ञात कीजिए।
उत्तर:
दिये गये एसिटिक अम्ल विलयन की मोलर चालकता

= \(\frac{5 \times 10^{-5} \mathrm{Scm}^{-1} \times 1000 \mathrm{~cm}^3}{0.001 \mathrm{~mol} \mathrm{~cm}^{-3}}\)
= 50 Scm2 mol-1
(ii) वियोजन की मात्रा α = 
α = \(\frac{50 \mathrm{Scm}^2 \mathrm{~mol}^{-1}}{250 \mathrm{Scm}^2 \mathrm{~mol}^{-1}}\)
= 1/5 =0.2
(iii) वियोजन स्थिरांक K = \(\frac{C \alpha^2}{(1-\alpha)}\)
\(\begin{aligned} &K=\frac{0.001 \times 0.04}{0.8} \\ &K=\frac{4 \times 10^{-5}}{0.8} \end{aligned}\)
K = 5 x 10-5 mol L-1
वियोजन स्थिरांक का मान 5 x 10-5 mol L-1 होगा।
प्रश्न 5.
NaCI, HCI तथा CH3COOH हेतु Λ°m का मान क्रमशः 110, 100 तथा 390 S cm-2 mol-1 है तो CH3COONa हेतु Λ°m का मान ज्ञात कीजिए।
उत्तर:
कोलराउश के नियमानुसार Λ°CH3COONa = Λ°CH3COOH + Λ°NaCl - Λ°HCL
= 390 + 110 - 100
= 400 Scm-2 mol-1
अत: CH3COONa Λ°m का मान 400 S cm-2 mol-1 होगा।
प्रश्न 6.
0.15 mol L-1 NaCIविलयन से भरे एक चालकता सेल का प्रतिरोध 502 है। यदि उसी सेल का प्रतिरोध 0.02 mol L-1 NaCl विलयन भरने पर 5000 हो तो 0.02 mol-1 NaCl विलयन की चालकता ज्ञात करो।
(0.15 mol L-1 NaCl विलयन की चालकता 1.5 S/m है।
उत्तर:
(i) NaCl विलयन से भरे सेल का सेल स्थिरांक
x = चालकता - प्रतिरोध
x = 1.5 S/m x 500
x = 75m-1
(ii) 0.02 mol L-1NaCl विलयन की चालकता

K = \(\frac{75 \mathrm{~m}^{-1}}{500 \Omega}\)
= 0.15 Sm-1
सेल की चालकता 0.15 Sm-1 होगी।
प्रश्न 7.
निम्नलिखित सेल के लिए e.m.f. परिकलित कीजिए
Zn(s)/zn2+ (0.1 M) || (0.01 M Ag+/Ag(s)
दिया है : E°Zn2+/Zn = - 0.76 V, E°Ag+/Ag = + 0.80 V
[दिया है : log 10 = 1]
उत्तर:
उपयुक्त सेल समीकरण
Zn + 2Ag+ → Zn2+ + 2Ag
नेन्स्ट समीकरण
Ecell = E°cell + \(\frac{0.059}{n} \log \frac{\left[\mathrm{Z}_n\right][\mathrm{Ag}+]^2}{\left[\mathrm{Z}_n^{2+}\right][\mathrm{Ag}]^2}\)
यदि [Cu] = [Ag] = 1 Eon = (E°Cathode - E°Anode) + \(\frac{0.059}{n} \log \frac{\left[\mathrm{Ag}^{+}\right]^2}{\left[\mathrm{Z}_n^{2+}\right]}\)
= [0.80 - (0.76)] + \(\frac{0.059}{2} \log \frac{(1.01) 2}{(0.1)}\)
= 1.56 + 0.05/2 log \(\frac{10^{-2} \times 10^{-2}}{10^{-1}}\)
= 1.56 + \(\frac{0.059}{2}\) log 10-4 + 1
= 1.56 + \(\frac{0.059}{2}\) log 10-3
= 1.56 + 0.0295 x (-3)
= 1.56 - 0.0885
= 1.4715 V

प्रश्न 8.
कॉपर सल्फेट के विलयन को 1-5 एम्पियर की धारा से 20 मिनट तक विद्युत्-अपघठन किया गया। कैथोड पर निक्षेपित कॉपर का द्रव्यमान क्या होगा? (F = 96500C)
उत्तर:
धारा (i) = 1.5A
समय (t) = 20 min
= 20 x 60s
= 1200
Q = i x t
= 1.5 x 1200 = 1800C
Cu2+ + 2e — Cu
2 mol 63 g
2 mol इलेक्ट्रॉन = 2 x 96500C
=193000C
193000 C विद्युत् धारा से निक्षेपित होता है = 63g Cu
900 C विद्युत् आवेश से निक्षेपित होता है = \(\frac{63 \times 1800}{193000}\)
= 0.588gCu
= 0.588 g Cu निक्षेपित होगा।
प्रश्न 9.
निम्नलिखित सेल के लिए 25°C पर सेल अभिक्रिया का e.m.f. तथा AG ज्ञात कीजिए
Zn(s) | Zn2+ (0.0004 M)|| Cd2+ (0.2 M)| Cd(s)
दिया गया है, .
E°zn2+ /Zn = - 0.763V
E°Cd2+ / Cd = - 0.403 V
उत्तर:
सेल अभिक्रिया निम्न होगी
Zn + Cd2+ → Zn2+ + Cd
Eसेल = E°सेल + \(\frac{0.059}{n} \log \frac{[\mathrm{Zn}]\left[\mathrm{Cd}^{2+}\right]}{\left[\mathrm{Zn}^{2+}\right][\mathrm{Cd}]}\)
लेकिन [Zn] = [Cd] =1
Eसेल = (E°4घोड - E°नेड) + \(\frac{0.059}{n} \log \frac{\left[\mathrm{Cd}^{2+}\right]}{\left[\mathrm{Zn}^{2+}\right]}\)
= (E°Cd2+ /Cd - E°(zn2+/ Zn)) + \(\frac{0.059}{2} \log \frac{\left[\mathrm{Cd}^{2+}\right]}{\left[\mathrm{Zn}^{2+}\right]}\)
= [- 0.403 - (-0.763)] + \(\frac{0.059}{2} \log \frac{0.2}{0.0004}\)
= -0.403 + 0.763 + 0.059/2
= 0.36 + 0.059/2 [-0.6989 - (0.6020 - 4)]
= 0.36 + 0.059/2 [-0.6989 - (-3.398)]
= 0.36 + 0.059/2 [-0.6989 + 3.398]
= 0.36 + 0.059/2 × 2.6991
= 0.36 + 0.0796
∴ Eसेल = 0.4396 v
∆G = -nF Ecell
∆G = - 2 × 96500 × 0.4396
= - 84842.8 j mol-1
= - 84.8 KJ mol-1
प्रश्न 10.
0.05 M KOH विलयन के कॉलम का विद्युत प्रतिरोध 5 x 103 ohm है। इसका अनुप्रस्थ-काट क्षेत्रफल 0.625 cm2 और लम्बाई 50 cm है। इसकी प्रतिरोधकता, चालकता तथा मोलर चालकता का परिकलन कीजिए।
उत्तर:
अनुप्रस्थ काट का क्षेत्रफल (A) = 0.625 cm2
1 = 50 cm
\(R=\frac{\rho}{A}\)
= \(\frac{5 \times 10^3 \Omega \times 0.625 \mathrm{~cm}^2}{50 \mathrm{~cm}}\)
= 0.625 x 102 Ωcm
= 62.5 2 cm
चालकता (K) = 1/p
= \(\left(\frac{1}{62.5}\right) 5 \mathrm{~cm}^{-1}\)
= 0.016 S cm-1
मोलर चालकता (Am) = \(\frac{\mathrm{K} \times 1000}{\mathrm{C}} \mathrm{cm}^3 \mathrm{~L}^{-1}\)
= \(\frac{0.016 \mathrm{~S} \mathrm{~cm}^{-1} \times 1000 \mathrm{~cm}^3 \mathrm{~L}^{-1}}{0.05 \mathrm{~mol} \mathrm{~L}^{-1}}\)
= 320 S cm2 mol-1

प्रश्न 11.
निम्नलिखित सेल के लिए 293K पर विद्युत वाहक बल तथा मुक्त ऊर्जा परिवर्तन के मान ज्ञात कीजिए।
Zn(s) | Zn2+(aq) (0.1 M) || Cu2+ (aq) (1.0M)|Cu(s)
दिया गया है
E°zn2+ /Zn = - 0.76
वोल्ट, E° Cu2+ | Cu = + 0.34 वोल्ट
F = 96500 कूलॉम मोल-1, log10 = 1)
उत्तर:
सैल Zn(s) | Zn2+(aq) (0.1 M) || Cu2+ (aq) (1.0M)|Cu(s)
सैल अभिक्रिया Zns + Cu2+(aq) → Zn2+(aq) + Cu(s)
नेटं समीकरण के अनुसार
Eसैल = Eसैल - \(\frac{0.059}{2} \log \frac{\left[Z n_{(a q)}^{2+}\right]}{\left[C u_{(a q)}^{2+}\right]}\)
Eसैल = E° Cu2+ | Cu - E°zn2+ /Zn
= 0.34 - (-0.76)
= 1.10volt
Eसैल = 1.10 - \(\frac{0.059}{2} \log -\frac{0.1}{1.0}\)
= 1.10 volt + 0.0295
= 1.129V
∆G = nEसैल
= -2. x 96500 x 1.129
= -217897J mol-1
= -217.9KJ mol-1
प्रश्न 12.
एक सेल का मानक e.m.f. ज्ञात कीजिए जिसकी सेल अभिक्रिया निम्न है
Zn + 2Ag+ Zn2+ + 2Ag
दिया है:
E°zn2+ /Zn = - 0.76 V,
E°Ag2+ /Ag = + 0.80V
उत्तर:
Ecell = E cathode - E°Anode
= E°Ag+/Ag - E°zn2+/Zn
= 0.80 - (-0.76)
= 0.80 + 0.76 = 1.56V
प्रश्न 13.
निम्नलिखित सेल के विद्युत वाहक बल की गणना कीजिए
Cu | Cu++(1M) | Ag+ (IM)|Ag
दिया है : E° Cu2+ | Cu = + 0.34 volt
E° Ag+ | Ag = + 0.80 volt
उत्तर:
- ve ध्रुव +ve ध्रव
Cu | Cu2+ (IM) || Ag+ (IM) | Ag
सेल का अर्द्ध अभिक्रिया समी.
Cu→ Cu2+ + 2e ऑक्सीकरण (ऐनोड)
2Ag+ + 2e → 2Ag अपचयन (कैथोड)
सेल का पूर्ण अभिक्रिया समीकरण
Cu(s) + 2Ag+ (aq) → Cu2+ + 2Ag
EAg = E - 0.0591/n log [Ag+]
= + 0.80 - 0.0591/1 log 1 = + 0.80 Volt
ECu = E°Cu - 0.0591/2 log [Cu+]
= + 0.34 - 0.0591/2 log 1
= + 0.34
Ecell = Ecathode - Eanode = 0.80 - 0.34
= 0.46 Volt
प्रश्न 14.
निम्नलिखित सेल का e.m.f. निकालिए। यह भी बताइए कि कौन-सा इलेक्ट्रोड धन ध्रुव और कौन-सा ऋण ध्रुव है? सेल में होने वाली अर्द्ध अभिक्रियाएँ और पूर्ण अभिक्रियाएँ लिखिए।
Ni | Ni++ (0.1M) || Ag+ (0.1M) | Ag
E° Ni++ | Ni = - 0.25 v और E° Ag+ | Ag = + 0.80 V
उत्तर:
- ve ध्रव + ve ध्रव
Ni || Ni++ (0.1M) || Ag+ (0.1M)|Ag
सेल का अर्द्ध अभिक्रिया समी.
Ni(s) → Ni++ (aq) + 2e
(ऑक्सीकरण) (ऐनोड)
2Ag+ + 2e → 2Ag (अपचयन (कैथोड) सेल का पूर्ण अभिक्रिया समी.
Ni(s) + 2Ag+(aq) = Ni++(aq) + 2Ag(s)
EAg = E°Ag - 0.059/n log[Ag+]
= 0.80 - \(\frac{0.059}{1}\) log 1 x 10-1
= 0.80 - 0.059 = 0.741 V
ENi = ENi - 0.0059/n log[Ni++]
= - 0.25 – 0.059/2 log 1 x 10-1
= - 0.25 - 0.029
= - 0.279 v
= Ecathode - Eanode
= 0.741 - (-0.279) = 1.020 V.

प्रश्न 15.
यदि 298 K पर CH3COOH, HCl एवं NaCl के लिए अनन्त तनुता पर मोलर चालकताओं के मान क्रमशः 390.5, 425.4 एवं 126.4 S cm2 mol-1 हैं तो CH3COONa की अनन्त तनुता पर मोलर चालकता ज्ञात कीजिए।
उत्तर:
Λ∞(CH3COONa) = Λ∞(CH3COOH) + Λ∞(NaCl) - Λ∞(HCl)
मान रखने पर
Λ∞(CH3COONa) = 390.5 + 126.4 - 425.4
Λ∞(CH3COONa) = 516.9 - 425.4
Λ∞(CH3COONa) = 915.5 cm2 mol-1
298 K पर 0.10 M KCI विलयन की चालकता 0.0129 S cm-1 है। इसकी मोलर चालकता का परिकलन कीजिए।
मोलर चालकता (Λm) = \(\frac{\mathrm{K} \times 1000}{\mathrm{C}}\)
K = 0.0129 s cm-1, C = 0.10M
Λm = \(\frac{0.0129 \times 1000}{0.10}\)
Λm = 129.0 S cm2 mol-1
प्रश्न 16.
KCI, HCI एवं CH3COOK के लिए Λm के मान क्रमशः 149.8 S cm-2 mol-1 425.9 S cm2 mol-1 एवं 114.4 S cm2 mol-1 हैं। CH3COOH के लिए उत्तर Λm का मान ज्ञात कीजिए।
उत्तर:
Λm(CH3COOH) = ΛM(CH3COOK) + Λm(HCI) - Λm(KCI)
= 114.4 + 425.9 - 149.8
= 540.3 - 149.8
= 390.5 S cm2 mol-1
प्रश्न 17.
5A विद्युत् धारा 30 मिनट में AgNO3 विलयन में से 10.00g सिल्वर निक्षेपित करती है। सिल्वर के विद्युत्-रासायनिक तुल्यांक की गणना कीजिए।
उत्तर:
विद्युत् धारा (i) = 5A
समय (t) =30 min
= 30 x 60s
= 1800s
विद्युत् धारा की मात्रा (Q) =i x t
= 5 x 1800
= 9000C
हम जानते हैं कि
\(\mathrm{Z}=\frac{\mathrm{W}}{i \times t}\)
= \(\frac{10.00}{5 \times 1800}\)
= \(\frac{10.00}{9000}\)
= 0.0011
यहाँ सिल्वर का विद्युत्-रासायनिक तुल्यांक = 0.0011
प्रश्न 18.
डेनियल सैल के लिए मानक इलेक्ट्रोड विभव का मान 1.1V है। एक अभिक्रिया जिसके लिए n का मान 1 हो तो गिब्ज ऊर्जा का परिकलन J mol-1 में ज्ञात कीजिए। (F = 96487C mol-1)
उत्तर:
∆G° = - nF E°सेल
∆GO = मानक गिब्ज ऊर्जा = ?
F = 96487 C mol-1
E°सेल = 1.1V;n=1
∆r G° = -1 x 96487 x 1.1
= -106135.7 J mol-1
प्रश्न 19.
Na2SO4 के लिए की गणना कीजिए।
Λ°Na+ = 50.1 S cm-1 mol-1 तथा Λ°SO2-4 = 160.0 Scm-1 moL-1 है। इसमें प्रयुक्त नियम की परिभाषा लिखिए।
उत्तर:
Λm (Na2SO4) = 2Λ°Na+ + Λ°SO2-4
= 2 x 50.1 + 160.0
= 100.2 + 160.0
= 260.2 S cm-1 mol-1
प्रयुक्त नियम कॉलरॉऊश नियम है। इसके अनुसार, 'अनन्त तनुता पर किसी विद्युत अपघट्य की मोलर चालकता, उस विद्युत अपघट्य के धनायन और ऋणायन की मोलर आयनिक चालकताओं के योग के बराबर होती है।
Λ°m = Λ°v+ + Λ°Λ°
v+ और v- क्रमशः धनायनों और ऋणायनों की संख्या है।

प्रश्न 20.
एक सेल जिसका आरेख:
Zn | Zn2+ (1.0 M) || Cu2+ (1.0 M) | Cu है
यदि.Cu2+/Cu और Zn2+/Zn युग्मों के मानक अपचयन विभव + 0.35V और - 0.763 V हैं तो
(i) सेल अभिक्रिया लिखिए।
(ii) सेल के e.m.f. की गणना कीजिए।
उत्तर:
(i) सेल अभिक्रिया
कैथोड पर, Cu2+ + 2e- → Cu(अपचयन)
ऐनोड पर, Zn → Zn2+ + 2e- (ऑक्सीकरण)
Cu2+ + Zn → Zn2+ + Cu
0059, [Cu2+][Zn] Izn] = [Cu] = 1
(i) Ecell = E° cell + \(\frac{0.059}{n} \log \frac{\left[\mathrm{Cu}^{2+}\right][\mathrm{Zn}]}{\left[\mathrm{Zn}^{2+}\right][\mathrm{Cu}]}\)
[Zn] = [CU] = 1
Ecell = [E°(cathode) – E° Anode)] + \(\frac{0.059}{2} \log \frac{\left[\mathrm{Cu}^{2+}\right]}{\left[\mathrm{Zn}^{2+}\right]}\)
= 0.35 - (-0.763) + 0952/2 log1
= 0.35 + 0.763 + \(\left(\frac{0.059}{2} \times 0\right)\)
=1.113V
प्रश्न 21.
एक अभिक्रिया निम्न है:
2Ag+ + Cd = 2Ag + Cd+
यदि Ag+ + e → Ag और Cd2+ + 2e- → Cd
युग्मों के अपचयन विभव क्रमशः + 0.80 V और - 0.40 V हैं, तो
(i) इस अभिक्रिया का E क्या होगा?
(ii) जिस सेल में यह अभिक्रिया हो रही है उसका कौन-सा : इलेक्ट्रोड ऋणात्मक होगा?
उत्तर:
(i) E°Cell = E°Ccathode) - E°CAnode)
= E°(Ag+/Ag) - EP(Cd2+/Cd)
=+ 0.80 - (-0.40)
= 0.80 + 0.40
= 1.2v
(ii) Cd इलेक्ट्रोड ऋणात्मक होगा।
प्रश्न 22.
अनन्त तनुता पर MgCl2 विलयन की मोलर चालकता परिकलित कीजिए। यदि Λ∞mMg2+ तथा Λ∞Cl- की आयनिक चालकता क्रमशः 106.1 तथा 76.3 S cm2 mol-1 हैं।
उत्तर:
MgCl2 → Mg2+ + 2 Cl-
Λ∞m(MgCl2) = Λ∞mMg2+ + Λ∞ Cl-
= 106.1 + 2 x 76.3
Λ∞m(MgCl2) = 106 -1 + 152.6
= 258.7 S cm2 mol-1
प्रतियोगी परिक्षा में पूछे गये प्रश्न:
प्रश्न 1.
जिंक को आयरन पर लेपित करने से जस्तेदार लोहा (आयरन) बनता है, जबकि इसका विपरीत सम्भव नहीं। इसका कारण है।
(a) जिंक का ऋणात्मक इलेक्ट्रोड विभव आयरन से ज्यादा है।
(b) जिंक, आयरन से हल्का होता है।
(c) जिंक का गलनांक आयरन से कम होता है।
(d) जिंक का ऋणात्मक इलेक्ट्रोड विभव आयरन से अधिक होता।
उत्तर:
(a) जिंक का ऋणात्मक इलेक्ट्रोड विभव आयरन से ज्यादा है।
प्रश्न 2.
सेल अभिक्रिया के लिए:
2Fe3+ (aq) + 2I-(aq) → 2Fe2+(aq) + I2(aq)
- 298 K पर Eसेल = 0.24 V है। सेल अभिक्रिया की मानक गिब्ज़ ऊर्जा (∆°G) होगी: [दिया गया है, फैराडे स्थिरांक F = 96500 C mol-1]
(a) 23.16 i J mol-1
(b) -46.32 i J mol-1
(c) -23.16 i J mol-1
(d) 46.32 i J mol-1
उत्तर:
(b) -46.32 i J mol-1
प्रश्न 3.
एक सेल के लिए जिसमें एक इलेक्ट्रॉन सम्मिलित है, 298 K पर E°सेल = 0.24 V है। सेल अभिक्रिया के लिए साम्य स्थिरांक [दिया गया है T = 298 K पर, imm = 0.059 V]
(a) 1.0 x 1030
(b) 1.0 x 102
(c) 1.0 x 105
(d) 1.0 x 1010
उत्तर:
(d) 1.0 x 1010

प्रश्न 4.
एक विद्युत् रसायन सेल, Zn|ZnSO4 (0.01 M) || CuSO4 (1.0 M) | Cu, इस डेनियन सेल का emf E1 है। जब ZnSO4 की सांद्रता को 1.0 M तक परिवर्तित तथा CuSO4 की सांद्रता को 0.01 M तक परिवर्तित किया जाता है, तो emf में परिवर्तन E2 है। निम्न में से कौन-सा E1 एवं E2 में संबंध है?
(दिया गया, RT/F = 0.059)
(a) E = E2
(b) E < E2
(c) E1 > E2
(d) E2 = 0 ≠ E
उत्तर:
(c) E1 > E2
प्रश्न 5.
0.5 mol/dm3 AgNO3 के विलयन, जिसकी विद्युत् अपघटनी चालकता 5.76 x 10-3 s cm-1 है, की 298 K पर मोलर चालकता है
(a) 0.086S cm2 / mol
(b) 28.8 S cm2 / mol
(c) 2.88 S cm2 / mol
(d) 11.52 Scm2 / mol
उत्तर:
(d) 11.52 Scm2 / mol
प्रश्न 6.
गलित सोडियम क्लोराइड के विद्युत् अपघटन के दौरान 3 ऐम्पियर धारा से 0.10 मोल क्लोरीन गैस के बनने में कितना समय लगता है?
(a) 220 मिनट
(b) 330 मिनट
(c) 55 मिनट
(d) 110 मिनट
उत्तर:
(d) 110 मिनट
प्रश्न 7.
यदि किसी दी गयी अभिक्रिया के लि का मान ऋणात्मक है, तो ∆G° एवं K के मानों के लिए सही सम्बन्ध हैं:
(a) ∆G° < 0; Keq > 1
(b) ∆G° < 0; Keq < 1
(c) ∆G° > 0; Keq < l
(d) ∆G° > 0; Ke∆ > 1
उत्तर:
(c) ∆G° > 0; Keq < l
प्रश्न 8.
1 ऐम्पियर धारा पर विद्युत् अपघटन के दौरान 60 सेकण्ड में कैथोड पर इलेक्ट्रॉनों की मुक्त संख्या है (इलेक्ट्रॉन का आवेश = 1.60 x 10-19 C)
(a) 3.75 x 1020
(b) 7.48 x 1023
(c) 6 x 1023
(d) 6 x 1020
उत्तर:
(a) 3.75 x 1020
प्रश्न 9.
ज़िक को आयरन पर लेपित करने से जस्तेदार लोहा (आयरन) बनता है, जबकि इसका विपरीत संभव नहीं है। इसका कारण है:
(a) जिंक का ऋणात्मक इलेक्ट्रोड विभव आयरन से कम है।
(b) जिंक का ऋणात्मक इलेक्ट्रोड विभव आयरन से ज्यादा है।
(c) जिंक, आयरन से हल्का होता है।
(d) जिंक का गलनांक आयरन से कम है।
उत्तर:
(a) जिंक का ऋणात्मक इलेक्ट्रोड विभव आयरन से कम है।
प्रश्न 10.
298 K पर शुद्ध जल में H2- इलेक्ट्रोड का विभव शून्य करने के लिए आवश्यक H2 दाब है
(a) 10-10 atm
(b) 10-4 atm
(c) 10-14 atm
(d) 10-12 atm
उत्तर:
(b) 10-4 atm

- RBSE Class 12 Chemistry Notes Chapter 16 दैनिक जीवन में रसायन
- RBSE Class 12 Chemistry Notes Chapter 15 बहुलक
- RBSE Class 12 Chemistry Notes Chapter 14 जैव-अणु
- RBSE Class 12 Chemistry Notes Chapter 13 ऐमीन
- RBSE Class 12 Chemistry Notes Chapter 12 ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
- RBSE Class 12 Chemistry Notes Chapter 11 ऐल्कोहॉल, फीनॉल एवं ईथर
- RBSE Class 12 Chemistry Notes Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
- RBSE Class 12 Chemistry Notes Chapter 9 उपसहसंयोजन यौगिक
- RBSE Class 12 Chemistry Notes Chapter 8 d- एवं f-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम