RBSE Class 12 Chemistry Important Questions Chapter 2 विलयन
Rajasthan Board RBSE Class 12 Chemistry Important Questions Chapter 2 विलयन Important Questions and Answers.
Rajasthan Board RBSE Solutions for Class 12 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 12. Students can also read RBSE Class 12 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 12 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 12 Chemistry Chapter 2 Important Questions विलयन
बहुविकल्पीय प्रश्न:
प्रश्न 1.
मोलल जलीय विलयन में विलेय का मोल प्रभाज है:
(i) 1
(ii) 1.8
(iii) 18
(iv) 0.018
उत्तर:
(iv) 0.018
प्रश्न 2.
शुद्ध जल की मोलरता होती है:
(i) 55.56
(ii) 5.556
(iii) 0.18
(iv) 0.018
उत्तर:
(ii) 5.556

प्रश्न 3.
0.2 M HSO, विलयन की सान्द्रता ग्राम प्रति लीटर में होगी:
(i) 21.4
(ii) 39.2
(iii) 9.8
(iv) 19.6
उत्तर:
(iii) 9.8
प्रश्न 4.
किसका वाष्प दाब न्यूनतम होगा?
(i) 0.1 MBACl2 विलयन
(ii) 0.1 M फोनॉल विलयन
(iii) 0.IM सुक्रोस विलयन
(iv) 0.1 M सोडियम क्लोराइड विलयन
उत्तर:
प्रश्न 5.
12.0 ग्राम यूरिया को 1 लीटर जल में घोला गया तथा 68.4 ग्राम सुक्रोज को 1 लीटर जल में घोला गया। यूरिया बिलयन के वाष्पदाब का आपेक्षित अवमन होगा:
(i) सुक्रोस विलयन की अपेक्षा अधिक
(ii) सुक्रोस विलयम की अपेक्षा कम
(iii) सुक्रोस विलयन की अपेक्षा दोगुना
(iv) सुक्रोस विलयन के बराबर
उत्तर:
(iii) सुक्रोस विलयन की अपेक्षा दोगुना
प्रश्न 6.
निम्न के 0.1 M जलीय मोलल विलयन में न्यूनतम हिमांक किसका
(i) पोटैशियम सल्फेट
(ii) सोडियम क्लोराइड
(iii) यूरिया
(iv) ग्लूकोस
उत्तर:
(ii) सोडियम क्लोराइड
प्रश्न 7.
दो द्रवों P एवं एके वाष्पदाव क्रमश: 80 mm एवं 60 mm हैं। P के 3 मोल तथा Q के 2 मोल मिलाने पर प्राप्त विलयन का कुल वाष्पदाब होगा
(i) 140mm
(ii) 20mm
(iii) 68mm
(iv) 72mm
उत्तर:
(iv) 72mm
प्रश्न 8.
निम्नलिखित में से कौन-सा अणुसंख्य गुणधर्म है?
(i) श्यानता
(ii) परासरण दाब
(iii) प्रकाशिक पूर्णन
(iv) पृष्ठ तनाव
उत्तर:
(ii) परासरण दाब

प्रश्न 9.
निम्नलिखित में से विलयन का कौन-सा भौतिक गुण अणुओं की संख्या पर निर्भर नहीं करता?
(i) वाह्य सह अवनमन
(ii) हिमांक अवनमन
(ii) पृष्ठ तनाव
(iv) परासरण दाब
उत्तर:
(i) वाह्य सह अवनमन
प्रश्न 10.
निम्न में किसके जलीय विलयन का क्वथनांक सर्वाधिक होगा?
(i) 1% ग्लूकोस
(ii) 1% NaCl
(iii) 1% CaCl2
(iv) 1% सुक्रोस
उत्तर:
(i) 1% ग्लूकोस
प्रश्न 11.
किस सूत्र द्वारा मोलल उन्नयन स्थिरांक (K) की गणना की जा सकती है?
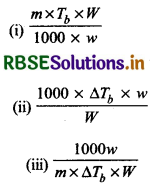
(iv) इनमें से कोई नहीं
उत्तर:
\(\text { (i) } \frac{m \times T_b \times W}{1000 \times w}\)
प्रश्न 12.
निम्नलिखित में से किसका परासरण दाब सबसे कम होता है?
(i) पोटैशियम क्लोराइड विलयन
(ii) स्वर्ण विलयन
(iii) मैग्नीशियम क्लोराइड विलयन
(iv) ऐलुमिनियम फॉस्फेट विलयन
उत्तर:
(iii) मैग्नीशियम क्लोराइड विलयन
प्रश्न 13.
किसी विलयन का परासरण दाब किस सम्बन्ध द्वारा प्रदर्शित किया जाता है?

उत्तर:
\(\text { (iv) } \frac{\mathrm{P}}{\mathrm{C}}=\mathrm{RT}\)
प्रश्न 14.
निम्नलिखित विलयानों में सर्वाधिक परासरण दाब किसका है?
(i) 1 MKCL
(ii) 1M (NH4)3 PO4
(iii) 1 M Bacl2
(iv) 1 M C6H12O6
उत्तर:
प्रश्न 15.
समान ताप पर किस विलयनों के युग्म समपरासरी हैं?
(i) 0.1 M Nacia 0.1 M Na2SO4
(ii) 0.1 Mयूरिया तथा 0.1 MNCI
(iii) 0.1M यूरिया तथा 0.2 M MgCl2
(iv) 0.1 M Ca(NO3)2 910.1 M Na2SO4
उत्तर:
(ii) 0.1 Mयूरिया तथा 0.1 MNCI

प्रश्न 16.
गन्ने की शक्कर (अणुभार 342) का 5% विलयन, पदार्थ के 1% विलयन से समपरासरी है। पदार्थ का अणुभार है
(i) 68.4
(ii) 171.2
(iii) 136.2
(iv) 34.2
उत्तर:
(iv) 34.2
प्रश्न 17.
ग्लूकोस CHHO (मोलर द्रव्यमान : 180g/मोल) के 50 mL जलीय विलयन में 6.02 x 1022 अणु उपस्थित है। विलयन की सांगता होगी।
(i) 0.1 M
(ii) 0.2M
(iii) 1.OM
(iv) 2.0M
उत्तर:
(iv) 2.0M
अति लघूत्तरात्मक प्रश्न:
प्रश्न 1.
क्या गर्मियों में कार के रेडिएटरों में ऐचिल्लीन ग्लाइकॉल के प्रयोग की सलाह दी जाती है?
उत्तर:
नहीं, गर्मियों में कार के रेडिएटरों में ऐथिलीन ग्लाइकॉल की सलाह नहीं दी जाती है क्योंकि ऐथिलीन ग्लाइकॉल जल के हिमांक को कम कर देता है-जो सर्दियों में रेडिएटर में जल को जमने से रोकता है इसलिए इसकी सलाह सर्दियों में दी जाती है।
प्रश्न 2.
प्रतिलोम परासरण को परिभाषित कीजिए।
उत्तर:
यदि बिलयन पर उसके परासरण दाब से अधिक दाब लगाया जाये तो अर्द्धपारगम्य झिल्ली के माध्यम से विलयन से विलायक के अणुओं का प्रवाह शुद्ध विलायक की तरफ होने लगता है। इसे प्रतिलोम परासरण कहते हैं।
प्रश्न 3.
मोलरता किसे कहते हैं? इस पर ताप का प्रभाव लिखिए।
उत्तर:
एक लीटर विलयन में घुले हुए विलेय के मोलों की संख्या विलयन की मोलरता कहते हैं। ताप का प्रभाव-ताप बढ़ाने से विलयन की मोलरता घट जाती है क्योंकि ताप बढ़ाने से विलयन का आयतन बढ़ जाता है।

प्रश्न 4.
विलयन में किसी पदार्थ के मोल अंश को परिभाषित कीजिए।
उत्तर:
विलयन में किसी अववव का मोल अंश विलयन में उस अवयव के मोल और विलयन के सभी अवयवों के कुल मोलों की संख्या का अनुपात होता है।
प्रश्न 5.
मोललता तथा मोलरता में अन्तर दें।
उत्तर:
|
मोलरता |
मोललता |
|
1. 1 L विलयन में उपस्थित विलेय के मोलों की संख्या मोलरता कहलाती है। |
1. 1 kg विलायक में उपस्थित विलेय ' के मोलों की संख्या मोललता कहलाती है। |
|
2. इसकी इकाई mol/L है। |
2. इसकी इकाई molkg है। |
|
3. यह ताप के साथ परिवर्तित होती है। |
3. यह ताप के साथ अपरिवर्तित रहती होती है। |
प्रश्न 6.
निम्नलिखित को क्वथनांक के बढ़ते क्रम में व्यवस्थित कीजिए।
0.1 M Na2SO4 0.1M NaCl, 0.1 M C6H12O6 0.1 M Al2(SO4)3
उत्तर:
0.1 C6H12O6 < o.1 M NaCl < 0.1 M Na2SO4 < 0.1 M Al2(SO4)3
प्रश्न 7.
बेन्जीन में एबेनोइक अम्ल के लिए वाण्ट हॉफ गुणांक का मान कितना होगा?
उत्तर:
बेन्जीन में एथेनोइक अम्ल का वाण्टहॉफ गुणांक 0.5 होगा, क्योंकि एथेनोइक अम्ल द्विलक बनाता है।
प्रश्न 8.
ppm क्या होता है?
उत्तर:
विलेय के भार भागों की वह संख्या जो विलयन के एक मिलियन (100) भार भागों में उपस्थित हो, ppm कहलाती है।

प्रश्न 9.
मोलरता की तुलना में मोललता को वरीयता क्यों दी जाती है.?
उत्तर:
इसका कारण है कि मोललता पर ताप का कोई प्रभाव नहीं पड़ता है एवं यह केवल द्रव्यमानों से सम्बन्धित होती है।
प्रश्न 10.
किसी पदार्थ का 1 मोल 500 m जल में घोला गया। विलयन की मोलरता की गणना कीजिए।
उत्तर:
मोललता = \(\frac{1 \times 1000}{500}\)
प्रश्न 11.
100 g विलायक में विलेय का मोल घुला है। विलयन की मोललता ज्ञात कीजिए।
उत्तर:

= \(\frac{0.1 \times 1000}{1000}\) = 1m
प्रश्न 12.
साधारणतया किसी विलायक में विलेय को घोलने पर उसका क्वथनांक बढ़ जाता है। क्यों? उचित कारण दीजिए।
उत्तर:
किसी विलायक में कोई अवाष्पशील पदार्थ घोलने पर विलयन का वायदाब कम हो जाता है, जिसके परिणामस्वरूप विलयन का क्वथनांक बढ़ जाता है।
प्रश्न 13.
समपरासरी विलयन किसे कहते हैं?
उत्तर:
ऐसे बिलयन, जिनके परासरण दाब समान ताप पर समान हों, समपरासरी विलयन कहलाते हैं। दो समपरासरी विलयनों को अर्द्ध-पारगम्य झिल्ली द्वारा पृथक् करने पर परासरण नहीं होता है।
प्रश्न 14.
5% \(\left(\frac{\mathbf{W}}{\mathbf{V}}\right)\) NaCl के 200 mL विलयन बनाने हेतु कितने ग्राम NaCl की आवश्यकता होगी?
उत्तर:

5 = \(\frac{\mathrm{W}}{200} \times 100\)
W = 10g
प्रश्न 15.
हेनरी का नियम समझाइए।
उत्तर:
हेनरी का नियम (Henry's Law): किसी द्रव में गैस की विलेयता गैस के दाव के समानुपाती होती है, अर्थात् गैस का आंशिक दाब 'P' तथा गैस के मोल अंश (x) हो, तो
p = KH x
जहाँ K = हेनरी स्थिरांक।
प्रश्न 16.
परासरण दाब किसे कहते हैं ?
उत्तर:
परासरण दाब (Osmotic Pressure): किसी विलयन को अर्द्धपारगम्य झिल्ली द्वारा विलायक से पृथक् करके उसके परासरण को रोकने के लिए विलयन पर कम-से-कम जितना बाहा दाय लगाना पड़ता है, विलयन का परासरण दाब कहलाता है।

प्रश्न 17.
विलयन की मोललता ज्ञात करने का सूत्र लिखिए।
उत्तर:

प्रश्न 18.
स्थिर क्वाथी मिश्रण की परिभाषा लिखिए।
उत्तर:
स्थिरक्वाथी मिश्रण (Azeotropic mixture): दो या दो से अधिक अवयवों का ऐसा मिश्रण जो अवयवों के संघटन के प्रभावित हुये बिना एक ही ताप पर आसवित होते हैं। स्थिर क्वाथी मिश्रण (Azootropic Mixture) कहलाते हैं।
प्रश्न 19.
(अ) सामान्यतः ताप बढ़ाने पर गैसों की द्रवों में विलेयता घटती है; कारण दीजिए।
उत्तर:
(अ) स्थिर दाब पर सामान्यत: ताप बढ़ाने पर गैसों की द्रवों में विलेयता घटती है क्योंकि ताप बझने पर द्रव में गैस के अणुओं की गतिज ऊर्जा बढ़ती है जिससे गैस के बाहर निकलने की प्रवृत्ति में वृद्धि होती है।
प्रश्न 20.
मोल अंश को परिभाषित करें।
उत्तर:
मोल अंश-विलयन में किसी अवयव का मोल अंश विलयन में उस अवयव के मोल और विलयन के सभी अवयवों के कुल मोलों की संख्या का अनुपात होता है।
प्रश्न 21.
संतृप्त विलयन क्या होता है?
उत्तर:
संतृप्त विलयन (Saturated Solution): ऐसा विलयन जिसमें एक निश्चित ताप पर और अधिक ठोस घोला न जा सके, संतृप्त विलयन कहलाता है।
प्रश्न 22.
अणुसरख्यक गुण धर्म क्या है? इन गुणों का एक उदाहरण दीजिए।
उत्तर:
वे गुणधर्म जो विलेय के कणों की संख्या पर निर्भर करते है, परन्तु विलेय की प्रकृति पर नहीं, अणुसंख्यक गुणधर्म कहलाते हैं।
उदाहरण: हिमांक में अवनमन
प्रश्न 23.
सोडियम कार्बोनेट के 20% जलीय विलयन से आप क्या समझते हैं?
उत्तर:
सोडियम कार्बोनेट के 20% जलीय विलयन का अर्थ है कि 20g सोडियम कार्बोनेट विलयन के 1008 में उपस्थित है। यहाँ विलायक का भार 80g है।

प्रश्न 24.
विलयन, विलेय एवं विलायक को परिभाषित करें।
उत्तर:
दो या दो से अधिक यौगिकों का समांगी मिश्रण विलयन कहलाता है। इसमें जो अवयव अधिक मात्रा में प्रमुख रूप से उपस्थित होता है विलायक कहलाता है एवं जो अवयव कम मात्रा में होता है, विलेय कहलाता है।
प्रश्न 25.
कच्चे आम को सांद्र लवणीय विलयन में रखे जाने पर क्या होता है?
उत्तर:
सांद्र लवणीय विलयन में रखने पर कच्चा आम बहिः परासरण के कारण जल को बाहर निकाल देता है एवं संकुचित हो जाता
प्रश्न 26.
मोल अंश ज्ञात करने का सूत्र लिखिए।
उत्तर:
अवयव A का मोल अंश = \(\frac{n_{\mathrm{A}}}{n_{\mathrm{A}}+n_{\mathrm{B}}}\)
अवयव B का मोल अंश = \(\frac{n_{\mathrm{B}}}{n_{\mathrm{A}}+n_{\mathrm{B}}}\)
nA = अवयव A के मोलों की संख्या
nB = अवयव B के मोलों की संख्या
प्रश्न 27.
सामान्यतः ताप बढ़ाने पर गैसों की द्रवों में विलेयता घटती है, कारण दीजिए।
उत्तर:
स्थिर दाब पर सामान्यतः ताप बढ़ाने पर गैसों की द्रवों में विलेयता घटती है। क्योंकि ताप बढ़ाने पर द्रव में गैस के अणुओं की गतिज ऊर्जा बढ़ती है। जिससे गैस के अणुओं के बाहर निकलने में वृद्धि होती है।
प्रश्न 28.
विलयन में सभी अवयवों के मोल-अंशों का योग क्या होता है?
उत्तर:
सभी अवयवों के मोल अंशों का योग एक होता है।
प्रश्न 29.
किसी विलयन के परासरण दाब एवं उसके अणु भार में क्या सम्बन्ध है?
उत्तर:
\(\pi \mathrm{V}=\frac{\mathrm{W}_{\mathrm{B}}}{\mathrm{M}_{\mathrm{B}}} \times \mathrm{R} \times \mathrm{T}\)
जहाँ
π = परासरण दाब
V = विलयन का आयतन
WB = विलेय का द्रव्यमान
MB = विलेय का अणु भार
R = गैस नियतांक
T ताप K में
प्रश्न 30.
वाष्य दाब अवनमन के लिये रॉउल्ट का नियम लिखें।
उत्तर:
अवाष्पशील विलेय के विलयन का वाध्य दाब, विलायक के वाष्प दाब से कम होता है अत: रॉयल्ट के अनुसार, "एक निश्चित ताप पर अवाष्पशील विलेय युक्त विलयन के लिये आपेक्षिक वाष्य दाब अवनमन विलेय के मोल अंश के बराबर होता है।"
\(\frac{p_{\mathrm{A}}^0-p_{\mathrm{A}}}{p_{\mathrm{A}}^0}=x_{\mathrm{B}}\)
प्रश्न 31.
गोताखोरों द्वारा ले जाये जाने वाले ऑक्सीजन टैंकों में क्या होता है?
उत्तर:
गोताखोरों द्वारा ले जाये जाने वाले ऑक्सीजन टैंकों में 11.7% हीलियम, 56.2% नाइट्रोजन तथा 32.1% ऑक्सीजन होती है।
प्रश्न 32.
मोलल उन्नयन स्थिरांक अथवा मोलल हिमांक स्थिरांक किसी एक विलायक के लिये निश्चित मान होते हैं, क्यों?
उत्तर:
मोलल उन्नयन (अथवा हिमांक) स्थिरांक K का मान निम्न सूत्र द्वारा दिया जा सकता है।
\(\mathrm{K}=\frac{\mathrm{RT}^2}{1000 \times \mathrm{L}}\)
जहाँ T = विलायक का क्वथनांक (अथवा हिमांक)
L = विलायक के वाष्पन (अथवा गलन) की गुप्त
ऊष्मा/g चूँकि T एवं L के मान किसी विलायक के लिये निश्चित होते हैं। अतः K का मान भी विलायक के लिये निश्चित होता है।

प्रश्न 33.
जल में सोडियम क्लोराइड घोलने से जल के क्वथनांक पर क्या प्रभाव पड़ता है?
उत्तर:
चूँकि जल में नमक घोलने पर नमक के अणु जल की सतह का कुछ भाग घेर लेते हैं अत: वाष्पन के लिये उपलब्ध आपेक्षिक पृष्ठ सतह कम हो जाती है जिससे वाष्पन कम हो जाता है जिसके कारण क्वथनांक बढ़ जाता है।
प्रश्न 34.
क्वथनांक उन्नयन या हिमांक अवनमन की विधि से अणु भार ज्ञात करने में साधारण थर्मामीटर का उपयोग क्यों नहीं किया जाता है?
उत्तर:
क्योंकि क्वथनांक में उन्नयन तथा हिमांक मैं अवनमन बहुत कम होता है। अतः हमें 0.01°C की लघुतम माप के थर्मामीटर की आवश्यकता होती है। ऐसा थर्मामीटर बैकमान ने बनाया था जिसे बैकमान थर्मामीटर कहते हैं।
प्रश्न 35.
एक प्रोटीन के 0.2L जलीय विलयन में 1.26g प्रोटीन है। 300K पर इस विलयन का परासरण दाब 2.578 10-3 bar पाया गया। प्रोटीन के मोलर द्रव्यमान का परिकलन कीजिए।
उत्तर:
\(\mathrm{M}_{\mathrm{B}}=\frac{\mathrm{W} \times \mathrm{R} \times \mathrm{T}}{\pi \times \mathrm{V}}\)
\(=\frac{1.26 \times 0.83 \times 300}{2.57 \times 10^{-3} \times 0.200}\)
= 61.04 × 103 g/mol
प्रश्न 36.
हिमांक अवनमन विधि से किसी अवाष्पशील पदार्थ का अणुभार ज्ञात करने का सूत्र लिखो?
उत्तर:
किसी अवाष्पशील पदार्थ का अणुभार निम्नलिखित सूत्र द्वारा ज्ञात कर सकते है
\(\mathbf{M}_{\mathrm{B}}=\frac{\mathrm{K}_f \times \mathrm{W}_{\mathrm{B}} \times 1000}{\mathrm{~W}_{\mathrm{A}} \times \Delta \mathrm{T}_f}\)
जहाँ
Kf = मोलाल अवनमन स्थिरांक
wB = विलेय का ग्राम में द्रव्यमान
wA = विलायक का भार g में
∆Tf = हिमांक में अवनमन
MB = विलेय का अणु भार।
WA = विलायक का भार में
प्रश्न 37.
समपरासारी विलयन (Isotonie Solution) क्या होते
उत्तर:
समपरासारी विलयन (Isotonie Solution): ऐसे विलयन जिनका परासरण दाब समान ताप पर समान हो, समपरासारी विलयन (isotonic solutions) कहलाते हैं। इनकी मोलर सान्द्रता समान होती है एवं ये अद्धपारगम्य झिल्ली द्वारा परासरण की प्रक्रिया को प्रदर्शित नहीं करते है।
प्रश्न 38.
NaCl, CaCl2, CaF2 आदि को बर्फ से ढकी सड़कों को साफ करने में प्रयुक्त करते हैं, क्यों?
उत्तर:
NaCl, CaCl2 CaF2 आदि विहिमीकारक पदार्थ का कार्य करते है अर्थात् जल के हिमांक को कम कर देते हैं जिससे यह जमकर बर्फ महीं बन पाता है। इसी कारण जब इन्हें सड़कों पर छिड़कते हैं तो बर्फ गल जाती है और रास्ता साफ हो जाता है।
प्रश्न 39.
अणुसंख्यक गुणधर्म कितने प्रकार के होते हैं?
उत्तर:
ये निम्न प्रकार के होते हैं:
- क्वथनांक में उन्नयन
- हिमांक में अवनमन
- वाष्पदाव में कमी
- परासरण दाब।
प्रश्न 40.
जल में चीनी या नमक मिलाने से जल का क्वथनांक क्यों बढ़ जाता है?
उत्तर:
जब किसी अवाष्पशील विलेय को जल में मिलाते हैं तो जल का वाध्य दाब घट जाता है क्योंकि कुछ विलेय के कण विलायक की सतह को घेर लेते हैं जिसके कारण वाध्य दाब कम हो जाता है। वाष्य दाब को वायुमण्डलीय दाब के बराबर करने के लिये उसे अधिक ताप देना होता है, जिस कारण क्वथनांक बढ़ जाता है।
प्रश्न 41.
जल में NaCl घोलने पर विलयन के हिमांक पर क्या प्रभाव पड़ता है?
उत्तर:
जल में नमक घोलने पर नमक के अणु जल की सतह का कुछ भाग घेर लेते हैं अत: वाष्यन के लिये उपलब्ध आपेक्षिक पृष्ठ सतह कम हो जाती है। इसके फलस्वरूप वाष्पन कम होता है अत: हिमांक कम हो जाता है।

प्रश्न 42.
जल में ऐसीटोन घोलने पर उसके क्वथनांक पर क्या प्रभाव पड़ेगा?
उत्तर:
ऐसीटोन वाष्पशील द्रव है अत: विलयन का क्वथनांक जल एवं ऐसीटोन के क्वथनांकों के मानों के बीच रहेगा।
प्रश्न 43.
अजलीय विलयनों के परासरण दाब को प्रयोगात्मक रूप से ज्ञात करने की विधि कौन-सी है?
उत्तर:
टाउनसेंड विधि।
प्रश्न 44.
कार्बनिक प्रकृति की कृत्रिम अर्द्ध-पारगम्य झिल्ली का कार्य कौन करता है?
उत्तर:
फीनॉल का तल।
प्रश्न 45.
तनु विलयन के लिये वाण्टहॉफ समीकरण क्या होता है।
उत्तर:
यदि तनु विलयन में विलेय वियोजित या संगुणित होता है तो इनके अणु भार अपसामान्य निकलते हैं। इनके अपसामान्य अनु भारों को तथा अणुसंख्यक गुणों को स्पष्ट करने के लिये वाण्टहॉफ ने एक गुणांक दिया जिसे वाण्टहॉफ गुणांक ' कहते हैं। इसके अनुसार,

प्रश्न 46.
असामान्य अणुभार को सामान्य अणुभार से सम्बन्धित करने वाले बॉन्ट हॉफ गुणांक का सूत्र लिखिए। यह संगुणन व वियोजन क्रिया से किस प्रकार प्रभावित होता है?
उत्तर:
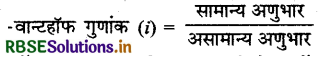
सगुणन में i का मान एक से कम तथा वियोजन में एक से अधिक हैं।
प्रश्न 47.
निम्नलिखित को परिभाषित की लिए।
(अ) आदर्श विलयन
(ब) अनादर्श विलयन
उत्तर:
(अ) आदर्श विलयन-वह विलयन जो ताप एवं सान्द्रता की सभी परासों पर राउल्ट के नियम का पालन करता है, आदर्श विलयन कहलाता है।
(ब) अनादर्श विलयन-वे विलयन जो राउल्ट के नियम का पालन नहीं करते और विलेय तथा विलेवन को मिलाने पर एन्थैल्पी परिवर्तन एवं आयतन परिवर्तन प्रदर्शित करते हैं, अनादर्श विलयन कहलाते हैं।
प्रश्न 48.
जल वाष्य दाब क्या होगा यदि एक चम्मच चीनी उसमें डाल दी जाये?
उत्तर:
जल का वाष्ण दाब घट जायेगा।
प्रश्न 49.
क्वथनांक उन्नयन विधि से किसी अवाष्पशील पदार्थ का अणु भार ज्ञात करने का सूत्र लिखो?
उत्तर:
क्वथनांक उन्नयन विधि से किसी अवाष्पशील पदार्थ का अणुभार निम्न सूत्र द्वारा ज्ञात कर सकते हैं
\(\mathrm{M}_{\mathrm{B}}=\frac{\mathrm{K}_b \times \mathrm{W}_{\mathrm{B}} \times 1000}{\Delta \mathrm{T}_b \times \mathrm{W}_{\mathrm{A}}}\)
Kb = मोलल उन्नयन स्थिरांक
wB = विलेय की मात्रा में
wA = विलायक की मात्रा में
∆T = क्वथनांक में उन्नयन
MB = विलेय का अणु भार
प्रश्न 50.
हिमांक अवनमन विधि से किसी अवाष्पशील पदार्थ का अणुभार ज्ञात करने का सूत्र लिखो?
उत्तर:
किसी अवाध्यशील पदार्थ का अणुभार निम्नलिखित सूत्र द्वारा ज्ञात कर सकते हैं
\(\mathrm{M}_{\mathrm{B}}=\frac{\mathrm{K}_f \times \mathrm{W}_{\mathrm{B}} \times 1000}{\mathrm{~W}_{\mathrm{A}} \times \Delta \mathrm{T}_f}\)
जहाँ
Kf = मोलल अवनमन स्थिरांक
wB = विलेय का में द्रव्यमान
wA = विलायक का भार में
∆Tf = हिमांक में अवनमन
MB = विलेय का अणु भार
लघू उत्तरात्मक प्रश्न:
प्रश्न 1.
बेसों की द्रवों में विलेयता को प्रभावित करने वाले कारक लिखें।
उत्तर:
- ताप का प्रभाव (Effeet of Temperature): ला-शातेलिये के नियमानुसार ताप बढ़ाने पर साम्य ऊष्माशोषी अभिक्रिया की दिशा में विस्थापित हो जाता है। अतः यदि अभिक्रिया ऊष्माक्षेपी है तो ताप बढ़ाने पर ठोसों की विलेयता द्रव में कम हो जाती है और यदि अभिक्रिया ऊष्माशोषी है तो ताप बढ़ाने पर ठोसों की विलेयता अधिक हो जाती है।
- दाब-ठोसों की द्रवों में विलेयता पर दाब का कोई सार्थक प्रभाव नहीं होता है क्योंकि ठोस एवं द्रव अत्यधिक असंपीड्य होते हैं।
- विलेय और विलायक की प्रकृति पर-यदि विलेय ध्रुवीय है तो यह ध्रुवीय विलायक में घुलेगा एवं यदि विलेय अध्रुवीय है तो यह अध्रुवीय विलायक में घुलेगा।
प्रश्न 2.
ऐथेनॉल तथा ऐसीटोन का मिश्रण ऋणात्मक विचलन क्यों प्रदर्शित करता है?
अथवा
ऐथेनॉल व ऐसीटोन का मिश्रण किस प्रकार का विचलन दिखाता है कारण दे।
उत्तर:
ऐथेनॉल तथा ऐसीटोन का मिश्रण जब बनाया जाता है तो अन्तराआण्विक हाइड्रोजन बन्ध के कारण नये आकर्षण बल उत्पन्न होते हैं तथा आकर्षण बल प्रबल हो जाते हैं जिसके कारण विलेय-विलायक अणुओं के मध्य अन्योन्य क्रियाएँ विलेय-विलेय तथा विलायक-विलायक की अपेक्षा प्रबल हो जाती है और इसी कारण ऐथेनॉल तथा ऐसीटोन का मिश्रण ऋणात्मक विचलन प्रदर्शित करता है।

प्रश्न 3.
स्थिरक्याची विलयन क्या हैं? ये कितने प्रकार के होते?
उत्तर:
ऐसे द्विषटकीय मिश्रण, जिनका द्रव व वाष्प प्रावस्था में संघटन समान होता है तथा जो एक स्थिर ताप पर उबलते हैं एवं जिनके घटकों को प्रभाजी आसवन द्वारा अलग नहीं किया जा सकता है। स्थिरक्वाथी विलयन कहलाते हैं। ये दो प्रकार के होते हैं
- न्यूनतम क्वथनांकी स्थिरक्वाथी: जो विलयन एक निश्चित संगठन पर रॉउल्ट नियम से अत्यधिक धनात्मक विचलन प्रदर्शित करते है, न्यूनतम स्थिरक्वाथी विलबन कहलाते हैं। उदाहरण-एथेनॉल एवं जल।
- अधिकतम क्वथनांकी स्थिरक्वाश्थी: वे बिलबन जो कि रॉउल्ट नियम से बहुत अधिक ऋणात्मक विचलन दर्शाते हैं। एक विशिष्ट। संगठन पर अधिकतम क्वथनांकी स्थिरक्वाथी विलयन कहलाते हैं। उदाहरण-नाइट्रिक अम्ल व जल।
प्रश्न 4.
एक अवाष्पशील विलेय को किसी विलायक में मिलाने से उसका वाध्य दाब कम क्यों हो जाता है?
उत्तर:
किसी द्रव में उपस्थित अणु प्रत्येक दिशा में गतिशील रहते हैं। सतह के अणुओं की गतिज ऊर्जा अन्य अणुओं की अपेक्षा अधिक होती है। अतः ये अणु द्रव की सतह से वाष्प के रूप में पृथक हो जाते हैं। अणुओं की वह प्रवृत्ति निगामी प्रवृत्ति कहलाती है। वाष्य के थे अणु सतह पर दाब डालते है, जिसको वाष्प दाब कहते हैं। किसी द्रव या विलायक में अवाष्पशील पदार्थ मिलाने पर द्रव के अणुओं की यह निर्गामी प्रवृत्ति घट जाती है; क्योंकि विलेय पदार्थ द्रव के अणुओं पर एक प्रकार का अवरोध उत्पन्न करता है; अत: द्रव का वाष्प दाब घट जाता है; इसलिए विलयन का वाध्य दाब विलायक के वाष्प दाब से सदा कम है।

प्रश्न 5.
राउल्ट का वाष्य दाब अवनमन नियम लिखिए। इसकी सीमाएँ भी लिखिए।
उत्तर:
राउल्ट के नियम के अनुसार, किसी विलयन के वाष्प-दाब का आपेक्षिक अवनमन विलेय पदार्थ के मोल प्रभाज के बराबर होता
\(\frac{p-p_s}{p}=\frac{n_1}{n_1+n_2}\)
जहाँ, P तथा Ps क्रमशः विलायक तथा विलयन के वाष्य दाब है और n1 तथा n2 क्रमशः विलेय तथा विलायक के ग्राम अणुओं की संख्या है।
सीमाएँ:
- राउल्ट का नियम तनु विलयनों पर लागू होता है। सान्द्र विलयन राउल्ट के नियम से विचलन प्रदर्शित करते हैं।
- यह नियम केवल अवाष्पशील पदार्थों के विलयनों पर लागू होता
- वैद्युत-अपघटयों के विलयनों पर राउल्ट का नियम लागू नहीं होता है।
- जो पदार्थ विलयनों में संगुणित हो जाते हैं, उन पदार्थों के विलयन भी राउल्ट के नियम का पालन नहीं करते हैं।
प्रश्न 6.
द्रवों के वाष्य दाब को प्रभावित करने वाले कारक लिखें?
उत्तर:
द्रवों के वाष्य दाब को प्रभावित करने वाले निम्न कारक
- ताप (Temperature): ताप बढ़ाने पर द्रवों का वाष्प दाब बढ़ जाता है क्योंकि अणुओं की गतिज ऊर्जा ताप बढ़ने से बढ़ जाती है।
- द्रव की प्रकृति (Nature of Liquid): जिन द्रवों का अन्तराआण्विक आकर्षण बल कम होता है उन द्रवों का वाष्प दाब ज्यादा होता है एवं जिन द्रवों का अन्तराआण्विक आकर्षण बल ज्यादा होता है उनका वाष्प दाब कम होता है।
- श्यानता (Viscosity): जिन द्रवों की श्यानता ज्यादा होती है उनका वाध्य दाब कम एवं जिन द्रवों की श्यानता कम होती है, उनका वाष्प दाब अधिक होता है।
प्रश्न 7.
ऐनॉक्सिया क्या है?
उत्तर:
ऐनॉक्सिया ऊँचाई वाली जगहों पर रहने वाले लोगों में पायी जाने वाली एक बीमारी है। इसमें लोग स्पष्टतया सोच नहीं पाते एवं कमजोर हो जाते हैं क्योंकि ऊंचाई वाली जगह पर दाब कम होता है जिसके कारण रूधिर और ऊतकों में ऑक्सीजन की सान्द्रता निम्न हो जाती है।
प्रश्न 8.
आदर्श एवं अनादर्श विलयन में अन्तर बताइए।
उत्तर:
|
आदर्श विलयन (Ideal Solution) |
अनादर्श विलयन (Non-ideal Solution) |
|
1. सभी ताप एवं सान्द्रता पर राउल्ट के नियम का पालन करता है। PA = PA°xA; PB = PB°XB |
1. सभी ताप एवं सान्द्रता पर राउल्ट के नियम का पालन नहीं करता है। PA + PA°XAB PB + PB°B |
|
2. मिश्रण के आयतन पर कोई परिवर्तन नहीं होता है। ∆V mix = 0 |
2. मिश्रण के आयतन में परिवर्तन होता ∆Vmix # 0 |
|
3. मिश्रण की एन्थैल्पी पर कोई परिवर्तन नहीं होता। ∆Hmix = 0 |
3. मिश्रण की एन्थैल्पी परिवर्तित हो जाती है। ∆Hmix #0 |
प्रश्न 9.
परासरण क्या है? परासरण दाब के लिए व्यजंक लिखिए।
उत्तर:
विलायक के अणुओं का अपरासरण झिल्ली में होकर शुद्ध विलायक से विलयन की ओर या तनु विलयन से सान्द्र विलयन की ओर स्वत: प्रवाह परासरण कहलाता है। परासरण दाब के लिए व्यंजक
Pv = nRT
जहाँ P = विलयन का परासरण दाब (वायुमण्डल में)
V = विलयन का आयतन (लीटर में)
n = विलेय के मोलों की संख्या w/m = 
T = परमताप और
R = विलयन स्थिरांक = 0.082 लीटर-वायु/डिग्री/मोल
प्रश्न 10.
0.1 M ग्लूकोस तथा 0.1 M सोडियम क्लोराइड विलवन में किसका परासरण दाब अधिक होगा और क्यों? कारण सहित लिखिए।
उत्तर:
इनमें 0.1 M सोडियम क्लोराइड का जलीय विलयन अधिक परासरण दाब को व्यका करता है। क्योंकि वह आयनन पर Na+ तथा Cl- दो आयन देता है, जबकि ग्लूकोस का आयनन नहीं होता है। परासरण दाब अणुसंख्य गुणधर्म का उदाहरण है। अणुसंख्य गुणधर्म आयनों की संख्या पर निर्भर करते हैं। अणुसंख्या गुणधर्म अणुओं की संख्या (इन गुणों में आयन अणुओं के समान व्यवहार करते हैं)।

प्रश्न 11.
ग्राम-अणुक उन्नयन स्थिरांक तथा ग्राम अणुक अवनमन स्थिरांक को परिभाषित कीजिए।
उत्तर:
ग्राम-अणुक उन्नयन स्थिरांक-किसी विलायक के 100g में किसी अवाष्पशील विलेय या वैद्युत-अन अपघटय के एक ग्राम-अणु घोलने पर उसके क्वथनांक में जो उन्नयन होता है, वह उस विलायक का ग्राम-अणुक उन्नयन स्थिरांक कहते हैं। इसको K या K100 से व्यक्त करते है।
ग्राम-अणुक अवनमन स्थिरांक: किसी अवाष्पशील वैद्युत-अपघट्य के 1 ग्राम-अणु (मोल) को 100 ग्राम विलायक में' घोलने पर विलायक के हिमांक में जो अवनमन होता है, उसे विलायक का ग्राम-अणु अवनमन स्थिरांक कहते हैं।
प्रश्न 12.
विसरण एवं परासरण में अन्तर लिखें।
उत्तर:
|
विसरण |
परासरण |
|
1. इसमें अर्द्धपारगम्य झिल्ली का प्रयोग नहीं होता है। |
1. इसमें अर्द्धपारगम्य झिल्ली का - प्रयोग होता है। |
|
2. विसरण द्रव, गैस एवं ठोस तीनों में हो सकता है। |
2. यह केवल द्रव में होता है। |
|
3. इसको न तो रोका जा सकता है और न ही विपरीत दिशा में प्रवाहित किया जा सकता है। |
3. इसे बाह्य दाब लगाकर रोका जा सकता है या विपरीत दिशा में प्रवाहित किया जा सकता है। |
|
4. इसमें विलेय तथा विलायक दोनों के ही अणु एक क्षेत्र से दूसरे क्षेत्र में जा सकते हैं। |
4. इसमें केवल विलायक के अणु कम सान्द्रता वाले विलयन से अधिक सान्द्रता वाले विलयन की तरफ जाते हैं। |
प्रश्न 13.
पानी में डालने पर किशमिश फूल जाती है जबकि चीनी के सान्द्र विलयन में यह सिकुड़ जाती है। क्यों?
उत्तर:
पानी में डालने पर किशमिश परासरण के कारण फूल जाती है क्योंकि यहाँ पर विलायक के अणुओं का प्रवाह कम सान्द्रता वाले (जल) से अधिक सान्द्रता वाले (किशमिश) विलयन की तरफ होता है। जबकि किशमिश को चीनी में डालने से किशमिश के अन्दर की सान्द्रता कम हो जाती है और विलायक के अणु किशमिश से चीनी के सान्द्र विलयन की तरफ प्रवाह करते हैं। अत: किशमिश चीनी के सान्द्र विलयन में परासरण के कारण पिचक जाती है।
प्रश्न 14.
(अ) रुधिर में ऑक्सीजन की कम सान्द्रता से पर्वतारोही कमजोर हो जाते हैं एवं स्पष्टतया सोच नहीं पाते
(i) इस विशिष्ट दशा को क्या कहते हैं? नाम लिखो।
(ii) इस स्थिति का कारण स्पष्ट करो।
(ब) 30 एथेनोइक अम्ल 100g जल में है। एथेनोइक अम्ल की जल में मोललता ज्ञात करो।
उत्तर:
(अ) (i) इस दशा को एनॉक्सिया कहते हैं।
(ii) जैसे-जैसे ऊँचाई पर जाते हैं,०, का आंशिक दाब कम होता जाता है, जिससे पर्वतारोही के रुधिर एवं ऊतकों में 0, की सान्द्रता कम हो जाती है जिसके कारण एनॉक्सिया की स्थिति बन जाती है।
(ब) हम जानते हैं कि एथेनोइक अम्ल का अणुभार = 60

\(\mathrm{m}=\frac{30 \times 1000}{60 \times 10}\)
m = 5m
अत: एथेनोइक अम्ल को मोललता 5m होगी।
प्रश्न 11.
(a) शुद्ध विलायक तथा एक विलयन के बाष्य दाब एवं ताप के मध्य आलेख खींचने पर क्रमशः प्राप्त वक्रों के चित्र बनाइए।
(b) नमकीन जल में रखने पर रुधिर कोशिकाएँ सिकुड़ जाती हैं। कारण दीजिए।
उत्तर:
(अ)
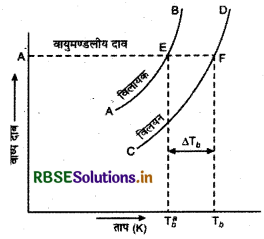
(ब) जब रुधिर कोशिकाओं को नमकीन जल में रखा जाता है तो उनमें उपस्थित विलायक परासरण द्वारा नमकीन जल में आ जाता है। परिणामस्वरूप रुधिर कोशिकाएँ सिकुड़ जाती है।
प्रश्न 16.
(अ) (i) जल वाध्य दाब का क्या होगा यदि एक चम्मच चीनी उसमें डाल दी जाये?
(ii) वहणुओं के मोलर द्रव्यमान ज्ञात करने के लिए कौन-सा अणुसंख्यक गुणधर्म उपयुक्त है?
(ब) क्या क्वथनांक का उन्नयन समान होगा यदि 0.1 मोल सोडियम क्लोराइड या 0.1 मोल चीनी को 1 लीटर जल में विलेय किया जाए? समझाइए।
(स) क्या हम स्थिर क्वांथी मिश्रण के यौगिकों को प्रभाजी आसवन द्वारा पृथक् कर सकते हैं ? समझाइए।
उत्तर:
(अ) (i) जल में एक चम्मच चीनी डालने पर उसके वाष्प दाब में अवनमन हो जाता है। क्योंकि चीनी (अवाष्पशील) पदार्थ का वाष्पदाब नगण्य होता है।
(ii) वृहणुओं के मोलर द्रव्यमान ज्ञात करने के लिए उपयुक्त अणुसंख्यक गुण परासरण दाब है।
(ब) क्वथनांक उन्नयन दोनों विलयनों में असमान होगा। 0.1 मोल प्रति लीटर सोडियम क्लोराइड के विलयन का क्वथनांक उन्नयन अधिक होगा क्योंकि NaCl का आयनन होने के कारण कर्णों की संख्या दोगुनी हो जायेगी और क्वथनांक उन्नयन भी लगभग दो गुना होगा। 0.1 मोल प्रतिलीटर चीनी के विलयन में आयनन नहीं होगा अत: विलयन में कणों की संख्या NaCl के विलयन की तुलना में आधी होगी।
(स) स्थिर क्वाथी मिश्रण के यौगिकों को प्रभाजी आसवन द्वारा पृथक नहीं कर सकते क्योंकि दोनों यौगिकों के एक निश्चित प्रतिशत का मिश्रण दोनों के क्वथनांकों से कम क्वथनांक पर उबलता है और वाष्पीकृत प्राप्त होता है न कि शुद्ध अवयव।

प्रश्न 17.
परासरण दाब ज्ञात करने का सूत्र स्थापित करें।
उत्तर:
π α 1/V (जब ताप समान हो)
(वान्ट हॉफ तथा बॉयल का नियम
π α T (जब आयतन समान हो)
(वान्ट हॉफ तथा चार्ल्स का नियम)
π α n (जब ताप व आयतन समान हो)
(वान्ट हॉफ तथा आवोगाद्रो का नियम)
उपर्युक्त तीनों नियमों से,
π α \(\frac{n \mathrm{~T}}{\mathrm{~V}}\)
π = \(\frac{\mathrm{R} n \mathrm{~T}}{\mathrm{~V}}\)
πV = nRT
π = \(\frac{n}{\mathrm{~V}}\)RT
π = CRT
प्रश्न 18.
क्वथनांक में उन्नयन को चित्र द्वारा प्रदर्शित करें।
उत्तर:
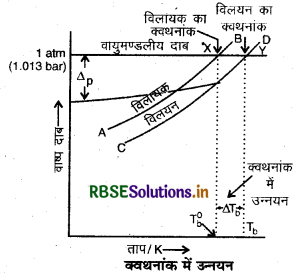
प्रश्न 19.
यदि द्रव A और B के क्वथनांक क्रमशः 140°C और 180°C है, तो उस द्रव की पहचान कीजिए जिसका 90°C पर वाष्य दाब उच्चतर होगा।
उत्तर:
द्रव का क्वथनांक जितना कम होगा उतना ही द्रव वाष्पशील होता है। अत: द्रव A का वाष्प दाब उच्चतर होगा।
प्रश्न 20.
वाष्पशील विलेय युक्त विलयन के लिए राउन्ट का नियम समझाइए?
उत्तर:
ठोस-द्रव विलयन का वाष्य दाब (Vapour Pressure of SolidLiquid Solutions):
किसी विलायक में अवाष्पशील विलेय (ठोस) को मिश्रित करके गर्म करने पर विलयन का वाष्प दाब, विलायक की तुलना में कम पाया जाता है। यह वाष्प दाब अवनमन (Lowering of Vapour Pressure) कहलाता है।
यदि शद्ध विलायक का दाब P° और विलयन का वाष्प दाब P है, तो वाष्प दाब अवनमन = P° - P
इसे निम्न प्रकार समझ सकते हैं कि-वाष्पीकरण एक पृष्ठीय प्रक्रिया है जिसमें विलायक के अणु द्रव की सतह से वाष्प में बदलते रहते हैं। जब द्रव विलायक में अवाष्पशील विलेय मिलाया जाता है तो विलयन की सतह पर कुछ स्थान अवाष्पशील विलेय के अणु ग्रहण कर लेते हैं। जिससे सतह पर विलायक के कणों की संख्या घट जाती है। इसी कारण विलयन की वाष्पन दर घट जाती है अत: विलायक का वाष्प दाब भी कम हो जाता है।
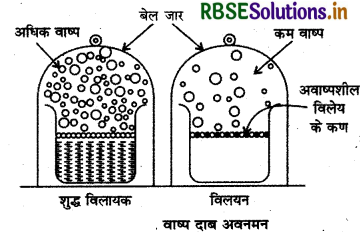
विलायक के वाष्प दाब में कमी विलयन में उपस्थित अवाष्पशील विलेय की मात्रा पर निर्भर करती है, उसकी प्रकृति पर नहीं।
अवाष्पशील विलेय युक्त विलयन के लिए रॉउल्ट का नियम (Raoult's Law for a Solution containing Non-volatile Solute): जब विलेय अवाष्पशील होता है तो केवल विलायक अणु ही वाष्प अवस्था में होते हैं और वाष्प दाब का कारण होते हैं। यदि अवाष्पशील विलेय (B) युक्त विलयन में विलयन का वाष्प दाब केवल वाष्पशील द्रव विलायक (A) के आंशिक दाब के बराबर ही होता है क्योंकि अवाष्पशील ठोस विलेय का आंशिक वाष्प दाब नगण्य होता है।
अत: विलयन का वाष्प दाब p = PA + PB
p = PA ( ∵PB = नगण्य)
तथा
PA = PA x A
यहाँ शुद्ध विलायक का वाष्प दाब एवं x विलायक का मोल अंश है।
विलयन का वाष्प दाब (PA) विलायक के वाष्प दाब (P°A) से कम होता है (क्योंकि xA < 1) दोनों के अन्तर (P°A - PA) को वाष्प दाब अवनमन कहते हैं।
KA = 1 - XB
(xB = अवाष्पशील विलेय B का मोल अंश)
\(\frac{p_{\mathrm{A}}^0-p_{\mathrm{A}}}{p_{\mathrm{A}}^0}\) आपेक्षिक वाष्प दाब अवनमन (Relative Lowering of Vapour Pressure) कहते हैं।
अतः रॉउल्ट के नियमानुसार एक निश्चित ताप पर अवाष्पशील विलेय युक्त विलयन के लिए आपेक्षिक वाष्प दाब अवनमन विलेय की मोल भिन्न के बराबर होता है। विलायक के वाष्प दाब व मोल अंश के मध्य आलेख रेखीय प्राप्त होता है।

प्रश्न 21.
अवाष्पशील विलेय युक्त विलयन के लिए राउन्ट का नियम समझाओं?
उत्तर:
ठोस-द्रव विलयन का वाष्य दाब (Vapour Pressure of SolidLiquid Solutions) :
किसी विलायक में अवाष्पशील विलेय (ठोस) को मिश्रित करके गर्म करने पर विलयन का वाष्प दाब, विलायक की तुलना में कम पाया जाता है। यह वाष्प दाब अवनमन (Lowering of Vapour Pressure) कहलाता है।
यदि शद्ध विलायक का दाब P° और विलयन का वाष्प दाब P है, तो वाष्प दाब अवनमन = P° - P
इसे निम्न प्रकार समझ सकते हैं कि-वाष्पीकरण एक पृष्ठीय प्रक्रिया है जिसमें विलायक के अणु द्रव की सतह से वाष्प में बदलते रहते हैं। जब द्रव विलायक में अवाष्पशील विलेय मिलाया जाता है तो विलयन की सतह पर कुछ स्थान अवाष्पशील विलेय के अणु ग्रहण कर लेते हैं। जिससे सतह पर विलायक के कणों की संख्या घट जाती है। इसी कारण विलयन की वाष्पन दर घट जाती है अत: विलायक का वाष्प दाब भी कम हो जाता है।

विलायक के वाष्प दाब में कमी विलयन में उपस्थित अवाष्पशील विलेय की मात्रा पर निर्भर करती है, उसकी प्रकृति पर नहीं।
अवाष्पशील विलेय युक्त विलयन के लिए रॉउल्ट का नियम (Raoult's Law for a Solution containing Non-volatile Solute): जब विलेय अवाष्पशील होता है तो केवल विलायक अणु ही वाष्प अवस्था में होते हैं और वाष्प दाब का कारण होते हैं। यदि अवाष्पशील विलेय (B) युक्त विलयन में विलयन का वाष्प दाब केवल वाष्पशील द्रव विलायक (A) के आंशिक दाब के बराबर ही होता है क्योंकि अवाष्पशील ठोस विलेय का आंशिक वाष्प दाब नगण्य होता है।
अत: विलयन का वाष्प दाब p = PA + PB
p = PA ( ∵PB = नगण्य)
तथा
PA = PA x A
यहाँ शुद्ध विलायक का वाष्प दाब एवं x विलायक का मोल अंश है।
विलयन का वाष्प दाब (PA) विलायक के वाष्प दाब (P°A) से कम होता है (क्योंकि xA < 1) दोनों के अन्तर (P°A - PA) को वाष्प दाब अवनमन कहते हैं।
KA = 1 - XB
(xB = अवाष्पशील विलेय B का मोल अंश)
\(\frac{p_{\mathrm{A}}^0-p_{\mathrm{A}}}{p_{\mathrm{A}}^0}\) आपेक्षिक वाष्प दाब अवनमन (Relative Lowering of Vapour Pressure) कहते हैं।
अतः रॉउल्ट के नियमानुसार एक निश्चित ताप पर अवाष्पशील विलेय युक्त विलयन के लिए आपेक्षिक वाष्प दाब अवनमन विलेय की मोल भिन्न के बराबर होता है। विलायक के वाष्प दाब व मोल अंश के मध्य आलेख रेखीय प्राप्त होता है।
प्रश्न 22.
गैसों की द्रवों में विलेयता पर दाब के प्रभाव को सचिन वर्णन कीजिए।
उत्तर:
ठोस-द्रव विलयन का वाष्य दाब (Vapour Pressure of SolidLiquid Solutions) :
किसी विलायक में अवाष्पशील विलेय (ठोस) को मिश्रित करके गर्म करने पर विलयन का वाष्प दाब, विलायक की तुलना में कम पाया जाता है। यह वाष्प दाब अवनमन (Lowering of Vapour Pressure) कहलाता है।
यदि शद्ध विलायक का दाब P° और विलयन का वाष्प दाब P है, तो वाष्प दाब अवनमन = P° - P
इसे निम्न प्रकार समझ सकते हैं कि-वाष्पीकरण एक पृष्ठीय प्रक्रिया है जिसमें विलायक के अणु द्रव की सतह से वाष्प में बदलते रहते हैं। जब द्रव विलायक में अवाष्पशील विलेय मिलाया जाता है तो विलयन की सतह पर कुछ स्थान अवाष्पशील विलेय के अणु ग्रहण कर लेते हैं। जिससे सतह पर विलायक के कणों की संख्या घट जाती है। इसी कारण विलयन की वाष्पन दर घट जाती है अत: विलायक का वाष्प दाब भी कम हो जाता है।

विलायक के वाष्प दाब में कमी विलयन में उपस्थित अवाष्पशील विलेय की मात्रा पर निर्भर करती है, उसकी प्रकृति पर नहीं।
अवाष्पशील विलेय युक्त विलयन के लिए रॉउल्ट का नियम (Raoult's Law for a Solution containing Non-volatile Solute): जब विलेय अवाष्पशील होता है तो केवल विलायक अणु ही वाष्प अवस्था में होते हैं और वाष्प दाब का कारण होते हैं। यदि अवाष्पशील विलेय (B) युक्त विलयन में विलयन का वाष्प दाब केवल वाष्पशील द्रव विलायक (A) के आंशिक दाब के बराबर ही होता है क्योंकि अवाष्पशील ठोस विलेय का आंशिक वाष्प दाब नगण्य होता है।
अत: विलयन का वाष्प दाब p = PA + PB
p = PA ( ∵PB = नगण्य)
तथा
PA = PA x A
यहाँ शुद्ध विलायक का वाष्प दाब एवं x विलायक का मोल अंश है।
विलयन का वाष्प दाब (PA) विलायक के वाष्प दाब (P°A) से कम होता है (क्योंकि xA < 1) दोनों के अन्तर (P°A - PA) को वाष्प दाब अवनमन कहते हैं।
KA = 1 - XB
(xB = अवाष्पशील विलेय B का मोल अंश)
\(\frac{p_{\mathrm{A}}^0-p_{\mathrm{A}}}{p_{\mathrm{A}}^0}\) आपेक्षिक वाष्प दाब अवनमन (Relative Lowering of Vapour Pressure) कहते हैं।
अतः रॉउल्ट के नियमानुसार एक निश्चित ताप पर अवाष्पशील विलेय युक्त विलयन के लिए आपेक्षिक वाष्प दाब अवनमन विलेय की मोल भिन्न के बराबर होता है। विलायक के वाष्प दाब व मोल अंश के मध्य आलेख रेखीय प्राप्त होता है।
आंकिक प्रश्न:
प्रश्न 1.
250g पानी में 60 g ग्लूकोस (मोलर द्रव्यमान = 180 g mol-1 ) मिलाने पर बने विलयन का हिमांक परिकलित कीजिए।
(पानी के लिए Kf = 1.86 K kg mol-1)
उत्तर:
विलेय का भार (WB) = 60 g
विलायक का भार (WA) = 600g
विलेय का अणुभार (MB) = 180 g/mol
जल का हिमांक = 273.15K
\(\begin{aligned} \Delta \mathrm{T}_f &=\frac{\mathrm{K}_f \times \mathrm{W}_{\mathrm{B}} \times 1000}{\mathrm{M}_{\mathrm{B}} \times \mathrm{W}_{\mathrm{A}}} \\ &=\frac{1.86 \times 60 \times 1000}{180 \times 600} \end{aligned}\)
= 1.03K
विलयन का हिमांक = 273.15 - ∆Tf
= 273.15 - 1.03
= 272.12K

प्रश्न 2.
600g जल में 31 एथिलीन ग्लाइकॉल (मोलर द्रव्यमान = 62g mol-1 घोलकर प्रतिहिम विलयन बनाया गया। विलयन का हिमांक परिकलित कीजिए।
(जल के लिए Kf = 1.86 K kg mol-1)
उत्तर:
विलेय का भार (WB) = 60 g
विलायक का भार (WA) = 600g
विलेय का अणुभार (MB) = 180 g/mol
जल का हिमांक = 273.15K
\(\begin{aligned} \Delta \mathrm{T}_f &=\frac{\mathrm{K}_f \times \mathrm{W}_{\mathrm{B}} \times 1000}{\mathrm{M}_{\mathrm{B}} \times \mathrm{W}_{\mathrm{A}}} \\ &=\frac{1.86 \times 60 \times 1000}{180 \times 600} \end{aligned}\)
= 1.03K
विलयन का हिमांक = 273.15 - ∆ Tf
= 273.15 - 1.03
= 272.12K
प्रश्न 3.
300 K पर 30g प्रति लीटर सांद्रता वाले ग्लूकोस के विलयन का परासरण दाब 4.98 bar है। यदि इसी ताप पर ग्लूकोस विलयन का परासरण दाब 1.52 bar है, तो उसकी सांद्रता क्या होगी?
उत्तर:
π = 4.98 bar, T = 300K,
V = 1L.
ग्लूकोस का द्रव्यमान WB = 6g
ग्लूकोस (C6H12O6) का मोलर द्रव्यमान
= 6 x 12 + 12 x 1 + 6 x 16
MB = 72 + 12 + 96
= 180g mol-1
प्रथम विलयन के लिए
πV = nBRT
πV = \(\frac{\mathrm{W}_{\mathrm{B}}}{\mathrm{M}_{\mathrm{B}}}\) x R x T
4.98 x 1 = \(\frac{36}{180}\) x R x 300

= 0.083 L bark-1 mol-1
दूसरे विलयन के लिए,
π (परासरण दाब) = 1.52 bar
C (सान्द्रता) = ?
R (गैस नियतांक) = 0.083 L bar K-1 mol-1
T (ताप) = 300K
V(आयतन) = 1L
π = CRT
∴ \(\mathrm{C}=\frac{\pi}{\mathrm{RT}}\)
0.061 mol L-1
विलयन की सान्द्रता = 0.061 mol L-1
प्रश्न 4.
300 K पर यूरिया (मोलर द्रव्यमान = 60 g/mol) के 5% विलयन का परासरण दाब परिकलित कीजिए। [R = 0.0821 L atm K kg mol-1]
उत्तर:
प्रश्नानुसार दिया हैयूरिया का मोलर द्रव्यमान = 6 g/mol
R = 0.0821 L atm k-1 mol-1
T = 300K
∵ 5 ग्राम यूरिया विलयन का आयतन = 100 mL
∴ 60 ग्राम यूरिया विलयन का आयतन = 100 x 60 mL
= 1200ml
= 1.2
परासरण दाब (P) = \(\frac{\mathrm{RT}}{\mathrm{V}}\)
= \(\frac{0.0821 \times 300}{1.2}\)
= 20.52 वायुमण्डल
प्रश्न 5.
5g बेन्जोइक अम्ल (M = 122g mol-1) 35 g बेन्जीन में घोलने पर हिमांक में 2.94K का अवनमन होता है। यदि यह विलयन में द्वितब बनाता है तो बेन्जोइक अम्ल का संगुणन कितने प्रतिशत होगा? (बेन्जीन के लिए Kf = 4.9Kkg mol-1)
उत्तर:
WB = 5g
WA = 35 g
Kf = 49 K kg mol-1
∆Tf = 2.94K
बेन्जोइक अम्ल का मोलर उव्यमान (C6H5COOH)
= (12 x 6)+(5 x 1) + (12 x 1) + (16 x 2) + (1 x 1)
= 122 g/mol
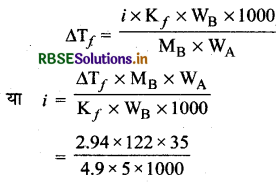
i = 0.512
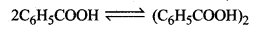
\(\begin{aligned} &\alpha=\frac{i-1}{\left(\frac{1}{m}\right)-1} \\ &x=\frac{0.512-1}{\left(\frac{1}{5}\right)-1} \end{aligned}\)
⇒ \(\frac{-0.488}{-0.8}\)
x = 0.61
अतः बेन्जोइक अम्ल का बेन्जीन में सगुणन = 61%

प्रश्न 6.
50 mL. मेथेनॉल को 150mL जल में घोला गया है। मेथेनॉल की आयतन प्रतिशतता क्या होगी?
उत्तर:
मेथेनॉल का आयतन = 50mL
जल का आयतन = 150mL
विलयन का आयतन = 50 + 150 = 200 mL
आयतन प्रतिशतता = \(\frac{50}{200}\) x 100
= 25 % v/v
प्रश्न 7.
20 यूरिया को जल में घोलकर कुल आयतन 500ml किया गया है। विलयन की % w/V ज्ञात कीजिये।
उत्तर:
यूरिया का द्रव्यमान = 20g
विलयन का आयतन = 500mL
द्रव्यमान आयतन प्रतिशतता % w/v = \(\frac{20}{500}\) x 100
= 4%w/V
प्रश्न 8.
एक प्रोटीन के 0.2 L विलयन में 1.26g प्रोटीन है। 300K पर इस विलयन का परासरण दाब 2.57 x 10-3 bar पाया गया। प्रोटीन के मोलर द्रव्यमान का परिकलन कीजिए। [R = 0.083 L bar mol-1 K-1]
उत्तर:
परासरण दाब (π) = 32.57 x 10-3
प्रोटीन का द्रव्यमान (WA) = 1.26g
विलयन का आयतन (V) = 0.2L
प्रोटीन का मोलर द्रव्यमान (MA) = ?
विलयन का ताप = 300K
R = 0.083 1 bar mol-1 K-1

= 61022 g mol-1
प्रश्न 9.
एक बिलयन के 500 mL में 4gNaOH है। इसकी मोलरता ज्ञात कीजिए।
उत्तर:
मोलरता (M) =

\(\mathrm{M}=\frac{4 \mathrm{~g} \times 1000}{40 \mathrm{~g} \cdot \mathrm{mol}^{-1} \times 500 \mathrm{~mL}}\)
= 0.2M = 0.2 mol L-1
प्रश्न 10.
5gNaOH को 500 mL जल में घोला गया। विलयन की मोलरता ज्ञात कीजिए।
उत्तर:
मोलरता (M) = ?
WB = 5g
MB = 23 + 16 + 1 = 40 g mol-1
V(mL) = 500mL
मोलरता (M) = \(\frac{\mathrm{W}_{\mathrm{B}} \times 1000}{\mathrm{M}_{\mathrm{B}} \times \mathrm{V}_{(\mathrm{mL})}}\)
= \(\frac{5 \times 1000}{40 \times 500}=\frac{5000}{20000}\)
= - 0.25 mol/L
प्रश्न 11.
दो द्रवों तथा B के वाष्य दाब क्रमश: 80 mm तथा 60 mm है। A के 3 मोल तथा B के 2 मोल मिलाने पर प्राप्त विलयन का कुल वाष्य दाब क्या होगा?
उत्तर:
कुल दाब = PA' + PB'
PA' = PA x XA = 80 x \(\frac{3}{2+3}\)
= 80 x 3/5 = 16 x 3 = 48 mm
PB' = PB x XB = 60 x 2/5 = 12 x 2 = 24
कुल दाब = PA' + pB' = 48 + 24 = 72 mm

प्रश्न 12.
वाण्ट-हॉफ गुणांक क्या है? 0.1 मोलल Ca(NO3)2 के विलयन के क्वथनांक की गणना कीजिए। जल के लिए Kb = 0.52 K kg mol-1
उत्तर:
वाण्ट-हॉफ गुणांक-वाण्ट-हॉफ गुणांक किसी पदार्थ के अणुसंख्य गुणधर्मों के प्रेक्षित तथा परिकलित या आपेक्षित मानों का अनुपात होता है।
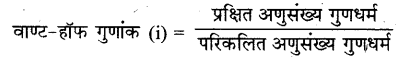
Ca(NO3) → Ca++ + 2NO-3
i = 3 m = 0.1, kb = 0.52
∆Tb = i x m x kb
= 3 x 0.1 x 0.52 = 0.156°C
क्वथनांक T = 100 + 0.156 = 100.156°C
प्रश्न 13.
12 4 ग्लूकोज को 100 g जल में घोलने पर विलयन का क्वथनांक 100.34°C पाया गया। ग्लूकोज के मोलल उन्नयन स्थिरांक की गणना कीजिए। [C = 12,O = 16,H = 1]
उत्तर:
\(\Delta \mathrm{T}_b=\frac{1000 \times k_b \times w}{m \times \mathrm{W}}\)
या
\(k_b=\frac{\Delta T_b \times m \times \mathrm{W}}{1000 \times w}\)
दिया है, = विलेय का द्रव्यमान = 12g
W = विलायक का द्रव्यमान = 100g
m = विलेय (ग्लूकोज) का अगुभार = 180
∆Tb = Ts - T0
= 100.34 - 100
= 0.34°C
kb = ?
\(k_b=\frac{0.34 \times 180 \times 100}{1000 \times 12}\)
= 0.51°C/मोलल
प्रश्न 14.
27°C पर डेसी मोलर यूरिया बिलयन का परासरण दाब ज्ञात कीजिए। R = 0.082 ली.वायु./डिग्री-मोल।
उत्तर:
दिया गया है, T = 27 + 273 = 300 K. n/v = 1/10
P = ?
R = 0.0821
PV = nRT
\(\mathrm{P}=\frac{n}{v} \mathrm{RT}\)
P = 1/10 x 0.0821 x 300 = 0.0821 x 30
= 0.821 x 3
= 2463 atm.
प्रश्न 15.
K4[Fe(CN)6] का 0.05M बिलबन 300K पर 92% बियोजित होता है। बिलबन का परासरण दाब ज्ञात कीजिए।
(R = 0.0821 atmLK-1 mol-1)
उत्तर:
π = iCRT
\(i=\frac{1+\alpha(n-1)}{1}\)
α = 92/100
K4 = [Fe (CN)6] में n = 5
i = 1+(5 - 1)
= 1+3.68
= 4.68
C = 0.05, R = 0.0821,T = 300K
π = 4.68 x 0.05 x 0.0821 x 300 =5.76atm.

प्रश्न 16.
27°C ताप पर यूरिया के 0.01 M विलयन का परासरण दाब ज्ञात कीजिए।
(R = 30.0821 L atm K-1 mol-1)
उत्तर:
परासरण दाब (π) = RT
π = CRT
यहाँ
C = 0.01M
R = 0.0821 L atm K-1 mol-1
T = 27°C + 273
= 300K
अतः π = 0.01 x 0.0821 x 300
= 0.2463 atm
प्रश्न 17.
400K ताप पर किसी विलयन का परासरण दाब 0.0821 वायुमण्डल है। विलयन की सान्द्रता मोल/लीटर में ज्ञात कीजिए। (R = 0.0821 L atm K-1 mol-1)
उत्तर:
π = CRT
c = \(\frac{\pi}{\mathrm{RT}}\)
π = परासरण दाब,
T = ताप (K)
\(\mathrm{C}=\frac{0.0821}{0.0821 \mathrm{~L} \mathrm{~atm} \mathrm{\textrm {K } ^ { - 1 } \mathrm { mol } ^ { - 1 } \times 4 0 0 \mathrm { K }}}\)
= 2.5 x 10-3 mol/L
प्रश्न 18.
Na2SO4 का 0.1 M विलयन 95% की सीमा तक घुलनशील है। इसका 27°C पर परासरण दाब क्या होगा? (R = 0.0821 Latm K-1 mol-1)
उत्तर:
π = CRT
i = \(\frac{1+x(n-1)}{1}\)
α = \(\frac{95}{100}\)
N2SO4 में n = 6
\(\begin{aligned} i &=1+\frac{95}{100}(6-1) \\ &=1+\frac{95}{100} \times 5 \end{aligned}\)
C = 0.IM, R = 0.0821 L atm K-I mol-1
T = 327 + 273 = 300K
π = 5.6 x 0.1 x 0.0821 x 300
= 13.79 atm
प्रश्न 19.
H2SO4 का एक नमूना 94% (w/v) है और इसका घनत्व 1.84gmL है। इस बिलबन की मोललता ज्ञात कीजिए। [H = 1,0 = 16,S = 32]
उत्तर:
100 mL में H2SO4 का द्रव्यमान = 940g
100mL नमने का भार-आयतन x घनत्व = 100 x 1.84 = 1848
नमूने में विलायक की मात्रा = 184 - 94 = 90g = 0.09 kg
तथा H2SO4 का अणु भार = 2 x 1 + 32 + 4 x 16 =98

= \(\frac{94 / 98}{0.09}\) = 10.65 atm
प्रश्न 20.
14.6258 सोडियम क्लोराइड को 250g जल में विलेय किया गया। प्राप्त विलयन की मोललता की गणना कीजिए। [Na = 23,CI = 35.51]
उत्तर:
सोडियम क्लोराइड के ग्राम-अणुओं की संख्या

प्रश्न 21.
एक विलयन में 40g NaOH को 500 mL जल में घोला गया है। इसकी मोलरता एवं नॉर्मलता की गणना कीजिए।
उत्तर:

NaOH विलयन की नॉर्मलता एवं मोलरता समान होगी क्योंकि इसका तुल्यांकी भार एवं अणुभार समान हैं।

प्रश्न 22.
जब एक अवाष्पशील पदार्थ का 1.5g 60 ग्राम जल में घोला जाता है। तो उसका हिमांक 0.136°C कम हो जाता है। पदार्थ के अणुभार की गणना कीजिए। (जल का मोलल अवनमन स्थिरांक = 1.86°C)
उत्तर:
दिया है,
w = 1.5g.
W = 60g.
∆Tf = 0.136°C,
m = ?
K = 1.86
सूत्र \(m=\frac{1000 \times \mathrm{K}_f \times w}{\Delta \mathrm{T}_f \times \mathrm{W}}=\frac{1000 \times 1.86 \times 1.5}{0.136 \times 60}=\frac{2790}{8.16}\)
= 314.91 = 342 लगभग
प्रश्न 23.
72 जल और 928 एथिल ऐल्कोहॉल के मिश्रण में दोनों का मोल-प्रभाज ज्ञात कीजिए।
उत्तर:

प्रश्न 24.
36 gजल और 46g एथिल ऐल्कोहॉल मिश्रण में दोनों प्रभाजजात कीजिए।
उत्तर:
H2O के मौलों की संख्या (N) = \(\frac{36}{18}\) = 2
C2H5OH के मोलों की संख्या (w) = 46/46 = 1
C2H5OH का मोल प्रभाज = \(\frac{n}{\mathrm{~N}+n}=\frac{1}{2+1}=\frac{1}{3}\) = 0.333
H2O का मोल प्रभाज = \(\frac{\mathrm{N}}{n+\mathrm{N}}=\frac{2}{1+2}=\frac{2}{3}\) = 0.666
प्रश्न 25.
बूरिया का एक विलयन भारानुसार 6% है। विलयन में यूरिया तथा जल का मोल प्रभाज ज्ञात कीजिए। (यूरिया का अणुभार 360)
उत्तर:
यूरिया के मोलों की संख्या n = 6/60 = 0.1
जल के मोलों की संख्या = \(\frac{100-6}{18}=\frac{94}{18}\) = 5.2
यूरिया का मोल प्रभाज = \(\frac{n}{n+\mathrm{N}}=\frac{0.1}{0.1+5.2}\)
\(=\frac{0.1}{5.3}=\frac{1}{53}\) = 0.01887
जल का मोल प्रधाज = 1 - 0.01887 = 0.982
प्रश्न 26.
एक सल्फ्यूरिक अम्ल विलयन की मोललता की गणना कीजिए जिसमें जल का मोल प्रभाज 0.85 है।
उत्तर:
जल का मोल प्रभाज = 0.85
H2SO4 का मोल प्रभाजे = 1 - 0.85 = 0.15
जल का मोल प्रभाज (xH2O) = \(\frac{n \mathrm{H}_2 \mathrm{O}}{n \mathrm{H}_2 \mathrm{O}+{ }^n \mathrm{H}_2 \mathrm{SO}_4}\) = 0.85
H2SO4 का मोल प्रभाज (xH2SO4) = \(\frac{n \mathrm{H}_2 \mathrm{SO}_4}{n \mathrm{H}_2 \mathrm{O}+{ }^n \mathrm{H}_2 \mathrm{SO}_4}\)
= 0.15
समी. (i) को समी. (i) से भाग देने पर,
\(\frac{0.15}{0.85}=\frac{n \mathrm{H}_2 \mathrm{SO}_4}{n \mathrm{H}_2 \mathrm{O}}\)
यदि H2SO4 को 1000 ग्राम जल में घोला गया है तो,
\(\frac{0.15}{0.85}=\frac{n \mathrm{H}_2 \mathrm{SO}_4}{\frac{1000}{18}}\)
\({ }^n \mathrm{H}_2 \mathrm{SO}_4=\frac{0.15}{0.85} \times \frac{1000}{18}\)
= 18
अत: H2SO4 की मोललता = 9.8 molkg (विलायक)
प्रश्न 27.
बेन्जीन के एक विलयन में घुली है। विलयन में I, का मोल प्रभाज 0.25 है। विलयन की मोललता ज्ञात कीजिए।
उत्तर:

प्रश्न 28.
शुद्ध बेन्जीन का किसी ताप पर वाष्पदाब 640mmHg है। एक अवाष्पशील विद्युत अपघटय ठोस जिसका भार 2.75 हैं, 39बेन्जीन में डाला गया। बिलयन का वाष्पदाब 600 mmHg है। ठोस पदार्थ का अणुभार ज्ञात कीजिए।
उत्तर:
Po = 640 mm Hg.Ps = 600 mmHg. w = 2.75g. W = 39g m = ?


प्रश्न 29.
चीनी का जल में बना एक 5% (भारानुसार) विलयन का हिमांक 271Kहै। ग्लूकोस के जल में बने 5% विलयन के हिमांक की गणना कीजिए, यदि शुद्ध जल का हिमांक 273.15K है।
उत्तर:
चीनी के विलयन के लिए,

∆Tf = 4.085K
ग्लकोस विलयन का हिमांक = 273.15 - 4.085 = 269.07 K.
प्रश्न 30.
जल में सुक्रोस (M = 342g mol-1) के 4% विलयन (प्रतिशत द्रव्यमान w/w) का हिमांक 271.15K है। जल में ग्लूकोस (M = 180g mol-1) के 5% विलयन का हिमांक परिकलित कीजिए।
(दिया है : शुद्ध जल का हिमांक = 273.15K)
उत्तर:
चीनी के विलयन के लिए,

∆Tf = 4.085K
ग्लकोस विलयन का हिमांक = 273.15 - 4.085 = 269.07 K.
प्रश्न 31.
27°C पर 2% यूरिया विलयन का परासरण दाब ज्ञात कीजिए। (विलयन स्थिरांक = 0.082 ली.वायु/डिग्री/मोल)
उत्तर:
प्रश्नानुसार, R = 0.082,T = 27 + 273 = 300K
यूरिया का अणुभार = 60
∴ 2g यूरिया विलयन का आयतन 100 ml
∴ 60 g (1 मोल) यूरिया विलयन का आयतन = 60
= 3000 mL = 3 लीटर
सूत्रानुसार, परासरण दाब (P) = \(\frac{\mathrm{RT}}{\mathrm{V}}=\frac{0.0822 \times 300}{3}\)
= 8.2 atm.
प्रतियोगी परिक्षा में पूछे गये प्रश्न:
प्रश्न 1.
एक आदर्श विलयन के लिए, सही विकल्प है:
(1) ∆मिश्रण G = 0 स्थिर T तथा P पर
(2) ∆मिश्रण S = 0 स्थिर T तथा p पर
(3) ∆मिश्रण V = 0 स्थिर T तथा P पर
(4) ∆मिश्रण H = 0 स्थिर T तथा P पर
उत्तर:
(4) ∆मिश्रण H = 0 स्थिर T तथा P पर

प्रश्न 2.
वह मिश्रण जो उच्चतम क्वथनांक वाला स्थिस्क्वाथी बनाता है, वह होगा:
(1) हेप्टेन + ऑक्टेन
(2) जल + नाइट्रिक अम्ल
(3) एथेनॉल + जल
(4) एसीटोन + कार्बन डाइसल्फाइड
उत्तर:
(2) जल + नाइट्रिक अम्ल
प्रश्न 3.
निम्न में से कौन ताप पर निर्भर है?
(1) मोललता
(2) मोलरता
(3) मोल अंश
(4) भार प्रतिशत
उत्तर:
(2) मोलरता
प्रश्न 4.
एक तनु विलयन की मोललता को दुगुना किया जाता है, तो मोलाल अवनमन स्थिरांक (KF) होगा:
(1) दुगुना
(2) आधा
(3) तिगुना
(4) अपरिवर्तित
उत्तर:
(4) अपरिवर्तित
प्रश्न 5.
प्रबल विद्युत् अपघट्य बेरियम हाइड्रॉक्साइड के तनु जलीय विलयन के लिए बान्ट हॉफ गुणक (1) है
(1) 2
(2) 3
(3) 0
(4) 1
उत्तर:
(2) 3
प्रश्न 6.
आदर्श विलयन के लिए निम्न में से कौन-सा एक गलत है?
(1) ∆P = Pobs - P ष्नियम द्वारा परिकलित = 0
(2) ∆मिश्रणG = 0
(3) ∆मिश्रणH = 0
(4) ∆मिश्रणU = 0
उत्तर:
(2) ∆मिश्रणG = 0

प्रश्न 7.
बेन्जीन एवं टॉलूईन के 1:1 आदर्श मोलर मिश्रण के वाष्प संयोजन के लिये निम्नलिखित में से कौन-सा कथन सत्य है? कल्पना करें कि तापमान 25°C पर स्थिर है। (दिये गये वाष्प दाब 25°C पर बेन्जीन = 12.8 kPa, टॉलूईन= 3.85 kPa)
(1) वाष्प में समान मात्रा में बेन्जीन एवं टॉलईन होगी।
(2) अपर्याप्त सूचनाओं के कारण कोई पूर्वानुमान नहीं लगाया जा सकता है।
(3) वाध्य में बेन्जीन की अधिक प्रतिशतता होगी।
(4) वाष्प में टॉलूईन की अधिक प्रतिशतता होगी।
उत्तर:
(3) वाध्य में बेन्जीन की अधिक प्रतिशतता होगी।
प्रश्न 8.
एक 6.5g विलेय का 100 g जल में विलयन का 100°C पर वाष्य दाब 732 mm है। यदि K= 0.52, तो इस विलबन का क्वथनांक होगा:
(1) 102°C
(2) 103°C
(3) 1017°C
(4) 100°C
उत्तर:
(3) 1017°C
प्रश्न 9.
1.00 m जलीय विलयन में विलेय की मोल-अंश है:
(1) 00.177
(2) 1.770
(3) 0.0354
(4) 0.0177
उत्तर:
(4) 0.0177
प्रश्न 10.
निम्न में से किसके 0.10 m जलीय विलयन का सबसे ज्यादा हिमांक में अवनमन होगा?
(1) KCl
(2) C6H12O6
(3) Al2(SO4)3
(4) k2SO4
उत्तर:
(3) Al2(SO4)3

- RBSE Class 12 Chemistry Notes Chapter 16 दैनिक जीवन में रसायन
- RBSE Class 12 Chemistry Notes Chapter 15 बहुलक
- RBSE Class 12 Chemistry Notes Chapter 14 जैव-अणु
- RBSE Class 12 Chemistry Notes Chapter 13 ऐमीन
- RBSE Class 12 Chemistry Notes Chapter 12 ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
- RBSE Class 12 Chemistry Notes Chapter 11 ऐल्कोहॉल, फीनॉल एवं ईथर
- RBSE Class 12 Chemistry Notes Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
- RBSE Class 12 Chemistry Notes Chapter 9 उपसहसंयोजन यौगिक
- RBSE Class 12 Chemistry Notes Chapter 8 d- एवं f-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम