RBSE Solutions for Class 9 Science Chapter 3 परमाणु एवं अणु
Rajasthan Board RBSE Solutions for Class 9 Science Chapter 3 परमाणु एवं अणु Textbook Exercise Questions and Answers.
RBSE Class 9 Science Solutions Chapter 3 परमाणु एवं अणु
RBSE Class 9 Science Chapter 3 परमाणु एवं अणु InText Questions and Answers
पृष्ठ 36.
प्रश्न 1.
एक अभिक्रिया में 5.3g सोडियम कार्बोनेट एवं 6.0g एसीटिक अम्ल अभिकृत होते हैं। 2.2g कार्बन डाइऑक्साइड, 8.2g सोडियम एसीटेट एवं 0.9g जल उत्पाद के रूप में प्राप्त होते हैं। इस अभिक्रिया द्वारा दिखाइए कि यह परीक्षण द्रव्यमान संरक्षण के नियम के अनुरूप है।
सोडियम कार्बोनेट + एसीटिक अम्ल → सोडियम एसीटेट + कार्बन डाइऑक्साइड + जल
उत्तर:
द्रव्यमान संरक्षण के नियमानुसार, किसी रासायनिक अभिक्रिया में द्रव्यमान का न तो सृजन किया जा सकता है और न विनाश अर्थात् कुल द्रव्यमान संरक्षित रहता है। अभिकारकों का द्रव्यमान = सोडियम कार्बोनेट का द्रव्यमान + एसीटिक अम्ल का द्रव्यमान
= 5.3g + 6.0g
= 11.3g
उत्पादों का द्रव्यमान = सोडियम एसीटेट का द्रव्यमान + कार्बन डाइऑक्साइड का द्रव्यमान + जल का द्रव्यमान
= 8.2g + 2.2g + 0.9g
= 11.3g
अतः अभिकारकों का द्रव्यमान = उत्पादों का द्रव्यमान
11.3g = 11.3g
इस प्रकार इस अभिक्रिया में अभिकारकों एवं उत्पादों का द्रव्यमान समान है। अतः यह परीक्षण द्रव्यमान संरक्षण के नियम के अनुरूप है।

प्रश्न 2.
हाइड्रोजन एवं ऑक्सीजन द्रव्यमान के अनुसार 1 : 8 के अनुपात में संयोग करके जल निर्मित करते हैं। 3g हाइड्रोजन गैस के साथ पूर्ण रूप से संयोग करने के लिए ऑक्सीजन गैस के कितने द्रव्यमान की आवश्यकता होगी?
उत्तर:
∵ 1g हाइड्रोजन गैस से क्रिया के लिए आवश्यक ऑक्सीजन गैस = 8g
∴ 3g हाइड्रोजन गैस के लिए आवश्यक ऑक्सीजन = \(\frac{8}{1} \times 3\)
= 24g
अतः 3g हाइड्रोजन गैस के साथ पूर्ण रूप से संयोग करने के लिए 24g ऑक्सीजन गैस की आवश्यकता होगी।
प्रश्न 3.
डाल्टन के परमाणु सिद्धान्त का कौनसा अभिग्रहीत द्रव्यमान के संरक्षण के नियम का परिणाम है?
उत्तर:
"परमाणु अविभाज्य कण हैं, जिनका किसी रासायनिक अभिक्रिया में न तो सृजन किया जा सकता है और न विनाश।" डाल्टन के परमाणु सिद्धांत का यही अभिग्रहीत द्रव्यमान के संरक्षण के नियम का परिणाम है।
प्रश्न 4.
डाल्टन के परमाणु सिद्धान्त का कौनसा अभिग्रहीत निश्चित अनुपात के नियम की व्याख्या करता है? .
उत्तर:
"भिन्न - भिन्न तत्वों के परमाणु परस्पर छोटी पूर्ण संख्या के अनुपात में संयोग कर यौगिक निर्मित करते हैं तथा किसी भी यौगिक में परमाणुओं की सापेक्ष संख्या एवं प्रकार निश्चित होते हैं।" डाल्टन के परमाणु सिद्धांत का यह अभिग्रहीत निश्चित अनुपात के नियम की व्याख्या करता है।
पृष्ठ 40.
प्रश्न 1.
परमाणु द्रव्यमान इकाई को परिभाषित कीजिए।
उत्तर:
परमाणु द्रव्यमान इकाई: कार्बन - 12 समस्थानिक के एक परमाणु द्रव्यमान के 1/12वें भाग को मानक परमाणु द्रव्यमान इकाई कहते हैं।

प्रश्न 2. एक परमाणु को आँखों द्वारा देखना क्यों संभव नहीं होता है?
उत्तर:
परमाणु का आकार अत्यन्त सूक्ष्म होता है, इस कारण इसको आँखों द्वारा देखना सम्भव नहीं होता है।
पृष्ठ 44.
प्रश्न 1.
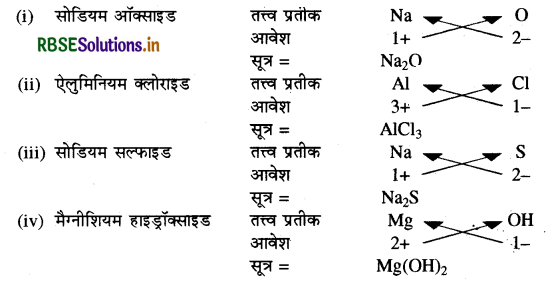
निम्न के सूत्र लिखिए।
(i) सोडियम ऑक्साइड।
(ii) ऐलुमिनियम क्लोराइड।
(iii) सोडियम सल्फाइड।
(iv) मैग्नीशियम हाइड्रॉक्साइड।
उत्तर:
प्रश्न 2.
निम्नलिखित सूत्रों द्वारा प्रदर्शित यौगिकों के नाम लिखिए
(i) Al2(SO4)3
(ii) CaCl2
(iii) K2SO4
(iv) KNO3
(v) CaCO3
उत्तर:
|
सूत्र |
यौगिक का नाम |
|
Al2(SO4)3 |
ऐलुमिनियम सल्फेट |
|
CaCl2 |
कैल्सयम क्लोराइड |
|
K2SO4 |
पोटैशियम सल्फेट |
|
KNO3 |
पोटैशियम नाइट्रेट |
|
CaCO3 |
कैल्सियम कार्बोनेट |

प्रश्न 3.
रासायनिक सूत्र से क्या तात्पर्य है?
उत्तर:
रासायनिक सूत्र - किसी यौगिक का रासायनिक सूत्र उसके संघटक का प्रतीकात्मक निरूपण होता है अथवा किसी यौगिक में उपस्थित सभी तत्त्वों की परमाणु संख्या के प्रतीकात्मक निरूपण को रासायनिक सूत्र कहते हैं। जैसे-हाइड्रोजन क्लोराइड का रासायनिक सूत्र HCl है। इसका अर्थ यह है कि HCl के एक अणु में हाइड्रोजन तथा क्लोरीन के एक - एक परमाणु उपस्थित हैं।
प्रश्न 4.
निम्न में कितने परमाणु विद्यमान हैं ?
(i) H2S अणु एवं
(ii) PO43- आयन
उत्तर:
(i) H2S में हाइड्रोजन के दो तथा सल्फर (गंधक) का एक परमाणु हैं अतः कुल 2 + 1 = 3 परमाणु विद्यमान हैं।
(ii) PO43- में फास्फोरस का 1 तथा ऑक्सीजन के 4 परमाणु हैं अतः कुल 1 + 4 = 5 परमाणु विद्यमान हैं।
पृष्ठ 46.
प्रश्न 1.
निम्न यौगिकों के आणविक द्रव्यमान का परिकलन कीजिए।
1.H2
2.O2
3. Cl2
4. CO2
5. CH4
6. C2H6
7. C2H4
8. NH3 एवं
9. CH3OH
उत्तर:
1. H2 का आण्विक द्रव्यमान = H का परमाणु द्रव्यमान x 2
= 1 x 2 = 2u
2. O2 का आण्विक द्रव्यमान = O का परमाणु द्रव्यमान x 2
= 16 x 2 = 32u
3. Cl2 का आण्विक द्रव्यमान = Cl का परमाणु द्रव्यमान x 2
= 35.5 x 2
= 71u
4. CO2 का आण्विक द्रव्यमान = C का परमाणु द्रव्यमान + (O का परमाणु द्रव्यमान x 2)
= 12 + (16 x 2)u
= 12 + 32u
= 44u
5. CH4 का आण्विक द्रव्यमान = C का परमाणु द्रव्यमान + (H का परमाणु द्रव्यमान x 4)
= 12 + (1 x 4)u
= 16u
6. C2H6 का आण्विक द्रव्यमान = (C का परमाणु द्रव्यमान x 2) + (H का परमाणु द्रव्यमान x 6)
= (12 x 2) + (1 x 6) u
= 24 + 6u
= 30u
7. C2H4 का आण्विक द्रव्यमान = (C का परमाणु द्रव्यमान x 2) + (H का परमाणु द्रव्यमान x 4)
= (12 x 2) + (1 x 4) u = 24 + 4u
= 28u
8. NH3 का आण्विक द्रव्यमान = N का परमाणु द्रव्यमान + (H का परमाणु द्रव्यमान x 3)
= 14 + (1 x 3)u
= 17u
9. CH3OH का आण्विक द्रव्यमान = C का परमाणु द्रव्यमान + (H का परमाणु द्रव्यमान x 3) + 0 का परमाणु द्रव्यमान + H का परमाणु द्रव्यमान
= 12 + (1 x 3) + 16 + 1u
= 12 + 3 + 16 + 1u
= 32u

प्रश्न 2.
निम्न यौगिकों के सूत्र इकाई द्रव्यमान का परिकलन कीजिए (i) ZnO, (ii) Na2O एवं (iii) K2CO3
दिया गया है: Zn का परमाणु द्रव्यमान = 65u; Na का परमाणु द्रव्यमान = 23u; K का परमाणु द्रव्यमान = 39u; C का परमाणु द्रव्यमान = 12u एवं O का परमाणु द्रव्यमान = 16u है।
उत्तर:
(i) ZnO का सूत्र इकाई द्रव्यमान = Zn का परमाणु द्रव्यमान + O का परमाणु द्रव्यमान
= (65 + 16)u
= 81u
(ii) Na2O का सूत्र इकाई द्रव्यमान = (Na का परमाणु द्रव्यमान x 2) + O का परमाणु द्रव्यमान
= (23 x 24) + 16u
= (46 + 16)u
= 62u
(iii) K2CO3 का सूत्र इकाई द्रव्यमान = (K का परमाणु द्रव्यमान x 2) + C का परमाणु द्रव्यमान + (O का परमाणु द्रव्यमान x 3)
= (39 x 2) + 12 + (16 x 3)u
= (78 + 12 + 48)u
= 138u
पृष्ठ 48.
प्रश्न 1.
यदि कार्बन परमाणुओं के एक मोल का द्रव्यमान 12g है, तो कार्बन के एक परमाणु का द्रव्यमान क्या होगा?
उत्तर:
मोल कार्बन परमाणुओं का द्रव्यमान = 12g
या 6.022 x 1023 कार्बन परमाणु = 12g
∴ एक कार्बन परमाणु का द्रव्यमान = \(\frac{12}{6.022 \times 10^{23}} \mathrm{~g}\)
= 1.9927 x 10-23g
प्रश्न 2.
किसमें अधिक परमाणु होंगे 100g सोडियम अथवा 100g लोहा (Fe)? (Na का परमाणु द्रव्यमान = 23u, Fe का परमाणु द्रव्यमान = 56u)
उत्तर:
दिया गया है Na का परमाणु द्रव्यमान = 23u
Fe का परमाणु द्रव्यमान = 56 u
\(∴\) Na का मोलर द्रव्यमान (M1) = 23g
Fe का मोलर द्रव्यमान (M2) = 56g
100g सोडियम में Na के मोल = \(\frac{100 g}{23 g}\) = 4.348 मोल
इसी प्रकार 100g लोहा में Fe के मोल = \(\frac{100 g}{56 g}\) = 1.785 मोल
चूँकि Na के मोलों की संख्या Fe के मोलों की संख्या से अधिक है, अत: 100g में Na के परमाणु Fe से अधिक होंगे।
RBSE Class 9 Science Chapter 3 परमाणु एवं अणु Textbook Questions and Answers
प्रश्न 1.
0.24g ऑक्सीजन एवं बोरॉन युक्त यौगिक के नमूने में विश्लेषण द्वारा यह पाया गया कि उसमें 0.096g बोरॉन एवं 0.144g ऑक्सीजन है। उस यौगिक के प्रतिशत संघटन का भारात्मक रूप में परिकलन कीजिए।
उत्तर:
दिया गया है-यौगिक का द्रव्यमान = 0.24g
बोरॉन का द्रव्यमान = 0.096g
ऑक्सीजन का द्रव्यमान = 0.144g

\(=\frac{0.096 \times 100}{0.24}=40 \%\)

\(=\frac{0.144 \times 100}{0.24}=60 \%\)

प्रश्न 2.
3.0g कार्बन 8.00g ऑक्सीजन में जलकर 11.00g कार्बन डाइ ऑक्साइड निर्मित करता है। जब 3.00g कार्बन को 50.00g ऑक्सीजन में जलाएंगे तो कितने ग्राम कार्बन डाइऑक्साइड का निर्माण होगा? आपका उत्तर रासायनिक संयोजन के किस नियम पर आधारित होगा?
उत्तर:
प्रश्नानुसार 3.0g कार्बन 8.0g ऑक्सीजन से संयोग कर 11.0g कार्बन डाइऑक्साइड निर्मित करता है। जब 3.0g कार्बन को 50.0g ऑक्सीजन में जलायेंगे, तब भी उत्पन्न कार्बन डाइऑक्साइड का द्रव्यमान 11.0g ही होगा, क्योंकि स्थिर अनुपात के नियमानुसार किसी यौगिक में तत्व हमेशा एक निश्चित अनुपात में ही संयोग करते हैं। अत: 3.0g कार्बन 8.0g ऑक्सीजन से ही संयोग करेगा। ऑक्सीजन की अधिक मात्रा बिना संयोग किए शेष रह जाएगी।
प्रश्न 3.
बहुपरमाणुक आयन क्या होते हैं ? उदाहरण दीजिए।
उत्तर:
बहुपरमाणुक आयन: परमाणुओं के समूह, जिन पर नेट आवेश विद्यमान हो उन्हें बहुपरमाणुक आयन कहते हैं। जैसे - अमोनियम आयन (NH+4), कार्बोनेट आयन (CO3-2), सल्फेट आयन (SO4-2) आदि बहुपरमाणुक आयन हैं।
प्रश्न 4.
निम्नलिखित के रासायनिक सूत्र लिखिए।
(a) मैग्नीशियम क्लोराइड।
(b) कैल्सियम क्लोराइड।
(c) कॉपर नाइट्रेट।
(d) ऐलुमिनियम क्लोराइड।
(e) कैल्सियम कार्बोनेट।
उत्तर:

प्रश्न 5.
निम्नलिखित यौगिकों में विद्यमान तत्वों का नाम दीजिए।
(a) बुझा हुआ चूना।
(b) हाइड्रोजन ब्रोमाइड।
(c) बेकिंग पाउडर (खाने वाला सोडा)।
(d) पोटैशियम सल्फेट।
उत्तर:
|
यौगिक का नाम |
सूत्र |
विद्यमान तत्व |
|
(a) बुझा हुआ चूना |
Ca(OH)2 |
कैल्सियम, ऑक्सीजन, हाइड्रोजन |
|
(b) हाइड्रोजन ब्रोमाइड |
HBr |
हाइड्रोजन, ब्रोमीन |
|
(c) बेकिंग पाउडर |
NaHCO3 |
सोडियम, हाइड्रोजन, कार्बन, ऑक्सीजन |
|
(d) पोटैशियम सल्फेट |
K2SO4 |
पोटैशियम, सल्फर, ऑक्सीजन |

प्रश्न 6.
निम्नलिखित पदार्थों के मोलर द्रव्यमान का परिकलन कीजिए।
(a) एथाइन, C2H2
(b) सल्फर अणु, S8
(c) फॉस्फोरस अणु, P4 (फॉस्फोरस का परमाणु द्रव्यमान = 31)
(d) हाइड्रोक्लोरिक अम्ल, HCI
(e) नाइट्रिक अम्ल, HNO3
उत्तर:
किसी पदार्थ के एक मोल अणु के द्रव्यमान को उसका मोलर द्रव्यमान कहते हैं।
(a) C का परमाणु द्रव्यमान = 12u
H का परमाणु द्रव्यमान = 1u
अतः C2H2 का अणु द्रव्यमान = (2 x C का परमाणु द्रव्यमान) + (2 x H का परमाणु द्रव्यमान)
= (2 x 12) + (2 x 1)u
= 24 + 2u
= 26u.
अत: C2H2 का मोलर द्रव्यमान = 26g
(b) सल्फर का परमाणु द्रव्यमान = 32u
अत: S8 का अणु द्रव्यमान = -32 x 8u
= 256u
अतः सल्फर अणु (S8) का मोलर द्रव्यमान = 256g
(c) फॉस्फोरस का परमाणु द्रव्यमान = 31u
अत: Pa का अणु द्रव्यमान = 31 x 4u
= 124u
अत: फॉस्फोरस अणु, P4 का मोलर द्रव्यमान = 124g
(d) हाइड्रोजन का परमाणु द्रव्यमान = 1u
क्लोरीन का परमाणु द्रव्यमान = 35.5
अत: HCl का अणु द्रव्यमान = H का परमाणु द्रव्यमान + Cl का परमाणु द्रव्यमान
= 1 + 35.5u
= 36.5 u
अत: HCl का मोलर द्रव्यमान = 36.5g
(e) हाइड्रोजन का परमाणु द्रव्यमान = 1u
नाइट्रोजन का परमाणु द्रव्यमान = 14u
ऑक्सीजन का परमाणु द्रव्यमान = 16u
अतः HNO3 का अणु द्रव्यमान = H का परमाणु द्रव्यमान + N का परमाणु द्रव्यमान + (O कापरमाणु द्रव्यमान x 3)
= 1 + 14 + (16 x 3)u
= 1 + 14 + 48u
= 63u
अत: HNO3 का मोलर द्रव्यमान = 63g
प्रश्न 7.
निम्न का द्रव्यमान क्या होगा?
(a) 1 मोल नाइट्रोजन परमाणु
(b) 4 मोल ऐलुमिनियम परमाणु (ऐलुमिनियम का परमाणु द्रव्यमान = 27)
(c) 10 मोल सोडियम सल्फाइट (Na2SO3)
उत्तर:
किसी तत्त्व के एक परमाणु या यौगिक के एक अणु का द्रव्यमान उसका मोलर द्रव्यमान होता है।
(a) N का परमाणु द्रव्यमान = 14u
∴ अत: 1 मोल नाइट्रोजन परमाणु का द्रव्यमान = 14g
(b) Al का परमाणु द्रव्यमान = 27u
∴ Al का 1 मोल = 27g
∴ AI के 4 मोल = 27 x 4 = 108g
(c) Na2SO3 का अणु द्रव्यमान = (Na x 2) + S + (O x 3)
= (23 x 2) + 32 + (16 x 3)u
= 46 + 32+ 48u
= 126u
अतः Na2SO3 का 1 मोल = 126g
∴ Na2SO3 के 10 मोल = 126 x 10 = 1260g

प्रश्न 8.
मोल में परिवर्तित कीजिए।
(a) 12g ऑक्सीजन गैस।
(b) 20g जल।
(c) 22g कार्बन डाइऑक्साइड।
उत्तर:
(a) ऑक्सीजन गैस का अणु द्रव्यमान = 32u
अत: ऑक्सीजन गैस का मोलर द्रव्यमान = 32g
प्रश्नानुसार ऑक्सीजन का दिया गया द्रव्यमान = 12g

मोलों की संख्या = \(\frac{12}{32}\) = 0.375 मोल
अत: 12g ऑक्सीजन गैस में मोलों की संख्या = 0.375 मोल
(b) जल (H2O) का अणु द्रव्यमान = 18u
जल का मोलर द्रव्यमान = 18g
प्रश्न में जल का दिया गया द्रव्यमान = 20g

मोलों की संख्या = \(\frac{20}{18}\) = 1.11 मोल
अतः 20g जल में मोलों की संख्या = 1.11 मोल
(c) CO2 का अणु द्रव्यमान = 12 + (16 x 2)u
= (12 + 32)
= 44u
CO2 का मोलर द्रव्यमान = 44g
प्रश्न में, CO2 का दिया गया द्रव्यमान = 22g

मोलों की संख्या = \(\frac{22}{44}\) = 0.5 मोल
अत: 22g CO2 में मोलों की संख्या = 0.5 मोल
प्रश्न 9.
निम्न का द्रव्यमान क्या होगा?
(a) 0.2 मोल ऑक्सीजन परमाणु
(b) 0.5 मोल जल के अणु
उत्तर:
(a) ऑक्सीजन का परमाणु द्रव्यमान = 16u
ऑक्सीजन का मोलर द्रव्यमान (M) = 16g
1 मोल ऑक्सीजन = 16g
मोल ऑक्सीजन संख्या (n) = 0.2
द्रव्यमान(m) = मोलर द्रव्यमान x मोल संख्या(n)
द्रव्यमान = 16 x 0.2g
अत: 0.2 मोल ऑक्सीजन परमाणु का द्रव्यमान = 3.2g
(b) H2O का अणु द्रव्यमान = (1 x 2) + 1 u = 18u
H2O का मोलर द्रव्यमान (M) = 18g
मोल जल संख्या (n) = 0.5
द्रव्यमान (m) = मोलर द्रव्यमान (M) x मोल संख्या (n)
0.5 मोल H2O का द्रव्यमान = 18 x 0.5g
= 9.0g

प्रश्न 10.
16 ग्राम ठोस सल्फर में सल्फर (S) के अणुओं की संख्या का परिकलन कीजिए।
उत्तर:
S8 का अणु द्रव्यमान = 32 x 8u
= 256u
S8 का मोलर द्रव्यमान = 256g
S8 अणु का दिया गया द्रव्यमान (m) = 16g
आवोगाद्रो स्थिरांक (No) = 6.022 x 1023 अणु
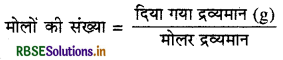
\(=\frac{16}{256}\)
16g S8 में अणुओं की संख्या = मोलों की संख्या x आवोगाद्रो संख्या
16 = 256 x 6.022 x 1023 अणु
= 0.3764 x 1023 अणु
= 3.764 x 1020 अणु
अंत: 16g S8 में अणुओं की संख्या 3.764 x 1022 होगी।
प्रश्न 11.
0.051 ग्राम ऐलुमिनियम ऑक्साइड (Al2O3) में ऐलुमिनियम आयनों की संख्या का परिकलन कीजिए।
[संकेत - किसी आयन का द्रव्यमान उतना ही होता है जितना कि उस तत्व के परमाणु का द्रव्यमान होता है। ऐलुमिनियम का परमाणु द्रव्यमान = 27u है।]
उत्तर:
AI2O3 का अणु द्रव्यमान = (27 x 2) + (16 x 3)u
= (54 + 48)
= 102u
अतः Al2O3 का मोलर द्रव्यमान = 102g
Al2O3 का दिया गया द्रव्यमान (m) = 0.051g
आवोगाद्रो संख्या (No) = 6.022 x 1023
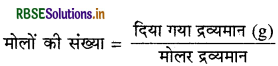
\(=\frac{0.051}{102}\)
अत: 0.051g AI2O3 में अणुओं की संख्या = मोलों की संख्या x आवोगाद्रो संख्या
\(=\frac{0.051}{102} \times 6.022 \times 10^{23}\)
= 0.003011 x 1023
अत: आयनों की संख्या = 0.003011 x 1023
Al2O3 का प्रत्येक अणु दो ऐलुमिनियम आयन से बना है।
अतः ऐलुमिनियम आयनों की संख्या = 2 x 0.003011 x 1023
= 0.006022 x 1023
= 6.022 x 1020 आयन
अत: 0.051g ऐलुमिनियम ऑक्साइड (Al2O3) में ऐलुमिनियम आयनों की संख्या = 6.022 x 1020
