RBSE Class 9 Science Important Questions Chapter 3 परमाणु एवं अणु
Rajasthan Board RBSE Class 9 Science Important Questions Chapter 3 परमाणु एवं अणु Important Questions and Answers.
RBSE Class 9 Science Chapter 3 Important Questions परमाणु एवं अणु
बहुचयनात्मक प्रश्न :
प्रश्न 1.
द्रव्यमान संरक्षण के नियम को समझाने के लिए निम्न में से कौन से युग्म का उपयोग नहीं करेंगे?
(अ) कॉपर सल्फेट सोडियम कार्बोनेट
(ब) बेरियम क्लोराइड सोडियम सल्फेट
(स) लेड नाइट्रेट सोडियम क्लोराइड
(द) पोटैशियम क्लोरेट मैग्नीज डाइऑक्साइड
उत्तर:
(अ) कॉपर सल्फेट सोडियम कार्बोनेट
प्रश्न 2.
यदि 9g जल का अपघटन करें। स्थिर अनुपात के नियम के आधार पर हाइड्रोजन तथा ऑक्सीजन की मात्रा प्राप्त होगी।
(अ) 1 : 8
(ब) 2 : 7
(स) 4 : 8
(द) अनिश्चित
उत्तर:
(द) अनिश्चित

प्रश्न 3.
1 मीटर में नैनोमीटर होते हैं।
(अ) 10-9
(ब) 109
(स) 10-8
(द) 108
उत्तर:
(ब) 109
प्रश्न 4.
हाइड्रोजन परमाणु की त्रिज्या है।
(अ) 10-10 m
(ब) 10-6 m
(स) 1 mm
(द) 10-20 m
उत्तर:
(अ) 10-10 m
प्रश्न 5.
कोबाल्ट का प्रतीक है।
(37) CO
(ब) Cu
(स) CO
(द) Ca
उत्तर:
(स) CO
प्रश्न 6.
लौह (आयरन) का प्रतीक है।
(अ) Ir
(ब) Fe
(स) I
(द) FO
उत्तर:
(ब) Fe
प्रश्न 7.
परमाणु द्रव्यमान की मानक इकाई है।
(अ) एक प्रोटान का भार
(ब) एक न्यूट्रान का भार
(स) एक हाइड्रोजन का भार
(द) कार्बन - 12 परमाणु का 1/12वाँ भार भाग
उत्तर:
(द) कार्बन - 12 परमाणु का 1/12वाँ भार भाग
प्रश्न 8.
H2SO4 का अणु द्रव्यमान 98 है। यदि ऑक्सीजन व हाइड्रोजन का परमाणु द्रव्यमान क्रमश: 16u तथा 1u है तो सल्फर का परमाणु द्रव्यमान होगा।
(अ) 3u
(ब) 16u
(स) 32u
(द) 24u
उत्तर:
(स) 32u

प्रश्न 9.
किसी यौगिक के 1 मोल में परमाणुओं की संख्या होगी।
(अ) 6.022 x 1024
(ब) 6.022 x 1022
(स) 6.022 x 1021
(द) 6.022 x 1023
उत्तर;
(द) 6.022 x 1023
प्रश्न 10.
तत्व 'x' के ऑक्साइड का सूत्र 'xo' है। इस तत्व के नाइट्राइट का सूत्र होगा।
(अ) x N
(ब) x NO2
(स) x3 N2
(द) x (NO2)2
उत्तर:
(द) x (NO2)2
प्रश्न 11.
ऐलुमिनियम फास्फेट का अणुसूत्र है।
(अ) AIPO4
(ब) Al4 (PO4)3
(स) AIPO2
(द) AIPO2
उत्तर:
(अ) AIPO4
प्रश्न 12.
NH4+ तथा SO4-2 के संयोग से बनने वाले यौगिक का सूत्र होगा।
(अ) (NH4)2SO4
(ब) NH4SO4
(स) NH4(SO4)2
(द) (NH4)2(SO4)3
उत्तर:
(अ) (NH4)2SO4
प्रश्न 13.
परमाणु भार का अन्तर्राष्ट्रीय मात्रक है।
(अ) H - 1
(ब) O - 16
(स) C - 12
(द) N - 14
उत्तर:
(स) C - 12
रिक्त स्थान वाले प्रश्न:
निम्नलिखित प्रश्नों में रिक्त स्थानों की पूर्ति कीजिए।
प्रश्न 1.
लौह (आयरन) का प्रतीक Fe है जो कि उसके लैटिन नाम ................... से व्युत्पन्न किया गया है।
उत्तर:
फेरम

प्रश्न 2.
सल्फाइड आयन का संकेत ..................... होता है।
उत्तर:
S2
प्रश्न 3.
अणुओं के एक मोल का द्रव्यमान ...................कहलाता है।
उत्तर:
आण्विक द्रव्यमान (g)
प्रश्न 4.
आवोगाद्रो संख्या का मान ..................... होता है।
उत्तर:
6.022 x 1023
प्रश्न 5.
He का परमाणु द्रव्यमान ..................होता है।
उत्तर:
4u
सत्य / असत्य कथन वाले प्रश्न:
निम्नलिखित कथनों में सत्य तथा असत्य कथन छाँटिए।
प्रश्न 1.
डाल्टन का परमाणु सिद्धान्त रासायनिक संयोजन के नियमों पर आधारित था।
उत्तर:
सत्य

प्रश्न 2.
अधिकांश तत्वों के परमाणु स्वतंत्र रूप से अस्तित्व में रहते हैं।
उत्तर:
असत्य
प्रश्न 3.
सभी द्रव्यों की रचनात्मक इकाई परमाणु होती है।
उत्तर:
सत्य
प्रश्न 4.
कापर द्विपरमाणुक तत्व है।
उत्तर:
असत्य
प्रश्न 5.
अमोनिया में नाइट्रोजन तथा हाइड्रोजन तत्वों का द्रव्यमान अनुपात 14 : 3 होता है।
उत्तर:
सत्य
प्रश्न 6.
नाइट्राइड आयन का संकेत N3- होता है।
उत्तर:
सत्य।
मिलान वाले प्रश्न:
निम्नलिखित प्रश्नों में भाग (अ) का मिलान भाग (ब) से करके सही कूट ( कोड ) का चयन कीजिए।
प्रश्न 1.
|
भाग (अ) |
भाग (ब) |
|
1. ओजोन |
(a). K2S |
|
2. पोटेशियम सल्फाइड |
(b). 34 |
|
3. H2(CO3)3 |
(c). त्रिपरमाणुक |
|
4. H2S का आण्विक द्रव्यमान |
(d). ऐलुमिनियम कार्बोनेट |
उत्तर:
|
भाग (अ) |
भाग (ब) |
|
1. ओजोन |
(a). त्रिपरमाणुक |
|
2. पोटेशियम सल्फाइड |
(b). K2S |
|
3. H2(CO3)3 |
(c). ऐलुमिनियम कार्बोनेट |
|
4. H2S का आण्विक द्रव्यमान |
(d). 34 |

प्रश्न 2.
|
भाग (अ) |
भाग (ब) |
|
1. 6.022 X 1023 हाइड्रोजन परमाणु |
(a) परमाणु |
|
2. 16 ग्राम हीलियम |
(b) हाइड्रोजन का एक मोल |
|
3. किसी तत्व का सूक्ष्मतम कण |
(c) MgS |
|
4. मैग्नीशियम सल्फाइड |
(d) 4 मोल हीलियम |
उत्तर:
|
भाग (अ) |
भाग (ब) |
|
1. 6.022 X 1023 हाइड्रोजन परमाणु |
(b) हाइड्रोजन का एक मोल |
|
2. 16 ग्राम हीलियम |
(d) 4 मोल हीलियम |
|
3. किसी तत्व का सूक्ष्मतम कण |
(a) परमाणु |
|
4. मैग्नीशियम सल्फाइड |
(c) MgS |
प्रश्न 3.
|
भाग (अ) |
भाग (ब) |
|
1. स्वर्ण का प्रतीक |
(a) 3:8 |
|
2. कार्बन डाइऑक्साइड में कार्बन तथा ऑक्सीजन का द्रव्यमान अनुपात |
(b) स्थिर अनुपात का नियम |
|
3. पोटेशियम नाइट्रेट |
(c) Au |
|
4. लवाइजिए |
(d) KNO3 |
उत्तर:
|
भाग (अ) |
भाग (ब) |
|
1. स्वर्ण का प्रतीक |
(c) Au |
|
2. कार्बन डाइऑक्साइड में कार्बन तथा ऑक्सीजन का द्रव्यमान अनुपात |
(a) 3:8 |
|
3. पोटेशियम नाइट्रेट |
(d) KNO3 |
|
4. लवाइजिए |
(b) स्थिर अनुपात का नियम |
प्रश्न 4.
|
भाग (अ) |
भाग (ब) |
|
1. हीमोग्लोबिन अणु की त्रिज्या |
(a). 2 मोल ऑक्सीजन |
|
2. सल्फर की संयोजकता |
(b). 3.011 x 1023 |
|
3. 23 ग्राम सोडियम |
(c). सोडियम परमाणु 10-8 मीटर |
|
4. 32 ग्राम ऑक्सीजन |
(d). 2 |
उत्तर:
|
भाग (अ) |
भाग (ब) |
|
1. हीमोग्लोबिन अणु की त्रिज्या |
(c). सोडियम परमाणु 10-8 मीटर |
|
2. सल्फर की संयोजकता |
(d). 2 |
|
3. 23 ग्राम सोडियम |
(b). 3.011 x 1023 |
|
4. 32 ग्राम ऑक्सीजन |
(a). 2 मोल ऑक्सीजन |
अतिलघूत्तरात्मक प्रश्न:
प्रश्न 1.
सभी द्रव्यों की रचनात्मक इकाई क्या होती है?
उत्तर:
परमाणु।

प्रश्न 2.
परमाणु की त्रिज्या को सामान्यतः किसमें मापा जाता है?
उत्तर:
नेनोमीटर (nm) में।
प्रश्न 3.
परमाणु द्रव्यमान की इकाई amu हेतु IUPAC का नवीनतम अनुमोदन कौनसा है?
उत्तर:
u' यूनीफाइड द्रव्यमान ।
प्रश्न 4.
चतुर्परमाणुक और बहुपरमाणुक तत्वों के एक - एक उदाहरण लिखिए।
उत्तर:
चतुर्परमाणुक तत्व = फॉस्फोरस
बहुपरमाणुक तत्व = सल्फर
प्रश्न 5.
किसी आयनिक यौगिक का सूत्र ज्ञात करने में कौन सहायता करता है?
उत्तर:
आयनों पर उपस्थित आवेश।
प्रश्न 6.
महर्षि कनाड ने अविभाज्य सूक्ष्मतम कण को क्या कहा था?
उत्तर:
परमाणु।
प्रश्न 7.
जल में हाइड्रोजन और ऑक्सीजन के द्रव्यमानों का अनुपात सदैव कितना होता है?
उत्तर:
1 : 8
प्रश्न 8.
अमोनिया (NH3) में, नाइट्रोजन और हाइड्रोजन के द्रव्यमानों का अनुपात सदैव क्या होता है?
उत्तर:
14 : 3
प्रश्न 9.
सबसे पहले तत्वों के लिए प्रतीक का उपयोग किस वैज्ञानिक ने किया था?
उत्तर:
डाल्टन ने।

प्रश्न 10.
IUPAC का पूरा नाम लिखिए।
उत्तर:
इन्टरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड कैमिस्ट्री।
प्रश्न 11.
सोडियम और पोटेशियम के प्रतीक किनसे व्युत्पन्न हैं?
उत्तर:
नैट्रियम और कैलियम से
प्रश्न 12.
कॉपर का नाम किससे लिया गया है?
उत्तर:
इसके प्राप्ति स्थल साइप्रस (Cyprus) से।
प्रश्न 13.
द्रव्यमान संरक्षण का नियम क्या है?
उत्तर:
इस नियम के अनुसार "किसी रासायनिक अभिक्रिया में द्रव्यमान का न तो सृजन किया जा सकता है, और न ही विनाश।"
प्रश्न 14.
स्थिर अनुपात का नियम लिखिए।
उत्तर:
इस नियम के अनुसार "किसी भी यौगिक में तत्व सदैव एक निश्चित द्रव्यमानों के अनुपात में विद्यमान होते हैं।
प्रश्न 15.
निम्न की त्रिज्या मीटर में व्यक्त कीजिए
- जल अणु
- हाइड्रोजन परमाणु।
उत्तर:
- जल अणु की त्रिज्या = 10-9 मी.
- हाइड्रोजन परमाणु की त्रिज्या = 10-10 मी.।
प्रश्न 16.
निम्न के परमाणु द्रव्यमान (u) का मान लिखिए
- सोडियम
- ऑक्सीजन।
उत्तर:
- सोडियम = 23u
- ऑक्सीजन = 16u
प्रश्न 17.
परमाणुकता क्या है?
उत्तर:
किसी अणु की संरचना में प्रयुक्त होने वाले परमाणुओं की संख्या को उस अणु की परमाणुकता कहते हैं।

प्रश्न 18.
Al(NO3)3 में ऐलुमिनियम की संयोजकता कितनी है?
उत्तर:
AI(NO3)3 में AI की संयोजकता + 3 है।
प्रश्न 19.
कैल्सियम सल्फाइड तथा मैग्नीशियम कार्बोनेट का अणु सूत्र लिखिए।
उत्तर:
कैल्सियम सल्फाइड = Cas तथा मैग्नीशियम कार्बोनेट = MgCO3
प्रश्न 20.
दो ऐसे तत्वों के नाम लिखिए जिनके प्रतीक नाम के प्रथम व तीसरे अक्षर से बने हैं।
उत्तर;
- सीजियम (Cs)
- क्लोरीन (CI)।
प्रश्न 21.
Ca व Ca2+ में क्या अंतर है?
उत्तर:
Ca कैल्सियम का परमाणु है जबकि Ca2+ कैल्सियम का आयन है।
प्रश्न 22.
संयोजकता किसे कहते हैं?
उत्तर:
किसी तत्व की संयोजन शक्ति अथवा क्षमता उस तत्व की संयोजकता कहलाती है।
प्रश्न 23.
द्विअंगी यौगिक से क्या अभिप्राय है?
उत्तर:
दो भिन्न - भिन्न तत्वों से निर्मित सरलतम यौगिकों को द्विअंगी यौगिक कहते हैं।
प्रश्न 24.
मोलर द्रव्यमान किसे कहते हैं?
उत्तर:
किसी तत्व के परमाणुओं के एक मोल का द्रव्यमान, उसका मोलर द्रव्यमान कहलाता है।
प्रश्न 25.
तत्वों के प्रतीक क्या होते हैं?
उत्तर:
तत्वों के नामों के संक्षिप्त रूप 'प्रतीक' कहलाते हैं।
प्रश्न 26.
क्या मोल द्वारा सिर्फ परमाणुओं को गिना जा सकता है?
उत्तर:
नहीं, मोल अतिसूक्ष्म स्तर पर सभी प्रकार के कणों (परमाणु, अणु या आयन आदि) को गिनने की इकाई होती है।
प्रश्न 27.
किसी पदार्थ के एक ग्राम परमाणु द्रव्यमान या एक ग्राम आण्विक द्रव्यमान में कितने परमाणु उपस्थित होते हैं?
उत्तर:
6.022 x 1023 परमाणु।

प्रश्न 28.
सापेक्षिक परमाणु द्रव्यमान किसे कहते हैं?
उत्तर:
किसी तत्व का सापेक्षिक परमाणु द्रव्यमान उसके परमाणुओं का औसत द्रव्यमान तथा कार्बन - 12 परमाणु के द्रव्यमान के 1/12 वें भाग का अनुपात होता है।
लघूत्तरात्मक प्रश्न:
प्रश्न 1.
भारतीय दार्शनिकों द्वारा परमाणु की क्या व्याख्या की गई थी? समझाइए।
उत्तर:
भारतीय दार्शनिक महर्षि कनाड ने बताया कि यदि हम द्रव्य (पदार्थ) को विभाजित करते जाएँ तो हमें छोटे - छोटे कण प्राप्त होते जाएँगे तथा अंत में एक सीमा आएगी जब प्राप्त कण को और विभाजित नहीं किया जा सकेगा अर्थात् वह सूक्ष्मतम कण अविभाज्य रहेगा। इस अविभाज्य सूक्ष्मतम कण को उन्होंने 'परमाणु' कहा। एक अन्य दार्शनिक पकुधा कात्यायाम ने इनका समर्थन करते हुए बताया कि "ये कण सामान्यतः संयुक्त रूप में मिलते हैं, जो हमें द्रव्यों के भिन्न - भिन्न रूप प्रदान करते हैं।"
प्रश्न 2.
स्थिर अनुपात के नियम को एक उदाहरण द्वारा समझाइए।
उत्तर:
स्थिर अनुपात का नियम-लवाइजिए, प्राउस्ट तथा अन्य वैज्ञानिकों के अनुसार कोई भी यौगिक दो या दो से अधिक तत्वों से बना होता है। इस यौगिक में तत्वों का अनुपात सदैव स्थिर होता है, चाहे इसे किसी भी स्थान से प्राप्त किया जाए अथवा किसी भी विधि से बनाया जाए। जैसे - यौगिक जल (H2O) में हाइड्रोजन एवं ऑक्सीजन के द्रव्यमानों का अनुपात सदैव 1 : 8 होता है चाहे जल का स्रोत कोई भी हो। अतः स्थिर अनुपात के नियम के अनुसार "किसी भी यौगिक में तत्व सदैव एक निश्चित द्रव्यमानों के अनुपात में ही विद्यमान होते हैं।" इसे निश्चित अनुपात का नियम भी कहते हैं।
प्रश्न 3.
अणु एवं परमाणु में दो अन्तर लिखिए।
उत्तर:
अणु एवं परमाणु में निम्नलिखित अन्तर होते हैं।
|
अणु |
परमाणु |
|
1. यह दो या दो से अधिक परमाणुओं से मिलकर बनता है। |
1. यह किसी भी पदार्थ का वह सूक्ष्मतम कण है, जो रासायनिक अभिक्रिया में भाग ले सकता है। |
|
2. यह स्वतंत्र अवस्था में रह सकता है। |
2. यह स्वतंत्र अवस्था में नहीं रह सकता है। |
प्रश्न 4.
डाल्टन के परमाणु सिद्धांत के मुख्य बिन्दु लिखिए।
उत्तर:
डाल्टन के परमाणु सिद्धांत के मुख्य बिन्दु निम्न हैं।
- सभी द्रव्य परमाणुओं से निर्मित होते हैं।
- परमाणु अविभाज्य सूक्ष्मतम कण होते हैं जो रासायनिक अभिक्रिया में न तो सृजित होते हैं न ही उनका विनाश होता है।
- दिए गए तत्व के सभी परमाणुओं का द्रव्यमान एवं रासायनिक गुणधर्म समान होते हैं।
- भिन्न - भिन्न तत्वों के परमाणुओं के द्रव्यमान एवं रासायनिक गुण भिन्न - भिन्न होते हैं।
- भिन्न - भिन्न तत्वों के परमाणु परस्पर छोटी पूर्ण संख्या के अनुपात में संयोग कर यौगिक निर्मित करते हैं।
- प्रत्येक यौगिक में परमाणुओं की सापेक्ष संख्या एवं प्रकार निश्चित होते हैं।

प्रश्न 5.
परमाणु द्रव्यमान इकाई निर्धारण के लिए प्रारंभ में प्रकृतिजन्य ऑक्सीजन परमाणु के द्रव्यमान के 1/16 भाग को इकाई के रूप में क्यों लिया गया था?
उत्तर:
प्रकृतिजन्य ऑक्सीजन परमाणु के द्रव्यमान के 1/16 भाग को इकाई के रूप में लेने के निम्न कारण थे
- ऑक्सीजन अनेक तत्वों के साथ अभिक्रिया करके यौगिक बनाता है।
- इस परमाणु द्रव्यमान इकाई द्वारा अधिकांश तत्वों के परमाणु द्रव्यमान पूर्णांक में प्राप्त होते हैं।
प्रश्न 6.
निम्न तत्वों के परमाणु द्रव्यमान (u) लिखिए।
(i) कार्बन
(ii) नाइट्रोजन
(iii) ऑक्सीजन
(iv) सोडियम
(v) गंधक
(vi) क्लोरीन
(vii) कैल्सियम।
उत्तर:
|
तत्व |
परमाणु द्रव्यमान (u) |
|
(i) कार्बन (C) |
12 |
|
(ii) नाइट्रोजन (N) |
14 |
|
(iii) ऑक्सीजन (O) |
16 |
|
(iv) सोडियम (Na) |
23 |
|
(v) गंधक (सल्फर) (S) |
32 |
|
(vi) क्लोरीन (Cl) |
35.5 |
|
(ivi) कैल्सियम (Ca) |
40 |
प्रश्न 7.
अणु क्या है? उदाहरण के माध्यम से समझाइए।
उत्तर:
साधारणतया अणु ऐसे दो या दो से अधिक परमाणुओं का समूह होता है, जो आपस में रासायनिक बंध द्वारा जुड़े होते हैं, अर्थात् वे परस्पर आकर्षण बल द्वारा जुड़े होते हैं । इस प्रकार अणु किसी तत्व या यौगिक का वह सूक्ष्मतम कण है, जो स्वतंत्र रूप से अस्तित्व में रह सकता है तथा जो उस यौगिक के सभी गुणधर्मों को प्रदर्शित करता है। एक ही तत्व के परमाणु अथवा भिन्न - भिन्न तत्वों के परमाणु परस्पर संयोग करके अणु बनाते हैं। उदाहरण: दो हाइड्रोजन परमाणुओं के संयोजन से हाइड्रोजन गैस का एक अणु बनता है, उसे H2 से प्रदर्शित करते हैं।

प्रश्न 8.
अणुओं की परमाणुकता से क्या आशय है? समझाइए।
उत्तर:
किसी अणु की संरचना में प्रयुक्त होने वाले परमाणुओं की संख्या को उस अणु की परमाणुकता कहते हैं। जब तत्वों के अणु उसी तत्व के केवल एक परमाणु द्वारा निर्मित होते हैं, तो वे एक परमाणुक कहलाते हैं, जैसे - आर्गन, हीलियम आदि। परन्तु ऑक्सीजन, नाइट्रोजन व हाइड्रोजन जैसे अणु दो परमाणुओं से बनते हैं, इसलिए ये द्वि - परमाणुक अणु कहलाते हैं। धातु व कुछ अन्य तत्वों के अणुओं जैसे कि कार्बन की सरल संरचना नहीं होती है किन्तु उनके अणुओं में असीमित परमाणु परस्पर बंधे होते हैं। इस प्रकार परमाणुओं की संख्या के आधार पर अणु की परमाणुकता निर्धारित होती है।
प्रश्न 9.
यौगिक के अणु में परमाणुओं की संख्या का अनुपात किस प्रकार ज्ञात करते हैं?
उत्तर:
भिन्न - भिन्न तत्वों के परमाणु एक निश्चित अनुपात में मिलकर यौगिकों के अणु का निर्माण करते हैं। जैसे - जल के निर्माण में प्रयुक्त परमाणुओं की संख्या का अनुपात निम्न प्रकार से ज्ञात करते है
|
तत्व
|
द्रव्यमान अनुपात |
परमाणु द्रव्यमान (u) |
द्रव्यमान अनुपात |
सरल अनुपात |
|
परमाणु द्रव्यमान |
||||
|
H |
1 |
1 |
1/1 = 1 |
1 X 2= 2 |
|
O |
8 |
16 |
8/16 = 2 |
½ X 2 = 1 |
इस प्रकार जल के अणु में प्रयुक्त परमाणुओं की संख्या का अनुपात H : O = 2 : 1 है।
प्रश्न 10.
निम्नलिखित यौगिकों के रासायनिक नाम लिखिए
(i) Ca3(PO4)2
(ii) K2CO3
(iii) AgCI
उत्तर:
|
(i) Ca3(PO4)2 |
कैल्सिम फास्फेट |
|
(ii) K2CO3 |
पोटेशियम कार्बोनेट |
|
(iii) AgCI |
सिल्वर क्लोराइड |
प्रश्न 11.
निम्नलिखित यौगिकों के रासायनिक नाम लिखिए।
(i) Al2 (SO4)3
(ii) K2SO4
(iii) KNO3
(iv) CaCO3
उत्तर:
|
(i) Al2 (SO4)3 |
ऐलुमिनियम सल्फेट |
|
(ii) K2SO4 |
पोटैशियम सल्फेट |
|
(iii) KNO3 |
पोटैशियम नाइट्रेट |
|
(iv) CaCO3 |
कैल्सियम कार्बोनेट |
प्रश्न 12.
आण्विक द्रव्यमान से क्या आशय है? उदाहरण द्वारा समझाइए।
उत्तर:
आण्विक द्रव्यमान: किसी पदार्थ का आण्विक द्रव्यमान उसके सभी संघटक परमाणुओं के द्रव्यमानों का योग होता है। इस प्रकार यह अणु का वह सापेक्ष द्रव्यमान है जिसे परमाणु द्रव्यमान इकाई (u) द्वारा व्यक्त किया जाता है।
उदाहरण:
जल (H2O) का आण्विक द्रव्यमान (2 x 1) + (1 x 16) = 18u होता है।

प्रश्न 13.
सूत्र इकाई द्रव्यमान से क्या तात्पर्य है? इसका परिकलन किस प्रकार करते हैं? एक उदाहरण द्वारा समझाइए।
उत्तर:
सूत्र इकाई द्रव्यमान: किसी पदार्थ का सूत्र इकाई द्रव्यमान, उसके सभी संघटक परमाणुओं के परमाणु द्रव्यमानों का योग होता है। इसके परिकलन में उस पदार्थ के लिए सूत्र इकाई का उपयोग करते हैं, जिसके संघटक आयन होते हैं।
उदाहरणार्थ: सोडियम क्लोराइड (NaCl) के इकाई सूत्र द्रव्यमान का परिकलन निम्न प्रकार करते हैं NaCl का इकाई सूत्र द्रव्यमान = (1 x 23 u) + (1 x 35.5 u)
= 58.5u
प्रश्न 14.
मोल से आप क्या समझते हैं?
उत्तर:
मोल, पदार्थ की वह मात्रा है, जिसमें कणों की संख्या (परमाणु, आयन या अणु) कार्बन - 12 के ठीक 12g में विद्यमान परमाणुओं के बराबर होती है। अत: किसी पदार्थ के एक मोल में कणों की संख्या निश्चित होती है, जिसका मान 6.022 x 1023 (आवोगाद्रो संख्या) होता है।
प्रश्न 15.
आयन तथा परमाणु में अन्तर लिखिए।
उत्तर:
|
आयन |
परमाणु |
|
1. यह विद्युत आवेशित होते हैं। |
1. ये उदासीन होते हैं। |
|
2. इनका इलेक्ट्रॉनिक विन्यास स्थायी होता है। |
2. अक्रिय गैसों को छोड़कर शेष तत्वों के परमाणुओं का इलेक्ट्रॉनिक विन्यास अस्थायी होता है। |
|
3. ये स्वतंत्र अवस्था में रह सकते हैं। |
3. ये स्वतंत्र अवस्था में नहीं रह सकते। |
प्रश्न 16.
ग्राम परमाणु द्रव्यमान को समझाइए।
उत्तर:
किसी तत्व के एक मोल परमाणुओं का ग्राम में व्यक्त द्रव्यमान, ग्राम परमाणु द्रव्यमान कहलाता है। अतः किसी पदार्थ की वह मात्रा, जिसका ग्रामों में द्रव्यमान, उसके परमाणु द्रव्यमान के बराबर हो, उस पदार्थ का ग्राम परमाणु द्रव्यमान कहलाता है।
उदाहरण:
नाइट्रोजन का परमाणु द्रव्यमान 14 होता है, अतः इसका ग्राम परमाणु द्रव्यमान 14 ग्राम होगा। इस प्रकार किसी पदार्थ का ग्राम परमाणु द्रव्यमान उसके एक मोल परमाणुओं का द्रव्यमान होता है।

प्रश्न 17.
आयन क्या होता है? लिखिए।
उत्तर:
आयन: वह आवेशित कण, जिस पर धन अथवा ऋण आवेश होता है, आयन कहलाता है। ऋण (-) आवेशित कण को ऋणायन (anion) तथा धन (+) आवेशित कण को धनायन (cation) कहते हैं।
उदाहरणार्थ: NaCl में धनायन सोडियम आयन (Na+) तथा ऋणायन क्लोराइड आयन (Cl-) संघटक कण के रूप में विद्यमान होते हैं। अत: आयन एक आवेशित परमाणु अथवा परमाणुओं का एक ऐसा समूह होता है, जिस पर नेट आवेश विद्यमान होता है।
प्रश्न 18.
रासायनिक संयोजन के नियम लिखिए।
उत्तर:
लवाइजिए एवं प्राउस्ट ने रासायनिक संयोजन के निम्न दो नियम प्रतिपादित किए।
- द्रव्यमान संरक्षण का नियम: इसके अनुसार किसी रासायनिक अभिक्रिया में द्रव्यमान का न तो सृजन किया जा सकता है और न ही विनाश।
- स्थिर अनुपात का नियम: इसके अनुसार किसी भी यौगिक में तत्व सदैव एक निश्चित द्रव्यमानों के अनुपात में विद्यमान होते हैं।
निबन्धात्मक प्रश्न:
प्रश्न 1.
तत्वों के प्रतीक से क्या आशय है? सबसे पहले प्रतीकों का प्रयोग किस वैज्ञानिक ने किया तथा उनके द्वारा क्या प्रतीक दिए गए? उदाहरण दीजिए।
उत्तर:
प्रतीक: रसायन विज्ञान में प्रत्येक तत्व को किसी विशेष चिह्न से प्रकट किया जाता है। अतः तत्वों के नामों के संक्षिप्त रूप ही उनके 'प्रतीक' कहलाते हैं। डाल्टन ऐसे प्रथम वैज्ञानिक थे, जिन्होंने तत्वों के प्रतीकों का प्रयोग अत्यन्त विशिष्ट अर्थ में किया। जब उन्होंने किसी तत्व के प्रतीक का प्रयोग किया तो यह प्रतीक उस तत्व की एक निश्चित मात्रा की ओर इंगित करता था अर्थात् यह प्रतीक तत्व के एक परमाणु को प्रदर्शित करता था। डाल्टन द्वारा प्रयोग किए गए कुछ प्रतीक अग्र प्रकार थे
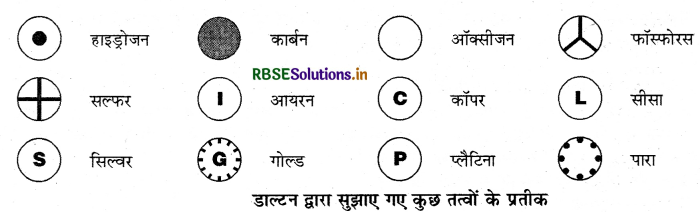
प्रारंभ में तत्वों के नाम की व्युत्पत्ति उन स्थानों के नामों से की गई थी, जहाँ वे सर्वप्रथम पाए गए थे, जैसे कॉपर (Copper) का नाम साइप्रस (Cyprus) से व्युत्पन्न हुआ। कुछ तत्वों के नामों को विशिष्ट रंगों से लिया गया, जैसेस्वर्ण (Gold) का नाम अंग्रेजी के उस शब्द से लिया गया, जिसका अर्थ होता है पीला। आजकल इंटरनेशनल यूनियन ऑफ प्योर एंड एप्लाइड केमिस्ट्री (IUPAC) तत्वों के नामों को स्वीकृति प्रदान करती है।
अधिकतर तत्वों के प्रतीक उन तत्वों के अंग्रेजी नामों के एक या दो अक्षरों से बने होते हैं। किसी प्रतीक के पहले अक्षर को सदैव बड़े अक्षर में तथा दूसरे अक्षर को छोटे अक्षर में लिखा जाता है। जैसे - Al, Co आदि। कुछ तत्वों के प्रतीक उनके अंग्रेजी नामों के पहले अक्षर तथा बाद में आने वाले किसी एक अक्षर को संयुक्त करके बनाते हैं, जैसे - Cl, Zn आदि। अन्य तत्वों के प्रतीकों को लैटिन, जर्मन या ग्रीक भाषाओं में उनके नामों से बनाया गया है, जैसे-लोहे का Fe (फेरम), सोडियम का Na (नैट्रियम) आदि।

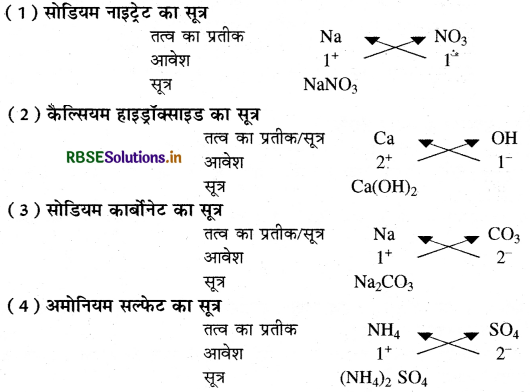
प्रश्न 2.
निम्नलिखित यौगिकों के रासायनिक सूत्र लिखिए
(1) सोडियम नाइट्रेट
(2) कैल्सियम हाइड्रॉक्साइड
(3) सोडियम कार्बोनेट
(4) अमोनियम सल्फेट।
उत्तर:
प्रश्न 3.
द्रव्यमान संरक्षण के नियम को एक प्रयोग द्वारा समझाइए।
उत्तर:
द्रव्यमान संरक्षण का नियम:
इस नियम के अनुसार "किसी रासायनिक अभिक्रिया में द्रव्यमान का न तो सृजन किया जा सकता है और न ही विनाश।" इसे हम अग्र प्रयोग द्वारा समझा सकते हैं।
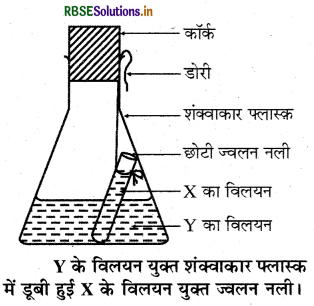
प्रयोग: सर्वप्रथम बेरियम क्लोराइड तथा सोडियम सल्फेट का 10 ml जल में जलीय विलयन पृथक्-पृथक् तैयार करते हैं। बेरियम क्लोराइड का विलयन (X) ज्वलन नली (छोटी परखनली) में तथा सोडियम सल्फेट का विलयन (Y) एक शंक्वाकार फ्लास्क में लेते हैं। अब ज्वलन नली को सावधानीपूर्वक एक धागे की सहायता से Y विलयनयुक्त नली फ्लास्क में इस प्रकार लटकाते हैं कि दोनों विलयन आपस में मिलें नहीं। इसके पश्चात् फ्लास्क के मुख को एक कॉर्क की से बंद कर देते हैं। पूरे उपकरण को सावधानीपूर्वक तौल लेते हैं।
अब फ्लास्क को झुकाकर, इस प्रकार घुमाते हैं कि बेरियम चित्र-के विलयन यक्त शंक्वाकार फ्लास्क क्लोराइड व सोडियम सल्फेट के विलयन आपस में पूरी तरह में डबी हई x के विलयन यक्त ज्वलन नली। मिल जाएँ। हम देखते हैं कि शंक्वाकार फ्लास्क में रासायनिक अभिक्रिया होती है और फ्लास्क में एक सफेद अवक्षेप बन जाता है। रासायनिक अभिक्रिया के पश्चात् पुनः पूरे उपकरण को तौलते हैं, तो हम पाते हैं कि रासायनिक अभिक्रिया के पश्चात् फ्लास्क अन्तर्वस्तुओं के साथ उतना ही द्रव्यमान प्रदर्शित करता है जितना अभिक्रया से पहले था। इससे द्रव्यमान संरक्षण के नियम की पुष्टि होती है।

प्रश्न 4.
आयन किसे कहते हैं? ये कितने प्रकार के होते हैं? उदाहरण सहित समझाइए।
उत्तर:
आयन: प्रत्येक तत्त्व का एक निश्चित परमाणु क्रमांक तथा इलेक्ट्रॉनिक विन्यास होता है और वह दूसरे तत्त्व से भिन्न होता है। तत्त्वों के रासायनिक गुण परमाणुओं की इलेक्ट्रॉनीय संरचना पर निर्भर करते हैं। परमाणु जब इलेक्ट्रॉन का त्याग कर देता है तब धन आवेशित हो जाता है और इलेक्ट्रॉन ग्रहण करने पर वह ऋण आवेशित हो जाता है। ये आवेशित कण ही आयन कहलाते हैं। अत: आयन एक आवेशित परमाणु अथवा परमाणुओं का एक ऐसा समूह होता है, जिस पर नेट आवेश विद्यमान होता है। परमाणुओं के समूह, जिन पर नेट आवेश विद्यमान हो, उसे बहुपरमाणुक आयन कहते हैं। इनके ऊपर एक निश्चित आवेश होता है।
आयन इन पर विद्यमान आवेश के आधार पर ये दो प्रकार के होते है।
- धनायन (Cation): इन पर धन आवेश पाया जाता है। धनायन बनने के लिए ऊर्जा की आवश्यकता होती है।
- ऋणायन (Anion): इन पर ऋण (-) आवेश पाया जाता है। ऋणायन बनने पर ऊर्जा का उत्सर्जन होता है। कुछ आयनों के नाम तथा संकेत निम्न प्रकार हैं।
|
संयोजकता |
आयन का नाम |
संकेत |
हाइड्रोजन |
संकेत |
बहुपरमाणुक आयन |
संकेत |
|
1. |
सोडियम |
Na+ |
हाइड्राइड |
H+ |
अमोनियम |
NH4+ |
|
पोटैशियम |
K+ |
क्लोराइड |
H- |
हाइड्रॉक्साइड |
OH- |
|
|
सिल्वर |
Ag+ |
ब्रोमाइड |
Cl- |
नाइट्रेट |
NO3- |
|
|
|
|
आयोडाइड |
Br- |
हाइड्रोजन |
|
|
|
|
|
ऑक्साइड |
I- |
कार्बोनेट |
HCO3- |
|
|
2. |
मैग्नीशियम |
Mg2+ |
सल्फाइड |
O2- |
कार्बोनेट |
CO32- |
|
कैल्सयम |
Ca2+ |
नाइट्राइड |
S2- |
सल्फाइट |
SO32- |
|
|
जिक |
Zn2+ |
|
|
सल्फेट |
SO42- |
|
|
3. |
ऐलुमिनियम |
Al3+ |
हाइड्रोजन |
N3- |
फॉस्फेट |
PO43- |
प्रश्न 5.
रासायनिक सूत्र लिखते समय हमें किन - किन बातों का ध्यान रखना चाहिए?
उत्तर:
किसी यौगिक का रासायनिक सूत्र, उसके सभी संघटक तत्वों के परमाणुओं की संख्या को दर्शाता है।
रासायनिक सूत्र लिखते समय सामान्यत: निम्नलिखित बातों का ध्यान रखना चाहिए:
- तत्व के अणु में उपस्थित परमाणुओं की संख्या उसके प्रतीक के नीचे लिखते हैं। उदाहरण: हाइड्रोजन का अणु H2 फास्फोरस का अणु P4 आदि।
- जब एक यौगिक किसी धातु एवं अधातु के संयोग से निर्मित होता है, तो यौगिक के रासायनिक सूत्र में सर्वप्रथम धातु तत्व या धनात्मक मूलक के प्रतीक को बायीं ओर तथा अधातु तत्व या ऋणात्मक मूलक के प्रतीक को दायीं ओर लिखते हैं। उदाहरण: कैल्सियम ऑक्साइड CaO आयरन सल्फाइड FeS
- प्रतीकों के ऊपर उनकी संयोजकता लिखते हैं।
- संयोजकता को व्युत्क्रम प्रतीक के नीचे लिखते हैं।
- दोनों मूलकों की संयोजकता समान होने पर किसी भी मूलक के नीचे कोई संख्या नहीं लिखते हैं।
- संख्या एक नहीं लिखते हैं।
- आयन की संयोजकता अथवा आवेश संतुलित होना चाहिए।
- बहुपरमाणुक आयनों द्वारा निर्मित यौगिकों में आयन को पहले कोष्ठक में लिखते हैं, तत्पश्चात् आयनों की संख्या कोष्ठक के बाहर लिखते हैं। उदाहरण: MgOH2 यदि बहुपरमाणुक आयन की संख्या 1 हो, तो कोष्ठक नहीं लगाते हैं। उदाहरण: NaOH
प्रश्न 6.
निम्नलिखित यौगिकों के रासायनिक सूत्र लिखिए।
(1) हाइड्रोजन सल्फाइड।
(2) कार्बन टेट्रा क्लोराइड।
(3) मैग्नीशियम क्लोराइड।
(4) ऐलुमिनियम ऑक्साइड।
(5) कैल्सियम ऑक्साइड।
उत्तर:

प्रश्न 7.
मोल संकल्पना क्या है? इसका प्रादुर्भाव कैसे हुआ?
उत्तर:
1. मोल संकल्पना:
पदार्थों की मात्राओं का ज्ञान, उनके द्रव्यमानों के आधार की अपेक्षा उनके अणुओं एवं परमाणुओं की संख्या के आधार पर प्राप्त करना अधिक सुविधाजनक होता है। अतः एक नई इकाई 'मोल' (mole) प्रस्तावित की गई। इसके अनुसार किसी स्पीशीज (परमाणु, अणु, आयन अथवा कण) के एक मोल में मात्राओं की वह संख्या है जो ग्राम में उसके परमाणु अथवा आण्विक द्रव्यमान के बराबर होती है। "किसी पदार्थ का एक मोल उसकी वह मात्रा है, जिसमें उतने ही कण उपस्थित होते हैं, जितने कार्बन - 12 समस्थानिक के ठीक 12 ग्राम में परमाणुओं की संख्या होती है।"
किसी पदार्थ के एक मोल में कणों (परमाणु, अणु या आयन) की संख्या निश्चित होती है, जिसका मान 6.022 x 1023 होता है। यह मान प्रायोगिक विधि से प्राप्त किया गया है। इसको आवोगाद्रो स्थिरांक अथवा आवोगाद्रो संख्या कहते हैं, जिसको 'No' या ‘NA' से निरूपित किया जाता है। किसी पदार्थ के एक मोल का द्रव्यमान उसके सापेक्ष परमाणु एवं अणु द्रव्यमान (ग्राम में) के बराबर होता है। किसी तत्त्व के परमाणुओं के एक मोल का द्रव्यमान जिसे मोलर द्रव्यमान कहते हैं, हमें उसी संख्यात्मक मान को लेना पड़ेगा परन्तु इकाई को 4 से 8 में परिवर्तित करना पड़ेगा। परमाणुओं के मोलर द्रव्यमान को ग्राम परमाणु द्रव्यमान भी कहते हैं। उदाहरण: 14 हाइड्रोजन में केवल 1 हाइड्रोजन परमाणु होता है लेकिन 1g हाइड्रोजन में उसके 1 मोल परमाणु होते हैं।
2. मोल संकल्पना का प्रादुर्भाव:
परमाणु एवं अणु आकार में बहुत सूक्ष्म होते हैं और किसी पदार्थ की बहुत कम मात्रा में भी इनकी संख्या बहुत अधिक होती है। अभिक्रियाओं को संपन्न कराने के लिए अणुओं एवं परमाणुओं की संख्याओं की आवश्यकता होती है, इसके लिए रसायनज्ञों को द्रव्यमानों को ग्रामों में संख्याओं के साथ सम्बन्धित करना पड़ता है जो कि निम्न प्रकार से करते हैं।
1 मोल = 6.022 x 1023 = ग्राम सापेक्ष द्रव्यमान।
मोल संकल्पना के अनुसार 12 g कार्बन में 6.022 x 1023 कार्बन होते है एवं इन कणों को गिनना सम्भव नहीं है। अत: इनकी संख्या को मोल में व्यक्त करके कार्य करना सरल हो जाता है। इस कारण रसायनज्ञों के परिकलन की इकाई मोल हुई। विल्हेल्म ओस्टवाल्ड ने 1896 में 'मोल' शब्द प्रस्तावित किया था एवं 1967 में मोल इकाई स्वीकार कर ली गई, जो परमाणुओं एवं अणुओं की वृहत् संख्या को निरूपित करने का सरलतम उपाय है।

प्रश्न 8.
मोल, आवोगाद्रो संख्या तथा द्रव्यमान के मध्य सम्बन्ध को आरेख द्वारा दर्शाइए।
उत्तर:
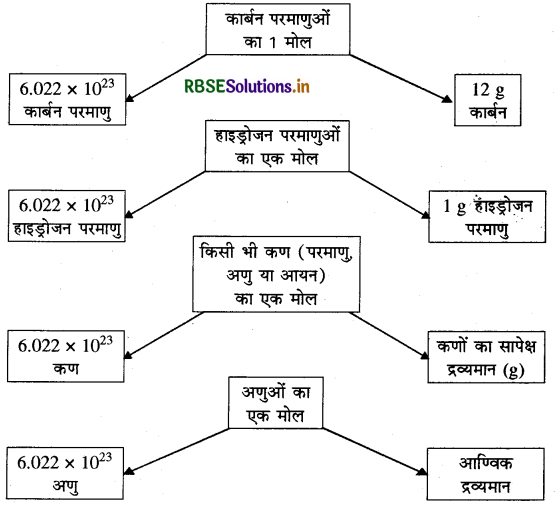
आंकिक प्रश्न:
प्रश्न 1.
जल (H2O) एवं नाइट्रिक अम्ल (HNO3) के आण्विक द्रव्यमान का परिकलन कीजिए।
उत्तर:
हल:
(i) जल (H2O) का आण्विक द्रव्यमान
हाइड्रोजन का परमाणु द्रव्यमान = 1u
ऑक्सीजन का परमाणु द्रव्यमान = 16.u
अतः जल (H2O), जिसमें दो परमाणु हाइड्रोजन एवं एक परमाणु ऑक्सीजन होते हैं। का आण्विक द्रव्यमान
= (2 x 1) + (1 x 16)u
= 2 + 164
= 184
अतः जल का आण्विक द्रव्यमान = 18 u
(ii) नाइट्रिक अम्ल (HNO3) का आण्विक द्रव्यमान
हाइड्रोजन (H) का परमाणु द्रव्यमान = 1u
नाइट्रोजन (N) का परमाणु द्रव्यमान = 14u
ऑक्सीजन (O) का परमाणु द्रव्यमान = 16u
नाइट्रिक अम्ल में एक परमाणु H, एक परमाणु N का एवं तीन परमाणु ऑक्सीजन के हैं। अत: नाइट्रिक अम्ल का आण्विक द्रव्यमान
= 1u + 14u + (3 x 16)u
15u+ 48u
= 63u
प्रश्न 2.
CaCl2 के सूत्र इकाई द्रव्यमान का परिकलन कीजिए।
उत्तर:
हल:
कैल्सियम क्लोराइड का सूत्र इकाई CaCl2 है।
Ca का परमाणु द्रव्यमान = 40u
Cl (क्लोरीन) का परमाणु द्रव्यमान = 35.5u
CaCl2 का सूत्र इकाई द्रव्यमान = 1 x 40u + (2 x 35.5)u
= 40 u + 71u
= 111u.

प्रश्न 3.
निम्न यौगिकों के सूत्र इकाई द्रव्यमान का परिकलन कीजिए।
(i) KNO3
(ii) Na2SO4
यहाँ [K = 39 u, N = 14 u, O = 16 u, Na = 23 u, S = 32 u है।]
उत्तर:
हल:
(i) KNO3 (पोटेशियम नाइट्रेट) का सूत्र इकाई द्रव्यमान
= K + N + 30
= 39u + 14u + (3 x 164)
= 39u + 14u + 48u
= 101u.
(ii) Na2SO4 सोडियम सल्फेट का सूत्र इकाई द्रव्यमान
= 2Na + S + 4 x O
= (2 x 23u) + 324 + (4 x 164)
= 46u + 32u + 64u
= 142u.
प्रश्न 4.
निम्नलिखित में मोलों की संख्या का परिकलन कीजिए।
(i) 52g हीलियम (द्रव्यमान से मोल प्राप्त कीजिए।)
(ii) 12.044 x 1023 हीलियम परमाणुओं की संख्या (कणों की संख्या से मोल प्राप्त कीजिए।)
उत्तर:
हल:
मोलों की संख्या = n
दिया गया द्रव्यमान = m
मोलर द्रव्यमान = M
दिये गये कणों की संख्या = N
कणों की आवोगाद्रो संख्या = No
(i) He का परमाणु द्रव्यमान = 4u
He का मोलर द्रव्यमान = 4g

(ii) हम जानते हैं कि 1 मोल = 6.022 x 1023

प्रश्न 5.
निम्नलिखित द्रव्यमानों का परिकलन कीजिए।
(i) 0.5 मोल N2 गैस (अणु के मोल से द्रव्यमान)
(ii) 0.5 मोल N परमाणु (परमाणु के मोल से द्रव्यमान)
(ii) 3.011 x 1023 N परमाणुओं की संख्या (संख्या से द्रव्यमान)
(iv) 6.022 x 1023 N2 अणुओं की संख्या (संख्या से द्रव्यमान)
उत्तर:
हल:
(i) N2 गैस का अणु द्रव्यमान = 2 x 14
= 28u
∴ N2 गैस का मोलर द्रव्यमान = 28g
अतः द्रव्यमान (m) = मोलर द्रव्यमान x मोलों की संख्या (M x n)
28 x 0.5 = 14g.
(ii) चूँकि N का परमाणु द्रव्यमान = 14u
N का मोलर द्रव्यमान = 14g
अतः द्रव्यमान (m) = मोलर द्रव्यमान x मोलों की संख्या (M x n)
14 x 0.5 = 7g.
(iii)

द्रव्यमान (m) = मोलर द्रव्यमान x मोलों की संख्या (M x n)
∴ द्रव्यमान = 14 x 0.5
= 7g.
(iv)

प्रश्न 6.
निम्नलिखित प्रत्येक में कणों की संख्या का परिकलन कीजिए।
(i) 46g सोडियम परमाणु (द्रव्यमान से संख्या)
(iii) 8g ऑक्सीजन अणु (द्रव्यमान से अणुओं की संख्या)
(iii) 0.1 मोल कार्बन परमाणु (दिए गए मोल से संख्या)।
उत्तर:
हल:

सोडियम का परमाणु द्रव्यमान = 23u
सोडियम का मोलर द्रव्यमान = 23g
प्रश्नानुसार सोडियम का दिया गया द्रव्यमान = 46g
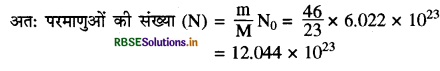
(ii)

आवोगाद्रो संख्या ऑक्सीजन का परमाणु द्रव्यमान = 16u
∴ ऑक्सीजन अणु का मोलर द्रव्यमान = 16 x 2 = 32g
प्रश्नानुसार ऑक्सीजन का दिया गया द्रव्यमान = 8g
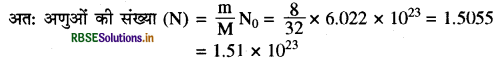
(iii) कणों (परमाणु) की संख्या = कण के मोलों की संख्या x आवोगाद्रो संख्या
N = n x No
= 0.1 x 6.022 x 1023
= 6.022 x 1022

प्रश्न 7.
जल (H2O) के 1.5 मोल में कितने हाइड्रोजन परमाणु होंगे?
उत्तर:
हल:
H2O के एक मोल में अणुओं की संख्या
= 6.022 x 1023
= 12.044 x 1024
अत: H2O के 1.5 मोल में हाइड्रोजन परमाणुओं की संख्या
= 1.5 x 12.044 x 1023
= 18.066 x 1023
प्रश्न 8.
ग्लूकोस के 0.25 मोल का ग्रामों में भार क्या होगा?
उत्तर:
हल:
ग्लूकोस (C6H12O6) का मोलर द्रव्यमान = (6 x 12) + (1 x 12) + (6 x 16)
= 72 + 12 + 96
= 180
ग्लूकोस का 1 मोल = 180 ग्राम
अतः ग्लूकोस का 0.25 मोल = 0.25 x 180 ग्राम
= 45 ग्राम.
प्रश्न 9.
बेरियम क्लोराइड के 0.2 मोल से क्लोराइड आयनों के कितने मोल प्राप्त होंगे?
उत्तर:
हल:
बेरियम का अणु सूत्र BaCl2 है अतः इसके एक अणु से दो क्लोराइड आयन (Cl-) प्राप्त होंगे।
1 मोल BaCl2 से प्राप्त क्लोराइड आयन = 2 मोल Cl-
आयन अतः 0.2 मोल BaCl से प्राप्त होंगे = 0.2 x 2 मोल Cl- आयन
= 0.4 मोल Cl- आयन
प्रश्न 10.
4.9 ग्राम H2SO4 में कितने मोल होंगे?
उत्तर:
हल:
H2SO4 का मोलर द्रव्यमान = (2 x 1) + (1 x 32) + (4 x 16)
= 2+ 32 + 64 = 98
98 ग्राम H2SO4 = 1

अत: 4.9 ग्राम H2SO4 में 0.05 मोल होंगे।

प्रश्न 11.
10g जल में जल के अणुओं की संख्या ज्ञात कीजिए। (आवोगाद्रो संख्या = 6.022 x 1023)
उत्तर:
हल:
1 मोल जल = 6.022 x 1027 जल के अणु
या 18 ग्राम जल = 6.022 x 1023 जल अणु

