RBSE Class 10 Science Important Questions Chapter 5 तत्वों का आवर्त वर्गीकरण
Rajasthan Board RBSE Class 10 Science Important Questions Chapter 5 तत्वों का आवर्त वर्गीकरण Important Questions and Answers.
Rajasthan Board RBSE Solutions for Class 10 Science in Hindi Medium & English Medium are part of RBSE Solutions for Class 10. Students can also read RBSE Class 10 Science Important Questions for exam preparation. Students can also go through RBSE Class 10 Science Notes to understand and remember the concepts easily. Browsing through class 10 science chapter 12 question answer in hindi that includes all questions presented in the textbook.
RBSE Class 10 Science Chapter 5 Important Questions तत्वों का आवर्त वर्गीकरण
वस्तुनिष्ठ प्रश्न
प्रश्न 1.
आधुनिक आवर्त सारणी का आधार है.
(अ) परमाणु द्रव्यमान
(ब) आणविक द्रव्यमान
(स) परमाणु संख्या
(द) परमाणु आयतन
उत्तर:
(स) परमाणु संख्या

प्रश्न 2.
L कोश में इलेक्ट्रॉनों की संख्या होगी
(अ) 2
(ब) 18
(स) 8
(द) 32
उत्तर:
(स) 8
प्रश्न 3.
आवर्त सारणी में किसी समूह के सभी तत्वों में समान होते हैं
(अ) परमाणु संख्या
(ब) परमाणु द्रव्यमान
(स) इलेक्ट्रॉनों की संख्या
(द) संयोजी इलेक्ट्रॉनों की संख्या
उत्तर:
(द) संयोजी इलेक्ट्रॉनों की संख्या
प्रश्न 4.
वर्ग में ऊपर से नीचे जाने पर परमाणु साइज.(आकार) में -
(अ) कमी होती है।
(ब) वृद्धि होती है।
(स) स्थिर रहता है।
(द) अनिश्चित होता है।
उत्तर:
(ब) वृद्धि होती है।

प्रश्न 5.
सिलिकॉन है -
(अ) धातु
(ब)अधातु
(स) उपधातु
(द) उपर्युक्त में से कोई नहीं ।
उत्तर:
(स) उपधातु
प्रश्न 6.
धातुओं के ऑक्साइड की प्रवृत्ति सामान्यतः होती है
(अ) अम्लीय
(ब) उदासीन
(स) उभयधर्मी
(द) क्षारीय
उत्तर:
(द) क्षारीय
अतिलघूत्तरात्मक प्रश्न
प्रश्न 1.
सर्वप्रथम किसने तत्वों को समूहों में व्यवस्थित करने का प्रयास किया था?
उत्तर:
सन् 1817 में जर्मन रसायनज्ञ, वुल्फगांग डॉबेराइनर ने समान गुणधर्मों वाले तत्वों को समूहों में व्यवस्थित करने का प्रयास किया।
प्रश्न 2.
डॉबेराइनर ने किस तत्व की पहचान उत्प्रेरक के रूप में की थी?
उत्तर:
प्लैटिनम।
प्रश्न 3.
मेन्डेलीफ ने आवर्त सारणी में कुछ रिक्त स्थान क्यों छोड़े थे?
उत्तर:
मेन्डेलीफ ने दृढ़तापूर्वक कुछ ऐसे तत्वों के अस्तित्व का अनुमान किया जो उस समय तक ज्ञात नहीं थे। उनके लिए मेन्डेलीफ ने आवर्त सारणी में रिक्त स्थान छोड़े थे।

प्रश्न 4.
क्लोरीन समस्थानिकों के परमाणु भार लिखिए।
उत्तर:
Cl35 और Cl37
प्रश्न 5.
आवर्त सारणी में आवर्त (Periods) तथा वर्ग (Group) किसे कहते हैं? ये कितने - कितने होते हैं?
उत्तर:
आवर्त सारणी में क्षैतिज पंक्तियों को आवर्त और ऊर्ध्वाधर स्तम्भों को वर्ग कहते हैं। आधुनिक आवर्त सारणी में 18 वर्ग और 7 आवर्त होते हैं।
प्रश्न 6.
सोडियम क्लोरीन तथा सिलिकॉन में से कौनसी उपधातु है?
उत्तर:
सिलिकॉन।
प्रश्न 7.
न्यूलैण्ड का अष्टक नियम क्या है?
उत्तर:
न्यूलैण्ड का अष्टक नियम-जब तत्वों को उनके बढ़ते परमाणु द्रव्यमान के आधार पर व्यवस्थित किया जाता है तो प्रत्येक आठवें तत्व के गुण पहले तत्व के गुणों के समान होते हैं।
प्रश्न 8.
आधुनिक आवर्त नियम क्या है?"समझाइए।
उत्तर:
आधुनिक आवर्त नियम - मोज्ले के अनुसार, “तत्वों के भौतिक और रासायनिक गुण उनके परमाणु संख्या के आवर्ती फलन होते हैं।”

प्रश्न 9.
मेण्डेलीफ का आवर्त नियम लिखिए।
उत्तर:
मेण्डेलीफ के अनुसार, “तत्वों के भौतिक और रासायनिक गुण उनके परमाणु द्रव्यमान के आवर्ती फलन होते हैं।” इसे ही मेण्डेलीफ का आवर्त नियम कहते हैं।
प्रश्न 10.
किसी कोश में इलेक्ट्रॉनों की अधिकतम संख्या किस सूत्र से ज्ञात की जाती है?
उत्तर:
किसी कोश में इलेक्ट्रॉनों की अधिकतम संख्या = 2n2 सूत्र से ज्ञात की जाती है। (n = कोश की संख्या)
प्रश्न 11.
तीसरे आवर्त में स्थित तत्वों में धातु कौनसे हैं?
उत्तर:
तीसरे आवर्त में Na, Mg, Al धातु हैं।
प्रश्न 12.
आवर्त सारणी के तीसरे समूह में एक तत्व Y है तो इसके ऑक्साइड का सूत्र क्या होगा?
उत्तर:
तत्व तीसरे समूह का है अतः इसकी संयोजकता 3 है तथा ऑक्सीजन की संयोजकता 2 है। अतः ऑक्साइड का सूत्र Y203 होगा।
प्रश्न 13.
किसी समूह में उपस्थित तत्वों की संयोजकता क्या होगी?
उत्तर:
किसी समूह के तत्वों की संयोजकता = समूह की संख्या या 8 - समूह की संख्या ।
प्रश्न 14.
क्लोरीन, ब्रोमीन तथा आयोडीन में से किसकी क्रियाशीलता हाइड्रोजन के प्रति न्यूनतम है?
उत्तर:
हेलोजन वर्ग में F2से I2 तक क्रियाशीलता कम होती है। अतः हाइड्रोजन के प्रति आयोडीन की क्रियाशीलता न्यूनतम है।
प्रश्न 15.
समूह 1 के तत्वों का नाम क्या है?
उत्तर:
समूह एक के तत्वों को क्षार धातु कहते हैं |
प्रश्न 16.
तीसरे आवर्त में तत्वों के ऑक्साइडों के क्षारीय गुण में क्या परिवर्तन होता है?
उत्तर:
तीसरे आवर्त में बाएँ से दाएँ जाने पर तत्वों के ऑक्साइडों का क्षारीय गुण कम होता है।

प्रश्न 17.
डॉबेरांइनर के त्रिक् का एक उदाहरण लिखिए।
उत्तर:
Cl, Br तथा I डॉबेराइनर के त्रिक का उदाहरण है।
प्रश्न 18.
आवर्त में तत्वों में इलेक्ट्रॉन त्यागने की प्रवृत्ति कम होती है। क्यों?
उत्तर:
आवर्त में जैसे-जैसे बाईं से दाईं ओर जाते हैं संयोजकता कोश के इलेक्ट्रॉनों पर लगने वाला प्रभावी नाभिकीय आवेश बढ़ता है, जिससे इलेक्ट्रॉन त्यागने की प्रवृत्ति घट जाती है।
प्रश्न 19.
धातु, विद्युत धनात्मक होते हैं, क्यों?
उत्तर:
आबंध बनाते समय धातु में इलेक्ट्रॉन त्यागने की प्रवृत्ति होती है अतः ये विद्युत धनात्मक होते हैं।
प्रश्न 20.
किसी समूह के कौनसे भाग में तत्वों में धात्विक गुण अधिक होगा तथा परमाणु आकार अधिक होगा?
उत्तर:
किसी समूह के नीचे की तरफ स्थित तत्वों में धात्विक गुण अधिक होगा तथा परमाणु आकार भी अधिक होगा।
प्रश्न 21.
आवर्त सारणी में आवर्त किसे कहते हैं तथा परमाणु क्रमांक में परिवर्तन से परमाणु की संरचना किस प्रकार बदलती है?
उत्तर:
आवर्त सारणी में क्षैतिज पंक्तियों को आवर्त कहते हैं | परमाणु क्रमांक में परिवर्तन से इलेक्ट्रॉनों तथा प्रोटॉनों की संख्या में परिवर्तन होता है। अतः परमाणु की संरचना में परिवर्तन होता है।

प्रश्न 22.
आज तक हमें कितने तत्वों की जानकारी है?
उत्तर:
118 तत्व।
प्रश्न 23.
न्यूलैण्ड्स की कल्पना के अनुसार, प्रकृति में कुल तत्वों की संख्या कितनी थी?
उत्तर:
न्यूलैण्ड्स की कल्पना के अनुसार प्रकृति में कुल तत्वों की संख्या 56 थी।
लघूत्तरात्मक प्रश्न
प्रश्न 1.
न्यूलैंड्स के अष्टक सिद्धान्त को लिखिए। निम्नलिखित से समान गुणधर्म रखने वाले तत्व का नाम लिखिए
(अ) नाइट्रोजन
(ब) लिथियम।
उत्तर:
न्यूलैंड्स का अष्टक सिद्धान्त-न्यूलैंड्स ने सन् 1866 में ज्ञात तत्वों को परमाणु द्रव्यमान के बढ़ते क्रम में रखा (हाइड्रोजन से थोरियम तक)। उन्होंने देखा कि प्रत्येक आठवें तत्व का गुण पहले तत्व के गुण के समान है। उन्होंने इसकी तुलना संगीत के अष्टक से की और इसलिए इसे 'न्यूलैंड्स का अष्टक सिद्धान्त' कहा जाता है। न्यूलैंड्स के अष्टक सिद्धान्त के अनुसार नाइट्रोजन के समान गुणधर्म वाला तत्व फॉस्फोरस तथा लिथियम के समान तत्व सोडियम है।
प्रश्न 2.
आवर्त सारणी में किसी आवर्त में बायें से दायें जाने पर निम्नलिखित में क्या परिवर्तन होता है?
(i) परमाणु आकार
(ii) धात्विक गुण
(iii) संयोजकता इलेक्ट्रॉनों की संख्या।
उत्तर:
(i) परमाणु आकार-आवर्त में बाईं से दाईं ओर जाने पर परमाणु त्रिज्या घटती है। नाभिक में आवेश के बढ़ने से यह इलेक्ट्रॉनों को नाभिक की ओर अधिक आकर्षित करता है जिससे परमाणु का आकार घटता जाता है।
(ii) धात्विक गुण-आवर्त में जैसे-जैसे संयोजकता कोश के इलेक्ट्रॉनों पर लगने वाला प्रभावी नाभिकीय आवेश बढ़ता है, इलेक्ट्रॉन त्यागने की प्रवृत्ति कम होती है, अतः धात्विक गुण कम होते जाते हैं।
(iii) संयोजकता इलेक्ट्रॉनों की संख्या-आवर्त में बायें से दायें जाने पर संयोजकता इलेक्ट्रॉन की संख्या में पहले वृद्धि व बाद में कमी आती है।

प्रश्न 3.
डॉबेराइनर के त्रिक् क्या हैं? उदाहरण सहित बताइए।
उत्तर:
वर्ष 1817 में डॉबेराइनर ने समान गुणधर्मों वाले तत्वों को समूहों में व्यवस्थित करने का प्रयास किया। उन्होंने तीन-तीन तत्व वाले कुछ समूहों को चुना एवं इन समूहों को त्रिक कहा। डॉबेराइनर के अनुसार त्रिक के तीनों तत्वों को उनके परमाणु द्रव्यमान के आरोही क्रम में रखने पर बीच वाले तत्व का परमाणु द्रव्यमान, अन्य दो तत्वों के परमाणु द्रव्यमान का लगभग औसत होता है।' उदाहरण के लिए, लीथियम (Li), सोडियम (Na) एवं पोटैशियम (K) का त्रिक जिनके परमाणु द्रव्यमान क्रमशः 6.9, 23.0 तथा 39.0 हैं।
अन्य उदाहरण: Ca (40.1)
CI(35.5)
Sr (87.6)
Br (79.9)
Ba(137.3)
I(126.9)
प्रश्न 4.
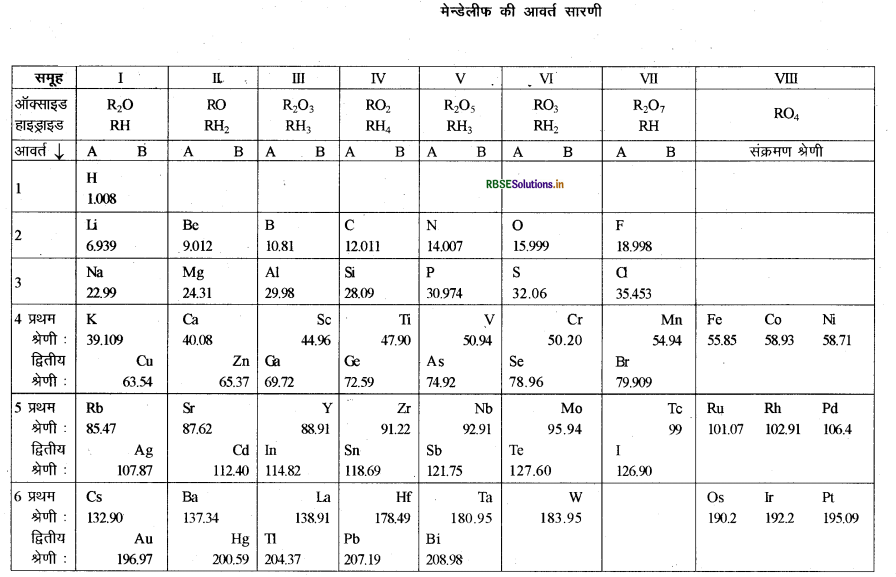
मेन्डेलीफ की आवर्त सारणी में तत्वों को किस प्रकार व्यवस्थित किया तथा उनके द्वारा तत्वों के वर्गीकरण का आधार क्या था? समझाइए।
उत्तर:
मेन्डेलीफ के समय 63 तत्व ज्ञात थे। उन्होंने अपनी सारणी में तत्वों को उनके मूल गुणधर्म, परमाणु द्रव्यमान तथा रासायनिक गुणों में समानता के आधार पर व्यवस्थित किया। रासायनिक गुणधर्मों के अन्तर्गत मेन्डेलीफ ने तत्वों के ऑक्सीजन एवं हाइड्रोजन के साथ बनने वाले यौगिकों पर अपना ध्यान दिया क्योंकि ऑक्सीजन एवं हाइड्रोजन अत्यन्त सक्रिय तत्व हैं तथा अधिकांश तत्वों के साथ यौगिक बनाते हैं | तत्व से बनने वाले हाइड्राइड एवं ऑक्साइड के सूत्र को तत्वों के वर्गीकरण के लिए मूलभूत गुणधर्म माना गया।
फिर उन्होंने समान गुणधर्म वाले तत्वों को अलग किया तथा उन्होंने देखा कि अधिकांश तत्वों को आवर्त सारणी में स्थान मिल गया था तथा अपने परमाणु द्रव्यमान के बढ़ते क्रम में वे तत्व व्यवस्थित हो गए। उन्होंने देखा कि समान भौतिक एवं रासायनिक गुणधर्म वाले तत्व एक निश्चित अंतराल के बाद फिर आ जाते हैं। इसी आधार पर मेन्डेलीफ ने आवर्त सारणी बनाई, जिसका सिद्धान्त है-तत्वों के गुणधर्म उनके परमाणु द्रव्यमान का आवर्त फलन होते हैं। इसे मेन्डेलीफ का आवर्त नियम कहते हैं। मेन्डेलीफ की आवर्त सारणी में ऊर्ध्व स्तम्भ को ‘ग्रुप' (समूह) तथा क्षैतिज पंक्तियों को पीरियड' (आवर्त) कहते हैं।
प्रश्न 5.
मेन्डेलीफ ने उस समय तक अज्ञात तत्वों का नामकरण किस प्रकार किया? उदाहरण देकर समझाइए।
उत्तर:
मेन्डेलीफ ने कुछ ऐसे तत्वों के अस्तित्व का अनुमान किया जो उस समय तक ज्ञात नहीं थे। इनका नामकरण उन्होंने उसी समूह में इससे पहले आने वाले तत्व के नाम में ‘एका' (संस्कृत शब्द) उपसर्ग लगाकर किया। जैसे एका-बोरॉन, एका-ऐलुमिनियम तथा एका-सिलिकॉन जो बाद में स्कैंडियम, गैलियम, जर्मेनियम के रूप में ज्ञात हुए।
प्रश्न 6.
आधुनिक आवर्त नियम क्या है तथा आधुनिक आवर्त सारणी किस आधार पर बनाई गई? समझाइए।
उत्तर:
आधुनिक आवर्त नियम-“तत्वों के गुणधर्म उनकी परमाणु संख्या का आवर्त फलन होते हैं।" हेनरी मोज्ले द्वारा प्रस्तुत आधुनिक आवर्त सारणी परमाणु संख्या के आधार पर है जो कि अधिक आधारभूत गुण है। परमाणु संख्या से हमें परमाणु के नाभिक में स्थित प्रोटोनों की संख्या ज्ञात होती है तथा एक तत्व से दूसरे तक बढ़ने पर इस संख्या में एक की वृद्धि होती है। तत्वों को उनकी परमाणु-संख्या (Z) के बढ़ते क्रम में व्यवस्थित करने पर जो वर्गीकरण प्राप्त होता है उसे आधुनिक आवर्त सारणी कहा जाता है। तत्वों को परमाणु-संख्या के आरोही क्रम में व्यवस्थित करने पर तत्वों के गुणधर्मों का अधिक परिशुद्धता से अनुमान लगा सकते हैं।

प्रश्न 7.
(a) परमाणु क्रमांक 17 वाले तत्व की संयोजकता कितनी है तथा यह किस प्रकार ज्ञात की जाती है?
(b) ब्रोमीन तथा आयोडीन को एक ही समूह में रखा गया है।
उत्तर:
(a) तत्व का परमाणु क्रमांक 17 है अतः इसके नाभिक में 17 प्रोटॉन तथा परमाणु में 17 इलेक्ट्रॉन होंगे। अतः इस तत्व का इलेक्ट्रॉनिक विन्यास 2, 8, 7 है अर्थात् इसके संयोजी कोश में 7 इलेक्ट्रॉन हैं अतः इसे अपना कोश पूर्ण करने के लिए एक इलेक्ट्रॉन की आवश्यकता होती है। अतः इसकी संयोजकता - 1 होगी।
तत्व की संयोजकता = संयोजी कोश में इलेक्ट्रॉनों की संख्या
या
तत्व की संयोजकता = 8-संयोजी कोश में इलेक्ट्रॉनों की संख्या
(b) ब्रोमीन तथा आयोडीन को एक ही समूह में रखा गया है क्योंकि दोनों ही तत्वों के बाह्यतम कोश में 7 इलेक्ट्रॉन हैं तथा दोनों ही - 1 संयोजकता दर्शाते हैं।
प्रश्न 8.
(a) आधुनिक आवर्त सारणी में कोबाल्ट (Co) तथा Ni (निकल) के स्थान कैसे निर्धारित किए गए हैं?
(b) (i) आधुनिक आवर्त सारणी के समूह 1 में उपस्थित तत्वों के नाम बताइए।
(ii) समूह 1 के पहले तीन तत्वों के इलेक्ट्रॉनिक विन्यास लिखिए।
(iii) इन तत्वों के इलेक्ट्रॉनिक विन्यास में क्या समानता है?
(iv) इन तीनों तत्वों में कितने संयोजकता इलेक्ट्रॉन हैं?
उत्तर:
(a) कोबाल्ट (Co) का परमाणु क्रमांक 27 एक निकल (Ni) का परमाणु क्रमांक 28 है। आधुनिक आवर्त सारणी के नियम के अनुसार आवर्त सारणी में तत्वों को बढ़ते हुए परमाणु क्रमांक के क्रम में रखा जाता है। अतः कम परमाणु क्रमांक वाला तत्व कोबाल्ट पहले तथा अधिक परमाणु क्रमांक वाला तत्व निकल बाद में आयेगा।
(b) (i) आधुनिक आवर्त सारणी के समूह 1 में उपस्थित तत्व
हाइड्रोजन (H),
लीथियम (Li),
सोडियम (Na),
पोटैशियम (K),
रूबीडियम (Rb),
सीजियम (Cs)
तथा फ्रांसियम (Fr) हैं।
(ii) प्रथम तीन तत्वों के इलेक्ट्रॉनिक विन्यास
हाइड्रोजन (H) =1
लीथियम (Li) = 2, 1
सोडियम (Na) = 2,8, 1
(iii) इन सबके बाहरी कोश में इलेक्ट्रॉनों की संख्या समान (प्रत्येक में 1) है। अतः इनके संयोजी इलेक्ट्रॉनों की संख्या भी समान है।
(iv) इन सभी तत्वों में एक संयोजकता इलेक्ट्रॉन है।

प्रश्न 9.
(i) आवर्त सारणी के दीर्घ रूप में Li,Be, B,C,N,O,F तथा Ne दूसरे आवर्त के तत्व हैं। इनका इलेक्ट्रॉनिक विन्यास लिखिए।
(ii) क्या इन सभी तत्वों के संयोजकता इलेक्ट्रॉनों की संख्या समान है?
(iii) क्या इनके कोशों की संख्या समान है?
उत्तर:
(i)
|
तत्व
|
परमाणु क्रमाक
|
इलेक्ट्रॉनिक विन्यास |
|
|
K |
L |
||
|
Li |
3 |
2 |
1 |
|
Be |
4 |
2 |
2 |
|
B |
5 |
2 |
3 |
|
C |
6 |
2 |
4 |
|
N |
7 |
2 |
5 |
|
O |
8 |
2 |
6 |
|
F |
9 |
2 |
7 |
|
Ne |
10 |
2 |
8 |
(ii) नहीं, इन तत्वों के संयोजकता इलेक्ट्रॉनों की संख्या भिन्न-भिन्न है।
(iii) हाँ, इन सभी तत्वों में कोशों की संख्या समान है।
प्रश्न 10.
(i) संयोजकता किसे कहते हैं?
(ii) किसी तत्व की संयोजकता कैसे ज्ञात की जाती है तथा समूह एवं आवर्त में संयोजकता में क्या परिवर्तन होता है?
उत्तर:
(i) संयोजकता किसी भी तत्व की संयोजकता उसके परमाणु के सबसे बाहरी कोश में उपस्थित संयोजकता इलेक्ट्रॉनों की संख्या से निर्धारित की जाती है।
(ii) संयोजकता का निर्धारण: तत्वों की संयोजकता का निर्धारण निम्न प्रकार से किया जाता है
- यदि तत्वों के परमाणुओं के बाह्यतम कोशों में इलेक्ट्रॉनों की संख्या 1, 2, 3 या 4 है, तो उनकी संयोजकताएँ क्रमशः 1, 2, 3 तथा 4 होंगी।
- यदि तत्वों के परमाणुओं के बाह्यतम कोशों में इलेक्ट्रॉनों की संख्या 5, 6 या 7 है तो उन तत्वों की संयोजकताएँ क्रमशः 3, 2, 1 होंगी।
- यदि तत्वों के परमाणुओं के बाह्यतम कोशों में इलेक्ट्रॉनों की संख्या 8 है तो उन तत्वों की संयोजकता शून्य (0) होगी। समूह में सभी तत्वों की संयोजकताएँ समान होती हैं परन्तु आवर्त में बाएँ से दाएँ जाने पर संयोजकता पहले 1 से 4 तक बढ़ती है, फिर 1 तक घटकर उत्कृष्ट गैस की स्थिति में शून्य हो जाती है।
|
तत्व |
Li |
Be |
B |
C |
N |
O |
F |
Ne |
|
संयोजकता |
1 |
2 |
3 |
4 |
3 |
2 |
1 |
0 |
प्रश्न 11.
आधुनिक आवर्त सारणी में एक टेढ़ी-मेढ़ी रेखा क्यों खींची गई है?
उत्तर:
आधुनिक आवर्त सारणी में एक टेढ़ी-मेढ़ी रेखा धातुओं को अधातुओं से अलग करती हैं। इस रेखा पर आने वाले तत्व-बोरोन, सिलिकन, जर्मेनियम, आर्सेनिक, ऐंटिमनी, रेल्यूरियम एवं पोलोनियम धातुओं एवं अधातुओं दोनों के गणुंधर्म प्रदर्शित करते हैं।
प्रश्न 12.
(i) प्रथम समूह के तत्वों की परमाणु त्रिज्या में परिवर्तन का अध्ययन कीजिए तथा उन्हें आरोही क्रम में व्यवस्थित कीजिए।
|
प्रथम समूह के तत्व |
Na |
Li |
Rb |
Cs |
K |
|
परमाणु त्रिज्या (pm) |
186 |
152 |
244 |
262 |
231 |
(ii) किस तत्व का परमाणु सबसे छोटा तथा किसका सबसे बड़ा है?
(iii) समूह में ऊपर से नीचे जाने पर परमाणु साइज में कैसा परिवर्तन होगा?
उत्तर:
(i) प्रथम समूह के तत्वों की परमाणु त्रिज्या का आरोही क्रम निम्न प्रकार होगा-
Li< Na <K <Rb <Cs
(ii) Li का परमाणु सबसे छोटा तथा Cs का परमाणु सबसे बड़ा है।
(iii) समूह में ऊपर से नीचे जाने पर परमाणु साइज में वृद्धि हो रही है क्योंकि नीचे जाने पर एक नया कोश जुड़ जाता है, इससे नाभिक तथा सबसे बाहरी कोश के बीच की दूरी बढ़ जाती है। इस कारण नाभिक का आवेश बढ़ जाने के बाद भी परमाणु का आकार बढ़ जाता है।
प्रश्न 13.
(i) दूसरे आवर्त के तत्वों की परमाणु त्रिज्याएँ नीचे दी गई हैं
|
दूसरे आवर्त के तत्व |
B |
Be |
O |
N |
Li |
C |
|
परमाणु त्रिज्या (pm) |
88 |
111 |
66 |
74 |
152 |
77 |
इन्हें परमाणु त्रिज्या के अवरोही क्रम में व्यवस्थित कीजिए।
(ii) क्या ये तत्व अब आवर्त सारणी के आवर्त की तरह ही व्यवस्थित हैं?
(iii) किस तत्व का परमाणु सबसे बड़ा है एवं किसका सबसे छोटा है?
(iv) आवर्त में बाईं से दाईं ओर जाने पर परमाणु त्रिज्या किस प्रकार बदलती है?
उत्त:
(i) दूसरे आवर्त के तत्वों की परमाणु त्रिज्या का अवरोही (घटता) क्रम निम्न है-
Li> Be>B>C> N>O
(ii) हाँ, अब ये तत्व आवर्त सारणी के आवर्त की तरह ही व्यवस्थित हैं।
(iii) Li का परमाणु सबसे बड़ा तथा O (ऑक्सीजन) का परमाणु सबसे छोटा है।
(iv) आवर्त में बाईं से दाईं ओर जाने पर परमाणु त्रिज्या कम होती है।

प्रश्न 14.
(क) आवर्त सारणी के आधार पर तत्वों के गुणों में आवर्तिता का क्या अर्थ है?
(ख) एक परमाणु का इलेक्ट्रॉनिक विन्यास 2,8, 8, 2 है।
(i) इस तत्व की परमाणु संख्या क्या है?
(ii) निम्न में किस तत्व के साथ इसकी रासायनिक समानता होगी? (परमाणु संख्या कोष्ठक में दी गई है) Na (11),O (8), Mg (12), Ne (10), F (9)
उत्तर:
(क) जब तत्वों को उनके परमाणु संख्या के वृद्धि क्रम में रखा जाता है तो भौतिक एवं रासायनिक गुणों में एक प्रकार की आवर्तिता पाई जाती है अर्थात् एक तत्व से दूसरे तत्व के गुणों में एक क्रमबद्ध परिवर्तन होता है तथा निश्चित अवधि के पश्चात् उनके भौतिक एवं रासायनिक गुणों की पुनरावृत्ति होती है। पुनरावृत्ति को व्यक्त करने की घटना को आवर्तिता कहते हैं।
(ख)
(i) तत्व की परमाणु संख्या = इलेक्ट्रॉनों की संख्या = 2 + 8 +8 + 2 = 20
(ii) इस तत्व की रासायनिक समानता Mg (12) से होगी क्योंकि Mg का इलेक्ट्रॉनिक विन्यास 2, 8, 2 है।
प्रश्न 15.
(अ) इलेक्ट्रॉनिक विन्यास 2, 8,7 वाला एक तत्व x है। बताइए(क) इस तत्व की परमाणु संख्या क्या है?
(ख) इसकी आवर्त संख्या क्या है?
(ग) यह तत्व आवर्त सारणी के किस समूह का तत्व है?
(ब) तत्व में कितने संयोजक इलेक्ट्रॉन हैं?
उत्तर:
(अ) (क) तत्व की परमाणु संख्या 17 है।
(ख) तत्व की आवर्त संख्या भी 17 है।
(ग) यह तत्व आवर्त सारणी के समूह VII-A का तत्व है।
(ब) तत्व में सात संयोजक इलेक्ट्रॉन हैं।
प्रश्न 16.
दो तत्व x तथा Y जिनके परमाणु क्रमांक क्रमशः 11 व 17 हैं
(क) ये तत्व आवर्त सारणी के किस वर्ग में हैं?
(ख) इन तत्वों में से कौनसी धातु तथा कौनसी अधातु है?
(ग) ये तत्व आवर्त सारणी में किस आवर्त में हैं?
उत्तर:
(क) X तत्व IA वर्ग में एवं Y तत्व VIIA वर्ग में आता है।
(ख) तत्व X धातु तथा तत्व Y अधातु है।
(ग) दोनों तत्व आवर्त सारणी के तीसरे आवर्त में हैं।

प्रश्न 17.
(क) उन तत्वों के नाम बताइए जो आवर्त सारणी के तीसरे आवर्त में हैं और उनका धातु व अधातु में वर्गीकरण कीजिए।
(ख) आवर्त सारणी के किस ओर आप धातुओं को पाते हैं?
उत्तर:
(क) आवर्त सारणी के तीसरे आवर्त में Na, Mg, AI, Si, P, S तथा CI तत्व आते हैं। इन तत्वों में से Na, Mg तथा Al धातु तत्व हैं तथा P, S तथा Cl अधातु तत्व हैं जबकि Si अर्द्धधातु/उपधातु तत्व है।
(ख) आवर्त सारणी में बाईं ओर (प्रथम, द्वितीय तथा तृतीय समूह) के तत्व धातु तत्व हैं।
प्रश्न 18.
एक तत्व Y आवर्त सारणी के दूसरे आवर्त और वर्ग 16 में है
(a) क्या वह धातु है या अधातु?
(b) उसकी संयोजकता क्या है?
उत्तर:
(a) तत्व Y अधातु है।
(b) Y तत्व ऑक्सीजन है, जिसकी परमाणु संख्या 8 है, अतः इसकी संयोजकता 2 (1s', 25, 2p") है।
प्रश्न 19.
निम्नलिखित गुण एक आवर्त तथा वर्ग में किस प्रकार परिवर्तित होते हैं
(a) परमाणु आकार
(b) विद्युत ऋणात्मकता।
उत्तर:
(a) परमाणु आकार-एक आवर्त में बायें से दायीं ओर जाने पर परमाणु आकार (परमाणु त्रिज्या) घटता है (शून्य वर्ग को छोड़कर) जबकि वर्ग में ऊपर से नीचे जाने पर परमाणु का आकार बढ़ता है क्योंकि नीचे जाने पर एक नया कोश जुड़ जाता है। इससे नाभिक तथा बाहरी कोश के बीच की दूरी बढ़ जाती है। अतः नाभिक का आवेश बढ़ जाने के बाद भी परमाणु का आकार बढ़ जाता है।
(b) विद्युत ऋणात्मकता-आवर्त में बायें से दायीं ओर जाने पर विद्युत ऋणात्मकता बढ़ती है (शून्य वर्ग को छोड़कर) तथा वर्ग (समूह) में नीचे की ओर जाने पर इसका मान घटता है।
प्रश्न 20.
(अ) समस्थानिक किसे कहते हैं?
(ब) किन्हीं दो उत्कृष्ट गैसों के नाम लिखिए।
(स) एक तत्व का इलेक्ट्रॉनिक विन्यास 2, 8,2 है। इसकी वर्ग संख्या तथा संयोजकता क्या होगी?
उत्तर:
(अ) एक ही तत्व के भिन्न-भिन्न परमाणु जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न-भिन्न होती है, समस्थानिक कहलाते हैं। जैसे Cl35 तथा Cl37
(ब) (i) हीलियम (He)
(ii) नीऑन (Ne)
(स) इलेक्ट्रॉनिक विन्यास 2, 8, 2 वाला तत्व मैग्नीशियम (Mg) है। इसकी वर्ग संख्या 2 तथा संयोजकता भी 2 है।

निबन्धात्मक प्रश्न
प्रश्न 1.
मेन्डेलीफ की आवर्त सारणी की उपलब्धियाँ क्या थीं तथा मेन्डेलीफ के वर्गीकरण की सीमाएँ भी बताइए।
उत्तर:
मेन्डेलीफ का आवर्त नियम-इस नियम के अनुसार, “तत्वों के भौतिक तथा रासायनिक गुण उनके परमाणु द्रव्यमान के आवर्ती फलन होते हैं।"
मेण्डेलीफ आवर्त सारणी की उपलब्धियाँ:
(i) मेन्डेलीफ ने आवर्त सारणी में कुछ स्थानों को रिक्त छोड़ दिया तथा मेन्डेलीफ ने दृढ़ विश्वास से कुछ ऐसे तत्वों के अस्तित्व का अनुमान किया जो उस समय ज्ञात नहीं थे। इनका नामकरण उन्होंने उसी समूह में इससे पहले आने वाले तत्व के नाम में एका उपसर्ग लगाकर किया। जैसे बाद में ज्ञात होने वाले स्कैंडियम, गैलियम, जर्मेनियम के गुणधर्म क्रमशः एका-बोरॉन, एका-ऐलुमिनियम तथा एका-सिलिकॉन के समान थे। मेन्डेलीफ द्वारा अनुमानित एकाऐलुमिनियम तथा बाद में ज्ञात गैलियम के गुणधर्म को सारणी में दिया गया है
सारणी: एका-ऐलुमिनियम तथा गैलियम के गुणधर्म
|
गुणधर्म |
एका-ऐलुमिनियम |
गैलियम |
|
परमाणु द्रव्यमान |
68 |
69.7 |
|
ऑक्साइड का सूत्र |
E2O2 |
Ga2O3 |
|
क्लोराइड का सूत्र |
ECl3 |
GaCl3 |
इससे मेन्डेलीफ की आवर्त सारणी की परिशुद्धता तथा उपयोगिता सिद्ध होती है।
(ii) उत्कृष्ट गैसों; जैसे-हीलियम (He), निऑन (Ne) एवं आर्गन (Ar) का पता देर से चला क्योंकि ये अक्रिय हैं तथा वायुमण्डल में इनकी मात्रा बहुत कम है। जब इन गैसों का पता चला तब पिछली व्यवस्था को छेड़े बिना ही इन्हें नए समूह वर्ग में रखा जा सका। .
(iii) इस प्रकार मेण्डेलीफ की आवर्त सारणी में तत्व अपने बढ़ते. परमाणु द्रव्यमान के क्रम में व्यवस्थित हैं तथा एक ही समूह के सभी तत्वों के गुणधर्म समान होते हैं। मेन्डेलीफ के वर्गीकरण की सीमाएँ:
मेन्डेलीफ की आवर्त सारणी में अनेक दोष पाए गए। मुख्य दोष निम्न प्रकार से हैं -
(i) हाइड्रोजन का स्थान-मेन्डेलीफ की आवर्त सारणी में हाइड्रोजन का स्थान अनिश्चित है। हाइड्रोजन प्रथम समूह के क्षारीय धातु तथा सप्तम समूह के हैलोजन तत्वों से गुणों में समानता रखता है | अतः यह निश्चित नहीं हो पाया कि हाइड्रोजन को प्रथम समूह में रखा जाए या सप्तम समूह में।
(ii) समस्थानिकों का स्थान-आवर्त सारणी में समस्थानिकों को कोई स्थान नहीं दिया गया है।
(iii) कुछ समान गुणों वाले तत्वों को पृथक् स्थान-मेन्डेलीफ ने कुछ समान गुणों वाले तत्वों को एक ही समूह में रखने के बजाय अलग-अलग समूहों में रखा।
उदाहरणस्वरूप: कॉपर तथा मर्करी, सिल्वर तथा थैलियम, बेरियम तथा लैड।
(iv) कुछ असमान गुणों वाले तत्वों को एक ही समूह में स्थान-आवर्त सारणी में कुछ असमान गुणों वाले तत्वों को एक ही समूह में स्थान दिया गया है, जैसे IA तथा IB के तत्वों को एक ही समूह में रखा।
(v) आठवें समूह में एक साथ तीन तत्वों को रखना-सारणी में आठवें समूह में एक साथ तीन तत्वों को रखा गया है, जैसे-Fe, Co Ni, Ru, Rh, Pd, Os, Ir व Pt.
(vi) कुछ अधिक परमाणु भार वाले तत्वों को पहले रखना-सारणी में कुछ अधिक परमाणु भार वाले तत्वों को कम परमाणुओं वाले तत्वों से पहले स्थान दिया गया है, जैसे-कोबाल्ट (58.9) को निकल (58.7) से पहले।
प्रश्न 2.
निम्न को स्पष्ट कीजिए
(a) समूह में ऊपर से नीचे जाने पर नाभिक का आवेश बढ़ जाने पर भी परमाणु का साइज क्यों बढ़ जाता है?
(b) धात्विक अभिलक्षण आवर्त में घटता है तथा समूह में नीचे जाने पर बढ़ता है।
उत्तर:
(a) समूह में ऊपर से नीचे जाने पर परमाणु का साइज बढ़ता है। ऐसा इसलिए होता है क्योंकि नीचे जाने पर एक नया कोश जुड़ जाता है। इससे नाभिक तथा सबसे बाहरी कोश के बीच की दूरी बढ़ जाती है और इस कारण नाभिक का आवेश बढ़ जाने के बाद भी परमाणु का साइज बढ़ जाता है।
(b) आवर्त में जैसे-जैसे संयोजकता कोश के इलेक्ट्रॉनों पर लगने वाला प्रभावी नाभिकीय आवेश बढ़ता है, इलेक्ट्रॉन त्यागने की प्रवृत्ति घट जाती है। समूह में नीचे की ओर, संयोजकता इलेक्ट्रॉन पर क्रिया करने वाला प्रभावी नाभिकीय आवेश घटता है क्योंकि सबसे बाहरी इलेक्ट्रॉन नाभिक से दूर होते हैं। इसलिए यह इलेक्ट्रॉन सुगमतापूर्वक निकल जाते हैं। इसलिए धात्विक अभिलक्षण आवर्त में घटता है तथा समूह में नीचे जाने पर बढ़ता है।
प्रश्न 3.
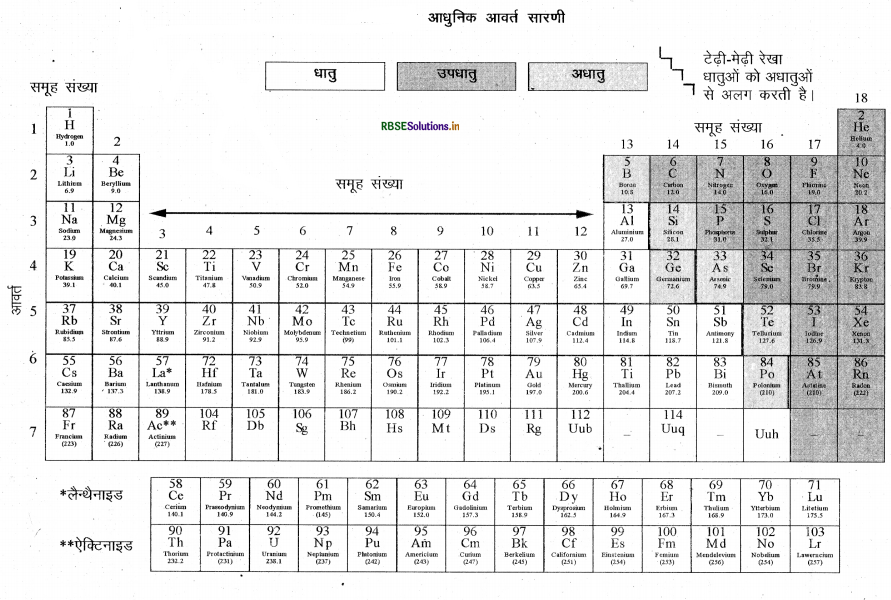
आधुनिक आवर्त सारणी (आवर्त सारणी का दीर्घ रूप) में तत्वों की स्थिति की विस्तृत व्याख्या कीजिए।
उत्तर:
आधुनिक आवर्त सारणी हेनरी मोज्ले ने प्रस्तुत की थी। इसके अनुसार “तत्वों के गुण उनकी परमाणु · संख्या के आवर्ती फलन होते हैं।” आधुनिक आवर्त सारणी में 18 वर्ग (ऊर्ध्व स्तम्भ) या समूह हैं तथा 7 आवर्त (क्षतिजपंक्तियाँ) हैं। आवर्त सारणी के किसी वर्ग में सभी तत्वों के संयोजकता इलेक्ट्रॉनों की संख्या समान होती है। जैसे वर्ग 1 में संयोजकता इलेक्ट्रॉन एक है जबकि वर्ग 17 (F, CI) में संयोजकता इलेक्ट्रॉनों की संख्या 7 है। अतः आधुनिक आवर्त सारणी में वर्ग (समूह) बाहरी कोश के समान इलेक्ट्रॉनिक विन्यास को दर्शाता है।
किसी आवर्त में स्थित तत्वों के संयोजकता इलेक्ट्रॉनों की संख्या तो भिन्न-भिन्न होती है लेकिन इनमें कोशों की संख्या समान होती है। आवर्त में बाईं से दाईं ओर जाने पर परमाणु-संख्या में इकाई की वृद्धि होती है तो संयोजकता इलेक्ट्रॉनों की संख्या में भी इकाई वृद्धि होती है। अतः कोशों की समान संख्या वाले विभिन्न तत्वों के परमाणु एक ही आवर्त में स्थित होते हैं | Na, Mg, AI, Si, PS, Cl एवं Ar आधुनिक आवर्त सारणी के तीसरे आवर्त में स्थित हैं क्योंकि इनके परमाणुओं के इलेक्ट्रॉन K, L एवं M कोशों में स्थित हैं। प्रत्येक आवर्त यह दर्शाता है कि एक नया कोश इलेक्ट्रॉनों से भरा गया।
विभिन्न कक्षों में भरे जाने वाले इलेक्ट्रॉनों की संख्या के आधार पर इन आवर्तों में तत्वों की संख्या बता सकते हैं। किसी कोश में इलेक्ट्रॉनों की अधिकतम संख्या एक सूत्र 2n पर निर्भर करती है जहाँ n, नाभिक से नियत कोश की संख्या को दर्शाता है। जैसे,
K कोश – 2 (1)2 = 2, प्रथम आवर्त में दो तत्व हैं।
L कोश - 2 (2)2 = 8, दूसरे आवर्त में आठ तत्व हैं।
M कोश – 2 (3)2 = 18, लेकिन बाहरी कोश में आठ से अधिक इलेक्ट्रॉन नहीं हो सकते हैं इसलिए तीसरे आवर्त में भी आठ तत्व होंगे।
आवर्त सारणी में तत्वों की स्थिति से उसकी रासायनिक क्रियाशीलता ज्ञात होती है। तत्व द्वारा निर्मित आबंध के प्रारूप तथा इसकी संख्या संयोजकता इलेक्ट्रॉनों द्वारा निर्धारित होती है। आधुनिक आवर्त सारणी में समस्थानिकों को एक ही स्थान पर रखा गया क्योंकि उनके परमाणु क्रमांक समान होते हैं।

प्रश्न 4.
तत्वों के धात्विक तथा अधात्विक गुणों की विस्तृत विवेचना कीजिए तथा आवर्त व वर्ग में इन गुणों में परिवर्तन की भी व्याख्या कीजिए।
उत्तर:
तत्वों के धात्विक एवं अधात्विक गुण-आधुनिक आवर्त सारणी में एक टेढ़ी-मेढ़ी रेखा धातुओं को अधातुओं से पृथक् करती है। इस रेखा पर आने वाले तत्व-बोरोन, सिलिकन, जर्मेनियम, आर्सेनिक, ऐंटिमनी, टेल्यूरियम एवं पोलोनियम में धातुओं एवं अधातुओं दोनों के गुणधर्म होते हैं। इसलिए इन्हें अर्द्धधातु या उपधातु भी कहते हैं।
तीसरे आवर्त में Na, Mg तथा Al जैसी धातुएँ आवर्त सारणी में बाईं तरफ तथा फॉस्फोरस (P), सल्फर (S), क्लोरीन (Cl) तथा Ar जैसी अधातुएँ आवर्त सारणी के दाईं ओर स्थित हैं। बीच में सिलिकन (Si) है जो उपधातु है। बन्ध बनाते समय धातुओं में इलेक्ट्रॉन त्यागने की प्रवृत्ति होती है अर्थात् धातुएँ विद्युत धनात्मक होती हैं। आवर्त में जैसे-जैसे संयोजकता कोश के इलेक्ट्रॉनों पर लगने वाला प्रभावी नाभिकीय आवेश बढ़ता है, इलेक्ट्रॉन त्यागने की प्रवृत्ति कम होती है। समूह में नीचे की ओर, संयोजकता इलेक्ट्रॉनों पर लगने वाला प्रभावी नाभिकीय आवेश कम होता है क्योंकि सबसे बाहरी इलेक्ट्रॉन नाभिक से दूर होते जाते हैं।
इसलिए यह इलेक्ट्रॉन आसानी से निकल जाते हैं अतः आवर्त में धात्विक गुण कम होता है तथा समूह में नीचे जाने पर धात्विक गुण बढ़ते हैं। अधातुएँ विद्युत ऋणात्मक होती हैं अर्थात् इनमें इलेक्ट्रॉन ग्रहण करके बन्धं बनाने की प्रवृत्ति होती है। आवर्त में अधातु गुण बढ़ता है तथा वर्ग में अधातु गुण कम होता है। अतः अधातुएँ आवर्त सारणी में दाहिनी तरफ, ऊपर की ओर स्थित होती हैं। इससे हमें तत्वों के ऑक्साइडों की अम्लीय या क्षारीय प्रवृत्ति भी ज्ञात होती है। धातुओं के ऑक्साइड सामान्यतः क्षारीय तथा अधातुओं के ऑक्साइड अम्लीय होते हैं। आवर्त सारणी में धातुओं की क्रियाशीलता वर्ग में बढ़ती है। जैसे प्रथम समूह (Li, Na, K, Rb, Cs) तथा अधातुओं की क्रियाशीलता वर्ग में कम होती है जैसे हेलोजेन समूह (F, CI, Br, I)।

- RBSE Solutions for Class 10 Science Chapter 12 विद्युत
- RBSE Class 10 Science Notes in Hindi & English Medium Pdf Download
- RBSE Class 10 Science Important Questions in Hindi & English Medium
- RBSE Solutions for Class 10 Science in Hindi Medium & English Medium
- RBSE Class 10 Science Important Questions Chapter 16 प्राकृतिक संसाधनों का संपोषित प्रबंधन
- RBSE Class 10 Science Important Questions Chapter 13 विद्युत धारा का चुम्बकीय प्रभाव
- RBSE Class 10 Science Important Questions Chapter 10 प्रकाश - परावर्तन तथा अपवर्तन
- RBSE Class 10 Science Important Questions Chapter 11 मानव नेत्र एवं रंगबिरंगा संसार
- RBSE Class 10 Science Important Questions Chapter 12 विद्युत
- RBSE Class 10 Science Important Questions Chapter 14 उर्जा के स्रोत
- RBSE Class 10 Science Important Questions Chapter 15 हमारा पर्यावरण