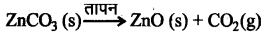RBSE Class 10 Science Important Questions Chapter 3 धातु एवं अधातु
Rajasthan Board RBSE Class 10 Science Important Questions Chapter 3 धातु एवं अधातु Important Questions and Answers.
Rajasthan Board RBSE Solutions for Class 10 Science in Hindi Medium & English Medium are part of RBSE Solutions for Class 10. Students can also read RBSE Class 10 Science Important Questions for exam preparation. Students can also go through RBSE Class 10 Science Notes to understand and remember the concepts easily. Browsing through class 10 science chapter 12 question answer in hindi that includes all questions presented in the textbook.
RBSE Class 10 Science Chapter 3 Important Questions धातु एवं अधातु
वस्तुनिष्ठ प्रश्न
प्रश्न 1.
पीतल एक मिश्र धातु है -
(अ) ताँबा + टिन
(ब) जिंक + टिन
(स) ताँबा + जिंक
(द) ताँबा + ऐलुमिनियम
उत्तर:
(स) ताँबा + जिंक

प्रश्न 2.
सल्फाइड अयस्क से धातुओं के निष्कर्षण के लिए किस विधि का उपयोग किया जाता है -
(अ) भर्जन
(ब) निस्तापन
(स) संक्षारण
(द) थर्मिट प्रक्रम
उत्तर:
(अ) भर्जन
प्रश्न 3.
अधातु जो कमरे के तार पर द्रव होती है -
(अ) मर्करी
(ब) सल्फर
(स) ब्रोमीन
(द) कार्बन
उत्तर:
(स) ब्रोमीन
प्रश्न 4.
वह अधातु जो चमकीली होती है -
(अ) सीजियम
(ब) सल्फर
(स) आयोडीन
(द) फॉस्फोरस
उत्तर:
(स) आयोडीन
प्रश्न 5.
विद्युत का सुचालक अधातु निम्न में से कौन है?
(अ) आयोडीन
(ब) ग्रेफाइट (कार्बन)
(स) हीरा (कार्बन)
(द) सल्फर
उत्तर:
(ब) ग्रेफाइट (कार्बन)

प्रश्न 6.
आयनिक यौगिक निम्न में से किसमें घुलनशील होते हैं?
(अ) बेन्जीन
(ब) पेट्रोल
(स) जल
(द) किरोसिन
उत्तर:
(स) जल
प्रश्न 7.
विद्युत तारों की वेल्डिंग के लिए प्रयुक्त मिश्र धातु है -
(अ) काँसा
(ब) पीतल (ब्रास)
(स) सोल्डर
(द) घटा धातु
उत्तर:
(स) सोल्डर

अतिलघूत्तरात्मक प्रश्न
प्रश्न 1.
धातुओं के कुछ भौतिक गुण लिखिए।
उत्तर:
धातुएँ भारी, चमकदार, तन्य तथा आघातवर्ध्य होती हैं। ये ऊष्मा और विद्युत की सुचालक होती हैं।
प्रश्न 2.
ऐलुमिनियम के किसी एक अयस्क का नाम तथा सूत्र बताइए ।
उत्तर:
ऐलुमिनियम का अयस्क - बॉक्साइट
सूत्र-AI2O3.2H2O
प्रश्न 3.
तीन धातुएँ बताइए जिनसे सिक्के बनाए जाते हैं।
उत्तर:
(i) कॉपर (Cu)
(ii) चाँदी (Ag)
(iii) सोना (Au)
प्रश्न 4.
'धात्विक चमक' किसे कहते हैं?
उत्तर:
अपने शुद्ध रूप में धातु की सतह चमकदार होती है। धातु के इस गुण धर्म को 'धात्विक चमक' कहते हैं।
प्रश्न 5.
भर्जन किसे कहते हैं?
उत्तर:
सल्फाइड अयस्क को वायु की उपस्थिति में अधिक ताप पर गर्म करने पर यह ऑक्साइड में परिवर्तित हो जाता है। यह प्रक्रिया भर्जन कहलाती है।

प्रश्न 6.
'ध्वानिक (सोनोरस) धातुएँ क्या होती हैं?
उत्तर:
जो धातुएँ कठोर सतह से टकराने पर आवाज उत्पन्न करती है उन्हें 'ध्वानिक (सोनोरस) कहते हैं।
प्रश्न 7.
विद्युत तार पर PVC अथवा रबड़ जैसी सामग्री की परत क्यों होती है?
उत्तर:
विद्युत तार विद्युत सुचालक धातु से बने होते हैं। जबकि PVC अथवा रबड़ जैसी सामग्री विद्युत की कुचालक होती है जिसके कारण विद्युत तार को छूने पर लगने वाले विद्युत आघात से बचा जा सकता है।
प्रश्न 8.
स्कूल की घंटी धातु की क्यों बनी होती है?
उत्तर:
धातुएँ कठोर सतह से टकराकर आवाज उत्पन्न करती हैं इसलिए स्कूल की घंटी धातु से बनाई जाती है ताकि आवाज दूर तक सुनाई दे सके।
प्रश्म 9.
दो धातुओं के नाम बताइए जो अत्यंत अधिक ताप पर भी ऑक्सीजन के साथ अभिक्रिया नहीं करती हैं?
उत्तर:
'सिल्वर' एवं 'गोल्ड' अत्यंत अधिक ताप पर भी ऑक्सीजन के साथ अभिक्रिया नहीं करते हैं।
प्रश्न 10.
लोहे पर जंग क्यों लगता है?
उत्तर:
लम्बे समय तक आर्द्र वायु में रहने पर लोहे पर भूरे रंग की परत चढ़ जाती है, जिसे जंग कहते हैं | जंग आयरन ऑक्साइड (Fe2O3) तथा आयरन हाइड्रॉक्साइड का मिश्रण होता है।
प्रश्न 11.
अति शुद्ध सोना कितने कैरेट का होता है?
उत्तर:
24 कैरेट का।
प्रश्न 12.
उन धातुओं का नाम बताइए जो न तो शीतल जल के साथ और न ही गर्म जल के साथ अभिक्रिया करती हैं, परन्तु भाप के साथ अभिक्रिया कर ऑक्साइड व हाइड्रोजन प्रदान करती हैं?
उत्तर:
ऐलुमिनियम, आयरन तथा जिंक।

प्रश्न 13.
सोल्डर नामक मिश्रधातु के कौन - कौनसे अवयव हैं?
उत्तर:
सोल्डर मिश्रधातु के दो अवयव हैं - सीसा तथा टिन ।
प्रश्न 14.
कई धातुओं के अयस्क ऑक्साइड क्यों होते हैं?
उत्तर:
ऑक्सीजन की अत्यधिक अभिक्रियाशीलता एवं पृथ्वी पर इसके प्रचुर मात्रा में पाए जाने के कारण कई धातुओं के अयस्क ऑक्साइड होते हैं।
प्रश्न 15.
निम्न अयस्कों के सूत्र लिखिए
(i) हेमेटाइट
(ii) कॉपर पाइराइट।
उत्तर:
(i) हेमेटाइट (Fe2O3)
(ii) कॉपर पाइराइट (CuFeS2)
प्रश्न 16.
अत्यधिक सक्रिय धातुओं का निष्कर्षण किस विधि द्वारा किया जाता है?
उत्तर:
अत्यधिक सक्रिय धातुओं का निष्कर्षण उनके लवणों के विद्युत अपघटन द्वारा किया जाता है।
प्रश्न 17.
ताँबे के शुद्धिकरण में प्रयुक्त विद्युत अपघट्य बताइए।
उत्तर:
कॉपर सल्फेट (CuSO4) का विलयन ।
प्रश्न 18.
सबसे अधिक आघातवर्धनीय धातुएँ कौनसी होती हैं?
उत्तर:
सोना तथा चाँदी सबसे अधिक आघातवंर्धनीय धातुएँ हैं।
प्रश्न 19.
ऐसी कौनसी धातुएँ हैं जिन्हें हथेली पर रखने पर पिघलने लगती हैं?
उत्तर:
गैलियम तथा सीजियम, क्योंकि इनका गलनांक बहुत कम होता है।
प्रश्न 20.
मर्करी (पारद) के एक अयस्क का नाम बताइए ।
उत्तर:
सिनाबार (Hgs)
प्रश्न 21.
अपररूप किसे कहते हैं?
उत्तर:
एक ही तत्व के भिन्न - भिन्न रूप जिनके गुणों में भिन्नता होती है, उन्हें अपररूप कहते हैं। हीरा तथा ग्रेफाइट कार्बन के अपररूप हैं।

प्रश्न 22.
सबसे कठोर प्राकृतिक पदार्थ कौनसा होता है?
उत्तर:
हीरा सबसे कठोर प्राकृतिक पदार्थ है।
प्रश्न 23.
धातुएँ तनु अम्लों से क्रिया करके क्या बनाती हैं?
उत्तर:
धातुएँ तनु अम्लों से क्रिया करके लवण तथा हाइड्रोजन बनाती हैं।
धातु + तनु अम्ल → लवण + H2
जैसे - Mg, Al, Zn, Fe
प्रश्न 24.
अम्लराज (ऐक्वारेजिया) का संघटन क्या है?
उत्तर:
अम्लराज सान्द्र HNO3 + सान्द्र HCl का 1 : 3 में मिश्रण है।
प्रश्न 25.
'निस्तापन' किसे कहते हैं?
उत्तर:
कार्बोनेट अयस्क को सीमित वायु में अधिक ताप पर गर्म करने से यह ऑक्साइड में परिवर्तित हो जाता है। इस प्रक्रिया को निस्तापन कहते हैं।
प्रश्न 26.
आयनिक यौगिक ठोस अवस्था में विद्युत का चालन नहीं करते। क्यों?
उत्तर:
ठोस अवस्था में दृढ़ संरचना के कारण आयनों की गति सम्भव नहीं होती अतः विद्युत का चालन नहीं होता।
प्रश्न 27.
अभिक्रियाशीलता के आधार पर धातुओं को कौनसे भागों (वर्गों) में विभाजित किया जाता है?
उत्तर:
तीन भागों में:
- निम्न अभिक्रियाशील धातुएँ
- मध्यम अभिक्रियाशील धातुएँ
- उच्च अभिक्रियाशील धातुएँ।
प्रश्न 28.
जंग (Rust) क्या होती है?
उत्तर:
लम्बे समय तक आर्द्र वायु में रहने पर लोहे पर भूरे रंग की परत जम जाती है, इसे जंग कहते हैं।
प्रश्न 29.
यशदलेपन (Galvanisation) या गैल्वेनीकरण किसे कहते हैं?
उत्तर:
लोहे एवं इस्पात को जंग से सुरक्षित रखने के लिए उन पर जस्ते (जिंक) की एक पतली परत चढ़ाई जाती है। इस प्रक्रिया को यशदलेपन कहते हैं।
प्रश्न 30.
थर्मिट अभिक्रिया का संतुलित रासायनिक समीकरण लिखिए।
उत्तर:
Fe2O3(s) + 2 Al (s) → 2 Fe(l) + Al2O3 (s) + ऊष्मा

प्रश्न 31.
अमलगम किसे कहते हैं?
उत्तर:
मिश्र धातु बनाते समय यदि एक धातु पारद (मर्करी) है, तो इसके मिश्र धातु को अमलगम कहते हैं |
प्रश्न 32.
उत्कृष्ट गैसों की क्रियाशीलता बहुत कम होती है। क्यों?
उत्तर:
उत्कृष्ट गैसों का संयोजकता कोश पूर्ण होने के कारण इनकी क्रियाशीलता बहुत कम होती है।
प्रश्न 33.
सक्रियता श्रेणी किसे कहते हैं? इसकी एक उपयोगिता लिखिए।
उत्तर:
सक्रियता श्रेणी - धातुओं की क्रियाशीलता को अवरोही क्रम में व्यवस्थित करने पर जो सूची (श्रेणी) प्राप्त होती है, उसे सक्रियता श्रेणी कहते हैं। उपयोगिता - इसके द्वारा किसी अयस्क से धातु के निष्कर्षण में सहयोग मिलता है।
प्रश्न 34.
कौनसी धातुओं को विद्युत अपघटनी परिष्करण विधि द्वारा शुद्ध रूप में प्राप्त किया जा सकता है?
उत्तर:
कॉपर, जिंक, टिन, निकल, सिल्वर, गोल्ड आदि ।
प्रश्न 35.
'ऐनोड पंक' किसे कहते हैं?
उत्तर:
जब धातुओं को विद्युत अपघटनी परिष्करण विधि द्वारा शुद्ध रूप में प्राप्त करते हैं तो अविलेय अशुद्धियाँ - ऐनोड तली पर निक्षेपित हो जाती हैं जिसे ऐनोड पंक कहते हैं।
प्रश्न 36.
'काँसा' नामक मिश्रातु के कौन - कौन से अवयव है? इस मिश्रातु की एक विशेषता बताइए।
उत्तर:
काँसा ताम्र (Cu) एवं टिन (Sn) की मिश्रातु है। काँसा विद्युत का कुचालक है।

प्रश्न 37.
धातुओं का उपयोग खाना पकाने के बर्तन बनाने के लिए क्यों किया जाता है?
उत्तर:
धातु ऊष्मा के सुचालक होते हैं तथा इनका गलनांक भी बहुत अधिक होता है इसलिए इनका उपयोग बर्तन बनाने के लिए किया जाता है।
लघूत्तरात्मक प्रश्न
प्रश्न 1.
धातुओं के सामान्य गुणधर्म बताइए।
उत्तर:
धातुओं के सामान्य गुणधर्म:
- शुद्ध अवस्था में धातु की सतह चमकदार होती है, इसे धात्विक चमक कहते हैं।
- धातुएँ सामान्यतः ठोस व कठोर होती हैं तथा भिन्न - भिन्न धातुओं की कठोरता अलग - अलग होती है।
- धातुएँ आघातवर्धनीय एवं तन्य होती हैं।
- धातुएँ ऊष्मा की सुचालक होती हैं तथा इनका गलनांक भी उच्च होता है अतः इनको खाना पकाने के बर्तन बनाने में प्रयुक्त करते हैं।
- धातुएँ सामान्यतः विद्युत की सुचालक होती हैं। अतः बिजली के तारों पर पॉलिवाइनिल क्लोराइड (PVC) या रबड़ की परत चढ़ाते हैं। यह परत विद्युत की कुचालक होती है।
- धातुएँ ध्वानिक (सोनोरस) होती हैं अर्थात् कठोर सतह से टकराने पर आवाज उत्पन्न करती हैं।
प्रश्न 2.
अधातुओं के सामान्य गुण क्या हैं? लिखिए।
उत्तर:
अधातुओं के सामान्य गुण:
- सामान्यतः अधातुएँ कमरे के ताप पर ठोस, द्रव (ब्रोमीन) या गैस हो सकती हैं।
- अधातुओं में चमक नहीं होती लेकिन आयोडीन अधातु होते हुए भी चमकीला होता है।
- अधातुओं का गलनांक व क्वथनांक धातुओं से कम होता है।
- अधातुएँ आघातवर्धनीय एवं तन्य नहीं होतीं।
- अधातुएँ विद्युत की कुचालक होती हैं। अपवाद: ग्रेफाइट।
- अधातुएँ सोनोरस नहीं होतीं।
प्रश्न 3.
मैग्नीशियम तथा सल्फर को दहन करने पर क्या होगा? प्राप्त यौगिक का पानी में विलयन बनाकर लिटमस से जाँच करके बताइए कि कौनसा तत्व अम्लीय ऑक्साइड बनाता है तथा कौनसा क्षारीय। समीकरण सहित समझाइए।
उत्तर:
1. मैग्नीशियम को वायु में गर्म करने पर चमकदार श्वेत ज्वाला के साथ दहन होकर मैग्नीशियम ऑक्साइड बनता है जो कि क्षारीय होता है क्योंकि Mg धातु है तथा धातुओं के ऑक्साइड सामान्यतः क्षारीय होते हैं। इस ऑक्साइड को पानी में घोलने पर मैग्नीशियम हाइड्रॉक्साइड बनता है जो लाल लिटमस को नीला करता है।
2Mg(s) + O2(g) → 2MgO(s)
MgO + H2O → Mg(OH)2
2. सल्फर भी वायु से क्रिया करके सल्फर डाइऑक्साइड बनाता है जो कि अम्लीय है क्योंकि सल्फर अधातु है। इस ऑक्साइड को पानी में घोलने पर अम्लीय विलयन बनेगा जो नीले लिटमस को लाल कर देता है।
S(s) + O2(g) → SO2(g)

प्रश्न 4.
कॉपर (Cu) तथा ऐलुमिनियम (Al) को वायु की उपस्थिति में गर्म करने पर क्या होगा? प्राप्त ऑक्साइडों की प्रकृति कैसी है? अभिक्रिया सहित बताइए। क्या धातु ऑक्साइड जल में घुलनशील होते हैं?
उत्तर:
जब कॉपर को वायु की उपस्थिति में गर्म किया जाता है तो यह ऑक्सीजन के साथ क्रिया करके काले रंग का कॉपर (II) ऑक्साइड बनाता है।
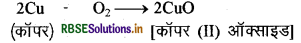
इसी प्रकार ऐलुमिनियम, ऐलुमिनियम ऑक्साइड बनाता है।
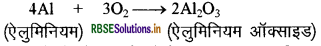
धातु ऑक्साइड सामान्यतः क्षारीय होते हैं लेकिन ऐलुमिनियम ऑक्साइड, जिंक ऑक्साइड जैसे कुछ धातु ऑक्साइड अम्लीय तथा क्षारकीय दोनों व्यवहार प्रदर्शित करते हैं। ऐसे धातु ऑक्साइड जो अम्ल तथा क्षारक दोनों से अभिक्रिया करके लवण तथा जल प्रदान करते हैं, उभयधर्मी ऑक्साइड कहलाते हैं। अम्ल तथा क्षारक के साथ ऐलुमिनियम ऑक्साइड निम्न प्रकार से अभिक्रिया करता है
Al2O3 + 6HCl → 2AlCl3 + 3H2O
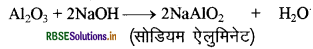
अधिकांश धातुएँ ऑक्साइड जल में अघुलनशील हैं लेकिन इनमें से कुछ ऑक्साइड जल में घुलकर क्षार प्रदान करते हैं। सोडियम ऑक्साइड एवं पोटैशियम ऑक्साइड निम्न प्रकार से जल में घुलकर क्षार प्रदान करते हैं
Na2O(s) + H2O(l) → 2NaOH(aq)
K2O(s) + H2O(l) → 2KOH(aq)
प्रश्न 5.
Mg, Al, Zn, Pb, K, Na, Fe, Cu, Ag आदि धातुओं की ऑक्सीजन से क्रिया द्वारा तुलना करके इनकी क्रियाशीलता की व्याख्या कीजिए।
उत्तर:
ऑक्सीजन के साथ सभी धातुएँ एक ही दर से अभिक्रिया नहीं करती हैं। विभिन्न धातुएँ ऑक्सीजन के साथ विभिन्न क्रियाशीलता दर्शाती हैं | पोटैशियम (K) तथा सोडियम (Na) ऑक्सीजन के साथ तेजी से क्रिया करती हैं कि खुले में रखने पर आग पकड़ लेती हैं। सामान्य ताप पर मैग्नीशियम (Mg), ऐलुमिनियम (AI), जिंक (Zn), लेड (Pb) आदि धातुओं की सतह पर ऑक्साइड की पतली परत चढ़ जाती है। ऑक्साइड की यह परत धातुओं को पुनः ऑक्सीकरण से सुरक्षा
प्रदान करती है। गर्म करने पर आयरन (Fe) का दहन तो नहीं होता है लेकिन जब बर्नर की ज्वाला में लौह चूर्ण डालते हैं तब वह तेजी से जलने लगता है।
कॉपर (Cu) का भी दहन नहीं होता है लेकिन गर्म धातु पर कॉपर (II) ऑक्साइड की काले रंग की परत जम जाती है। सिल्वर (Ag) एवं गोल्ड (Au) अधिक ताप पर भी ऑक्सीजन के साथ अभिक्रिया नहीं करते हैं | उपरोक्त सभी धातुओं की क्रियाशीलता का क्रम निम्न है
K> Na > Mg > Al> Zn > Fe > Pb > Cu> Ag
प्रश्न 6.
धातुओं की जल के साथ अभिक्रिया, धातु की क्रियाशीलता पर निर्भर करती है। विभिन्न धातुओं के उदाहरण से इसकी व्याख्या कीजिए।
उत्तर:
जल के साथ अभिक्रिया करके धातुएँ, धातु ऑक्साइड तथा H2 गैस बनाती हैं। कुछ धातु ऑक्साइड जल में विलेय होकर धातु हाइड्रॉक्साइड बनाते हैं। लेकिन सभी धातुएँ जल के साथ अभिक्रिया नहीं करती हैं | K तथा Na जैसी धातुएँ ठंडे जल के साथ तेजी से अभिक्रिया करती हैं तथा यह अभिक्रिया ऊष्माक्षेपी होती है जिससे उत्पन्न H2 गैस तत्काल प्रज्वलित हो जाती है।
2K(s) + 2H2O(l) → 2KOH(aq) + H2(g) + ऊष्मीय ऊर्जा
2 Na(s) + 2H2O(l) → 2NaOH(aq) + H2(g) + ऊष्मीय ऊर्जा ।
जल के साथ कैल्सियम की अभिक्रिया थोड़ी धीमी गति से होती है।
Ca(s) + 2H2O(l) → Ca(OH)2(aq) + H2(g)
मैग्नीशियम ठण्डे जल के साथ अभिक्रिया नहीं करता है परन्तु गर्म जल के साथ अभिक्रिया करके वह मैग्नीशियम हाइड्रॉक्साइड एवं हाइड्रोजन गैस देता है। ऐलुमिनियम, आयरन तथा जिंक जैसी धातुएँ न तो ठण्डे जल के साथ और न ही गर्म जल के साथ अभिक्रिया करती हैं। लेकिन भाप के साथ अभिक्रिया करके यह धातु ऑक्साइड तथा हाइड्रोजन बनाती हैं।
2Al(s) + 3H2O(g) → AlO3(s) + 3H2(g)
3Fe(s) + 4H2O(g) → Fe3O4(s) + 4H2(g)
लेड, कॉपर, सिल्वर तथा गोल्ड जैसी धातुएँ जल के साथ बिल्कुल अभिक्रिया नहीं करती हैं।
प्रश्न 7.
एनोडीकरण क्या होता है? इसके क्या उपयोग हैं?
उत्तर:
एनोडीकरण - ऐलुमिनियम पर मोटी ऑक्साइड की परत बनाने की प्रक्रिया को एनोडीकरण कहते हैं। वायु के सम्पर्क में आने पर ऐलुमिनियम पर ऑक्साइड की एक पतली परत का निर्माण होता है। ऐलुमिनियम ऑक्साइड की यह परत इसे संक्षारण से बचाती है। इस परत को मोटा करके इसे संक्षारण से अधिक सुरक्षित कर सकते हैं। ऐनोडीकरण के लिए ऐलुमिनियम की एक साफ वस्तु को ऐनोड बनाकर तनु सल्फ्यूरिक अम्ल (H2SO4) के साथ इसका विद्युत अपघटन किया जाता है। ऐनोड पर उत्सर्जित ऑक्सीजन गैस ऐलुमिनियम के साथ अभिक्रिया करके ऑक्साइड की एक मोटी परत बना देती है। इस ऑक्साइड की परत को रंगकर ऐलुमिनियम की आकर्षक वस्तुएँ बनाई जा सकती हैं।

प्रश्न 8.
कैल्सियम तथा मैग्नीशियम धातु की जल के साथ अभिक्रिया कराने पर ये तैरने क्यों लगते हैं?
उत्तर:
जल के साथ अभिक्रिया करके धातुएँ हाइड्रोजन गैस तथा धातु ऑक्साइड उत्पन्न करती हैं। जल के साथ कैल्सियम की अभिक्रिया थोड़ी धीमी होती है।
Ca (s) + 2H2O(l) → Ca (OH)2 (aq) + H2(g) + ऊष्मीय ऊर्जा
यहाँ उत्सर्जित ऊष्मा हाइड्रोजन के प्रज्जवलित होने के लिए पर्याप्त नहीं होती है इसीलिए अभिक्रिया में उत्पन्न हाइड्रोजन गैस के बुलबुले कैल्सियम धातु की सतह पर चिपक जाते हैं जिससे कैल्सियम तैरना प्रारंभ कर देता है। इसी प्रकार मैग्नीशियम गर्म जल के साथ अभिक्रिया करके मैग्नीशियम हाइड्रॉक्साइड एवं हाइड्रोजन गैस उत्पन्न करता है। चूंकि हाइड्रोजन गैस के बुलबुले मैग्नीशियम धातु की सतह से चिपक जाते हैं अतः यह भी तैरना प्रारंभ कर देता है।
प्रश्न 9.
धातुओं की अम्लों के साथ अभिक्रिया की व्याख्या कीजिए।
उत्तर:
सामान्यतः धातुएँ अम्ल के साथ अभिक्रिया करके संगत लवण तथा H2 गैस देती हैं।
धातु + तनु अम्ल → लवण + हाइड्रोजन
Mg(s) + 2HCl(aq) → MgCl(aq) + H2(g)
Zn(s) + H2SO4(aq) → ZnSO4(aq) + H2(g)
Mg, Al, Zn, Fe तथा Cu की तनु हाइड्रोक्लोरिक अम्ल से क्रियाशीलता का क्रम निम्न होता है
Mg > Al> Zn > Fe> Cu
मैग्नीशियम के साथ अभिक्रिया सर्वाधिक ऊष्माक्षेपी है। कॉपर की तनु HCl से कोई अभिक्रिया नहीं होती।
जब धातुएँ नाइट्रिक अम्ल (HNO3) के साथ अभिक्रिया करती हैं तब हाइड्रोजन गैस उत्सर्जित नहीं होती है लेकिन मैग्नीशियम (Mg) एवं मैंगनीज (Mn), अति तनु HNO3 के साथ अभिक्रिया कर H2 गैस उत्सर्जित करते हैं।
प्रश्न 10.
सक्रियता श्रेणी किसे कहते हैं? इसके आधार पर समझाइए कि किसी धातु लवण के विलयन की अन्य धातु से अभिक्रिया सम्भव है या नहीं।
उत्तर:
सक्रियता श्रेणी - सक्रियता श्रेणी वह सूची है, जिसमें धातुओं को उनकी क्रियाशीलता के अवरोही क्रम में व्यवस्थित किया जाता है। सक्रियता श्रेणी निम्न प्रकार है -
सक्रियता श्रेणी - धातुओं की सापेक्ष अभिक्रियाशीलताएँ
|
K |
पोटैशियम |
सबसे अधिक अभिक्रियाशीलसोडियम |
|
Na |
सोडियम |
|
|
Ca |
कैल्सियम |
|
|
Mg |
मैग्नीशियम |
|
|
AI |
ऐलुमिनियम |
|
|
Zn |
जिंक |
घटती अभिक्रियाशीलता |
|
Fe |
आयरन |
|
|
Pb |
लेड |
|
|
H |
हाइड्रोजन |
|
|
Cu |
कॉपर (ताँबा) |
|
|
Hg |
मर्करी (पारद) |
|
|
Ag |
सिल्वर |
|
|
Au |
गोल्ड |
सबसे कम अभिक्रियाशील |
अधिक अभिक्रियाशील धातु अपने से कम अभिक्रियाशील धातु को उसके लवण (यौगिक) के विलयन से या गलित अवस्था से विस्थापित कर देती है। अगर धातु (A), धातु (B) को उसके विलयन से विस्थापित कर देती है तो यह धातु (B) की अपेक्षा अधिक क्रियाशील है।
धातु (A) + (B) का लवण विलयन → (A) का लवण विलयन + धातु (B)
उदाहरण:
Cu+2SO4-2(aq) + Fe(s) → FeSO4(aq) + Cu(s)
इस अभिक्रिया से सिद्ध हो रहा है कि Fe, Cu से अधिक क्रियाशील है। इस अभिक्रिया की विपरीत अभिक्रिया सम्भव नहीं है।
प्रश्न 11.
धातुएँ अम्ल के साथ अभिक्रिया करके हाइड्रोजन गैस प्रदान करती हैं परन्तु नाइट्रिक अम्ल के साथ अभिक्रिया करने पर हाइड्रोजन गैस उत्सर्जित क्यों नहीं होती है?
उत्तर:
जब धातुएँ नाइट्रिक अम्ल के साथ अभिक्रिया करती हैं तब हाइड्रोजन गैस उत्सर्जित नहीं होती है क्योंकि HNO3 एक प्रबल ऑक्सीकारक होता है जो उत्पन्न H2 को ऑक्सीकृत करके जल में परिवर्तित कर देता है एवं स्वयं नाइट्रोजन के किसी ऑक्साइड (N2O, NO, NO2) में अपचयित हो जाता है। जैसे
Zn + 4HNO3 → Zn (NO3)2 + 2NO2 + 2H2O
प्रश्न 12.
क्या होगा,
(a) जब सिल्वर नाइट्रेट के विलयन में कॉपर की एक पट्टी (strip) डाली जाती है।
(b) जब कॉपर सल्फेट के विलयन में Zn की पट्टी (strip) डाली जाती है।
उत्तर:
(a) जब सिल्वर नाइट्रेट के विलयन में कॉपर की पट्टी डालते हैं तो विलयन से Ag पृथक् हो जाता है तथा कॉपर नाइट्रेट बनता है, जिसके कारण विलयन नीला हो जाता है, क्योंकि सिल्वर की तुलना में कॉपर अधिक क्रियाशील है।
2AgNO3 (aq) + Cu(s)→Cu(NO3)2(aq) + 2Ag(s)
(b) जब कॉपर सल्फेट के विलयन में जिंक की पट्टी डाली जाती है तो विलयन से Cu पृथक् हो जाता है। कॉपर सल्फेट के विलयन का नीला रंग गायब होने लगता है तथा जिंक सल्फेट बनता है क्योंकि जिंक, कॉपर से अधिक क्रियाशील है।
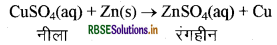

प्रश्न 13.
प्रकृति में धातुएँ किस अवस्था में पाई जाती हैं? समझाइए।
उत्तर:
पृथ्वी की भूपर्पटी धातुओं का मुख्य स्रोत है। समुद्री जल में भी NaCl, MgCl, आदि विलेय लवण उपस्थित रहते हैं। कुछ धातुएँ भूपर्पटी में स्वतंत्र अवस्था में पाई जाती हैं। कुछ धातुएँ यौगिकों के रूप में मिलती हैं। सक्रियता श्रेणी में नीचे आने वाली धातुएँ जैसे गोल्ड, सिल्वर, प्लैटिनम आदि स्वतंत्र अवस्था में पाई जाती हैं | कॉपर एवं सिल्वर, अपने सल्फाइड या ऑक्साइड अयस्क के रूप में संयुक्त अवस्था में भी पाए जाते हैं।
सक्रियता श्रेणी में सबसे ऊपर की धातुएँ (K, Na, Ca, Mg एवं AI) इतनी अधिक अभिक्रियाशील होती हैं कि ये कभी भी स्वतंत्र अवस्था में नहीं पाई जातीं। सक्रियता श्रेणी के मध्य की धातुएँ (Zn, Fe, Pb आदि) की अभिक्रियाशीलता मध्यम होती है। पृथ्वी की भूपर्पटी में ये मुख्यतः ऑक्साइड, सल्फाइड या कार्बोनेट के रूप में पाई जाती हैं। कई धातुओं के अयस्क ऑक्साइड होते हैं । ऑक्सीजन की अत्यधिक अभिक्रियाशीलता एवं पृथ्वी पर इसके प्रचुर मात्रा में पाए जाने के कारण ऑक्साइड बनते हैं।
प्रश्न 14.
भर्जन तथा निस्तापन में अन्तर बताइए।
उत्तर:
|
भर्जन |
निस्तापन |
|
1. यह प्रक्रिया सल्फाइड अयस्कों हेतु प्रयुक्त की जाती है। |
1. यह प्रक्रिया कार्बोनेट अयस्कों हेतु प्रयुक्त की जाती है। |
|
2. इसमें अयस्क को वायु की उपस्थिति में अधिक ताप पर गर्म करके ऑक्साइड में परिवर्तित किया जाता है। |
2. इसमें अयस्क को वायु की उपस्थिति में अधिक ताप पर गर्म करके ऑक्साइड में बदला जाता है। |
|
3. उदाहरण: |
3. उदाहरण: |
प्रश्न 15.
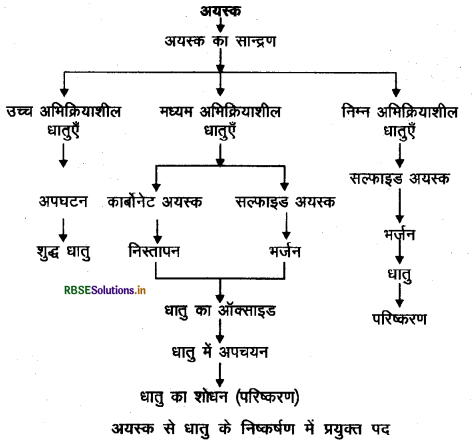
किसी अयस्क से शुद्ध धातु के निष्कर्षण में प्रयुक्त पदों (चरण) का एक चार्ट बनाइए।
उत्तर:
किसी अयस्क से शुद्ध धातु के निष्कर्षण में प्रयुक्त विभिन्न पदों को निम्न चार्ट द्वारा दर्शाया जा सकता है -
प्रश्न 16.
सोने की शुद्धता किसमें मापी जाती है? शुद्ध सोने के आभूषण क्यों नहीं बनाए जाते हैं?
उत्तर:
सोने की शुद्धता कैरेट में मापी जाती है। शुद्ध सोने को 24 कैरेट कहते हैं तथा यह काफी नर्म होता है। इसलिए यह आभूषण बनाने के लिए उपयुक्त नहीं होता है। इसे कठोर बनाने के लिए इसमें चाँदी या ताँबा मिलाया जाता है। भारत में अधिकांशतः आभूषण बनाने के लिए 22 कैरेट सोने का उपयोग किया जाता है। इसका अर्थ यह है कि 22 भाग शुद्ध सोने में 2 भाग ताँबा या चाँदी का मिलाया जाता है।
प्रश्न 17.
(a) खुली वायु में कुछ दिन रखने पर सिल्वर (चाँदी) की वस्तुएँ काली हो जाती हैं। क्यों?
(b) आर्द्र वायु में कॉपर की भूरे रंग की चमक धीरे - धीरे क्यों खत्म हो जाती है?
उत्तर:
(a) खुली वायु में कुछ दिन छोड़ देने पर सिल्वर की वस्तुएँ काली हो जाती हैं क्योंकि वायु में उपस्थित सल्फर, सिल्वर के साथ क्रिया करता है, जिससे सिल्वर पर सल्फाइड की परत बन जाती है।
(b) कॉपर वायु में उपस्थित आर्द्र कार्बन - डाइऑक्साइड (CO2) के साथ अभिक्रिया करता है जिससे हरे रंग के बेसिक कॉपर कार्बोनेट की परत इसकी सतह पर चढ़ने लगती है। जिससे इसकी सतह से भूरे रंग की चमक धीरेधीरे खत्म हो जाती है।
प्रश्न 18.
जिंक, आयरन से भी अधिक विद्युत धनी है, अतः इसका संक्षारण, आयरन से अधिक तेजी से होना चाहिए लेकिन ऐसा नहीं होता जबकि इसे आयरन के रक्षण (गैल्वेनीकरण) हेतु प्रयुक्त करते हैं। क्यों?
उत्तर:
जिंक जब आर्द्र वायु के सम्पर्क में आता है तो इस पर क्षारीय जिंक कार्बोनेट [Zn(OH)2ZnCO3] की रक्षी परत बन जाती है। यह परत जिंक की पुनः अभिक्रिया से रक्षा करती है। अतः जिंक का संक्षारण नहीं होता अतः इसे लोहे को जंग लगने से बचाने के लिए प्रयोग में लिया जाता है।
प्रश्न 19.
थर्मिट अभिक्रिया किसे कहते हैं? अभिक्रिया का संतुलित रासायनिक समीकरण दीजिए।
उत्तर:
अत्यधिक अभिक्रियाशील धातुएँ जैस- सोडियम, कैल्सियम, ऐलुमिनियम आदि निम्न अभिक्रियाशीलता वाले धातुओं को उनके यौगिकों से विस्थापित कर सकती है। यह विस्थापन अभिक्रियाएँ अत्यधिक ऊष्माक्षेपी होती हैं। इनमें उत्सर्जित ऊष्मा की मात्रा इतनी अधिक होती है कि धातुएँ गलित अवस्था में प्राप्त होती हैं। इसलिए आयरन (III) ऑक्साइड (Fe2O3) के साथ ऐलुमिनियम की अभिक्रिया का उपयोग रेल की पटरी एवं मशीनी पुों की दरारों को जोड़ने के लिए किया जाता है। इस अभिक्रिया को थर्मिट अभिक्रिया कहते हैं |
Fe2O3(s) + 2Al(s)→ 2Fe(l) + AlO3(s) + ऊष्मा
प्रश्न 20.
(a) लोहे का शुद्ध अवस्था में उपयोग नहीं किया जाता। क्यों?
(b) लोहे की कठोरता बढ़ाने के लिए क्या किया जाता है? इससे स्टेनलेस इस्पात (स्टील) किस प्रकार बनाया जाता है?
उत्तर:
(a) लोहे को शुद्ध अवस्था में उपयोग में नहीं लिया जाता क्योंकि शुद्ध लोहा अत्यन्त नर्म होता है एवं गर्म करने पर सुगमतापूर्वक खिंच जाता है।
(b) लोहे की कठोरता बढ़ाने के लिए इसमें थोड़ा कार्बन (लगभग 0.05 प्रतिशत) मिलाते हैं। इससे लोहा कठोर एवं प्रबल हो जाता है। स्टेनलेस इस्पात बनाने के लिए लोहे के साथ निकल एवं क्रोमियम मिलाया जाता है। स्टेनलेस इस्पात कठोर होता है तथा इस पर जंग नहीं लगता है।
इस प्रकार लोहे के साथ अन्य पदार्थ मिलाने से इसके गुण बदल जाते हैं।
प्रश्न 21.
शुद्ध धातु की तुलना में मिश्रातु में गलनांक व विद्युत चालकता में क्या परिवर्तन आ जाता है उदाहरण देकर समझाइए।
उत्तर:
शुद्ध धातु की अपेक्षा उसके मिश्रातु की विद्युत चालकता तथा गलनांक कम होता है। उदाहरण के लिए ताँबा एवं जस्ते (Cu एवं Zn) की मिश्रातु 'पीतल' तथा ताम्र एवं टिन (Cu एवं Sn) की मिश्रातु 'काँसा' विद्युत के कुचालक हैं, जबकि ताम्र का उपयोग विद्युतीय परिपथ बनाने में किया जाता है। सीसा एवं टिन (Pb एवं Sn) की मिश्रातु 'सोल्डर' है जिसका गलनांक बहुत कम होता है इसलिए इसका उपयोग विद्युत तारों की परस्पर वेल्डिंग के लिए किया जाता है।

प्रश्न 22.
सक्रियता श्रेणी में नीचे आने वाली धातुओं का निष्कर्षण किस प्रकार किया जाता है? समझाइए।
उत्तर:
सक्रियता श्रेणी में नीचे आने वाली धातुएँ बहुत कम क्रियाशील होती हैं। इन धातुओं के ऑक्साइड को केवल गर्म करने से ही धातु प्राप्त किया जा सकता है। जैसे सिनाबार (HgS) मर्करी (पारद) का एक अयस्क है। इसे वायु में गर्म करने पर यह सबसे पहले मयूंरिक ऑक्साइड (HgO) में परिवर्तित होता है और अधिक गर्म करने पर मयूरिक ऑक्साइड मर्करी (पारद) में अपचयित हो जाता है।
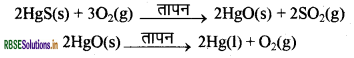
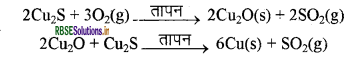
इसी प्रकार, प्राकृतिक रूप से Cu2S के रूप में उपलब्ध ताँबे (कॉपर) को केवल वायु में गर्म करके इसको अयस्क से अलग किया जा सकता है।
प्रश्न 23.
सक्रियता श्रेणी में सबसे ऊपर स्थित धातुओं का निष्कर्षण किस विधि से किया जाता है? उदाहरण सहित व्याख्या कीजिए।
उत्तर:
सक्रियता श्रेणी में सबसे ऊपर स्थित धातुएँ (K, Na, Ca, Mg एवं Al) अत्यन्त क्रियाशील होती हैं। इन्हें कार्बन के साथ गर्म करके इनके यौगिकों से प्राप्त नहीं कर सकते। उदाहरण के लिए, कार्बन के द्वारा सोडियम, मैग्नीशियम, कैल्सियम, ऐलुमिनियम आदि के ऑक्साइड का अपचयन कर उन्हें धातुओं में परिवर्तित नहीं किया जा सकता है। इन धातुओं की बंधुता कार्बन की अपेक्षा ऑक्सीजन के प्रति अधिक होती है। इन धातुओं को विद्युत अपघटनी अपचयन द्वारा प्राप्त किया जाता है। जैसे सोडियम, मैग्नीशियम एवं कैल्सियम को उनके गलित क्लोराइडों के विद्युत अपघटन से प्राप्त किया जाता है। कैथोड (ऋण आवेशित इलेक्ट्रोड) पर धातुएँ निक्षेपित हो जाती हैं तथा ऐनोड (धन आवेशित इलेक्ट्रोड) पर क्लोरीन मुक्त होती है। अभिक्रियाएँ इस प्रकार हैं
कैथोड पर: Na+ + e- → Na
ऐनोड पर: 2Cl- → Cl2 + 2e-
इसी प्रकार, ऐलुमिनियम ऑक्साइड के विद्युत अपघटनी अपचयन से ऐलुमिनियम प्राप्त किया जाता है। MgCl2 (गलित) से Mg प्राप्त किया जाता है।

कैथोड पर Mg2+ + 2e → Mg(s)
ऐनोड पर 2Cl → Cl2(g) + 2e
कैथौड पर अपचयन होता है तथा एनोड पर ऑक्सीकरण होता है।
प्रश्न 24.
अयस्कों का सान्द्रण क्यों किया जाता है?
उत्तर:
खनिज अयस्कों में अनेक अशुद्धियाँ, जैसे पत्थर के टुकड़े, मिट्टी, रेत आदि होती हैं, जिन्हें गैंग या आधात्री कहते हैं। सान्द्रण की क्रिया द्वारा इन अशुद्धियों को दूर किया जाता है। सान्द्रण की क्रिया कर लेने के बाद अयस्क धातु के निष्कर्षण के लिए अधिक उपयुक्त बन जाते हैं।
प्रश्न 25.
अयस्कों के समृद्धिकरण तथा धातुओं के परिष्करण में अन्तर कीजिए।
उत्तर:
|
अयस्कों के समृद्धिकरण |
धातुओं का परिष्करण |
|
1. अयस्कों से मिट्टी, रेत आदि जैसी अशुद्धियों (गैंग) को हटाना अयस्कों का समृद्धिकरण करना कहलाता है। |
1. विभिन्न अपचयन प्रक्रमों से प्राप्त धातुओं में अनेक अपद्रव्य होते हैं जिन्हें हटाकर शुद्ध धातु प्राप्त करने की प्रक्रिया धातुओं का परिष्करण कहलाती है। |
|
2. इस प्रक्रिया के लिए विभिन्न अपचयन प्रक्रमों का किया जाता है। |
2. इस प्रक्रिया के लिए विद्युत अपघटनी परिष्करण जैसी विधियों का उपयोग किया जाता है। |
प्रश्न 26.
किसी धातु की तनु H2SO4 अम्ल से क्रिया कराई जाती है। उत्सर्जित गैस को चित्र में दिखाई विधि से एकत्र किया जाता है। निम्नलिखित के उत्तर दीजिए.
(a) गैस का नाम बताइए।
(b) गैस को एकत्र करने की विधि का नाम बताइए।
(c) क्या गैस जल में विलेय है अथवा नहीं?
(d) क्या गैस वायु से हल्की है अथवा भारी?
(e) गैस का रासायनिक सूत्र लिखें।
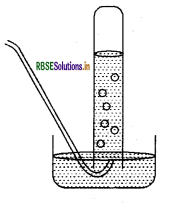
उत्तर:
(a) हाइड्रोजन गैस।
(b) गैस को एकत्र करने की विधि 'आसवन विधि' है।
(c) गैस जल में विलेय नहीं है।
(d) गैस वायु से हल्की है।
(e) गैस का रासायनिक सूत्र = H2
प्रश्न 27.
आयनिक यौगिक ठोस अवस्था में विद्युत का चालन नहीं करते हैं परन्तु गलित अवस्था में या जलीय विलयन के रूप में विद्युत का चालन करते हैं। इसके पीछे क्या वैज्ञानिक कारण है?
उत्तर:
ठोस अवस्था में आयनिक यौगिक विद्युत का चालन नहीं करते क्योंकि ठोस अवस्था में दृढ़ संरचना के कारण आयनों की गति सम्भव नहीं होती है। परन्तु आयनिक यौगिक गलित अवस्था या जलीय विलयन के रूप में विद्युत का चालन करते हैं क्योंकि इन अवस्थाओं में विपरीत आवेश वाले आयनों के मध्य स्थिर वैद्युत आकर्षण बल ऊष्मा के कारण कमजोर पड़ जाता है। इसलिए आयन स्वतंत्र रूप से गमन करते हैं और विद्युत का चालन करते हैं |

निबन्धात्मक प्रश्न
प्रश्न 1.
धातुओं तथा अधातुओं की क्रिया से आयनिक यौगिक बनने को समझाइए तथा आयनिक यौगिकों के सामान्य गुणधर्म भी बताइए। अथवा Mg व CI परमाणु के इलेक्ट्रॉनिक विन्यास दीजिए। Mg व Cl के मध्य इलेक्ट्रॉनों के स्थानान्तरण से MgCI, यौगिक का बनना दर्शाइए।
उत्तर:
धातुएँ विद्युत धनी होती हैं अतः आसानी से इलेक्ट्रॉन देकर धनायन बनाती हैं तथा अधातुएँ विद्युत ऋणी होती हैं। अतः धातु से इलेक्ट्रॉन ग्रहण करके ऋणायन बनाती हैं | इन आयनों के मध्य आकर्षण को ही आयनिक बन्ध कहते हैं। जिन यौगिकों में आयनिक बन्ध होता है, उन्हें आयनिक यौगिक कहते हैं। उदाहरण- NaCl का बनना।
सोडियम परमाणु के बाह्यतम कोश में केवल एक इलेक्ट्रॉन होता है। यदि यह अपने M कोश से एक इलेक्ट्रॉन त्याग देता है तब L कोश इसका बाह्यतम कोश बन जाता है, जिसमें स्थायी अष्टक उपस्थित है। इस परमाणु के नाभिक में 11 प्रोटॉन हैं लेकिन इलेक्ट्रॉनों की संख्या 10 होने के कारण इसमें धन आवेश की अधिकता होती है तथा यह सोडियम धनायन Na+ बनाता है। परन्तु क्लोरीन के बाह्यतम कोश में 7 इलेक्ट्रॉन होते हैं तथा अष्टक पूर्ण होने के लिए इसे एक इलेक्ट्रॉन की आवश्यकता है।
जब सोडियम एवं क्लोरीन अभिक्रिया करते हैं तब सोडियम द्वारा त्यागा गया एक इलेक्ट्रॉन क्लोरीन ग्रहण कर लेता है। एक इलेक्ट्रॉन ग्रहण करके क्लोरीन - परमाणु, इकाई ऋण आवेश प्राप्त करता है क्योंकि इसके नाभिक में 17 प्रोटॉन होते हैं तथा इसके सभी कोशों (K, L एवं M कोश) में कुल 18 इलेक्ट्रॉन होते हैं। इससे क्लोराइड ऋणायन Cl- प्राप्त होता है। इसलिए इन दोनों तत्वों के बीच निम्न प्रकार से आदान - प्रदान का सम्बन्ध स्थापित हो जाता है -
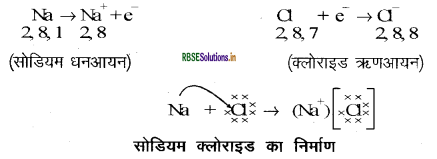
विपरीत आवेश होने के कारण सोडियम तथा क्लोराइड आयन परस्पर आकर्षित होते हैं तथा प्रबल स्थिरवैद्युत आकर्षण बल से बँधकर सोडियम क्लोराइड (NaCl) के रूप में उपस्थित रहते हैं | यहाँ सोडियम क्लोराइड अणु के रूप में नहीं पाया जाता है बल्कि यह विपरीत आयनों का समूह होता है। MgCl का बनना: Mg, दो इलेक्ट्रॉन देकर Mg + बनाता है तथा ये दोनों इलेक्ट्रॉन दो क्लोरीन परमाणु ग्रहण करते हैं जिससे दो Cl- बनते हैं।

धातु से अधातु में इलेक्ट्रॉन के स्थानान्तरण से बने यौगिकों को आयनिक यौगिक या वैद्युत संयोजक यौगिक कहा जाता है। सामान्य गुणधर्म-आयनिक यौगिकों के सामान्य गुण निम्न प्रकार से हैं -
(1) भौतिक प्रकृति (Physical State):
धन एवं ऋण आयनों के बीच प्रबल आकर्षण बल के कारण आयनिक यौगिक ठोस एवं कठोर होते हैं। ये यौगिक सामान्यतः भंगुर होते हैं तथा दाब डालने पर छोटे-छोटे टुकड़ों में टूट जाते हैं।
(2) गलनांक एवं क्वथनांक (Melting and Boiling Point):
आयनिक यौगिकों का गलनांक एवं क्वथनांक बहुत अधिक होता है क्योंकि प्रबल अंतर - आयनिक आकर्षण बल को तोड़ने के लिए ऊर्जा की अधिक मात्रा की आवश्यकता होती है।
(3) घुलनशीलता (Solubility):
वैद्युत संयोजक यौगिक सामान्यतः जल में घुलनशील तथा किरोसिन, पेट्रोल आदि कार्बनिक विलायकों में अविलेय होते हैं।
(4) विद्युत चालकता (Electrical conductance):
किसी विलयन से विद्युत के चालन के लिए आवेशित कणों की गतिशीलता आवश्यक होती है। आयनिक यौगिकों के जलीय विलयन में आयन उपस्थित होते हैं। जब विलयन में विद्युत धारा प्रवाहित की जाती है तो यह आयन विपरीत इलेक्ट्रोड की ओर गमन करने लगते हैं। ठोस अवस्था में आयनिक यौगिक विद्युत का चालन नहीं करते हैं क्योंकि ठोस अवस्था में दृढ़ संरचना के कारण आयनों की गति नहीं होती है। लेकिन आयनिक यौगिक गलित अवस्था में विद्युत का चालन करते हैं. क्योंकि गलित अवस्था में भी विपरीत आवेश वाले आयनों के मध्य स्थिरवैद्युत आकर्षण बल ऊष्मा के कारण कमजोर पड़ जाता है। इसलिए आयन स्वतंत्र रूप से गमन करते हैं एवं विद्युत का चालन करते हैं।

प्रश्न 2.
प्रयोग द्वारा सिद्ध कीजिए कि धातु ऊष्मा के सुचालक होते हैं। उत्तर - धातु ऊष्मा के सुचालक होते हैं, इसे सिद्ध करने के लिए निम्न प्रयोग करते हैं -
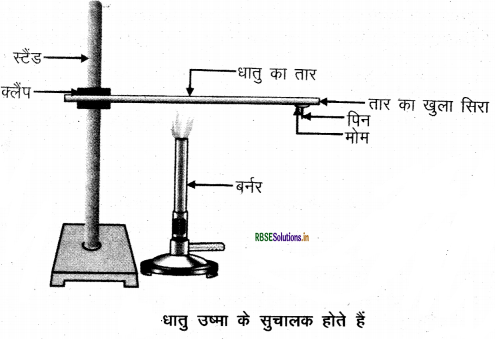
- ऐलुमिनियम या कॉपर का तार लेकर उसे क्लैंप की सहायता से स्टैंड से बाँध देते है।
- तार के खुले सिरे पर मोम का उपयोग कर एक पिन चिपका देते हैं।
- स्पिरिट लैंप, मोमबती या बर्नर से क्लैंप के निकट तार को गर्म करते हैं।
- थोड़ी देर बाद प्रेक्षित करने पर देखते हैं कि मोम के पिघलने से पिन नीचे गिर जाती है परन्तु तार नहीं पिघलता। उपरोक्त प्रयोग से पता चलता है कि धातु ऊष्मा के सुचालक हैं तथा इनका गलनांक बहुत अधिक होता है|
प्रश्न 3.
सक्रियता श्रेणी के मध्य में स्थित धातुओं के निष्कर्षण की विस्तृत विवेचना कीजिए।
उत्तर:
सक्रियता श्रेणी के मध्य में स्थित धातुएँ; जैसे- आयरन, जिंक, लेड, कॉपर आदि की क्रियाशीलता मध्यम होती है। प्रकृति में ये धातुएँ प्रायः सल्फाइड या कार्बोनेट के रूप में पाई जाती हैं। सल्फाइड या कार्बोनेट की तुलना में धातु को उसके ऑक्साइड से प्राप्त करना अधिक आसान होता है। इसलिए अपचयन से पहले धातु के सल्फाइड एवं कार्बोनेट को धातु ऑक्साइड में परिवर्तित करते हैं।
सल्फाइड अयस्क को वायु की उपस्थिति में अधिक ताप पर गर्म करने पर यह ऑक्साइड में परिवर्तित हो जाता है। इस प्रक्रिया को भर्जन कहते हैं। इसी प्रकार कार्बोनेट अयस्क को सीमित वायु में अधिक ताप पर गर्म करने से यह ऑक्साइड में परिवर्तित हो जाता है। इस प्रक्रिया को निस्तापन कहा जाता है।
जिंक के अयस्कों के भर्जन एवं निस्तारण के समय निम्न रासायनिक अभिक्रिया होती है -
भर्जन- 
निस्तापन- 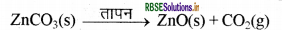
इसके पश्चात् कार्बन जैसे उपयुक्त अपचायक का उपयोग कर धातु ऑक्साइड से धातु प्राप्त किया जाता है। उदाहरण-जब जिंक ऑक्साइड को कार्बन के साथ गर्म किया जाता है तो यह जिंक धातु में अपचयित हो जाता है।

धातुओं को उनके यौगिकों से प्राप्त करना अपचयन प्रक्रम है। इसके अलावा विस्थापन अभिक्रिया का भी उपयोग किया जाता है। अत्यधिक क्रियाशील धातुएँ; जैसे-सोडियम, कैल्सियम, ऐलुमिनियम आदि को अपचायक के रूप में उपयोग किया जा सकता है क्योंकि ये निम्न क्रियाशीलता वाले धातुओं को उनके यौगिकों से विस्थापित कर देती हैं | जैसे मैंगनीज डाइऑक्साइड को ऐलुमिनियम चूर्ण के साथ गर्म किया जाता है तो निम्न अभिक्रिया होती है
3MnO2 (s) + 4Al(s) → 3Mn(l) + 2Al2O3 (s) + ऊष्मा
इसमें MnO2 का अपचयन तथा Al का ऑक्सीकरण हो रहा है। यह विस्थापन अभिक्रियाएँ अत्यधिक ऊष्माक्षेपी होती हैं। इनमें उत्सर्जित ऊष्मा की मात्रा इतनी अधिक होती है कि धातुएँ गलित अवस्था में प्राप्त होती हैं।

प्रश्न 4.
धातुओं एवं अधातुओं के बीच कैसे विभेद करेंगे?
उत्तर:
भौतिक गुणों में विभेद धातुएँ -
|
धातुएँ |
अधातुएँ |
|
1. यह सामान्य ताप पर ठोस होती हैं। (अपवाद-पारा) |
यह सामान्य ताप पर तीनों अवस्थाओं में पाई जाती हैं। सल्फर और फॉस्फोरस ठोस रूप में, H2, O2 एवं N2 गैसीय रूप में तथा ब्रोमीन तरल रूप में पाये जाते हैं। |
|
2. यह तन्य तथा आघातवर्ध्य होती हैं । |
यह प्रायः भंगुर होती हैं। |
|
3. इनमें धात्विक चमक पाई जाती है। |
इनमें चमक नहीं होती परन्तु हीरा, ग्रेफाइट तथा आयोडीन अपवाद हैं। |
|
4. यह ऊष्मा तथा विद्युत की सुचालक होती हैं। (बिस्मथ अपवाद) |
ग्रेफाइट को छोड़कर शेष सभी अधातुएँ विद्युत की कुचालक हैं | |
|
5. इनके गलनांक तथा क्वथनांक बहुत अधिक होते हैं। |
इनके गलनांक तथा क्वथनांक कम होते हैं | (अपवाद ग्रेफाइट) |
|
6. प्रत्येक धातु की कठोरता दूसरी धातु से भिन्न होती है। Fe, Cu, Al धातुएँ अत्यन्त कठोर होती हैं। इसके विपरीत Na, K, Li धातुएँ इतनी मुलायत होती हैं होती है।कि उन्हें चाकू से भी काटा जा सकता है। |
अधिकतर ठोस अधातुएँ बहुत मुलायम होती हैं | केवल एक अधातु हीरा (कार्बन का अपररूप) बहुत कठोर होती है। |
|
7. यह अपारदर्शक होती हैं। |
गैसीय अधातुएँ पारदर्शक होती हैं। |
धातुओं एवं अधातुओं के गुणों में विभेद -
|
धातुएँ |
अधातुएँ |
|
1. धातुएँ क्षारीय ऑक्साइड बनाती हैं। |
अधातुएँ अम्लीय तथा उदासीन ऑक्साइड बनाती हैं। |
|
2. यह अम्लों से अभिक्रिया करके हाइड्रोजन गैस तथा लवण बनाती हैं। |
यह अम्लों में से हाइड्रोजन गैस को उत्सर्जित नहीं करती हैं। |
|
3. इनकी प्रकृति धनात्मक होती है। |
इनकी प्रकृति ऋणात्मक होती है। |
|
4. यह क्लोरीन से संयोग करके क्लोराइड बनाती हैं, जो वैद्युत संयोजक होते हैं। |
यह क्लोरीन से संयोग करके क्लोराइड बनाती हैं, परन्तु वे सहसंयोजक होते हैं। |
|
5. धातुएँ अपचायक हैं। |
अधातुएँ ऑक्सीकारक हैं। |
|
6. यह जलीय विलयन में धनायन बनाती हैं। |
अधातुएँ जलीय विलयन में ऋणायन बनाती हैं। |
प्रश्न 5.
धातु पर भाप की क्रिया को नामांकित चित्र बनाते हुए समझाइए।
उत्तर:
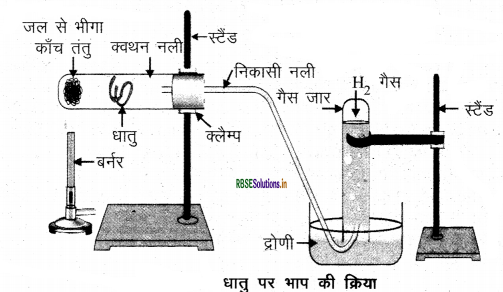
जल के साथ अभिक्रिया करके धातुएँ हाइड्रोजन गैस तथा धातु ऑक्साइड उत्पन्न करती हैं। परन्तु ऐलुमिनियम, आयरन तथा जिंक जैसी धातुएँ न तो शीतल जल के साथ और न ही गर्म जल के साथ अभिक्रिया करती है। लेकिन भाप के साथ अभिक्रिया करके यह धातु ऑक्साइड तथा हाइड्रोजन प्रदान करती है।
2Al(s) + 3H2O(g) →Al2O3(s) +3H2(g)
3Fe(s) + 4H2O(g) → Fe3O4(s) + 4H2(g)
प्रश्न 6.
मिश्र धातु किसे कहते हैं? इनके बनाने के उद्देश्यों का वर्णन करो।
उत्तर:
मिश्र धातु:
किसी धातु का किसी अन्य धातु या अधातु के साथ मिलाकर बनाया गया समांगी मिश्रण, मिश्रधातु कहलाता है। इसे तैयार करने के लिए पहले मूल धातु को गलित अवस्था में लाया जाता है। फिर दूसरे तत्वों को एक निश्चित अनुपात में इसमें विलीन किया जाता है। फिर इसे कमरे के ताप पर ठण्डा किया जाता है।
शुद्ध धातु की अपेक्षा उसके मिश्रधातु की विद्युत चालकता तथा गलनांक कम होता है। स्टेनलेस स्टील, ताँबा, पीतल, कांसा, सोल्डर आदि सभी मिश्र धातुएँ हैं।
मिश्र धातु बनाने के उद्देश्य:
- कठोरता बढ़ाने के लिए: लोहे में कार्बन की मात्रा मिलाकर स्टेनलेस स्टील बनाया जाता है, जो लोहे से अधिक कठोर होता है। सोने में ताँबा तथा चाँदी में सीसा मिलाने से उनकी कठोरता अधिक हो जाती है।
- शक्ति बढ़ाने के लिए: इस्पात, ड्यूरेलियम (ऐलुमिनियम से बना मिश्र धातु) आदि मिश्र धातुएँ कठोर होने के कारण शक्तिशाली भी होती हैं।
- संक्षारण रोकने के लिए: जैसे स्टेनलेस स्टील, लोहे तथा जिंक से बनी मिश्रधातु आदि पर जंग नहीं लगता।
- गलनांक कम करने के लिए: जैसे सीसा एवं टिन (Pb एवं Sn) की मिश्र धातु सोल्डर है, जिसका गलनांक बहुत कम होता है। इस कारण इसका उपयोग विद्युत तारों की परस्पर वेल्डिंग के लिए किया जाता है।
- घरेलू उपयोग घरों, कारखानों, दफ्तरों में सभी जगह मिश्र धातुओं का उपयोग होता है, जैसे घर के बर्तन, अलमारी, पंखे, फ्रिज, आभूषण, मशीनों और वाहनों के गियर, यातायात के साधन, मूर्तियाँ आदि को बनाने में मिश्र धातुओं का उपयोग किया जाता है।
प्रश्न 7.
जंग किसे कहते हैं? इसके लिए किन - किन आवश्यकताओं का पूरा होना आवश्यक होता है? लोहे को जंग से बचाने की मुख्य विधियाँ लिखिए।
उत्तर:
जंग -
लम्बे समय तक आर्द्र वायु में रहने पर लोहे पर भूरे रंग के पदार्थ की परत चढ़ जाती है, जिसे जंग कहते हैं | यह आयरन (III) ऑक्साइड और आयरन (III) हाइड्रॉक्साइड का यौगिक होता है। जंग लोहे की सतह को कमजोर कर देता है। इसके कारण लोहे की बनी वस्तुओं का बहुत नुकसान होता है। लोहे पर जंग लगने के लिए वायु एवं नमी की आवश्यकता होती है। इसे निम्न क्रियाकलाप द्वारा स्पष्ट किया जा सकता है
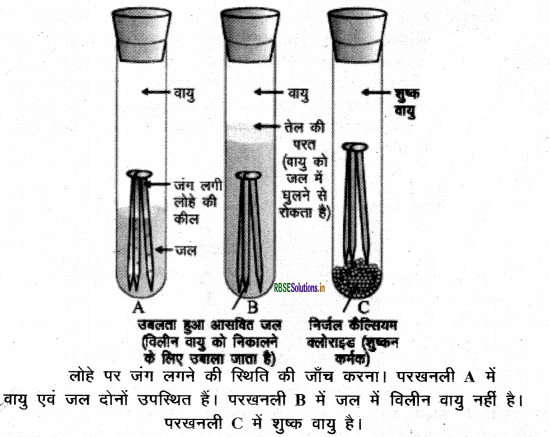
क्रियाकलाप:
- तीन परखनलियाँ A, B और C लेकर प्रत्येक में स्वच्छ लोहे की कीलें डालते हैं तथा परखनली A में थोड़ा जल डालकर उसे कार्क से बंद कर देते हैं।
- परखनली B में उबलता हुआ आसवित जल डालकर उसमें 1 mL तेल मिलाकर कॉर्क से बन्द कर देते हैं। परखनली B में तेल डालने के कारण यह वायु को जल में विलीन होने से रोकता है।
- परखनली C में थोड़ा - सा निर्जल कैल्सियम क्लोराइड डालकर उसे कॉर्क से बन्द कर देते हैं। कैल्सियम क्लोराइड वायु की नमी को सोख लेता है। इन परखनलियों को कुछ दिन छोड़ देने के बाद उनका प्रेक्षण करते हैं।
प्रेक्षण एवं परिणाम:
हम देखते हैं कि परखनली A में रखी लोहे की कीलों पर जंग लग गया है परन्तु परखनली B एवं C में रखी कीलों पर जंग नहीं लगता है। परखनली A की कील वायु व जल दोनों में रहती है। परखनली B वाली कील केवल जल के सम्पर्क में रहती है एवं परखनली C की कील शुष्क वायु के सम्पर्क में रहती हैं। इस कारण इन पर जंग नहीं लगता है। इससे यह निष्कर्ष निकलता है कि लोहे पर जंग लगने के लिए वायु व नमी दोनों की आवश्यकता होती है।
लोहे को जंग से बचाने के उपाय:
लोहे को निम्न उपाय अपनाकर जंग से बचाया जा सकता है
- लोहे पर तेल या ग्रीस की तह जमाकर।
- लोहे की सतह पर पेंट करके।
- लोहे की सतह पर प्लास्टिक की परत लगाकर |
- यशदलेपन द्वारा (लोहे की वस्तुओं पर जस्ते की परत चढ़ाकर)।
- लोहे पर क्रोमियम लेपन करके।
- ऐनोडीकरण द्वारा।
- मिश्रधातु बनाकर।
प्रश्न 8.
अयस्क किसे कहते हैं? ताँबे के परिष्करण की विद्युत अपघटनी विधि का सचित्र वर्णन कीजिए।
उत्तर:
अयस्क:
जिन खनिजों में किसी विशेष धातु की मात्रा अधिक रूप से होती है, जिसे निकालना लाभकारी होता है, उन्हें अयस्क कहते हैं। ताँबे के परिष्करण की विद्युत अपघटनी विधि - कॉपर, जिंक, टिन, निकल, सिल्वर, गोल्ड आदि जैसी धातुओं का परिष्करण विद्युत अपघटन द्वारा किया जाता है। इस विधि में, अशुद्ध धातु को ऐनोड तथा शुद्ध धातु की पतली परत को कैथोड बनाया जाता है। धातु के लवण के विलयन को विद्युत अपघट्य के रूप में लेते हैं । चित्र के अनुसार उपकरण व्यवस्थित किया जाता है। विद्युत अपघट्य से जब विद्युत प्रवाहित की जाती है तब ऐनोड पर स्थित अशुद्ध धातु विद्युत अपघट्य में घुल जाती है। इतनी ही मात्रा में शुद्ध धातु विद्युत अपघट्य से कैथोड पर जमा हो जाती है। विलेय अशुद्धियाँ विलयन में चली जाती हैं तथा अविलेय अशुद्धियाँ ऐनोड के नीचे निक्षेपित हो जाती हैं जिसे ऐनोड पंक कहते हैं।
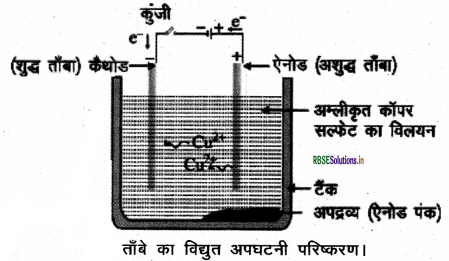

प्रश्न 9.
धातुओं की लवण विलयन के साथ अभिक्रिया को उदाहरण देकर समझाइए।
उत्तर:
धातुओं की अन्य धातु लवणों के विलयन के साथ अभिक्रिया को निम्न प्रयोग द्वारा समझा जा सकता है
1. दो परखनलियाँ लेकर एक में कॉपर सल्फेट विलयन तथा दूसरी में आयरन सल्फेट विलयन डाल देते हैं।
2. कॉपर का एक स्वच्छ तार एवं आयरन की एक कील देते हैं ।
3. कॉपर के तार को आयरन सल्फेट के विलयन में जबकि आयरन की कील को कॉपर सल्फेट के विलयन' में डाल देते हैं।
4. 20 मिनट बाद प्रेक्षण करने पर देखते हैं कि कॉपर सल्फेट का नीला विलयन हल्के हरे रंग के विलयन में बदल जाता है जबकि आयरन सल्फेट के विलयन में किसी भी प्रकार का परिवर्तन नहीं होता है।
5. इस अभिक्रिया को निम्न समीकरण द्वारा प्रदर्शित कर सकते हैं
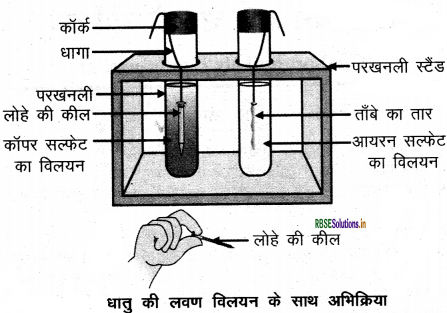
इस प्रयोग में आयरन अपने से कम अभिक्रियाशील धातु कॉपर को उसके यौगिक के विलयन से विस्थापित कर देता है। . इस प्रकार निष्कर्ष निकाला जा सकता है कि अभिक्रियाशील धातु अपने से कम अभिक्रियाशील धातु को उसके लवण विलयन से विस्थापित कर देती है।


- RBSE Solutions for Class 10 Science Chapter 12 विद्युत
- RBSE Class 10 Science Notes in Hindi & English Medium Pdf Download
- RBSE Class 10 Science Important Questions in Hindi & English Medium
- RBSE Solutions for Class 10 Science in Hindi Medium & English Medium
- RBSE Class 10 Science Important Questions Chapter 16 प्राकृतिक संसाधनों का संपोषित प्रबंधन
- RBSE Class 10 Science Important Questions Chapter 13 विद्युत धारा का चुम्बकीय प्रभाव
- RBSE Class 10 Science Important Questions Chapter 10 प्रकाश - परावर्तन तथा अपवर्तन
- RBSE Class 10 Science Important Questions Chapter 11 मानव नेत्र एवं रंगबिरंगा संसार
- RBSE Class 10 Science Important Questions Chapter 12 विद्युत
- RBSE Class 10 Science Important Questions Chapter 14 उर्जा के स्रोत
- RBSE Class 10 Science Important Questions Chapter 15 हमारा पर्यावरण