RBSE Class 10 Science Important Questions Chapter 2 अम्ल, क्षारक एवं लवण
Rajasthan Board RBSE Class 10 Science Important Questions Chapter 2 अम्ल, क्षारक एवं लवण Important Questions and Answers.
RBSE Class 10 Science Chapter 2 Important Questions अम्ल, क्षारक एवं लवण
वस्तुनिष्ठ प्रश्न
प्रश्न1.
हमारा उदर कौनसा अम्ल उत्पन्न करता है?
(अ) H2SO4
(ब) HNO3
(स) NaOH
(द) HCl
उत्तर:
(द) HCl

प्रश्न 2.
दाँत साफ करने के लिए प्रयुक्त टूथपेस्ट की प्रकृति किस प्रकार की होती है?
(अ) क्षारीय
(ब) अम्लीय
(स) उदासीन
(द) संक्षारकीय
उत्तर:
(अ) क्षारीय
प्रश्न 3.
पीने के पानी को जीवाणुओं से मुक्त कराने के लिए निम्न में से किसका उपयोग किया जाता है?
(अ) बेकिंग सोडा
(ब) विरंजक चूर्ण
(स) धोने का सोडा
(द) उपरोक्त में से कोई नहीं
उत्तर:
(ब) विरंजक चूर्ण
प्रश्न 4.
आसुत जल की pH का मान है'
(अ) 9
(ब) 7
(स) 5
(द) 3
उत्तर:
(ब) 7

प्रश्न 5.
हमारे रुधिर की प्रकृति होती है
(अ) अम्लीय
(ब) क्षारीय
(स) उदासीन
(द) कुछ अम्लीय व कुछ क्षारीय
उत्तर:
(ब) क्षारीय
प्रश्न 6.
अधातुओं के ऑक्साइड की प्रकृति होती है
(अ) क्षारीय
(ब) अम्लीय
(स) उदासीन
(द) अक्रिय
उत्तर:
(ब) अम्लीय
प्रश्न 7.
सान्द्र H2SO4 को जल में मिलाने पर
(अ) ऊष्मा अवशोषित होती है।
(ब) ऊष्मा उत्सर्जित होती है।
(स) कोई परिवर्तन नहीं होता।
(द) विलयन गाढ़ा हो जाता है।
उत्तर:
(ब) ऊष्मा उत्सर्जित होती है।
प्रश्न 8.
बेकिंग सोडा को गर्म करने पर बना यौगिक है
(अ) NaNO3
(ब) Na2CO3
(स) NH4CI
(द) NaHCO3
उत्तर:
(ब) Na2CO3

प्रश्न 9.
तनु सल्फ्यूरिक अम्ल की क्रिया निम्न में से किससे कराने पर हाइड्रोजन गैस निकलती है?
(अ) Zn
(ब) Mg
(स) Fe
(द) उपरोक्त सभी उत्तर-तालिका
उत्तर:
(द) उपरोक्त सभी उत्तर-तालिका
अतिलघूत्तरात्मक प्रश्न
प्रश्न 1.
बेकिंग पाउडर के दो प्रमुख घटक लिखिए।
उत्तर:
- NaCl (सोडियम क्लोराइड)
- CO2, NH3 आदि ।
प्रश्न 2.
अम्लीय ऑक्साइड के नाम लिखिए जिनके द्वारा अम्लीय वर्षा होती है।
उत्तर:
- सल्फ्यू रिक अम्ल (HSO4)
- नाइट्रिक अम्ल (HNO3)
प्रश्न 3.
दो संश्लेषित सूचकों के नाम लिखिए।
उत्तर:
- मेथिल ऑरेंज
- फीनॉल्पथेलिन ।

प्रश्न 4.
किसका pH अधिक होगा
(i) रक्त अथवा आसुत जल
(ii) जठर रस अथवा नींबू का रस।
उत्तर:
(i) रक्त का pH अधिक है।
(ii) जठर रस का pH अधिक है।
प्रश्न 5.
किसी विलयन की उदासीन प्रकृति के लिए pH का मान कितना होता है?
उत्तर:
किसी भी उदासीन विलयन के pH का मान 7 होता है।
प्रश्न 6.
चींटी के डंक से स्राव होने वाले अम्ल का नाम लिखिए।
उत्तर:
मेथैनॉइक अम्ल।
प्रश्न 7.
ऐसे दो यौगिकों के नाम बताइए जिनमें हाइड्रोजन है, लेकिन वे अम्ल नहीं हैं तथा उनके विलयन में विद्युत का चालन नहीं होता।
उत्तर:
ऐल्कोहॉल (C2H5OH) तथा ग्लुकोज़ (C6H12O6)।
प्रश्न 8.
हाइड्रोजन आयन की सान्द्रता मापने की विधि किस वैज्ञानिक द्वारा दी गई थी?
उत्तर:
सोरेन्सन।
प्रश्न 9.
नींबू के रस का pH कितना होता है?
उत्तर:
नींबू का रस अम्लीय होता है। इसका pH मान लगभग 2.2 होता है।

प्रश्न 10.
'मिल्क ऑफ मैग्नीशिया' का pH कितना होता है?
उत्तर:
मिल्क ऑफ मैग्नीशिया के pH का मान 10 होता है।
प्रश्न 11.
'मिल्क ऑफ मैग्नीशिया की उपयोगिता बताइए।
उत्तर:
मिल्क ऑफ मैग्नीशिया (मैग्नीशियम हाइड्रॉक्साइड) एक दुर्बल क्षारक है जिसका उपयोग ऐन्टैसिड के रूप में उदर में अम्ल की आधिक्य मात्रा को उदासीन करने में किया जाता है।
प्रश्न 12.
Zn की NaOH विलयन से क्रिया करवाने पर H2 गैस प्राप्त होती है। इसका समीकरण लिखिए।
उत्तर:

प्रश्न 13.
धातुओं के ऑक्साइड की प्रकृति सामान्यतः कैसी होती है? दो उदाहरण दीजिए।
उत्तर:
धातुओं के ऑक्साइड सामान्यतः क्षारीय प्रकृति के होते हैं, जैसे - CaO, MgO

प्रश्न 14.
प्रबल अम्लों तथा प्रबल क्षारों के दो-दो उदाहरण दीजिए।
उत्तर:
प्रबल अम्ल:
HCl (हाइड्रोक्लोरिक अम्ल), H2SO4 (सल्फ्यूरिक अम्ल)।
प्रबल क्षार:
NaOH (सोडियम हाइड्रॉक्साइड), KOH (पोटेशियम हाइड्रॉक्साइड)।
प्रश्न.15.
दुर्बल अम्ल तथा दुर्बल क्षारकों के दो - दो उदाहरण लिखिए।
उत्तर:
दुर्बल अम्ल:
CH3COOH, HCN
दुर्बल क्षारक:
NH4OH, Mg(OH)2
प्रश्न 16.
सार्वत्रिक/सार्वभौम सूचक क्या होते हैं? लिखिए।
उत्तर:
ये अनेक सूचकों का मिश्रण होते हैं। ये किसी विलयन में H+ आयन की विभिन्न सान्द्रता को विभिन्न रंगों में प्रदर्शित करते हैं।
प्रश्न 17.
जठर रस की pH कितनी होती है?
उत्तर:
जठर रस की pH लगभग 1.2 होती है।
प्रश्न 18.
टमाटर में कौनसा अम्ल पाया जाता है?
उत्तर:
टमाटर में ऑक्सैलिक अम्ल पाया जाता है।

प्रश्न 19.
सोडियम वर्ग के चार लवण बताइए।
उत्तर:
सोडियम सल्फेट (Na2SO4), सोडियम क्लोराइड (NaCl), सोडियम नाइट्रेट (NaNO3), सोडियम कार्बोनेट (Na2CO3)।
प्रश्न 20.
सोडियम एसीटेट का जलीय विलयन क्षारीय होता है। क्यों?
उत्तर:
सोडियम एसीटेट (CH3COONa), दुर्बल अम्ल (CH3COOH) तथा प्रबल क्षार (NaOH) से बना लवण है अतः इसका जलीय विलयन क्षारीय होगा।
प्रश्न 21.
सोडियम क्लोराइड के जलीय विलयन में विद्युत प्रवाहित करने पर कैथोड तथा एनोड पर कौनसी गैस प्राप्त होती है?
उत्तर:
सोडियम क्लोराइड (NaCl) के जलीय विलयन में विद्युत प्रवाहित करने पर कैथोड पर H2 तथा एनोड पर Cl2 गैस बनती है।
प्रश्न 22.
बेकिंग सोडा के निर्माण में प्रयुक्त समीकरण लिखिए।
उत्तर:

प्रश्न 23.
CuSO4. 5H2O का विशिष्ट नाम क्या है?
उत्तर:
CuSO4 . 5H2O को नीला थोथा (Blue vitreol) कहते हैं।
प्रश्न 24.
Na2CO3 के क्रिस्टल में कितने जल के अणु जुड़े होते हैं?
उत्तर:
Na2CO3 के क्रिस्टल में जल के 10 अणु जुड़े होते हैं।
(Na2CO3. 10H2O)

प्रश्न 25.
जिप्सम का रासायनिक नाम क्या है?
उत्तर:
जिप्सम (CaSO4 . 2H2O) का रासायनिक नाम कैल्सियम सल्फेट डाइहाइड्रेट है।
प्रश्न 26.
कैल्सियम कार्बोनेट (CaCO3) के विभिन्न रूप कौनसे हैं? लिखिए।
उत्तर:
चूना पत्थर (Lime Stone), खड़िया (Chalk) एवं संगमरमर (Marble)|
प्रश्न 27.
मधुमक्खी द्वारा डंक मारे गए अंग में किस प्रकार के दैनिक उपयोगी यौगिक का प्रयोग करने पर आराम मिलता है?
उत्तर:
मधुमक्खी द्वारा डंक मारे गए अंग में 'बेकिंग सोडा' जैसे दुर्बल क्षारक के उपयोग से आराम मिलता है।
प्रश्न 28.
संतरे में कौनसा अम्ल उपस्थित होता है?
उत्तर:
सिट्रिक अम्ल।
प्रश्न 29.
विरंजक चूर्ण का रासायनिक सूत्र लिखिए।
उत्तर:
CaOCl2
प्रश्न 30.
धोवन सोडा का जलीय विलयन अम्लीय है अथवा क्षारीय, बताइए।
उत्तर:
क्षारीय।

प्रश्न 31.
ऐसे प्राकृतिक पदार्थों के बारे में बताइए जिन्हें अम्ल एवं क्षारक सूचक के रूप में प्रयुक्त किया जा सकता है।
उत्तर:
बहुत सारे प्राकृतिक पदार्थ, जैसे-लाल पत्ता गोभी, हल्दी, हायड्रेजिया, पेटूनिया एवं जेरानियम जैसे कई फूलों की रंगीन पंखुड़ियाँ किसी विलयन में अम्ल एवं क्षारक की उपस्थिति को सूचित करने में प्रयुक्त कर सकते हैं ।
प्रश्न 32.
pH स्केल में p किस बात का सूचक है?
उत्तर:
pH स्केल में p ‘पुसांस' (Potenz) का सूचक होता है, जिसका अर्थ 'शक्ति' होता है।
प्रश्न 33.
तनुकरण किसे कहते हैं?
उत्तर:
जल में अम्ल या क्षारक मिलाने पर आयन की सान्द्रता (H2O+/OH- ) में प्रति इकाई आयतन में कमी हो जाती है। इस प्रक्रिया को तनुकरण कहते हैं।
प्रश्न 34.
क्रिस्टलन का जल से क्या अभिप्राय है?
उत्तर:
लवण के एक सूत्र इकाई में जल के निश्चित अणुओं की संख्या को क्रिस्टलन का जल कहते हैं।

लघूत्तरात्मक प्रश्न
प्रश्न 1.
निम्नलिखित में से प्रबल अम्ल एवं प्रबल क्षार है
(अ) ऐसीटिक अम्ल अथवा हाइड्रोक्लोरीन अम्ल
(ब) सोडियम हाइड्रॉक्साइड अथवा कैल्सियम हाइड्रॉक्साइड।
उत्तर:
(अ) प्रबल अम्ल - हाइड्रोक्लोरीन अम्ल (HCI)
(ब) प्रबल क्षार - सोडियम हाइड्रॉक्साइड (NaOH)।
प्रश्न 2.
pH स्केल किसे कहते हैं? स्पष्ट करो कि मुँह का pH परिवर्तन दन्त क्षय का कारण है।
उत्तर:
pH स्केल:
किसी विलयन में उपस्थित हाइड्रोजन आयन की सान्द्रता ज्ञात करने के लिए एक स्केल विकसित किया गया है, जिसे pH स्केल कहते हैं। इस pH स्केल से शून्य (अधिक अम्लता) से 14 (अधिक क्षारीय) तक pH को ज्ञात कर सकते हैं। किसी भी उदासीन विलयन का pH मान 7 होगा। यदि pH स्केल में किसी विलयन का मान 7 से कम हो तो विलयन अम्लीय होगा एवं यदि pH का मान 7 से ज्यादा हो तो विलयन क्षारीय प्रकृति का होगा। यदि मुँह में pH का मान 5.5 से कम होगा तो दन्त क्षय होना शुरू हो जाता है। मुँह में उपस्थित जीवाणु, भोजन के पश्चात् मुँह में अवशिष्ट शर्करा एवं भोज्य पदार्थों का निम्नीकरण करके अम्ल उत्पन्न करते हैं जिससे मुँह का pH 5.5 से कम हो जाता है जो दन्त क्षय का कारण बनता है।
प्रश्न 3.
जिंक की सल्फ्यूरिक अम्ल से क्रिया पर गैस x बनती है
(i) गैस x का नाम दीजिए।
(ii) अभिक्रिया का समीकरण लिखिए।
(iii) गैस x की पहचान कैसे करेंगे?
उत्तर:
(i) गैस X का नाम हाइड्रोजन (H2) गैस है।
(ii) क्रिया का समीकरण:
Zn + H2SO4 → ZnSO4 + H2 (↑) (X)
(iii) गैस x की पहचान-जलती हुई मोमबत्ती को गैस की परखनली के पास ले जाने पर यह फटफट की ध्वनि के साथ जलती है।
प्रश्न 4.
(अ) सोडियम हाइड्रॉक्साइड की जिंक धातु से होने वाली क्रिया से निकलने वाली गैस का नाम लिखिए। अभिक्रिया का समीकरण भी लिखिए।
(ब) निम्न में किसका उपयोग किया जाता है?
(i) पीने वाले जल को जीवाणुओं से मुक्त करने के लिए
(ii) रसोईघर में स्वादिष्ट खस्ता पकौड़े बनाने में
(iii) जल की स्थाई कठोरता दूर करने में
(iv) खिलौने तथा सजावट का सामान बनाने में।
उत्तर:
(अ) सोडियम हाइड्रॉक्साइड की जिंक धातु से क्रिया होने पर हाइड्रोजन (H2) गैस निकलती है।
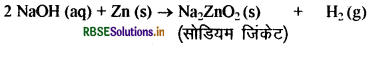
(ब)
(i) विरंजक चूर्ण का।
(ii) बेकिंग सोडा।
(iii) धोने के सोडे का।
(iv) प्लास्टर ऑफ पेरिस का।

प्रश्न 5.
स्तम्भ A से स्तम्भ B को सुमेलित कीजिए
|
A |
B |
|
(i)प्रबल अम्ल |
(a) हल्दी |
|
(ii) दुर्बल अम्ल |
(b) NH4Cl |
|
(iii)प्रति अम्ल |
(c) Na2CO3 |
|
(iv) प्रबल क्षार |
(d) मेथिल ऑरेंज |
|
(v) दुर्बल क्षार |
(e) CHCOOH |
|
(vi) उदासीन लवण |
(f) H2SO4 |
|
(vii) अम्लीय लवण |
(g) NH4OH |
|
(viii) क्षारीय लवण |
(h) मिल्क ऑफ मैग्नेशिया |
|
(ix) प्राकृतिक सूचक |
(i) NaOH |
|
(x) संश्लेषित सूचक |
(j) NaCl |
उत्तर:
|
A |
B |
|
(i) प्रबल अम्ल |
(f) H2SO4 |
|
(ii) दुर्बल अम्ल |
(e) CHCOOH |
|
(iii) प्रति अम्ल |
(h) मिल्क ऑफ मैग्नेशिया |
|
(iv) प्रबल क्षार |
(i) NaOH |
|
(v) दुर्बल क्षार |
(g) NH4OH |
|
(vi) उदासीन लवण |
(c) Na2CO3 |
|
(vii) अम्लीय लवण |
(b) NH4Cl |
|
(viii) क्षारीय लवण |
(j) NaCl |
|
(ix) प्राकृतिक सूचक |
(a) हल्दी |
|
(x) संश्लेषित सूचक |
(d) मेथिल ऑरेंज |
प्रश्न 6.
लिटमस प्राकृतिक सूचक है या कृत्रिम? श्वेत कपड़े पर लगे सब्जी के दाग पर साबुन लगाने पर वह लाल भूरा हो जाता है। क्यों?
उत्तर:
लिटमस एक प्राकृतिक सूचक है। श्वेत कपड़े पर लगे सब्जी के दाग पर साबुन लगाने पर वह लाल भूरा हो जाता है क्योंकि सब्जी में स्थित हल्दी क्षारीय साबुन से क्रिया करके लाल भूरा रंग देती है। हल्दी भी लिटमस के समान एक प्राकृतिक सूचक होती है।
प्रश्न 7.
अम्लों में अम्लीय गुणधर्म व क्षारकों में क्षारकीय गुणधर्म किसके कारण होता है?
उत्तर:
अम्ल विलयन में हाइड्रोजन आयन H+(aq) उत्पन्न करते हैं जिसके कारण उनका गुणधर्म अम्लीय होता है जबकि क्षारक, विलयन में हाइड्रॉक्साइड आयन (OH-) उत्पन्न करते हैं जिसके कारण उनका गुणधर्म क्षारकीय होता है।
प्रश्न 8.
विज्ञान की प्रयोगशाला में उपस्थित हाइड्रोक्लोरिक अम्ल (HCl), सल्फ्यूरिक अम्ल (H2SO4), नाइट्रिक अम्ल (HNO3), ऐसीटिक अम्ल (CHCOOH), सोडियम हाइड्रॉक्साइड (NaOH), कैल्सियम हाइड्रॉक्साइड [Ca(OH)2], पोटैशियम हाइड्रॉक्साइड (KOH), मैग्नीशियम हाइड्रॉक्साइड [Mg(OH)2] एवं अमोनियम हाइड्रॉक्साइड (NH4OH) में से अम्ल तथा क्षार छाँटिए। इनमें से कौन फीनॉल्पथेलीन सूचक के विलयन को गुलाबी बनाता है तथा कौन मेथिल ऑरेन्ज सूचक के पीले रंग को लाल में परिवर्तित करेगा?
उत्तर:
उपरोक्त यौगिकों में से अम्ल तथा क्षार निम्न प्रकार से हैं
अम्ल: HCI, H2SO4, HNO3, CH3COOH
क्षार: NaOH, Ca(OH)2, KOH, Mg(OH)2, NH4OH
अम्ल नीले लिटमस को लाल करते हैं तथा मेथिल ऑरेन्ज के पीले रंग को लाल में परिवर्तित करते हैं, इसके विपरीत क्षार लाल लिटमस को नीला कर देते हैं तथा फीनॉल्पथेलीन विलयन को गुलाबी बनाते हैं।

प्रश्न 9.
धातुओं की अम्ल तथा क्षार से अभिक्रिया कैसे होती है? क्या यह सभी धातु तथा सभी अम्लों से होती है? उदाहरण सहित समझाइए।
उत्तर:
धातुएँ अम्ल से क्रिया करके हाइड्रोजन गैस देती हैं तथा अम्ल के अवशिष्टों के साथ मिलकर धातु एक यौगिक बनाता है, जिसे लवण कहते हैं। अम्ल के साथ धातु की अभिक्रिया को इस प्रकार व्यक्त कर सकते हैं
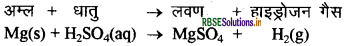
केवल सक्रिय धातुएँ ही हाइड्रोजन अम्लों से क्रिया करके H2 देती हैं। कुछ धातुएँ क्षारों से भी क्रिया करके H2 देती हैं तथा लवण भी बनाती हैं, जैसे Zn, Al इत्यादि ।
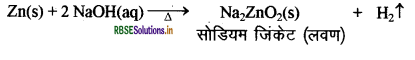
किन्तु ऐसी अभिक्रियाएँ सभी धातुओं के साथ सम्भव नहीं हैं।
प्रश्न 10.
'ऐन्टैसिड' (antacid) क्या होता है? उदाहरण दीजिए।
उत्तर:
ऐसे क्षारक जिनका उपयोग उदर में अम्ल की आधिक्य मात्रा को उदासीन करने में किया जाता है ऐन्टैसिड कहलाते है।
उदाहरण:
ऐलुमिनियम, कैल्सियम, मैग्नीशियम व सोडियम के बाइकार्बोनेट्स।
प्रश्न 11.
धातु कार्बोनेट (NaCO3) तथा धातु हाइड्रोजन कार्बोनेट (NaHCO3) की तन HCI से क्रिया करवाने पर कौनसी गैस बनती है तथा इसे चूने के पानी में प्रवाहित करने पर क्या होगा? समीकरण सहित समझाइए।
उत्तर:
धातु कार्बोनेट तथा धातु हाइड्रोजन कार्बोनेट को तनु HCl से क्रिया करवाने पर CO2 गैस निकलती है तथा लवण व जल बनता है।
Na2CO3(s) + 2HCl(aq) → 2NaCl(aq) + H2O(l) + CO2(g)
NaHCO3(s)+ HCl(aq)→ NaCl(aq) + H2O(l) + CO2(g)
प्राप्त CO2 गैस को चूने के पानी में प्रवाहित करने पर CaCO3 का श्वेत अवक्षेप बनता है तथा अत्यधिक मात्रा में CO2 गैस प्रवाहित करने पर कैल्सियम हाइड्रोजन कार्बोनेट [Ca(HCO3)2] बनने के कारण विलयन पुनः रंगहीन हो जाता है।

प्रश्न 12.
धात्विक ऑक्साइड की प्रकृति अम्लीय होती है या क्षारीय? इनकी अम्ल से क्रिया कराने पर क्या होगा? उदाहरण सहित बताइए।
उत्तर:
धात्विक ऑक्साइड सामान्यतः क्षारीय प्रकृति के होते हैं। ये अम्लों से क्रिया करके लवण व जल बनाते हैं, जैसे-धातु ऑक्साइड + अम्ल → लवण + जल

क्षारक एवं अम्ल की अभिक्रिया के समान ही धात्विक ऑक्साइड अम्ल के साथ अभिक्रिया करके लवण व जल बनाते हैं। अतः धात्विक ऑक्साइड को क्षारकीय ऑक्साइड भी कहते हैं।

प्रश्न 13.
CO2 जो कि कार्बन (अधातु) का ऑक्साइड है, क्षारक Ca(OH)2 से क्रिया करके लवण व जल बनाता है। इससे क्या सिद्ध होता है?
उत्तर:
CO2 (कार्बन डाइऑक्साइड) Ca(OH)2 क्षारक से क्रिया करके लवण व जल बनाता है। इससे यह सिद्ध होता है कि यह अम्लीय प्रकृति का है। यह क्षारक एवं अम्ल के बीच होने वाली अभिक्रिया के समान है। अतः अधातुओं के ऑक्साइड अम्लीय प्रकृति के होते हैं।
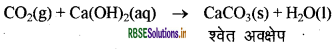
प्रश्न 14.
यदि आपके परिवार का कोई सदस्य अत्यधिक भोजन करने के कारण अम्लता से पीड़ित है तो आप कौन सा उपचार सुझाएँगे?
उत्तर:
हमारा उदर हाइड्रोक्लोरिक अम्ल (HCl) उत्पन्न करता है। यह उदर को हानि पहुँचाए बिना भोजन के पाचन में सहायक होता है। अपच की स्थिति में उदर अत्यधिक मात्रा में अम्ल उत्पन्न करता है जिसके कारण उदर में दर्द एवं जलन का अनुभव होता है जिसे अम्लता (acidity) कहते है। इस दर्द से मुक्त होने के लिए ऐन्टैसिड (antacid) जैसे क्षारकों का उपयोग किया जाता है जो अम्ल की आधिक्य मात्रा को उदासीन करता है। इसके लिए मैग्नीशियम हाइड्रॉक्साइड (मिल्क ऑफ मैग्नीशिया) जैसे दुर्बल क्षारक का उपयोग किया जाता है।
प्रश्न 15.
अम्ल तथा क्षारक को परिभाषित कीजिए तथा उदाहरण भी दीजिए।
उत्तर:
अम्ल वे पदार्थ हैं जो जलीय विलयन में H+ या H3O+ देते हैं | जलीय विलयन में H+ स्वतंत्र नहीं रहता। यह H2O से क्रिया करके H3O+ बना लेता है | H+ के कारण ही इनका गुणधर्म अम्लीय होता है। जैसे - HCI, HNO3 इत्यादि।
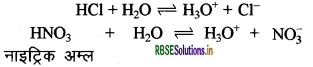
क्षारक वे पदार्थ हैं जो जलीय विलयन में OH- (हाइड्रॉक्साइड) आयन देते हैं। सभी क्षारक जल में घुलनशील नहीं होते हैं | जल में घुलनशील क्षारक को क्षार कहते हैं। इनका स्वाद कड़वा तथा स्पर्श साबुन की तरह होता है तथा इनकी प्रकृति संक्षारक (Corrosive) होती है। जैसे - NaOH, KOH इत्यादि ।
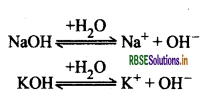
प्रश्न 16.
pH स्केल किसे कहते हैं? इससे किसी विलयन की अम्लीय या क्षारकीय प्रकृति किस प्रकार ज्ञात होती है? समझाइए।
उत्तर:
pH स्केल - किसी विलयन में उपस्थित हाइड्रोजन आयन की सान्द्रता ज्ञात करने के लिए एक स्केल विकसित किया गया, जिसे pH स्केल कहते हैं। इसमें p एक जर्मन शब्द ‘पुसांस' (Potenz.) से बना है, जिसका अर्थ शक्ति होता है।
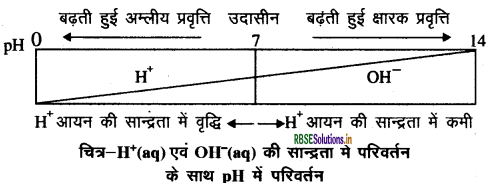
इस pH स्केल से शून्य (अधिक अम्लता) से चौदह (अधिक क्षारीय) तक pH को ज्ञात कर सकते हैं। साधारणतः pH को ऐसी संख्या के रूप में देखते हैं, जो किसी विलयन की अम्लता अथवा क्षारकीयता को दर्शाती है। हाइड्रोनियम आयन की सान्द्रता जितनी अधिक होगी, उसका pH उतना ही कम होगा।
किसी भी उदासीन विलयन का pH मान 7 होगा । यदि pH स्केल में किसी विलयन का मान 7 से कम है तो यह अम्लीय विलयन होगा एवं यदि pH मान 7 से 14 तक बढ़ता है तो वह विलयन में OH- की सान्द्रता में वृद्धि को दर्शाता है अर्थात् यह क्षारीय प्रवृत्ति को प्रदर्शित करेगा।

प्रश्न 17.
अम्ल एवं क्षारक की शक्ति किस पर निर्भर करती है? प्रबल एवं दुर्बल अम्ल तथा प्रबल एवं दुर्बल क्षारक से क्या अभिप्राय है?
उत्तर:
अम्ल एवं क्षारक की शक्ति विलयन (जल) में क्रमशः H+ आयन तथा OH- आयन की संख्या पर निर्भर करती है।
प्रबल एवं दुर्बल अम्ल:
जलीय विलयन में अधिक मात्रा में H+ आयन उत्पन्न करने वाले अम्ल, प्रबल अम्ल कहलाते हैं, जैसे- हाइड्रोक्लोरिक अम्ल (HCl); जबकि कम H+ आयन उत्पन्न करने वाले अम्ल, दुर्बल अम्ल कहलाते हैं, जैसे - ऐसीटिक अम्ल [CH3COOH] |
प्रबल एवं दुर्बल क्षारक:
जलीय विलयन में अधिक मात्रा में OH- आयन देने वाले क्षारक, प्रबल क्षारक कहलाते हैं, जैसे - NaOH,KOH आदि; जबकि कम मात्रा में OH- आयन उत्पन्न करने वाले क्षारक, दुर्बल क्षारक कहलाते हैं, जैसे - NH4OH, Ca(OH)2 आदि।
प्रश्न 18.
प्राकृतिक स्रोतों से प्राप्त होने वाले कुछ प्राकृतिक अम्लों की सूची लिखिए।
उत्तर:
प्राकृतिक स्रोतों से प्राप्त होने वाले अम्ल अग्र प्रकार से हैं -
|
प्राकृतिक स्रोत |
प्राप्त अम्ल |
|
(1) सिरका |
ऐसीटिक अम्ल |
|
(2) संतरा |
सिट्रिक अम्ल |
|
(3) इमली |
टार्टरिक अम्ल |
|
(4) टमाटर |
ऑक्सैलिक अम्ल |
|
(5) खट्टा दूध (दही) |
लैक्टिक अम्ल |
|
(6) नींबू |
सिट्रिक अम्ल |
|
(7) चींटी का डंक |
मेथेनॉइक अम्ल |
|
(8) नेटल का डंक |
मेथेनॉइक अम्ल |
प्रश्न 19.
विभिन्न लवणों के विलयन की PH भिन्न - भिन्न होती है, क्यों? निम्नलिखित लवणों के विलयन की pH बताइए तथा यह भी बताइए कि ये किस अम्ल तथा किस क्षार से मिलकर बने हैं? सोडियम क्लोराइड, पोटैशियम नाइट्रेट, जिंक सल्फेट, कॉपर सल्फेट, सोडियम ऐसीटेट एवं सोडियम हाइड्रोजन कार्बोनेट।
उत्तर:
विभिन्न लवणों के विलयनों की pH भिन्न - भिन्न होती है क्योंकि उनकी जल से क्रिया द्वारा भिन्न - भिन्न प्रबलता के अम्ल एवं क्षार बनते हैं। प्रबल अम्ल तथा प्रबल क्षारक से बने लवण के विलयन की pH का मान 7 होता है जबकि प्रबल अम्ल तथा दुर्बल क्षारक से बने लवण के विलयन की pH का मान 7 से कम तथा प्रबल क्षारक एवं दुर्बल अम्ल से बने लवण के विलयन की pH का मान 7 से अधिक होता है।
दिए गए लवणों का pH मान, विलयन की प्रकृति तथा लवण बनाने में उपयोगी अम्ल व क्षार निम्न प्रकार से हैं -
|
लवण |
प्रयुक्त अम्ल |
प्रयुक्त क्षारक |
pH |
विलयन की प्रकृति |
|
1. सोडियम क्लोराइड (NaCl) |
HCl |
NaOH |
7 |
उदासीन |
|
2. पोटेशियम नाइट्रेट (KNO3) |
HNOS3 |
KOH |
7 |
उदासीन |
|
3. जिंक सल्फेट (ZnSO4) |
H2SO4 |
Zn(OH)2 |
7 से कम |
अम्लीय |
|
4. कॉपर सल्फेट (CuSO4) |
H2SO4 |
Cu(OH)2 |
7 से कम |
अम्लीय |
|
5. सोडियम ऐसीटेट (CH3COONa) |
CH3COOH |
NaOH |
7 से अधिक |
क्षारीय |
|
6. सोडियम हाइड्रोजन कार्बोनेट (NaHCO3) |
H2CO3 |
NaOH |
7 से अधिक |
क्षारीय |
प्रश्न 20:
दंत क्षय के कारण को स्पष्ट करते हुए इससे बचाव के दो उपाय बताइए।
उत्तर:
दाँतों का इनैमल (दन्तवल्क) कैल्सियम हाइड्रोक्सीएपेटाइट से बना होता है जो कि शरीर का सबसे कठोर पदार्थ है। यह जल में नहीं घुलता लेकिन मुँह की pH का मान 5.5 से कम होने पर यह संक्षारित हो जाता है। मुँह में उपस्थित जीवाणु (बैक्टीरिया) भोजन के पश्चात् मुँह में अवशिष्ट शर्करा एवं खाद्य पदार्थों का निम्नीकरण करके अम्ल उत्पन्न करते हैं जिससे मुँह का pH 5.5 से कम हो जाता है और दंत - क्षय प्रारम्भ हो जाता है।
बचाव के उपाय:
- भोजन के बाद मुँह साफ करने से इससे बचाव किया जा सकता है।
- मुँह की सफाई के लिए क्षारकीय दंत-मंजन का उपयोग करने से अम्ल की आधिक्य मात्रा को उदासीन किया जा सकता है।
प्रश्न 21.
क्लोराइड परिवार, नाइट्रेट परिवार, सल्फेट परिवार के चार - चार लवण लिखिए।
उत्तर:
(1) क्लोराइड परिवार के लवण
(i) NaCl सोडियम क्लोराइड
(ii) पोटेशियम क्लोराइड (KCI)
(iii) MgCl2 मैग्नीशियम क्लोराइड
(iv) अमोनियम क्लोराइड (NH4CI)
(2) नाइट्रेट परिवार के लवण:
(i) KNO3 पोटेशियम नाइट्रेट
(ii) NaNO3 सोडियम नाइट्रेट
(iii) Ca(NO3)2 कैल्सियम नाइट्रेट
(iv) NH4NO3 अमोनियम नाइट्रेट
(3) सल्फेट परिवार के लवण:
(i) K2SO, पोटेशियम सल्फेट
(ii) Na2SO4 सोडियम सल्फेट
(iii) Mg.SO4 मैग्नीशियम सल्फेट
(iv) CuSO4 कॉपर सल्फेट

प्रश्न 22.
'क्लोर-क्षार प्रक्रिया' किसे कहते हैं? समीकरण सहित समझाइए तथा इससे बने उत्पादों के उपयोग भी लिखिए।
उत्तर:
क्लोर - क्षार प्रक्रिया - सोडियम क्लोराइड के जलीय विलयन (लवण जल) से विद्युत प्रवाहित करने पर यह वियोजित होकर सोडियम हाइड्रॉक्साइड (NaOH) उत्पन्न करता है। इस प्रक्रिया को 'क्लोर - क्षार प्रक्रिया' कहते हैं क्योंकि इससे निर्मित उत्पाद - क्लोरीन (क्लोर) एवं सोडियम हाइड्रॉक्साइड (क्षार) होते हैं।
2NaCl(aq) + 2H2O(l) → 2NaOH(aq) + Cl2(g) + H2(g)
क्लोरीन गैस ऐनोड पर मुक्त होती है एवं हाइड्रोजन गैस कैथोड पर । कैथोड पर सोडियम हाइड्रॉक्साइड विलयन का निर्माण भी होता है। इस प्रक्रिया से उत्पन्न हुए तीनों उत्पाद H2,Cl2 तथा NaOH के विभिन्न उपयोग हैं | H2 गैस ईंधन, मार्गरीन, खाद के लिए तथा NH3 बनाने के लिए प्रयुक्त होती है।
Cl2 गैस जल की स्वच्छता में तथा पी.वी.सी., रोगाणुनाशक, सी.एफ.सी. तथा कीटाणुनाशक बनाने में प्रयुक्त होती है।
NaOH धातुओं से ग्रीस हटाने के लिए, कृत्रिम फाइबर, साबुन तथा अपमार्जक बनाने में प्रयुक्त होता है | H2 तथा Cl2 की क्रिया से बना HCI (हाइड्रोक्लोरिक अम्ल) इस्पात की सफाई में, अमोनियम क्लोराइड औषधियाँ तथा सौन्दर्य प्रसाधन बनाने में प्रयुक्त होता है। NaOH तथा Cl2 की क्रिया से विरंजक चूर्ण बनता है जिसे वस्त्र आदि के विरंजन में प्रयुक्त करते हैं।
प्रश्न 23.
क्रिस्टलन जल किसे कहते हैं? क्रिस्टलन जल युक्त यौगिकों के दो उदाहरण दीजिए। ऐसे यौगिकों को गर्म करने पर क्या होता है?
उत्तर:
क्रिस्टलन जल - लवण के एक सूत्र इकाई में जल के निश्चित अणुओं की संख्या को क्रिस्टलन जल कहते हैं।
उदाहरण:
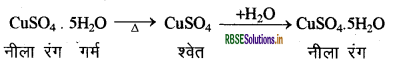
(1) CuSO4.5H2O (क्रिस्टलीय कॉपर सल्फेट - नीला रंग) - इसको गर्म करने पर इसमें से जल के अणु निकल जाते हैं तथा यह रंगहीन (श्वेत) हो जाता है। इसमें जल डालने पर यह पुनः नीले रंग का हो जाता है।
(2) Na2CO3 . 10H2O (धोने का सोडा) - इसको गर्म करने पर भी इसमें से जल के अणु बाहर निकल जाते हैं।
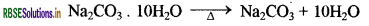
प्रश्न 24.
प्लास्टर ऑफ पेरिस क्या होता है? इसे किस प्रकार बनाते हैं तथा इसके उपयोग क्या हैं? अथवा प्लास्टर ऑफ पेरिस का रासायनिक सूत्र एवं इसकी जल के साथ रासायनिक अभिक्रिया को लिखिए।
उत्तर:
CaSO4.\(\frac{1}{2}\) H2O को प्लास्टर ऑफ पेरिस कहते हैं।
निर्माण:
जिप्सम को 373 K पर गर्म करने पर यह जल के अणुओं का त्याग कर कैल्सियम सल्फेट अर्धहाइड्रेट/हेमिहाइड्रेट (CaSO4.\(\frac{1}{2}\) H2O) बनाता है। इसे प्लास्टर ऑफ पेरिस कहते हैं। इसका उपयोग टूटी हुई हड्डियों को सही जगह पर स्थिर रखने के लिए किया जाता है। प्लास्टर ऑफ पेरिस एक सफेद चूर्ण है, जो जल मिलाने पर पुनः जिप्सम बनकर कठोर ठोस पदार्थ बन जाता है।
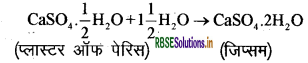
इसमें जल का केवल आधा अणु क्रिस्टलन के जल के रूप में जुड़ा होता है। इसमें CaSO4 का दो इकाई सूत्र जल के एक अणु के साथ साझेदारी करता है। अन्य उपयोग: प्लास्टर ऑफ पेरिस का उपयोग खिलौना बनाने, सजावट का सामान एवं सतह को चिकना बनाने के लिए भी किया जाता है।
प्रश्न 25.
अम्ल व क्षार में कोई दो अन्तर लिखिए।
उत्तर:
अम्ल एवं क्षार में अन्तर -
|
अम्ल |
क्षार |
|
1. यह स्वाद में खट्टे होते हैं। |
यह स्वाद में तीखे व कड़वे होते हैं। |
|
2. यह नीले लिटमस को लाल कर देते हैं। |
यह लाल लिटमस को नीला कर देते हैं। |
प्रश्न 26.
कैल्सियम सल्फेट अर्धहाइड्रेट को प्लास्टर ऑफ पेरिस क्यों कहा जाता है? .
उत्तर:
प्राचीन समय में पेरिस के निकट जिप्सम से बड़ी मात्रा में कैल्सियम सल्फेट अर्धहाइड्रेट का निर्माण किया जाता था इसलिए इसे प्लास्टर ऑफ पेरिस के नाम से भी जाना जाता है।

प्रश्न 27.
विरंजक चूर्ण का सूत्र एवं दो उपयोग लिखिए।
उत्तर:
विरंजक चूर्ण का सूत्र CaOCl2 होता है।
उपयोग:
- प्रमुख उपयोग विरंजक के रूप में।
- पीने के पानी के शुद्धिकरण में ।
प्रश्न. 28.
धावन सोडा का रासायनिक सूत्र व दो उपयोग लिखिए।
उत्तर:
धावन सोडा का रासायनिक सूत्र NaCO3. 10H2O होता है।
उपयोग:
- जल की स्थायी कठोरता को हटाने में।
- बोरेक्स जैसे सोडियम यौगिक के उत्पादन में।
प्रश्न 29.
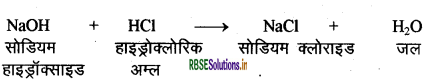
अम्ल एवं क्षारक के बीच की रासायनिक अभिक्रिया को उदासीनीकरण अभिक्रिया कहते हैं। क्यों? एक उदाहरण दें।
उत्तर:
अम्ल एवं क्षारक के बीच की रासायनिक अभिक्रिया से लवण तथा जल बनते हैं अर्थात् दोनों एक - दूसरे को उदासीन कर देते हैं। इसीलिए अम्ल व क्षारक के बीच की अभिक्रिया उदासीनीकरण अभिक्रिया कहलाती है।
उदाहरण:
प्रश्न 30.
लिटमस क्या है? लिखिए।
उत्तर:
लिटमस - यह एक प्राकृतिक सूचक है। इसे थैलोफाइटा समूह के लाइकेन/लिचेन (lichen) पौधे से निकाला जाता है। लिटमस विलयन जब न तो अम्लीय होता है और न ही क्षारकीय, तब यह बैंगनी रंग का होता है। इसे प्रायः अम्ल - क्षारक सूचक की तरह उपयोग किया जाता है।
प्रश्न 31.
गंधीय सूचक किसे कहते हैं?
उत्तर:
गंधीय सूचक - ऐसे पदार्थ, जिनकी गंध अम्लीय या क्षारकीय माध्यम में बदल जाती है, उन्हें गंधीय (Olfactory) सूचक कहते हैं। बारीक कटी प्याज, लौंग का तेल तथा तनु वैनिला एसेंस का गंधीयसूचक की तरह उपयोग किया जाता है।
प्रश्न 32.
नेटल के विषय में लिखिए।
उत्तर:
नेटल एक शाकीय पादप है, जो जंगलों में उपजता है। इसके पत्तों में डंकनुमा बाल होते हैं, जो अगर गलती से छ जाएँ तो डंक जैसा दर्द होता है। इन बालों में मेथेनॉडक अम्ल का स्राव होने के कारण यह दर्द होता है। पारंपरिक तौर पर इसका इलाज डंक वाले स्थान पर डॉक पौधे की पत्ती रगड़कर किया जाता है। चूँकि डॉक की पत्ती के रस की प्रकृति क्षारीय होती है। यह अम्ल के प्रभाव को समाप्त कर देता है और पीड़ा दूर हो जाती है। ये पौधे अधिकतर नेटल के पास ही पैदा होते हैं।

प्रश्न 33.
हाइड्रोजन आयन की सान्द्रता ज्ञात करने में प्रयुक्त स्केल का नाम लिखिए। अम्लीय वर्षा का कारण व इसके दो कुप्रभावों को लिखिए।
उत्तर:
(1) हाइड्रोजन आयन की सान्द्रता ज्ञात करने में प्रयुक्त स्केल को pH स्केल कहते हैं।
(2) अस्लीय वर्षा - जब वर्षा के जल की pH का मान 5.6 से कम हो जाता है, तब वह अम्ल वर्षा कहलाती है।
कुप्रभाव:
(i) अम्लीय वर्षा का जल जब नदी में प्रवाहित होता है तो नदी के जल का pH मान भी कम हो जाता है। ऐसी नदी में जलीय जीवधारियों की उत्तरजीविता कठिन हो जाती है।
(ii) अम्लीय वर्षा के सम्पर्क में आने पर चर्म रोग हो सकता है।
प्रश्न 34.
'खनिज नमक' किसे कहते हैं? यह साधारण नमक से किस प्रकार भिन्न है?
उत्तर:
विश्व के कई भागों में ठोस लवणों का निक्षेप पाया जाता है। इनमें बड़े आकार के क्रिस्टल पाये जाते हैं जो प्रायः अपद्रव्यों.के कारण भूरे रंग के होते हैं। इसे खनिज नमक कहते हैं। साधारण नमक (सोडियम क्लोराइड) में अपद्रव्यों का अभाव होता है इसलिए श्वेत. रंग के क्रिस्टल के रूप में होता है जबकि खनिज नमक में अपद्रव्य पाए जाते हैं इसलिए क्रिस्टल भूरे रंग के होते हैं।
निबन्धात्मक प्रश्न
प्रश्न 1.
विरंजक चूर्ण (CaOCl2), बेकिंग सोडा (NaHCO3) तथा धोने का सोडा (Na2CO3.10H2O) के बनाने की विधि (निर्माण) तथा उपयोग बताइए।
उत्तर:
(1) विरंजक चूर्ण (CaOCl2):
शुष्क बुझा हुआ चूना [Ca(OH)2] पर क्लोरीन की क्रिया से विरंजक चूर्ण का निर्माण होता है। विरंजक चूर्ण को CaOCl2 से दर्शाया जाता है यद्यपि वास्तविक संगठन काफी जटिल होता है।
Ca(OH)2 + Cl2 → CaOCl + H2O
विरंजक चूर्ण का उपयोग:
(i) वस्त्र उद्योग में सूती एवं लिनेन के विरंजन में, कागज की फैक्ट्री में लकड़ी के मज्जा एवं लाउंड्री में साफ कपड़ों के विरंजन के लिए।
(ii) कई रासायनिक उद्योगों में एक उपचायक के रूप में।
(iii) पीने वाले जल को जीवाणुमुक्त करने के लिए रोगाणुनाशक के रूप में।
(2) बेकिंग सोडा (NaHCO3):
NaCl की NH3 तथा CO2 गैस से क्रिया द्वारा NaHCO का निर्माण किया जाता है।
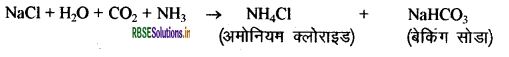
NaHCO3 को सोडियम हाइड्रोजन कार्बोनेट कहते हैं। यह एक दुर्बल असंक्षारक क्षारक है। खाना पकाते समय इसे गर्म करने पर निम्न अभिक्रिया होती है

बेकिंग सोडा (NaHCO3) के उपयोग:
(i) बेकिंग पाउडर बनाने में, जो बेकिंग सोडा (सोडियम हाइड्रोजनकार्बोनेट) एवं टार्टरिक अम्ल का मिश्रण है। जब बेकिंग पाउडर को गर्म किया जाता है या जल में मिलाया जाता है तो निम्न अभिक्रिया होती है
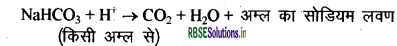
इस अभिक्रिया में उत्पन्न कार्बन डाइऑक्साइड के कारण पावरोटी या केक में खमीर उठ (फूल) जाता है तथा इससे यह मुलायम एवं स्पंजी हो जाता है।
(ii) सोडियम हाइड्रोजनकार्बोनेट भी ऐन्टैसिड का एक संघटक है। क्षारीय होने के कारण यह पेट में अम्ल की अधिकता को उदासीन करके राहत पहुंचाता है।
(iii) इसका उपयोग सोडा-अम्ल अग्निशामक में भी किया जाता है।
(3) धोने का सोडा (Na2CO3 . 10H2O):
इसे सोडियम क्लोराइड से प्राप्त किया जाता है। बेकिंग सोडा को गर्म करके सोडियम कार्बोनेट प्राप्त किया जा सकता है। सोडियम कार्बोनेट के पुनः क्रिस्टलीकरण से धोने का सोडा प्राप्त होता है। यह भी एक क्षारकीय लवण है।
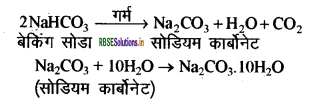
धोने के सोडे के उपयोग:
(i) सोडियम कार्बोनेट का उपयोग काँच, साबुन एवं कागज उद्योगों में होता है।
(ii) इसका उपयोग बोरेक्स (Na2B4O7) के उत्पादन में होता है।
(iii) सोडियम कार्बोनेट का उपयोग घरों में साफ - सफाई के लिए होता है।
(iv) जल की स्थायी कठोरता को दूर करने के लिए इसका उपयोग होता है।

प्रश्न 2.
दैनिक जीवन में pH के महत्त्व का विवेचन कीजिए।
उत्तर:
दैनिक जीवन में pH का महत्त्व - किसी विलयन में उपस्थित हाइड्रोजन आयन की सान्द्रता ज्ञात करने के लिए एक स्केल विकसित किया गया, जिसे pH स्केल कहते हैं। इस pH में p 'पुसांस' (Potenz) का सूचक होता है, जिसका अर्थ है शक्ति | pH स्केल से सामान्यतः शून्य (अधिक अम्लता) से चौदह (अधिक क्षारीय) तक pH को ज्ञात कर सकते हैं। हमारे दैनिक जीवन में pH का महत्त्व निम्न प्रकार से है -
(1) पौधे एवं पशु pH के प्रति संवेदनशील होते हैं:
हमारा शरीर 7.0 से 7.8 pH परास के बीच कार्य करता है। जीवित प्राणी केवल निश्चित pH परास में ही जीवित रह सकते हैं। वर्षा के जल की pH मान जब 5.6 से कम हो जाती है तो वह अम्लीय वर्षा कहलाती है। अम्लीय वर्षा का जल जब नदी में प्रवाहित होता है तो नदी के जल के pH का मान कम हो जाता है। ऐसी नदी में जलीय जीवधारियों का जीवन कठिन हो जाता है।
(2) उपज में महत्त्व:
अच्छी उपज के लिए पौधों को एक विशिष्ट pH परास की आवश्यकता होती है। अतः विभिन्न स्थानों की मिट्टी की pH ज्ञात करके उसके अनुसार उसका उपचार किया जाता है। जब मिट्टी अधिक अम्लीय होती है तो उसमें चूना मिलाया जाता है तथा मिट्टी के क्षारीय होने पर उसमें कोई अम्लीय पदार्थ मिलाकर उचित pH पर लाया जाता है।
(3) पाचन तंत्र में महत्त्व:
हमारे पाचन तंत्र में भी pH का बहुत महत्त्व होता है। हमारा उदर हाइड्रोक्लोरिक अम्ल HCI उत्पन्न करता है। यह उदर को हानि पहुँचाए बिना भोजन के पाचन में सहायक होता है। अपच की स्थिति में उदर अत्यधिक मात्रा में अम्ल उत्पन्न करता हैं, जिसके कारण उदर में दर्द एवं जलन का अनुभव होता है। इसके लिए ऐन्टैसिड (antacid) जैसे क्षारकों का उपयोग किया जाता है। यह ऐन्टैसिड अम्ल की आधिक्य मात्रा को उदासीन करता है। इसके लिए मैग्नीशियम हाइड्रॉक्साइड (मिल्क ऑफ मैगनीशिया) जैसे दुर्बल क्षारक का उपयोग किया जाता है।
(4) pH परिवर्तन के कारण दंत - क्षय:
मुँह के pH का मान 5.5 से कम होने पर दाँतों का क्षय प्रारम्भ हो जाता है। दाँतों का इनैमल कैल्सियम फॉस्फेट से बना होता है जो कि शरीर का सबसे कठोर पदार्थ है। यह जल में नहीं घुलता लेकिन मुँह की pH का मान 5.5 से कम होने पर इसका संक्षारण हो जाता है। मुँह में उपस्थित बैक्टीरिया, भोजन के पश्चात् मुँह में अवशिष्ट शर्करा एवं खाद्य पदार्थों का निम्नीकरण करके अम्ल उत्पन्न करते हैं। भोजन के बाद मुँह साफ करने से इससे बचा जा सकता है। मुँह की सफाई के लिए क्षारकीय दंत - मंजन का उपयोग करने से अम्ल की आधिक्य मात्रा को उदासीन किया जा सकता है और दंत क्षय को रोका जा सकता है।
(5) पशुओं एवं पौधों द्वारा उत्पन्न रसायनों से आत्मरक्षा:
मधुमक्खी का डंक एक अम्ल छोड़ता है जिसके कारण दर्द एवं जलन का अनुभव होता है। डंक मारे गए अंग में बेकिंग सोडा जैसे दुर्बल क्षारक का उपयोग करने से आराम मिलता है। नेटल (nettle) के डंक वाले बाल मेथैनॉइक अम्ल छोड़ जाते हैं जिनके कारण दर्द का अनुभव होता है। पारंपरिक तौर पर इसका इलाज डंक वाले स्थान पर डॉक पौधे की पत्ती रगड़कर किया जाता है।

प्रश्न 3.
धातु कार्बोनेट तथा धातु हाइड्रोजन कार्बोनेट की अम्ल के साथ अभिक्रिया को नामांकित चित्र द्वारा दर्शाइए तथा उपरोक्त अभिक्रिया के रासायनिक समीकरण भी लिखिए।
उत्तर:
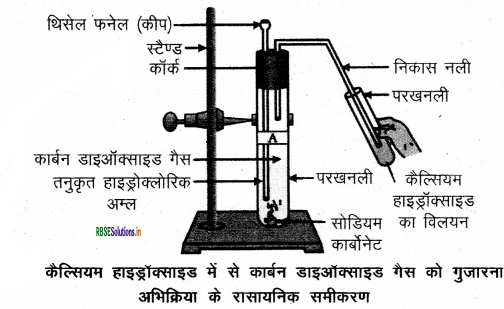
(i) Na2CO3(s)+ 2HCl(aq) → 2NaCl(aq) + H2O(l) + CO2 (g)
(ii) NaHCO3(s) + HCl(aq) → NaCl(aq) + H2O(1) + CO2 (g)
