RBSE Solutions for Class 12 Chemistry Chapter 9 उपसहसंयोजन यौगिक
Rajasthan Board RBSE Solutions for Class 12 Chemistry Chapter 9 उपसहसंयोजन यौगिक Textbook Exercise Questions and Answers.
RBSE Class 12 Chemistry Solutions Chapter 9 उपसहसंयोजन यौगिक
RBSE Class 12 Chemistry उपसहसंयोजन यौगिक InText Questions and Answers
प्रश्न 1.
निम्नलिखित उपसहसंयोजन यौगिकों के सूत्र लिखिए:
1. टेदाऐग्मीनडाइएक्वाकोबाल्ट (III) क्लोराइड
2. पोटैशियम टेट्रासायनोनिकिलेट (II)
3. ट्सि (एथेन-1, 2-डाइऐमीन) क्रोमियम (II) क्लोराइड
4. ऐम्मीनब्रोमिडोक्लोरिडोनाइटिटो-N-प्लैटिनेट (II)
5. डाइक्लोरोबिस (एथेन-1, -डाइऐमीन) प्लैटिनम (Iv) नाइट्रेट
6. आयरन (III) हेक्सोसायनोफेरेट (II)
उत्तर:
- [CO(NH3)4(H2O)2]Cl3
- K2[Ni(CN)4]
- [Cr(en)3]Cl3
- [Pt(NH3) BrCI(NO2)]-
- [PtCl2(en)2](NOH)2
- Fe4[Fe(CN)6]3
प्रश्न 2.
निम्नलिखित उपसहसंयोजन यौगिकों के IUPAC नाम लिखिए:
1. [CO(NH3)6]Cl3
2. [CO(NH3)5 Cl]Cl2
3. K3[Fe(CN)6]
4. K3[Fe(C2O4)3]
5. K2[PdCl4]
6. [Pt(NH3)2 Cl (NH2CH3)]Cl
उत्तर:
- हेक्साऐम्मीनकोबाल्ट (III) क्लोराइड
- पेण्टाऐम्मीनक्लोरिडोकोबाल्ट (III) क्लोराइड
- पोटैशियम हेक्सासायनोफेरेट (III)
- पोटैशियम ट्राइऑक्सेलेटोफेरेट (III)
- पोटैशियम टेट्राक्लोरिडोपैलेडेट (II)
- डाइऐम्मीनक्लोरिडो (मेथिलऐमीन) प्लैटिनम (II)
- क्लोराइड।

प्रश्न 3.
निम्नलिखित संकुलों द्वारा प्रदर्शित समावयवता का प्रकार बतलाइए तथा इन समावयवों की संरचना बनाइए:
1. K[Cr(H2O)2(C2O4)2]
2. [Co(en)3]Cl3
3. [CO(NH3)5(NO2)](NO3)2
4. [Pt(NH3)(H2O)Cl2]
उत्तर:
(i) K[Cr(H2O)2(C2O4)2] द्वारा प्रदर्शित समावयवता: (a) यह संकुल ज्यामितीय समावयवता प्रदर्शित करता है। इसमें इसके दो संमावयवी समपक्ष व विपक्ष होते हैं।
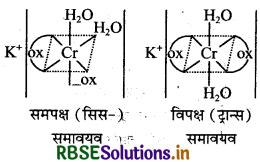
(b) सिस या समपक्ष समावयवी के दो प्रकाशिक समावयवी (d तथा l ) होते हैं, ट्रान्स या विपक्ष समावयवी प्रकाशिक समावयवता प्रदर्शित नहीं करता है।
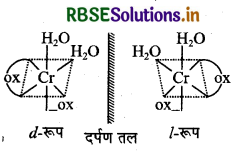
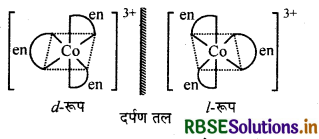
(ii) [Co(en)3]Cl3 संकुल प्रकाशिक समावयवता प्रदर्शित करते हैं। इसके d तथा l दो समावयव होते हैं।
(iii) [CO(NH3)5 (NO5)] (NO3)2 संकुल आयनन तथा बन्धनी समावयवता को प्रदर्शित करता है।
(a) आयनन समावयवता:
[CO(NH3)5 (NO5)] (NO3)2
तथा [Co(NH3)5(ONO)](NO3)2 (NO)
(b) बन्धनी समावयवता
\(\left[\mathrm{Co}\left(\mathrm{NH}_3\right)_5\left(\mathrm{NO}_2\right)\right]\left(\mathrm{NO}_3\right)_2\)
तथा \(\left[\mathrm{Co}\left(\mathrm{NH}_3\right)_5(\mathrm{ONO})\right]\left(\mathrm{NO}_3\right)_2\)
(iv) [Pt(NH3)(H2O)Cl2] संकुल ज्यामितीय समावयवता प्रदर्शित करता है।
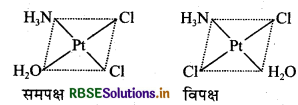
प्रश्न 4.
इसका प्रमाण दीजिए कि
[CO(NH3)5CI]SO4 तथा [Co(NH3)5 SO4]Cl आयनन समावयव हैं।
उत्तर:
आयनन समावयव जल में घुलकर भिन्न आयन देते हैं, इसलिए विभिन्न अभिकर्मकों से भिन्न-भिन्न अभिक्रियाएँ करते हैं। अतः ये दोनों समावयव भी भिन्न-भिन्न अवक्षेप भिन्न-भिन्न अभिकर्मक के साथ देंगे।

प्रश्न 5.
संयोजकता आबन्ध सिद्धान्त के आधार पर समझाइए कि वर्ग समतलीय संरचना वाला |Ni(CN)4]2- आयन प्रतिचुम्बकीय है तथा चतुष्फलकीय ज्यामिति वाला [NiCl4]2- आयन अनुचुम्बकीय है।
उत्तर:
[Ni(CN)4]2- का चुम्बकीय व्यवहार
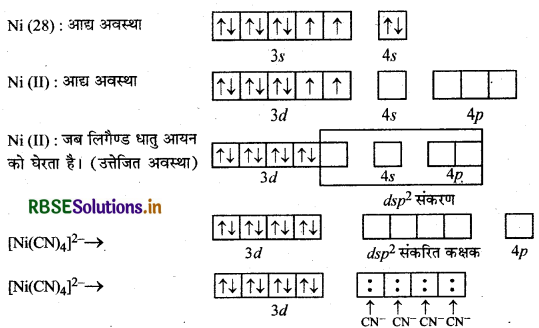
उपर्युक्त संकुल [Ni(CN)4]2- में कोई भी अयुग्मित इलेक्ट्रॉन नहीं है अत: यह प्रतिचुम्बकीय है।
[NiCl4]2- का चुम्बकीय व्यवहार: इसमें Cl- एक दुर्बल क्षेत्र लिगण्ड है। इस कारण यह इलेक्ट्रॉनों का बग्मन नहीं करता है।
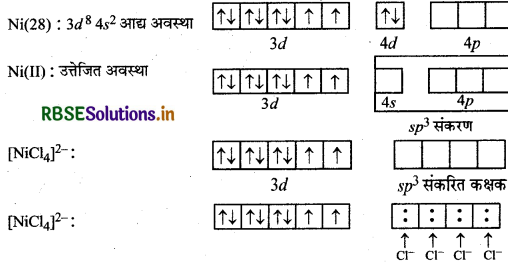
उपर्युक्त संकुल अनुचुम्बकीय है क्योंकि इसमें अयुग्मित इलेक्ट्रॉन उपस्थित है।
प्रश्न 6.
[NiCl4]2- अनुचुम्बकीय है जबकि [Ni(CO)4] प्रतिचुम्बकीय है; यद्यपि दोनों ही चतुष्फलकीय हैं, क्यों?
उत्तर:
यहाँ दोनों संकुलों में से CO प्रबल क्षेत्र लिगैण्ड है जबकि Cl- एक दुर्बल क्षेत्र लिगैण्ड है। [Ni(CO)4] में Ni की ऑक्सीकरण अवस्था शून्य जबकि [NiCl4]2- में निकिल की ऑक्सीकरण अवस्था + 2 है। प्रबल क्षेत्र लिगण्ड की उपस्थिति के कारण [Ni(CO)4] में इलेक्ट्रॉनों का युग्मन हो जाता है जिस कारण इस संकुल में कोई भी अयुग्मित इलेक्ट्रॉन शेष नहीं रहता, तथा [Ni(CO)4] का व्यवहार प्रतिचुम्बकीय हो जाता है। जबकि [NiCl4]2- में c के दुर्बल क्षेत्र के होने के कारण इलेक्ट्रॉन का युग्मन नहीं होता एवं [NiCl4]2- में अयुग्मित इलेक्ट्रॉनों की उपस्थिति के कारण इसका व्यवहार अनुचुम्बकीय हो जाता है।

प्रश्न 7.
[Fe(H2O)6]3+ प्रबल अनुचुम्बकीय है, जबकि [Fe(CN)6]3- दुर्बल अनुचुम्बकीय है। समझाइए।
उत्तर:
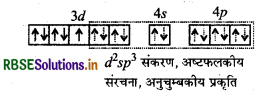
CN एक प्रबल क्षेत्र लिगैण्ड है। यह Fe3+ के 3d इलेक्ट्रॉनों को युगलित कर देता है तथा यहाँ केवल एक ही अयुग्मित इलेक्ट्रॉन शेष रहता है। [Fe(CN)6]3- में d2sp3 संकरण होता है जो एक आन्तरिक कक्षक संकुल बनाता है। [Fe(H2O)6]3+ में H2O एक दुर्बल क्षेत्र लिगैण्ड है, यह Fe3+ के 3d इलेक्ट्रॉनों का युग्मन नहीं कर पाता। इस कारण इसमें कुल पाँच अयुग्मित इलेक्ट्रॉन होते हैं। [Fe(H2O)6]3+ में spसंकरण होता है जो कि बाहा कक्षक संकुल बनाता है। अत: [Fe(CN)6]3- में कम अयुग्मित इलेक्ट्रॉनों की संख्या के कारण यह दुर्बल अनुचुम्बकीय होता है जबकि [Fe(H2O)6]3+ में पाँच अयुग्मित इलेक्ट्रॉनों की उपस्थिति के कारण यह प्रबल अनुचुम्बकीय होता है।
प्रश्न 8.
समझाइए कि [CO(NH3)6]3+ एक आन्तरिक कक्षकसंकुल है जबकि [Ni(NH3)6]2+ एक बाह्य कक्षक संकुल है।
उत्तर:
NH3 की उपस्थिति में CO3+ आयन के 3d- इलेक्ट्रॉन युग्मित होकर दो रिक्त d- कक्षक 3d-उपकोश में छोड़ते हैं। इस कारण,
Co(NH3)6]3+ में d2sp3 संकरण हो जाता है जो कि एक आन्तरिक पश्चात् भी 34 में दो कक्षक खाली नहीं हो पाते, अत: [Ni(NH3)6]2+ कक्षक संकुल है। का निर्माण संकरण के द्वारा होता है जो कि एक बाह्य कक्षक में निकिल + 2 ऑक्सीकरण अवस्था में है अर्थात् संकुल है। Ni2+ का इलेक्ट्रॉनिक विन्यास 3d8 4s0 है। चूंकि यहाँ युग्मन करने के
प्रश्न 9.
वर्ग समतली [Pt(CN)4]2- आयन में अयुग्मित इलेक्ट्रॉनों की संख्या बताइए।
उत्तर:
[Pt(CN)4]2- का परमाणु क्रमांक 78 है तथा इस संकुल में इसकी ऑक्सीकरण अवस्था + 2 है। इसका इलेक्ट्रॉनिक विन्यास 5d8 6s1 होता है, अत: Pt2+ का विन्यास 5d8 होगा।
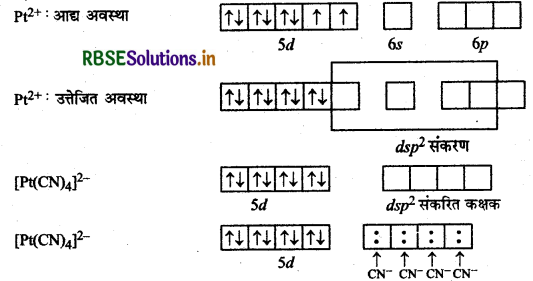
यहाँ [Pt(CN)4]2- की वर्गसमतली संरचना तथा इसमें dsp2 संकरण है। चूंकि 54 कक्षकों में इलेक्ट्रॉन युगलित होकर एक -कक्षक संकरण के लिए छोड़ते हैं, अत: यहाँ एक भी अयुग्मित इलेक्ट्रॉन उपस्थित नहीं है।
प्रश्न 10.
क्रिस्टल क्षेत्र सिद्धान्त को प्रयुक्त करते हुए समझाइए कि कैसे हेक्साऐक्वामैंगनीज (II) आयन में पांच अयुगलित इलेक्ट्रॉन हैं जबकि हेक्सासायनो आयन में केवल एक ही अयुग्मित इलेक्ट्रॉन है।
उत्तर:
[Mn(H2O)6]2+ में Mn की + 2 ऑक्सीकरण अवस्था है। इसका विन्यास 3d5 होता है। H2O की उपस्थिति में इन पाँच इलेक्ट्रॉनों का वितरण क्रिस्टल क्षेत्र सिद्धान्त के आधार पर (t2g)3 (eg)2 है, अर्थात् यहाँ पाँच इलेक्ट्रॉन अयुगलित रह जाते हैं।
CN- लिगैण्ड की उपस्थिति में Mn2+ में 5 इलेक्ट्रॉनों का वितरण (t2g)3 (eg)2 होता है। अर्थात् केवल एक इलेक्ट्रॉन ही अयुग्मित होता है।
RBSE Class 12 Chemistry उपसहसंयोजन यौगिक Textbook Questions and Answers
प्रश्न 1.
वर्नर की अभिधारणाओं के आधार पर उपसहसंयोजन यौगिकों में आबन्धन को समझाइए।
उत्तर:
(Werner's Theory of Coordination Compounds): एल्फ्रेड वर्नर (Alfred Werner) ने संकुल यौगिकों के गुणों की व्याख्या उनकी संरचना के आधार पर की, जो वर्नर का उपसहसंयोजकता का सिद्धान्त कहलाती है। इसके लिए वर्नर को नोबेल पुरस्कार प्रदान किया गया। वर्नर के उपसहसंयोजकता सिद्धान्त की प्रमुख परिकल्पनाएँ (postulates) निम्नलिखित हैं
(i) उपसहसंयोजन यौगिकों में धातुएँ दो प्रकार को सयोजकताए दर्शाती है:
(अ) प्राथमिक या मुख्य संयोजकता (Primary or Principal Valency): प्राथमिक संयोजकताएँ सामान्य रूप से आयनिक होती हैं। यह सदैव ऋणात्मक आयनों द्वारा ही सन्तुष्ट होती हैं। संकुल यौगिकों में इसके द्वारा बने बन्ध को बिन्दुकित रेखा (dotted line) द्वारा दर्शाते हैं। इस बन्धन के टूटने से आयन बनते हैं। आजकल प्राथमिक संयोजकता का तात्पर्य ऑक्सीकरण संख्या से है।
(ब) द्वितीयक या सहायक संयोजकता (Secondary or Auxiliary Valency):
- द्वितीयक संयोजकताएँ अन-आयनीय होती हैं। ये उदासीन अणुओं अथवा ऋणात्मक आयनों द्वारा सन्तुष्ट होती हैं। द्वितीयक संयोजकता उपसहसंयोजन संख्या के बराबर होती है। इसका मान किसी धातु के लिए निश्चित होता है। द्वितीयक संयोजकता द्वारा बने बन्ध को ठोस रेखा (solid line) द्वारा प्रदर्शित करते हैं। इस बन्ध के टूटने पर आयन नहीं बनते हैं।
- प्रत्येक परमाणु अपनी प्राथमिक व द्वितीयक दोनों प्रकार की संयोजकताओं को सन्तुष्ट करने की प्रवृत्ति रखता है। कभी-कभी ऋणायन दोहरा (dual) व्यवहार भी दर्शाते है अर्थात् वे एक ही समय में केन्द्रीय परमाणु की प्राथमिक व द्वितीयक दोनों प्रकार की संयोजकताओं को सन्तुष्ट करते हैं।
- द्वितीयक संयोजकताएँ केन्द्रीय धातु आयन के चारों और अन्तराकाश (space) में दिष्ट (directed) रहती हैं। इसी लक्षण के कारण उपसहसंयोजन यौगिक त्रिविम समावयवता (stereoisomerism) प्रदर्शित करते हैं। आधुनिक सूत्रीकरण में इस प्रकार की दिकस्थान व्यवस्थाओं को समन्वय बहुफलक (coordination polyhedra) कहते हैं। गुरु कोष्ठक में लिखी स्पीशीज संकुल तथा गुरु कोष्ठक के बाहर लिखे आयन, प्रति आयन (counter ions) कहलाते हैं।
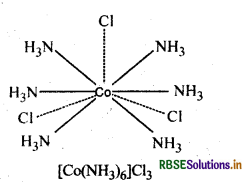
- वर्नर के अनुसार संक्रमण तत्वों के समन्वय यौगिकों में सामान्यतः अष्टफलकीय, चतुष्फलकीय व वर्ग समतलीय ज्यामितियाँ पायी जाती हैं। इस प्रकार [Co(NH3)6]3+ [COCI(NH3)5]2+ तथा [CoCI2(NH3)4]+ को ज्यामितियों अष्टफलकीय हैं, जबकि [Ni(Co)4] तथा [PICl4]2- क्रमशः चतुष्फलकीय तथा वर्ग समतली हैं।
उदाहरण:
(i) [Co(NH3)6]3+
(ii) [COCI(NH3)5]2+
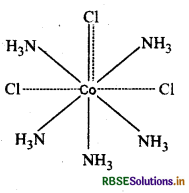
(iii) [CoCI2(NH3)4]+
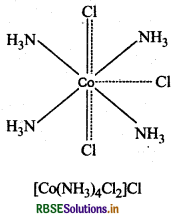
(iv) [CoCI3 3NH3
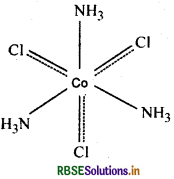
वे क्लोरीन जो उपर्युक्त उदाहरणों में बिन्दुकित एवं ठोस दोनों रेखाओं से बन्धित हैं, प्राथमिक एवं द्वितीयक दोनों प्रकार की संयोजकताओं की प्रदर्शित करते हैं।
वर्नर का प्रायोगिक सत्यापन (Experimental Verification of Werner): बर्नर ने कोबाल्ट (III) क्लोराइड के अमोनिया के साथ बने विभिन्न यौगिकों में बह देखा कि सामान्य ताप पर इनके विलयन में AgNO3 विलयन डालने पर कुछ क्लोराइड आयन विलयन में रहते है तथा कुछ आयन ही AgCl के रूप में अवक्षेपित हो जाते हैं।
जैसे:
|
1 मोल CoCl3 6NH3 (पीला) |
3 मोल AgCI देता है |
|
1 मोल CoCl3 5NH3 नीललोहित (बैंगनी)] |
2 मोल AgCI देता है |
|
1 मोल CoCl3 4NH3 (हरा) |
1 मोल ACI देता है |
|
1 मोल CoCl3 4NH3 (बैंगनी) |
1 मोल ACI देता है |
इन प्रेक्षणों से ज्ञात होता है कि यौगिक सकुल के रूप में पाए जाते हैं। संकुल यौगिकों के सूत्र निम्न सारणी के अनुसार लिख सकते हैं जो कि विलयनों में चालकता मापन परिणामों से सिद्ध हो जाते हैं। इन सकुल यौगिकों में बड़े कोष्टक में उपस्थित परमाणु एकल सत्ता (Single Entity) के रूप में रहते हैं। जिनका वियोजन नहीं होता है। इन संकुल यौगिकों में कोबाल्ट आयन से छः समूह (NH, या CF अथवा दोनों) जुड़े हुए हैं। कोबाल्ट की द्वितीय सयोजकता छः है।
सारणी 9.1 कोबाल्ट (III) क्लोराइड-अमोनिया संकुलों का सूत्रीकरण रंग:
|
रंग |
सूत्र |
विलयन चालकता सम्बन्ध पीला |
|
पीला |
[Co(NH3)6]3+ 3Cl- |
1 : 3 विद्युत अपघट्य नीललोहित |
|
नीललोहित |
[CoCl(NH3)5]2+ 2Cl- |
1 : 2 विद्युत अपघट्य |
|
हरा |
[CoCl2(NH3)4]+ Cl- |
1 : 1 विद्युत अपघट्य बैंगनी |
|
बैंगनी |
[CoCl2(NH3)4]+ Cl- |
1 : 1 विद्युत अपघट्य |
उपरोक्त सारणी में अन्तिम दो यौगिकों के मूलानुपाती सूत्र, CoCl3.4NH3, समान हैं, परन्तु गुणधर्म भिन्न हैं। ऐसे यौगिक समावयवी (Isomers) कहलाते हैं।

प्रश्न 2.
FeSO4 विलयन तथा (NH4)2 SO4 विलयन का 1 : 1 मोलर अनुपात में मिश्रण Fe2+ आयन का परीक्षण देता है, परन्तु CuSO4 व जलीय अमोनिया का 1 : 4 मोलर अनुपात में मिश्रण Cu2+ आयनों का परीक्षण नहीं देता। समझाइए, क्यों?
उत्तर:
FeSO4 विलयन तथा (NH4)2SO4 विलयन का 1 : 1 मोलर अनुपात में मिश्रण द्विक लवण बनाता है। यह द्विक लवण FeSO4 (NH4)2SO4.6H2O (मोहर लवण) है जो विलयन में आयनित' होकर Fe2+ आयन देता है। इसलिए यह Fe2+ आयनों का परीक्षण देता CuSO4, व जलीय विलयन का 1 : 4 मोलर अनुपात में मिश्रण संकर लवण बनाता है जिसका सूत्र [Cu (NH3)4]2+ है। संकुल आयन, [Cu (NH3)4]2+ आयनित होकर Cu2+ आयन नहीं देता है। इसलिए यह cu2+ आयनों का परीक्षण नहीं देता।
प्रश्न 3.
प्रत्येक के दो उदाहरण देते हुए निम्नलिखित को समजाइए-उपसहसंयोजन सत्ता, लिगैण्ड, उपसहसंयोजन संख्या, उपसहसंयोजन बहुफलक, होमोलेप्टिक तथा हेटेरोलेप्टिक।
उत्तर:
(i) उपसहसंयोजन सत्ता या समन्वय सत्ता (Coordination Entity): केन्द्रीय धातु परमाणु अथवा आयन किसी एक निश्चित संख्या में आयन अथवा अणु से उपसहसंयोजन बन्ध द्वारा आबन्धित होते हैं। केन्द्रीय परमाणु तथा आयनों के इस समूह को उपसहसंयोजन सत्ता कहते हैं।
उदाहरण: [CO(NH3)3 Br3] एक उपसहसंयोजन सत्ता है जिसमें कोबाल्ट आयन तीन अमोनिया अणुओं तथा तीन ब्रोमाइड आयनों से घिरा है।
- [Pt (NH3)2 Cl2]
- [Fe(CN)6]4-
- [Co(NH3)6]3+ आदि।
(ii) लिगैण्ड (Ligand): उपसहसंयोजन सत्ता में केन्द्रीय परमाणु/आयन से परिबद्ध आयन अथवा अणु लिगैण्ड कहलाते हैं। ये सामान्य आयन भी हो सकते हैं तथा बड़े अणु जैसे - NH2 CH2 CH2 NH2 अथवा वृहदाणु जैसे प्रोटीन भी हो सकते हैं। दाता परमाणुओं की संख्या के आधार पर इन्हें एकदन्तुर, द्विदन्तुर, त्रिदन्तुर आदि लिगण्डों में वर्गीकृत किया गया है।
उदाहरण: एकदन्तुर लिगण्ड: H2O, Cl- NH3 NO आदि।
द्विदन्तुर लिगैण्ड: NH2CH2 CH2NH3, C2O42- आदि।
(iii) उपसहसंयोजन संख्या (Coordination Number): एक संकुल में धातु आयन की उपसहसंयोजन संख्या उससे आबंधित लिगण्डों के उन दाता परमाणुओं की संख्या के बराबर होती है, जो सीधे धातु आयन से जुड़े हों।
उदाहरण: [PtCl6]2- तथा [Ni(CH3)4]2+ में Pt की उपसहसंयोजन संख्या 6 तथा Ni की उपसहसंयोजन संख्या 4 है।
(iv) उपसहसंयोजन बहुफलक (Coordination Polyhedron): केन्द्रीय परमाणु/आयन से सीधे जुड़े लिगैण्ड परमाणुओं की दिक् स्थान व्यवस्था (Spatial arrangement) को सामान्य बहुफलक कहते हैं। इनमें अष्टफलकीय, वर्ग समतलीय तथा चतुष्कलकीय मुख्य हैं।
उदाहरण: [CO(NH3)6]3+ अष्टफलकीय तथा [Ni(CO)4] चतुष्कलकीय होता है।
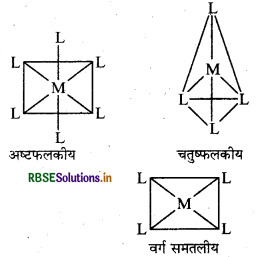
(V) होमोलेष्टिक (Hormoleptic): संकुल जिसमें धातु परमाणु केवल एक प्रकार के दाता समूह से जुड़ा रहता है, होमोलेप्टिक संकुल कहलाता है। उदाहरणार्थ: [Co(NH3)4Cl2+]+ तथा [pt(NH3)5Cl3+] आदि।
(vi) हेटेरोलेष्टिक (Heteroleptic): ऐसे संकुल जिसमें धातु परमाणु एक से अधिक प्रकार के दाता समूहों से जुड़ा रहता है, हेटेरोलेष्टिक संकुल कहलाता है।
उदाहरणार्थ: [CO(NH3)4Cl2]+ तथा [Pt(NH3)5 Cl]3+ आदि।

प्रश्न 4.
एकदन्तुर, द्विदन्तुर तथा उभयदन्तुर लिगैण्ड से क्या तात्पर्य है? प्रत्येक के दो उदाहरण दीजिए।
उत्तर:
एकदन्तुर लिगैण्ड (Monodentate ligand): ऐसा लिगैण्ड जिसमें केवल एक दाता परमाणु होता है, एकदन्तुर लिगण्ड कहलाता है।
उदाहरण: CI- H2O, NH3,CO,NO3-, NO2- आदि।
द्विदन्तुर लिगैण्ड (Bidentate ligand): जब लिगैण्ड धातु आयन से दो दाता परमाणुओं द्वारा परिबद्ध होता है तो उसे द्विदन्तुर लिगैण्ड कहते
उदाहरण: NH2CH2CH2NH2 (एथेन-1,2-डाइऐमीन), C2O42- (ऑक्सेलेट आयन) आदि।
उभयदन्तुर लिगैण्ड (Ambidentate ligand): वह एकदन्तुर लिगैण्ड जो दो भिन दाता परमाणुओं द्वारा धातु से जुड़ सकता है, उभयदन्ती लिगैण्ड कहलाता है।
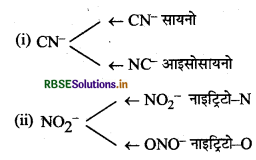
प्रश्न 5.
निम्नलिखित उपसहसंयोजन सत्ता में धातुओं की ऑक्सीकरण संख्या का उल्लेख कीजिए।
(i) [Co(H2O) (CN) (en)2]2+
(ii) [CoBr2(en)2]+
(iii) [PtCl4]2-
(iv) K3 [Fe(CN)6]
(V) [Cr(NH3)3 Cl3]
उत्तर:
(i) [Co(H2O) (CN) (en)2]2+
x + 0 + (-1) + 2 x 0 = +2
⇒ χ - 1 = + 2
∴ χ = + 3
(ii) [CoBr2(en)2]+
χ + 2 × (-1) + 2 × 0 = + 1
⇒ χ - 2 = + 1
∴ χ = + 3
(iii) [PtCl4]2-
χ + 4 × (-1) = -2
⇒ χ - 4 = - 2
∴ χ = + 2
(iv) K3 [Fe(CN)6]
3 × (+1) + χ + 6 × (-1) = 0
⇒ + 3 + χ - 6 = 0
∴ χ = + 3
(V) [Cr(NH3)3 Cl3]
χ + 3 × 0 + 3 × (-1) = 0
⇒ χ - 3 = 0
∴ χ = + 3
प्रश्न 6.
IUPAC नियमों के आधार पर निम्नलिखित के लिए सूत्र लिखिए
1. टेट्राहाइड्रोऑक्सोजिंकेट (II)
2. पोटैशियम टेट्राक्लोरिडोपैलेडेट (II)
3. डाइऐम्मीनडाइक्लोरिडोप्लैटिनम (II)
4. पोटैशियम टेदासायनोनिकिलेट (II)
5. पेण्टाऐम्मीननाइट्रिटो-O-कोबाल्ट (III)
6. हेक्साऐम्मीनकोबाल्ट (III) सल्फेट
7. पोटैशियम दाइ (ऑक्सेलेटो) क्रोमेट (III)
8. हेक्साऐम्मीनप्लैटिनम (IV)
9. टेट्रानोमिडोक्यूप्रेट (II)
10 पेण्टाऐम्मीननाइट्रिटो- N - कोबाल्ट (II)
उत्तर:
- [Zn(OH)4]+
- K2[PdCl4]
- [Pt (NH3)2Cl2]
- K2 [Ni(CN)4]
- [Co(NH3)5(ONO)]2+
- [Co(NH3)6](SO4)3
- K3 [Cr(C2O4)3]
- [Pt(NH3)6]4+
- [CuBr4]2-
- [Co(NH3)5 (NO2)]2+
प्रश्न 7.
IUPAC नियमों के आधार पर निम्नलिखित के सुव्यवस्थित नाम लिखिए:
1. [Co(NH3)6]Cl3
2. [Pt(NH3)2 Cl(NH2 CH3)]
3. [Ti(H2O)6]3+
4. [Co(NH3)4 Cl(NO2)]Cl
5. [Mn(H2O)6]2+
6. [NiCl4]2-
7. [Ni(NH3)6]Cl2
8. [Co(en)3]3+
9. [Ni(CO)4]
उत्तर:
- हेक्साऐम्मीनकोबाल्ट (III) क्लोराइड
- डाइऐम्मीनक्लोरिडो (मेथिल ऐमीन) प्लैटिनम (II) क्लोराइड
- हेक्साऐक्वाटाइटेनियम (III) आयन
- टेट्राऐम्मीनक्लोरिडोनाइट्रिटो- N -कोबाल्ट (III) क्लोराइड
- हेक्साऐक्वामैंगनीज (II) आयन
- टेट्राक्लोरिडोनिकिलेट (II) आयन
- हेक्साऐग्मीननिकिल (II) क्लोराइड
- ट्रिस (एथेन-1, 2-डाइऐमीन) कोबाल्ट (III) आयन
- टेट्राकार्बोनिलनिकिल (0)।

प्रश्न 8.
उपसहसंयोजन यौगिकों के लिए सम्भावित विभिन्न प्रकार की समावयवताओं को सूचीबद्ध कीजिए तथा प्रत्येकका एक उदाहरण दीजिए।
उत्तर:
उपसहसंयोजन यौगिकों में दो प्रकार की समावयवताएँ होती हैं, जो अग्न प्रकार हैं

(1) संरचनात्मक समावयवता (Structural Isomerism): इसे निम्न प्रकार वर्गीकृत किया गया है
(i) आयनन समावयवता:
उदाहरण:
(i) [Co(NH3)5Cl]Br
तथा
(ii) [Co(NH3)5NO]NO3
(ii) बन्धनी समावयवता
उदाहरण:
[CO(NH3)5(ONO)]Cl2 तथा
[CO(NH3)5(ONO)]Cl2
(ii) [CO(NH3)5(CN)]Cl2
तथा
[CO(NH3)5 (NC)] Cl2
(iii) उपसहसंयोजन समावयवता:
उदाहरण:
(i) [Cr(NH3)6] [C0(CN)6]
तथा [Cr(NH3)6] [C0(CN)6]
(ii) [Pt(NH3)4][PtCl4]
[Pt(NH3)3Cl] [PtCl3 (NH3)]
(iv) विलायकयोजन समावयवता
उदाहरण:
(i) [Cr(H2O)6] Cl3
[Cr(H2O)5Cl]Cl2 . H2O
तथा [Co(H2O)6] Br3 तथा [Co(H2O)5Br]Br2 H2O
(2) त्रिविम समावयवता (Stereoisomerism):
(i) ज्यामितीय समावयवता,
उदाहरण:
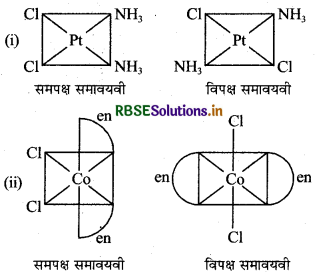
(ii) प्रकाशिक समावयवता:
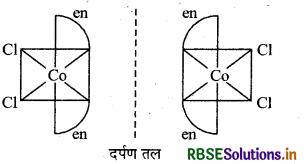
प्रश्न 9.
निम्नलिखित उपसहसंयोजन सत्ता में कितने ज्यामितीय समावयव सम्भव है?
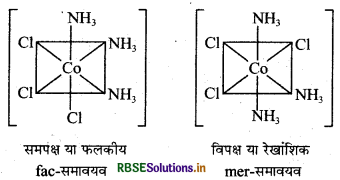
(क) [Cr(C2O4)3]3- (ख) [CO(NH3)3Cl3]
उत्तर:
(क) [Cr(C2O4)3]3- के कोई भी ज्यामितीय समावयव सम्भव नहीं हैं।
(ख) [CO(NH3)3Cl3]- इस संकुल में दी ज्यामितीय समावयव
प्रश्न 10.
निम्नलिखित के प्रकाशिक समावयवों की संरचनाएँ बनाइए
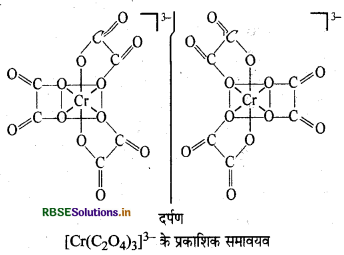
\(\text { (i) }\left[\mathrm{Cr}\left(\mathrm{C}_2 \mathrm{O}_4\right)_3\right]^{3-}\)
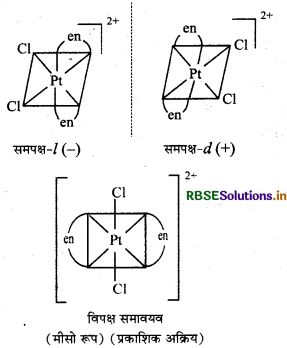
\(\text { (ii) }\left[\mathrm{PtCl}_2(\mathrm{en})_2\right]^{2+}\)
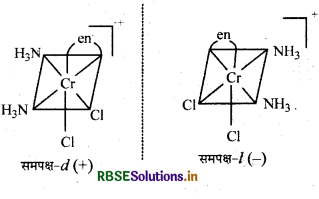
\(\text { (iii) }\left[\mathrm{Cr}\left(\mathrm{NH}_3\right)_2 \mathrm{Cl}_2(\mathrm{en})\right]^{+}\)
उत्तर:
\(\text { (i) }\left[\mathrm{Cr}\left(\mathrm{C}_2 \mathrm{O}_4\right)_3\right]^{3-}\)
\(\text { (ii) }\left[\mathrm{PtCl}_2(\mathrm{en})_2\right]^{2+}\)
\(\text { (iii) }\left[\mathrm{Cr}\left(\mathrm{NH}_3\right)_2 \mathrm{Cl}_2(\mathrm{en})\right]^{+}\)
प्रश्न 11.
निम्नलिखित के सभी समावयवों (ज्यामितीय व भुवण) की संरचनाएँ बनाइए:
\(\text { (i) }\left[\mathrm{CoCl}_2(\mathrm{en})_2\right]^{+}\)
\(\text { (ii) }\left[\mathrm{Co}\left(\mathrm{NH}_3\right) \mathrm{Cl}(\mathrm{en})_2\right]^{2+}\)
\(\text { (iii) }\left[\mathrm{Co}\left(\mathrm{NH}_3\right)_2 \mathrm{Cl}_2 \text { (en) }\right]^{+}\)
उत्तर:
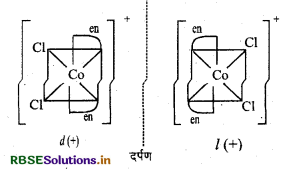
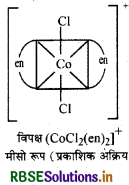
समपक्ष \(\left[\mathrm{CoCl}_2(\mathrm{en})_2\right]^{+}\) के प्रकाशिक समावयव
\(\text { (ii) }\left[\mathrm{Co}\left(\mathrm{NH}_3\right) \mathrm{Cl}(\mathrm{en})_2\right]^{2+}\)
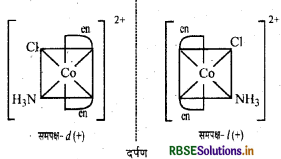
समपक्ष \(\left[\mathrm{Co}\left(\mathrm{NH}_3\right) \mathrm{Cl}(\mathrm{en})_2\right]^{2+}\) के प्रकाशिक समावयव़
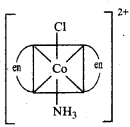
विपक्ष \(\left[\mathrm{Co}\left(\mathrm{NH}_3\right) \mathrm{Cl}(\mathrm{en})_2\right]^{2+}\) (प्रकाशिक अक्रिय)
\(\text { (iii) }\left[\mathrm{Co}\left(\mathrm{NH}_3\right)_2 \mathrm{Cl}_2 \text { (en) }\right]^{+}\)
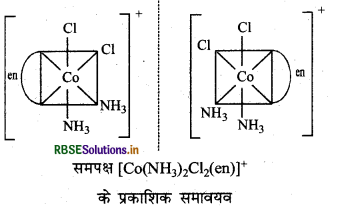

प्रश्न 12.
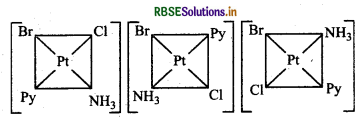
\(\left[\mathrm{Pt}^{\left(\mathrm{NH}_3\right)(\mathrm{Br})}(\mathrm{Cl})(\mathrm{Py})\right]\) के सभी ज्यामितीय समावयव लिखिए। इनमें से कितने धुवण समावयवता दर्शायेंगे।
उत्तर:
तीन ज्यामितीय समाववव सम्भव है। इस प्रकार के समावयव धूवण समावयवता प्रदर्शित नहीं करते हैं क्योंकि वर्ग समतलीय संकुलों में ध्रुवण समावषवता मुश्किल से पायी जाती है।
प्रश्न 13.
जलीय कॉपर सल्फेट विलयन (नीले रंग का) निम्नलिखित प्रेक्षण दर्शाता है
(i) जलीय पोटैशियम फ्लुओराइड के साथ हरा रंग।
(ii) जलीय पोटैशियम क्लोराइड के साथ चमकीला हरा रंग। उपर्युक्त प्रायोगिक परिणामों को समझाइए।
उत्तर:
जलीय कॉपर सल्फेट \(\left[\mathrm{Cu}\left(\mathrm{H}_2 \mathrm{O}\right)_4\right]^{2+} \mathrm{SO}_4{ }^{2-} \cdot \mathrm{H}_2 \mathrm{O}\) के रूप में पाया जाता है। इस विलयन का रंग नीला होता है जो कि \(\left[\mathrm{Cu}\left(\mathrm{H}_2 \mathrm{O}\right)_4\right]^{2+}\) के कारण होता है।
(i) जब पोर्टेशियम फ्लुओराइड मिलाया जाता है तो F- आयन H2O को प्रतिस्थापित कर देते हैं तथा [CuF4]2- बनाते हैं जो कि एक हरे रंग का अवक्षेप होता है।

(ii) जब पोटैशियम क्लोराइड मिलाया जाता है तो Cl- आयन H2O को प्रतिस्थापित कर देते हैं तथा [CuCl4]2- बनाते हैं जो कि चमकीले हरे रंग का विलयन होता है।

प्रश्न 14.
कॉपर सल्फेट के जलीय विलयन में जलीय KCN को आधिक्य में मिलाने पर बनने वाली उपसहसंयोजन सत्ता क्या होगी? इस विलयन में जब H2S गैस प्रवाहित की जाती है तो कॉपर सल्फाइड का अवक्षेप क्यों नहीं प्राप्त होता?
उत्तर:
कॉपर सल्फेट के जलीय विलयन में जलीय KCN मिलाने पर पहले क्यूप्रिक सायनाइड बनता है जो अपघटित होकर क्यूप्रस सायनाइड तथा सायनोजन गैस देता है। क्यूप्रस सायनाइड, पोटैशियम सायनाइड के आधिक्य में घुलकर K3[Cu(CN)4] संकुल बनाता है।
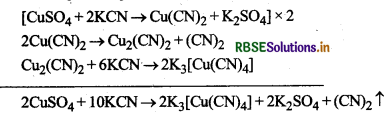
इस प्रकार बनने वाली उपसहसंयोजन सत्ता (Cu(CN)4]3- है।।
चूंकि CN- एक प्रबल लिगैण्ड है, इसलिए संकुल आयन उच्च स्थायीं होता है तथा वियोजित या आयनित होकर Cu2+ आयन नहीं देता; अत: H2S के साथ-कोई अवक्षेप नहीं बनता।
प्रश्न 15.
संयोजकता आबन्ध सिद्धान्त के आधार पर निम्नलिखित उपसहसंयोजन सत्ता में आबन्ध की प्रकृति की विवेचना कीजिए:
(क) [Fe (CN)6]4-
(ख) [FeF6]3+
(ग) [Co(C2O4)3]3-
(घ) [CoF6]3-
उत्तर:
(क) [Fe (CN)6]4- इस संकुल में आयरन का परमाणु क्रमांक 26, इलेक्ट्रॉनिक विन्यास 3d64s2 तथा ऑक्सीकरण अवस्था (+2) है।
Fe (26) = 3d64s2
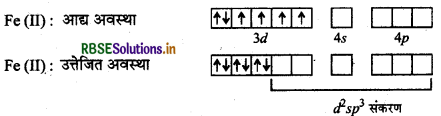
चूंकि यहाँ CN- एक प्रवल क्षेत्र लिगैण्ड है अत: यह इलेक्ट्रॉनों का युग्मन कर देता है तथा 3d के दो कक्षक संकरण के लिए खाली हो जाते हैं। यहाँ d2sp3 प्रकार का संकरण होता है।
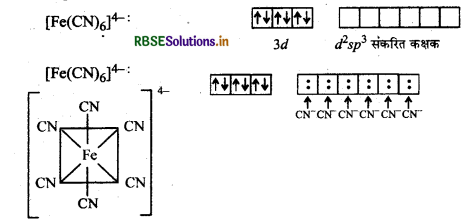
संकरण: d2sp3
ज्यामितीय: अष्टफलकीय
रंग: रंगहीन (क्योंकि कोई भी अयुग्मित इलेक्ट्रॉन नहीं है)
चुम्बकत्व: प्रतिचुम्बकीय (कोई भी अयुग्मित इलेक्ट्रॉन नहीं है)
संकुल: यह एक आन्तरिक कक्षक (निम्न चक्रण) संकुल है।
(ख) [FeF6]3- यहाँ पर Fe का परमाणु क्रमांक 26 है तथा इलेक्ट्रॉनिक विन्यास 3d64s2 है तथा Fe की ऑक्सीकरण संख्या (+ 3) है। यहाँ Fएक दुर्बल क्षेत्र लिगैण्ड है तथा यह इलेक्ट्रॉनों का युग्मन नहीं कर पाता है।
Fe (26): 3d6 4s2
Fe (III): 3d5 4s0 4p0 4d0
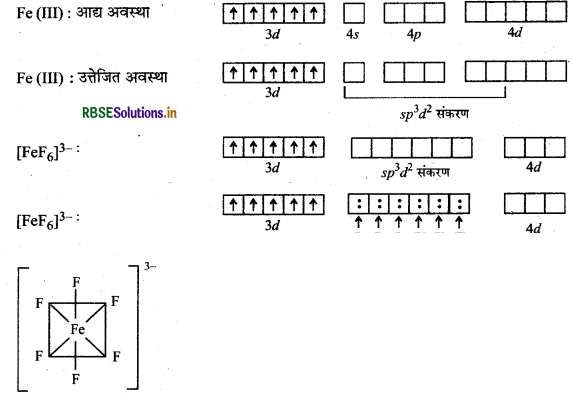
संकरण: sp3 d2
ज्यामितीय: अष्टफलकीय
रंग: रंगीन (क्योंकि अयुग्मित इलेक्ट्रॉन उपस्थित)
चुम्बकत्व: अनुचुम्बकीय (अयुग्मित इलेक्ट्रॉनों के कारण)
μ = \(\sqrt{n(n+2)} \text { B.M. }\)
μ = \(\sqrt{5(5+2)} \text { B.M. }\)
μ = \(\sqrt{35} \text { B.M. }\)
संकुल: यह एक बाह्य कक्षक (उच्च चक्रण) संकुल है।
(ग) [Co(C2O4)3]3- यहाँ Co का परमाणु क्रमांक 27, इलेक्ट्रॉनिक विन्यास 3d7 4s2 तथा ऑक्सीकरण संख्या (+ 3) है। यहाँ C2O42- एक प्रबल क्षेत्र लिगैण्ड है तथा यह इलेक्ट्रॉनों का युग्मन कर आन्तरिक कक्षक संकुल बनाता है।
Co(27) : 3d7 4s2
Co(III) : 3d6 4s0 4po
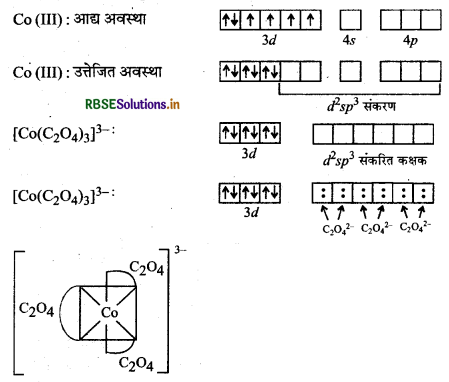
ज्यामितीय: अष्टफलकीय
संकरण: d2sp3
रंग: रंगहीन (अयुग्मित इलेक्ट्रॉनों की अनुपस्थिति के कारण)
चुम्बकत्व: प्रतिचुम्बकीय (अयुग्मित इलेक्ट्रॉनों की अनुपस्थिति के कारण)
संकुल: यह एक आन्तरिक कक्षक (निम्न चक्रण) संकुल है।
(घ) [CoF6]3- यहाँ पर कोबाल्ट का परमाणु क्रमांक 27, इलेक्ट्रॉनिक विन्यास 3d74s2 तथा Co की ऑक्सीकरण संख्या (+ 3) है।
Co(27): 3d74s2
Co (III) : 3d6 4s° 4p°4d°
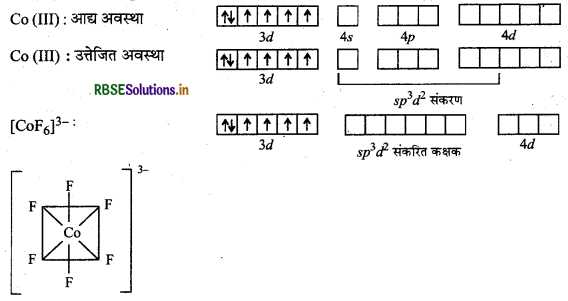
संकरण: Sp3d2
जयामितीय: कष्टफलकीय
रंग: रंगीन (क्योंकि अबुग्मित इलेक्ट्रॉन उपतित)
चुम्बकत्व: अनुचुक्वकीय (अयुडिमत इलेक्ट्रानों के कारण)
μ = \(\sqrt{n(n+2)} \text { B.M }\)
= \(\sqrt{4(4+2)} \text { B.M }\)
= \(\sqrt{24} \text { B.M }\)
संकुल: यह एक बाह्य कक्षक (उच्च चक्रण) संकुल है।

प्रश्न 16.
अष्टफलकीय क्रिस्टल क्षेत्र में 4-कक्षकों के विपाटन को दर्शाने के लिए चित्र बनाइए।
उत्तर:
जब छ: लिगैण्ड धातु परमाणु को चारों ओर से घेरते हैं तो धातु परमाणु के अपभ्रंश (degenerate) 4-कक्षक उत्तेजित होकर दो भागों में विपाटन कर देते हैं।
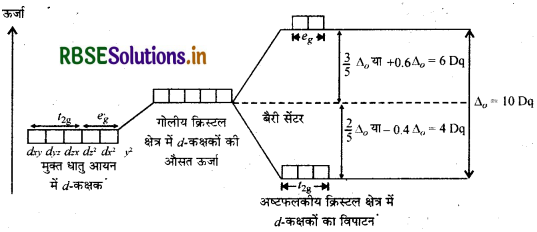
अष्टफलकीय क्रिस्टल क्षेत्र में 4 - कक्षकों का विपाटन: यहाँ दोनों इलेक्ट्रॉनिक विन्यासों में अर्थात् (t2g) तथा (e) कक्षकों में 10 Dq का अन्तर होता है। यहाँ दोनों विन्यासों के अन्तर की ऊर्जा क्रिस्टल क्षेत्र विपाटन ऊर्जा कहलाती है।
प्रश्न 17.
स्पेक्ट्रमीरासायनिक श्रेणी क्या है? दुर्बल क्षेत्र लिगण्ड तथा प्रबल क्षेत्र लिगैण्ड में अन्तर स्पष्ट कीजिए।
उत्तर:
स्पेक्ट्रमीरासायनिक श्रेणी (Spectrochemical Series): लिगैण्डों को उनकी प्रबलता क्षेत्र के आधार पर एक श्रेणी में व्यवस्थित किया जाता है। यह श्रेणी स्पेक्ट्रमीरासायनिक श्रेणी कहलाती है। यह निम्न प्रकार होती है
I- < Br- < SCN- < Cl- < S2- < F- < OH- < C2O42- < H2O < NCS- < EDTA4- < NH3 < en < CN- < CO
यह विभिन्न लिगैण्डों के साथ बने संकुलों द्वारा प्रकाश के अवशोषण पर आधारित प्रायोगिक तथ्यों द्वारा निर्धारित श्रेणी है।
दुर्बल क्षेत्र लिगैण्ड तथा प्रबल क्षेत्र लिगैण्ड में अन्तर (Difference between Weak field Ligand and Strong field Ligand):
प्रश्न 18.
क्रिस्टल क्षेत्र विपाटन ऊर्जा क्या है? उपसहसंयोजन सत्ता में 4-कक्षकों का वास्तविक विन्यास ∆0 के मान के आधार पर कैसे निर्धारित किया जाता है?
उत्तर:
जब लिगैण्ड धातु आवन/परमाणु के साथ उपसहसंयोजन बन्ध बनाने के लिए आते हैं तो धातु आयन के अपभ्रंश (degenerate) कक्षकों की ऊर्जा में परिवर्तन होता है तथा कक्षक दो समुच्चयों में विपाटित हो जाते हैं जिनमें से एक समुच्चय की ऊर्जा अधिक व दूसरे समुच्चय की ऊर्जा कम होती है। इन दोनों समुच्चयों के बीच की ऊर्ज का अन्तर ही क्रिस्टल क्षेत्र विपाटन ऊर्जा (Crystal Field Splitting Energy. CFSE) कहलाता है। उपसहसंयोजन सत्ता में कक्षकों का वास्तविक विन्यास ∆0 के मान पर निर्धारित करता है। क्योंकि यदि ∆0 > P(युग्मन ऊर्जा) तो चौथा इलेक्ट्रॉन कक्षक में प्रवेश कर जाता है तथा विन्यास (t2g)3 (eg)1 हो जाता है और इस प्रकार उच्च चक्रण संकुलों का निर्माण होता है। ऐसे लिगैण्ड जिनमें इस प्रकार का विन्यास होने की सम्भावना होती है, दुर्बल क्षेत्र लिगैण्ड कहलाते हैं। और यदि ∆0 > P (युग्मन ऊर्जा) तो चौथा इलेक्ट्रॉन ! कक्षक में ही युग्मित हो जाता है तथा (t2g)4 (eg)0 विन्यास प्राप्त होता है। ऐसी स्थिति में निम्न चक्रण संकुलों का निर्माण होता है तथा लिगैण्ड जिनमें ∆0 > P होता है, प्रबल क्षेत्र लिगैण्ड कहलाते हैं।
प्रश्न 19.
[Cr(NH3)6]3+ अनुचुम्बकीय है जबकि [Ni(CN)4]2- प्रतिचुम्बकीय। समझाइए, क्यों?
उत्तर:
[Cr(NH3)6]3+ यहाँ Cr का परमाणु क्रमांक 24, इलेक्ट्रॉनिक विन्यास 3d5 4s1 तथा ऑक्सीकरण संख्या + 3 है।
अत: Cr(24) : 3d5 4s1
Cr (III) : 3d3 4s° 4po
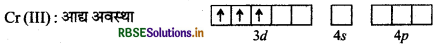
यहाँ NH, एक प्रबल क्षेत्र लिगैण्ड है परन्तु यहाँ ब-उपकोश के दो कक्षक पहले से ही खाली हैं, अत: इलेक्ट्रॉनों के युग्मन की कोई आवश्यकता नहीं है।
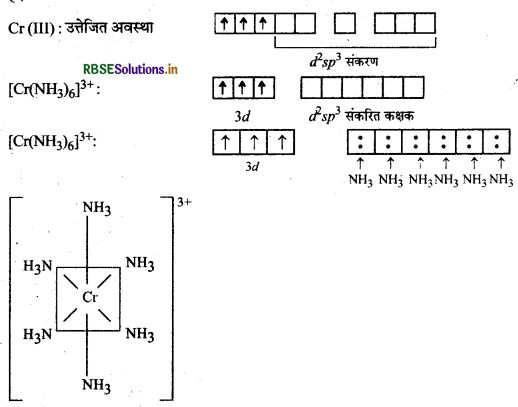
संकरण: d2 sp3
ज्यामितीय: अष्टफलकीय
रंग: रंगीन (अयुग्मित इलेक्ट्रॉनों के कारण)
चुम्बकत्व: अनुचुम्बकीय (अयुग्मित इलेक्ट्रॉनों के कारण)
μ = \(\sqrt{n(n+2)} \mathrm{BM}\)
= \(\sqrt{3(3+2)} \text { BM }\)
= \(\sqrt{15} \mathrm{BM}\)
[Ni(CN)4]2- यहाँ निकिल का परमाणु क्रमांक 28, इलेक्ट्रॉनिक विन्यास 3d8 4s2 तथा ऑक्सीकरण संख्या + 2 है।
Ni(28): 3d8 4s2
Ni (II) : 3d8 4s° 4p°
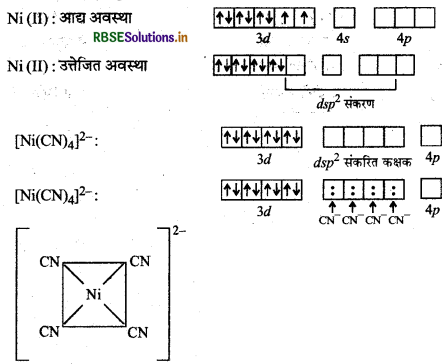
संकरण: dsp2
ज्यामितीय: वर्ग समतलीय
रंग: रंगहीन (अयुग्मित इलेक्ट्रॉनों की अनुपस्थिति के कारण)
चुम्बकत्व: प्रतिचुम्बकीय (अयुग्मित इलेक्ट्रॉनों की अनुपस्थिति के कारण)

प्रश्न 20.
[Ni(H2O)6]2+ का विलयन हरा है परन्तु [Ni(CN)4]2- का विलयन रंगहीन है। समझाइए।
उत्तर:
[Ni(H2O)6]2+ यहाँ निकिल का परमाणु क्रमांक 28, इलेक्ट्रॉनिक विन्यास 3d8 4s2 तथा ऑक्सीकरण संख्या + 2 है।
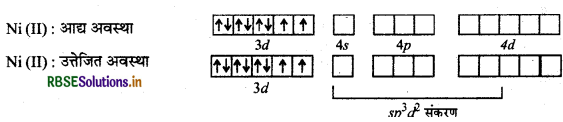
चूँकि H2O एक दुबल क्षेत्र लिगैण्ड है अत: यह इलेक्ट्रॉनों का युग्मन नहीं कर पाता है तथा बाह्य कक्षक संकरण में भाग लेते हैं।
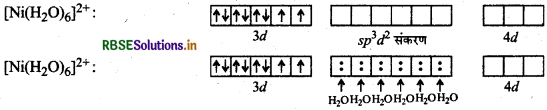
चूँकि यहाँ पर दो अयुग्मित इलेक्ट्रॉन उपस्थित है अत: यह हरा विलयन बनाता है।
[Ni(CN)4]2- : यहाँ Ni का परमाणु क्रमांक 28, इलेक्ट्रॉनिक विन्यास 3d8 4s2 तथा ऑक्सीकरण अवस्था + 2 है।
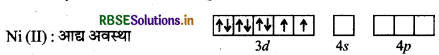
चूँकि CN- एक प्रथल क्षेत्र लिगैण्ड है अत: यह इलेक्ट्रॉनों का युग्मन करेगा।
चूँकि यहाँ पर सभी इलेक्ट्रॉन युग्मित हैं अतः विलयन रंगहीन होगा।
प्रश्न 21.
[Fe(CN)6]4- तथा [Fe(H2O)6]2+ के तनु विलयनों के रंग भिन्न होते हैं, क्यों?
उत्तर:
दोनों संकुलों में Fe की ऑक्सीकरण अवस्था (+2) है। अत: Fe2+ का विन्यास 3d6 होगा। प्रबल क्षेत्र लिगैण्ड CN- की उपस्थिति में इलेक्ट्रॉनों का युग्मन होता है परन्तु एक अयुग्मित इलेक्ट्रॉन शेष रहता है, जिसके कारण [Fe(CN)6]4- रंगीन होता है। [Fe(H2O)6]2+ में भी Fe की ऑक्सीकरण संख्या + 2 तथा विन्यास 3d6 है। परन्तु यहाँ पर H2O एक दुर्बल क्षेत्र लिगैण्ड है जिसके कारण इलेक्ट्रॉन का युग्मन नहीं हो पाता है और इस संकुल में कुल 4 अयुग्मित इलेक्ट्रॉन उपस्थित होते हैं। चूँकि दोनों संकुलों में अयुग्मित इलेक्ट्रॉनों की संख्या भिन्न-भिन्न है अतः ये विलयनों में भिन्न-भिन्न रंग देते हैं।
प्रश्न 22.
धातु कार्बोनिलों में आबन्ध की प्रकृति की विवेचना कीजिए।
उत्तर:
धातु कार्बोनिलों के धातु-कार्बन आबन्ध में तथा p दोनों के गुण पाये जाते हैं। M-C σ आबन्ध कार्बोनिल समूह के कार्बन पर उपस्थित इलेक्ट्रॉन युगल को धातु के रिक्त कक्षक में दान करने से बनता है। M-C σआवन्ध धातु के पूरित कक्षकों में से एक इलेक्ट्रॉन युगल को कार्बन मोनोक्साइड के रिक्त प्रतिआबन्धन π* कक्षक में दान करने से बनता है। धातु से लिगैण्ड का आबन्ध एक सहक्रियाशीलता का प्रभाव उत्पन्न करता है जो co व धातु के मध्य आबन्ध को मजबूत बनाता है
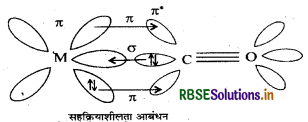
प्रश्न 23.
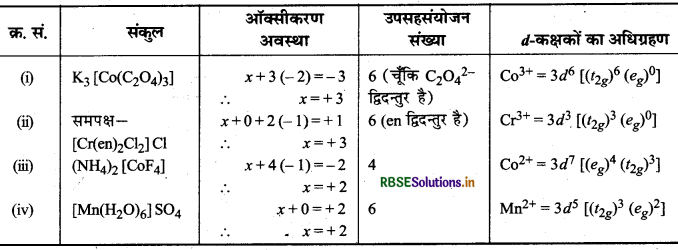
निम्नलिखित संकुलों में केन्द्रीय धातु आयन की ऑक्सीकरण अवस्था, d - कक्षकों का अधिग्रहण एवं उपसहसंयोजन संख्या बतलाइए:
(i) K3[Co(C2O4)3]
(ii) समपक्ष: [Cr(en)2Cl2]CI
(ii) (NH4)2][COF4]
(iv)[Mn(H2O)6] SO4
उत्तर:

प्रश्न 24.
निम्नलिखित संकुलों के IUPAC नाम लिखिए तथा ऑक्सीकरण अवस्था, इलेक्ट्रॉनिक विन्यास और उपसहसंयोजन संख्या दर्शाइए। संकुल का त्रिविम रसायन तथा चुम्बकीय आघूर्ण भी बतलाइए:
(i) K[Cr(H2O)2(C2O4)2].3H2O
(ii)[CrCl3(Py)3]
(iii) [CO(NH3)5 CI] Cl2
(iv) Cs[FeCl4]
(V) K4[Mn(CN)6]
उत्तर:
(i) K[Cr(H2O)2(C2O4)2].3H2O
IUPAC नाम-पोटैशियम डाइऐक्वाडाइऑक्सेलेटो- क्रोमियम (III) हाइड्रेट
ऑक्सीकरण अवस्था
K[Cr(H2O)2(C2O4)2]
+ 1 + x + 2 x 0 + 2 x (-2) = 0
+ 1 + x - 4 = 0
∴ x = +3
उपसहसंयोजन संख्या: यहाँ संकुल की उपसहसंयोजन संख्या 6
त्रिविम रसायन: चूँकि उपसहसंयोजन संख्या 6 है अत: यह अष्टफलकीय है।
चुम्बकीय आघूर्ण व इलेक्ट्रॉनिक विन्यास:
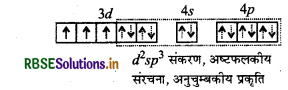
चुम्बकीय आघूर्णं
μ = \(\sqrt{n(n+2)} \mathrm{BM}\)
= \(\sqrt{3(3+2)} \mathrm{BM}\)
= \(\sqrt{3 \times 5} \text { BM }\)
= 3.87 B,
(ii) [CrCI3(Py)3]: ट्राइक्लोरिडोट्राइपिरिडीन क्रोमियम (III)
ऑक्सीकरण संख्या [CrCl3(Py)3]
x + 3 x (-1) +3 x 0 = 0
⇒ x - 3 = 0
∴ x = +3
उपसहसंयोजन संख्या: उपसहसंयोजन संख्या 6 है।
त्रिविम रसायन: चूँकि उपसहसंयोजन संख्या 6 हैं अतः यह अष्टफलकीय होगा।
चुम्बकीय आघूर्ण व इलेक्ट्रॉनिक विन्यास:
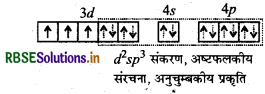
चुम्बकीय आघूर्ण (μ) = \(\sqrt{n(n+2)} \mathrm{BM}\)
= \(\sqrt{3(3+2)} \mathrm{BM}\)
= \(=\sqrt{3 \times 5} \mathrm{BM}\)
= 3.87 BM
(iii) [CO(NH3)5 Cl]Cl2
IUPAC नाम-पेन्टाऐम्मीनक्लोरिडोकोबाल्ट (III) क्लोराइड
ऑक्सीकरण संख्या: [CO(NH3)5 Cl]Cl2
x + 5 x 0 + (-1)+ 2 x (-1) = 0
उपसहसंयोजन संख्या-उपसहसंयोजन संख्या 6 है। त्रिविम रसायन-उपसहसंयोजन संख्या 6 है, अत: यह अष्टफलकीय
चुम्बकीय आघूर्ण व इलेक्ट्रॉनिक विन्यास:
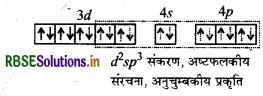
चुम्बकीय आघूर्ण (μ) = 0.
(iv) Cs [FeCl4]
IUPAC नाम: सीजियम टेट्राक्लोरिडोफेरेट (III)
ऑक्सीकरण संख्या: Cs [FeCl4]
+ 1 + x + 4 x (-1) = 0
⇒ x - 3 = 0
∴ x = +3
उपसहसंयोजन संख्या: इसकी उपसहसंयोजन संख्या 4 है।
त्रिविम रसायन: चतुष्फलकीय।
चुम्बकीय आघूर्ण व इलेक्ट्रॉनिक विन्यास:

यहाँ 5 अयुग्मित इलेक्ट्रॉन हैं अत: यह अनुचुम्बकीय है।
चुम्बकीय आघूर्ण μ = \(\sqrt{n(n+2)} \text { BM }\)
= \(\sqrt{5(5+2)} \text { BM }\)
= \(\sqrt{5 \times 7} \mathrm{BM}\)
= 5.92 Bm
(v) K4[Mn(CN)6]
IUPAC नाम-पोटैशियम हेक्सासायनोमैंगनीज (II)
ऑक्सीकरण संख्या: K4[Mn(CN)6]
4 x + 1 + x + 6 x (-1) = 0
⇒ + 4 + x - 6 = 0
∴ x = + 2
उपसहसंयोजन संख्या: उपसहसंयोजन संख्या 6 है।
त्रिविम रसायन: अष्टफलकीय।
चुम्बकीय आघूर्ण व इलेक्ट्रॉनिक विन्यास:
चुम्बकीय आघूर्ण:
μ = \(\sqrt{n(n+2)} \mathrm{BM}\)
= \(\sqrt{1(1+2)} \text { BM }\)
= 1.732 B M
प्रश्न 25.
क्रिस्टल क्षेत्र सिद्धान्त के आधार पर संकुल [Ti(H2O)6]3+ के बैंगनी रंग की व्याख्या कीजिए।
उत्तर:
क्रिस्टल क्षेत्र सिद्धान्त के अनुसार, [Ti(H2O)6]3+ बैंगनी रंग का होता है, क्योंकि इसमें धातु के-कक्षक का एक इलेक्ट्रॉन संकुल की निम्नतम ऊर्जा अवस्था (t2g) से उत्तेजित होकर इससे अगले उच्च रिक्त , कक्षक में चला जाता है।
अत: 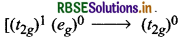
संक्रमण अर्थात् d - d संक्रमण के कारण [Ti(H2O)6]3+ बैंगनी रंग का दिखाई देता है।

प्रश्न 26.
कीलेट प्रभाव से क्या तात्पर्य है? एक उदाहरण दीजिए।
उत्तर:
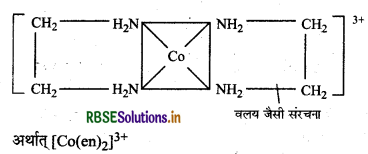
कीलेट प्रभाव-जब एक द्विदन्तुर या बहुदन्तुर लिगण्ड धातु आयन/परमाणु से दाता परमाणुओं द्वारा जुड़ता है तो केन्द्रीय पातु व लिगैण्डों के मध्य एक वलय जैसी संरचना बनती है जो कि संकल के स्थायित्व को बढ़ा देती है।
द्विदन्तुर या बहुदन्तुर लिगण्डों का संकुलों के स्थायित्व को बढ़ा देने का प्रभाव कीलेट प्रभाव (Chelate effect) कहलाता है।
प्रश्न 27.
प्रत्येक का एक उदाहरण देते हुए निम्नलिखित में उपसहसंयोजन यौगिकों की भूमिका की संक्षिप्त विवेचना कीजिए
(i) जैव प्रणालियाँ
(ii) विश्लेषणात्मक रसायन
(iii) औषध रसायन
(iv) धातुओं का निष्कर्षण/धातुकर्म।
उत्तर:
धातुओं के निष्कर्षण में (In Extraction of Metals): उत्कृष्ट धातुओं जैसे-सोना, चाँदी आदि के निष्कर्षण में संकुल निर्माण का योगदान है।
जैव तन्त्र में (In Biological System): उपसहसंयोजन यौगिकों का जैव तन्त्र में महत्वपूर्ण स्थान है जो कि निम्न प्रकार से है
कई प्राकृतिक यौगिक उपसहसंयोजक यौगिकों के रूप में पाये जाते
(8) औषध रसायन में (In Medicinal Field): उपसहसंयोजन यौगिकों का उपयोग आजकल औषध रसायन में व्यापक रूप से किया जा रहा है।
उदाहरण:
- EDTA को लेड की विषाक्तता के उपचार में प्रयुक्त किया ।जांता है।
- समेंपिक्ष-प्लैटिन (cis-platin) तथा सम्बन्धित यौगिकों का उपयोग ट्यूमर वृद्धि को प्रभावी रूप से रोकने के लिए किया जाता है।
- पर की अधिकता को शरीर में से दूर करने के लिए Dपेनिसिलऐमीन तथा कॉपर के मध्य संकुल बनाकर किया जाता है। यह संकुल मूत्र के साथ विसर्जित हो जाता है।
- आयरन की अधिकता डेसफेरीऑक्सिम-B लिगैण्डों के साथ संकूल बनाकर दुर की जाती है।
विशलेषणात्मक रसायन में (In AnalyticalChemistry): विश्लेषणात्मक रसायन में कई क्षारीय मूलकों का निश्चयात्मक परीक्षण उनको संकुलों में परिवर्तित करके करते हैं। इनके उदाहरण निम्न प्रकार हैं:
(i) CU2+ मूलक का परीक्षण, अमोनिया के साथ इसकी क्रिया कराकर फलस्वरूप बनने वाले संकुल से करते हैं।

(ii) Fe3+ आयन, जो कि तृतीय समूह में होता है, का परीक्षण पोटैशियम फेरोसायनाइड से करते हैं। यहाँ दोनों अभिक्रिया करके नीले रंग का संकुल बनाते हैं।
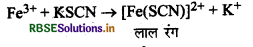
(iii) निकिल आयन का परीक्षण DMG के साथ गुलाबी रंग के संकुल को बनाकर किया जाता है।

(iv) IIA तथा IIB के आयनों, जैसे As3+, Sb3+, Sn4+ आदि का परीक्षण भी संकुल बनाकर किया जाता है।
प्रश्न 28.
संकुल [Co(NH3)6] Cl2 से विलयन में कितने आयन उत्पन्न होंगे
(i) 6
(ii) 4
(iii) 3
(iv) 2
उत्त:
कोबाल्ट (Co) की उपसहसंयोजन संख्या = 6
संकुल [Co(NH3)6]Cl2 विलयन में इस प्रकार आयनित होगा:
\(\left[\mathrm{Co}\left(\mathrm{NH}_3\right)_6\right] \mathrm{Cl}_2 \stackrel{a q}{\longrightarrow}\left[\mathrm{Co}\left(\mathrm{NH}_3\right)_6\right]^{2+}+2 \mathrm{Cl}^{-}\)
अतः तीन आयन उत्पन्न होंगे।
इसलिए विकल्प (III) सही है।
प्रश्न 29.
निम्नलिखित आयनों में से किसके चुम्बकीय आघूर्ण का मान सर्वाधिक होगा
(i) Cr(H2O)6t
(ii) [Fe(H2O)]2+
(iii) [Zn(H2O)6]2+
उत्तर:
ऑक्सीकरण अवस्था है-Cr (IIT), Fe(II), Zn(II) Cr
Cr3+ का इलेक्ट्रॉनिक विन्यास = 3d3
अयुग्मित इलेक्ट्रॉन = 3
Fe2+ का इलेक्ट्रॉनिक विन्यास = 3d6
अयुग्मित इलेक्ट्रॉन= 4
Z2+ का इलेक्ट्रॉनिक विन्यास = 3d10,
अयुग्मित इलेक्ट्रॉन = 0
चुम्बकीय आघूर्ण (μ) = \(\sqrt{n(n+2)}\)
चूँकि n = 4 सबसे अधिक है, अतः विकल्प (ii) के चुम्बकीय आघूर्ण का मान सर्वाधिक होगा।

प्रश्न 30.
K[Co(CO)4] में कोबाल्ट की ऑक्सीकरण संख्या है:
(I) + 1
(iI) +3
iii) -1
(iv) -3
उत्तर:
K[Co(CO)4]
+1 + χ + 4 x 0 = 0
अत: विकल्प (III) सही है।
प्रश्न 31.
निम्नलिखित में सर्वाधिक स्थायी संकुल है:
(i) [Fe(H2O)6]2+
(ii) [Fe(NH3)6]3+
(iii) [Fe(C2O4)3]3-
(iv) [FeCl6]3-
उत्तर:
दिए गए संकुलों में प्रत्येक में Fe, + 3 ऑक्सीकरण अवस्था में है। चूंकि C2O42- द्विदन्तुर कीलेट लिगैण्ड है, यह कोलेट वलय बनाता है, इसलिए विकल्प सर्वाधिक स्थायी संकुल है।
प्रश्न 32.
निम्नलिखित के लिए दृश्य प्रकाश में अवशोषण की तरंगदैर्ध्य का सही क्रम क्या होगा?
[Ni(H2O)6]2+ [Ni(NH3)6]2+ [Ni(NO2)6]4-
उत्तर:
चूँकि यहाँ धातु आयन समान हैं, अत: स्पेक्ट्रो रासायनिक
श्रेणी से लिगैण्डों के बढ़ते हुए क्षेत्र सामर्थ्य का क्रम इस प्रकार होगा
H2O < NH3 < NO2
अत: उत्तेजन के लिए अवशोषित ऊर्जाओं का क्रम निम्नवत् होगा:
[Ni(H2O)6]2+ < [Ni(NH3)6]2+ < [Ni(NO2)6]4-
अत: E = \(\frac{h c}{\lambda}\): अवशोषित तरंगदैध्यं विपरीत क्रम में होगी।
