RBSE Solutions for Class 11 Chemistry Chapter 9 हाइड्रोजन
Rajasthan Board RBSE Solutions for Class 11 Chemistry Chapter 9 हाइड्रोजन Textbook Exercise Questions and Answers.
RBSE Class 11 Chemistry Solutions Chapter 9 हाइड्रोजन
RBSE Class 11 Chemistry हाइड्रोजन Textbook Questions and Answers
प्रश्न 9.1.
हाइड्रोजन के इलेक्ट्रॉनिक विन्यास के आधार पर आवर्त सारणी में इसकी स्थिति को युक्तिसंगत ठहराइए।
उत्तर:
हाइड्रोजन आवर्त सारणी का प्रथम तत्त्व है तथा इसका इलेक्ट्रोनिक विन्यास ns1 है। यह विन्यास क्षार धातुओं (प्रथम वर्ग) के समान (ns1) है अतः इसमें विद्युत धनीय गुण होते हैं तथा इसकी संयोजकता एक एवं ऑक्सीकरण अवस्था + 1 है। यह अपचायक भी होता है तथा अधातुओं से क्रिया करता है। लेकिन इसकी आयनन ए-थैल्पी उच्च होती है अतः यह धातु गुण नहीं दर्शाता।
2H2 + O2 → 2H2O
4Na + O2 → 2Na2O
अतः इसे वर्ग संख्या 1 में - s - खण्ड के तत्वों के ऊपर रखा गया है। यह हैलोजनों (वर्ग संख्या 17) से भी अनेक समानताएँ दर्शाता है, क्योंकि इसका इलेक्ट्रॉनिक विन्यास 17वें वर्ग से सम्बन्धित है जो कि संगत उत्कृष्ट गैस विन्यास से एक कम है अतः यह एक इलेक्ट्रॉन ग्रहण कर ऋणायन (-1) बनाता है तथा हैलोजेन के समान द्विपरमाण्वीय अणु बनाता है। परन्तु आधुनिक आवर्त सारणी जो कि इलेक्ट्रोनिक विन्यास पर आधारित है, के अनुसार इसका स्थान युक्तिसंगत है।

प्रश्न 9.2.
हाइड्रोजन के समस्थानिकों के नाम लिखिए तथा बताइए कि इन समस्थानिकों का द्रव्यमान अनुपात क्या है?
उत्तर:
हाइड्रोजन के अभी तक तीन समस्थानिक ज्ञात हैं:
- सामान्य हाइड्रोजन (प्रोटियम) H परमाणु भार 1.0078
- ड्यूटेरियम ( भारी हाइड्रोजन) H अथवा D (परमाणु भार 2.014)
- अति भारी हाइड्रोजन (ट्राइटियम) H अथवा T (परमाणु भार 3.016)
- इनके द्रव्यमान का अनुपात 1.0078 2.0143.016 अर्थात् । : 2 : 3 है।
प्रश्न 9.3.
सामान्य परिस्थितियों में हाइड्रोजन एक परमाण्विक की अपेक्षा द्विपमाण्विक रूप में क्यों पाया जाता है?
उत्तर:
हाइड्रोजन का इलेक्ट्रॉनिक विन्यास Is है, अत: यह अपने निकटतम उत्कृष्ट गैस (He) के समान स्थायी इलेक्ट्रोनिक विन्यास प्राप्त करना चाहता है जिसे प्राप्त करने के लिए दो हाइड्रोजन परमाणु परस्पर संयोग करते हैं तथा ये एक एक इलेक्ट्रॉन का साझा करके स्थायी सहसंयोजक बंध द्वारा द्वि-परमाण्विक अणु (H-H) बनते हैं। इस प्रक्रिया में अधिक मात्रा में ऊर्जा निकलती है। इससे भी इसके स्थायित्व की पुष्टि होती है।
H(g) + H(g) → H2(g), ∆H = - 4358kJ mol-1
प्रश्न 9.4.
'कोल गैसीकरण' से प्राप्त डाइहाइड्रोजन का उत्पादन कैसे बढ़ाया जा सकता है?
उत्तर:
सिन्गैस (कोल गैस) का निर्माण कोल तथा जलवाष्प से बॉश (Bosch Process) विधि द्वारा किया जाता है, इसे कोल गैसीकरण कहते हैं। इस क्रिया में रक्त तप्त कोयले पर 1270K ताप पर जलवाष्प डालते हैं।
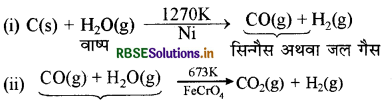
जल गैस के मिश्रण में उपस्थित CO से H2O की क्रिया द्वारा H2 का उत्पादन बढ़ाया जा सकता है। यह क्रिया आयरन क्रोमेट (FeCrO4) उत्प्रेरक द्वारा तीव्रता से होती है। इसे भाप अंगार गैस सृति अभिक्रिया (water gas shift reaction) कहते हैं।
प्रश्न 9.5.
विद्युत अपघटन विधि द्वारा डाइहाइड्रोजन वृहद् स्तर पर किस प्रकार बनाई जा सकती है? इस प्रक्रम में वैद्युत- अपघट्य की क्या भूमिका है?
उत्तर:
जल के विद्युत अपघटन में अल्प मात्रा में अम्ल अथवा क्षार मिलाकर जल की चालकता को बढ़ा दिया जाता है। दो Pt की पत्ती इलेक्ट्रोड का कार्य करती हैं। विद्युत प्रवाहित करने पर H2 गैस कैथोड पर एकत्रित होती है, जबकि O2 गैस एनोड पर एकत्रित होती है। रासायनिक अभिक्रिया निम्न प्रकार से होती है।

Ba(OH)2 के जलीय विलयन की गर्म अवस्था में Ni इलेक्ट्रॉडों को प्रयुक्त करके विद्युत अपघटन करने पर अति शुद्ध हाइड्रोजन (99.95% ) प्राप्त होती है। वैद्युत अपघट्य द्वारा जल का आयनन शीघ्रता से होता है, अतः क्रिया तेजी से होती है तथा शुद्ध H प्राप्त होती है। वैद्युत अपघट्य जल की चालकता को भी बढ़ाता है।
प्रश्न 9.6.
निम्नलिखित समीकरणों को पूर्ण कीजिए:
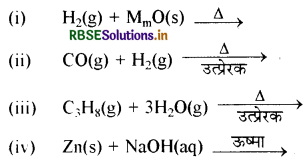
उत्तर:
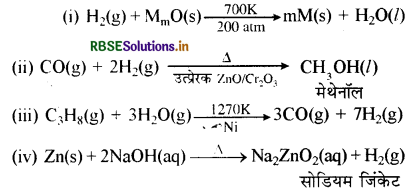

प्रश्न 9.7.
डाइहाइड्रोजन की अभिक्रियाशीलता के पदों में H-H बंध की उच्च एन्थैल्पी के परिणामों की विवेचना कीजिए।
उत्तर:
H-H बंध वियोजन एन्थैल्पी किसी तत्त्व के दो परमाणुओं के बीच एकल बंध के लिए अधिकतम होती है। डाइहाइड्रोजन की उच्च बन्ध ऐन्धैल्पी (435.88 kJ mol- 11) के कारण यह स्थायी होती है। अतः यह सामान्य ताप पर बहुत कम क्रियाशील रहती है, लेकिन उच्च ताप तथा उत्प्रेरक की उपस्थिति के कारण इसकी क्रियाशीलता बढ़ जाती है।
प्रश्न 9.8.
हाइड्रोजन के (i) इलेक्ट्रॉन न्यून, (ii) इलेक्ट्रॉन परिशुद्ध तथा (iii) इलेक्ट्रॉन समृद्ध यौगिकों से आप क्या समझते हैं ? उदाहरणों द्वारा समझाइए ।
उत्तर:
- इलेक्ट्रॉन न्यून हाइड्राइड्स: इनमें इलेक्ट्रॉन की कमी होती है। उदाहरण डाई बोरेन (B2H6) बोरोन का एक इलेक्ट्रॉन न्यून हाइड्राइड है। वर्ग संख्या I3 के सभी हाइड्राइड्स जैसे BH3, AlH3 इलेक्ट्रॉन न्यून व्यवहार दर्शाते हैं। इनके पास इलेक्ट्रॉनों की कमी होती है अतः ये लुइस अम्ल की भाँति व्यवहार करते हैं तथा ये इलेक्ट्रॉनग्राही होते हैं।
- इलेक्ट्रॉन परिशुद्ध यौगिक: इनमें पर्याप्त मात्रा में इलेक्ट्रॉन होते हैं। कार्बन, सिलिकॉन (वर्ग 14 ) इत्यादि के हाइड्राइड्स इलेक्ट्रॉन परिशुद्ध यौगिक कहलाते हैं जैसे CH4 C2H6, SiH4, GeH4 इत्यादि।
- इलेक्ट्रॉन समृद्ध यौगिक: ये वे यौगिक हैं जिनमें एकाकी इलेक्ट्रॉन युग्म पाये जाते हैं। हाइड्रोजन के इस प्रकार के यौगिकों के उदाहरण NH3, H2O PH3 इत्यादि हैं। ये वर्ग 15, 16 तथा 17 के तत्त्वों से बने होते हैं।
प्रश्न 9.9.
संरचना एवं रासायनिक अभिक्रियाओं के आधार पर बताइए कि इलेक्ट्रॉन न्यून हाइड्राइड के कौन-कौनसे अभिलक्षण होते हैं?
उत्तर:
(i) इलेक्ट्रॉन न्यून हाइड्राइड्स क्रियाशील होते हैं तथा वे धातु तथा अधातुओं से शीघ्रता से क्रिया करते हैं। कुछ मुख्य उदाहरण निम्नलिखित हैं:
B2Hg + 3O2 → B2O3 + 3H2O
B2Hg + 6Cl2 → 2BCl3 + 6HCl
(ii) ये इलेक्ट्रॉन ग्राही की तरह व्यवहार दर्शाते हैं क्योंकि इनके पास इलेक्ट्रॉन की कमी होती है अतः ये इलेक्ट्रॉन न्यून यौगिक होते हैं।
B2H6 + NH3 → [BH2(NH3)2+] [BH4]-
B2Hg + 2NaH → 2Na+ [BH4]-
इनमें उप-सहसंयोजक बंध (दाता-ग्राही बंध) पाया जाता है। उपरोक्त उदाहरण में NH3 दाता है तथा B2H6 ग्राही (acceptor) की भाँति व्यवहार दर्शाता है। ये बहुलक के रूप में पाए जाते हैं।
प्रश्न 9.10.
क्या आप आशा करते हैं कि (Cn H2n+2) कार्बनिक हाइड्राइड लूइस अम्ल या क्षार की भाँति कार्य करेंगे? अपने उत्तर को युक्तिसंगत ठहराइए।
उत्तर:
Cn H2n+2 संतृप्त हाइड्रोकार्बन्स का सामान्य सूत्र है अर्थात् ये कार्बन के संतृप्त हाइड्राइड्स हैं। इनमें प्रबल सहसंयोजक बंध पाया जाता है तथा ये इलेक्ट्रॉन परिशुद्ध हाइड्राइड हैं अतः ये लूइस अम्ल या क्षार की तरह व्यवहार नहीं करते हैं क्योंकि इनमें इलेक्ट्रॉन की कमी या अधिकता नहीं होती है।
प्रश्न 9.11.
अरससमीकरणमितीय हाइड्राइड (Non- stochiometric hydride) से आप क्या समझते हैं? क्या आप क्षारीय धातुओं से ऐसे यौगिकों की आशा करते हैं? अपने उत्तर को न्यायसंगत ठहराइए।
उत्तर:
वे हाइड्राइड जिनमें स्थिर संगठन का नियम लागू नहीं होता तथा इनमें हाइड्रोजन की न्यूनता होती है, उन्हें अरससमीकरणमितीय हाइड्राइड कहते हैं। जैसे - LaH 2.87, ZrH 1.3 - 1.75 इनमें धातु तथा हाइड्रोजन का अनुपात भिन्नों में होता है जो कि ताप तथा दाब पर निर्भर करता है। सामान्यतः ये d तथा f-ब्लॉक के तत्वों से बनते हैं। क्षार धातु ऐसे यौगिक नहीं बनाते क्योंकि ये हाइड्रोजन परमाणु को इलेक्ट्रॉन देकर H बनाते हैं अतः इनके हाइड्राइड आयनिक होते हैं। इनमें धातु तथा हाइड्रोजन का अनुपात निश्चित होता है, अतः क्षार धातु केवल रससमीकरणमितीय हाइड्राइड ही बनाते हैं।

प्रश्न 9.12.
हाइड्रोजन भंडारण के लिए धात्विक हाइड्राइड किस प्रकार उपयोगी है? समझाइए।
उत्तर:
संक्रमण तत्वों द्वारा बनाये गये हाइड्राइड धात्विक हाइड्राइड्स होते हैं। इनमें धातु के जालक में पर्याप्त रिक्त स्थान पाया जाता है जिसमें धातु द्वारा अपने आयतन से कई गुना अधिक हाइड्रोजन अवशोषित कर ली जाती है। वास्तव में यह हाइड्रोजन परमाणुओं के रूप में धातु के पृष्ठ पर अधिशोषित हो जाती है। जैसे - Pt, Pd, Ni इत्यादि अपने आयतन से 80 गुना अधिक मात्रा में H2 गैस अधिशोषित (Adsorb) करके इसका भंडारण (storage) करते हैं। जब इन्हें गर्म किया जाता है तो ये अपघटित होकर हाइड्रोजन को मुक्त कर देते हैं तथा पुनः धाविक अवस्था में आ जाते हैं। इस प्रकार मुक्त हाइड्रोजन ईंधन की तरह प्रयुक्त होती है, अतः इनका उपयोग हाइड्रोजन के भण्डारण में किया जाता है।
प्रश्न 9.13.
कर्तन (Cutting) और वेल्डिंग में परमाण्वीय हाइड्रोजन अथवा ऑक्सी हाइड्रोजन टॉर्च किस प्रकार कार्य करती है? समझाइए।
उत्तर:
(i) परमाण्वीय तथा ऑक्सी हाइड्रोजन टॉर्च इस सिद्धान्त पर कार्य करती है कि यदि हाइड्रोजन को उच्च दाब एवं ताप पर प्रवाहित कर विद्युत स्फुलिंग (Electric-spark) किया जाये तो इसके बंध टूट जाते हैं तथा यह उच्च दाब से परमाण्विक (सक्रिय) हाइड्रोजन के रूप में आ जाती है। यह परमाण्विक हाइड्रोजन अस्थायी (जीवन काल 0.3 sec ) होती है। अतः इन हाइड्रोजन परमाणुओं के पुनः संयोग से टंग्स्टन धातु की सतह पर लगभग 4000 K तक ताप उत्पन्न हो जाता है। अतः यह क्रिया ऊष्माक्षेपी (Exothermic) होती है जिससे इसका उपयोग धातुओं को मोड़ने, जोड़ने तथा काटने में किया जाता है। विद्युत स्फुलिंग
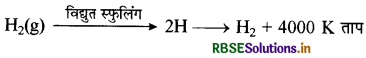
∆H = + 436kJ mol-1
(ii) ऑक्सी- हाइड्रोजन टॉर्च में H1⁄2 के अणु को O2 के साथ आनुपातिक मात्रा में मिलाकर ऊष्मा उत्पन्न की जाती है, क्योंकि यह एक ऊष्माक्षेपी अभिक्रिया है। उत्पन्न ऊष्मा को धातुओं के कर्तन (cutting) तथा वेल्डिंग में प्रयुक्त किया जाता है।
प्रश्न 9.14.
NH3, H2O तथा HF में से किसमें हाइड्रोजन बंध का परिमाण उच्चतम अपेक्षित है और क्यों?
उत्तर:
हाइड्रोजन बंध की प्रबलता परमाणु की विद्युत ऋणता तथा आकार पर निर्भर करती है। यह बंध दो विद्युतऋणी परमाणुओं के मध्य हाइड्रोजन परमाणु के आने से बनता है। चूँकि F की विद्युत ॠणता का मान अधिकतम होता है तथा इसका आकार छोटा होता है। अतः H-F बन्ध की ध्रुवता सबसे अधिक होती है। इसलिए HF में हाइड्रोजन बंध का परिमाण उच्चतम होता है।
प्रश्न 9.15.
लवणीय हाइड्राइड जल के साथ प्रबलता से अभिक्रिया करके आग उत्पन्न करती है। क्या इसमें CO2 (जो एक सुपरिचित अग्निशामक है) का उपयोग हम कर सकते हैं? समझाइए।
उत्तर:
लवणीय हाइड्राइड जल के साथ विस्फोटक अभिक्रिया करके H2 गैस देते हैं जिसके दहन से आग उत्पन्न होती है।
उदाहरण:
NaH + H2O → NaOH(aq) + H2 ↑
इस आग को बुझाने के लिए CO2 का प्रयोग नहीं कर सकते क्योंकि यह गर्म धातु हाइड्राइड द्वारा अपचयित होकर फार्मेट आयन बनाती है।
NaH + CO2 → HCOONa
अतः इस प्रकार की आग को साबुन के घोल अथवा रेत (sand) जैसे अग्निशामकों द्वारा बुझाया जाता है।
प्रश्न 9.16.
निम्नलिखित को व्यवस्थित कीजिए:
(i) CaH2, BeH2 तथा TiH2 को उनकी बढ़ती हुई विद्युत चालकता के क्रम में।
(ii) LiH, NaH तथा CsH को आयनिक गुण के बढ़ते हुए क्रम में।
(iii) H-H, D-D तथा F F को उनके बंध- वियोजन एंथैल्पी के बढ़ते हुए क्रम में।
(iv) NaH, MgH2 तथा HO को बढ़ते हुए अपचायक गुण के क्रम में।
उत्तर:
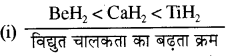
व्याख्या - BeH2 सहसंयोजक हाइड्राइड है, CaH2 पिघली हुई अवस्था में विद्युत का चालन करता है जबकि TiH सामान्य अवस्था में विद्युत का सुचालक है। वर्ग में आयनन एन्थैल्पी कम होती है, अतः इन हाइड्राइडों का आयनिक गुण बढ़ता है।
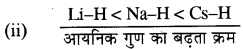
व्याख्या - LiH में थोड़ा सहसंयोजी गुण होता है जबकि NaH तथा CsH आयनिक हाइड्राइड हैं।
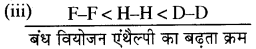
व्याख्या - F F में फ्लुओरीन परमाणुओं पर एकाकी युग्म उपस्थित होने के कारण इनके मध्य प्रतिकर्षण होता है अतः इसकी बन्ध वियोजन एन्बैल्पी सबसे कम होती है। चूँकि ड्यूटेरियम का परमाणु आकार हाइड्रोजन से कम होता है, अतः इसकी बंध वियोजन एन्थैल्पी H2 की बन्ध वियोजन एन्थेल्पी से अधिक होती है।
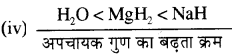
व्याख्या - जल तथा MgH2 सहसंयोजक हाइड्राइड हैं, लेकिन OH बंध वियोजन ऊर्जा Mg-H बन्ध वियोजन ऊर्जा से अधिक होती है। अतः जल का अपचायक गुण MgH2 से कम होता है जबकि NaH एक आयनिक हाइड्राइड है, जो कि प्रबल अपचायक होता है।
प्रश्न 9.17
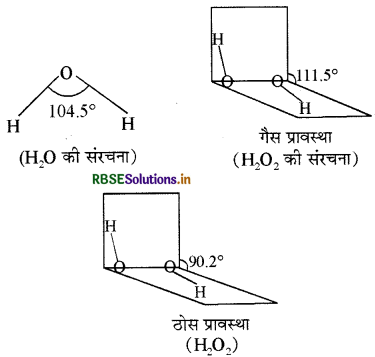
H2O तथा H2O2 की संरचनाओं की तुलना कीजिए।
उत्तर:
H2O में sp संकरण पाया जाता है तथा इसकी कोणीय (Angular), बंकित या V आकृति (संरचना) होती है जिसमें बंध कोण 104.5° होता है। H2O2 की संरचना खुली पुस्तक की तरह तथा असमतलीय होती है जिसमें द्विफलकीय कोण 111.5° होता है। H2O2 की ठोस अवस्था में बन्ध कोण 90.2° होता है। H2O2 में भी sp संकरण होता है तथा इसके दो OH बन्ध भिन्न तल में उपस्थित होते हैं।
प्रश्न 9.18.
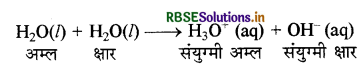
जल के स्वतः प्रोटोनीकरण से आप क्या समझते हैं? इसका क्या महत्व है?
उत्तर:
जल एक अम्ल तथा क्षार दोनों की तरह व्यवहार करता है अतः यह उभयधर्मी होता है। यह स्वतः आयनन द्वारा हाइड्रोनियम आयन तथा हाइड्रॉक्साइड आयन देता है जिसे निम्न प्रकार से प्रदर्शित करते हैं।
जल अपने से प्रबल अम्लों से क्रिया करके क्षार की तरह तथा क्षारों से क्रिया करके अम्लीय गुण दर्शाता है।

प्रश्न 9.19.
F2 के साथ जल की अभिक्रिया में ऑक्सीकरण तथा अपचयन के पदों पर विचार कीजिए तथा बताइए कि कौनसी स्पीशीज़ ऑक्सीकृत या अपचयित होती है?
उत्तर:
F2 की H2O से क्रिया, रेडॉक्स उपापचयी अभिक्रिया होती है जिसमें F2 ऑक्सीकारक तथा H2O अपचायक की तरह व्यवहार करता है। जल ऑक्सीकृत होकर O2 मुक्त करता है जबकि F2 अपचयित होकर F देती है। संपूर्ण रासायनिक अभिक्रिया निम्न प्रकार होती है:
2F2(g) + 2H2O(l) → 4H(aq) + 4F(aq) + O2(g)
प्रश्न 9.20.
निम्नलिखित अभिक्रियाओं को पूर्ण कीजिए:
(i) PbS(s) + H2O2 (aq) →
(ii) MnO4- (aq) + H2O2 (aq) →
(iii) CaO (s) + H2O(g) →
(iv) AlCl3 (g) + H2O(l) →
(v) Ca3N2 (s) + H2O(l) →
उपर्युक्त को (क) जल अपघटन (ख) अपचयोपचय (Redox) तथा (ग) जलयोजन अभिक्रियाओं में वर्गीकृत कीजिए।
उत्तर:
उपर्युक्त अभिक्रियाएँ निम्नलिखित हैं- (संतुलित)
(i) PbS(s) + 4H2O2(aq) → PbSO4(s) + 4H2O(l)
यह अपचयोपचय (Redox ) अभिक्रिया है।
(ii) 2MnO4 (aq) + 5H2O2 (aq) + 6H+(aq) → 2Mn2+(aq) + 8H2O(l) + 5O2(g)
यह भी एक अपचयोपचय (Redox ) अभिक्रिया है ।
(iii) CaO(s) + H2O(g) → Ca(OH)2(aq)
यह जल योजन अभिक्रिया है।
(iv) AlCl3(g) + 3H2O(l) → Al(OH)3(s) + 3HCl(aq)
यह जल अपघटन की अभिक्रिया है।
(v) Ca3N2(s) + 6H2O (l) → 3Ca(OH)2(aq) + 2NH3(aq)
यह भी जल अपघटन की अभिक्रिया है।
प्रश्न 9.21.
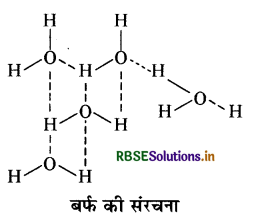
बर्फ के साधारण रूप की संरचना का उल्लेख कीजिए।
उत्तर:
बर्फ की एक सुव्यवस्थित त्रिविमीय हाइड्रोजन बंधित संरचना होती है। X - किरणों द्वारा अध्ययन से ज्ञात होता है कि बर्फ के क्रिस्टल में एक ऑक्सीजन परमाणु चार हाइड्रोजन परमाणुओं से चतुष्फलकीय रूप से घिरा होता है। हाइड्रोजन बंध के कारण बर्फ की वृहद् छिद्रयुक्त, खुली संरचना होती है।
प्रश्न 9.22.
जल की अस्थायी एवं स्थायी कठोरता के क्या कारण हैं? वर्णन कीजिए।
उत्तर:
जल एक सार्वभौमिक (Universal) विलायक है। वर्षा का जल इसका शुद्धतम रूप होता है परन्तु जब यह जमीन पर गिरता है तो मृदा में उपस्थित बाइकार्बोनेट, क्लोराइड सल्फेट Ca2+ तथा Mg 2+ आयन इसे कठोर बना देते हैं। जल की अस्थायी कठोरता का कारण Ca(HCO3)2 तथा Mg (HCO3)2 हैं जबकि स्थायी कठोरता का कारण विलेयशील कैल्सियम तथा मैग्नीशियम क्लोराइड (CaCl2, MgCl2) एवं सल्फेट (CaSO4. MgSO4) हैं।
प्रश्न 9.23.
संश्लेषित आयन विनिमयक विधि द्वारा कठोर जल के मृदुकरण के सिद्धांत एवं विधि की विवेचना कीजिए।
उत्तर:
आयन विनिमयक संश्लेषित रेजिन्स द्वारा (By the Synthetic Ion Exchange Resins): जल की कठोरता दूर करने की यह एक नई, सस्ती एवं सरल विधि है। इस विधि में मुख्यतः संश्लेषित धनायन विनिमयक रेजिन्स का प्रयोग करते हैं। धनायन विनिमयक रेजिन SOH समूहयुक्त जल में अविलेय वृहत (large) कार्बनिक यौगिक होते हैं। इस आयन विनिमय रेजिन (RSOH) की NaCl से क्रिया कराके इसे RNa में परिवर्तित कर लिया जाता है। यहाँ R एक रेजिन ऋणायन है। यह रेजिन कठोर जल में उपस्थित Ca2+ तथा Mg2+ का विनिमय Na+ से करके कठोर जल को मृदु कर देता है।
2RNa + Ca2+(aq) → R2Ca(s) + 2Na+(aq)
रेजिन को पुनर्जनित करने के करवायी जाती है। जल को क्रमशः धनायन विनिमयक तथा ऋणायन लिए इसकी क्रिया NaCl के साथ विनिमयक रेजिन में से प्रवाहित करके शुद्ध जल प्राप्त किया जाता है।
2RH(s) + M2 (aq) → R2M(s) + 2H+(aq) (M2+ = Ca2+ / Mg2+ )
धनायन विनिमय प्रक्रम में जल में उपस्थित Ca2+ तथा Mg2+ आयन का विनिमय H+ द्वारा हो जाता है तथा प्रोटॉन (H) का निष्कासन होता है जिससे जल अम्लीय हो जाता है।
इसी प्रकार ऋणायन विनिमय उपस्थित Cl- SO42- तथा HCO3- प्रक्रम में OH का विनिमय जल में (x) आयनों द्वारा होता है।
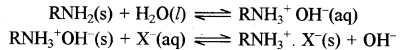
इस प्रक्रम में OH- आयन निष्कासित होते हैं जो कि धनायन विनिमय से निष्कासित H' आयनों से क्रिया करके HO बनाते हैं जिससे जल उदासीन हो जाता है तथा प्राप्त जल विखनिजित (Demineralised) एवं विआयनित (Deionised) होता है।
H+(aq) + OH-(aq) → H2O(l)
जब धनायन तथा ऋणायन विनिमयकों के रेजिन तलों का पूर्ण रूप से उपयोग हो जाता है तो इन्हें क्रमश: तनु अम्ल तथा तनु क्षार विलयनों से अभिक्रिया कराकर पुनर्जनित कर लिया जाता है।

प्रश्न 9.24.
जल के उभयधर्मी स्वभाव को दर्शाने वाले रासायनिक समीकरण लिखिए।
उत्तर:
रासायनिक अभिक्रियाओं में जल अम्ल तथा क्षार दोनों के गुण प्रदर्शित करता है। उपर्युक्त दोनों प्रकार की अभिक्रियाओं के उदाहरण निम्नलिखित हैं।
अम्ल के रूप में:
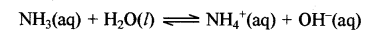
क्षार के रूप में
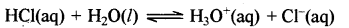
प्रश्न 9.25.
हाइड्रोजन परॉक्साइड के ऑक्सीकारक एवं अपचायक रूप को अभिक्रियाओं द्वारा समझाइए।
उत्तर:
H2O2 एक प्रबल ऑक्सीकारक तथा दुर्बल अपचायक है। यह अम्लीय तथा क्षारीय माध्यम में ऑक्सीकारक एवं अपचायक दोनों व्यवहार दर्शाता है। इसके प्रमुख उदाहरण निम्नलिखित हैं:
(a) अम्लीय माध्यम में H2O2 ऑक्सीकारक के रूप में:
(i) 2Fe2+(aq) + 2H+(aq) + H2O2 (aq) → 2Fe2+(aq) + 2H2O(l)
(ii) PbS( s) + 4H2O2(aq) → PbSO(s) + 4H2O(l)
(b) अम्लीय माध्यम में H2O2 अपचायक के रूप में:
(i) 2MnO4 (aq) + 6H+(aq) + 5H2O2(aq) → 2Mn2+(aq) + 8H2O(l) + 5O2(g)
(ii) HOCl(aq) + H2O2(aq) → H3O+ (aq) + Cl(aq) + O2 (g)
(c) क्षारीय माध्यम में H2O2 ऑक्सीकारक के रूप में:
(i) 2Fe2+(aq) + H2O2 (aq) → 2Fe3+(aq) + 2OH-(aq)
(ii) Mn" (aq) + H2O2 (aq) → Mn4+(aq) + 2OH-(aq)
(d) क्षारीय माध्यम में H2O2 अपचायक के रूप में:
(i) I2(s) + H2O2(aq) + 2OH (aq) → 2I-(aq) + 2H2O(l) + O2(g)
(ii) 2MnO4- (aq) + 3H2O2 (aq) → 2MnO2 (s) + 3O2(g) + 2H2O(l) + 2OH-(aq)
प्रश्न 9.26.
विखनिजित जल से क्या अभिप्राय है? यह कैसे प्राप्त किया जा सकता है?
उत्तर:
सभी प्रकार के धनायनों तथा ऋणायनों से मुक्त जल को विखनिजित जल (Demineralised) कहते हैं। इसे सामान्य जल पर आयन विनिमयित क्रिया (lon Exchanged Reaction) द्वारा प्राप्त किया जाता है। कठोर जल पर रेजिन्स द्वारा उपचार करके भी विखनिजित जल प्राप्त कर सकते हैं। H2 तथा O2 के संयोग से बना जल भी विखनिजित जल होता है।
प्रश्न 9.27.
क्या विखनिजित या आसुत जल पेय प्रयोजनों में उपयोगी है? यदि नहीं, तो इसे उपयोगी कैसे बनाया जा सकता है?
उत्तर:
विखनिजित जल पूर्णतया आयनों से मुक्त होता है, अतः यह पीने में प्रयुक्त नहीं किया जाता है। इसमें कोई भी आवश्यक खनिज भी नहीं पाया जाता है। इसलिए इसे पीने योग्य बनाने हेतु निश्चित मात्रा में उपयोगी खनिज मिलाए जाते हैं।
प्रश्न 9.28.
जीवमंडल एवं जैव प्रणालियों में जल की उपादेयता (Usefulness) को समझाइए।
उत्तर:
अन्य द्रवों की तुलना में जल का क्वथनांक, हिमांक, वाष्पन ऊष्मा, संलयन ऊष्मा, विशिष्ट ऊष्मा, तापीय चालकता, पृष्ठ तनाव, द्विध्रुव आघूर्ण तथा परावैद्युतांक के मान उच्च होते हैं। इन्हीं गुणों के कारण जीवमण्डल में जल की महत्त्वपूर्ण भूमिका होती है। प्राणियों तथा पादपों का 65-70% भाग जल होता है। जल की उच्च वाष्पन ऊष्मा तथा उच्च ऊष्माधारिता (Heat capacity) ही जीवों के शरीर तथा जलवायु के सामान्य ताप को बनाए रखने के लिए उत्तरदायी है। वनस्पतियों एवं प्राणियों के उपापचय (Metabolism) में अणुओं के अभिगमन के लिए जल एक उत्तम विलायक का कार्य करता है। प्रकाश संश्लेषण में भी जल का प्रयोग होता है, जिसके द्वारा वातावरण में O2 गैस मुक्त होती है।
प्रश्न 9.29.
जल का कौनसा गुण इसे विलायक के रूप में उपयोगी बनाता है? यह किस प्रकार के यौगिक:
(i) घोल सकता है और (ii) जल अपघटन कर सकता है?
उत्तर:
जल में स्थायी ध्रुवता पायी जाती है तथा इसका परावैद्युत स्थिरांक एवं द्विध्रुव आघूर्ण (Dipolemoment ) उच्च होता है। अतः यह एक आदर्श विलायक का कार्य करता है। जल उदासीन प्रकृति का होता है तथा यह 0°C से 100°C तक उपयोगी होता है। उच्च ध्रुवता के कारण जल आयनिक पदार्थों तथा अंतराअणुक H- बंध के कारण कुछ ध्रुवीय सहसंयोजक यौगिकों के लिए विलायक के रूप में प्रयुक्त किया जाता है। अतः जल ध्रुवता रखने वाले यौगिकों (Polar Compounds ) को घोल लेता है तथा सहसंयोजी यौगिकों तथा लवणों का जल अपघटन कर देता है। अनेक यौगिकों की जल अपघटन की अभिक्रियाएँ निम्नलिखित हैं।
Al4C3(s) + 12H2O(l) → 4Al(OH)3(aq) + 3CH4(g)
P4O10(s) + 6H2O(l) → 4H3PO4(aq)
Mg3N2(s) + 6H2O(l) → 2NH3(g) + 3Mg(OH)2(aq)
SiCl4 (7) + 2H2O(I) → SiO2 (s) + 4HCl(aq)

प्रश्न 9.30.
H2O एवं D2O के गुणों को जानते हुए क्या आप मानते हैं कि D2O का उपयोग पेय प्रयोजनों के रूप में लाया जा सकता है?
उत्तर:
D2O को भारी जल कहते हैं। यह प्राणियों तथा वनस्पतियों के लिए हानिकारक होता है, क्योंकि इसकी प्रकृति विषैली होती है अतः इसे पेय प्रयोजनों हेतु प्रयुक्त नहीं किया जाता है। D2O जैविक उपापचय क्रियाओं जैसे कोशिका विभाजन को अति मन्द कर देता है, इससे पादपों की वृद्धि नहीं होती है तथा यह सामान्य जल के समान व्यवहार नहीं दर्शाता है।
प्रश्न 9.31.
'जल अपघटन (Hydrolysis) तथा 'जलयोजन' (Hydration) पदों में क्या अंतर है?
उत्तर:
किसी यौगिक की जल से क्रिया को जल अपघटन कहते हैं जैसे किसी लवण की जल से क्रिया होकर अम्ल तथा क्षार बनते हैं।

इसी प्रकार SiCl4 के जल अपघटन से SiO2 तथा HCl बनते हैं। SiCl4 + 2H2O → SiO2 + 4HCl
लेकिन जलयोजन (Hydration) वह प्रक्रिया है जिसमें किसी सरल लवण, अनार्द्र लवण (Anhydrous salt) अथवा संकुल आयन से जल का अणु जुड़ता है। उदाहरण: [ Fe (H2O)6] Cl3 में जल के अणुओं द्वारा FeCl3 जालक का जलयोजन होता है तथा CuSO4 के जलयोजित जालक को संकुल के रूप में निम्न प्रकार से प्रदर्शित किया जाता है:
CuSO4. H2O + 4H2O → [Cu(H2O)4]2 + SO42- . H2O (नीला संकुल)
इसी प्रकार आयनिक यौगिकों को जल में घोलने पर उनके आयनों का भी जलयोजन हो जाता है।
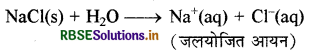
प्रश्न 9.32.
लवणीय हाइड्राइड किस प्रकार कार्बनिक यौगिकों से अति सूक्ष्म जल की मात्रा को हटा सकते हैं?
उत्तर:
कक्ष ताप पर लवणीय हाइड्राइड जैसे NaH, CaH2 शीघ्रता से जल से क्रिया करते हैं तथा हाइड्रोजन गैस निकालते हैं क्योंकि ये प्रबल अपचायक होते हैं। अतः इनका उपयोग जल की अति सूक्ष्म मात्रा को निकालने में किया जाता है। इनकी रासायनिक अभिक्रिया निम्न प्रकार होती है:
MH + H2O2(l) → MOH + H2(g)↑
अतः कार्बनिक यौगिक का लवणीय हाइड्राइड पर आसवन करने पर हाइड्रोजन गैस मुक्त हो जाती है तथा जलविहीन कार्बनिक यौगिक पृथक् हो जाते हैं।
प्रश्न 9.33.
परमाणु क्रमांक 15, 19, 23 तथा 44 वाले तत्व यदि डाइहाइड्रोजन से अभिक्रिया कर हाइड्राइड बनाते हैं, तो उनकी प्रकृति से आप क्या आशा करेंगे? जल के प्रति इनके व्यवहार की तुलना कीजिए।
उत्तर:
(i) परमाणु क्रमांक 15 का तत्व फॉस्फोरस है। यह एक अधात्विक तत्व है तथा हाइड्रोजन से अभिक्रिया कर यह अधात्विक हाइड्राइड, फॉस्फीन (PH) बनाता है जो कि एक सहसंयोजी हाइड्राइड है।
(ii) परमाणु क्रमांक 19 पोटेशियम का है, यह एक धातु है। इसका हाइड्राइड KH एक लवणीय हाइड्राइड है।
(iii) परमाणु क्रमांक 23 वाला तत्व एक संक्रमण तत्व वैनेडियम है। यह अंतराकाशी हाइड्राइड VHo.5 बनाता है।
(iv) परमाणु क्रमांक 44 रुथेनियम का है। यह आठवें समूह का तत्व है अतः यह हाइड्राइड नहीं बनाता है। उपरोक्त सभी हाइड्राइडों में केवल KH ही जल में शीघ्रता से क्रिया करता है तथा तेजी से हाइड्रोजन गैस मुक्त करता है।
2KH(s) + 2H2O(l) → 12KOH (aq) + 2H2 (g)

प्रश्न 9.34.
जब ऐलुमिनियम (III ) क्लोराइड एवं पोटैशियम क्लोराइड को अलग-अलग (i) सामान्य जल, (ii) अम्लीय जल एवं (iii) क्षारीय जल से अभिकृत कराया जाएगा, तो आप किन-किन विभिन्न उत्पादों की आशा करेंगे? जहाँ आवश्यक हो वहाँ रासायनिक समीकरण दीजिए।
उत्तर:
ऐलुमिनियम ( III ) क्लोराइड (AICI) एक दुर्बल क्षार [Al(OH)] तथा प्रबल अम्ल (HCI) से बना लवण है। यह साधारण जल से जल अपघटित हो जाता है तथा अभिक्रिया निम्न प्रकार होती है:
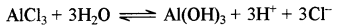
अम्लीय जल में इसका आयनन होकर Al3+ तथा Cl- प्राप्त होते है।
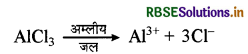
जबकि क्षारीय जल में AlCl3, मेटाऐलुमिनेट आयन तथा टेट्रा हाइड्रॉक्सो एलुमिनेट आयन बनाता है।
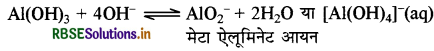
पोटैशियम क्लोराइड (KCl) प्रबल अम्ल (HCl) तथा प्रबल क्षार (KOH) से बना लवण है। यह सामान्य जल में उदासीन व्यवहार दर्शाता है तथा निम्न प्रकार आयनित होता है क्योंकि इसका जल अपघटन नहीं होता।

KCl का यह व्यवहार अम्लीय क्षारीय तथा उदासीन विलयन में समान रहता है।
प्रश्न 9.35.
H2O2 विरंजनकारक के रूप में कैसे व्यवहार करता है? लिखिए।
उत्तर:
H2O2 अपघटित होकर नवजात ऑक्सीजन देता है, अतः यह एक विरंजक कारक की तरह कार्य करता है। यह नवजात ऑक्सीजन पदार्थ को ऑक्सीकृत कर देती है। नम अवस्था में इस प्रकार से प्राप्त नवजात ऑक्सीजन रेशम, सिल्क, पुष्प, बाल, नरम लकड़ी इत्यादि का रंग उड़ाने में प्रयुक्त की जाती है।
H2O2 → H2O + [O]
प्रश्न 9.36.
निम्नलिखित पदों से आप क्या समझते हैं?
(i) हाइड्रोजन अर्थव्यवस्था,
(ii) हाइड्रोजनीकरण,
(iii) सिन्गैस,
(iv) भाप अंगार गैस सृति अभिक्रिया तथा
(v) ईंधन सेल।
उत्तर:
(i) हाइड्रोजन अर्थव्यवस्था हाइड्रोजन अर्थव्यवस्था का मूल सिद्धान्त ऊर्जा का द्रव हाइड्रोजन अथवा गैसीय हाइड्रोजन के रूप में अभिगमन (Transportation) तथा भण्डारण है। इसका मुख्य उद्देश्य तथा लाभ, ऊर्जा का संचरण विद्युत ऊर्जा के रूप में न होकर हाइड्रोजन के रूप में होना है। हमारे देश में प्रथम बार 2005 में हाइड्रोजन को स्वचालित वाहनों के ईंधन के रूप में प्रयुक्त किया गया था। आजकल हाइड्रोजन का उपयोग ईंधन सेलों में विद्युत उत्पादन के लिए किया जाता है।
(ii) हाइड्रोजनीकरण हाइड्रोजनीकरण की क्रिया सामान्यतः कार्बनिक रसायन में होती है। इस क्रिया के अन्तर्गत असंतृप्त हाइड्रोकार्बन अथवा उनके व्युत्पन्नों के साथ हाइड्रोजन का योग होकर संतृप्त उत्पाद बनते हैं। हाइड्रोजनीकरण के कुछ उदाहरण निम्नलिखित हैं:
(a) ऐलकाइन का ऐल्कीन तथा एल्केन में परिवर्तन
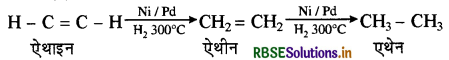
(b) वनस्पति तेलों का वसा में परिवर्तन

(iii) सिनौस: CO तथा H2 का मिश्रण सिन्गैस कहलाता है। इसे जल गैस (Water gas) भी कहा जाता है। रक्त तप्त कोक पर जलवाष्प प्रवाहित करके सिन्गैस प्राप्त की जाती है। CO + H2 का मिश्रण मेथेनॉल तथा कई हाइड्रोकार्बनों के संश्लेषण में प्रयुक्त होता है अतः इसे संश्लेषण गैस या सिन्नगैस (Syngas) कहते हैं।
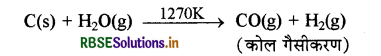
(iv) भाप - अंगार गैस सृति अभिक्रिया: CO गैस जब आयरन क्रोमेट (FeCrO4) उत्प्रेरक की उपस्थिति में जलवाष्प से क्रिया करती है तो भाप - अंगार गैस बनती है। इसे भाप अंगार गैस सृति (Shift) अभिक्रिया कहते हैं। इससे हाइड्रोजन का व्यावसायिक उत्पादन किया जाता है।
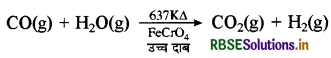
इस मिश्रण से CO2 गैस को सोडियम आर्सीनेट के साथ क्रिया द्वारा पृथक् किया जाता है।
(v) ईंधन सेल - अंतरिक्ष यानों में प्रयुक्त होने वाली वह सेल जो ईंधन के दहन से उत्पन्न ऊर्जा को सीधे ही विद्युत ऊर्जा में बदल देती है, उसे ईंधन सेल कहते हैं। इस प्रकार की सेल का सरल उदाहरण H2O2 ईंधन सेल है। इसकी क्षमता 95% होती है। इससे प्रदूषण नहीं होता है तथा इससे दूसरे ईंधनों की तुलना में अधिक ऊर्जा उत्पन्न होती है।
