RBSE Solutions for Class 11 Chemistry Chapter 8 अपचयोपचय अभिक्रियाएँ
Rajasthan Board RBSE Solutions for Class 11 Chemistry Chapter 8 अपचयोपचय अभिक्रियाएँ Textbook Exercise Questions and Answers.
RBSE Class 11 Chemistry Solutions Chapter 8 अपचयोपचय अभिक्रियाएँ
RBSE Class 11 Chemistry अपचयोपचय अभिक्रियाएँ Textbook Questions and Answers
प्रश्न 8.1.
निम्नलिखित स्पीशीज़ में प्रत्येक रेखांकित तत्त्व की ऑक्सीकरण संख्या का निर्धारण कीजिए:
(क) NaH2PO4
(ग) H4P2O7
(ख) NaHSO4
(घ) K2MnO4
(च) NaBH4
(ङ) CaO2
(ज) KAl(SO4)2. 12H2O
(छ) H2S2O7
उत्तर:
(क) NaH2PO4 में माना कि P की ऑक्सीकरण संख्या P की ऑक्सीकरण संख्या है, अतः अणु में उपस्थित सभी तत्त्वों की ऑक्सीकरण संख्या लिखने पर
NaH2PO4
+ 1 + 1 x - 2
(+1) + [(+1) × 2] + (x) + [(−2) × 4] = 0
x = +8 - 3
x = +5
अत: NaH2PO4 में P की ऑक्सीकरण संख्या +5 है।
(ख) NaHSO4 में S की ऑक्सीकरण संख्या
NaHSO4
+ 1 + 1 x - 2
(+1) + (+1) + (x) + [(-2) × 4] = 0
x = +8 - 2
x = +6
(ग) H4P2O7 में P की ऑक्सीकरण संख्या
H4P2O7
+ 1 x - 2
[(+1) × 4] + [(x) × 2] + [(2) × 7] = 0
2x = +14 - 4
2 x = + 10
x = +5
(घ) KMnO4 में Mn की ऑक्सीकरण संख्या
K2MnO4
+ 1 x - 2
[(+1) × 2] + (x) + [(−2) × 4] = 0
x = +8 - 2
x = +6
(ङ) CaO2 में 0 की ऑक्सीकरण संख्या
CaO2
+2 x
(+2) + 2(x) = 0
2x = 2
x = -1
(च) NaBH4 में B की ऑक्सीकरण संख्या
NaBH4
+ 1 x - 1
(यहाँ H4 हाइड्राइड के रूप में है अतः इसका ऑक्सीकरण अंक - 1 है।)
(+1) + (x) + [(−1) × 4] = 0
x = +4-1
x = +3
(छ) H2S2O7 में S की ऑक्सीकरण संख्या
H2S2O7
+1 x - 2
X = [(+1) 2] + [(x) × 2] + [(-2) × 7] = 0
2x = +14 - 2
2x = +12
x = +6
(ज) KAl(SO4)2.12H2O में S की ऑक्सीकरण संख्या
KAl(SO4)2 12H2O
+1 + 3x - 2 = (0)
x = (+1) + (+3) + [(x) + (-2) × 4] × 2 + 0
+ 4 + 2x - 16 + 0 = 0
2x = +16 - 4
2x = +12
x = +6

प्रश्न 8.2.
निम्नलिखित यौगिकों के रेखांकित तत्त्वों की ऑक्सीकरण संख्या क्या है तथा इन परिणामों को आप कैसे प्राप्त करते हैं?
(क) KI3
(ग) Fe3O4
(ङ) CH3COOH
(ख) H2SO4
(घ) CH3CH2OH
उत्तर:
(क) KI3 में K की ऑक्सीकरण संख्या +1 है अतः I की औसत ऑक्सीकरण संख्या - 1/3 होगी। यह अंश में है अत: इसकी संरचना निम्न प्रकार होगी:
K+ [I - I ← I]
अतः 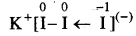 में 12 अणु और I आयन के मध्य उप-सहसंयोजक बंध बनता है I2 उदासीन है, अतः इसमें प्रत्येक I- परमाणु की ऑक्सीकरण संख्या शून्य होगी तथा I की ऑक्सीकरण संख्या - 1 है। अतः I की औसत ऑक्सीकरण संख्या = [I - I ← I]
में 12 अणु और I आयन के मध्य उप-सहसंयोजक बंध बनता है I2 उदासीन है, अतः इसमें प्रत्येक I- परमाणु की ऑक्सीकरण संख्या शून्य होगी तथा I की ऑक्सीकरण संख्या - 1 है। अतः I की औसत ऑक्सीकरण संख्या = [I - I ← I]
\(\frac{0+0-1}{3}\)
= -1/3
(ख) H2S4O6 में S की औसत ऑक्सीकरण संख्या है जो x निम्न प्रकार ज्ञात की जाती है
H2S4O6
+ 1 x - 2
[(+1) × 2] + [(x) × 4] + [(-2) × 6] = 0
4x = 12 - 2
\(x=+\frac{12-2}{4}\)
x = 2.5
यह संख्या अंश में है तथा इसमें चारों s परमाणुओं का ऑक्सीकरण अंक भिन्न-भिन्न है। अतः H2S4O6 की संरचना निम्न प्रकार होगी:
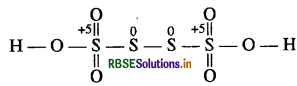
अतः S की औसत ऑक्सीकरण संख्या = \(\frac{+5+0+0+5}{4}\)
= 2.5
(ग) Fe3O4 में Fe की औसत ऑक्सीकरण संख्या निम्न प्रकार ज्ञात की जा सकती है:
Fe3O4
x - 2
[(x) × 3] + [(-2) × 4] = 0
X = + 8/3
यह संख्या भिन्नात्मक है अतः Fe3O4 एक मिश्रित ऑक्साइड है जो कि FeO तथा Fe2O3 का मिश्रण है। FeO में Fe की ऑक्सीकरण संख्या +2 तथा Fe2O3 में Fe की ऑक्सीकरण संख्या +3 है।
अत: Fe की औसत ऑक्सीकरण संख्या FeO Fe2O3
\(\frac{+2+3+3}{3}=\frac{+8}{3}\)
(घ) CH3CH2OH में C परमाणु की औसत ऑक्सीकरण संख्या निम्न प्रकारे ज्ञात की जाती है:
CH3-CH2-OH
(x) + [(+1) × 3] + x + [(+1) × 2] + (-2) + (+1) = 0
2x + 3+ 2 - 2 + 1 = 0
2x = - 4
x = -2
CH3CH2OH की संरचना निम्न प्रकार होती है:
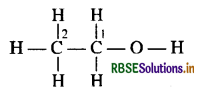
C1 एक - OH समूह (-1) तथा एक CH3 समूह (+1) से जुड़ा है अतः इसकी ऑक्सीकरण संख्या
CH3-CH2-OH
+1+ x + 2 - 1 = 0
x = -2
C2, तीन H (+1) तथा एक -CH2-OH (- 1) से जुड़ा है अतः इसकी ऑक्सीकरण संख्या
CH3-CH2-OH
+ 3+ x 1 = 0
x = - 2
अत: CH3-CH2-OH में दोनों C परमाणुओं का ऑक्सीकरण अंक समान (-2) है।
(ङ) CH3COOH में C परमाणु की औसत ऑक्सीकरण संख्या निम्न प्रकार ज्ञात की जाती है।
CH3COOH
(x) + [(+1) × 3] + (x) + [(-2) × 2] + (+1) = 0
2x = 0
x = 0
CH3COOH की संरचना को निम्न प्रकार प्रदर्शित किया जाता है।
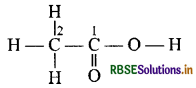
CH3COOH में C2, तीन H परमाणु (+1) तथा एक -COOH
(-1) से जुड़ा है।
अतः टे की ऑक्सीकरण संख्या CH3COOH
= 3 (+ 1) + x + 1 (- 1) = 0
x = + 2
तथा C1, CH3 (+1), (-2) तथा -OH (-1) से जुड़ा है, अ C की ऑक्सीकरण संख्या CH3COOH
+ 1 + x + 1 (−2) + 1 (1 ) = 0
x = + 2
अत: C की औसत ऑक्सीकरण संख्या = \(\frac{-2+2}{2}\)
= 0
प्रश्न 8.3.
निम्नलिखित अभिक्रियाओं का अपचयोपचय अभिक्रियाओं के रूप में औचित्य स्थापित करने का प्रयास करें:
(क) CuO(s) + H2(g) → Cu (s) + H2O(g)
(ख) Feg Og (s) + 3CO (g) → 2Fe(s) + 3CO2 (g)
(ग) 4BCl3(g) + 3LiAIH4(s) → 2B2H6(g) + 3LiCl(s) + 3AICl3(s)
(घ) 2K(s) + F2(g) → 2K + F-(s)
(ङ) 4NH3(g) + 5O2(g) → 4NO(g) + 6H2O(g)
उत्तर:
(क) 
इस अभिक्रिया में CuO में Cu की ऑक्सीकरण अवस्था +2 है जो उत्पाद (Cu) में शून्य हो रही है। अत: CuO का अपचयन हो रहा है जबकि H2 में H की ऑक्सीकरण अवस्था शून्य से बढ़कर +1 (H2O में) हो रही है अतः H का ऑक्सीकरण हो रहा है। इसलिए यह एक अपचयोपचय (रेडॉक्स) अभिक्रिया है।
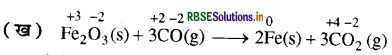
इस अभिक्रिया में Fe2O3 का अपचयन हो रहा है क्योंकि Fe की ऑक्सीकरण अवस्था +3 से घटकर शून्य (Fe में) हो रही है जबकि CO का ऑक्सीकरण हो रहा है क्योंकि कार्बन की ऑक्सीकरण अवस्था +2(CO) से + 4(CO2) हो रही है। अतः यह भी एक रेडॉक्स अभिक्रिया है।
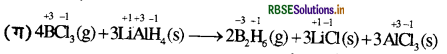
इस अभिक्रिया में BCl3 का अपचयन हो रहा है, क्योंकि B की ऑक्सीकरण अवस्था +3 से घटकर 3 (B2H6) हो रही है। इसके साथ LiAIH4 का ऑक्सीकरण हो रहा है। क्योंकि H की ऑक्सीकरण अवस्था-1 से बढ़कर +1 (B2H6 में) हो रही है। इसलिए यह एक रेडॉक्स अभिक्रिया है।
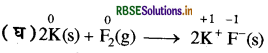
इस अभिक्रिया में K का ऑक्सीकरण हो रहा है क्योंकि प्रारम्भ में इसकी ऑक्सीकरण अवस्था शून्य है जबकि KF में यह +1 है जबकि F का अपचयन हो रहा है क्योंकि F2 में इसका ऑक्सीकरण अंक शून्य है जबकि K-F यह 1 हो जाता है। अतः यह भी एक रेडॉक्स अभिक्रिया का उदाहरण है।
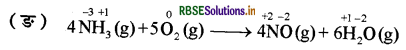
इस अभिक्रिया में NH3 का ऑक्सीकरण हो रहा है। क्योंकि इसमें N की ऑक्सीकरण संख्या 3 से बढ़कर +2 (NO) हो रही है तथा O2 का अपचयन हो रहा है क्योंकि इसमें 0 की ऑक्सीकरण संख्या शून्य से घटकर 2 (H2O) हो रही है। अत: यह भी एक रेडॉक्स अभिक्रिया है।

प्रश्न 8.4.
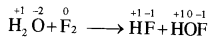
फ्लुओरीन बर्फ से अभिक्रिया करके यह परिवर्तन लाती है:
H2O(s) + F2(g) → HF(g) + HOF (g) इस अभिक्रिया का अपचयोपचय औचित्य स्थापित कीजिए।
उत्तर:
इस अभिक्रिया में F का ऑक्सीकरण अंक शून्य से - तथा ऑक्सीजन का ऑक्सीकरण अंक 2 से शून्य हो रहा है अतः इसमें F2 का अपचयन तथा ऑक्सीजन का ऑक्सीकरण हो रहा है। इसलिए यह एक अपचयोपचय अभिक्रिया है।
प्रश्न 8.5.
H2SO5 Cr2O72- तथा NO-3 में सल्फर, क्रोमियम तथा नाइट्रोजन की ऑक्सीकरण संख्या की गणना कीजिए। साथ ही इन यौगिकों की संरचना बताइए तथा इसमें हेत्वाभास (Fallacy) का स्पष्टीकरण दीजिए।
उत्तर:
(i) H2SO5 को परॉक्सो सल्फ्यूरिक ऐसिड (कैरो- अम्ल) कहते हैं। इसमें S की ऑक्सीकरण संख्या +6 होती है:
H2SO5
(+1) × 2 + (x) + [(2) × 5] = 0
x = 10 - 2
x = +8
लेकिन यह संभव नहीं है क्योंकि सल्फर के बाहरी कोश में 6 इलेक्ट्रॉन ही होते हैं अतः इसकी अधिकतम ऑक्सीकरण संख्या +6 हो सकती है। इस हेत्वाभास (Fallacy) को इसकी संरचना से समझाया जा सकता है। H2SO5 की संरचना से स्पष्ट है कि इसमें दो ऑक्सीजन परमाणु परॉक्साइड अवस्था में हैं जिनमें 0 का ऑक्सीकरण अंक-1 होता है।
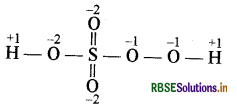
अतः सल्फर का ऑक्सीकरण अंक
(+1) + (2) + x + [(−2) × 2] + [(−1) × 2] + (+ 1) = 0
- 1 + x - 4 - 2 + 1 = 0
x = + 6
(ii) Cr2O72- में क्रोमियम की ऑक्सीकरण संख्या
Cr2O72-
2x + 1 - 2 × (7)] = -2
2x = + 12
x = +6
इसमें कोई हेत्वाभास (Fallacy) नहीं है।
(iii) NO3- में N की ऑक्सीकरण संख्या x + [ (-2) × 3] = -1
x = +5
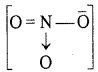
संरचना के आधार पर N की ऑक्सीकरण अवस्था निम्न प्रकार ज्ञात की जाती है:
[(−2) × 2] + (x) + (-2) = -1
x = +5
NO3 में N की सामान्य ऑक्सीकरण संख्या + 5 ही है अतः इसमें कोई हेत्वाभास नहीं है।
प्रश्न 8.6.
निम्नलिखित यौगिकों के सूत्र लिखिए:
(क) मरक्यूरी (II) क्लोराइड
(ख) निकल (II) सल्फेट
(ग) टिन (IV) ऑक्साइड
(घ) थेलियम (I) सल्फेट
(ङ) आयरन (III) सल्फेट
(च) क्रोमियम (III) ऑक्साइड
उत्तर:
(क) HgCl2
(ग) SnO2
(ङ) Fe2 (SO4)3
(ख) NiSO4
(घ) Th2SO4
(च) Cr2O3
प्रश्न 8.7.
उन पदार्थों की सूची तैयार की 4 से +4 तक की तथा नाइट्रोजन की ऑक्सीकरण अवस्था होती है।
उत्तर:
|
कार्बन के यौगिक |
ऑक्सीकरण अवस्था |
नाइट्रोजन के यौगिक |
ऑक्सीकरण अवस्था |
|
CH4 |
-4 |
NH3 |
-3 |
|
CH3 – CH3 |
-3 |
NH2 – NH2 |
-2 |
|
CH3Cl |
-2 |
NH2Cl |
-1 |
|
C2H4Cl2 |
-1 |
N2 |
0 |
|
CH2Cl2 |
0 |
N2O |
+1 |
|
CHCl3 |
+2 |
NO |
+2 |
|
C2Cl6 |
+3 |
N2O3 |
+3 |
|
CCl4 |
+4 |
N2O4 |
+4 |
प्रश्न 8.8.
अपनी अभिक्रियाओं में सल्फर डाइऑक्साइड तथा हाइड्रोजन परॉक्साइड ऑक्सीकारक तथा अपचायक दोनों ही रूपों में क्रिया करते हैं, जबकि ओजोन तथा नाइट्रिक अम्ल केवल ऑक्सीकारक के रूप में ही क्यों?
उत्तर:
SO2 में S की ऑक्सीकरण संख्या +4 होती है जबकि S -2 से +6 के मध्य ऑक्सीकरण अवस्था दर्शाता है अत: SO2 में S का ऑक्सीकरण अंक कम भी हो सकता है तथा अधिक भी अतः इसका ऑक्सीकरण तथा अपचयन दोनों संभव है। अतः SO2 ऑक्सीकारक तथा अपचायक दोनों ही रूपों में कार्य कर सकती है। H2O2 का व्यवहार भी SO2 के ही समान है, क्योंकि इसमें ऑक्सीजन का ऑक्सीकरण अंक -1 है। ऑक्सीजन शून्य तथा 2 के मध्य ऑक्सीकरण अंक दर्शाती है OF2 में ऑक्सीजन + 2 ऑक्सीकरण अवस्था दर्शाती है। अतः हम यह कह सकते हैं कि H2O2 में ऑक्सीजन अपनी ऑक्सीकरण संख्या कम करके तथा बढ़ाकर के ऑक्सीकारक तथा अपचायक दोनों व्यवहार दर्शाता है। जबकि O3 (ओजोन) में ऑक्सीजन की ऑक्सीकरण अवस्था शून्य होती है। यह अपनी ऑक्सीकरण अवस्था को कम (-1, - 2) तो कर सकता है लेकिन बढ़ा नहीं सकता, अतः O3 केवल ऑक्सीकारक की तरह ही व्यवहार करता है। इसी प्रकार से HNO3 में N का ऑक्सीकरण अंक +5 है जो कि अधिकतम है अतः यह अपना ऑक्सीकरण अंक कम तो कर सकता है लेकिन बढ़ा नहीं सकता है। इसी कारण यह भी केवल ऑक्सीकारक की तरह ही व्यवहार करता है।

प्रश्न 8.9.
इन अभिक्रियाओं को देखिए:
(क) 6CO2 (g) + 6H2O(l) → C6H12O6(aq) + 6O2(g)
(ख) O3 (g) + H2O2 (l) → H2O(l) + 2O2 (g)
बताइए कि इन्हें निम्नलिखित ढंग से लिखना ज्यादा उचित क्यों है?
(क) 6CO2 (g) + 12H2O(l) → C6H12O6(aq) + 6H2O(l) + 6O2 (g)
(ख) O3(g) + H2O2 (l) → H2O(l) + O2(g) + O2(g)
उपरोक्त अपचयोपचय अभिक्रियाओं (क) तथा (ख) के अन्वेषण (Investigation) की विधि सुझाइए।
उत्तर:
(क) यह प्रकाश संश्लेषण की जटिल रासायनिक अभिक्रिया है। इसमें क्लोरोफिल की उपस्थिति में जल के 12 अणु अपघटित होकर H2 तथा O2 देते हैं क्रिया में बनी H2, CO2 को अपचयित करके कार्बोहाइड्रेट (C6H12O6) बनाती है अतः इसे निम्न प्रकार से प्रदर्शित किया जाता है:
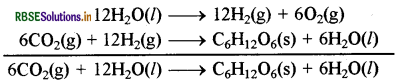
इस अभिक्रिया में जल के 12 अणु भाग लेते हैं तथा ये जल के 6 अणु उत्पन्न करते हैं अतः इसे उपरोक्त रूप में लिखना ही उचित रहेगा।
(ख) ओजोन तथा H2O2 की क्रिया वास्तव में निम्न प्रकार होती है:
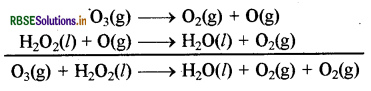
अंतिम समीकरण यह दर्शाता है कि O2 का एक अणु O3 से प्राप्त होता है तथा दूसरा अणु H2O2 से प्राप्त होता है अतः इस समीकरण को उपरोक्त प्रकार से लिखना उचित रहेगा।
दोनों अभिक्रियाओं का अन्वेषण आधुनिक ट्रेसर तकनीक के द्वारा किया जा सकता है। इसमें समस्थानिक युक्त जल (H2O) तथा H2O2 18 अथवा O318 का उपयोग करके अभिक्रिया के पथ का निर्धारण किया जा सकता है।
प्रश्न 8.10.
AgF2 एक अस्थिर यौगिक है। यदि यह बन जाए, तो यह यौगिक एक अति शक्तिशाली ऑक्सीकारक की भाँति कार्य करता है। क्यों?
उत्तर:
AgF2 में Ag की ऑक्सीकरण अवस्था +2 है जो कि एक अति अस्थायी ऑक्सीकरण अवस्था है। अतः यह एक इलेक्ट्रॉन ग्रहण करके शीघ्रता से अपचयित होकर स्थायी ऑक्सीकरण अवस्था (+1) प्राप्त कर लेती है।
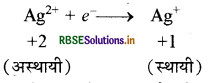
यही कारण है कि यदि AgF2 बन जाये तो यह प्रबल ऑक्सीकारक की तरह कार्य करता है।
प्रश्न 8.11.
"जब भी एक ऑक्सीकारक तथा अपचायक के बीच अभिक्रिया सम्पन्न की जाती है, तब अपचायक के आधिक्य में निम्नतर ऑक्सीकरण अवस्था का यौगिक तथा ऑक्सीकारक के आधिक्य में उच्चतर ऑक्सीकरण अवस्था का यौगिक बनता है।" इस वक्तव्य का औचित्य तीन उदाहरण देकर दीजिए।
उत्तर:
नीचे दी गई रासायनिक क्रियाओं के आधार पर हम दिये गये वक्तव्य का औचित्य सिद्ध कर सकते हैं।
उदाहरण 1.
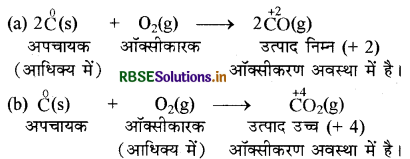
(i) (a) में कार्बन अधिकता में है जबकि (i) (b) में ऑक्सीजन आधिक्य में है। अतः यहाँ कार्बन अपचायक तथा O2 ऑक्सीकारक है।
उदाहरण 2.

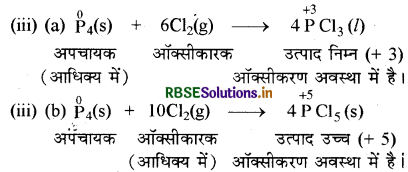
उदाहरण 3.
प्रश्न 8.12.
इन प्रेक्षणों की अनुकूलता को कैसे समझाएँगे?
(क) यद्यपि क्षारीय पोटैशियम परमैंगनेट तथा अम्लीय पोटैशियम परमैंगनेट दोनों ही ऑक्सीकारक हैं। फिर भी टॉलुईन से बेंजोइक अम्ल बनाने के लिए हम एल्कोहॉलिक पोटैशियम परमैंगनेट का प्रयोग ऑक्सीकारक के रूप में क्यों करते हैं? इस अभिक्रिया के लिए संतुलित अपचयोपचय समीकरण दीजिए।
(ख) क्लोराइडयुक्त अकार्बनिक यौगिक में सांद सल्फ्यूरिक अम्ल डालने पर हमें तीक्ष्ण गंध वाली HCl गैस प्राप्त होती है, परंतु यदि मिश्रण में ब्रोमाइड उपस्थित हो, तो हमें ब्रोमीन की लाल वाष्प प्राप्त होती है, क्यों?
उत्तर:
(क) मेथिल बेन्जीन (टालुईन), KMnO4 से निम्न प्रकार क्रिया करता है तथा यह एक रेडॉक्स अभिक्रिया है:
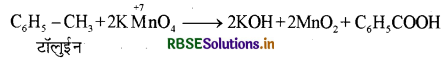
इस अभिक्रिया में सह उत्पाद भी बनते हैं। अम्लीय तथा क्षारीय KMnO4 द्वारा टॉलुईन के ऑक्सीकरण को नियंत्रित करना कठिन होगा क्योंकि इसमें बना बेंजोइक अम्ल सह-उत्पादों से प्रभावित रहेगा अतः KMnO4 के स्थान पर ऐल्कोहॉलिक KMnO4 का प्रयोग ऑक्सीकारक के रूप में करते हैं। ऐल्कोहॉलिक KMnO4 लेने के निम्नलिखित कारण भी हैं:
(i) अम्ल या क्षार नहीं लेने के कारण प्रक्रिया की लागत कम हो जाती है।
(ii) ऐल्कोहॉल, KMnO4 (आयनिक यौगिक) तथा टॉलुईन (अध्रुवीय कार्बनिक यौगिक) के मध्य समांगी मिश्रण बनाने में सहायक होता है।
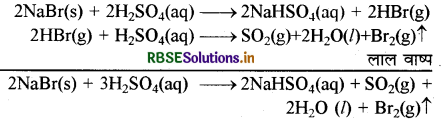
(ख) क्लोराइड युक्त लवण सान्द्र H2SO4 से निम्न प्रकार क्रिया करता है:
2NaCl(s) + H2SO4(l) → 2NaHSO4(s) + 2HCl(g)
यहाँ प्रबल अम्ल (H2SO4), दुर्बल अम्ल (HCl) को लवण से विस्थापित कर रहा है अतः इस अभिक्रिया में HCl बनती है। अभिक्रिया से प्राप्त HCl दुर्बल अपचायक है। अतः यह H2SO4 को SO2 में अपचयित नहीं कर सकता, लेकिन ब्रोमाइड उपस्थित होने पर अभिक्रिया से बना HBr एक प्रबल अपचायक है, जो कि H2SO4 को SO2 में अपचयित कर देता है तथा स्वयं ऑक्सीकृत होकर Br2 देता है। जिसकी लाल वाष्प प्राप्त होती है।
अभिक्रियाएँ निम्न प्रकार से होती हैं:

प्रश्न 8.13.
निम्नलिखित अभिक्रियाओं में ऑक्सीकृत, अपचयित, ऑक्सीकारक तथा अपचायक पदार्थ पहचानिए:
(क) 2AgBr(s) + C6H6O2(aq) → 2Ag(s) + 2HBr(aq) + C6H4O2(aq)
(ख) HCHO(l) + 2[Ag(NH3)2]+(aq) + 3OH-(aq) → 2Ag(s) + HCOO(aq) + 4NH3(aq) + 2H2O(l)
(ग) HCHO(l) + 2Cu2+(aq) + 5OH-(aq) → Cu2O(s) + HCOO-(aq) + 3H2O(l)
(घ) N2H4(l) + 2H2O2(l) → N2(g) + 4H2O(l)
(ङ) Pb(s) + PbO2(s) + 2H2SO4(aq) → 2PbSO4(s) + 2H2O(l)
उत्तर:
|
ऑक्सीकारक |
अपचायक |
ऑक्सीकृत पदार्थ |
अपचयित पदार्थ |
|
AgBr(s) |
C6H6O2(aq) |
C6H6O2(aq) |
AgBr(s) |
|
Ag(NH3)2 |
HCHO(aq) |
HCHO(aq) |
Ag(NH3)2 |
|
CU2+(aq) |
HCHO(aq) |
HCHO(aq) |
CU2+(aq) |
|
H2O2(l) |
N2H4(l) |
N2H4(l) |
H2O2(l) |
|
PbO2(s) |
Pb(s) |
Pb(s) |
PbO2(s) |
प्रश्न 8.14.
निम्नलिखित अभिक्रियाओं में एक ही अपचायक थायोसल्फेट, आयोडीन तथा ब्रोमीन से अलग-अलग प्रकार से अभिक्रिया क्यों करता है?
2S2O32-(aq) + I2(s) → S4O62-(aq) + 2I-(aq)
S2O32-(aq) + 2Br2(l) + 5H2O(l) → 2SO42-(aq) + 4Br-(aq) + 10H+(aq)
उत्तर:
दिया गया अपचायक सोडियम थायोसल्फेट (Na2S2O3) है जिसमें S के ऑक्सीकरण अंक में परिवर्तन निम्न प्रकार होता है:
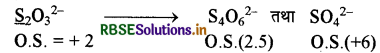
∵ ब्रोमीन, आयोडीन से प्रबल ऑक्सीकारक है अतः यह S2O32- (S की O.S. + 2) को SO, 2 (S की O.S. + 6) में ऑक्सीकृत कर देता है, जबकि I2 एक दुर्बल ऑक्सीकारक है। अतः यह S2O32- (S की O.S. + 2) को S4O62- (S की O.S. + 2.5) में ऑक्सीकृत करता है। इसी कारण S2O32- ब्रोमीन तथा आयोडीन से भिन्न-भिन्न प्रकार से अभिक्रिया करता है।
प्रश्न 8.15.
अभिक्रिया देते हुए सिद्ध कीजिए की हैलोजनों में फ्लुओरीन श्रेष्ठ ऑक्सीकारक तथा हाइड्रोहैलिक यौगिकों में हाइड्रोआयोडिक अम्ल श्रेष्ठ अपचायक है।
उत्तर:
हैलोजनों की ऑक्सीकारक क्षमता का घटता क्रम निम्न प्रकार होता है:
F2 > C2 > Br2 > I2
प्रयोगों द्वारा ज्ञात होता है कि F2 प्रबल ऑक्सीकारक है अतः यह Cl-, Br- तथा I- आयनों को ऑक्सीकृत करती है, Cl2 केवल Br- तथा I- आयनों को एवं Br2 केवल I- आयनों को ऑक्सीकृत करती है। I2 किसी भी हैलाइड आयन को ऑक्सीकृत नहीं कर पाती है। F2 की ऑक्सीकारक अभिक्रियाओं के उदाहरण निम्नलिखित है।
F2(g) + 2Cl-(aq) → 2F-(aq) + Cl2(g)
F2 (g) + 2Br-(aq) → 2F-(aq) + Br2 (l)
F2(g) + 2I-(aq) → 2F-(aq) + I2 (s)
इसी प्रकार से Cl2 की ऑक्सीकारक अभिक्रियाएँ निम्न हैं:
Cl2(g) + 2Br-(aq) → 2Cl-(aq) + Br2(l)
Cl2(g) + 2I-(aq) → 2Cl-(aq) + I2(s)
तथा Br2 की ऑक्सीकारक अभिक्रियाएँ निम्न होती हैं:
Br2(l) + 2I-(aq) → 2Br-(aq) + I2 (s)
अतः फ्लुओरीन श्रेष्ठ ऑक्सीकारक है।
हाइड्रोहैलिक अम्लों के अपचायक गुण का घटता क्रम निम्न प्रकार होता है:
HI > HBr > HCI > HF
अतः HI तथा HBr, H2SO4 को SO2 में अपचयित कर देते हैं। जबकि HCI तथा HF नहीं।
2HBr + H2SO4 → Br2 + SO2 + 2H2O
2HI + H2SO4 → I2 + SO2 + 2H2O
HI, Cu2+ को Cu+1 में अपचयित कर देता है जबकि HBr
2Cu2+(aq) + 4I-(aq) → Cu2I2 (s) + I2(aq)
HCI, MnO2 को Mn2+ में अपचयित कर देता है लेकिन HF
MnO2(s) + 4HCl(aq) → MnCl(aq) + Cl2(g) + 2H2O
अतः हाइड्रोहैलिक अम्लों में हाइड्रोआयोडिक अम्ल श्रेष्ठ अपचायक है।
प्रश्न 8.16.
निम्नलिखित अभिक्रिया क्यों होती है:
XeO64-(aq) + 2F-(aq) + 6H+(aq) → F2(g) + 3H2O(l)
यौगिक Na4XeO6 (जिसका एक भाग XeO64- + है ) के बारे में आप इस अभिक्रिया से क्या निष्कर्ष निकाल सकते हैं?
उत्तर:
इस रासायनिक अभिक्रिया में XeO64- का XeO3 में अपचयन हो रहा है तथा F-, F2 में ऑक्सीकृत हो रही है। यौगिक Na2XeO6 तथा इससे बना आयन XeO64- + भी F2 से प्रबल ऑक्सीकारक पदार्थ है अतः यह अभिक्रिया होती है। इस अभिक्रिया में ऑक्सीकरण अंक में परिवर्तन निम्न प्रकार होता है।
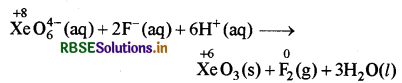

प्रश्न 8.17.
निम्नलिखित अभिक्रियाओं पर ध्यान दीजिए:
(क) H3PO2(aq) + 4AgNO3(aq) + 2H2O (l) → H3PO2(aq) + 4Ag(s) + 4HNO3(aq)
(ख) H3PO4(aq) + 2CuSO4(aq) + 2H2O(l) → H3PO4 (aq) + 2Cu(s) + H2SO4(aq)
(ग) C6H5CHO(l) + 2[Ag(NH3)2]+(aq) + 3OH(aq) → C6H5COO-(aq) + 2Ag(s) + 4NH3(aq) + 2H2O(l)
(घ) C6H5CHO(l) + 2Cu2+(aq) + 5ŌH(aq) → कोई परिवर्तन नहीं।
इन अभिक्रियाओं से Ag तथा Cu2+ के व्यवहार के विषय में निष्कर्ष निकालिए।
उत्तर:
उपर्युक्त अभिक्रियाओं Ag+ तथा Cu2+ के व्यवहार के बारे में निम्नलिखित निष्कर्ष निकाले जा सकते हैं:
(i) Ag+ तथा Cu2+ दोनों ऑक्सीकारक पदार्थ हैं क्योंकि अभिक्रिया (क) तथा (ख) यह दर्शाती है कि Ag+ तथा Cu2+ दोनों आयन H3PO2 को H3PO4 में ऑक्सीकृत कर रहे हैं तथा स्वयं Ag तथा Cu में अपचयित हो रहे हैं अतः H3PO2 अपचायक है।
(ii) अभिक्रिया (ग) से ज्ञात होता है कि [Ag(NH3)2]+ आयन C6H5CHO को C6H5COŌ में ऑक्सीकृत कर रहा है परन्तु अभिक्रिया (घ) के अनुसार Cu2 ऐसा नहीं कर रहा है। अतः यह निष्कर्ष निकलता है कि Ag+, Cu2+ की अपेक्षा प्रबल ऑक्सीकारक है।
प्रश्न 8.18.
आयन इलेक्ट्रॉन विधि द्वारा निम्नलिखित रेडॉक्स अभिक्रियाओं को संतुलित कीजिए:
(क) MnO4-(aq) + I-(aq) → MnO2(s) + I2(s) (क्षारीय माध्यम)
(ख) MnO4-(aq) + SO2(g) → Mn2+(aq) + HSO4-(aq) (अम्लीय माध्यम)
(ग) H2O2(aq) + Fe2+(aq) → Fe3+(aq) + H2O(l) (अम्लीय माध्यम)
(घ) Cr2O72- + SO2(g) → Cr3+(aq) + SO42-(aq) (अम्लीय माध्यम )
उत्तर:
(क) MnO4-(aq) + I-(aq) → MnO2 (s) + I2 (s) की क्षारीय माध्यम में ऑक्सीकरण अर्ध-अभिक्रिया निम्न प्रकार होगी:
I-(aq) → I2(s)
2I- → I2 (परमाणुओं को सन्तुलित करने पर)
2I- → I2 + 2e (आवेश को सन्तुलित करने पर )...(a)
इसी प्रकार से अपचयन की अर्ध-अभिक्रिया निम्न प्रकार
MnO-4(aq) → MnO2(S)
MnO-4 → MnO2(S) + 2H2O
(ऑक्सीजन को सन्तुलित करने पर)
MnO-4 + 4H+ → MnO2 + 2H2O
(हाइड्रोजन को सन्तुलित करने पर)
MnO-4 + 4H+ + 4OH → MnO2 + 2H2O + 4ŌH
( क्षारीय माध्यम के कारण दोनों पक्षों में OH जोड़ने पर )
MnO-4 → MnO2 + 4OH- + 2H2O
MnO-4 + 2H2O + 3e MnO2 + 4ŌH (आवेश को सन्तुलित करने पर )...(b)
समीकरण (a) को 3 से तथा (b) को 2 से गुणा करके, इन्हें जोड़ने पर
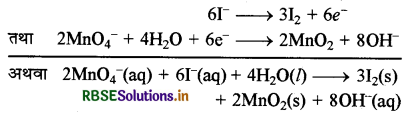
यह संतुलित समीकरण है।
(ख) MnO4-(aq) + SO2 (aq) → Mn2+(aq) + HSO4(aq)
अम्लीय माध्यम में क्रिया कराने पर ऑक्सीकरण की अर्ध-अभिक्रिया निम्न प्रकार होती है:
SO2(g) → HSO4-(aq)
SO2 + 2H2O → HSO4- (ऑक्सीजन का संतुलन)
SO2 + 2H2O → HSO-4 + 3H+ + 2e- (हाइड्रोजन का संतुलन)
SO2 + 2H2O → HSO4- + 3H+ + 2e- (आवेश का संतुलन) ... (a)
अपचयन की अर्ध- समीकरण निम्नलिखित है:
MnO-4 → Mn2+
MnO4 → Mn2+ + 4H2O ( ऑक्सीजन का संतुलन )
MnO4 + 8H+ → Mn2+ + 4H2O (हाइड्रोजन का संतुलन)
MnO4 + 8H+ + 5e → Mn2+ + 4H2O (आवेश का संतुलन) ... (b)
समीकरण (a) को 5 से तथा (b) को 2 से गुणा करके जोड़ने पर
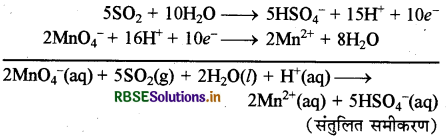
(ग) H2O2 (aq) + Fe2+(aq) → Fe3+(aq) + H2O(l) (अम्लीय माध्यम)
ऑक्सीकरण की अर्ध-अभिक्रिया निम्नलिखित है:
Fe2+(aq) → Fe3+(aq)
Fe2+ → Fe3+ + e- (आवेश का संतुलन) ... (a)
अपचयन की अर्ध-अभिक्रिया निम्नलिखित है:
H2O2 (aq) → H2O(l)
H2O2 → H2O + H2O (ऑक्सीजन का संतुलन)
H2O2 + 2H+ → 2H2O (हाइड्रोजन का संतुलन)
H2O2 + 2H+ + 2e- → 2H2O (आवेश का संतुलन) ...(b)
समीकरण (a) को 2 से गुणा करके समीकरण (b) में जोड़ने पर
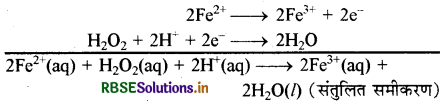
(घ) Cr2O72- (aq) + SO2-(aq) → Cr3+(aq) + SO42- (aq) (अम्लीय माध्यम)
इस अभिक्रिया में ऑक्सीकरण की अर्ध-अभिक्रिया निम्नलिखित
SO2(aq) → SO42-(aq)
SO2 + 2H2O → SO42- (ऑक्सीजन का संतुलन)
SO2 + 2H2O → SO42- + 4H+(हाइड्रोजन का संतुलन)
SO2 + 2H2O → SO42- + 4H+ + 2e- (आवेश का संतुलन) ... (a)
अपचयन की अर्ध-अभिक्रिया निम्नलिखित है:
Cr2O72- (aq) → Cr3+(aq)
Cr2O72- → 2Cr3+ ( क्रोमियम का संतुलन )
Cr2O72- → 2Cr3+ + 7H2O (ऑक्सीजन का संतुलन)
Cr2O72-(aq) + 14H+ → 2Cr3+ + 7H2O (हाइड्रोजन का संतुलन)
Cr2O72- + 14H+ + 6e- → 2Cr3+ + 7H2O (आवेश का संतुलन) ... (b)
समीकरण (a) को 3 से गुणा करके समीकरण (b) में जोड़ने पर

प्रश्न 8.19.
निम्नलिखित अभिक्रियाओं के समीकरणों को आयन इलेक्ट्रॉन तथा ऑक्सीकरण संख्या विधि द्वारा संतुलित कीजिए तथा इनमें ऑक्सीकारकों और अपचायकों की पहचान कीजिए:
(क) Ps(s) + OH-(aq) → PH3(g) + HPO-2(aq)
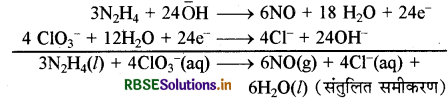
(ख) N2H4(l) + ClO-3(aq) → NO(g) + Cl- (g)
(ग) Cl2O7(g) + H2O2(aq) → ClO-2 (aq) + O2(g) + H+(aq)
उत्तर:
(क) P4s ( s) + 3OH-(aq) + 3H2O (l) → PH3(g) + 3H2PO2 (aq)
इस अभिक्रिया में P ऑक्सीकारक तथा अपचायक दोनों का कार्य करता है। यह अपचयित होकर PH3 तथा ऑक्सीकृत होकर H3PO2 देता है।
(ख) 3NH4(l) + 4ClO3-(aq) → 6NO(g) + 4Cl-(aq) + 6H2O(l)
इस अभिक्रिया में N2H4 ऑक्सीकारक है। अतः N2H4 ऑक्सीकृत होकर NO देता है जबकि ClO3- अपचयित होकर Cl- देता है।
(ग) Cl2O7(g) + 4H2O2(aq) + 2OH-(aq) → 2ClO-2(aq) + 4O2(g) + 5H2O(l)
इस अभिक्रिया में Cl2O7 ऑक्सीकारक है, अतः यह अपचयित होकर ClO-2 देता है जबकि H2O2 अपचायक है। अतः यह ऑक्सीकृत होकर O2 देता है।
आयन इलेक्ट्रॉन विधि द्वारा संतुलन:
(क) P4(s) + OH-(aq) → PH3(g) + H2PO2 (aq) (क्षारीय माध्यम में)
यहाँ P से PH3 तथा P से ही H2PO-2 बन रहा है:
अतः इसमें ऑक्सीकरण की अर्ध- अभिक्रिया निम्न है:
P(s) → H2PO-2 (aq)
P + 2H2O → H2PO-2 (ऑक्सीजन का संतुलन)
P + 2H2O → H2PO-2 + 2H+ (हाइड्रोजन का संतुलन)
P + 2H2O + 2OH- → H2PO-2 + 2H+ + 2OH- (क्षारीय माध्यम के लिए OH- का प्रयोग)
अथवा
P + 2OH- → H2PO-2
P + 2OH- → H2PO-2 + e- (आवेश का संतुलन) ... (a)
अपचयन की अर्ध-अभिक्रिया निम्नलिखित है:
P(s) → PH3(g)
P + 3H+ → PH3 (हाइड्रोजन का संतुलन)
P + 3H+ + 3ŌH → PH3 + 3OH- (क्षारीय माध्यम के लिए OH का प्रयोग)
P + 3H2O +3e - → PH3 + 3OH- (आवेश का संतुलन) ... (b)
अभिक्रिया (a) को 3 से गुणा करके समीकरण (b) में जोड़ने पर
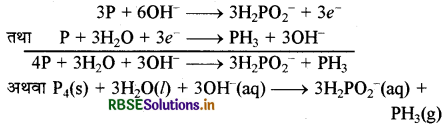
ऑक्सीकरण संख्या विधि द्वारा सन्तुलन:
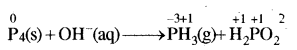
P के ऑक्सीकरण अंक में कुल = 3 x 4 = 12
P के ऑक्सीकरण अंक में कुल = 3 x 4 = 12
(i) अतः ऑक्सीकरण अंक में हुई कमी /वृद्धि को सन्तुलित करने के लिए PH3 को 1 से तथा H2PO2 को 3 से गुणा करने पर:
P4 + OH- → PH3 + 3H2PO-2
(ii) ऑक्सीजन को संतुलित करने के लिए OH- को 6 से गुणा करने पर:
P4 + 6OH → PH3 + 3H2PO2
(iii) हाइड्रोजन परमाणुओं को संतुलित करने के लिए अभिक्रिया के बायीं तरफ 3H2O तथा दाहिनी तरफ 3OH जोड़ने पर:
P4 + 6OH- + 3H2O → PH + 3H2PO2 + 3OH-
अथवा P4(s) + 3OH-(aq) + 3H2O (l) → PH3(g) + 3H2PO2 (aq)
(ख) N2H4(l) + CIO3-(aq) → NO (g) + Cl-(aq) (क्षारीय माध्यम)
आयन इलेक्ट्रॉन विधि- इसमें ऑक्सीकरण अर्ध- अभिक्रिया निम्नलिखित है:
N2H4(l) → NO(g)
N2H4 → 2NO (नाइड्रोजन का संतुलन)
N2H4 + 2H2O → 2NO (ऑक्सीजन का संतुलन)
N2H4 + 2H2O → 2NO + 8H+ (हाइड्रोजन का संतुलन)
N2H4 + 2H2O + 8OH- → 2NO + 8H+ + 8OH- (क्षारीय माध्यम के लिए OH- का प्रयोग)
अथवा N2H4 + 8OH- → 2NO + 6H2O
N2H + 8OH → 2NO + 6H2O + 8e- (आवेश का संतुलन) .......... (a)
अपचयन की अर्ध-अभिक्रिया निम्नलिखित है:
ClO3-(aq) → Cl-(aq)
ClO3- → Cl- + 3H2O (ऑक्सीजन का संतुलन)
ClO-3 + 6H+ → Cl- + 3H2O (हाइड्रोजन का संतुलन)
ClO-3 + 6OH- → Cl- + 3H2O + 6OH- (आवेश का संतुलन ) ..... (b)
अथवा
ClO-3 + 3H2O → CF + 6OH-
ClO3 + 3H2O + 6e- → Cl- + 6OH-
समीकरण (a) को 3 से तथा समीकरण (b) को 4 से गुणाकरके दोनों को जोड़ने पर
ऑक्सीकरण संख्या विधि:
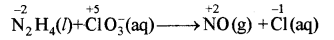
N के ऑक्सीकरण अंक में कुल वृद्धि = 2 × 4 = 8
Cl के ऑक्सीकरण अंक में कुल कमी = 16 = 6
अतः NH4 को 3 से तथा ClO3- को 4 से गुणा करने पर
3N2H4 + 4ClO3- → NO + Cl
N तथा CI को संतुलित करने पर
3N2H + 4CIO-3 → 6NO + 4Cl-
ऑक्सीजन को संतुलित करने के लिए अभिक्रिया के दाहिनी तरफ 6H2O जोड़ते हैं तो हाइड्रोजन अपने आप संतुलित हो जाती है:
3N2H2 (l) + 4ClO3- (aq) → 6NO (g) + 4Cl-(aq) + 6H2O(l)
(ग) Cl2O7 (g) + H2O2(aq) → ClO2- (aq) + O2 (g) + H+(aq) (क्षारीय माध्यम )
आयन इलेक्ट्रॉन विधि:
इस अभिक्रिया में ऑक्सीकरण की अर्ध-अभिक्रिया निम्नलिखित
H2O2(aq) → O2(g)
H2O2 → O2 + 2H (हाइड्रोजन का संतुलन)
2OH + H2O2 → O2 + 2H+ + 2OH (OH का प्रयोग )
H2O2 + 2OH- → O2 + 2H2O + 2e- (आवेश का संतुलन) (a)
अपचयन की अर्ध-अभिक्रिया निम्नलिखित है:
Cl2O7(g) → ClO2-(aq)
Cl2O7 → 2ClO-2 (क्लोरीन का संतुलन )
Cl2O7 → 2ClO-2 + 3H2O (ऑक्सीजन का संतुलन)
Cl2O7 + 6H+ → 2ClO-2 + 3H2O (हाइड्रोजन का संतुलन)
Cl2O7 + 6H+ + 6OH- → 2ClO-2 + 3H2O + 6OH-
Cl2O7 + 3H2O → 2ClO-2 + 6OH-
समीकरण (a) को 4 से गुणा करके समीकरण (b) में जोड़ने पर
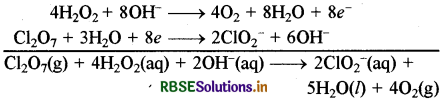
ऑक्सीकरण संख्या विधि:
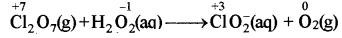
Cl के ऑक्सीकरण अंक में कुल कमी = 4 x 2 = 8
O के ऑक्सीकरण अंक में कुल वृद्धि = 2 × 1 = 2
अतः H2O2 तथा O2 को 4 से गुणा करने पर
Cl2O7 + 4H2O2 → ClO-2 + 4O2
क्लोरीन को संतुलित करने पर:
Cl2O7 + 4H2O2 → 2ClO-2 + 4O2
आवेश को संतुलित करने पर:
Cl2O5 + 4H2O2 + 2ŌH → 2ClO2 + 4O2
हाइड्रोजन को संतुलित करने पर:
Cl2O(g) + 4H2O2 (aq) + 2OH-(aq) → 2ClO-2 (aq) + 4O2(g) + 5H2O(l)

प्रश्न 8.20.
निम्नलिखित अभिक्रिया से आप कौनसी सूचनाएँ प्राप्त कर सकते हैं:
(CN)2(g) + 2OH (aq) → CN (aq) + CNO (aq) + H2O(l)
उत्तर:
यह एक असमानुपातन अभिक्रिया है। इस अभिक्रिया में (CN)2, CN में अपचयित तथा CNO में ऑक्सीकृत हो रहा है। OH से यह ज्ञात होता है कि अभिक्रिया क्षारीय माध्यम में हो रही है। इस रासायनिक अभिक्रिया की प्रकृति छद्म हैलोजन (psuedo halogen) अभिक्रिया के समान है।
प्रश्न 8.21.
Mn3+ आयन विलयन में अस्थायी होता है तथा असमानुपातन द्वारा Mn2+, MnO2 और H+ आयन देता है। इस अभिक्रिया के लिए संतुलित आयनिक समीकरण लिखिए।
उत्तर:
उपर्युक्त रासायनिक अभिक्रिया को निम्न प्रकार से प्रदर्शित किया जा सकता है:
Mn3+(aq) → Mn2+(aq) + MnO2 (s) + H+(aq)
अभिक्रिया से स्पष्ट है कि Mn3+ → Mn2+ में अपचयित तथा MnO2 में ऑक्सीकृत हो रहा है। अतः
अभिक्रिया निम्नलिखित होगी:
Mn3+(aq) → Mn2+(aq)
तथा ऑक्सीकरण की अर्ध-अभिक्रिया निम्नलिखित होगी:
Mn3+(aq) → MnO2(s)
आयन इलेक्ट्रॉन विधि द्वारा समीकरण का संतुलन निम्न प्रकार किया जाता है:
अपचयन: Mn3+ + e- → Mn2+
(आवेश का संतुलन)
ऑक्सीकरण
Mn3+ + 2H2O → MnO2
(ऑक्सीजन का संतुलन)
Mn3+ + 2H2O → MnO2 + 4H (aq) (हाइड्रोजन का संतुलन)
Mn3+ + 2H2O → MnO2 + 4H + e (आवेश का संतुलन)
दोनों अर्ध-अभिक्रियाओं को जोड़ने पर:
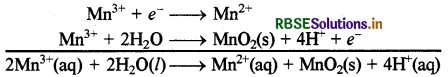
प्रश्न 8.22.
Cs, Ne, I तथा F में ऐसे तत्त्व की पहचान कीजिए, जो
(क) केवल ऋणात्मक ऑक्सीकरण अवस्था प्रदर्शित करता है।
(ख) केवल धनात्मक ऑक्सीकरण अवस्था प्रदर्शित करता है।
(ग) ऋणात्मक तथा धनात्मक दोनों ऑक्सीकरण अवस्था प्रदर्शित करता है।
(घ) न ऋणात्मक और न ही धनात्मक ऑक्सीकरण अवस्था प्रदर्शित करता है।
उत्तर:
(क) फ्लुओरीन आवर्त सारणी का सबसे अधिक विद्युतऋणी तत्त्व है, अतः इसकी ऑक्सीकरण अवस्था केवल -1 होती है।
(ख) Cs आवर्त सारणी का सबसे अधिक विद्युतधनी तत्त्व है, अतः यह सदैव +1 ऑक्सीकरण अवस्था प्रदर्शित करता है।
(ग) आयोडीन वह हैलोजन है जो ऋणात्मक तथा धनात्मक दोनों ऑक्सीकरण अवस्था प्रदर्शित करता है। अंतर हैलोजन यौगिकों में यह धनात्मक (+1, 3, 5 तथा + 7) जबकि अन्य यौगिकों में यह ऋणात्मक (- 1) ऑक्सीकरण अवस्था दर्शाता है।
(घ) Ne एक उत्कृष्ट गैस है, इसकी रासायनिक अभिक्रियाएँ करने की प्रवृत्ति नहीं होती है। अतः यह न तो ऋणात्मक और न ही धनात्मक ऑक्सीकरण अवस्था प्रदर्शित करती है।
प्रश्न 8.23.
जल के शुद्धिकरण में क्लोरीन को प्रयोग में लाया जाता है। क्लोरीन की अधिकता हानिकारक होती है। सल्फर डाइऑक्साइड से अभिक्रिया करके इस अधिकता को दूर किया जाता है। जल में होने वाले इस अपचयोपचय परिवर्तन के लिए संतुलित समीकरण लिखिए।
उत्तर:
उपर्युक्त अभिक्रिया को निम्न प्रकार से प्रदर्शित किया जाता है:
Cl2(aq) + SO2 (aq) + H2O (l) → Cl-(aq) + SO42-(aq)
इस अभिक्रिया को संतुलित करने पर:
Cl2 (aq) + SO2 (aq) + 2H2O(l) → 2Cl-(aq) + SO42-(aq) + 4H+(aq)
इस अभिक्रिया में Cl2 अपचयित होती है तथा यह HCl बनाती है जबकि SO2 का ऑक्सीकरण होता है तथा यह H2SO4 बनाती है।
प्रश्न 8.24.
आवर्त सारणी की सहायता से निम्नलिखित प्रश्नों के उत्तर दीजिए:
(क) संभावित अधातुओं के नाम बताइए, जो असमानुपातन की अभिक्रिया प्रदर्शित कर सकती हों।
(ख) किन्हीं तीन धातुओं के नाम बताइए, जो असमानुपातन अभिक्रिया प्रदर्शित कर सकती हों।
उत्तर:
(क) फॉस्फोरस, क्लोरीन, सल्फर इत्यादि वे अधातुएँ हैं जो असमानुपातन की अभिक्रियाएँ प्रदर्शित करती हैं। इनके द्वारा प्रदर्शित अभिक्रियाएँ निम्नलिखित हैं:
P4 (s) + 3OH (aq) + 3H2O(l) → PH3(g) + 3H2PO-2 (aq)
Cl2 (aq) + 2OH-(aq) → Cl- (aq) + ClO-(aq) + H2O(l)
S8 ( s) + 12OH-(aq) → 4S2- (aq) + 2S2O32 (aq) + 6H2O(l)
(ख) Cu, Ga तथा In इन्डियम वे धातुएँ हैं जो असमानुपातन अभिक्रिया प्रदर्शित करती हैं। इनके द्वारा प्रदर्शित क्रियाएँ निम्नलिखित
2Cu+ (aq) → Cu2+ (aq) + Cu(s)
3Ga+(aq) → Ga3+(aq) + 2Ga(s)
3In+(aq) → In3+(aq) + 2In ( s)
प्रश्न 8.25.
नाइट्रिक अम्ल निर्माण की ओस्टवाल्ड विधि के प्रथम पद में अमोनिया गैस के ऑक्सीजन गैस द्वारा ऑक्सीकरण से नाइट्रिक ऑक्साइड गैस तथा जलवाष्प बनती है। 10.0 ग्राम अमोनिया तथा 20.00 ग्राम ऑक्सीजन द्वारा नाइट्रिक ऑक्साइड की कितनी अधिकतम मात्रा प्राप्त हो सकती है?
उत्तर:
इस प्रक्रम में निम्नलिखित रासायनिक अभिक्रिया होती
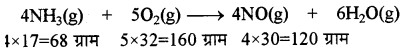
68 ग्राम NH के ऑक्सीकरण हेतु 160 ग्राम O2 की आवश्यकता होती है,
अतः 10 ग्राम NH के ऑक्सीकरण हेतु आवश्यक O2 की मात्रा
= 160/68 × 10 = 23.529 ग्राम
इस प्रक्रम में मात्र 20 ग्राम O2 प्रयुक्त की गई है अतः O2 सीमान्तकारी अभिकर्मक है। अतः बनने वाली NO O2 की मात्रा पर निर्भर है न कि NH
प्राप्त NO = 120 ग्राम
अतः 20 ग्राम O2 से प्राप्त NO = 120/60 x 20 = 15.00 ग्राम
अतः 20 ग्राम O2 द्वारा अधिकतम 15 ग्राम NO प्राप्त होगी।

प्रश्न 8.26.
सारणी 8.1
(पाठ्यपुस्तक) में दिए गए मानक विभवों की सहायता से अनुमान लगाइए कि क्या इन अभिकारकों के बीच अभिक्रिया संभव है?
(क) Fe3+(aq) तथा I- (aq)
(ख) Ag+ (aq) तथा Cu( s)
(ग) Fe3+ (aq) तथा Br- (aq)
(घ) Ag(s) तथा Fe3+ (aq)
(ङ) Br2 (aq) तथा Fe2+ (aq)
उत्तर:
(क) यह रासायनिक अभिक्रिया संभव है तथा निम्न प्रकार से होगी:
2Fe3+ (aq) + 2I- (aq) → 2Fe2+(aq) + I2 (s)
(ख) यह अभिक्रिया असंभव है क्योंकि इसके लिए E°से सेल ऋणात्मक है।
Cu(s) + 2Ag+(aq) → Cu2+(aq) + 2Ag(s)
(ग) यह अभिक्रिया संभव है।
Br-(aq) + Fe3+(aq) → Fe2+(aq) + 1⁄2 Br2(l)
(घ) Ag(s) तथा Fe+3 (aq) के बीच अभिक्रिया संभव नहीं है। क्योंकि इसके लिए E° सेल का मान ऋणात्मक है।
(ङ) यह अभिक्रिया संभव है।
2Fe2+(aq) + Br2 (aq) → 2Fe3+(aq) + 2Br-(aq)
सारणी में दिये गये मानक विभवों के आधार पर उपर्युक्त अभिक्रियाओं की विस्तृत व्याख्या निम्न प्रकार से की जा सकती है। जब विद्युत वाहक बल (E°) मान धनात्मक आता है तो अभिक्रिया सम्भव होती है।
(क) Fe3+(aq) तथा I-(aq)
ऑक्सीकरण की अर्ध-अभिक्रिया:
2I- → I2(g) + 2e-, E° = 0.54V
अपचयन की अर्ध-अभिक्रिया:
[Fe3+ + e- → Fe2+] x 2, E° = + 0.77V
अतः
2I- (aq) + 2Fe3+(aq) → I2(s) + 2Fe2+(aq)
विद्युत वाहक बल (E°) = E° (कैथोड) - E° (एनोड)
विद्युत वाहक बल (E°) = 0.770.54
E° = + 0.23V
इस अभिक्रिया के लिए विद्युत वाहक बल का मान धनात्मक है। अतः यह अभिक्रिया संभव है।
(ख) इस अभिक्रिया में Cu(s) इलेक्ट्रॉन त्यागता है तथा Ag+ इलेक्ट्रॉन ग्रहण करता है; अतः सेल में अर्ध- अभिक्रिया निम्न प्रकार होगी:
Cu(s) → Cu2+ + 2e-, E° = 0.34V
[Ag+ + e- → Ag] x 3, E° = 0.80V
संपूर्ण अभिक्रिया निम्न प्रकार से होती है:
Cu(s) + 2Ag+(aq) → Cu2+(aq) + 2Ag(s)
E° = 0.80 - 0.34 V = 0.46 V
यह मान धनात्मक है, अतः यह अभिक्रिया संभव है। (ग) इसमें ऑक्सीकरण तथा अपचयन की क्रियाएँ निम्न प्रकार से होती हैं:
ऑक्सीकरण:
Br(aq) → 1⁄2 Br2(l) + e, E° = - 1.09v
अपचयन:
Fe3+ + e- → Fe2+ E° = + 0.77V
सम्पूर्ण अभिक्रिया
Br-(aq) + Fe3+(aq) → Fe2+(aq) +1⁄2Br2(l)
E° = 0.77 - 1.09 = -0.32 V
यह मान ऋणात्मक है अतः यह अभिक्रिया असम्भव है।
(घ) Ag (s) तथा Fe3+ (aq) के मध्य ऑक्सीकरण की अभिक्रिया अग्र प्रकार होती है:
Ag → Ag+ + e-,
E° = -0.80V
अपचयन की अभिक्रिया निम्न प्रकार होती है:
Fe3+ + e- → Fe2+, E° = + 0.77V
सम्पूर्ण अभिक्रिया
Fe3+(aq) + Ag(s) → Fe2+(aq) + Ag+(aq)
E° = 0.77 - 0.80 V
E° = - 0.03 V
E° का मान ऋणात्मक है अतः यह अभिक्रिया संभव नहीं है। (ङ) इस अभिक्रिया में Br2 इलेक्ट्रॉन ग्रहण करती है तथा Fe2+ इलेक्ट्रॉन त्यागता है। अतः ऑक्सीकरण की अभिक्रिया निम्न प्रकार होती है:
[Fe+ → Fe+ + e] × 2 E° = 0.77 V अपचयन की अभिक्रिया निम्न प्रकार होती है-
Br2+ 2e- → 2Br
E° = 1.09 V
E = 1.09 - 0.77
= 0.32 V
सम्पूर्ण अभिक्रिया निम्न प्रकार होती है:
2Fe2 (aq) + Br2 (aq) → 2Fe3+(aq) + 2Br-(aq)
E° का मान धनात्मक है, अतः यह अभिक्रिया सम्भव है।
प्रश्न 8.27.
निम्नलिखित में से प्रत्येक के विद्युत अपघटन से प्राप्त उत्पादों के नाम बताइए:
(क) सिल्वर इलेक्ट्रोड के साथ AgNO3 का जलीय विलयन
(ख) प्लैटिनम इलेक्ट्रोड के साथ AgNO3 का जलीय विलयन
(ग) प्लैटिनम इलेक्ट्रोड के साथ H2SO4 का तनु विलयन
(घ) प्लैटिनम इलेक्ट्रोड के साथ CuCl2 का जलीय विलयन।
उत्तर:
(क) कैथोड पर Ag धातु प्राप्त होती है।
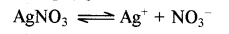
कैथोड पर
Ag+ + e- → Ag
जबकि एनोड पर समान मात्रा में Ag ऑक्सीकृत होकर Ag+ (विलेय) देता है।
Ag → Ag+ + e
(ख) कैथोड पर Ag धातु तथा एनोड पर 2 गैस प्राप्त होती है।
AgNO3 → Ag+ + NO3
कैथोड पर
Ag+ + e → Ag
एनोड पर
H2O → 2H+ + 1/2 O2 + 2e-
(ग) कैथोड पर H) गैस निकलती है तथा एनोड पर O2 गैस प्राप्त होती है।
H2SO4 → 2H+ + SO42-
कैथोड पर 2H+ + 2e- → H2
एनोड पर
H2O → 2H+ + 1/2O2 + 2e-
(घ) कैथोड पर Cu प्राप्त होता है जबकि एनोड पर Cl2 गैस प्राप्त होती है।
CuCl → Cu2+ + 2Cl-
कैथोड पर
Cu2+ + 2e- → Cu
एनोड पर
2Cl- → Cl2 + 2e-
प्रश्न 8.28.
निम्नलिखित धातुओं को उनके लवणों के विलयन में से विस्थापन की क्षमता के क्रम में लिखिए Al, Cu, Fe, Mg तथा Zn
उत्तर:
Mg, Al, Zn, Fe, Cu धातुओं को उनके लवणों के विलयन में से विस्थापन की क्षमता इनकी विद्युत रासायनिक श्रेणी में स्थिति पर निर्भर करती है। इस श्रेणी में नीचे स्थित धातु अपने ऊपर स्थित धातु को उसके लवण के विलयन में से विस्थापित कर देती है।
प्रश्न 8.29.
नीचे दिए गए मानक इलेक्ट्रोड विभवों के आधार पर धातुओं को उनकी बढ़ती अपचायक क्षमता के क्रम में लिखिए:
K+/K = - 2.93V, Ag/Ag = 0.80V, Hg2+/ Hg = 0.79V, Mg2+/Mg = 2.37V, Cr3+/ Cr = 0.74V
उत्तर:
किसी धातु इलेक्ट्रॉड के लिए मानक इलेक्ट्रॉड विभव का मान जितना कम होता है उसकी अपचायक क्षमता उतनी ही अधिक होती है।
Ag < Hg < Cr < Mg < K
धातुओं की अपचायक क्षमता का बढ़ता क्रम
प्रश्न 8.30.
उस गैल्वेनी सेल को चित्रित कीजिए, जिसमें निम्नलिखित अभिक्रिया होती है:
Zn(s) + 2Ag+(aq) → Zn2+(aq) + 2Ag(s)
अब बताइए कि:
(क) कौनसा इलेक्ट्रोड ऋण आवेशित है?
(ख) सेल में विद्युतधारा के वाहक कौन हैं?
(ग) प्रत्येक इलेक्ट्रोड पर होने वाली अभिक्रियाएँ क्या हैं?
उत्तर:
इस अभिक्रिया के लिए गैल्वेनी सेल को निम्न प्रकार प्रदर्शित किया जाता है
Zn(s) | Zn2+ (aq) || Ag+ (aq) | Ag(s)
(क) उपर्युक्त सेल में Zn इलेक्ट्रोड (एनोड ) ऋणावेशित होता है।
(ख) विद्युतधारा का प्रवाह इलेक्ट्रॉनों द्वारा होता है।
(ग) धनाग्र (एनोड ) पर निम्नलिखित क्रिया होती है।
Zn(s) → Zn2+(aq) + 2e- ( ऑक्सीकरण)
जबकि कैथोड (ऋणाग्र) पर निम्न अभिक्रिया होती है:
2Ag+(aq) + 2e- → 2Ag(s) (अपचयन)
