RBSE Solutions for Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता
Rajasthan Board RBSE Solutions for Class 11 Chemistry Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता Textbook Exercise Questions and Answers.
RBSE Class 11 Chemistry Solutions Chapter 3 तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता
RBSE Class 11 Chemistry तत्त्वों का वर्गीकरण एवं गुणधर्मों में आवर्तिता Textbook Questions and Answers
प्रश्न 3.1.
आवर्त सारणी में व्यवस्था का मौलिक आधार क्या है?
उत्तर:
आवर्त सारणी, तत्त्वों के इलेक्ट्रॉनिक विन्यास के आधार पर बनाई गयी है। किसी वर्ग के सभी तत्त्वों का बाह्यतम इलेक्ट्रॉनिक विन्यास समान होता है, अतः उनके गुण भी समान होते हैं। इसलिए तत्त्वों को वर्ग के अनुसार व्यवस्थित करने में आवर्त सारणी का महत्त्वपूर्ण योगदान है तथा तत्वों के गुणों का अध्ययन भी सामान्यतः वर्गों के आधार पर ही किया जाता है।

प्रश्न 3.2.
मेंडलीव ने किस महत्त्वपूर्ण गुणधर्म को अपनी आवर्त सारणी में तत्त्वों के वर्गीकरण का आधार बनाया? क्या वे उस पर दृढ़ रह पाए?
उत्तर:
मेंडलीव ने आवर्त सारणी में तत्त्वों के वर्गीकरण के लिए परमाणु भार को आधार बनाया। उन्होंने तत्त्वों को परमाणु भार के बढ़ते क्रम में व्यवस्थित किया तो पाया कि समान गुणों वाले तत्त्व एक वर्ग में उपस्थित तथा इन तत्त्वों द्वारा बने यौगिकों के गुणों में भी समानता पायी गयी। लेकिन परमाणु भार के बढ़ते क्रम में कुछ अपवाद भी आए। अतः परमाणु भार के बढ़ते क्रम का पूर्ण रूप से पालन नहीं हुआ तब गुणों में समानता को महत्त्व दिया गया, जैसे-1 का परमाणु भार Te ( वर्ग VI) से कम होने पर भी इसे वर्ग VII में F, CI के साथ रखा गया। इस प्रकार वे तत्वों के वर्गीकरण में परमाणु भार के बढ़ते क्रम पर दृढ़ नहीं रह पाए।
प्रश्न 3.3.
मेंडलीव के आवर्त नियम तथा आधुनिक आवर्त नियम में मौलिक अन्तर क्या है?
उत्तर- मेंडलीव का आवर्त नियम तत्वों के परमाणु भार पर आधारित है जबकि आधुनिक आवर्त नियम उनकी परमाणु संख्या पर आधारित है। मेंडलीव के अनुसार तत्त्वों के गुण उनके परमाणु भारों के आवर्ती फलन होते हैं जबकि आधुनिक आवर्त नियम के अनुसार, तत्त्वों के भौतिक तथा रासायनिक गुणधर्म उनके परमाणु क्रमांकों के आवर्ती फलन होते हैं।
प्रश्न 3.4.
क्वान्टम संख्याओं के आधार पर यह सिद्ध कीजिए कि आवर्त सारणी के छठवें आवर्त में 32 तत्त्व होने चाहिए।
उत्तर:
छठवें आवर्त के लिए = 6 होता है जो कि 6s से प्रारम्भ होता है तथा इसमें 4f, 5d तथा 6p उपकोश आते हैं। 6p में एक, 4p में तीन, 5d में 5 तथा 4f में 7 कक्षक हैं। अतः कुल कक्षकों की संख्या 16 होगी तथा एक कक्षक में दो इलेक्ट्रॉन भरे जाते हैं। अतः इलेक्ट्रॉनों की कुल संख्या 32 होगी इसलिए छठवें आवर्त में तत्त्वों की संख्या भी 32 होगी।
प्रश्न 3.5.
आवर्त और वर्ग के पदों में यह बताइए कि Z = 14 कहाँ स्थित होगा?
उत्तर:
परमाणु क्रमांक 14 का इलेक्ट्रॉनिक विन्यास = 1s2 2s2 2p6 3s2 3p2 होता है। अतः यह तीसरे आवर्त तथा चतुर्थ वर्ग में P- खण्ड का सदस्य है क्योंकि अन्तिम इलेक्ट्रॉन तीसरे कोश में है तथा चतुर्थ वर्ग का बाह्यतम इलेक्ट्रॉनिक विन्यास ns2 np2 होता है।
प्रश्न 3.6.
उस तत्त्व का परमाणु क्रमांक लिखिए, जो आवर्त सारणी में तीसरे आवर्त और 17वें वर्ग में स्थित होता है।
उत्तर:
17 वें वर्ग के तत्त्वों (हैलोजन) का बाह्यतम इलेक्ट्रॉनिक विन्यास ns1 np2 होता है तथा यह तीसरे आवर्त का तत्त्व है अतः इस तत्त्व का बाह्यतम इलेक्ट्रॉनिक विन्यास 3s2 3p5 होगा इसलिए यह तत्त्व क्लोरीन होगा जिसका परमाणु क्रमांक 17 है।
प्रश्न 3.7.
कौनसे तत्त्व का नाम निम्नलिखित द्वारा दिया गया है?
(i) लॉरेन्स बर्कले प्रयोगशाला द्वारा
(ii) सी बोर्ग समूह द्वारा।
उत्तर:
(i) बर्केलियम 97Bk
(ii) सीबोर्गियम 106Sg
प्रश्न 3.8.
एक ही वर्ग में उपस्थित तत्त्वों के भौतिक और रासायनिक गुणधर्म समान क्यों होते हैं?
उत्तर:
किसी वर्ग के सभी तत्त्वों के संयोजी कोश (बाह्यतम कोश) का इलेक्ट्रॉनिक विन्यास समान होता है, अतः किसी वर्ग में उपस्थित तत्त्वों के भौतिक और रासायनिक गुणधर्म समान होते हैं क्योंकि तत्वों के गुण बाह्यतम इलेक्ट्रॉन विन्यास पर निर्भर करते हैं।
प्रश्न 3.9.
परमाणु त्रिज्या' और 'आयनी त्रिज्या' से आप क्या समझते हैं?
उत्तर:
- परमाणु त्रिज्या(परमाणु आकार): परमाणु के नाभिक तथा बाह्यतम कोश में उपस्थित अन्तिम इलेक्ट्रॉन के बीच की दूरी को परमाणु त्रिज्या कहते हैं। सह-संयोजक अणुओं में एकल आबन्ध द्वारा जुड़े हुए दो समान अधात्विक परमाणुओं के नाभिकों के बीच की दूरी का आधा, परमाणु त्रिज्या के बराबर होता है।
- आयनी त्रिज्या: यह आयन का आकार बताती है किसी आयन के नाभिक तथा उसके अन्तिम इलेक्ट्रॉन के बीच दूरी जहाँ तक आयन का आयनिक बन्ध में प्रभाव रहता है, उसे आयनी त्रिज्या कहते हैं।
प्रश्न 3.10.
किसी वर्ग या आवर्त में परमाणु त्रिज्या किस प्रकार परिवर्तित होती है ? इस परिवर्तन की व्याख्या आप किस प्रकार करेंगे?
उत्तर:
वर्ग में ऊपर से नीचे जाने पर परमाणु त्रिज्या बढ़ती है। क्योंकि मुख्य क्वान्टम संख्या (17) का मान बढ़ने से नया कोश जुड़ता जाता है। अतः संयोजी इलेक्ट्रॉन नाभिक से दूर होते जाते हैं क्योंकि आन्तरिक ऊर्जा स्तरों में इलेक्ट्रॉन भरे रहते हैं, जिनके परिरक्षण प्रभाव के कारण नाभिकीय आकर्षण बल कम हो जाता है। आवर्त में बाएँ से दाएँ जाने पर परमाणु त्रिज्या घटती है क्योंकि कोश तो समान रहता है तथा उसी कोश में इलेक्ट्रॉन भरते जाते हैं लेकिन नाभिकीय आवेश में वृद्धि होती है जिससे नाभिकीय आकर्षण बल बढ़ जाता है।

प्रश्न 3.11.
समइलेक्ट्रॉनिक स्पीशीज से आप क्या समझते हैं? एक ऐसी स्पीशीज का नाम लिखिए, जो निम्नलिखित परमाणुओं या आयनों के साथ समइलेक्ट्रॉनिक होगी:
(i) F
(iii) Mg2+
(ii) Ar
(iv) Rb+
उत्तर:
समइलेक्ट्रॉनिक स्पीशीज - वे परमाणु या आयन जिनमें इलेक्ट्रॉनों की संख्या समान होती है, उन्हें समइलेक्ट्रॉनिक स्पीशीज कहते हैं। इनमें नाभिकीय आवेश भिन्न-भिन्न होता है।
(i) F- (9 + 1 = 10 इलेक्ट्रान) के समइलेक्ट्रानिक N-3 (7+ 3 = 10 इलेक्ट्रॉन) है ।
(ii) Ar (18 इलेक्ट्रॉन) के समइलेक्ट्रॉनिक Cl- (17 + 1 = 18 इलेक्ट्रॉन) है।
(iii) Mg2+ (12 - 2 = 10 इलेक्ट्रॉन) के समइलेक्ट्रॉनिक Na+ (11 - 1 = 10 इलेक्ट्रॉन) है।
(iv) Rb (37 - 1 = 36 इलेक्ट्रॉन) के समइलेक्ट्रॉनिक Br (35 + 1 = 36 इलेक्ट्रॉन) है।
प्रश्न 3.12.
निम्नलिखित स्पीशीज पर विचार कीजिए:
N3-, O2-, F-, Na+, Mg2+ और Al3+
(क) इनमें क्या समानता है?
(ख) इन्हें आयनी त्रिज्या के बढ़ते क्रम में व्यवस्थित कीजिए।
उत्तर:
(क) इन सभी स्पीशीज में 10 इलेक्ट्रॉन हैं अतः ये समइलेक्ट्रॉनिक आयन (स्पीशीज) हैं।
(ख) इन स्पीशीज की आयनी त्रिज्या का बढ़ता क्रम निम्न प्रकार होता है।
Al+3 < Mg2+ < Na+ < F- < O2- < N3- (नाभिकीय आवेश का मान बढ़ने पर समइलेक्ट्रॉनिक स्पीशीज की आयनी त्रिज्या कम होती है।)
प्रश्न 3.13.
धनायन अपने जनक परमाणुओं से छोटे क्यों होते हैं और ऋणायनों की त्रिज्या उनके जनक परमाणुओं की त्रिज्या से अधिक क्यों होती है? व्याख्या कीजिए।
उत्तर:
धनायन अपने जनक परमाणु से छोटे होते हैं क्योंकि धनायन बनने पर इलेक्ट्रॉनों की संख्या तो कम हो जाती है लेकिन नाभिकीय आवेश उतना ही रहता है, अतः नाभिकीय आकर्षण बल बढ़ जाता है। जैसे Na+ आयन Na से छोटा होता है। ऋणायन बनने पर इलेक्ट्रॉनों की संख्या बढ़ जाती है जबकि नाभिकीय आवेश समान रहता है, अतः नाभिकीय आकर्षण बल पहले की तुलना में कम हो जाता है इसलिए ऋणायनों की त्रिज्या उनके जनक परमाणुओं की त्रिज्या से अधिक होती है।
प्रश्न 3.14.
आयनन एन्थैल्पी और इलेक्ट्रॉन लब्धि एन्थैल्पी को परिभाषित करने में विलगित गैसीय परमाणु तथा 'आद्य अवस्था' पदों की सार्थकता क्या है?
उत्तर:
आयनन एन्थैल्पी किसी तत्त्व की मूल अवस्था में विलगित गैसीय परमाणु से बाह्यतम इलेक्ट्रॉन को पृथक् करने के लिए आवश्यक ऊर्जा को आयनन एन्थैल्पी कहते हैं। इलेक्ट्रॉन लब्धि एन्थैल्पी किसी उदासीन परमाणु द्वारा इलेक्ट्रॉन ग्रहण कर ऋणायन में परिवर्तित होने पर उत्सर्जित ऊर्जा को इलेक्ट्रॉन लब्धि एन्थैल्पी कहते हैं। नाभिक द्वारा इलेक्ट्रॉन पर लगने वाले आकर्षण बल पर अणु में उपस्थित अन्य परमाणु तथा पड़ोसी परमाणु का भी प्रभाव पड़ता है। अतः आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैल्पी ज्ञात करने के लिए यह आवश्यक है कि अन्तरापरमाणुक आकर्षण न्यूनतम हो जो कि गैसीय अवस्था में ही होता है, इसलिए इनकी परिभाषा में विलगित गैसीय परमाणु का प्रयोग किया जाता है। आद्य अवस्था से अर्थ है कि परमाणु अपनी अधिकतम स्थायी अवस्था में उपस्थित है। यदि परमाणु उत्तेजित अवस्था में होगा तो इलेक्ट्रॉन को निकालने के लिए कम ऊर्जा की आवश्यकता होगी तथा इलेक्ट्रॉन जोड़ने पर कम ऊर्जा उत्सर्जित होगी, अतः तुलना करने के लिए आयनन एन्थैल्पी तथा इलेक्ट्रॉन लब्धि एन्थैपी आद्य अवस्था में ही ज्ञात की जाती है।
प्रश्न 3.15.
हाइड्रोजन परमाणु में आद्य अवस्था में इलेक्ट्रॉन की ऊर्जा - 2.18 x 10-18 J है। परमाण्विक हाइड्रोजन की आयनन एन्थैल्पी J mol-1 के पदों में परिकलित कीजिए।
[संकेत- उत्तर प्राप्त करने के लिए मोल संकल्पना का उपयोग कीजिए ।]
उत्तर:
हाइड्रोजन की आद्य अवस्था में इलेक्ट्रॉन को निकालने के लिए आवश्यक ऊर्जा
= E∞ - E = 0 - E1 = (2.18 × 10-18 J)
= 2.18 × 1018 J
अतः एक मोल हाइड्रोजन परमाणुओं की आयनन एन्थैल्पी
= 2.18 × 10-18 × 6.022 x 1023 Jmol-1
= 13.12 × 105 = 1.312 × 106 J mol-1
प्रश्न 3.16.
द्वितीय आवर्त के तत्त्वों में वास्तविक आयनन एन्थल्पी का क्रम उस प्रकार है?
Li < B < Be < C < O < N < F < Ne व्याख्या कीजिए कि
(i) Be की ∆HiB से अधिक क्यों
(ii) O की ∆HiN और F से कम क्यों है?
उत्तर:
(i) Be की ∆iH (आयनन एन्थैल्पी), B से अधिक है क्योंकि s- इलेक्ट्रॉन, p- इलेक्ट्रॉन की तुलना में नाभिक के अधिक पास रहता है अर्थात् इसकी भेदन क्षमता अधिक होती है। Be में बाह्यतम 8- इलेक्ट्रॉन पृथक् होता है जबकि B में बाह्यतम p-इलेक्ट्रॉन निकलता है तथा बोरॉन का 2p इलेक्ट्रॉन, Be के 2s की तुलना में आन्तरिक क्रोड इलेक्ट्रॉनों द्वारा अधिक परिरक्षित रहता है। अतः Be का 2s इलेक्ट्रॉन, B के 2p इलेक्ट्रॉन की तुलना में मुश्किल से पृथक् होता है इसलिए इसे निकालने के लिए अधिक ऊर्जा की आवश्यकता होती है।
(ii) ऑक्सीजन की आयनन एन्थैल्पी (∆iH) का मान N तथा F से कम है क्योंकि N में अर्धपूरित स्थायी विन्यास (2p3 ) है जिसमें से इलेक्ट्रॉन को निकालने के लिए अधिक ऊर्जा की आवश्यकता होती है। जबकि ऑक्सीजन में बाह्यतम चार इलेक्ट्रॉनों में से दो इलेक्ट्रॉन एक कक्षक में हैं अतः इलेक्ट्रॉन- इलेक्ट्रॉन प्रतिकर्षण बढ़ जाता है जिसके कारण इसमें से इलेक्ट्रॉन को पृथक् करना नाइट्रोजन की तुलना में आसान है तथा F के छोटे आकार तथा अधिक नाभिकीय आवेश के कारण इसकी आयनन एन्थैल्पी (∆iH) ऑक्सीजन से अधिक होती है।

प्रश्न 3.17.
आप इस तथ्य की व्याख्या किस प्रकार करेंगे कि सोडियम की प्रथम आयनन एन्बैल्पी मैग्नीशियम की प्रथम आयनन एन्पी से कम है किन्तु इसकी द्वितीय आयनन एन्थैल्पी मैग्नीशियम की द्वितीय आयनन एन्थैल्पी से अधिक है।
उत्तर:
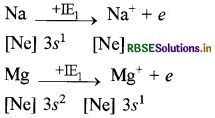
Na की प्रथम आयनन एन्थैल्पी Mg की प्रथम आयनन एन्थैल्पी से कम है क्योंकि इसमें नाभिकीय आवेश कम तथा परमाणु आकार बड़ा है। इसके साथ ही इसका इलेक्ट्रॉनिक विन्यास Mg की ' तुलना में कम स्थायी है जबकि Na की द्वितीय आयनन एन्थैल्पी Mg की तुलना में बहुत अधिक है क्योंकि Na से एक इलेक्ट्रॉन निकल जाने पर Na+ बनता है जिसमें स्थायी उत्कृष्ट गैस विन्यास है अतः इसमें से इलेक्ट्रॉन निकालना बहुत ही मुश्किल है जबकि Mg में बाह्यतम कोश तीसरा है तथा इसका विन्यास कम स्थायी है जिसमें से इलेक्ट्रॉन निकालना आसान होता है।
प्रश्न 3.18.
मुख्य समूह तत्वों में आयनन एन्थैल्पी के किसी समूह में नीचे की ओर कम होने के कौनसे कारक हैं?
उत्तर:
मुख्य समूह के तत्त्वों में वर्ग में ऊपर से नीचे जाने पर आयनन एन्थैल्पी का मान कम होता है। इसके मुख्य कारक दो हैं:
- परमाणु आकार: वर्ग में परमाणु आकार बढ़ने के कारण संयोजी इलेक्ट्रॉनों पर नाभिकीय आकर्षण बल कम होता जाता है अतः इलेक्ट्रॉन का निकलना आसान होता है।
- परिरक्षण प्रभाव: वर्ग में नाभिकीय आवेश की तुलना में परिरक्षण प्रभाव अधिक प्रभावी होता है, अतः बाह्यतम इलेक्ट्रॉन को निकालने के लिए कम ऊर्जा की आवश्यकता होती है।
प्रश्न 3.19.
वर्ग 13 के तत्त्वों की प्रथम आयनन एन्थैल्पी के मान (kJmol-1 में) इस प्रकार हैं:
|
B |
Al |
Ga |
In |
TI |
|
801 |
577 |
579 |
558 |
589 |
सामान्य से इस विचलन की प्रवृत्ति की व्याख्या आप किस प्रकार करेंगे?
उत्तर:
B से Al तक आयनन एन्थैल्पी सामान्य नियम के अनुसार कम होती है लेकिन Ga की आयनन एन्थैल्पी Al से कुछ अधिक है तथा TI की आयनन एन्थैल्पी Al, Ga तथा In से अधिक है, क्योंकि Al, s-खण्ड के बाद आता है जबकि Ga व In खण्ड के बाद तथा TI df खण्ड के बाद आता है। d तथा इलेक्ट्रॉन संयोजी इलेक्ट्रॉनों को परिरक्षित नहीं कर पाते हैं क्योंकि d f कक्षकों का परिरक्षण प्रभाव कम होता है। अतः नाभिकीय आकर्षण बल अधिक होने के कारण इलेक्ट्रॉन को निकालने के लिए अधिक ऊर्जा की आवश्यकता होती है।
प्रश्न 3.20
तत्त्वों के निम्नलिखित युग्मों में किस तत्त्व की इलेक्ट्रॉन लब्धि एन्थैल्पी अधिक ऋणात्मक होगी?
1. O या F
2. F या Cl
उत्तर:
- F की इलेक्ट्रॉन लब्धि एन्थैल्पी, O की इलेक्ट्रॉन लब्धि एन्थैल्पी से अधिक ऋणात्मक होगी क्योंकि इसके छोटे आकार तथा अधिक नाभिकीय के कारण यह आसानी से एक इलेक्ट्रॉन ग्रहण करके स्थायी उत्कृष्ट गैस विन्यास प्राप्त कर लेता है जबकि ऑक्सीजन में ऐसा नहीं होता।
- Cl की इलेक्ट्रॉन लब्धि एन्थैल्पी, F की इलेक्ट्रॉन लब्धि एल्पी से अधिक ऋणात्मक होगी क्योंकि F के छोटे आकार (= 2) तथा इलेक्ट्रॉनों के उच्च आवेश घनत्व के कारण जुड़ने वाला इलेक्ट्रॉन, प्रबल इलेक्ट्रॉन- इलेक्ट्रॉन प्रतिकर्षण अनुभव करता है। अतः इसमें इलेक्ट्रॉन जुड़ना मुश्किल होता है जबकि Cl का आकार बड़ा (13) होने के कारण इसमें इलेक्ट्रॉन जुड़ना आसान होता है।
प्रश्न 3.21.
आप क्या सोचते हैं कि 0 की द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी प्रथम इलेक्ट्रॉन लब्धि एन्बैल्पी के समान धनात्मक, अधिक ऋणात्मक या कम ऋणात्मक होगी? अपने उत्तर की पुष्टि कीजिए।
उत्तर:
ऑक्सीजन की द्वितीय इलेक्ट्रॉन लब्धि एन्थैल्पी धनात्मक होती है क्योंकि O(g) में एक इलेक्ट्रॉन जुड़ने पर O-(g) बनता है तथा O-(g) में पुनः इलेक्ट्रॉन जुड़ने पर O-(g) तथा आने वाले इलेक्ट्रॉन के मध्य प्रतिकर्षण होता है जिसके कारण ऊर्जा का अवशोषण होता है।
O-(g) + e → O2-(g) ∆H = ∆Heg? = + ve
प्रश्न 3.22.
इलेक्ट्रॉन लब्धि एन्थैल्पी और इलेक्ट्रॉन ऋणात्मकता (विद्युत ऋणात्मकता) में क्या मूल अन्तर है?
उत्तर:
इलेक्ट्रॉन लब्धि एन्थैल्पी तथा इलेक्ट्रॉन ऋणात्मकता दोनों ही किसी तत्त्व के परमाणु की इलेक्ट्रॉन को आकर्षित करने की प्रवृत्ति का माप है लेकिन इलेक्ट्रॉन लब्धि एन्थैल्पी किसी विलगित गैसीय परमाणु द्वारा इलेक्ट्रॉन ग्रहण करने पर उत्सर्जित ऊर्जा है जबकि इलेक्ट्रॉन ऋणात्मकता किसी परमाणु की साझे के इलेक्ट्रॉन युग्म को अपनी ओर आकर्षित करने की प्रवृत्ति है।
प्रश्न 3.23.
सभी नाइट्रोजन यौगिकों में N ( नाइट्रोजन) की विद्युत ऋणात्मकता पाऊलिंग पैमाने पर 3.0 है। आप इस कथन पर अपनी क्या प्रतिक्रिया देंगे?
उत्तर:
सभी नाइट्रोजन यौगिकों में N की विद्युत ऋणात्मकता पाऊलिंग पैमाने पर 3.0 है। यह कथन गलत है क्योंकि विद्युत ऋणात्मकता उस परमाणु पर भी निर्भर करती है जिससे वह जुड़ा हुआ है तथा यह संकरण अवस्था पर भी निर्भर करती है। अतः किसी तत्त्व की विद्युत ऋणात्मकता स्थिर नहीं होती है।
प्रश्न 3.24.
उस सिद्धान्त का वर्णन कीजिए जो परमाणु की त्रिज्या से सम्बन्धित होता है:
1. जब वह इलेक्ट्रॉन प्राप्त करता है।
2. जब वह इलेक्ट्रॉन का त्याग करता है।
उत्तर:
- जब परमाणु इलेक्ट्रॉन प्राप्त करता है तो ऋणायन बनता है तथा ऋणायन की त्रिज्या संगत परमाणु से अधिक होती है। क्योंकि इसमें एक या अधिक अतिरिक्त इलेक्ट्रॉन आने से इलेक्ट्रॉनों के मध्य प्रतिकर्षण बढ़ता है तथा नाभिकीय आवेश स्थिर रहता है, अतः प्रभावी नाभिकीय आवेश में कमी होती है जैसे F की त्रिज्या F से अधिक होती है।
- परमाणु के इलेक्ट्रॉन त्यागने पर धनायन बनता है तथा धनायन की त्रिज्या संगत परमाणु से कम होती है क्योंकि धनायन में इलेक्ट्रॉनों की संख्या कम हो जाती है तथा नाभिकीय आवेश उतना ही रहता है अतः नाभिकीय आकर्षण बल बढ़ जाता है। इसी कारण Na+ की त्रिज्या Na से कम होती है।
प्रश्न 3.25.
किसी तत्त्व के दो समस्थानिकों की प्रथम आयनन एन्बैल्पी समान होगी या भिन्न? आप क्या मानते हैं? अपने उत्तर की पुष्टि कीजिए।
उत्तर:
किसी तत्त्व के समस्थानिकों में इलेक्ट्रॉन की संख्या, नाभिकीय आवेश तथा परमाणु त्रिज्या समान होती हैं अतः उनकी प्रथम आयनन एन्थैल्पी का मान भी समान होगा।

प्रश्न 3.26.
धातुओं और अधातुओं में मुख्य अन्तर क्या है?
उत्तर:
- धातुओं में इलेक्ट्रॉन त्यागकर धनायन बनाने की प्रवृत्ति होती है जबकि अधातु इलेक्ट्रॉन ग्रहण कर ऋणायन बनाते हैं।
- धातु उच्च विद्युतधनी होते हैं जबकि अधातु विद्युतऋणी होते
- धातु प्रबल अपचायक होते हैं जबकि अधातु ऑक्सीकारक होते हैं।
- धातु सामान्यतः ठोस होते हैं जबकि अधातु ठोस या गैस होती है।
- धातुओं के ऑक्साइड क्षारीय या उभयधर्मी होते हैं जबकि अधातुओं के ऑक्साइड अम्लीय या उदासीन होते हैं।
- धातुओं के गलनांक तथा क्वथनांक उच्च होते हैं जबकि अधातुओं के गलनांक तथा क्वथनांक कम होते हैं।
- धातुएँ विद्युत तथा ऊष्मा की सुचालक होती हैं तथा अधातुएँ विद्युत तथा ऊष्मा की अति अल्प चालक होती हैं।
- धातुएँ आघातवर्धनीय तथा तन्य होती हैं जबकि अधातुएँ भंगुर होती हैं।
प्रश्न 3.27.
आवर्त सारणी का उपयोग करते हुए निम्नलिखित प्रश्नों के उत्तर दीजिए:
(क) उस तत्त्व का नाम बताइए, जिसके बाह्य उपकोश में पाँच इलेक्ट्रॉन उपस्थित हों।
(ख) उस तत्त्व का नाम बताइए, जिसकी प्रवृत्ति दो इलेक्ट्रॉनों को त्यागने की हो।
(ग) उस तत्त्व का नाम बताइए, जिसकी प्रवृत्ति दो इलेक्ट्रॉनों को प्राप्त करने की हो।
(घ) उस वर्ग का नाम बताइए, जिसमें सामान्य ताप पर धातु, अधातु, द्रव और गैस उपस्थित हों।
उत्तर:
(क) फ्लुओरीन (F) - इलेक्ट्रॉनिक विन्यास 1s2 2s2 2p5 या अन्य कोई हैलोजेन (CI, Br, I)।
(ख) Mg या Ca, Mg का इलेक्ट्रॉनिक विन्यास - 1s2 2s2 sp6 3s2 है। यह दो इलेक्ट्रॉन त्याग कर स्थायी उत्कृष्ट गैस विन्यास प्राप्त कर लेता है।
(ग) ऑक्सीजन (O) - यह दो इलेक्ट्रॉन ग्रहण कर Ne के समान स्थायी विन्यास प्राप्त करके O2- बनाता है।
(घ) 17वाँ वर्ग (हैलोजेन परिवार) इसमें Br द्रव तथा F, Cl गैस है। F, Cl, Br तथा अधातु हैं जबकि At धातु है।
प्रश्न 3.28.
प्रथम वर्ग के तत्त्वों के लिए अभिक्रियाशीलता का बढ़ता क्रम इस प्रकार है:
Li < Na < K < Rb <Cs जबकि वर्ग 17 के तत्त्वों में क्रम F > Cl > Br > I है। इसकी व्याख्या कीजिए।
उत्तर:
प्रथम वर्ग के तत्त्व धातु हैं जिनमें इलेक्ट्रॉन त्यागने की प्रवृत्ति बहुत अधिक होती है तथा वर्ग में ऊपर से नीचे जाने पर आयनन एन्थैल्पी का मान कम होता है अतः इलेक्ट्रॉन त्यागने की प्रवृत्ति बढ़ती जाती है इसलिए इनकी क्रियाशीलता का क्रम Li < Na < K < Rb < Cs होता है। 17 वें वर्ग के तत्त्व अधातु हैं जिनमें इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति होती है जो कि इलेक्ट्रॉड विभव पर निर्भर करती है। वर्ग में इलेक्ट्रॉड विभव (अपचयन विभव) का मान कम होता है, अतः इलेक्ट्रॉन ग्रहण करने की प्रवृत्ति कम होती जाती है। इसलिए इनकी क्रियाशीलता का क्रम निम्न प्रकार है - F > Cl > Br > I
प्रश्न 3.29.
s, p, d- और - ब्लॉक के तत्त्वों का सामान्य इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
s - ब्लॉक = ns1-2 ( यहाँ n=1 से 7 )
p-ब्लॉक = ns2 np1-6 ( यहाँ n = 2 से 6)
d-ब्लॉक = (n-1) d1-10 ns0-2 (यहाँ n= 4 से 7 )
f - ब्लॉक = (n - 2)f1-14 (n-1) d0-1 ns2 (यहाँ n = 6 तथा 7 )
प्रश्न 3.30.
तत्त्व जिसका बाह्य इलेक्ट्रॉनिक विन्यास निम्न है, का स्थान आवर्त सारणी में बताइए
(i) ns2 np4 जिसके लिए n = 3 है।
(ii) (n-1) d2 ns2 जब n = 4 है तथा 6 है।
(iii) (n - 2) f7 (n -1) d1 ns2, जब n = 6 है।
उत्तर:
(i) n = 3 इसलिए इस तत्त्व का बाह्य इलेक्ट्रॉनिक विन्यास 3s2 3p4 होगा अतः यह तीसरे आवर्त p-खण्ड तथा 16वें वर्ग का तत्त्व है क्योंकि p-खण्ड के तत्वों के लिए वर्ग संख्या = 10 + बाह्यतम कोश में इलेक्ट्रॉन की संख्या तथा इसमें अन्तिम इलेक्ट्रॉन - कक्षक में प्रवेश करता है।
(ii) n = 4 है इसलिए इस तत्त्व का बाह्य इलेक्ट्रॉनिक विन्यास 3d2 4s2 होगा। अतः यह चौथे आवर्त, d खण्ड तथा चौथे वर्ग का तत्त्व है क्योंकि इसमें d कक्षक अपूर्ण है तथा खण्ड में वर्ग संख्या = (n d इलेक्ट्रॉन + ns इलेक्ट्रॉन)।
(iii) n = 6 है इसलिए इस तत्त्व का बाह्य इलेक्ट्रॉनिक विन्यास 4f7 5d1 6s2 होगा अतः यह छठे आवर्त, f-खण्ड तथा तीसरे वर्ग का तत्त्व है क्योंकि खण्ड के सभी तत्त्व तीसरे वर्ग में माने जाते हैं तथा इनमें अन्तिम इलेक्ट्रॉन -कक्षक में प्रवेश करता है।
प्रश्न 3.31.
कुछ तत्त्वों की प्रथम ∆iH1 और द्वितीय ∆iH2 आयनन एन्थैल्पी (kJ mol-1 में) और इलेक्ट्रॉन लब्धि एन्थैल्पी (AegH) (kJ mol-1) निम्नलिखित है:
|
तत्त्व |
∆H1 |
∆H2 |
∆egH |
|
I |
520 |
7300 |
-60 |
|
II |
419 |
3051 |
-48 |
|
III |
1681 |
3374 |
-328 |
|
IV |
1008 |
1846 |
-295 |
|
V |
2372 |
5251 |
+48 |
|
VI |
738 |
1451 |
-40 |
ऊपर दिए गए तत्त्वों में से कौनसी
(क) सबसे कम अभिक्रियाशील तत्त्व है?
(ख) सबसे अधिक अभिक्रियाशील धातु है?
(ग) सबसे अधिक अभिक्रियाशील अधातु है?
(घ) सबसे कम अभिक्रियाशील अधातु है?
(ङ) ऐसी धातु, जो स्थायी द्विअंगी हैलाइड (Binary Halide), जिसका सूत्र MX2 (X = हैलोजन) है, बनाता है।
(च) ऐसी धातु, जो मुख्यत: सूत्र MX (X = हैलोजन ) वाले स्थायी सहसंयोजी हैलाइड बनाती है।
उत्तर:
(क) तत्त्व V सबसे कम अभिक्रियाशील तत्त्व है क्योंकि इसकी प्रथम आयनन एन्थैल्पी उच्चतम है तथा इलेक्ट्रॉन लब्धि एन्थैल्पी भी अधिकतम धनात्मक है।
(ख) तत्त्व II सबसे अधिक अभिक्रियाशील धातु है क्योंकि इसकी प्रथम आयनन एन्थैल्पी न्यूनतम है तथा इसकी इलेक्ट्रॉन लब्धि एन्थैल्पी कम ऋणात्मक है।
(ग) तत्त्व III सबसे अधिक अभिक्रियाशील अधातु है क्योंकि इसकी प्रथम आयनन एन्थैल्पी उच्च है तथा इलेक्ट्रॉन लब्धि एन्थैल्पी उच्चतम ऋणात्मक है।
(घ) तत्त्व IV सबसे कम अभिक्रियाशील अधातु है क्योंकि इसकी इलेक्ट्रॉन लब्धि एन्चैल्पी बहुत उच्च ऋणात्मक नहीं है तथा इसकी प्रथम आयनन एन्थैल्पी का मान भी बहुत अधिक नहीं है।
(ङ) तत्त्व VI की I तथा II आयनन एन्थैल्पी का मान बहुत कम है अतः यह द्वितीय वर्ग (क्षारीय मृदा धातु) का तत्त्व है इसलिए यह MX2 प्रकार के द्विअंगी हैलाइड बनाता है।
(च) तत्त्व I, MX प्रकार के स्थायी सहसंयोजी हैलाइड बनाता है क्योंकि इसकी प्रथम आयनन एन्थैल्पी का मान कम तथा द्वितीय आयनन एन्थैल्पी का मान बहुत अधिक है अतः यह छोटे आकार का क्षार धातु है जैसे Li है।

प्रश्न 3.32.
तत्त्वों के निम्नलिखित युग्मों के संयोजन से बने स्थायीद्विअंगी यौगिकों के सूत्रों की प्रगुक्ति (Prediction) कीजिए:
(क) लीथियम और ऑक्सीजन
(ख) मैग्नीशियम और नाइट्रोजन
(ग) ऐलुमिनियम और आयोडीन
(घ) सिलिकॉन और ऑक्सीजन
(ङ) फॉस्फोरस और फ्लुओरीन
(च) 71 वाँ तत्त्व और फ्लुओरीन।
उत्तर:
(क) Li2O [Li की संयोजकता = 1 (प्रथम वर्ग), 0 की संयोजकता = 2 (16वां वर्ग) ]
(ख) Mg3N2 [Mg की संयोजकता = 2 (द्वितीय वर्ग), N की संयोजकता = 3 (15वां वर्ग) ]
(ग) Al3 [AI की संयोजकता = 3 (तृतीय वर्ग), I की संयोजकता = 1 (17वां वर्ग ) ]
(घ) SiO2 [Si की संयोजकता = 4 ( 14वां वर्ग ), 0 की संयोजकता 2 (16वां वर्ग ) ]
(ङ) PF3 या PF5 [P की संयोजकता 3, 5 ( 15वां वर्ग), F की संयोजकता = 1 (17वां वर्ग)]
(च) 71वाँ तत्त्व = Lu
LuF3 [Lu की संयोजकता 3, F की संयोजकता = 1 (17वां वर्ग)]
प्रश्न 3.33.
आधुनिक आवर्त सारणी में आवर्त निम्नलिखित में से किसको व्यक्त करता है?
(क) परमाणु संख्या
(ख) परमाणु द्रव्यमान
(ग) मुख्य क्वान्टम संख्या
(घ) द्विगंशी क्वान्टम संख्या।
उत्तर:
(ग) आवर्त का मान, मुख्य क्वान्टम संख्या के मान के समान होता है।
प्रश्न 3.34.
आधुनिक आवर्त सारणी के सन्दर्भ में निम्नलिखित में से कौनसा कथन सही नहीं है?
(क) - ब्लॉक में 6 स्तम्भ हैं, क्योंकि कोश के सभी कक्षक भरने के लिए अधिकतम 6 इलेक्ट्रॉनों की आवश्यकता होती है।
(ख) - ब्लॉक में 8 स्तम्भ हैं, क्योंकि - उप-कोश के कक्षक भरने के लिए अधिकतम 8 इलेक्ट्रॉनों की आवश्यकता होती है।
(ग) प्रत्येक ब्लॉक में स्तम्भों की संख्या उस उपकोश में भरे जा सकने वाले इलेक्ट्रॉनों की संख्या के बराबर होती है।
(घ) तत्त्व के इलेक्ट्रॉन विन्यास को भरते समय अन्तिम भरे जाने वाले इलेक्ट्रॉन का उप-कोश उसके द्विगंशी क्वान्टम संख्या को प्रदर्शित करता है।
उत्तर:
कथन (ख) सही नहीं है क्योंकि d-खण्ड 10 स्तम्भ हैं जिनमें 10 इलेक्ट्रॉन भरे जा सकते हैं।
प्रश्न 3.35.
ऐसा कारक, जो संयोजकता इलेक्ट्रॉन को प्रभावित करता है, उस तत्त्व की रासायनिक प्रवृत्ति भी प्रभावित करता है। निम्नलिखित में से कौनसा कारक संयोजकता कोश को प्रभावित नहीं करता?
(क) संयोजकता मुख्य क्वान्टम संख्या (n)
(ख) नाभिकीय आवेश (Z)
(ग) नाभिकीय द्रव्यमान
(घ) क्रोड इलेक्ट्रॉनों की संख्या।
उत्तर:
(ग) नाभिकीय द्रव्यमान से संयोजकता कोश पर कोई प्रभाव नहीं होता है।
प्रश्न 3.36.
सम इलेक्ट्रॉनिक स्पीशीज F-, Ne और Na+ का आकार इनमें से किससे प्रभावित होता है?
(क) नाभिकीय आवेश (Z)
(ख) मुख्य क्वान्टम संख्या (n)
(ग) बाह्य कक्षकों में इलेक्ट्रॉन-इलेक्ट्रॉन अन्योन्य क्रिया
(घ) ऊपर दिए गए कारणों में से कोई भी नहीं, क्योंकि उनका आकार समान है।
उत्तर:
(क) नाभिकीय आवेश बढ़ने पर समइलेक्ट्रॉनिक स्पीशीज का आकार कम होता है।
प्रश्न 3.37.
आयनन एन्थैल्पी के सन्दर्भ में निम्नलिखित में से कौनसा कथन गलत है?
(क) प्रत्येक उत्तरोत्तर इलेक्ट्रॉन से आयनन एन्थैल्पी बढ़ती
(ख) क्रोड उत्कृष्ट गैस के विन्यास से जब इलेक्ट्रॉन को निकाला जाता है, तब आयनन एन्थैल्पी का मान अत्यधिक होता है।
(ग) आयनन एन्थैल्पी के मान में अत्यधिक तीव्र वृद्धि संयोजकता इलेक्ट्रॉनों के विलोपन को व्यक्त करता है।
(घ) कम 'n' मान वाले कक्षकों से अधिक " मान वाले कक्षकों की तुलना में इलेक्ट्रॉनों को आसानी से निकाला जा सकता है।
उत्तर:
(घ) कम 11 मान वाले कक्षक नाभिक के अधिक नजदीक होते हैं जिसमें से इलेक्ट्रॉन को निकालना मुश्किल होता है।

प्रश्न 3.38.
B, Al, Mg, K तत्त्वों के लिए धात्विक अभिलक्षण का सही क्रम इनमें से कौनसा है ?
(क) B > Al > Mg > K
(ख) Al > Mg > B > K
(ग) Mg > Al > K > B
(घ) K > Mg > Al > B
उत्तर:
(घ) आवर्त में धात्विक गुण कम होता है तथा वर्ग में धात्विक गुण बढ़ता है अतः K का धात्विक गुण अधिकतम तथा B का धात्विक गुण न्यूनतम है।
प्रश्न 3.39
तत्त्वों B, C, N, F और Si के लिए अधातु अभिलक्षण का इनमें से सही क्रम कौनसा है?
(क) B > C > SI > N > F
(ख) Sl > C > B > N > F
(ग) F > N > C > B > SI
(घ) F > N > C > Si > B
उत्तर:
(ग) वर्ग में अधातु गुण कम होता है तथा आवर्त में अधातु गुण बढ़ता है।
प्रश्न 3.40.
तत्त्वों F, Cl, O और N के ऑक्सीकारक गुणधर्म के आधार पर उनकी रासायनिक अभिक्रियाशीलता का सही क्रम निम्नलिखित में से कौनसा है?
(क) F > Cl > O > N
(ख) F > O > Cl > N
(ग) Cl > F > O > N
(घ) Ö > F > N > C
उत्तर:
(ख) आवर्त में ऑक्सीकरण गुण बढ़ता है तथा वर्ग में यह गुण कम होता है।
