RBSE Class 9 Science Important Questions Chapter 4 परमाणु की संरचना
Rajasthan Board RBSE Class 9 Science Important Questions Chapter 4 परमाणु की संरचना Important Questions and Answers.
RBSE Class 9 Science Chapter 4 Important Questions परमाणु की संरचना
बहुचयनात्मक प्रश्न:
प्रश्न 1.
'केनाल रे' की खोज का श्रेय जाता है?
(अ) ई. गोल्डस्टीन को
(ब) डाल्टन को
(स) रदरफोर्ड को
(द) टॉमसन को
उत्तर:
(अ) ई. गोल्डस्टीन को
प्रश्न 2.
परमाणु धन आवेशित गोला है, यह संकल्पना देने वाले वैज्ञानिक थे:
(अ) रदरफाड
(ब) टॉमसन
(स) डाल्टन
(द) नील्स बोर
उत्तर:
(ब) टॉमसन

प्रश्न 3.
न्यूक्लिऑन में होते हैं?
(अ) प्रोटॉन व इलेक्ट्रॉन
(ब) प्रोटॉन व न्यूट्रॉन
(स) न्यूट्रॉन व इलेक्ट्रॉन
(द) केवल न्यूट्रॉन
उत्तर:
(ब) प्रोटॉन व न्यूट्रॉन
प्रश्न 4.
किसी तत्त्व की द्रव्यमान संख्या होती है?
(अ) उसके नाभिक में उपस्थित प्रोटॉनों की कुल संख्या
(ब) उसके परमाणु में इलेक्ट्रॉन तथा प्रोटॉनों की कुल संख्या
(स) उसके नाभिक में उपस्थित न्यूट्रॉनों तथा प्रोटॉनों की कुल संख्या
(द) उसके नाभिक में उपस्थित न्यूट्रॉनों की संख्या
उत्तर:
(स) उसके नाभिक में उपस्थित न्यूट्रॉनों तथा प्रोटॉनों की कुल संख्या
प्रश्न 5.
यदि किसी तत्त्व की परमाणु संख्या 11 व द्रव्यमान संख्या 23 हो तो उसके परमाणु में इलेक्ट्रॉन, न्यूट्रॉन व प्रोटॉन की संख्या होगी
(अ) 23, 23, 11
(ब) 11, 11, 23
(स) 11, 12, 23
(द) 11, 12, 11
उत्तर:
(द) 11, 12, 11
प्रश्न 6.
α (अल्फा) कण पर धन आवेश जिस तत्त्व के परमाणु के समान है, वह है?
(अ) हाइड्रोजन
(ब) हीलियम
(स) लीथियम
(द) निऑन
उत्तर:
(ब) हीलियम
प्रश्न 7.
रदरफोर्ड ने अपने प्रयोगों के आधार पर निष्कर्ष निकाला कि नाभिक की त्रिज्या परमाणु की त्रिज्या से:
(अ) 10 गुणा बड़ी होती है
(ब) 102 गुणा छोटी होती है
(स) 105 गुणा छोटी होती है
(द) 1010 गुणा बड़ी होती है
उत्तर:
(स) 105 गुणा छोटी होती है
प्रश्न 8.
बोर और बरी के नियम अनुसार M कोश में अधिकतम इलेक्ट्रॉन होंगे:
(अ) 2
(ब) 8
(स) 18
(द) 32
उत्तर:
(स) 18

प्रश्न 9.
क्लोरीन के समस्थानिक 1735CI व 1737CI का प्रकृति में उपस्थित अनुपात है?
(अ) 1 : 3
(ब) 2 : 3
(स) 3 : 1
(द) 1 : 1
उत्तर:
(स) 3 : 1
प्रश्न 10.
कैंसर के उपचार में उपयोग में आने वाला समस्थानिक है?
(अ) यूरेनियम
(ब) कोबाल्ट
(स) आयोडीन
(द) नमक
उत्तर:
(ब) कोबाल्ट
प्रश्न 11.
समान न्यूक्लिऑनों वाला तत्त्व समूह है?
(अ) Ca व Ar
(ब) C व O
(स) He व Li
(द) N व O
उत्तर:
(अ) Ca व Ar
प्रश्न 12.
संयोजकता इलेक्ट्रॉन परमाणु के जिस कक्ष में उपस्थित होता है, वह है?
(अ) प्रथम कक्ष
(ब) बाह्यतम कक्ष
(स) द्वितीय कक्ष
(द) किसी भी कक्ष
उत्तर:
(ब) बाह्यतम कक्ष
प्रश्न 13.
I - 131 का उपयोग किस रोग के उपचार के लिए किया जाता है?
(अ) कैंसर
(ब) घेघा रोग
(स) ल्यूकेमिया
(द) रक्त विकार
उत्तर:
(ब) घेघा रोग
प्रश्न 14.
1906 में जे.जे. टॉमसन को भौतिक शास्त्र में नोबल पुरस्कार किस कारण से मिला था?
(अ) इलेक्ट्रॉन की खोज के कारण।
(ब) परमाणु मॉडल देने के कारण।
(स) केनाल किरणों की खोज के कारण।
(द) प्रोटॉन की खोज के कारण।
उत्तर:
(अ) इलेक्ट्रॉन की खोज के कारण।
रिक्त स्थान वाले प्रश्न:
निम्नलिखित प्रश्नों में रिक्त स्थानों की पूर्ति कीजिए:
प्रश्न 1.
परमाणु ............ है और आवेशित कणों से बना होता है।
उत्तर:
विभाज्य

प्रश्न 2.
नाभिक की त्रिज्या परमाणु की त्रिज्या से ............ गुणा छोटी है।
उत्तर:
105
प्रश्न 3.
किसी परमाणु के बाह्यतम कक्ष में उपस्थित इलेक्ट्रॉनों को ............ इलेक्ट्रॉन कहते हैं।
उत्तर:
संयोजकता
प्रश्न 4.
126C तथा 146C कार्बन के ............ हैं।
उत्तर:
समस्थानिक
प्रश्न 5.
इलेक्ट्रॉन की खोज ............ ने की थी।
उत्तर:
जे.जे. टॉमसन।
सत्य / असत्य कथन वाले प्रश्न:
निम्नलिखित प्रश्नों में सत्य तथा असत्य कथन छाँटिए:
प्रश्न 1.
हाइड्रोजन को छोड़कर सभी परमाणुओं के नाभिक में न्यूट्रॉन होते हैं।
उत्तर:
सत्य
प्रश्न 2.
न्यूट्रॉन आवेशित तथा द्रव्यमान में प्रोटॉन के बराबर होता है।
उत्तर:
असत्य

प्रश्न 3.
किसी परमाणु के आठ इलेक्ट्रॉन युक्त बाह्यतम कक्ष को अष्टक कहा जाता है।
उत्तर:
सत्य
प्रश्न 4.
किसी परमाणु के M कोश में इलेक्ट्रॉनों की अधिकतम संख्या 32 होती है।
उत्तर:
असत्य
प्रश्न 5.
प्रत्येक तत्व के परमाणु की एक निश्चित संयोजन शक्ति होती है उसे संयोजकता कहते हैं।
उत्तर:
सत्य।
मिलान वाले प्रश्न:
निम्नलिखित प्रश्नों में भाग (अ) का मिलान भाग (ब) से करके सही कूट (कोड) का चयन कीजिए:
प्रश्न 1.
|
भाग (अ ) |
भाग (ब) |
|
(i) 18Ar10 व 20Ca40 |
(a) समस्थानिक |
|
(ii) 17Cl35 व 17C137 |
(b) N के L कोश में इलेक्ट्रॉन |
|
(iii) 3, 5 |
(c) समभारिक |
|
(iv) 8 |
(d) फॉस्फोरस की संयोजकता |
उत्तर:
|
भाग (अ ) |
भाग (ब) |
|
(i) 18Ar10 व 20Ca40 |
(c) समभारिक |
|
(ii) 17Cl35 व 17C137 |
(a) समस्थानिक |
|
(iii) 3, 5 |
(d) फॉस्फोरस की संयोजकतां |
|
(iv) 8 |
(b) N के L कोश में इलेक्ट्रॉन |

प्रश्न 2.
|
भाग (अ) |
भाग (ब) |
|
(i) Nकोश में अधिकतम इलेक्ट्रॉन |
(a) कैंसर का उपचार |
|
(ii) प्रोटॉन की खोज |
(b) He2+ |
|
(iii) α कण |
(c) ई. गोल्डस्टीन |
|
(iv) कोबाल्ट का समस्थानिक |
(d) 32 |
उत्तर:
|
भाग (अ) |
भाग (ब) |
|
(i) Nकोश में अधिकतम इलेक्ट्रॉन |
(d) 32 |
|
(ii) प्रोटॉन की खोज |
(c) ई. गोल्डस्टीन |
|
(iii) α कण |
(b) He2+ |
|
(iv) कोबाल्ट का समस्थानिक |
(a) कैंसर का उपचार |
प्रश्न 3.
|
भाग (अ) |
भाग (ब) |
|
(i) किसी कोश में अधिकतम इलेक्ट्रॉन |
(a) P + n |
|
(ii) द्रव्यमान संख्या |
(b) प्रोटॉनों की संख्या |
|
(iii) परमाणु संख्या |
(c) हाइड्रोजन का समस्थानिक |
|
(iv) ड्यूटीरियम |
(d) 2n2 |
उत्तर:
|
भाग (अ) |
भाग (ब) |
|
(i) किसी कोश में अधिकतम इलेक्ट्रॉन |
(d) 2n2 |
|
(ii) द्रव्यमान संख्या |
(a) p + n |
|
(iii) परमाणु संख्या |
(b) प्रोटॉनों की संख्या |
|
(iv) ड्यूटीरियम |
(c) हाइड्रोजन का समस्थानिक |
अतिलघूत्तरांत्मक प्रश्न:
प्रश्न 1.
जे.जे. टॉमसन द्वारा किस अवपरमाणुक कण की खोज की गई थी?
उत्तर:
इलेक्ट्रॉन।
प्रश्न 2.
केनाल किरणों पर कौनसा आवेश पाया गया था?
उत्तर:
धन आवेश।

प्रश्न 3.
प्रोटॉन का द्रव्यमान इलेक्ट्रॉन की तुलना में कितना होता है?
उत्तर:
लगभग 2000 गुणा अधिक।
प्रश्न 4.
परमाणु से इलेक्ट्रॉन निकाल सकते हैं किन्तु प्रोटॉन नहीं, क्यों?
उत्तर:
परमाणु से प्रोटॉन नहीं निकाल सकते क्योंकि ये परमाणु के भीतर नाभिक में होते हैं।
प्रश्न 5.
परमाणु उदासीन क्यों होता है?
उत्तर:
परमाणु में धन आवेश (प्रोटॉन) तथा ऋण आवेश (इलेक्ट्रॉन) समान मात्रा में होते हैं अतः परमाणु उदासीन होता है।
प्रश्न 6.
टॉमसन ने परमाणु मॉडल की तुलना किससे की थी?
उत्तर:
क्रिसमस केक अथवा तरबूज से।
प्रश्न 7.
अल्फा कण क्या है?
उत्तर:
अल्फा कण द्वि धन आवेशित हीलियम नाभिक (42H2+) है।
प्रश्न 8.
परमाणु का नाभिक धन आवेशित है। यह खोज किस वैज्ञानिक ने की थी?
उत्तर:
अरनेस्ट रदरफोर्ड।
प्रश्न 9.
परमाणु का नाभिक धन आवेशित क्यों होता है?
उत्तर:
परमाणु के नाभिक में धनावेशित कण प्रोटॉन उपस्थित होते हैं, अत: यह धन आवेशित होता है।
प्रश्न 10.
विविक्त कक्षा किसे कहते हैं?
उत्तर:
किसी परमाणु के नाभिक के चारों ओर जिन निश्चित कक्षाओं में इलेक्ट्रॉन चक्कर लगा सकते हैं, उन्हें विविक्त कक्षा कहते हैं। इन्हें ऊर्जा स्तर भी कहते हैं।
प्रश्न 11.
विविक्त कक्षा की क्या विशेषता है?
उत्तर:
विविक्त कक्षाओं में चक्कर लगाते समय इलेक्ट्रॉन की ऊर्जा विकरित नहीं होती है।

प्रश्न 12.
किसी कक्षा में अधिकतम इलेक्ट्रॉनों की संख्या का निर्धारण किस सूत्र से होता है?
उत्तर:
2n2, यहाँ n कक्षा की संख्या या ऊर्जा स्तर है।
प्रश्न 13.
N कोश में इलेक्ट्रॉनों की अधिकतम संख्या कितनी होगी?
उत्तर:
N कोश के लिए n = 4 है अत: N कोश में इलेक्ट्रॉनों की अधिकतम संख्या 2n2 = 2 x 42 = 32
अत: N कोश में इलेक्ट्रॉनों की अधिकतम संख्या = 32.
प्रश्न 14.
किसी परमाणु के बाह्यतम कोश में इलेक्ट्रॉन की अधिकतम संख्या कितनी होगी?
उत्तर:
किसी परमाणु के बाह्यतम कोश की इलेक्ट्रॉनों की अधिकतम संख्या 8 होती है।
प्रश्न 15.
अष्टक किसे कहते हैं?
उत्तर:
आठ इलेक्ट्रॉनयुक्त बाह्यतम कक्ष को अष्टक कहते हैं।
प्रश्न 16.
संयोजकता इलेक्ट्रॉन किसे कहते हैं?
उत्तर:
किसी परमाणु की बाह्यतम कक्ष में उपस्थित इलेक्ट्रॉनों को संयोजकता इलेक्ट्रॉन कहते हैं।
प्रश्न 17.
मैग्नीशियम और ऐलुमिनियम की संयोजकता क्या है?
उत्तर:
मैग्नीशियम की संयोजकता 2 व ऐलुमिनियम की संयोजकता 3 है।

प्रश्न 18.
उन तत्वों का नाम बताइए जिनके परमाणुओं के संयोजकता कोश में 8 इलेक्ट्रॉन होते हैं।
उत्तर:
अक्रिय गैसें [हीलियम (He) को छोड़कर, जिसके संयोजी कोश में दो इलेक्ट्रॉन होते हैं।]
प्रश्न 19.
समस्थानिक किन अवपरमाणविक कणों में भिन्नता के कारण बनते हैं?
उत्तर:
समस्थानिक न्यूट्रॉनों की संख्या में भिन्नता के कारण बनते हैं।
प्रश्न 20.
एक समभारिक युग्म का उदाहरण दीजिए।
उत्तर:
समभारिक युग्म 4018Ar व 4020Ca.
प्रश्न 21.
कार्बन के दो समस्थानिक लिखिए।
उत्तर:
126C व 146C.
प्रश्न 22.
समभारिक युग्म के परमाणुओं में क्या समानता है?
उत्तर:
समभारिक युग्म के परमाणुओं का परमाणु द्रव्यमान समान होता है।
प्रश्न 23.
यूरेनियम समस्थानिक का परमाणु भट्टी में क्या उपयोग है?
उत्तर:
यूरेनियम समस्थानिक परमाणु भट्टी में ईंधन के रूप में प्रयुक्त होता है।
प्रश्न 24.
दो रेडियोधर्मी समस्थानिकों के नाम लिखिए।
उत्तर:
यूरेनियम - 235 तथा कोबाल्ट - 60.
प्रश्न 25.
इलेक्ट्रॉनिक विन्यास से क्या तात्पर्य है?
उत्तर:
किसी तत्व के परमाणु में उसके विभिन्न ऊर्जा स्तरों (कक्षाओं) में इलेक्ट्रॉनों का वितरण 'इलेक्ट्रॉनिक विन्यास' कहलाता है।
लघूत्तरात्मक प्रश्न:
प्रश्न 1.
'केनाल रे' (एनोड किरण) की क्या विशेषताएँ हैं?
उत्तर:
'केनाल रे' की विशेषताएँ।
- ये ई. गोल्डस्टीन द्वारा खोजी गई धनावेशित विकिरण थीं।
- इन पर इलेक्ट्रॉन के आवेश के बराबर किन्तु विपरीत आवेश था।
- इनका द्रव्यमान इलेक्ट्रॉन के द्रव्यमान से 2000 गुणा अधिक होता है।
- इनको प्रोटॉन कहा गया, जिसे p+ से दर्शाते हैं।
- प्रोटॉन का द्रव्यमान 1 इकाई और आवेश + 1 माना जाता है।

प्रश्न 2.
इलेक्ट्रॉन की कोई तीन विशेषताएँ लिखिए।
उत्तर:
इलेक्ट्रॉन की विशेषताएँ।
- इलेक्ट्रॉन की खोज का श्रेय जे.जे. टॉमसन को जाता है तथा इस पर ऋण आवेश पाया जाता है।
- इलेक्ट्रॉन का द्रव्यमान नगण्य तथा आवेश - 1 माना जाता है।
- इलेक्ट्रॉन नाभिक के चारों ओर कुछ निश्चित कक्षाओं / ऊर्जा - स्तरों में चक्कर लगाते हैं।
प्रश्न 3.
जे.जे. टॉमसन का परमाणु मॉडल क्या था? इसकी क्या विशेषताएँ थीं?
उत्तर:
जे.जे. टॉमसन का परमाणु मॉडल:
इनके अनुसार परमाणु एक धनावेशित गोला था जिसकी तुलना क्रिसमस केक से की गई थी, जिसमें इलेक्ट्रॉन धनात्मक गोला क्रिसमस केक में लगे सूखे मेवों की तरह थे या परमाणु में धन आवेश तरबूज के इलेक्ट्रॉन खाने वाले लाल भाग की तरह बिखरा है जबकि इलेक्ट्रॉन धनावेशित गोले में तरबूज के बीज की भाँति धंसे हैं।
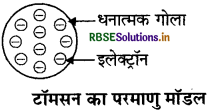
जे.जे. टॉमसन परमाणु मॉडल की मुख्य विशेषताएँ निम्न हैं।
- परमाणु एक धन आवेशित गोला होता है, जिसमें इलेक्ट्रॉन स्थित होते हैं।
- धन आवेश व ऋण आवेश परिमाण में समान होते हैं, इसीलिए परमाणु वैद्युतीय रूप से उदासीन होता है।
प्रश्न 4.
एक रासायनिक अभिक्रिया के समय किसी तत्व का परमाणु क्रमांक क्यों नहीं बदलता है? समझाइए।
उत्तर:
किसी तत्व के परमाणु में उपस्थित प्रोटॉनों की संख्या, उसका परमाणु क्रमांक कहलाती है। रासायनिक अभिक्रियाओं में केवल इलेक्ट्रॉन ही भाग लेते हैं, प्रोटॉन नहीं। इस कारण प्रोटॉनों की संख्या में कोई परिवर्तन नहीं होता है, परिणामस्वरूप तत्व का परमाणु क्रमांक भी नहीं बदलता है।
प्रश्न 5.
रदरफोर्ड द्वारा किये गये प्रयोग से प्राप्त प्रेक्षणों को लिखिए।
उत्तर:
रदरफोर्ड द्वारा किए गये प्रयोग से अग्रलिखित प्रेक्षण प्राप्त हुए।
- तेज गति से चल रहे अधिकांश अल्फा कण बिना विचलित हुए सोने की पन्नी से सीधे निकल गये।
- कुछ अल्फा कण पन्नी के द्वारा बहुत छोटे कोण से विक्षेपित हुए।
- आश्यर्चजनक रूप से प्रत्येक 12,000 कणों में से एक कण वापस आ गया।
प्रश्न 6.
α - कण प्रकीर्णन प्रयोग से रदरफोर्ड ने क्या परिणाम निकाले?
उत्तर:
अल्फा कण प्रकीर्णन प्रयोग के परिणामा।
- परमाणु के भीतर का अधिकांश भाग खाली है, क्योंकि अधिकांश अल्फा कण बिना विक्षेपित हुए सोने की पन्नी से बाहर निकल जाते हैं।
- बहुत कम कण अपने मार्ग से विक्षेपित होते हैं, जिससे यह पता चलता है कि परमाणु में धनावेशित भाग बहुत कम है।
- बहुत कम अल्फा कण 180° पर विक्षेपित हुए थे जो यह बताता है कि सोने के परमाणु का पूर्ण धनावेशित भाग और द्रव्यमान, परमाणु के भीतर बहुत कम आयतन में सीमित है।

प्रश्न 7.
रदरफोर्ड के परमाणु मॉडल के मुख्य बिन्दु क्या हैं?
उत्तर:
रदरफोर्ड ने अपने परमाणु मॉडल को निम्न प्रकार से प्रस्तुत किया।
- बहुत कम कण अपने मार्ग से विक्षेपित होते हैं, जिससे यह पता चलता है कि परमाणु में धनावेशित भाग बहुत कम है।
- परमाणु का सम्पूर्ण द्रव्यमान और धन आवेश एक अत्यन्त छोटे भाग में केन्द्रित होता है, जिसे नाभिक कहा जाता है
- परमाणु का अधिकांश भाग रिक्त होता है।
- इलेक्ट्रॉन नाभिक के चारों ओर निश्चित कक्षाओं (वर्तुलाकार मार्ग) में चक्कर लगाते हैं।
- नाभिक का आकार, परमाणु के आकार की तुलना में काफी कम होता है।
प्रश्न 8.
परमाणु के नाभिक पर संक्षिप्त टिप्पणी लिखिये।
उत्तर:
परमाणु का नाभिक अत्यंत सूक्ष्म होता है जिसमें न्यूट्रॉन एवं प्रोटॉन स्थित होते हैं। अत: परमाणु का लगभग सम्पूर्ण द्रव्यमान उसके नाभिक में स्थित होता है। नाभिक में धन आवेशित प्रोटॉनों के पाये जाने के कारण इसमें धन आवेश का उच्च घनत्व पाया जाता है। नाभिक में पाये जाने वाले प्रोटॉनों एवं न्यूट्रॉनों की कुल संख्या को सम्मिलित रूप से न्यूक्लिऑन्स या द्रव्यमान संख्या (A) कहते हैं।
प्रश्न 9.
परमाणु संख्या किसे कहते हैं? न्यूट्रॉन की संख्या, परमाणु संख्या तथा द्रव्यमान संख्या में सम्बन्ध लिखिए।
उत्तर:
परमाणु संख्या (Z): किसी तत्व के परमाणु के नाभिक में उपस्थित प्रोटॉनों की संख्या उस तत्व की परमाणु संख्या कहलाती है। किसी तत्व के सभी परमाणुओं की परमाणु संख्या समान होती है।
उदासीन परमाणु में परमाणु संख्या = इलेक्ट्रॉनों की संख्या = प्रोटॉनों की संख्या
न्यूट्रॉनों की संख्या = द्रव्यमान संख्या – परमाणु संख्या
अतः
N = A - Z

प्रश्न 10.
परमाणु के बाह्य भाग के स्वरूप को स्पष्ट कीजिए।
उत्तर:
परमाणु के बाह्य भाग में निश्चित कक्षों में इलेक्ट्रॉन नाभिक के चारों ओर चक्कर लगाते हैं, इन कक्षों को ऊर्जा स्तर कहा जाता है। प्रथम कक्ष को K, द्वितीय कक्ष को L, तृतीय कक्ष को M तथा चतुर्थ कक्ष को N आदि से प्रदर्शित किया जाता है। प्रत्येक कक्ष में इलेक्ट्रॉनों की अधिकतम संख्या 2n2 होती है।
जहाँ n = कक्षों की संख्या = 1, 2, 3, 4.
प्रश्न 11.
समस्थानिक किसे कहते हैं? इनके कोई दो गुण भी लिखिए।
उत्तर:
समस्थानिक: एक ही तत्त्व के विभिन्न परमाणु, जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न - भिन्न होती है, समस्थानिक कहलाते हैं, जैसे-कार्बन के दो समस्थानिक 126C और 146C हैं, जिनका द्रव्यमान क्रमशः 12 व 14 है।
समस्थानिकों के गुण:
- समस्थानिकों में प्रोटॉन व इलेक्ट्रॉन की संख्या समान होती है।
- समस्थानिकों के रासायनिक गुण समान लेकिन भौतिक गुण भिन्न होते हैं।
प्रश्न 12.
समस्थानिकों तथा समभारिकों में अन्तर लिखिए।
उत्तर:
समस्थानिक व समभारिक में निम्नलिखित अन्तर है।
|
समस्थानिक |
समभारिक |
|
1. इनमें परमाणु संख्या समान होती है। |
1. इनमें परमाणु संख्या समान नहीं होती। |
|
2. इनमें द्रव्यमान संख्या अलग - अलग होती है। |
2. इनमें द्रव्यमान संख्या समान होती है। |
|
3. समस्थानिक एक ही तत्त्व के विभिन्न परमाणु होते हैं। |
3. समभारिक अलग-अलग तत्त्वों के परमाणु होते हैं। |
|
4. समस्थानिक के रासायनिक गुण समान होते हैं। |
4. इनके रासायनिक गुण अलग - अलग होते हैं। |
प्रश्न 13.
किसी तत्त्व के परमाणु को परमाणु संख्या व द्रव्यमान संख्या के सहित किस प्रकार प्रदर्शित करते हैं?
उत्तर:
किसी तत्त्व के परमाणु को प्रदर्शित करने के लिए तत्त्व के प्रतीक के बाईं ओर ऊपर तत्त्व का द्रव्यमान और नीचे उसकी परमाणु संख्या लिखते हैं।

जैसे - नाइट्रोजन तत्त्व को इस प्रकार प्रदर्शित करते हैं 147N यहाँ 14 नाइट्रोजन की द्रव्यमान संख्या व 7 परमाणु संख्या है।
प्रश्न 14.
किसी तत्त्व के परमाणु की परमाणु संख्या 8 व द्रव्यमान संख्या 16 है। इसमें प्रोटॉन की संख्या, इलेक्ट्रॉन की संख्या, न्यूट्रॉन की संख्या तथा इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
दिया है: परमाणु संख्या = 8 अतः प्रोटॉन की संख्या = 8
तथा इलेक्ट्रॉन की संख्या = 8 होगी।
क्योंकि न्यूट्रॉन की संख्या = द्रव्यमान संख्या - प्रोटॉन संख्या
= 16 - 8 = 8
इलेक्ट्रॉनिक विन्यास 2, 6 होगा अर्थात् प्रथम कक्ष में 2 इलेक्ट्रॉन व द्वितीय कक्ष में 6 इलेक्ट्रॉन होंगे।

प्रश्न 15.
निऑन (Ne) व आर्गन (Ar) अक्रिय गैस क्यों हैं?
उत्तर:
बोर - बरी के नियमानुसार किसी परमाणु के बाह्यतम कक्ष में अधिकतम 8 इलेक्ट्रॉन हो सकते हैं। यह देखा गया था कि जिन तत्त्वों के परमाणुओं के बाह्यतम कक्ष पूर्ण रूप से इलेक्ट्रॉनों (8) से भरे होते हैं, वे रासायनिक रूप से अक्रिय होते हैं अर्थात् ऐसे तत्वों की संयोजकता शून्य होती है। निऑन का इलेक्ट्रॉनिक विन्यास 2, 8 तथा ऑर्गन का 2, 8, 8 होता है। अतः इनके बाह्यतम कक्ष (क्रमशः L और M) पूर्ण भरे हैं। इस कारण ये तत्व अक्रिय होते हैं तथा ये दोनों तत्व गैसें हैं, इसलिए इन्हें 'अक्रिय गैस' कहा जाता है।
प्रश्न 16.
संयोजकता इलेक्ट्रॉन से क्या आशय है? समझाइए।
उत्तर:
संयोजकता इलेक्ट्रॉन: किसी परमाणु के बाह्य कक्ष में उपस्थित इलेक्ट्रॉनों को संयोजकता इलेक्ट्रॉन कहा जाता है।
जैसे - सोडियम की परमाणु संख्या 11 है अतः इसका इलेक्ट्रॉनिक विन्यास 2, 8, 1 होगा। इसलिए सोडियम के बाह्य कक्ष (M) में 1 इलेक्ट्रॉन है जो सोडियम की संयोजकता इलेक्ट्रॉन है।
प्रश्न 17.
किसी तत्त्व A की परमाणु संख्या 18 है, जबकि अन्य तत्त्व B की परमाणु संख्या 19 है। इनमें से कौनसा तत्त्व अधिक क्रियाशील होगा?
उत्तर:
तत्त्व A की परमाणु संख्या = 18 अतः इसका इलेक्ट्रॉनिक विन्यास 2, 8, 8 होगा। तत्त्व B की परमाणु संख्या = 19.अतः इसका इलेक्ट्रॉनिक विन्यास 2, 8, 8, 1 होगा।
तत्त्व A के सभी कक्ष भरे हुए हैं, जबकि तत्त्व B के बाह्यतम कक्ष में एक इलेक्ट्रॉन उपस्थित है, जिसका त्याग करके यह अपने बाह्यतम कक्ष का अष्टक पूर्ण कर सकता है। इस कारण तत्व B अधिक क्रियाशील होगा।
प्रश्न 18.
किसी तत्त्व की परमाणु संख्या 13 तथा द्रव्यमान संख्या 27 है। इसके नाभिक का संघटन विभिन्न कक्षों में इलेक्ट्रॉनों के आवंटन को प्रदर्शित करो तथा तत्त्व की संयोजकता बताइए।
उत्तर:
तत्व की द्रव्यमान संख्या 27 तथा परमाणु संख्या 13 है।
अतः नाभिक में न्यूट्रॉनों की संख्या = 27 - 13 = 14
इस प्रकार परमाणु के नाभिक में 13 प्रोटॉन व 14 न्यूट्रॉन होंगे।
अतः तत्व का इलेक्ट्रॉनिक विन्यास = 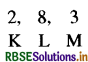
तत्व के बाह्य कक्ष में 3 संयोजी इलेक्ट्रॉन हैं, अतः तत्त्व की संयोजकता 3 होगी।

प्रश्न 19.
संकेत 4020Ca से लिखें।
(i) Ca की द्रव्यमान संख्या
(ii) Ca की परमाणु संख्या
(iii) Ca की नाभिक संरचना।
उत्तर:
(i) Ca की द्रव्यमान संख्या = 40
(ii) Ca की परमाणु संख्या = 20
(iii) Ca की नाभिक संरचना =
∵ द्रव्यमान संख्या = न्यूट्रॉनों की संख्या + प्रोटॉनों की संख्या
∴ न्यूट्रॉनों की संख्या = द्रव्यमानों की संख्या - प्रोटॉनों की संख्या
= 40 - 20
=20
अत: Ca के नाभिक में 20 प्रोटॉन और 20 न्यूट्रॉन होंगे।
निबन्धात्मक प्रश्न:
प्रश्न 1.
प्रकति में क्लोरीन दो समस्थानिकों के रूप में मिलती हैं, जिनकी द्रव्यमान संख्या क्रमशः 35u व 37u होती है। रासायनिक गणना के लिए हम क्लोरीन का द्रव्यमान क्या लेंगे? स्पष्ट कीजिए।
उत्तर:
किसी तत्त्व के एक परमाणु का द्रव्यमान, उस तत्त्व के प्रकृति में पाये जाने वाले सभी परमाणुओं के औसत द्रव्यमान के बराबर होता है। यदि किसी तत्त्व के समस्थानिक नहीं हैं, तो परमाणु का द्रव्यमान उसमें उपस्थित प्रोटॉन व न्यूट्रॉन के द्रव्यमान के योग के समान होता है। परन्तु यदि कोई तत्त्व समस्थानिकों के रूप में पाया जाता है तो प्रत्येक समस्थानिक का प्रतिशत जानना होगा तथा उनका औसत द्रव्यमान ज्ञात करना होगा।
इसी प्रकार क्लोरीन के औसत द्रव्यमान की गणना करनी होगी, जो कि निम्न प्रकार है:
प्रकृति में क्लोरीन के समस्थानिक का अनुपात 3 : 1 है, अतः
क्लोरीन का औसत परमाणु द्रव्यमान = \(\left[35 \times \frac{75}{100}+37 \times \frac{25}{100}\right]\)
= \(\left[35 \times \frac{3}{4}+37 \times \frac{1}{4}\right]\)
= \(\left[\frac{105}{4}+\frac{37}{4}\right]=\frac{142}{4}=35.5 \mathrm{u}\)
अतः रासायनिक गणना में हम क्लोरीन का औसत द्रव्यमान 35.5 4 लेंगे।
प्रश्न 2.
रदरफोर्ड के अल्फा कण प्रकीर्णन प्रयोग का वर्णन करो। इस प्रयोग के प्रेक्षण बताइए तथा इन प्रेक्षणों के आधार पर रदरफोर्ड के परमाणु मॉडल की विवेचना कीजिए।
उत्तर:
रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग या रदरफोर्ड का परमाणु मॉडल - अरनेस्ट रदरफोर्ड यह जानना चाहते थे कि इलेक्ट्रॉन परमाणु के भीतर कैसे व्यवस्थित है। इसके लिए उन्होंने एक प्रयोग किया। इस प्रयोग में, तेज गति से चल रहे अल्फा कणों को सोने की पन्नी पर टकराया गया। इन्होंने सोने की पन्नी इसलिए चुनी क्योंकि ये बहुत पतली परत चाहते थे और सोने की यह पन्नी 1000 परमाणुओं के बराबर मोटी थी। अल्फा कण द्विआवेशित हीलियम कण होते हैं। अतः ये धनावेशित होते हैं। इनका द्रव्यमान 4u होता है इसलिए तीव्र गति से चल रहे इन अल्फा कणों में पर्याप्त ऊर्जा होती है। रदरफोर्ड का अनुमान था कि अल्फा कण सोने के
परमाणुओं में विद्यमान अवपरमाणुक कणओं के द्वारा विक्षेपित होंगे। चूँकि अल्फा कण प्रोटॉन से बहुत अधिक भारी थे, इसलिए उन्होंने इनके अधिक विक्षेपण की आशा नहीं की थी। लेकिन अल्फा कण प्रकीर्णन प्रयोग ने आशा के बिल्कुल विपरीत परिणाम दिया, जैसा कि नीचे दिए गए चित्र में दर्शाया गया है
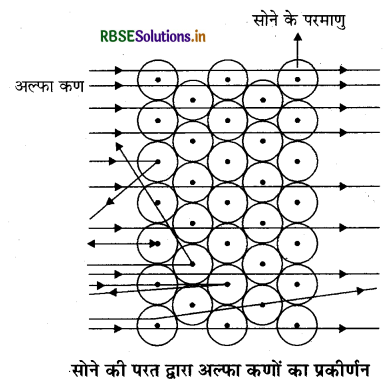
इससे निम्नलिखित परिणाम मिल।
- तेज गति से चल रहे अधिकतर अल्फा कण सोने की पन्नी से सीधे निकल गए।
- कुछ अल्फा कण पन्नी के द्वारा बहुत छोटे कोण से विक्षेपित हुए।
- आश्चर्यजनक रूप से प्रत्येक 12000 कणों में से एक कण वापस आ गया।
रदरफोर्ड के लिए ये परिणाम आश्चर्यजनक थे। उनके अनुसार अल्फा कणों का टंकराकर वापस लौटना, एक 15 इंच के तोप के गोले का टिशू पेपर के एक टुकड़े से टकराकर वापस लौटने के समान था। इस प्रयोग के आधार पर रदरफोर्ड ने निम्न परिणाम निकाले।
- परमाणु के भीतर का अधिकतर भाग खाली है क्योंकि अधिकांश अल्फा कण बिना विक्षेपित हुए सोने की पन्नी से बाहर निकल जाते हैं।
- बहुत कम अल्फा कण अपने मार्ग से विक्षेपित होते हैं, जिससे ज्ञात होता है कि परमाणु में धनावेशित भाग बहुत कम है।
- बहुत कम अल्फा कण 180° पर विक्षेपित हुए थे, जिससे पता चलता है कि सोने के परमाणु का पूर्ण धनावेशित भाग और द्रव्यमान, परमाणु के भीतर बहुत कम आयतन में सीमित है।
अपने प्रयोगों के आधार पर रदरफोर्ड ने परमाणु का नाभिकीय - मॉडल प्रस्तुत किया, जिसके प्रमुख लक्षण निम्न थे।
- परमाणु का केन्द्र धनावेशित होता है, जिसे नाभिक कहा जाता है। एक परमाणु का लगभग सम्पूर्ण द्रव्यमान नाभिक में ही होता है।
- इलेक्ट्रॉन नाभिक के चारों ओर निश्चित कक्षाओं (वर्तुलाकार मार्ग) में चक्कर लगाते हैं।
- नाभिक का आकार परमाणु के आकार की तुलना में काफी कम होता है।

प्रश्न 3.
परमाणु क्रमांक 1 से 18 तक के तत्त्वों के परमाणुओं का इलेक्ट्रॉनिक विन्यास दीजिए।
उत्तर:
बोर - बरी नियम के अनुसार परमाणु क्रमांक 1 से 18 तक के तत्त्वों के परमाणुओं का इलेक्ट्रॉनिक विन्यास अग्रलिखित है।
|
तत्त्व |
परमाणु |
इलेक्ट्रॉन विन्यास |
||||
|
प्रतीक |
परमाणु संख्या |
इलेक्ट्रॉनों की संख्या |
प्रथम कक्ष K |
द्वितीयकक्ष L |
तृतीय कक्ष M |
|
|
(i) हाइड्रोजन |
H |
1 |
1 |
1 |
- |
- |
|
(ii) हीलियम |
He |
2 |
2 |
2 |
- |
- |
|
(ii) लीथियम |
Li |
3 |
3 |
2 |
1 |
- |
|
(iv) बेरिलियम |
Be |
4 |
4 |
2 |
2 |
- |
|
(v) बोरोन |
B |
5 |
5 |
2 |
3 |
- |
|
(vi) कार्बन |
C |
6 |
6 |
2 |
4 |
- |
|
(vii) नाइट्रोजन |
N |
7 |
7 |
2 |
5 |
- |
|
(viii) ऑक्सीजन |
O |
8 |
8 |
2 |
6 |
- |
|
(ix) फ्लोरीन |
F |
9 |
9 |
2 |
7 |
- |
|
(x) नियॉन |
Ne |
10 |
10 |
2 |
8 |
- |
|
(xi)सोडियम |
Na |
11 |
11 |
2 |
8 |
1 |
|
(xii) मैग्नीशियम |
Mg |
12 |
12 |
2 |
8 |
2 |
|
(xiii) ऐलुमिनियम |
Al |
13 |
13 |
2 |
8 |
3 |
|
(xiv) सिलिकॉम |
Si |
14 |
14 |
2 |
8 |
4 |
|
(xv) फॉस्फोरस |
P |
15 |
15 |
2 |
8 |
5 |
|
(xvi) सल्फर |
S |
16 |
16 |
2 |
8 |
6 |
|
(xvii) क्लोरीन |
Cl |
17 |
17 |
2 |
8 |
7 |
|
(xviii) ऑर्गन |
Ar |
18 |
18 |
2 |
8 |
8 |
प्रश्न 4.
संयोजकता से क्या आशय है? संयोजकता का निर्धारण कैसे किया जाता है? उदाहरण सहित समझाइए।
उत्तर:
संयोजकता: किसी तत्त्व के परमाणु के बाह्यतम कोश में उपस्थित इलेक्ट्रॉनों की संख्या को संयोजकता इलेक्ट्रॉन कहते हैं अत: किसी परमाणु के बाह्यतम कक्ष में इलेक्ट्रॉनों का अष्टक पूर्ण करने के लिए जितनी संख्या में इलेक्ट्रॉनों की साझेदारी या स्थानान्तरण होता है, वह उस तत्त्व की संयोजकता होती है। संयोजकता का निर्धारण निम्न प्रकार से करते हैं।
(1) जिन तत्त्वों के परमाणुओं के बाह्यतम कक्ष पूर्ण रूप से भरे होते हैं, वे रासायनिक रूप से सक्रिय नहीं होते हैं तथा उनकी संयोजकता शून्य होती है। जैसे - He, Ne, Ar के बाह्यतम कक्ष में क्रमशः 2, 8, 8 इलेक्ट्रॉन होते हैं।
(2) हाइड्रोजन, लीथियम या सोडियम प्रत्येक परमाणु के बाह्यतम कक्ष में एक-एक इलेक्ट्रॉन होता है। अतः ये एक इलेक्ट्रॉन का त्याग कर सकते हैं। इसलिए इनकी संयोजकता 1 (एक) होती है।
(3) यदि किसी परमाणु के बाह्यतम कक्ष में इलेक्ट्रॉनों की संख्या उसकी क्षमता के अनुसार लगभग पूर्ण है तो इनकी संयोजकता अन्य प्रकार से निर्धारित होती है। जैसे फ्लोरीन परमाणु के बाह्यतम कक्ष में 7 (सात) इलेक्ट्रॉन होते हैं और इसकी संयोजकता (7) हो सकती है किन्तु बाह्यतम कक्ष में अष्टक बनाने के लिए यह 7 इलेक्ट्रॉन त्यागने की अपेक्षा 1 इलेक्ट्रॉन आसानी से प्राप्त कर सकता है। अतः इसकी संयोजकता, अष्टक (8) में से (7) सात घटाकर प्राप्त की जाती है। इस तरह फ्लोरीन की संयोजकता एक है। इसके अन्य उदाहरण निम्न हैं
|
तत्व का नाम
|
परमाणु संख्या |
इलेक्ट्रॉनिक विन्यास |
संयोजकता इलेक्ट्रॉन |
संयोजकता |
||
|
K |
L |
M |
||||
|
(i) ऑक्सीजन |
8 |
2 |
6 |
- |
6 |
8 – 6 =2 |
|
(ii) क्लोरीन |
17 |
2 |
8 |
7 |
7 |
8 – 7 = 1 |
|
(iii) सल्फर |
16 |
2 |
8 |
6 |
6 |
8 – 6 =2 |
