RBSE Class 11 Chemistry Notes Chapter 10 s-ब्लॉक तत्त्व
These comprehensive RBSE Class 11 Chemistry Notes Chapter 10 s-ब्लॉक तत्त्व will give a brief overview of all the concepts.
RBSE Class 11 Chemistry Chapter 10 Notes s-ब्लॉक तत्त्व
→ s-ब्लॉक के तत्व-वे तत्त्व जिनका इलेक्ट्रॉनिक विन्यास ns1 तथा ns2 होता है तथा जिनमें अन्तिम इलेक्ट्रॉन s-कक्षक में भरा जाता है उन्हें s-ब्लॉक के तत्त्व कहते हैं।
→ क्षार धातु-ये वर्ग संख्या 1 के तत्व हैं। H, Li, Na, K, Rb, Cs तथा Fr वर्ग 1 के तत्व हैं। इन्हें क्षार धातु कहते हैं क्योंकि ये जल के साथ क्रिया करके क्षारीय हाइड्रॉक्साइड बनाते हैं।
→ क्षारीय मृदा धातु-ये वर्ग संख्या 2 के तत्व हैं तथा इन्हें क्षारीय मृदा धातु इसलिए कहा जाता है क्योंकि इनके ऑक्साइड तथा हाइड्रॉक्साइड क्षारीय होते हैं तथा इनके ऑक्साइड भूपर्पटी में पाए जाते हैं। Be, Mg, Ca, Sr, Ba तथा Ra वर्ग 2 के तत्व हैं।
→ इलेक्ट्रॉनिक विन्यास-क्षार धातुओं का ns1 तथा क्षारीय मृदा धातुओं का ns- होता है।
→ प्राप्ति स्रोत-वर्ग 1 के तत्व पादपों की राख में मिलते हैं तथा - वर्ग:2 के तत्व मृदा की ऊपरी परत में पाए जाते हैं।
→ ऑक्सीकरण अवस्था-क्षार धातु +1 तथा क्षारीय मृदा धातु +2 ऑक्सीकरण अवस्था दर्शाते हैं।
→ परमाण्विक त्रिज्या-वर्ग में ऊपर से नीचे जाने पर परमाणु - त्रिज्या बढ़ती है।
→ आयनिक त्रिज्या-परमाणु त्रिज्या के समान आयनिक त्रिज्या भी वर्ग में बढ़ती है।
→ आयनन एन्थैल्पी-परमाणु आकार बढ़ने के कारण वर्ग में ऊपर से नीचे जाने पर आयनन एन्थैल्पी का मान कम होता जाता है।
→ क्रियाशीलता- -s- खण्ड के सभी तत्व क्रियाशील होते हैं। अतः ये स्वतंत्र अवस्था में नहीं पाये जाते हैं।
→ जलयोजन एन्थैल्पी-आयनिक त्रिज्या बढ़ने पर जलयोजन एन्थैल्पी घटती है।

→ विकर्ण संबंध-Li - Mg के साथ तथा Be -Al के साथ गुणों में समानता दिखाते हैं जिसे विकर्ण संबंध कहते हैं।
→ घनत्व-वर्ग 1 में घनत्व का क्रम निम्न प्रकार होता है
Li < Na >K < Rb < Cs
Na का घनत्व K से अधिक होता है।
वर्ग 2 में घनत्व का क्रम निम्न प्रकार होता है
Ca < Mg < Be < Sr < Ba
→ गलनांक-वर्ग में नीचे जाने पर गलनांक का मान कम होता है लेकिन वर्ग 2 में कैल्सियम का गलनांक अपेक्षाकृत अधिक होता है अतः वर्ग 2 में गलनांक का क्रम निम्न प्रकार होता है Be > Ca > Sr > Ba > Mg
→ प्रकाश विद्युत प्रभाव-सीजियम तथा पोटैशियम में प्रकाश विद्युत प्रभाव आसानी से होता है। अतः इनका उपयोग प्रकाश विद्युत सेल में किया जाता है ।
→ ज्वाला को रंग- ये विशिष्ट रंग प्रदान करते हैं ।

किरमिजी लाल सुनहरा पीला बैंगनी लाल बैंगनी नीला Ca, ईंट जैसा लाल रंग, Sr रक्त जैसा लाल तथा Ba हरा-पीला (सेब जैसा हरा) रंग देता है ।
→ s-ब्लॉक के तत्त्वों के मानक इलेक्ट्रॉड विभव के मान उच्च ऋणात्मक होते हैं अतः ये प्रबल अपचायक होते हैं लेकिन लीथियम का अपचायक गुण सर्वाधिक होता है ।
→ s - ब्लॉक के तत्त्व ऑक्सीजन के साथ क्रिया करके विभिन्न प्रकार के ऑक्साइड बनाते हैं, जो कि क्षारीय होते हैं तथा वर्ग में इनका क्षारीय गुण बढ़ता है । लेकिन BeO उभयधर्मी होता है।
→ वर्ग 1 तथा 2 के तत्त्वों की जल से क्रिया द्वारा हाइड्रॉक्साइड बनते हैं तथा ये हाइड्रॉक्साइड क्षारीय होते हैं । इन हाइड्रॉक्साइडों की क्षारीय प्रबलता का क्रम निम्नलिखित है-
- वर्ग -1 LiOH < NaOH < KOH < RbOH < CsOH
- वर्ग -2 Be(OH)2 < Mg(OH)2 < Ca(OH)2 < Sr(OH)2 < Ba(OH)2
वर्ग में हाइड्रॉक्साइडों की जल में विलेयता बढ़ती है ।
→ s ब्लॉक के तत्त्व हाइड्रोजन से क्रिया करके हाइड्राइड बनाते हैं जिनका तापीय स्थायित्व वर्ग में कम होता है ।
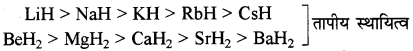
→ इन तत्त्वों की हैलोजनों के साथ क्रिया से हैलाइड बनते हैं जिनका आयनिक गुण वर्ग में बढ़ता जाता है। अतः इनके जल अपघटन की प्रवृत्ति कम होती जाती है 1
→ Li, Be तथा Mg, नाइट्रोजन के साथ क्रिया करके नाइट्राइड बनाते हैं ।
→ Be तथा Mg के अलावा, s-ब्लॉक के अन्य तत्त्व द्रव अमोनिया में विलेय होते हैं तथा यह विलयन रंगीन, विद्युत का सुचालक तथा अनुचुम्बकीय होता है ।
(i) वर्ग में ऊपर से नीचे जाने पर धातु कार्बोनेटों का स्थायित्व बढ़ता है तथा प्रथम वर्ग में तो केवल Li2CO3 का ही विघटन होता है लेकिन द्वितीय वर्ग के कार्बोनेटों को गर्म करने पर ये ऑक्साइड तथा CO2 देते हैं ।
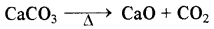
(ii) वर्ग 1 के तत्त्वों के कार्बोनेटों की विलेयता वर्ग में बढ़ती है जबकि वर्ग 2 में इनकी विलेयता कम होती है

→ क्षार धातु नाइट्रेटों को गर्म करने पर ये नाइट्राइट तथा ऑक्सीजन देते हैं लेकिन LiNO3 व क्षारीय मृदा धातुओं के नाइट्रेटों को गर्म करने पर ऑक्साइड, NO2, तथा O2 बनते हैं।
→ वर्ग में नाइट्रेटों की विलेयता बढ़ती है। | 26. क्षार धातु सल्फेटों की विलेयता वर्ग में बढ़ती है लेकिन क्षारीय मृदा धातुओं के सल्फेटों की जल में विलेयता वर्ग में कम होती है।
→ वर्ग 1 के तत्त्वों में लीथियम का व्यवहार असंगत होता है अतः यह अन्य क्षार धातुओं से भिन्नता दर्शाता है लेकिन मैग्नीशियम से समानता दर्शाता है। इसी प्रकार वर्ग 2 के तत्त्वों में बेरिलियम का व्यवहार भी असंगत होता है अत: यह अन्य क्षारीय मृदा धातुओं से भिन्नता दर्शाता है लेकिन ऐलुमिनियम से समानता दर्शाता है।
→ सोडियम के महत्त्वपूर्ण यौगिक निम्नलिखित हैं
- सोडियम कार्बोनेट (धावन सोडा) Na2CO3.10H2O, इसे सॉल्वे विधि द्वारा बनाया जाता है लेकिन इस विधि द्वारा K2CO3 का निर्माण सम्भव नहीं है।
- निर्जल सोडियम कार्बोनेट को सोडा एश कहते हैं।
- सोडियम क्लोराइड (NaCl)-इसे ब्राइन के क्रिस्टलीकरण द्वारा प्राप्त किया जाता है तथा गलित NaCl के विद्युत अपघटन से सोडियम धातु प्राप्त होती
- सोडियम हाइड्रॉक्साइड (कॉस्टिक सोडा) (NaOH) इसका निर्माण, कास्टनर कैलनर सेल में NaCl के जलीय विलयन के विद्युत अपघटन द्वारा किया जाता है।
- सोडियम हाइड्रोजन कार्बोनेट (बेकिंग सोडा) (NaHCO3)
→ कैल्सियम के महत्त्वपूर्ण यौगिक निम्नलिखित हैं
- कैल्सियम ऑक्साइड या बिना बुझा चूना (Cao), इसकी जल से क्रिया द्वारा Ca(OH)2 बनता है, इसे चूने को बुझाना कहते हैं।
- कैल्सियम हाइड्रॉक्साइड (बुझा चूना) Ca(OH)2, इसके जलीय निलम्बन को दूधिया चूना या चूने का दूध कहते हैं तथा इसके स्वच्छ विलयन को चूने का पानी कहते हैं।
- कैल्सियम कार्बोनेट (CaCO3)-यह चूना पत्थर, . संगमरमर (Marble) तथा खड़िया (Chalk) के रूप में पाया जाता है।
- कैल्सियम सल्फेट (CaSO4.2H20)-इसे जिप्सम कहते हैं।
- कैल्सियम सल्फेट अर्ध हाइड्रेट (CaSO4)2. H2O या CaSO4. \frac{1}{2}H2O, इसे प्लास्टर ऑफ पेरिस कहते हैं।

→ सीमेन्ट मुख्यतः डाइकैल्सियम सिलिकेट (Ca2SiO4), ट्राइकैल्सियम सिलिकेट (Ca3SiO5) तथा ट्राइकैल्सियम ऐलुमिनेट का मिश्रण होता है।
→ s-ब्लॉक के तत्त्वों में सोडियम, पोटैशियम, मैग्नीशियम तथा कैल्सियम जैविक महत्त्व के तत्त्व हैं।
