RBSE Class 11 Chemistry Notes Chapter 1 रसायन विज्ञान की कुछ मूल अवधारणाएँ
These comprehensive RBSE Class 11 Chemistry Notes Chapter 1 रसायन विज्ञान की कुछ मूल अवधारणाएँ will give a brief overview of all the concepts.
RBSE Class 11 Chemistry Chapter 1 Notes रसायन विज्ञान की कुछ मूल अवधारणाएँ
→ रसायन विज्ञान का महत्व-रसायन विज्ञान में पदार्थों का संघटन, संरचना, गुणधर्म एवं परिवर्तनों का अध्ययन किया जाता है। पदार्थ ठोस, द्रव तथा गैस अवस्था के रूप में पाए जाते हैं जिनमें घटक कणों की व्यवस्था भिन्न-भिन्न होती है, अतः इनके भौतिक गुण भी भिन्नभिन्न होते हैं।
→ द्रव्य का वर्गीकरण—द्रव्य को तत्वों, यौगिकों तथा मिश्रणों में वर्गीकृत किया जाता है।
→ तत्व-तत्व में सभी कण एक ही प्रकार के होते हैं जो कि अणु या परमाणु होते हैं।
→ यौगिक-दो या दो से अधिक तत्वों के परमाणुओं के निश्चित अनुपात में संयोग से बने अणु यौगिक कहलाते हैं।
→ मिश्रण—दो या अधिक पदार्थों के किसी भी अनुपात में मिलाने पर नया यौगिक नहीं बने तो इसे मिश्रण कहते हैं। मिश्रण दो प्रकार के होते हैं-समांगी तथा विषमांगी।
→ पदार्थों के गुण दो प्रकार के होते हैं-भौतिक गुण तथा रासायनिक गुण।
→ मात्रक तथा राशियाँ द्रव्य के गुणधर्मों को व्यक्त करने के लिए मात्रकों की आवश्यकता होती है जिनमें राशियों को व्यक्त किया जाता है।
→ मापन की पद्धतियाँ—मापन की तीन पद्धतियाँ होती हैं—अंग्रेजी पद्धति, मीटरी पद्धति तथा SI पद्धति। SI पद्धति सर्वमान्य है।
→ द्रव्यमान और भार-किसी पदार्थ का द्रव्यमान उसमें उपस्थित द्रव्य की मात्रा होती है जबकि किसी वस्तु का भार उस पर लगने वाला बल होता है।

→ घनत्व-किसी पदार्थ के प्रति इकाई आयतन के द्रव्यमान को घनत्व कहते हैं।
→ ताप को मापने के लिए तीन प्रकार के पैमाने होते हैं
- °C
- °F
- K
→ ताप के विभिन्न पैमानों के मध्य सम्बन्ध निम्नलिखित हैं
°F = \(\frac{9}{5}\)(°C) + 32
K = °C + 273.15
→ परिशुद्धता तथा यथार्थता-किसी राशि के विभिन्न मापनों की समीपता को परिशुद्धता कहते हैं। जबकि किसी विशिष्ट प्रायोगिक मान की, वास्तविक मान से समानता को उसकी यथार्थता कहते हैं।
→ वैज्ञानिक संकेतन-बहुत बड़ी संख्याओं को एक सरल तरीके से लिखने को वैज्ञानिक संकेतन या चरघातांकी संकेतन कहते हैं । इसमें किसी संख्या को N × 10n के रूप में लिखा जाता है। यहाँ n = चरघातांक तथा N = 1.000 से 9.999 के मध्य कोई संख्या।
→ सार्थक अंक-जब किसी मापन का परिणाम शुद्ध रूप से ज्ञात हो तब उस मापन में अर्थपूर्ण अंकों की संख्या को सार्थक अंक कहते हैं। अनिश्चितता को व्यक्त करने के लिए निश्चित अंकों के साथ अन्तिम अनिश्चित अंक भी लिखते हैं। अत: किसी मापन में सार्थक अंक उन अंकों की संख्या होती है जो निश्चितता के साथ ज्ञात होते हैं तथा उनके साथ एक अनिश्चित अंक हो।
→ विमीय विश्लेषण–विमीय विश्लेषण में मापी गई राशियों को मात्रकों की एक पद्धति से दूसरी पद्धति में परिवर्तित किया जाता है। इसे इकाई गुणक विधि या गुणक लेबल विधि भी कहते हैं।
→ रासायनिक संयोजन के नियम
- द्रव्यमान संरक्षण का नियम-द्रव्य को न तो बनाया जा सकता है और न ही नष्ट किया जा सकता है।
- स्थिर अनुपात का नियम—किसी शुद्ध यौगिक में उपस्थित तत्वों के द्रव्यमानों का अनुपात सदैव स्थिर रहता है; चाहे वह यौगिक किसी भी स्रोत या विधि से प्राप्त हुआ हो।
- गुणित अनुपात का नियम-जब दो तत्व संयोजित होकर एक से अधिक यौगिक बनाते हैं, तो एक तत्व के निश्चित भार के साथ क्रिया करने वाले दूसरे तत्व के द्रव्यमान छोटे पूर्णांकों के अनुपात में होते हैं।
- व्युत्क्रम अनुपात का नियम-जब दो भिन्न-भिन्न तत्त्व, किसी तीसरे तत्त्व के एक निश्चित द्रव्यमान के साथ पृथक्-पृथक् क्रिया करते हैं तो उनके द्रव्यमानों का अनुपात भी समान होता है या उसका सरल गुणक होता है जब वे आपस में क्रिया करते हैं।
- गैलूसैक का गैसीय आयतनों का नियम-समान ताप व दाब पर जब गैसें आपस में अभिक्रिया करती हैं या ये किसी अभिक्रिया द्वारा बनती हैं तो उनके आयतन सरल अनुपात में होते हैं।
→ आवोगाद्रो का नियम-समान ताप तथा दाब पर भिन्न-भिन्न गैसों के समान आयतन में अणुओं की संख्या समान होती है।
→ डाल्टन का परमाणु सिद्धान्त-द्रव्य छोटे-छोटे अविभाज्य कणों से मिलकर बना होता है, जिन्हें परमाणु कहते हैं जो कि रासायनिक अभिक्रिया में भाग लेता है।
→ परमाणु द्रव्यमान-परमाणु द्रव्यमान, कार्बन के 12C समस्थानिक के सापेक्ष व्यक्त किया जाता है। किसी तत्त्व का परमाणु द्रव्यमान उसके सभी समस्थानिकों के परमाणु द्रव्यमान का औसत होता है। किसी तत्त्व का परमाणु द्रव्यमान वह संख्या है जिससे यह ज्ञात होता है कि उस तत्त्व का परमाणु, हाइड्रोजन के एक परमाणु से कितने गुना भारी है।
एक परमाणु द्रव्यमान मात्रक (amu) = 1.66056 × 10-24g
किसी तत्त्व के परमाणु भार को ग्राम में व्यक्त करने पर इसे ग्राम परमाणु भार या ग्राम परमाणु कहते हैं।
→ आण्विक द्रव्यमान-किसी अणु का आण्विक द्रव्यमान उसमें उपस्थित विभिन्न तत्त्वों के परमाणु द्रव्यमानों का योग होता है। किसी पदार्थ का अणुभार वह संख्या है जिससे यह ज्ञात होता है कि उस पदार्थ का एक अणु हाइड्रोजन के एक परमाणु या 12C के एक परमाणु के भार भाग से कितने गुना भारी है।
→ सूत्र द्रव्यमान—वे पदार्थ जिनमें विविक्त (Discrete) अणु नहीं होते, उनमें आण्विक द्रव्यमान के स्थान पर सूत्र द्रव्यमान प्रयुक्त करते हैं, जैसे—Na Cl
→ मोल संकल्पना—किसी पदार्थ का एक मोल उसकी वह मात्रा है, जिसमें उतने ही कण (परणाणु, अणु) उपस्थित होते हैं, जितने C-12 समस्थानिक के 12 ग्राम (0.012 kg) में परमाणुओं की संख्या होती है। प्रत्येक पदार्थ के एक मोल में कणों की संख्या हमेशा समान होती है।
→ आवोगाद्रो संख्या-1 मोल पदार्थ में उपस्थित कणों (परमाणुओं, अणुओं आदि) की संख्या को आवोगाद्रो संख्या (NA) कहते हैं । इसका मान 6.022 × 1023 होता है।
→ मोलर द्रव्यमान—किसी पदार्थ के एक मोल के ग्राम में व्यक्त द्रव्यमान को उसका मोलर द्रव्यमान कहते हैं। पदार्थ का भार (ग्राम में)

→ प्रतिशत संघटन—किसी यौगिक में उपस्थित विभिन्न तत्वों की प्रतिशत मात्रा (भारात्मक) को प्रतिशत संघटन कहते हैं।
→ मूलानुपाती सूत्र–किसी यौगिक में उपस्थित विभिन्न तत्त्वों के परमाणुओं के सरलतम पूर्ण संख्या अनुपात को मूलानुपाती सूत्र कहते हैं।
→ आण्विक सूत्र—किसी यौगिक के एक अणु में उपस्थित विभिन्न प्रकार के परमाणुओं की वास्तविक संख्या को दर्शाने वाले सूत्र को आण्विक सूत्र कहते हैं।

→ स्टॉइकियोमीट्री ( रससमीकरणमिति)-किसी रासायनिक अभिक्रिया के संतुलित समीकरण में उपस्थित विभिन्न अभिकारकों एवं उत्पादों के मध्य अणुओं, मोलों, द्रव्यमानों तथा आयतनों के संदर्भ में मात्रात्मक सम्बन्ध को अभिक्रिया की स्टॉइकियोमीट्री कहते हैं तथा इस समीकरण में प्रयुक्त अंकों को स्टॉइकियोमीट्री गुणांक कहते हैं जो अभिकारकों तथा उत्पादों के मोलों को दर्शाते हैं।
→ सीमान्त अभिकर्मक-किसी अभिक्रिया संतुलित रासायनिक समीकरण के अनुसार आवश्यक अभिकर्मकों में से एक अभिकर्मक आवश्यक मात्रा से कम मात्रा में उपस्थित होता है तो उसके समाप्त होते ही अभिक्रिया रुक जाती है, उसे सीमान्त अभिकर्मक कहते हैं तथा प्राप्त उत्पाद की मात्रा सीमान्त अभिकर्मक की मात्रा के अनुसार ही होती है।
→ विलयन की सान्द्रता-विलयन की सान्द्रता को दो प्रकार के मात्रकों द्वारा व्यक्त किया जाता है-
(a) भार-भार मात्रक
(b) भार-आयतन मात्रक
(a) भार-भार मात्रक
- द्रव्यमान %
- मोल अंश
- मोललता।
(b) भार-आयतन मात्रक
- द्रव्यमान-आयतन %
- मोलरता
- नार्मलता
- फॉर्मलता।
→ भार-भार मात्रक ताप पर निर्भर नहीं करते जबकि भार-आयतन मात्रक ताप पर निर्भर करते हैं।
→ भार-भार मात्रक
(i) द्रव्यमान %-100 g विलयन में घुले हुए विलेय की ग्रामों में मात्रा को द्रव्यमान % कहते हैं।

(ii) मोल अंश-किसी मिश्रण या विलयन में उपस्थित किसी घटक के मोलों की संख्या तथा मिश्रण के कुल मोलों के अनुपात को उस घटक का मोल अंश कहते हैं।
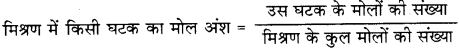
(iii) मोललता-1 kg विलायक में उपस्थित विलेय के मोलों की संख्या को उस विलयन की मोललता कहते हैं।

→ भार-आयतन मात्रक
(i) द्रव्यमान-आयतन % -100 ml विलयन में घुले हुए विलेय के ग्राम में द्रव्यमान को द्रव्यमान-आयतन % कहते हैं।
द्रव्यमान-आयतन % = विलेय की मात्रा (g) x 100 / विलयन का आयतन (ml)
(ii) मोलरता-एक लीटर विलयन में घुले हुए विलेय के मोलों की संख्या को विलयन की मोलरता कहते हैं।
मोलरता = विलेय के मोलों की संख्या/विलयन का आयतन (L)
(iii) नॉर्मलता-विलेय के ग्राम तुल्यांकों की संख्या जो एक लीटर विलयन में घुली होती है उसे विलयन की नार्मलता कहते हैं।नार्मलता = विलेय के ग्राम तुल्यांक/विलयन का आयतन (L)
(iv) फॉर्मलता-एक लीटर विलयन में घुले हुए विलेय के ग्राम सूत्र भारों की संख्या को विलयन की फॉर्मलता कहते हैं।

