RBSE Class 11 Chemistry Important Questions Chapter 5 द्रव्य की अवस्थाएँ
Rajasthan Board RBSE Class 11 Chemistry Important Questions Chapter 5 द्रव्य की अवस्थाएँ Important Questions and Answers.
RBSE Class 11 Chemistry Chapter 5 Important Questions द्रव्य की अवस्थाएँ
बहुचयनात्मक प्रश्न ( Multiple Choice Questions):
प्रश्न 1.
ताप में वृद्धि से निम्न में से द्रव का कौनसा गुण घटता नहीं है?
(अ) श्यानता
(ब) मोलों की संख्या पर
(स) घनत्व
(द) मापन के मात्रक पर
उत्तर:
(द) मापन के मात्रक पर

प्रश्न 2.
गैस नियतांक 'R' निर्भर करता है:
(अ) गैस के ताप पर
(ब) पृष्ठ तनाव
(स) आयतन पर
(द) वाष्प दाब
उत्तर:
(द) वाष्प दाब
प्रश्न 3.
निम्न में से किसका वाष्प दाब अधिकतम है:
(अ) जल
(ब) ग्लिसरॉल
(स) ऐल्कोहॉल
(द) एसिटिक अम्ल
उत्तर:
(स) ऐल्कोहॉल
प्रश्न 4.
आदर्श गैस के लिए संपीड्यता गुणांक का मान है:
(अ) 2.0
(ब) 1.5
(स) 1.0
(द) 0
उत्तर:
(स) 1.0
प्रश्न 5.
द्रव की बूँद गोल होती है:
(अ) श्यानता के कारण
(ब) पृष्ठ तनाव के कारण
(स) वान्डरवाल्स बल के कारण
(द) उपर्युक्त में से कोई नहीं
उत्तर:
(ब) पृष्ठ तनाव के कारण
प्रश्न 6.
वास्तविक गैस किन दशाओं में आदर्श गैस की तरह व्यवहार करती है?
(अ) उच्च ताप, निम्न दाब
(ब) निम्न ताप, उच्च दाब
(स) उच्च ताप, उच्च दाब
(द) निम्न ताप, निम्न दाब
उत्तर:
(अ) उच्च ताप, निम्न दाब
प्रश्न 7.
स्थिर ताप पर यदि गैस का दाब p तथा घनत्व d है तो p तथा d में सम्बन्ध होगा:
(अ) p α d2
(ब) p α d
(स) p α 1/d
(द) p α 1/d2
उत्तर:
(ब) p α d
प्रश्न 8.
मानक ऐन्थैल्पी की गणना निम्न में से किस तापक्रम पर की जाती है?
(अ) 0°C
(ब) 273°C
(स) 273 k
(द) 298 k
उत्तर:
(द) 298 k
प्रश्न 9.
ताप व दाब की समान स्थिति में निम्न में से किस गैस की गतिज ऊर्जा (प्रति मोल) अधिकतम होगी:
(अ) ऑक्सीजन
(ब) मेथेन
(स) हाइड्रोजन
(द) सभी की समान
उत्तर:
(द) सभी की समान
रिक्त स्थान वाले प्रश्न (Fill in the blanks):
प्रश्न 1.
परमाणुओं तथा अणुओं के मध्य आकर्षण और प्रतिकर्षण बलों को ..................... कहते हैं।
उत्तर:
अन्तराआण्विक बल
प्रश्न 2.
ऊष्मीय ऊर्जा के कारण पदार्थ के कणों के गमन को ...................... कहते हैं।
उत्तर:
ऊष्मीय ऊर्जा
प्रश्न 3.
किसी गैस का घनत्व उसके मोलर द्रव्यमान के ....................... होता है।
उत्तर:
समानुपाती

प्रश्न 4.
R का SI मात्रक ......................... है।
उत्तर:
8.314 JK mol-1
प्रश्न 5.
गैसों का अणुगति समीकरण .................. होता है।
उत्तर:
PV = 3 mvr2
प्रश्न 6.
वह गैस, जो दाब व ताप के सभी मानों पर गैस नियमों का पालन करती है, उसे ..................... होता है।
उत्तर:
आदर्श गैस
प्रश्न 7.
किसी द्रव के प्रवाह के प्रति उत्पन्न .................... को श्यानता कहते हैं।
उत्तर:
आन्तरिक प्रतिरोध
प्रश्न 8.
वे द्रव जिनमें हाइड्रोजन बन्ध पाया जाता है, उनकी श्यानता अपेक्षाकृत .................... होती है।
उत्तर:
अधिक।
निम्नलिखित में से सत्य एवं असत्य कथन छाँटिए ( True and False Statement):
प्रश्न 1.
KCl के जलीय विलयन में आयन - द्विध्रुव आकर्षण पाया जाता है।
उत्तर:
सत्य
प्रश्न 2.
Ar, Ne तथा He के क्वथनांक का बढ़ता क्रम Ar < Ne < He होता है।
उत्तर:
असत्य
प्रश्न 3.
आदर्श गैस समीकरण PV = 3/2KT होता है।
उत्तर:
असत्य

प्रश्न 4.
क्वथनांक वह ताप है जिस पर द्रव का वाष्प दाब, वायुमण्डलीय दाब के बराबर होता है।
उत्तर:
सत्य
प्रश्न 5.
स्थिर दाब पर किसी गैस की निश्चित मात्रा का आयतन उसके परम ताप के व्युत्क्रमानुपाती होता है। इसे चार्ल्स का नियम कहते हैं।
उत्तर:
असत्य
प्रश्न 6.
पहाड़ों पर भोजन धीरे पकता है।
उत्तर:
सत्य
प्रश्न 7.
ताप बढ़ाने पर द्रव का पृष्ठ तनाव कम हो जाता है।
उत्तर:
सत्य
प्रश्न 8.
वाष्पीकरण केवल निश्चित ताप पर ही होता है।
उत्तर:
असत्य
मिलान करने वाले प्रश्न (Matching type Questions):
सूची A तथा सूची B का मिलान कीजिए तथा सही कूट (Code) का चयन कीजिए:
प्रश्न 1.
|
सूची A |
सूची B |
|
(1) संपीड्यता गुणांक |
(a) न्यूटन मीटर। |
|
(2) मोलर द्रव्यमान |
(b) Z = PV/nRT |
|
(3) पृष्ठ तनाव का SI मात्रक |
(c) HCl के अणु |
|
(4) द्विध्रुव द्विध्रुव आकर्षण |
(d) M = dRT/p |
उत्तर:
|
सूची A |
सूची B |
|
(1) संपीड्यता गुणांक |
(b) Z = PV/nRT |
|
(2) मोलर द्रव्यमान |
(d) M = dRT/p |
|
(3) पृष्ठ तनाव का SI मात्रक |
(a) न्यूटन मीटर। |
|
(4) द्विध्रुव द्विध्रुव आकर्षण |
(c) HCl के अणु |

प्रश्न 2.
|
सूची A |
सूची B |
|
(1) ग्राहम का विसरण नियम |
(a) 22.4 लीटर |
|
(2) दाब का SI मात्रक |
(b) 3/2RT |
|
(3) गैस के एक अणु की औसत गतिज ऊर्जा |
(c) \(\frac{r_1}{r_2}=\sqrt{\frac{d_2}{d_1}}\) |
|
(4) NIP पर गैस के एक मोल का आयतन |
(d) Pa या Nm-2 |
उत्तर:
|
सूची A |
सूची B |
|
(1) ग्राहम का विसरण नियम |
(c) \(\frac{r_1}{r_2}=\sqrt{\frac{d_2}{d_1}}\) |
|
(2) दाब का SI मात्रक |
(d) Pa या Nm-2 |
|
(3) गैस के एक अणु की औसत गतिज ऊर्जा |
(a) 22.4 लीटर |
|
(4) NIP पर गैस के एक मोल का आयतन |
(b) 3/2RT |
प्रश्न 3.
|
सूची A |
सूची B |
|
(1) 1 Cal. |
(a) PV= स्थिरांक |
|
(2) वान्डरवाल्स बल की ऊर्जा |
(b) N2 |
|
(3) प्रकीर्णन बल का उदाहरण |
(c) 5-50 kJ/mol |
|
(4) बॉयल का नियम |
(d) 4.184 J |
उत्तर:
|
सूची A |
सूची B |
|
(1) 1 Cal. |
(d) 4.184 J |
|
(2) वान्डरवाल्स बल की ऊर्जा |
(c) 5-50 kJ/mol |
|
(3) प्रकीर्णन बल का उदाहरण |
(b) N2 |
|
(4) बॉयल का नियम |
(a) PV = स्थिरांक |
प्रश्न 4.
|
सूची A |
सूची B |
|
(1) चार्ल्स का नियम |
(a) |
|
(2) संयुक्त गैस नियम |
(b) V/T = स्थिरांक |
|
(3) गै-लुसैक का नियम |
\(\text { (c) } \frac{P_1 V_1}{T_1}=\frac{P_2 V_2}{T_2}\) |
|
(4) संपीड्यता गुणांक |
(d) P/T = स्थिरांक |
उत्तर:
|
सूची A |
सूची B |
|
(1) चार्ल्स का नियम |
(b) V/T = स्थिरांक |
|
(2) संयुक्त गैस नियम |
\(\text { (c) } \frac{P_1 V_1}{T_1}=\frac{P_2 V_2}{T_2}\) |
|
(3) गै-लुसैक का नियम |
(d) P/T = स्थिरांक |
|
(4) संपीड्यता गुणांक |
(a) |

प्रश्न 5.
|
सूची A |
सूची B |
|
(1) वाष्प दाब |
(a) ओस्टवाल्ड विस्कोमीटर |
|
(2) पृष्ठ सक्रिय पदार्थ |
(b) CCl4 > H2O |
|
(3) श्यानता गुणांक |
(c)अपमार्जक |
|
(4) श्यानता मापने का यंत्र |
(d) तरलता का व्युत्क्रम |
उत्तर:
|
सूची A |
सूची B |
|
(1) वाष्प दाब |
(b) CCl4 > H2O |
|
(2) पृष्ठ सक्रिय पदार्थ |
(c)अपमार्जक |
|
(3) श्यानता गुणांक |
(d) तरलता का व्युत्क्रम |
|
(4) श्यानता मापने का यंत्र |
(a) ओस्टवाल्ड विस्कोमीटर |
प्रश्न 6.
|
सूची A |
सूची B |
|
(1) श्यानता |
(a) HBr तथा Br2 के मध्य |
|
(2) गैस का औसत वेग |
(b) जल < ग्लिसरीन |
|
(3) मानक क्वथनांक |
(c) \(\bar{v}=\sqrt{\frac{8 R T}{n M}}\) |
|
(4) द्विध्रुव प्रेरित - द्विध्रुव आकर्षण |
(d) एक बार दाब पर किसी द्रव का क्वथनांक |
उत्तर:
|
सूची A |
सूची B |
|
(1) श्यानता |
(b) जल < ग्लिसरीन |
|
(2) गैस का औसत वेग |
(c) \(\bar{v}=\sqrt{\frac{8 R T}{n M}}\) |
|
(3) मानक क्वथनांक |
(d) एक बार दाब पर किसी द्रव का क्वथनांक |
|
(4) द्विध्रुव प्रेरित - द्विध्रुव आकर्षण |
(a) HBr तथा Br2 के मध्य |
अतिलघूत्तरात्मक प्रश्न (Very Short Answer Type Questions):
प्रश्न 1.
NaCl के जलीय विलयन में कौनसा आकर्षण बल पाय जाता है?
उत्तर:
NaCl के जलीय विलयन में आयन - द्विध्रुव आकर्षण पाया जाता है।
प्रश्न 2.
SI मात्रक में R का मान कितना होता है?
उत्तर:
SI मात्रक में R = 8.314 J K-1 mol-1
प्रश्न 3.
ऑक्सीजन के अणुओं के मध्य किस प्रकार का वान्डरवाल्स बल पाया जाता है?
उत्तर:
ऑक्सीजन एक अध्रुवीय अणु है अतः इसके अणुओं के मध्य प्रकीर्णन बल या लंडन बल पाए जाते हैं।

प्रश्न 4.
He, Ne तथा Ar के क्वथनांक का बढ़ता क्रम लिखिए
उत्तर:
He < Ne < Ar ( क्योंकि इनका आकार बढ़ रहा है अतः इनके मध्य वान्डरवाल बल बढ़ता है।)
प्रश्न 5.
HBr तथा Cl2 के अणुओं के मध्य किस प्रकार क वान्डर वाल्स बल होता है?
उत्तर:
HBr तथा Cl2 के अणुओं के मध्य द्विध्रुव-प्रेरितद्विध्रुव आकर्षण पाया जाता है।
प्रश्न 6.
गै-लुसैक नियम, किसमें सम्बन्ध दर्शाता है?
उत्तर:
गै- लुसैक नियम गैस के दाब तथा ताप में सम्बन्ध बतात।
प्रश्न 7.
आदर्श गैस समीकरण लिखिए।
उत्तर:
PV = nRT
प्रश्न 8.
आदर्श गैस किसे कहते हैं?
उत्तर:
वह काल्पनिक गैस जो गैस के सभी नियमों का पूर्ण रूप से पालन करती है, उसे आदर्श गैस कहते हैं। इसमें यह माना जाता है कि अणुओं के मध्य अन्तराअणुक बल नगण्य होते हैं।
प्रश्न 9.
आदर्श गैस के लिए संपीड्यता कारक का सूत्र क्या होता है?
उत्तर:
संपीड्यता कारक (Z) = PV/nRT आदर्श गैसों के लिए 7
= 1 होता है ।
प्रश्न 10.
कमरे के ताप पर He तथा H2 गैस द्रवित नहीं होती है क्यों?
उत्तर:
कमरे के ताप पर He तथा H2 गैस द्रवित नहीं हो सकती क्योंकि इन गैसों का क्रान्तिक ताप, कमरे के ताप से कम होता है।
प्रश्न 11.
ताप बढ़ाने पर द्रवों के वाष्प दाब पर क्या प्रभाव होगा?
उत्तर:
ताप बढ़ाने पर द्रवों का वाष्प दाब बढ़ता है।
प्रश्न 12.
श्यानता गुणांक का सूत्र लिखिए।
उत्तर:
F = nA du/dz
यहाँ n = श्यानता गुणांक।
प्रश्न 13.
ताप बढ़ाने पर द्रव के पृष्ठ तनाव पर क्या प्रभाव पड़ता है?
उत्तर:
ताप बढ़ाने पर द्रव का पृष्ठ तनाव कम हो जाता है।

प्रश्न 14.
वान्डरवाल समीकरण लिखिए।
उत्तर:
एक मोल गैस के लिए वान्डरवाल समीकरण निम्न प्रकार होता है:
(P + a/v2) (V - b) = RT
प्रश्न 15.
वाष्पीकरण तथा क्वथनांक में मुख्य अन्तर बताइए।
उत्तर:
वाष्पीकरण एक धीमा प्रक्रम है जो सभी तापों पर स्वतः होता है जबकि क्वथनांक वह ताप है जिस पर किसी द्रव का वाष्प दाब, बाह्य दाब (वायुमण्डलीय दाब ) के बराबर होता है।
प्रश्न 16.
गैसों का अणु गति समीकरण लिखिए।
उत्तर:
PV = 1/3 mnu2
लघूत्तरात्मक प्रश्न ( Short Answer Type Questions ):
प्रश्न 1.
निम्न को परिभाषित कीजिए:
1. स्थूल गुण
2. अन्तराआण्विक बल।
उत्तर:
- स्थूल गुण - द्रव्य के वे गुण अणुओं, परमाणुओं या आयनों के समूहों से सम्बन्धित होते हैं, उन्हें स्थूल गुण कहते हैं। जैसे - दाब, ताप इत्यादि।
- अन्तराआण्विक बल - अन्योन्य क्रियाकारी कणों (अणुओं तथा परमाणुओं) के मध्य आकर्षण तथा प्रतिकर्षण बलों को अन्तराआण्विक बल कहते हैं। इन्हें वैज्ञानिक के नाम के आधार पर वान्डरवाल बल कहते हैं।
प्रश्न 2.
गैसीय अवस्था के मुख्य भौतिक गुण बताइए।
उत्तर:
गैसीय अवस्था के मुख्य भौतिक गुण निम्नलिखित हैं:
- गैसें अत्यधिक संपीड्य होती हैं।
- गैसें सभी दिशाओं में समान दाब लगाती हैं।
- ठोसों तथा द्रवों की तुलना में गैसों का घनत्व बहुत कम होता है।
- गैसों का आयतन तथा आकृति अनिश्चित होती है तथा इनका आयतन तथा आकृति पात्र के अनुसार ही होती है।
- गैसें प्रत्येक अनुपात में एक-दूसरे में पूर्णत: मिश्रित होती हैं।
- गैस के अणुओं के मध्य आकर्षण बल नगण्य होते हैं।
- गैसों का विसरण तीव्र गति से होता है
प्रश्न 3.
बॉयल के नियम का प्रयोग करते हुए किसी गैस के घनत्व तथा दाब में सम्बन्ध स्थापित कीजिए।
उत्तर:
बॉयल के नियम से गैस के घनत्व तथा दाब में निम्न सम्बन्ध प्राप्त होता है:
चूँकि घनत्व (d) = 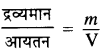
या V = m/d
बॉयल के नियम से PV = k1
V का मान रखने पर
\(P \frac{m}{d}=k_1\)
P अर्थात् स्थिर ताप पर गैस के निश्चित द्रव्यमान का दाब घनत्व के समानुपाती होता है।

प्रश्न 4.
चार्ल्स के नियम को परिभाषित कीजिए तथा इसका गणितीय रूप भी बताइए।
उत्तर:
चार्ल्स का नियम स्थिर दाब पर किसी गैस की निश्चित मात्रा का आयतन उसके परम ताप के समानुपाती होता है।
अर्थात्
V α T
V = k2 T,
V/T = k2 (स्थिरांक)
दो भिन्न-भिन्न आयतन तथा भिन्न-भिन्न तापों के लिए
\(\frac{V_1}{T_1}=\frac{V_2}{T_2}\)
प्रश्न 5.
वायु से भरे गुब्बारे को ऊपर ले जाने पर उसका आकार बड़ा होता जाता है, क्यों?
उत्तर:
बॉयल के नियमानुसार दिए गए ताप पर किसी गैस की निश्चित मात्रा का आयतन उसके दाब के व्युत्क्रमानुपाती होता है। अतः वायु से भरे गुब्बारे को ऊपर उठाने पर उसमें दाब कम हो जाता है जिससे गुब्बारे में भरी वायु (गैसों का मिश्रण) का आयतन बढ़ता जाता है अतः उसका आकार भी बड़ा होता जाता है।
प्रश्न 6.
सार्वत्रिक गैस स्थिरांक या गैस स्थिरांक का मान SI मात्रक में ज्ञात कीजिए।
उत्तर:
आदर्श गैस समीकरण PV = nRT से
R = PV/nT
R का मान P, V तथा T की इकाइयों पर निर्भर करता है। STP पर एक मोल आदर्श गैस के लिए R की गणना इस प्रकार करते हैं:
P = 105 Pa V = 22.71 × 10-3 m3
n = 1 mol
T = 273.15 K
अतः
\(\mathrm{R}=\frac{\left(10^5 \mathrm{~Pa}\right)\left(22.71 \times 10^{-3} \mathrm{~m}^3\right)}{(1 \mathrm{~mol})(273.15 \mathrm{k})}\)
R = 8.314 Pa m3 k - 1 mol-1
= 8.314 Nm± m3 K-1 mol-1 (1 Pa = Nm-2)
= 8.314 Nm K-1 mol-1
= 8.314 J K-1 mol-1 (1 Nm = 1J)
प्रश्न 7.
डाल्टन के आंशिक दाब के नियम को समझाइए।
उत्तर:
डाल्टन का आंशिक दाब का नियम: दो या दो से अधिक अक्रियाशील गैसों के मिश्रण को एक बन्द पात्र में लेने पर मिश्रण का कुल दाब प्रत्येक गैस के आंशिक दाब के योग के बराबर होता है।
गणितीय रूप में
Pकुल = P1 + P2 + P3
(स्थिर ताप व आयतन पर)
P1, P2 तथा P3 गैसों के आंशिक दाब हैं।
प्रश्न 8.
आदर्श गैस समीकरण PV = nRT की व्युत्पत्ति (Derive ) कीजिए।
उत्तर:
बॉयल के नियम से V α 1/P (स्थिर T तथा n पर )
चार्ल्स के नियम से V α T (स्थिर P तथा n पर )
आवोगाद्रो के नियम से V α n (स्थिर P तथा T पर )
अतः V α nt/p
V = R nT/p
अतः
PV = nRT
यह समीकरण किसी गैस की अवस्था को दर्शाता है अतः इसे अवस्था समीकरण भी कहते हैं।
प्रश्न 9.
स्वचालित वाहनों के टायरों में सर्दियों की अपेक्षा गर्मियों में दाब कम रखा जाता है, क्यों?
उत्तर:
गै-लुसैक नियम के अनुसार किसी गैस का दाब, ताप के समानुपाती होता है चूँकि गर्मियों में ताप अधिक होता है अतः स्वचालित वाहनों के टायरों में भी दाब बढ़ जाता है । अतः उच्च दाब पर टायर ट्यूब फट सकता है, इसलिए सर्दियों की अपेक्षा गर्मियों में टायरों का दाब कम रखा जाता है ताकि अधिक ताप पर भी टायर न फटे।
प्रश्न 10.
बहुत कम दाब पर वास्तविक गैस, आदर्श गैस की भाँति व्यवहार करती है, इसे वान्डर-वाल समीकरण से समझाइए।
उत्तर:
वान्डरवाल समीकरण: \(-\left(P+\frac{a}{V^2}\right)\)(V - b) = RT
(n = 1 मोल) में
जब दाब बहुत कम होगा तो आयतन अधिक होगा
अतः b <<< V तो
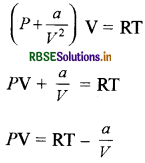
आयतन अधिक होने के कारण,
अत: PV = RT इससे सिद्ध होता है कि बहुत कम दाब पर वास्तविक गैस, आदर्श गैस की भाँति व्यवहार करती है।
प्रश्न 11.
दाब बढ़ाने पर द्रव का क्वथनांक बढ़ जाता है, क्यों?
उत्तर:
किसी द्रव का क्वथनांक वह ताप होता है जिस पर उसका वाष्प दाब, बाह्य, दाब के बराबर हो जाता है। जब दाब बढ़ाते हैं तो, द्रव के वाष्प दाब को इस बाह्य दाब के बराबर करने के लिए अधिक ऊर्जा की आवश्यकता होती है। अर्थात् द्रव को अधिक गर्म करना पड़ता है जिससे उसका क्वथनांक बढ़ जाता है।

प्रश्न 12.
क्रान्तिक स्थिरांकों को परिभाषित कीजिए।
उत्तर:
क्रान्तिक स्थिरांक: क्रान्तिक ताप, क्रान्तिक दाब तथा क्रान्तिक आयतन को सम्मिलित रूप से क्रान्तिक स्थिरांक कहते हैं।
क्रान्तिक ताप (TO): वह अधिकतम ताप जिस पर कोई गैस पर्याप्त दाब लगाने से द्रव अवस्था में परिवर्तित हो जाती है, उसे क्रान्तिक ताप कहते हैं।
क्रान्तिक दाब (PO): किसी गैस को उसके क्रान्तिक ताप पर द्रवित करने के लिए आवश्यक दाब को उस गैस का क्रान्तिक दाब कहते हैं।
क्रान्तिक आयतन (V): क्रान्तिक ताप तथा क्रान्तिक दाब पर किसी गैस के एक मोल का आयतन क्रान्तिक आयतन कहलाता है।
प्रश्न 13.
पहाड़ों पर भोजन धीरे क्यों पकता है तथा शल्य चिकित्सा में प्रयुक्त उपकरणों को ऑटोक्लेव में रोगाणुरहित किया जाता है, क्यों?
उत्तर:
पहाड़ों पर (उच्च उन्नतांश) वायु दाब कम होता है। अतः जल कम ताप पर उबलता है जिससे जल का क्वथनांक कम हो जाता है अतः भोजन धीरे पकता है। इसलिए प्रेशर कुकर का उपयोग करते हैं जिसमें दाब अधिक होने के कारण जल का क्वथनांक बढ़ जाता है।
ऑटोक्लेव पर दाब अधिक होने से जल का क्वथनांक बढ़ जाता है जिससे शल्य चिकित्सा के उपकरण आसानी से रोगाणुरहित हो जाते हैं।
प्रश्न 14.
पृष्ठ तनाव तथा पृष्ठीय ऊर्जा को परिभाषित कीजिए।
उत्तर:
पृष्ठ तनाव (γ): द्रव की सतह पर खींची गई एक रेखा की एकांक लम्बाई पर लगने वाले लम्बवत् बल को पृष्ठ तनाव कहते हैं। इसकी इकाई kgs-2 तथा SI मात्रक में Nm-1 होती है। किसी द्रव का निम्नतम ऊर्जा स्तर तब होता है जब उसका पृष्ठ क्षेत्रफल न्यूनतम हो। किसी द्रव के पृष्ठ क्षेत्रफल में एकांक वृद्धि करने के लिए आवश्यक ऊर्जा को पृष्ठीय ऊर्जा कहते हैं। इसकी इकाई Jm2 होती है।
प्रश्न 15.
पुरानी इमारतों की खिड़कियों के पलड़े के काँच की मोटाई शीर्ष की तुलना में पेंदे में अधिक होती है, क्यों?
उत्तर:
काँच एक अति चिपचिपा द्रव होता है, अत: इसकी श्यानता इतनी अधिक होती है कि इसके गुण ठोसों से मिलते हैं। काँच के प्रवाह गुण के कारण ही पुरानी इमारतों की खिड़कियों के पलड़े के काँच की मोटाई शीर्ष की तुलना में पेंदे पर अधिक होती है।
आंकिक प्रश्न (Numerical Questions):
प्रश्न 1.
27°C पर किसी गैस का आयतन 300 मिली. है। स्थिर दाब पर आयतन को 500 मिली. करने के लिए आवश्यक ताप की गणना कीजिए।
उत्तर:
\(\frac{V_1}{T_1}=\frac{V_2}{T_2}\)
V1 = 300 ml
T1 = 27°C + 273 = 300 K
V2 = 500ml
T2 = ?
\(\mathrm{T}_2=\frac{\mathrm{V}_2 \mathrm{~T}_1}{\mathrm{~V}_1}=\frac{500 \times 300}{300}\)
= 500 K
प्रश्न 2.
298 K ताप तथा 40k Pa दाब पर किसी गैस के 2 m3 आयतन में अणुओं की संख्या ज्ञात कीजिए।
उत्तर:
PV = nRT
n = PV/RT
P = 40k Pa = 40 x 103 Pa V = 2 m3
T = 298 K, R = 8.314 J K - 1 mol-1
\(\mathrm{n}=\frac{\left(40 \times 10^3 \mathrm{~Pa}\right)\left(2 \mathrm{~m}^3\right)}{\left(8.314 \mathrm{JK}^{-1} \mathrm{~mol}^{-1}\right) \times(298 \mathrm{~K})}\)
n = 32.28 mol (1 Pa = 1 J m3)
अणुओं की संख्या = मोल x आवोगाद्रो संख्या
= 32.28 × 6.022 x 1023
= 1.94 × 1025
प्रश्न 3.
300 K पर एक सिलिण्डर में भरी गैस का दाब 10 bar है। यदि सिलिण्डर की दाब को वहन करने की क्षमता 15 bar है तो किस ताप पर यह सिलिण्डर फट जायेगा?
उत्तर:
\(\frac{\mathrm{P}_1}{\mathrm{~T}_1}=\frac{\mathrm{P}_2}{\mathrm{~T}_2}\)
P1 = 10 bar P2 = 15 bar
T1 = 300K
T2 = ?
\(\mathrm{T}_2=\frac{\mathrm{P}_2 \mathrm{~T}_1}{\mathrm{P}_1}=\frac{15 \mathrm{bar} \times 300 \mathrm{~K}}{10 \mathrm{bar}}\)
T2 = 450 K
प्रश्न 4.
0.95 bar दाब तथा 25°C ताप पर नाइट्रोजन की एक निश्चित मात्रा का आयतन 250 cm है तो उस ताप की गणना कीजिए जिस पर इस गैस का आयतन 200 cm3 तथा दाब 1.25 bar हो।
उत्तर:
\(\frac{\mathrm{P}_1 \mathrm{~V}_1}{\mathrm{~T}_1}=\frac{\mathrm{P}_2 \mathrm{~V}_2}{\mathrm{~T}_2}\)
P1 = 0.95 bar,
V1 = 250 cm3
T1 = 25 + 273 = 298 K
P2 = 1.25 bar
V2 = 200 cm3
T2 = ?
अतः
\(\mathrm{T}_2=\frac{\mathrm{P}_2 \mathrm{~V}_2 \mathrm{~T}_1}{\mathrm{P}_1 \mathrm{~V}_1}=\frac{1.25 \times 200 \times 298}{0.95 \times 250}\)
T2 = 313.6 K

प्रश्न 5.
300 K ताप पर एक 10 लीटर आयतन के पात्र में 0.8 g He, 3.2 g O2 तथा 2.8 g N2 भरी हुई है। इस पात्र में उपस्थित गैसीय मिश्रण के कुल दाब की गणना कीजिये। ( R = 0.082 L atm K-1 mol-1 )
उत्तर:
He के मोल = 0.8/4
= 0.20
O2 के मोल = 3.2/3.2
= 0.10
N2 के मोल = 2.8/2.8 = 0.10
PV = nRT के अनुसार
अतः He का आंशिक दाब = \(\frac{0.2 \times 0.082 \times 300}{10}\)
= 0.492 atm
इसी प्रकार का आंशिक दाब = \(\frac{0.1 \times 0.082 \times 300}{10}\)
= 0.246 atm
N2 का आंशिक दाब = \(\frac{0.1 \times 0.082 \times 300}{10}\)
= 0.246
अतः मिश्रण का कुल दाब =
Pe + PO2 + PN2
= 0.492 + 0.246 + 0.246
P = 0.984 atm.
प्रश्न 6.
50ml NH3 20°C ताप तथा 500 mm दाब पर 10 मिनट में एक पात्र से विसरित हो जाती है, ताप व दाब की समान परिस्थिति में मोलर द्रव्यमान 34 वाली किसी अज्ञात गैस के 60ml. को विसरित होने में लगे समय की गणना कीजिए।
उत्तर:
NH3 के विसरण की दर = 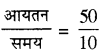
= 5 ml प्रति मिनट
अज्ञात गैस के विसरण की दर = 60/t ml प्रति मिनट

t = 12 × √2
t = 12 × 1.414
t = 16.968 मिनट
प्रश्न 7.
300 K ताप तथा 760 mm Hg दाब पर 500ml आयतन वाली H2 गैस का भार 4.09 x 10-2 g है तो हाइड्रोजन का अणुभार ज्ञात कीजिए।
उत्तर:
हम जानते हैं कि PV = nRT
अतः
n = PV/RT
T = 300K, P = 760Hgmm = 1 atm.
R = 0.082 L atm K-1 mol-1 V = 500ml = 0.5 L
अतः
\(\frac{1 \mathrm{~atm} \times 0.5 \mathrm{~L}}{0.082 \mathrm{~L} \text { atm } \mathrm{K}^{-1} \mathrm{~mol}^{-1} \times 300 \mathrm{~K}}\)
n = 2.03 × 10-2 mol
अतः H2 का भार = मोल मोलर द्रव्यमान
= 2.03 × 10-2 × 2
= 4.06 × 102 g
अतः H2 का अणु भार = \(\frac{4.06 \times 10^{-2}}{2.03 \times 10^{-2}}\)
= 2g
प्रश्न 8.
400 K ताप पर 10 L आयतन के पात्र में 2 मोल गैस उपस्थित है तो गैस के दाब का परिकलन कीजिए, जब यह गैस आदर्श गैस की भाँति व्यवहार करती है।
उत्तर:
हम जानते हैं कि आदर्श गैस समीकरण
PV = nRT
p = nRT/V
n = 2 मोल,
R = 0.082 Latm. K-1 mol-1
T = 400 KV = 10 L
अतः
\(\frac{2 \mathrm{~mol} \times 0.082 \mathrm{~L} \mathrm{~atm}^{-1} \mathrm{~K}^{-1} \mathrm{~mol}^{-1} \times 400 \mathrm{~K}}{10 \mathrm{~L}}\)
P = 6.56 atm
प्रश्न 9.
400K ताप पर O2 गैस का वर्गमाध्य मूल वेग ज्ञात कीजिए।
उत्तर:
\(\mathrm{V}_{\mathrm{rms}}=\sqrt{\frac{3 \mathrm{RT}}{\mathrm{M}}}\)
R = 8.314 × 107 erg K-1mol-1 T = 400K
\(\begin{aligned} & \mathrm{V}_{\mathrm{rms}}=\sqrt{\frac{3 \times 8.314 \times 10^7 \times 400}{32}} \\ & \mathrm{~V}_{\mathrm{rms}}=\sqrt{31.1 \times 10^8} \end{aligned}\)
= 5.57 × 104 cm sec-1
प्रश्न 10.
T K ताप पर CO2 गैस का प्रायिकता वेग 6 x 102 cm sec-1 है तो T की गणना कीजिए।
उत्तर:
प्रायिकता वेग
\(\sqrt{\frac{2 \mathrm{RT}}{\mathrm{M}}}=\sqrt{\frac{2 \times 8.314 \times \mathrm{T}}{44 \times 10^{-3}}}=6 \times 10^2\)
\(\frac{2 \times 8.314 \times \mathrm{T}}{44 \times 10^{-3}}=\left(6 \times 10^2\right)^2\)
\(T=\frac{36 \times 10^4}{377.90}\)
= 952.63 K
विभिन्न प्रतियोगी परीक्षाओं में पछे गये प्रश्न:
प्रश्न 1.
निम्नलिखित में से कौन सबसे कम आण्विक बल को प्रदर्शित करता है?
(a) NH3
(b) HCl
(c) He
(d) H2O
उत्तर:
(c) He

प्रश्न 2.
एक वायु का बुलबुला पानी के नीचे 15°C ताप तथा 1.5 बार दाब पर है। यदि बुलबुला सतह पर आता है जहाँ पर ताप 25°C तथा दाब 1.0 बार है, बुलबुले के आयतन में क्या परिवर्तन होगा:
(a) आयतन 0.70 के गुणांक द्वारा छोटा हो जायेगा
(b) आयतन 2.5 के गुणांक द्वारा बड़ा हो जायेगा
(c) आयतन 1.6 के गुणांक द्वारा बड़ा हो जायेगा
(d) आयतन 1.1 के गुणांक द्वारा बड़ा हो जायेगा
उत्तर:
(c) आयतन 1.6 के गुणांक द्वारा बड़ा हो जायेगा
प्रश्न 3.
एक गैस हीलियम की तुलना में निःसरित होने में तीन गुना समय लेती है, इसका अणु द्रव्यमान होगा:
(a) 27u
(b) 36u
(c) 64u
(d) 9u
उत्तर:
(b) 36u
प्रश्न 4.
गैस के अणुओं में प्रबल प्रतिकर्षण बलों का प्रभाव (Z = संपीडन गुणांक)
(a) Z पर निर्भर करता है और Z = 1 दर्शाता है
(b) Z पर निर्भर करता है और Z > 1 दर्शाता है
(c) Z पर निर्भर करता है और Z < 1 दर्शाता है
(d) Z से स्वतंत्र है
उत्तर:
(c) Z पर निर्भर करता है और Z < 1 दर्शाता है
प्रश्न 5.
जब किसी आदर्श गैस का परमताप दुगुना तथा दाब आधा कर देते हैं तो गैस का आयतन -
(a) दुगुना हो जाएगा
(b) एक चौथाई रह जाएगा
(c) चार गुना हो जाएगा
(d) अपरिवर्तित रहेगा
उत्तर:
(c) चार गुना हो जाएगा
प्रश्न 6.
गैसों के वान्डरवाल समीकरण में स्थिरांक 'b' मापन है:
(a) अन्तर - आण्विक आकर्षण का
(b) अणुओं के धारित आयतन का
(c) अन्तर - आण्विक प्रतिकर्षण का
(d) प्रति इकाई आयतन में अन्तरा - आण्विक संघट्टों का
उत्तर:
(b) अणुओं के धारित आयतन का
प्रश्न 7.
वास्तविक गैसों के लिए संशोधित आदर्श गैस समीकरण में आकर्षण बल के कारण दाब में कमी प्रत्यक्ष रूप से किसके समानुपाती है:
(a) n/V के
(b) nb के
(c) n2/b2 के
(d) n2/v2 के
उत्तर:
(d) n2/v2 के
प्रश्न 8.
एक आदर्श गैस को एक विलगित तंत्र में उत्क्रमणीय और अनुत्क्रमणीय रूप से विस्तारित किया जाता है। यदि T प्रारम्भिक ताप है और T अन्तिम ताप है। निम्न में से कौनसा कथन सत्य है?
(a) (T) अनुत्क्रमणीय > (T)उत्क्रमणीय
(b) Tf > Ti उत्क्रमणीय प्रक्रम के लिए Tf = Ti अनुत्क्रमणीय प्रक्रम के लिए
(c) (Tf)उत्क्रमणीय > (Tf) अनुत्क्रमणीय
(d) Tf = Ti उत्क्रमणीय और अनुत्क्रमणीय दोनों प्रक्रमों के लिए
उत्तर:
(a) (T) अनुत्क्रमणीय > (T)उत्क्रमणीय
प्रश्न 9.
निम्न में से किस मिश्रण में द्विध्रुव - द्विध्रुव आकर्षण होगा?
(a) जल तथा KCl
(b) बेन्जीन तथा एथेनॉल
(c) बेन्जीन तथा कार्बन टेट्राक्लोराइड
(d) ऐसीटोनाइट्राइल (CH3CN) तथा ऐसीटोन (CH3COCH3)
उत्तर:
(d) ऐसीटोनाइट्राइल (CH3CN) तथा ऐसीटोन (CH3COCH3)
प्रश्न 10.
समान तापक्रम पर CO और N2 की औसत मोलर गतिज ऊर्जाओं K.E. के मध्य सम्बन्ध को निम्नलिखित में से किसमें सही प्रदर्शित किया गया है?
\(\text { (a) } \overline{K E}_{C O}=\overline{K E}_{N_2}\)
\(\text { (b) } \overline{K E}_{C O}>\overline{K E}_{N_2}\)
\(\text { (c) } \overline{K E}_{C O}<\overline{K E}_{N_2}\)
(d) जब तक आयतन नहीं दिया जाये यह बताना सम्भव नहीं है
उत्तर:
\(\text { (a) } \overline{K E}_{C O}=\overline{K E}_{N_2}\)
प्रश्न 11.
स्थिर दाब पर किसी गैस के आयतन में वृद्धि होना दर्शाता है:
(a) गैस का दाब बढ़ जाता है।
(b) गतिज ऊर्जा अपरिवर्तित रहती है।
(c) अणुओं की संख्या बढ़ जाती है।
(d) गतिज ऊर्जा कम हो जाती है।
उत्तर:
(b) गतिज ऊर्जा अपरिवर्तित रहती है।
प्रश्न 12.
किसी गैस की आण्विक गति होती है:
(a) ताप के वर्गमूल के व्युत्क्रमानुपाती
(b) परमताप के व्युत्क्रमानुपाती
(c) ताप के वर्ग के अनुक्रमानुपाती
(d) ताप के वर्गमूल के अनुक्रमानुपाती
उत्तर:
(d) ताप के वर्गमूल के अनुक्रमानुपाती

प्रश्न 13.
एक गैस का सूत्र [CO]x पाया गया। यदि इसका वाष्प घनत्व 70 है तो x का मान है:
(a) 2.5
(b) 3.0
(c) 5.0
(d) 6.0
उत्तर:
(c) 5.0
प्रश्न 14.
दिया गया ग्राफ तीन वास्तविक गैसों A, B और C के Z ( संपीडन गुणांक = PV/nRT ) बनाम P के परिवर्तन प्रदर्शित करता है।
केवल गलत कथन की पहचान कीजिए:
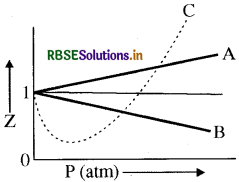
(a) गैस A के लिए a = 0 और इसकी P पर निर्भरता सभी दाबों पर रेखीय है
(b) गैस B के लिए b = 0 और इसकी P पर निर्भरता सभी दाबों पर रेखीय है
(c) गैस C के लिए जो कि एक लाक्षणिक वास्तविक गैस है जिसके न तो a और न ही b = 0, Z = 1, मानकर न्यूनतम और कटाव बिन्दु जानकर a और b की गणना की जा सकती है
(d) उच्च दाब पर सभी वास्तविक गैसों के लिए ढलान धनात्मक होता है
उत्तर:
(b) गैस B के लिए b = 0 और इसकी P पर निर्भरता सभी दाबों पर रेखीय है
प्रश्न 15.
वास्तविक गैस के लिए वाण्डर वाल्स (Vander Waal's) समीकरण में जो पद आकर्षण बल ( attractive force) को संशोधित करता है, वह है:
(a) nb
(b) an2/V2
(c) -an2/V2
(d) - nb
उत्तर:
(b) an2/V2
प्रश्न 16.
जब b = 0 और T = 300K है, तब एक मोल वान्डरवाल्स (Vander Waals) गैस के लिए PV vs 1/V रेखाचित्र नीचे दिखाया गया है। वान्डरवाल स्थिरांक a (atm. liter 2 mol-2) का मान है:
(a) 1.0
(b) 4.5
(c) 1.5
(d) 3.0
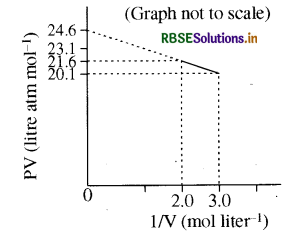
उत्तर:
(c) 1.5
प्रश्न संख्या 17 एवं 18 दिये गये Passage पर आधारित हैं।
Passage
वास्तविक गैसों के अध्ययन की एक महत्त्वपूर्ण पहुँच जिसमें पैरामीटर Z का विश्लेषण शामिल है सम्पीड्यता गुणांक Z \(\frac{\mathrm{PV}_m}{\mathrm{RT}}\) कहलाता है, जहाँ P दाब है, V, मोलर आयतन है, T परम ताप है तथा R सार्वत्रिक गैस स्थिरांक है। अतः इस सम्बन्ध को इस प्रकार भी प्रदर्शित कर सकते हैं - Z = 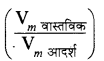 (जहाँ Vm आदर्श तथा Vm वास्तविक क्रमशः गैस के लिए मोलर आयतन है)। अनुरूप गैस के घटक कारण प्रतिकर्षण की Z > 1 कणों के मध्य उनके आकार गुणांक के प्रवृत्ति होती है, जबकि जो गैस Z < 1 के घटक कणों के मध्य आकर्षण बल होता है । जैसे-जैसे दाब कम होता है या ताप अधिक होता है, तब Z का मान 1 तक पहुँच जाता है (आदर्श व्यवहार तक पहुँच जाता है )।
(जहाँ Vm आदर्श तथा Vm वास्तविक क्रमशः गैस के लिए मोलर आयतन है)। अनुरूप गैस के घटक कारण प्रतिकर्षण की Z > 1 कणों के मध्य उनके आकार गुणांक के प्रवृत्ति होती है, जबकि जो गैस Z < 1 के घटक कणों के मध्य आकर्षण बल होता है । जैसे-जैसे दाब कम होता है या ताप अधिक होता है, तब Z का मान 1 तक पहुँच जाता है (आदर्श व्यवहार तक पहुँच जाता है )।
प्रश्न 17.
STP पर वास्तविक गैस 'G' के लिए Z > 1 है तब 'G' के लिए निम्न में से कौनसा कथन सत्य है:
(a) गैस का 1 मोल NTP पर 22.4 L आयतन घेरता है
(b) गैस का 1 मोल STP की तुलना में उच्च दाब पर 22.4 L आयतन घेरता है ( तापमान स्थिर रखते हैं )
(c) गैस का 1 मोल SIP की तुलना में निम्न दाब पर 22.4 L आयतन घेरता है ( तापमान स्थिर रखते हैं )
(d) उपरोक्त में से कोई नहीं
उत्तर:
(b) गैस का 1 मोल STP की तुलना में उच्च दाब पर 22.4 L आयतन घेरता है ( तापमान स्थिर रखते हैं )
प्रश्न 18.
वास्तविक गैस के n मोलों के लिए स्थिर ताप (T) पर दाब (P) व आयतन (V) के सम्बन्ध को निम्न ग्राफ द्वारा दर्शाया गया है । ग्राफ में दो क्षेत्र चिह्न (I) तथा (II) हैं। निम्न में से कौनसा विकल्प सही है:
(a) क्षेत्र (II) में Z < 1
(b) क्षेत्र (II) में Z = 1
(c) वक्र के लिए Z = 1
(d) जब हम क्षेत्र (II) से क्षेत्र (I) में गति करते हैं तब Z का मान 1 तक पहुँच जाता है
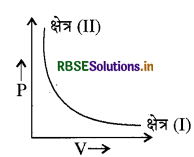
उत्तर:
(d) जब हम क्षेत्र (II) से क्षेत्र (I) में गति करते हैं तब Z का मान 1 तक पहुँच जाता है
प्रश्न 19.
निष्कर्ष को चुनिए जो कि नियमित निरीक्षण के लिए योग्य हो:
|
निरीक्षण |
निष्कर्ष |
|
I. Z = 1 |
I. गैस को आदर्श व्यवहार प्रदर्शित करने की आवश्यकता नहीं होती |
|
II. Z > 1 |
II. दाब लगाने पर गैस का आयतन बढ़ेगा |
|
III. Z < 1 |
III. गैस में द्रवीकृत होने की क्षमता होती है |
|
IV. Z → 1 कम दाब |
IV. गैस आदर्श व्यवहार तक पहुँच जाती है। |
(a) सभी निष्कर्ष सत्य हैं
(b) निष्कर्ष I, II तथा IV सत्य हैं
(c) निष्कर्ष I, III तथा IV सत्य हैं
(d) निष्कर्ष III तथा IV सत्य हैं
उत्तर:
(d) निष्कर्ष III तथा IV सत्य हैं