RBSE Class 11 Chemistry Important Questions Chapter 2 परमाणु की संरचना
Rajasthan Board RBSE Class 11 Chemistry Important Questions Chapter 2 परमाणु की संरचना Important Questions and Answers.
RBSE Class 11 Chemistry Chapter 2 Important Questions परमाणु की संरचना
बहुचयनात्मक प्रश्न (Multiple Choice Questions):
प्रश्न 1.
हाइड्रोजन परमाणु की बोर त्रिज्या का मान है:
(अ) 0.529 × 10-8 m
(ब) 0.529 × 10-10 m
(स) 5.29 × 10-8 m
(द) 5.29 × 10-10 m
उत्तर:
(ब) 0.529 × 10-10 m
प्रश्न 2.
दिगंशी क्वान्टम संख्या निर्धारित करती है:
(अ) चक्रण
(ब) अभिविन्यास
(स) आकार
(द) कक्षकों का कोणीय संवे
उत्तर:
(द) कक्षकों का कोणीय संवे
प्रश्न 3.
आयन जो CO के समइलेक्ट्रॉनीय है:
(अ) O2 ̄
(ब) CN-
(स) N2+
(द) O2+
उत्तर:
(ब) CN-

प्रश्न 4.
रदरफोर्ड परमाणु मॉडल किसका अस्तित्व बताता है:
(अ) नाभिक का
(ब) परमाणु का
(स) a कण का
(द) मेसॉन का
उत्तर:
(अ) नाभिक का
प्रश्न 5.
2px कक्षक में कितने नोडल तल हैं?
(अ) 2
(ब) 1
(स) 4
(द) 3
उत्तर:
(ब) 1
प्रश्न 6.
किसी तत्व का इलेक्ट्रॉनिक विन्यास 1s2 2s2 2p6 3s2 3p6 3d 4s1 दर्शाता है:
(अ) उत्तेजित अवस्था
(ब) धनायन
(स) निम्नतम अवस्था
(द) ऋणायन
उत्तर:
(स) निम्नतम अवस्था
प्रश्न 7.
किसी परमाणु के इलेक्ट्रानिक विन्यास को किससे समझाया जाता है:
(अ) n + 1 नियम
(ब) हुण्ड का नियम
(स) पाउली का अपवर्जन नियम
(द) उपर्युक्त सभी
उत्तर:
(द) उपर्युक्त सभी
प्रश्न 8.
हाइड्रोजन परमाणु की कौनसी श्रेणी का रेखीय स्पेक्ट्रम दृश्य क्षेत्र में होता है?
(अ) लाइमन
(ब) बामर
(स) पाशन
(द) ब्रैक्ट
उत्तर:
(ब) बामर
प्रश्न 9.
किसी कक्ष में इलेक्ट्रॉनों की अधिकतम संख्या होती है:
(अ) n2
(ब) 2n2
(स) 2n
(द) (n+1)
उत्तर:
(ब) 2n2
प्रश्न 10.
बोर परमाणु मॉडल किसको समझाता है?
(अ) हाइड्रोजन अणु
(ब) हाइड्रोजन स्पेक्ट्रम
(स) उस परमाणु या आयन का स्पेक्ट्रम जिसमें एक इलेक्ट्रान होता है
(द) Li+
उत्तर:
(स) उस परमाणु या आयन का स्पेक्ट्रम जिसमें एक इलेक्ट्रान होता है
प्रश्न 11.
निम्नलिखित में से किसमें प्रकाश विद्युत प्रभाव आसानी से होगा?
(अ) Cs
(ब) Na
(स) K
(द) Li
उत्तर:
(अ) Cs
प्रश्न 12.
किसी कक्ष में कक्षकों की संख्या होती है:
(अ) n2
(ब) 2n2
(स) 2l + 1
(द) 2 (2l + 1)
उत्तर:
(अ) n2
प्रश्न 13.
जब l = 3 हो तो m के कुल कितने मान होंगे?
(अ) 3
(ब) 5
(स) 7
(द) 10
उत्तर:
(स) 7
प्रश्न 14.
4s कक्षक में उपस्थित नोडल सतहों की संख्या है:
(अ) 2
(ब) 3
(स) 4
(द) 1
उत्तर:
(ब) 3

प्रश्न 15.
दे ब्रॉग्ली सूत्र है:
\(\text { (अ) } \lambda=\frac{\mathrm{h}}{\mathrm{mv}}\)
\(\text { (ब) } \lambda=\frac{\mathrm{h}}{\mathrm{mc}}\)
\(\text { (स) } \lambda=\frac{\mathrm{h}}{\mathrm{m} \overline{\mathrm{v}}}\)
(द) उपर्युक्त में से कोई नहीं
उत्तर:
\(\text { (ब) } \lambda=\frac{\mathrm{h}}{\mathrm{mc}}\)
प्रश्न 16.
हाइड्रोजन परमाणु का कौनसा इलेक्ट्रॉनीय तल केवल फोटोन का अवशोषण करता है, उत्सर्जन नहीं?
(अ) 2p
(ब) 2s
(स) 1s
(द) 3s
उत्तर:
(स) 1s
प्रश्न 17.
निम्नलिखित में से कौनसी क्वांटम संख्या अन्य क्वांटम संख्याओं पर निर्भर नहीं करती है?
(अ) n
(ब) 1
(स) m
(द) s
उत्तर:
(द) s
प्रश्न 18.
एक इलेक्ट्रॉन युक्त परमाणु में कुल चार ऊर्जा तल हैं तो इसके उत्सर्जन स्पेक्ट्रम में अधिकतम कितनी स्पेक्ट्रम रेखाएँ होंगी?
(अ) 4
(ब) 5
(स) 6
(द) 8
उत्तर:
(स) 6
प्रश्न 19.
d - इलेक्ट्रॉन के लिए कक्षक कोणीय का मान होगा:

उत्तर:
\(\text { (द) } \frac{\sqrt{6 h}}{2 \pi}\)
प्रश्न 20.
K (Z = 19) के संयोजी कोश में उपस्थित इलेक्ट्रॉन के लिए चारों क्वान्टम संख्याओं का सही समुच्चय है:
(अ) n = 4, 1 = 0, m = 0, s = + 1/2
(ब) n = 3, 1 = 0, m = 0, s = - 1/2
(स) n = 4, l = 1, m = + 1/2 s = + 1/2
(द) उपर्युक्त में से कोई नहीं
उत्तर:
(स) 6
रिक्त स्थान वाले प्रश्न (Fill in the blanks):
प्रश्न 1.
6Cl4 तथा N14 आपस में .................. हैं ।
उत्तर:
समभारिक
प्रश्न 2.
हाइड्रोजन स्पेक्ट्रम की पाशन श्रेणी ................ क्षेत्र में होती होता है।
उत्तर:
अवरक्त
प्रश्न 3.
इलेक्ट्रॉन का आवेश ................ होती है।
उत्तर:
1.6 x 10-19 कूलाम

प्रश्न 4.
किसी कोश में कक्षकों की संख्या .................... है।
उत्तर:
n2
प्रश्न 5.
हाइड्रोजन के किसी कोश के सभी उपकोशों की ऊर्जा ...................... होती है।
उत्तर:
समान
प्रश्न 6.
s कक्षक की आकृति ................. होती है।
उत्तर:
गोलाकार
प्रश्न 7.
चक्रण क्वान्टम संख्या का मान ............. होता है।
उत्तर:
+ 1⁄2 या - 1/2
प्रश्न 8.
p कक्षक .................... तीन प्रकार के होते हैं।
उत्तर:
px py
प्रश्न 9.
सामान्यतः s कक्षक के लिए नोडों की संख्या .................... होती है।
उत्तर:
n - 1
प्रश्न 10.
λ = h ............. होता है।
उत्तर:
mv
निम्नलिखित में से सत्य एवं असत्य कथन छाँटिए (True and False Statement):
प्रश्न 1.
इलेक्ट्रॉन का द्रव्यमान 9.1 x 10-31 ग्राम होता है।
उत्तर:
असत्य

प्रश्न 2.
न्यूट्रॉन उदासीन कण होता है।
उत्तर:
सत्य
प्रश्न 3.
हाइड्रोजन स्पेक्ट्रम की लाइमैन श्रेणी दृश्य क्षेत्र में होती है।
उत्तर:
असत्य
प्रश्न 4.
समन्यूट्रानिकों में न्यूट्रॉनों की संख्या समान होती है।
उत्तर:
सत्य
प्रश्न 5.
द्रव्य केवल तरंग गुण दर्शाता है।
उत्तर:
असत्य
प्रश्न 6.
p - कक्षक डम्बलाकार आकृति का होता है।
उत्तर:
सत्य
प्रश्न 7.
किसी कक्षक में इलेक्ट्रॉनों की संख्या = 2n2
उत्तर:
असत्य
प्रश्न 8.
f कक्षक, 4f कक्षक से प्रारम्भ होता है।
उत्तर:
सत्य
प्रश्न 9.
द्विगंशी क्वान्टम संख्या (l) = 0 से (n - 1)
उत्तर:
सत्य
प्रश्न 10.
परमाणु के नाभिक में उपस्थित न्यूट्रॉनों की संख्या को परमाणु संख्या कहते हैं।
उत्तर:
असत्य।
मिलान करने वाले प्रश्न (Matching type Questions):
सूची A तथा सूची B का मिलान कीजिए तथा सही कूट (Code) का चयन कीजिए:
प्रश्न 1.
|
सूची A |
सूची B |
|
(1) तरंग संख्या |
(a) मुख्य क्वान्टम संख्या |
|
(2) बोर कक्ष की त्रिज्या |
(b) 2 |
|
(3) किसी कक्षक में इलेक्ट्रॉनों की अधिकतम संख्या |
(c) 1/λ |
|
(4) K, L, M, N, O.... |
(d) n2/Z x 0.592 A |
उत्तर:
|
सूची A |
सूची B |
|
(1) तरंग संख्या |
(c) 1/λ |
|
(2) बोर कक्ष की त्रिज्या |
(d) n2/Z x 0.592 A |
|
(3) किसी कक्षक में इलेक्ट्रॉनों की अधिकतम संख्या |
(b) 2 |
|
(4) K, L, M, N, O.... |
(a) मुख्य क्वान्टम संख्या |

प्रश्न 2.
|
सूची A |
सूची B |
|
(1) प्लांक का क्वाण्टम सिद्धान्त |
(a) द्विधनावेशित |
|
(2) 3 d के लिए l का मान |
(b) e = h v |
|
(3) Fe2+ में अयुग्मित इलेक्ट्रॉनों की संख्या |
(c) 2 |
|
(4) α - कण पर आवेश |
(d) 4 |
उत्तर:
|
सूची A |
सूची B |
|
(1) प्लांक का क्वाण्टम सिद्धान्त |
(b) e = h v |
|
(2) 3 d के लिए l का मान |
(c) 2 |
|
(3) Fe2+ में अयुग्मित इलेक्ट्रॉनों की संख्या |
(d) 4 |
|
(4) α - कण पर आवेश |
(a) द्विधनावेशित |
प्रश्न 3.
|
सूची A |
सूची B |
| (1) किसी उपकोश में इलेक्ट्रॉनों की अधिकतम संख्या |
(a) हर्ट्ज {Hz} |
| (2) आवृत्ति की इकाई |
(b) 2.88 x 108 Z/n |
| (3) बोर कक्ष में इलेक्ट्रॉन का वेग |
(c) [Ar] 3d10 4s1 |
| (4) Cu का इलेक्ट्रॉनिक विन्यास |
(d) 2(2l + 1) |
उत्तर:
|
सूची A |
सूची B |
| (1) किसी उपकोश में इलेक्ट्रॉनों की अधिकतम संख्या |
(d) 2(2l + 1) |
| (2) आवृत्ति की इकाई |
(a) हर्ट्ज {Hz} |
| (3) बोर कक्ष में इलेक्ट्रॉन का वेग |
(b) 2.88 x 108 Z/n |
| (4) Cu का इलेक्ट्रॉनिक विन्यास |
(c) [Ar] 3d10 4s1 |
प्रश्न 4.
|
सूची A |
सूची B |
|
(1) कक्षकों का अभिविन्यास |
(a) चक्रण क्वाण्टम संख्या |
|
(2) Pd का इलेक्ट्रॉनिक विन्यास |
(b) चुम्बकीय क्वाण्टम संख्या |
|
(3) हाइजेनबर्ग का अनिश्चितता का सिद्धान्त |
(c) [Kr] 4d10 5s0 |
|
(4) क्वाण्टम संख्या जो अन्य क्वाण्टम संख्या पर निर्भर नहीं होती |
(d) ∆x x ∆p = h/4π |
उत्तर:
|
सूची A |
सूची B |
|
(1) कक्षकों का अभिविन्यास |
(b) चुम्बकीय क्वाण्टम संख्या |
|
(2) Pd का इलेक्ट्रॉनिक विन्यास |
(c) [Kr] 4d10 5s0 |
|
(3) हाइजेनबर्ग का अनिश्चितता का सिद्धान्त |
(a) चक्रण क्वाण्टम संख्या |
|
(4) क्वाण्टम संख्या जो अन्य क्वाण्टम संख्या पर निर्भर नहीं होती |
(d) ∆x x ∆p = h/4π |

प्रश्न 5.
|
सूची A |
सूची B |
|
(1) कक्षकों की आकृति |
(a) \(-13.6 \times \frac{Z^2}{n^2} \mathrm{eV}\) |
|
(2) बोर मॉडल का प्रथम अभिगृहीत |
(b) l के कुल मान |
|
(3) बोर कक्ष में इलेक्ट्रॉन की ऊर्जा (En) |
(c) दिगंशीय क्वान्टम संख्या |
|
(4) किसी कोश में उपकोशों की संख्या |
(d) \(m v^2=\frac{\mathrm{Ze}^2}{r}\) |
उत्तर:
|
सूची A |
सूची B |
|
(1) कक्षकों की आकृति |
(c) दिगंशीय क्वान्टम संख्या |
|
(2) बोर मॉडल का प्रथम अभिगृहीत |
(d) \(m v^2=\frac{\mathrm{Ze}^2}{r}\) |
|
(3) बोर कक्ष में इलेक्ट्रॉन की ऊर्जा (En) |
(b) l के कुल मान |
|
(4) किसी कोश में उपकोशों की संख्या |
(a) \(-13.6 \times \frac{Z^2}{n^2} \mathrm{eV}\) |
प्रश्न 6.
|
सूची A |
सूची B |
|
(1) धन किरणें या कैनाल किरणें |
(a) n = A - Z |
|
(2) न्यूट्रॉन की खोज |
(b) समन्यूट्रॉनिक |
|
(3) 3014Si तथा 3115p |
(c) चैडविक |
|
(4) न्यूट्रॉनों की संख्या |
(d) प्रोटॉन |
उत्तर:
|
सूची A |
सूची B |
|
(1) धन किरणें या कैनाल किरणें |
(d) प्रोटॉन |
|
(2) न्यूट्रॉन की खोज |
(c) चैडविक |
|
(3) 3014Si तथा 3115p |
(b) समन्यूट्रॉनिक |
|
(4) न्यूट्रॉनों की संख्या |
(a) n = A - Z |
प्रश्न 7.
|
सूची A |
सूची B |
|
(1) आइन्स्टीन का द्रव्यमान ऊर्जा समीकरण |
(a) KE = ½ mv2 |
|
(2) बामर श्रेणी का तरंगदैर्घ्य |
(b) रेखीय स्पेक्ट्रम |
|
(3) परमाण्वीय स्पेक्ट्रम |
(c) 4000 A - 7000 A |
|
(4) गतिज ऊर्जा |
(d) E = mc2 |
उत्तर:
|
सूची A |
सूची B |
|
(1) आइन्स्टीन का द्रव्यमान ऊर्जा समीकरण |
(d) E = mc2 |
|
(2) बामर श्रेणी का तरंगदैर्घ्य |
(b) रेखीय स्पेक्ट्रम |
|
(3) परमाण्वीय स्पेक्ट्रम |
(c) 4000 A - 7000 A |
|
(4) गतिज ऊर्जा |
(a) KE = ½ mv2 |
प्रश्न 8.
|
सूची A |
सूची B |
|
(1) इलेक्ट्रॉन की शून्य ऊर्जा |
(a) 2s , 2p |
|
(2) दूसरे कोश में उपकोश |
(b) 4 |
|
(3) d उपकोश में इलेक्ट्रॉनों की अधिकतम संख्या |
(c) अनन्त पर |
|
(4) d कक्षक में पालियों की संख्या |
(d) 10 |
उत्तर:
|
सूची A |
सूची B |
|
(1) इलेक्ट्रॉन की शून्य ऊर्जा |
(c) अनन्त पर |
|
(2) दूसरे कोश में उपकोश |
(d) 10 |
|
(3) d उपकोश में इलेक्ट्रॉनों की अधिकतम संख्या |
(a) 2s , 2p |
|
(4) d कक्षक में पालियों की संख्या |
(b) 4 |

प्रश्न 9.
|
सूची A |
सूची B |
|
(1) Px कक्षक के लिए नोडल तल |
(a) 6s, 5p, 4d |
|
(2) नाइट्रोजन में तीन अयुग्मित इलेक्ट्रॉन |
(b) yz |
|
(3) n = 5, l = 2 तथा m = 0 के लिए कक्षक |
(c) हुण्ड का अधिकतम बहुलकता का नियम |
|
(4) n + l = 6 के लिए उपकोश |
(d) 5dz2 |
उत्तर:
|
सूची A |
सूची B |
|
(1) Px कक्षक के लिए नोडल तल |
(b) yz |
|
(2) नाइट्रोजन में तीन अयुग्मित इलेक्ट्रॉन |
(c) हुण्ड का अधिकतम बहुलकता का नियम |
|
(3) n = 5, l = 2 तथा m = 0 के लिए कक्षक |
(d) 5dz2 |
|
(4) n+l = 6 के लिए उपकोश |
(a) 6s, 5p, 4d |
अतिलघूत्तरात्मक प्रश्न (Very Short Answer Type Questions):
प्रश्न 1.
किसी परमाणु में उपस्थित स्थायी मौलिक कणों के नाम लिखिए।
उत्तर:
इलेक्ट्रॉन, प्रोटॉन तथा न्यूट्रॉन।
प्रश्न 2.
प्रोटॉन किसे कहते हैं?
उत्तर:
हाइड्रोजन से प्राप्त धनायन को प्रोटॉन कहते हैं।
प्रश्न 3.
इलेक्ट्रॉन के लिए e/m का मान बताइए।
उत्तर:
इलेक्ट्रॉन के लिए का मान 1.758820 x 1011 कूलाम / किलोग्राम होता है।
प्रश्न 4.
हाइड्रोजन का वह समस्थानिक कौनसा है जिसमें दो न्यूट्रॉन होते हैं?
उत्तर:
ट्राइटियम।
प्रश्न 5.
प्रत्येक का एक उदाहरण बताइए।
(i) 40 18 Ar का समभारिक
(ii) 35Cl का समस्थानिक
उत्तर:
(i) 49K (ii) 17C137
प्रश्न 6.
प्रकाश की तरंग प्रकृति को सिद्ध करने वाली दो घटनाएँ बताइए।
उत्तर:
व्यतिकरण तथा विवर्तन।
प्रश्न 7.
प्लांक के क्वान्टम सिद्धान्त का सम्बन्ध बताइए।
उत्तर:
E = hv
प्रश्न 8.
द्रव्य की द्वैती प्रकृति किस प्रकार के कणों द्वारा दर्शायी जाती है?
उत्तर:
सूक्ष्म कणों जैसे इलेक्ट्रॉन तथा प्रोटॉन द्वारा द्रव्य की द्वैती प्रकृति दर्शायी जाती है।

प्रश्न 9.
बोर कक्ष में इलेक्ट्रॉन का वेग ज्ञात करने के लिए आवश्यक सूत्र लिखिए।
उत्तर:
v = 2.188 × 108 Z/n सेमी सेकण्ड 1
Z = परमाणु क्रमांक, n = कक्ष का मान
प्रश्न 10.
किसी परमाणु में n का मान बढ़ने पर त्रिज्या पर क्या प्रभाव होता है?
उत्तर:
किसी परमाणु में n का मान बढ़ने पर त्रिज्या में वृद्धि होती है।
प्रश्न 11.
इलेक्ट्रॉन की ऊर्जा (ev) ज्ञात करने के लिए आवश्यक सूत्र बताइए।
उत्तर:
इलेक्ट्रॉन की ऊर्जा (En) = - 13.6 x z2/n2 ev प्रति परमाणु
प्रश्न 12.
जब n का अधिकतम मान 4 है रेखाओं की संख्या कितनी होगी?
उत्तर:
स्पेक्ट्रम रेखाओं की अधिकतम संख्या = n(n-1)/2
n = 4
अतः स्पेक्ट्रम रेखाओं की संख्या 4(4-1)/2 = 6
प्रश्न 13.
किसी परमाणु में एक इलेक्ट्रॉन के विभिन्न ऊर्जा स्तरों के बीच की दूरी समान होती है अथवा नहीं।
उत्तर:
किसी परमाणु में एक इलेक्ट्रॉन के विभिन्न ऊर्जा स्तरों के बीच की दूरी समान नहीं होती।
प्रश्न 14.
विद्युत चुम्बकीय विकिरण किसे कहते हैं?
उत्तर:
विद्युत आवेशित कणों को त्वरित करने पर एकान्तर विद्युत एवं चुम्बकीय क्षेत्र उत्पन्न होते हैं जो तरंगों के रूप में संचरित होते हैं। इन्हें विद्युत चुम्बकीय विकिरण कहते हैं।
प्रश्न 15.
1 के किसी मान के लिए m के कितने मान होंगे?
उत्तर:
(2l + 1)
प्रश्न 16.
निम्नलिखित क्वान्टम संख्याओं से संबंधित कक्षक बताइए:
n = 5 l = 3
उत्तर:
5f
प्रश्न 17.
d- कक्षक की आकृति कैसी होती है?
उत्तर:
द्विडम्बेल।
प्रश्न 18.
dx2 - y2 एवं dz2 कक्षकों की आकृतियाँ बनाइए।
उत्तर:

प्रश्न 19.
Fe2+ आयन का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
26Fe = 1s2 2s2 2p6 3s2 3p6 3d6 4s2 अत: Fe2+ = [Ar]3d6
प्रश्न 20.
निम्नलिखित में से कौनसे उपकोश सम्भव हैं? 1p, 2s, 3d, 3f
उत्तर:
2s तथा 3d
प्रश्न 21.
फोटॉन तथा क्वान्टम में क्या अन्तर है?
उत्तर:
ऊर्जा की एक निश्चित मात्रा के पैकेट को क्वान्टम कहा जाता है जबकि फोटॉन केवल प्रकाश से संबंधित ऊर्जा का पैकेट ही होता है।
लघूत्तरात्मक प्रश्न ( Short Answer Type Questions):
प्रश्न 1.
कैनाल किरणों ( धनावेशित कणों) के अभिलक्षण बताइए।
उत्तर:
कैनाल किरणों के अभिलक्षण निम्नलिखित हैं:
- धनावेशित कण, कैथोड किरण नलिका में उपस्थित गैस की प्रकृति पर निर्भर करते हैं तथा ये साधारण धनावेशित गैसीय आयन होते हैं।
- कणों के आवेश और द्रव्यमान का अनुपात उस गैस पर निर्भर करता है, जिससे ये उत्पन्न होते हैं।
- कुछ धनावेशित कणों का विद्युत आवेश मूल इकाई का सरल गुणक होता है।
- चुम्बकीय तथा विद्युत क्षेत्रों में इन कणों का व्यवहार इलेक्ट्रॉन अथवा कैथोड किरण के व्यवहार के विपरीत होता है।
- धन किरणों के प्रत्येक कण का द्रव्यमान विसर्जन नलिका में गैस के परमाणु भार के लगभग समान होता है।
प्रश्न 2.
न्यूट्रॉन की खोज किस प्रकार हुई तथा इसके गुण क्या हैं?
उत्तर:
चैडविक (1932) ने Be पर एल्फा (a) कणों के प्रहार से न्यूट्रॉन की खोज की। यह उदासीन कण होता है जो कि परमाणु नाभिक में पाया जाता है तथा इसका द्रव्यमान प्रोटॉन से कुछ अधिक होता है।
प्रश्न 3.
परमाणु के थॉमसन मॉडल की व्याख्या कीजिए।
उत्तर:
जे. जे. थॉमसन (1898) के अनुसार परमाणु एक समान आवेशित गोला होता है, जिस पर धनावेश समान रूप से वितरित रहता है तथा इसके ऊपर इलेक्ट्रॉन इस प्रकार धँसे रहते हैं कि स्थायी स्थि वैद्युत व्यवस्था प्राप्त हो जाती है। इसे प्लम पुडिंग मॉडल या तरबूज मॉडल भी कहते हैं । इसमें धनावेश को पुडिंग या तरबूज तथा इलेक्ट्रॉन को प्लम या बीज की तरह माना गया है।
प्रश्न 4.
हाइड्रोजन परमाणु में बोर कक्ष की त्रिज्या ज्ञात करने का सूत्र बताइए।
उत्तर:
हाइड्रोजन परमाणु के किसी कक्षा की त्रिज्या:
\(r_n=\frac{n^2 h^2}{4 \pi^2 m e^2}\)
rn = n2 × 0.529 × 10-10 m
rn = n2 x 0.529 A
rn = n2 αo
ao = बोर त्रिज्या = 0.529 A = 52.9 Pm
प्रश्न 5.
निम्नलिखित को परिभाषित कीजिए तथा इनके मात्रक भी बताइए:
(i) आवृत्ति (ii) तरंगदैर्घ्य (iii) तरंग संख्या।
उत्तर:
(i) आवृत्ति (v) - किसी बिन्दु से प्रति सेकण्ड गुजरने वाली तरंगों की संख्या को आवृत्ति कहते हैं। इसका मात्रक हर्ट्स (Hz) या सेकंड-1 (s-1) होता है।(ii) तरंगदैर्घ्य (λ) - किसी तरंग के दो निकटतम शृंगों या गते के बीच की दूरी को तरंगदैर्ध्य कहते हैं। इसका मात्रक meter या cm या A होता है।
(iii) तरंग संख्या (v) प्रति इकाई लम्बाई में स्थित तरंगदैघ्यों की संख्या को तरंग संख्या कहते हैं। v = 1/λ का मात्रक cm-1 होता है।

प्रश्न 6.
प्रकाश विद्युत प्रभाव किसे कहते हैं तथा इसके प्रयोग के परिणाम भी बताइए।
उत्तर:
सक्रिय धातुओं जैसे K, Rb तथा Cs इत्यादि पर उपयुक्त आवृत्ति का प्रकाश डालने पर इनकी सतह से इलेक्ट्रॉनों का निष्कासन प्रकाश विद्युत प्रभाव कहलाता है तथा उत्सर्जित इलेक्ट्रॉनों को प्रकाश इलेक्ट्रॉन कहते हैं।
प्रकाश विद्युत प्रभाव:
- धातु की सतह से प्रकाशपुंज के टकराते ही इलेक्ट्रॉन निकलना प्रारम्भ हो जाते हैं अर्थात् धातु की सतह से इलेक्ट्रॉन के निष्कासन तथा सतह पर प्रकाशपुंज के टकराने के बीच कोई समय-अंतराल नहीं होता है।
- धातु की सतह से निष्कासित इलेक्ट्रॉनों की संख्या प्रकाश की तीव्रता के समानुपाती होती है।
प्रश्न 7.
परमाणु स्पेक्ट्रम सतत न होकर रेखीय होता है, क्यों?
उत्तर:
जब किसी पदार्थ में से सतत विकिरण प्रवाहित किय जाता है तो वह विकिरण की कुछ तरंगदैर्घ्य का अवशोषण कर लेता है इस पदार्थ द्वारा अवशोषित विकिरण की संगत लुप्त तरंगदैर्ध्य चमकीले सतत स्पेक्ट्रम में गहरे रंग की रेखाओं के रूप में दिखाई देते हैं, क्योंकि केवल विशेष तरंगदैघ्य वाला प्रकाश ही उत्सर्जित होता है, जिसके बीच का स्थान रहते हैं । अतः ऐसे स्पेक्ट्रम को रेखीय स्पेक्ट्रम कहते हैं रेखीय स्पेक्ट्रम, गैसीय अवस्था में परमाणुओं द्वारा ही प्रदर्शित किय जाता है अतः इसे परमाण्वीय स्पेक्ट्रम भी कहते हैं।
प्रश्न 8.
हाइड्रोजन के एक परमाणु में केवल एक इलेक्ट्रॉन होता है फिर भी इसके स्पेक्ट्रम में बहुत-सी रेखाएँ दिखाई देती हैं, क्यों?
उत्तर:
हाइड्रोजन का एक परमाणु किसी एक समय पर एक ही उत्तेजित अवस्था में हो सकता है लेकिन स्पेक्ट्रम लेते समय परमाणुओं का एक समूह होता है जिसमें सभी सम्भव उत्तेजित अवस्थाएँ होती हैं अतः जब ये परमाणु निम्न ऊर्जा अवस्था में आते हैं तो उत्सर्जित स्पेक्ट्रम में एक साथ बहुत-सी रेखाएँ दिखाई देती हैं।
प्रश्न 9.
निम्नलिखित में इलेक्ट्रॉनों की अधिकतम संख्या बताइए:
(i) कोश
(ii) M कोश
(iii) उपकोश
(iv) d उपकोश
उत्तर:
(i) किसी कोश में इलेक्ट्रॉनों की अधिकतम संख्या = 2n2
(ii) M कोश के लिए n = 3 अत: इसमें इलेक्ट्रॉनों की अधिकतम संख्या = 2n2 = 2 (3)2 = 18
(iii) किसी उपकोश में इलेक्ट्रॉनों की अधिकतम संख्या = 2 (2l + 1)
(iv) d उपकोश के लिए l = 2, अतः इसमें इलेक्ट्रॉनों की अधिकतम संख्या
= 2(2l + 1) = 2 ( 2 x 2 + 1) = 10
प्रश्न 10.
नोडल पृष्ठ किसे कहते हैं तथा 4s कक्षक के लिए नोडल पृष्ठों की संख्या कितनी होगी?
उत्तर:
वह क्षेत्र जहाँ पर इलेक्ट्रॉन प्रायिकता घनत्व शून्य होता है अर्थात् नाभिक के चारों ओर का वह स्थान जहाँ पर इलेक्ट्रॉन के पाए जाने की प्रायिकता लगभग शून्य होती है उसे नोडल पृष्ठ या त्रिज्य नोड कहते हैं । s कक्षक के लिए नोडल पृष्ठ = n - 1, अत: 4s के लिए 3 नोडल पृष्ठ होंगे।
प्रश्न 11.
निम्नलिखित तत्त्वों के इलेक्ट्रॉनिक विन्यास लिखिए:
(i) 29Cu
(ii) 42Mo
(iii) 46Pd
(iv) 47Ag
(v) 78 Pt
(vi) 79Au
उत्तर:
(i) 29Cu = [Ar] 3d104s1
(ii) 42Mo = [Kr] 4d10 5s1
(iii) 46Pd = [Kr] 4d10 5s0
(iv) 47Ag = [Kr] 4d105s1
(v) 78Pt = [Xe] 4f14 5d9 6s1
(vi) 79Au = [Xe] 4f14 5d10 6s1
प्रश्न 12.
चुम्बकीय क्वान्टम संख्या की व्याख्या कीजिए।
उत्तर:
चुम्बकीय क्वान्टम संख्या (m):
(i) यह कक्षक के बारे में बताती है।
(ii) इससे कक्षकों का त्रिविमीय अभिविन्यास ज्ञात होता है।
(iii) किसी उपकोश में कक्षकों की संख्या = 21 + 1
सम्भव मान
(iv) m1 = -1, - (1 - 1),(1 − 2), ........... 0 ............ 0 (1 - 1) - (1 − 2),
(v) l = 0 ( s) m 1 = 0, एक s कक्षक
l = 1(p) m1 = -1, 0, +1, तीन p कक्षक
l = 2 (d) m1 = -2, -1, 0, +1, +2, पाँच d कक्षक
l = 3 (f) m = -3, -2, -1, 0, +1, +2, +3, सात कक्षक
प्रश्न 13.
(a) किसी गतिमान कण का वेग दो गुना करने पर उसके तरंगदैर्घ्य पर क्या प्रभाव होगा?
(b) किसी कक्षक में उपस्थित दो इलेक्ट्रॉनों का चक्रण विपरीत होता है, क्यों?
उत्तर:
(a) वेग को दो गुना करने पर तरंगदैर्घ्य आधा हो जाएगा
क्योंकि λ = h/mv तथा h/mv स्थिर है
(b) किसी कक्षक में उपस्थित दो इलेक्ट्रॉनों का चक्रण विपरीत होने पर उनमें प्रतिकर्षण कम होता है।
प्रश्न 14.
(a) एक घूमती हुई क्रिकेट की बॉल में तरंग प्रकृति नहीं होती, क्यों ?
(b) गर्मियों के दिनों में काले कपड़े नहीं पहनने चाहिए, क्यों ?
उत्तर:
(a) सूत्र λ = h/mv के अनुसार अधिक द्रव्यमान युक्त वस्तु, जैसे क्रिकेट की बॉल आदि का तरंगदैर्घ्य इतना कम होता है कि उसका आसानी से मापन सम्भव नहीं है। अतः घूमती हुई क्रिकेट की बॉल में तरंग प्रकृति नहीं होती।
(b) काले कपड़े कृष्णिका की तरह व्यवहार करते हैं अतः ये सूर्य से प्राप्त विकिरणों का अवशोषण करके गर्मी उत्पन्न करते हैं इसलिए गर्मियों में काले कपड़े नहीं पहनने चाहिए।

प्रश्न 15.
विद्युत चुम्बकीय तरंग तथा द्रव्य तरंग में विभेद कीजिए।
उत्तर:
पदार्थ तरंगें अनुदैर्ध्य, अनुप्रस्थ या सतही तरंगें हो सकती हैं जबकि विद्युत चुम्बकीय तरंगें केवल अनुप्रस्थ होती हैं । अधिकांश पदार्थ तरंगों में ऊर्जा संचारित करने वाले कण परमाणु होते हैं, जबकि विद्युत चुम्बकीय में ऊर्जा संचारित करने वाले कण फोटॉन (जो द्रव्यमान रहित होते हैं) होते हैं।
प्रश्न 16.
श्रोडिन्जर समीकरण की व्याख्या कीजिए।
उत्तर:
श्रोडिन्जर समीकरण (Schrodinger Equation): यह समीकरण दे ब्रॉग्ली द्वारा बताए गए पदार्थ के कण तथा तरंग गुण युक्त द्वैत प्रकृति के आधार पर दिया गया है। ऐसे निकाय (जैसे-एक परमाणु या अणु) जिसकी ऊर्जा समय के साथ परिवर्तित नहीं होती है, के लिए श्रोडिंजर समीकरण को इस प्रकार लिखा जाता है:
\(\widehat{\mathrm{H}} \psi=\mathrm{E} \psi\)
प्रश्न 17.
हाइजेनबर्ग का अनिश्चितता का सिद्धान्त क्या है? समझाइए।
उत्तर:
द्रव्य तथा विकिरण की द्वैत प्रकृति के कारण यह सिद्धान्त दिया गया। हाइजेनबर्ग ( 1927 ) के अनुसार परमाणु में किसी इलेक्ट्रॉन की सही स्थिति और सही संवेग ( अथवा वेग ) का एक साथ यथार्थता के साथ निर्धारण करना असम्भव है।
गणितीय रूप में:
\(\begin{array}{r} \Delta \mathrm{x} \times \Delta p \geq \frac{h}{4 \pi} \\ \Delta \mathrm{x} \times \mathrm{m} \Delta \mathrm{v} \geq \frac{\mathrm{h}}{4 \pi} \\ \Delta \mathrm{x} \times \Delta \mathrm{v} \geq \frac{h}{4 \pi \mathrm{m}} \end{array}\)
प्रश्न 18.
किसी तत्त्व का रेखीय स्पेक्ट्रम उस तत्व का फिंगर प्रिन्ट कहलाता है, इस कथन को समझाइए।
उत्तर:
प्रत्येक तत्त्व का अपना एक विशेष रेखीय स्पेक्ट्रम होता है अतः इससे अज्ञात परमाणुओं को पहचानने में उसी प्रकार प्रयुक्त किया जाता है जिस प्रकार फिंगर प्रिन्ट से व्यक्ति की पहचान की जाती है अतः रेखीय स्पेक्ट्रम को उस तत्त्व का फिंगर प्रिन्ट कहा जाता है।
प्रश्न 19.
(a) यदि एक गतिशील प्रोटॉन तथा इलेक्ट्रॉन के तरंगदैर्घ्य समान हैं तो किसका वेग अधिक होगा तथा क्यों ?
(b) हाइजेनबर्ग के अनिश्चितता के सिद्धान्त का हमारे दैनिक जीवन में कोई महत्त्व नहीं है, क्यों ?
उत्तर:
(a) सूत्र λ = h/mv के अनुसार जब À तथा h स्थिर हैं तो वेग, द्रव्यमान के व्युत्क्रमानुपाती होगा, चूँकि इलेक्ट्रॉन का द्रव्यमान, प्रोटॉन के द्रव्यमान से कम होता है अतः इसका वेग अधिक होगा।
(b) हमारे दैनिक जीवन में उच्च तथा मध्यम द्रव्यमान युक्त गतिशील वस्तुओं का ही प्रयोग होता है, चूँकि प्रकाश के टक्कर करने वाले फोटॉनों का द्रव्यमान इतना कम होता है कि ये इन वस्तुओं की स्थिति में कोई विशेष परिवर्तन नहीं कर पाते हैं अतः इन वस्तुओं की सही स्थिति तथा सही संवेग का एक साथ मापन संभव है इसलिए दैनिक जीवन में अनिश्चितता के सिद्धान्त का कोई महत्त्व नहीं है।
प्रश्न 20.
(a) एक ऐसा तत्त्व बताइए जिसमें s इलेक्ट्रॉनों की संख्या p- इलेक्ट्रॉनों की संख्या के बराबर है।
(b) 1s तथा 2s कक्षकों में त्रिज्य नोडों की संख्या बताइए।
उत्तर:
(a) मैग्नीशियम में s तथा p इलेक्ट्रॉनों की संख्या बराबर
12Mg = 1s2, 2s2, 2p6, 3s2 (s इलेक्ट्रॉन = 6, p इलेक्ट्रॉन = 6)
(b) त्रिज्य नोडों की संख्या n = 1 अतः 1s तथा 2s कक्षकों में त्रिज्य नोडों की संख्या शून्य तथा
प्रश्न 21.
(a) यदि 3p उपकोश में केवल एक इलेक्ट्रॉन है तो यह इलेक्ट्रॉन 3px 3py तथा 3pz कक्षकों में से किसमें उपस्थित होगा?
(b) निम्नलिखित को प्रदर्शित करने वाली क्वान्टम संख्याएँ कौनसी है।
(i) कक्षकों का आकार
(ii) कक्षकों की आकृति
(iii) कक्षकों का अभिविन्यास
(c) किसी तत्त्व की द्रव्यमान संख्या उसकी परमाणु संख्या की दुगुनी है तथा इसके 2p उपकोश में चार इलेक्ट्रॉन हैं तो इस तत्त्व का नाम तथा इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
(a) 3p उपकोश में उपस्थित एक इलेक्ट्रॉन 3px 3py तथा 3p2 कक्षकों में से किसी में भी उपस्थित हो सकता है क्योंकि इन सभी कक्षकों की ऊर्जा समान है।
(b) (i) मुख्य क्वान्टम संख्या
(ii) द्विगंशीय क्वान्टम संख्या
(iii) चुम्बकीय क्वान्टम संख्या
(c) यह तत्त्व ऑक्सीजन है जिसकी द्रव्यमान संख्या (16) परमाणु संख्या (8) की दुगनी है। इसका इलेक्ट्रॉनिक विन्यास निम्नलिखित है- 80 = 1s2, 2s2, 2p4 जिसके 2p उपकोश में चार इलेक्ट्रॉन हैं।
आंकिक प्रश्न (Numerical Questions):
प्रश्न 1.
एक फोटोन की तरंगदैर्ध्य ज्ञात कीजिए जिसकी ऊर्जा 1 ev है।
उत्तर:
ऊर्जा (E) = hv = hc /λ
ऊर्जा, E = 1 ev = 1.6 x 10-19 J
\(\text { अत: } \lambda=\frac{\mathrm{hc}}{\mathrm{E}}=\frac{6.62 \times 10^{-34} \mathrm{Js} \times 3 \times 10^8 \mathrm{~ms}^{-1}}{1.6 \times 10^{-19} \mathrm{~J}}\)
λ = 12.41 × 10-7m
λ = 12.41 × 10-7 x. 1010 Å
λ = 12.41 × 103Å
प्रश्न 2.
किसी विकिरण की आवृत्ति 4 x 10 10s - 1 है तो इसके एक मोल फोटॉनों की ऊर्जा ज्ञात कीजिए।
उत्तर:
एक फोटॉन की ऊर्जा (E) = hv
= 6.62 × 10-34Js × 4 × 100s-1
= 26.48 × 10-24 J
एक मोल फोटॉनों की ऊर्जा = एक x फोटॉन की ऊर्जा आवोगाद्रो संख्या
= 26.48 × 10-24J x 6.022 x 1023
= 15.94J
प्रश्न 3.
हाइड्रोजन परमाणु में जब इलेक्ट्रॉन n = 1 से n = 2 में गमन करता है तो आवश्यक ऊर्जा (ev) कितनी होगी?
उत्तर:
ऊर्जा E = -13.6 \(\frac{\mathrm{z}^2}{\mathrm{n}^2} \mathrm{ev}\)
Z = 1
प्रथम कक्ष की ऊर्जा (E1) = \(\frac{-13.6 \times 1^2}{1^2}=-13.6 \mathrm{ev}\)
द्वितीय कक्ष की ऊर्जा (E2) = \(\frac{-13.6 \times 1^2}{2^2}\)
= - 3.4ev
अतः E2 - E1 = - 3.4 (-13.6 ) ev
= 10.2 ev

प्रश्न 4.
हाइड्रोजन परमाणु में जब इलेक्ट्रॉन प्रथम कक्ष से तृतीय कक्ष में गमन करता है तो आवश्यक ऊर्जा की आवृत्ति ज्ञात कीजिए।
उत्तर:
आवृत्ति (v) = 3.29 × 1015\(\left[\frac{1}{\mathrm{n}_{\mathrm{i}}^2}-\frac{1}{\mathrm{n}_{\mathrm{f}}^2}\right] \mathrm{Hz}\)
\(v=3.29 \times 10^{15}\left[\frac{1}{1^2}-\frac{1}{3^2}\right]\)
v = 3,29 × 1015 x 8/9
v = 2.9244 × 1015Hz.
प्रश्न 5.
हाइड्रोजन के प्रथम कक्ष से सम्बन्धित ऊर्जा का मान - 13.6 ev / परमाणु है तो तीसरे कक्ष से सम्बन्धित ऊर्जा ज्ञात कीजिए।
उत्तर:
परमाणु में किसी कक्ष की ऊर्जा (En)
\(\mathrm{E}_{\mathrm{n}}=\frac{\mathrm{E}_1}{n^2}\)
E1 = प्रथम कक्ष की ऊर्जा तथा n = कक्ष का मान
\(\therefore \quad \mathrm{E}_3=\frac{-13.6}{3^2}\)
= - 1.51 ev.
प्रश्न 6.
एक इलेक्ट्रॉन के वेग में अनिश्चितता 6 x 10 ms-1 है तो इसकी स्थिति में अनिश्चितता ज्ञात कीजिए।
उत्तर:
Δx x Δρ = h /4π
इलेक्ट्रॉन का द्रव्यमान (m) = 9.1 x 10-31 kg
h = 6.62 × 10-34 kg m2s-1
तथा Δv = 6 × 105 ms
अतः इलेक्ट्रॉनों की स्थिति में अनिश्चितता
\(\begin{gathered} \Delta x=\frac{\mathrm{h}}{4 \pi \Delta \mathrm{p}}=\frac{\mathrm{h}}{4 \pi \mathrm{m} \Delta \mathrm{v}} \\ =\frac{6.62 \times 10^{-34} \mathrm{~kg} \mathrm{~m}^2 \mathrm{~s}^{-1}}{4 \times 3.14 \times 9.1 \times 10^{-31} \mathrm{~kg} \times 6 \times 10^5 \mathrm{~ms}^{-1}} \end{gathered}\)
Δx = 9.6 ×10-11 m
विभिन्न प्रतियोगी परीक्षाओं में पछे गये प्रश्न:
प्रश्न 1.
Be2+ आयन किसके साथ समइलेक्ट्रॉनिक है:
(a) Mg 2+
(b) Na+
(c) Li+
(d) H+
उत्तर:
(c) Li+
प्रश्न 2.
कौनसा कथन असत्य है:
(a) ∆E × ∆t ≥ h/4r अनिश्चितता सिद्धान्त है ।
(b) ज्यामिति, संतुलित व्यवस्था और अधिक विनिमय ऊर्जा के कारण अर्धपूरित व पूर्णपूरित कक्षकों का स्थायित्व बढ़ जाता है।
(c) हाइड्रोजन जैसे परमाणु के लिए 2s कक्षक की ऊर्जा 2p कक्षक की ऊर्जा से कम होती है।
(d) डी- ब्रोग्ली तरंगदैर्ध्य λ = h/mv से दर्शायी जाती है। जहाँ m = कण का द्रव्यमान, = कण का सामूहिक वेग।
उत्तर:
(c) हाइड्रोजन जैसे परमाणु के लिए 2s कक्षक की ऊर्जा 2p कक्षक की ऊर्जा से कम होती है।
प्रश्न 3.
एक परमाणु के चौथे ऊर्जा स्तर में परमाणु ऑर्बिटलों की कुल संख्या है:
(a) 4
(b) 8
(c) 16
(d) 32
उत्तर:
(c) 16
प्रश्न 4.
नोडल पृष्ठ पर इलेक्ट्रॉन के होने की प्रायिकता होती है:
(a) एक
(b) कम
(c) अधिक
(d) शून्य
उत्तर:
(d) शून्य
प्रश्न 5.
हाइड्रोजन परमाणु की त्रिज्या 0.53 है। 3Li2+ की त्रिज्या है:
(a) 1.27 Å
(b) 0.17 Å
(c) 0.57 A
(d) 0.99 Å
उत्तर:
(b) 0.17 Å
प्रश्न 6.
हाइड्रोजन परमाणु की आयनन एन्थैल्पी 1.312 × 10° J mol-1 है। इस परमाणु में इलेक्ट्रॉन को n = 1 से n = 2 में उत्तेजित करने के लिए आवश्यक ऊर्जा है:
(a) 6.56 × 10o J mol-1
(b) 7.56 × 105 J mol-1
(c) 9.84 × 10o J mol-1
(d) 8.51 × 105 J mol-1
उत्तर:
(c) 9.84 × 10o J mol-1

प्रश्न 7.
समीकरण, E = - 2.178 × 10-18 J (Z2/n2) निष्कर्ष लिखे हैं, इनमें से कौनसा सही नहीं है:
(a) n = 1 के लिए इलेक्ट्रॉन की अधिक ऋणात्मक ऊर्जा होगी, n = 6 से। इससे पता चलता है कि सबसे छोटे अनुमत कक्ष में अधिक ढिलाई से बंधे इलेक्ट्रॉन होंगे।
(b) समीकरण में ऋणात्मक चिह्न दिखाता है कि जो इलेक्ट्रॉन न्यूक्लिअस से आबंध है उसकी ऊर्जा कम होगी उन इलेक्ट्रॉनों से जो न्यूक्लिअस से अनंत दूरी पर हों।
(c) जितना n का मान बृहत्तर (larger ) होगा उतनी कक्ष की त्रिज्या बृहत्तर होगी।
(d) इस समीकरण को प्रयोग करके ऊर्जा का अन्तर निकालते हैं जब इलेक्ट्रॉन कक्ष बदलता है।
उत्तर:
(a) n = 1 के लिए इलेक्ट्रॉन की अधिक ऋणात्मक ऊर्जा होगी, n = 6 से। इससे पता चलता है कि सबसे छोटे अनुमत कक्ष में अधिक ढिलाई से बंधे इलेक्ट्रॉन होंगे।
प्रश्न 8.
बोर के परमाणु मॉडल के अनुसार 5वें कोश में उपस्थित इलेक्ट्रॉन का कोणीय संवेग होगा:
(a) 10h/π
(b) 5h/π
(c) 2.5h /π
(d) 2h/π
उत्तर:
(c) 2.5h /π
प्रश्न 9.
निम्नलिखित व्यंजकों में कौन डी - ब्रोग्ली है:
(a) h = λ /mv
(b) λ = h/mv
(c) λ = m/hv
(d) λ = v/mh
उत्तर:
(b) λ = h/mv
प्रश्न 10.
cu+ की मूल अवस्था में पूर्ण भरे कक्षों, उपकक्षों, कक्षकों तथा अयुग्मित इलेक्ट्रॉनों की संख्या क्रमश: है:
(a) 3, 6, 15, 1
(b) 4, 8, 15, 0
(c) 3, 6, 14, 0
(d) 4, 7, 14, 2
उत्तर:
(c) 3, 6, 14, 0
प्रश्न 11.
कौनसी क्वांटम संख्या श्रोडिन्जर समीकरण से सम्बन्धित नहीं है:
(a) मुख्य
(b) द्विगंशी
(c) चुम्बकीय
(d) चक्रण
उत्तर:
(d) चक्रण
प्रश्न 12.
गैडोलीनियम (परमाणु क्रमांक 64 ) का इलेक्ट्रॉनिक विन्यास होगा:
(a) [Xe]4f8 5d9 6s2
(b) [Xe]4f7 5d1 6s2
(c) [Xe]4f3 5d5 6s2
(d) [Xe]4f6 5d2 6s2
उत्तर:
(b) [Xe]4f7 5d1 6s2
प्रश्न 13.
निम्न क्वाण्टम संख्या के लिए अधिकतम अभिनिर्धारित कक्षकों की संख्या क्या होगी?
n = 3, 1 = 1, m = 0
(a) 3
(b) 4
(c) 1
(d) 2
उत्तर:
(d) 2
प्रश्न 14.
पाँच d कक्षकों (dxy4 dyz dzx dx2-y2 तथा 12) के लिए निम्नलिखित में से कौनसा कथन सत्य है?
(a) सभी d कक्षकों की आकृति भिन्न होती है
(b) सभी d कक्षकों की आकृति समान होती है।
(c) प्रथम तीन d कक्षकों की आकृति समान परन्तु अन्तिम दो d कक्षकों की आकृति भिन्न होती है।
(d) प्रथम चार d कक्षकों की आकृति समान लेकिन अन्तिम d कक्षक की आकृति भिन्न होती है।
उत्तर:
(d) प्रथम चार d कक्षकों की आकृति समान लेकिन अन्तिम d कक्षक की आकृति भिन्न होती है।
प्रश्न 15.
नाइट्रोजन परमाणु में तीन अयुग्मित इलेक्ट्रॉन की उपस्थिति का स्पष्टीकरण दिया जा सकता है:
(a) पाउली अपवर्जन सिद्धान्त से
(b) हुण्ड के नियम से
(c) आफबाऊ सिद्धान्त से
(d) अनिश्चितता के सिद्धान्त से
उत्तर:
(b) हुण्ड के नियम से
प्रश्न 16.
इलेक्ट्रॉन पहले उस कक्षा में प्रवेश करते हैं जिसके लिए (n + 1) का मान न्यूनतम है। यह प्रतिपादित होता है:
(a) हुण्ड के नियम के रूप में
(b) आफबाऊ के सिद्धान्त के रूप में
(c) हाइजेनबर्ग के अनिश्चितता सिद्धान्त के रूप में
(d) पाउली के अपवर्जन नियम के रूप में
उत्तर:
(b) आफबाऊ के सिद्धान्त के रूप में

प्रश्न 17.
प्लांक नियतांक का मान 6.63 x 10-34 Js है और प्रकाश का वेग 3.0 × 108 ms-1 है। 8 x 1015 s-1 आवृत्ति वाले प्रकाश की तरंगदैर्ध्य (नैनोमीटर में) का मान सबसे करीब होगा:
(a) 3 × 107
(b) 2 x 10-25
(c) 5 × 10-18
(d) 4 x 101
उत्तर:
(d) 4 x 101
प्रश्न 18.
एक p - इलेक्ट्रॉन का कक्षक कोणीय संवेग इस प्रकार दिया जाता है:

उत्तर:
\(\text { (a) } \frac{h}{\sqrt{2} \pi}\)
प्रश्न 19.
निम्नलिखित में से कौनसा कथन असत्य है:
(a) 's' कक्षक में इलेक्ट्रॉन का कुल कक्षक कोणीय संवेग शून्य के बराबर है
(b) एक कक्षक तीन क्वाण्टम संख्याओं से निर्दिष्ट है जबकि एक परमाणु में एक इलेक्ट्रॉन चार क्वाण्टम संख्याओं से निर्दिष्ट है
(c) N परमाणु का इलेक्ट्रॉनिक विन्यास 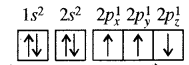
(d) d-z2 के लिए m का मान शून्य है
उत्तर:
(c) N परमाणु का इलेक्ट्रॉनिक विन्यास 
प्रश्न 20.
X - रे विकिरण जिसकी आवृत्ति 6.39 × 1017 s-1 है उसका तरंगदैर्घ्य (nm में) है। ( c = 3.00 x 108 ms-1)
(a) 0.469 nm
(b) 2.13nm
(c) 46.9nm
(d) 192.0nm
उत्तर:
(a) 0.469 nm
प्रश्न 21.
रूबीडियम (Z = 37) के संयोजी इलेक्ट्रॉन के लिए चार सेट क्वाण्टम संख्या का सही है :
(a) 5, 0, 0, + 1/2
(b) 5, 1, 0, + 1/2
(c) 5, 1, 1, + 1⁄2
(d) 6, 0, 0, + 1⁄2
उत्तर:
(a) 5, 0, 0, + 1/2
प्रश्न 22.
एक हाइड्रोजन परमाणु में द्वितीय बोर (Bohr) कक्षा में इलेक्ट्रॉन (electron) की गतिज ऊर्जा (kinetic energy) है:
[ao : बोर त्रिज्या (Bohr radius)]
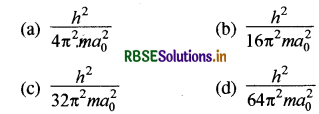
उत्तर:
\(\text { (c) } \frac{h^2}{32 \pi^2 m a_0^2}\)
प्रश्न 23.
हाइड्रोजन परमाणु के द्वितीय बोर कक्षा का अर्द्धव्यास होगा ( प्लांक स्थिरांक h = 6.6262 x 10-34 Js; इलेक्ट्रॉन का द्रव्यमान = 9.1091 x 10-31 kg; इलेक्ट्रॉन का आवेश e 1.60210 × 10-19 C; निर्वात का परावैद्युतांक Eo = 8.854185 × 10-12 kg 1m3 A1/2 )
(a) 4.76 Å
(b) 0.529 Å
(c) 2.12 A
(d) 1.65 Å
उत्तर:
(d) 1.65 Å
प्रश्न 24.
हाइड्रोजन परमाणु के 1s इलेक्ट्रॉन के नाभिक से दूरी पर एक अनन्त सूक्ष्म मोटाई, dr के गोलीय कोश में पाये जाने की प्रायिकता (probability) P है। इस कोश का आयतन 4πr2dr है । P की पर निर्भरता का गुणात्मक रेखाचित्र है:
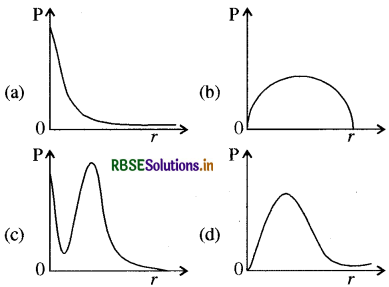
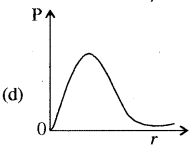
उत्तर:
प्रश्न 25.
एक इलेक्ट्रॉन की ऊर्जा को इस प्रकार प्रस्तुत किया जाता है:
E = 2.178 × 10-18J (Z2/n2) प्रकाश की तरंगदैर्ध्य हाइड्रोजन परमाणु में एक इलेक्ट्रॉन को n = 1 से n = 2 स्तर पर उत्तेजित करने के लिए आवश्यक होगी: (h = 6.62 × 10-34 Js और c = 3.0 x 108 ms-1)
(a) 1.214 × 10-7 m
(b) 2.816 x 10-7 m
(c) 6.500 x 10-7 m
(d) 8.500 x 10-7 m
उत्तर:
(a) 1.214 × 10-7 m
प्रश्न 26.
निम्नलिखित में से हाइड्रोजन की सम्भव उत्तेजित अवस्था की ऊर्जा कौनसी है?
(a ) + 13.6 ev
(b) - 6.8 ev
(c) - 3.4 ev
(d) + 6.8 ev
उत्तर:
(c) - 3.4 ev
प्रश्न 27.
एक गर्म फिलामेंट से निकली इलेक्ट्रॉन धारा को विभवान्तर पर रखी दो आवेशित प्लेटों के बीच से भेजा जाता है। यदि इलेक्ट्रॉन के आवेश तथा संहति क्रमश: e तथा m हों तो निम्न में से किसके द्वारा दिया जायेगा ( जब इलेक्ट्रॉन तरंग से
सम्बन्धित तरंगदैर्घ्य 2 है )
(a) 2me V
\(\text { (b) } \sqrt{m e \mathrm{~V}}\)
\(\text { (c) } \sqrt{2 m e \mathrm{~V}}\)
(d) meV
उत्तर:
\(\text { (c) } \sqrt{2 m e \mathrm{~V}}\)

प्रश्न संख्या 28, 29 एवं 30 दिये गये Passage पर आधारित हैं। Passage:
हाइड्रोजन के समान स्पीशीज Li2+ आयन गोलतः सममति अवस्था S1 में है, जिसका एक त्रिज्य नोड है । प्रकाश अवशोषण पर आयन का संक्रमण S2 अवस्था में हो जाता है। अवस्था S2 की एक त्रिज्य नोड है और इसकी ऊर्जा हाइड्रोजन परमाणु की निम्नतम अवस्था की ऊर्जा के बराबर है।
प्रश्न 28.
अवस्था S2 की कक्षक कोणीय संवेग क्वाण्टम संख्या है:
(a) 2
(b) 1
(c) 0
(d) 3
उत्तर:
(b) 1
प्रश्न 29.
S1 अवस्था की ऊर्जा हाइड्रोजन परमाणु की निम्नतम अवस्था की ऊर्जा के मात्रक में है:
(a) 4.50
(b) 1.50
(c) 2.25
(d) 0.75
उत्तर:
(c) 2.25
प्रश्न 30.
अवस्था S1 है:
(a) 2p
(b) 2s
(c) 1s
(d) 3s
उत्तर:
(b) 2s
