RBSE Solutions for Class 9 Science Chapter 4 परमाणु की संरचना
Rajasthan Board RBSE Solutions for Class 9 Science Chapter 4 परमाणु की संरचना Textbook Exercise Questions and Answers.
Rajasthan Board RBSE Solutions for Class 9 Science in Hindi Medium & English Medium are part of RBSE Solutions for Class 9. Students can also read RBSE Class 9 Science Important Questions for exam preparation. Students can also go through RBSE Class 9 Science Notes to understand and remember the concepts easily. The why do we fall ill important questions are curated with the aim of boosting confidence among students.
RBSE Class 9 Science Solutions Chapter 4 परमाणु की संरचना
RBSE Class 9 Science Chapter 4 परमाणु की संरचना InText Questions and Answers
पृष्ठ 53.
प्रश्न 1.
केनाल किरणें क्या हैं?
उत्तर:
1886 में ई. गोल्डस्टीन ने एक नए विकिरण की खोज की, जिसे उन्होंने 'कैनाल किरणें' अथवा 'कैनाल रे' कहा। ये किरणें धनावेशित विकिरण थीं, जिनके द्वारा अन्तत: दूसरे अवपरमाणुक कणों की खोज हुई।

प्रश्न 2.
यदि किसी परमाणु में एक इलेक्ट्रॉन और एक प्रोटॉन है, तो इसमें कोई आवेश होगा या नहीं?
उत्तर:
नहीं, परमाणु में कोई आवेश नहीं होगा क्योंकि इलेक्ट्रॉन और एक प्रोटॉन पर आवेश बराबर होता है, इसलिए ये एक - दूसरे के आवेशों को संतुलित कर देते हैं, जिससे परमाणु उदासीन हो जाता है।
पृष्ठ 56 I.
प्रश्न 1.
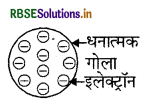
परमाणु उदासीन है, इस तथ्य को टॉमसन के मॉडल के आधार पर स्पष्ट कीजिए।
उत्तर:
टॉमसन के मॉडल के अनुसार, परमाणु धन आवेशित गोले का बना होता है और इलेक्ट्रॉन उसमें फंसे होते हैं। ऋणात्मक एवं धनात्मक आवेश परिमाण में समान होते हैं, इसलिए ये एक - दूसरे के प्रभाव को उदासीन कर देते हैं, जिस कारण परमाणु वैद्युतीय रूप से उदासीन होते हैं।
प्रश्न 2.
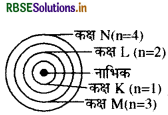
रदरफोर्ड के परमाणु मॉडल के अनुसार परमाणु के नाभिक में कौनसा अवपरमाणुक कण विद्यमान है?
उत्तर:
रदरफोर्ड के परमाणु मॉडल के अनुसार परमाणु के नाभिक में धनावेशित.कण प्रोटॉन विद्यमान है।
प्रश्न 3.
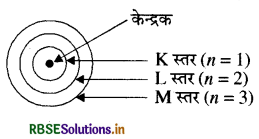
तीन कक्षाओं वाले बोर के परमाणु मॉडल का चित्र बनाइए।
उत्तर:
तीन कक्षाओं वाले बोर के परमाणु मॉडल का चित्र निम्न प्रकार है।
प्रश्न 4.
क्या अल्फा कणों का प्रकीर्णन प्रयोग सोने के अतिरिक्त दूसरी धातु की पन्नी से सम्भव होगा?
उत्तर:
अल्फा कणों के प्रकीर्णन प्रयोग के लिए सोने की अत्यन्त महीन पन्नी, जो लगभग 1000 परमाणुओं के बराबर मोटी होती है, को प्राप्त करना सम्भव होता है, क्योंकि इसकी आघातवर्धनीयता अधिक होती है। परन्तु किसी अन्य धातु की इतनी महीन पन्नी प्राप्त करना सम्भव नहीं है क्योंकि अन्य धातुओं की आघातवर्धनीयता कम होती है। इस कारण अल्फा कणों के प्रकीर्णन प्रयोग में सोने के अतिरिक्त दूसरी धातु की पन्नी का प्रयोग सम्भव नहीं है।
पृष्ठ 56 II
प्रश्न 1.
परमाणु के तीन अवपरमाणुक कणों के नाम लिखें।
उत्तर:
परमाणु के तीन अवपरमाणुक कण - प्रोटॉन, न्यूट्रॉन एवं इलेक्ट्रॉन हैं हीलियम परमाणु का परमाणु द्रव्यमान 4u है और उसके नाभिक में दो प्रोटॉन होते हैं। इसमें कितने न्यूट्रॉन होंगे परमाणु में इलेक्ट्रॉनों एवं प्रोटॉनों की संख्या समान है, इसलिए इस पर कोई आवेश नहीं होगा अर्थात् परमाणु वैद्युत उदासीन होगा।

प्रश्न 2.
हीलियम परमाणु का परमाणु द्रव्यमान 4u है और उसके नाभिक में दो प्रोटॉन होते हैं। इसमें कितने न्यूट्रॉन होंगे?
उत्तर:
हीलियम के परमाणु में न्यूट्रॉनों की संख्या = परमाणु द्रव्यमान – प्रोटॉनों की संख्या
= 4 - 2
= 2.
पृष्ठ 57.
प्रश्न 1.
कार्बन और सोडियम के परमाणुओं के लिए इलेक्ट्रॉन - वितरण लिखिए।
उत्तर:
|
परमाणु का नाम |
परमाणु क्रमांक |
इलेक्ट्रॉनिक - वितरण |
||
|
K |
L |
M |
||
|
कार्बन (C) |
6 |
2 |
4 |
|
|
सोडियम (Na) |
11 |
2 |
8 |
1 |
प्रश्न 2.
अगर किसी परमाणु का K और L कोश भरा है, तो उस परमाणु में इलेक्ट्रॉनों की संख्या क्या होगी?
उत्तर:
K कोश (n = 1) में इलेक्ट्रॉनों की अधिकतम संख्या
= 2n2
= 2(1)2 = 2
L कोश (n = 2) में इलेक्ट्रॉनों की अधिकतम संख्या
= 2n2
= 2(2)2 = 8
अत: परमाणु में 2 + 8 = 10 इलेक्ट्रॉन होंगे।
पृष्ठ 58.
प्रश्न 1.
क्लोरीन, सल्फर और मैग्नीशियम की परमाण संख्या से आप इनकी संयोजकता कैसे प्राप्त करेंगे?
उत्तर:
क्लोरीन, सल्फर और मैग्नीशियम का इलेक्ट्रॉनिक विन्यास निम्न है।
|
तत्व का नाम |
परमाणु संख्या |
इलेक्ट्रॉनिक विन्यास |
संयोजकता इलेक्ट्रॉन |
संयोजकता |
||
|
K |
L |
M |
||||
|
क्लोरीन |
17 |
2 |
8 |
7 |
7 |
8 – 7 = 1 |
|
सल्फर |
16 |
2 |
8 |
6 |
6 |
8 – 6 = 2 |
|
मैग्नीशियम |
12 |
2 |
8 |
2 |
2 |
2 |
1. क्लोरीन की परमाणु संख्या 17 व इलेक्ट्रॉनिक विन्यास 2, 8, 7 है। अतः इसके बाह्यतम कक्ष में 7 इलेक्ट्रॉन हैं, इसलिए अष्टक पूरा करने के लिए इसे 1 इलेक्ट्रॉन की आवश्यकता होगी इसलिए इसकी संयोजकता 1 है।
2. सल्फर (परमाणु संख्या 16) का इलेक्ट्रॉनिक विन्यास 2, 8, 6 है। अतः इसे अपना बाह्यतम कोश अर्थात् अष्टक पूरा करने के लिए 2 इलेक्ट्रॉन की आवश्यकता होगी। इसलिए इसकी संयोजकता 2 है।
3. मैग्नीशियम (परमाणु संख्या 12) का इलेक्ट्रॉनिक विन्यास 2, 8, 2 है। इसके बाह्यतम कक्ष में 2 व इससे पहले वाले कक्ष में 8 इलेक्ट्रॉन हैं। अतः स्थायी विन्यास प्राप्त करने के लिए यह इन 2 इलेक्ट्रॉनों का त्याग कर सकता है। अतः इसकी संयोजकता 2 है।
पृष्ठ 59.
प्रश्न 1.
यदि किसी परमाणु में इलेक्ट्रॉनों की संख्या 8 है और प्रोटॉनों की संख्या भी 8 है तब।
(a) परमाणु की परमाणुक संख्या क्या है?
(b) परमाणु का क्या आवेश है?
उत्तर:
(a) किसी तत्व की परमाणु संख्या, उसके परमाणु के नाभिक में उपस्थित प्रोटॉनों की संख्या के बराबर होती है। अत: इस परमाणु की परमाणुक संख्या = 8
(b) परमाणु में इलेक्ट्रॉनों एवं प्रोटॉनों की संख्या समान है, इसलिए इस पर कोई आवेश नहीं होगा अर्थात् परमाणु वैद्युत उदासीन होगा।

प्रश्न 2.
पाठ्यपुस्तक की सारणी 4.1 की सहायता से ऑक्सीजन और सल्फर परमाणु की द्रव्यमान संख्या ज्ञात कीजिए। उत्तर - ऑक्सीजन की द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
= 8 + 8 = 16
सल्फर की द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
= 16 + 16 = 32
पृष्ठ 60.
प्रश्न 1.
चिह्न ( प्रतीक) H, D और T के लिए प्रत्येक में पाए जाने वाले तीन अवपरमाणुक कणों को सारणीबद्ध कीजिए।
उत्तर:
H, D और T क्रमश: प्रोटियम, ड्यूटीरियम व ट्राइटियम हैं। ये हाइड्रोजन परमाणु के समस्थानिक हैं। इनमें पाये जाने वाले अवपरमाणुक कण निम्नलिखित हैं।
|
नाम |
सूत्र |
द्रव्यमान संख्या (A) |
प्रोटॉनों की संख्या (P+) |
न्यूट्रॉनों की संख्या (n0) |
इलेक्ट्रॉन की संख्या (e-) |
|
प्रोटियम |
41H(H) |
1 |
1 |
0 |
1 |
|
ड्यूटिरियम |
21H(D) |
2 |
1 |
1 |
1 |
|
ट्रिटियम |
31H(T) |
3 |
1 |
2 |
1 |
प्रश्न 2.
समस्थानिक और समभारिक के किसी एक युग्म का इलेक्ट्रॉनिक विन्यास लिखिए।
उत्तर:
- क्लोरीन के समस्थानिक 3517Cl व 3717Cl दोनों का इलेक्ट्रॉनिक विन्यास 2, 8, 7 है।
- समभारिक 4020Ca एवं 4018
Ar 4020Ca का इलेक्ट्रॉनिक विन्यास = 2, 8, 8, 2
4018Ar का इलेक्ट्रॉनिक विन्यास = 2, 8, 8
RBSE Class 9 Science Chapter 4 परमाणु की संरचना Textbook Questions and Answers
प्रश्न 1.
इलेक्ट्रॉन, प्रोटॉन और न्यूट्रॉन के गुणों की तुलना कीजिए।
उत्तर:
इलेक्ट्रॉन, न्यूट्रॉन और प्रोटॉन के गुणों की तुलना निम्न प्रकार की जा सकती है।
|
गुण |
इलेक्ट्रॉन |
प्रोटॉन |
न्यूट्रॉन |
|
खोजकर्ता |
जे. जे. टॉमसन |
ई. गोल्डस्टीन |
जे. चैडविक |
|
प्रतीक |
e- |
p+ |
n |
|
आवेश |
प्रोटॉन के द्रव्यमान का लगभग वाँ भाग |
धनावेश |
अनावेशित (उदासीन ) |
|
द्रव्यमान |
इलेक्ट्रॉन |
लगभग 1 इकाई |
प्रोटॉन के द्रव्यमान के लगभग बराबर |
प्रश्न 2.
जे.जे. टॉमसन के परमाणु मॉडल की क्या सीमाएँ हैं?
उत्तर:
जे.जे. टॉमसन का मॉडल परमाणु के उदासीन होने की व्याख्या तो कर सका किन्तु दूसरे वैज्ञानिकों द्वारा किए गए प्रयोगों के परिणामों को इस मॉडल के द्वारा समझाया नहीं जा सका।
प्रश्न 3.
रदरफोर्ड के परमाणु मॉडल की क्या सीमाएँ हैं?
उत्तर:
रदरफोर्ड के परमाणु मॉडल की सीमाएँ: गोलाकार (वर्तुलाकार) कक्ष में चक्रण करते हुए इलेक्ट्रॉन स्थायी नहीं रह सकता है क्योंकि कोई भी आवेशित कण गोलाकार कक्ष में त्वरित होगा। त्वरण के दौरान आवेशित कणों से ऊर्जा का विकिरण होगा। इस प्रकार स्थायी कक्ष में घूमता हुआ इलेक्ट्रॉन अपनी ऊर्जा विकिरित करेगा और नाभिक से टकरा जाएगा। इसका अभिप्राय यह होगा कि परमाणु अस्थायी है, परन्तु वास्तव में परमाणु स्थायी होते हैं। इसका समाधान रदरफोर्ड के परमाणु मॉडल में नहीं किया जा सका।

प्रश्न 4.
बोर के परमाणु मॉडल की व्याख्या कीजिए।
उत्तर:
रदरफोर्ड के परमाणु मॉडल की कमियों को दूर करने के लिए नील्स बोर ने परमाणु की संरचना के बारे में निम्नलिखित अवधारणाएँ प्रस्तुत की:
- इलेक्ट्रॉन केवल कुछ निश्चित कक्षाओं में ही चक्कर लगा सकते हैं जिन्हें इलेक्ट्रॉन की विविक्त कक्षा कहते हैं।
- जब इलेक्ट्रॉन इस विविक्त कक्षा में चक्कर लगाते हैं तो उनकी ऊर्जा विकिरित नहीं होती है अर्थात् इलेक्ट्रॉन की ऊर्जा निश्चित होती है। इन कक्षाओं को ऊर्जा स्तर कहते हैं।
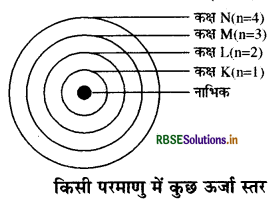
- प्रत्येक इलेक्ट्रॉन कोश एक निश्चित ऊर्जा युक्त होता है। इन कोशों (कंक्षाओं) को 1, 2, 3, 4 या K, L, M, N आदि द्वारा दर्शाया जाता है। सामने चित्र में एक परमाणु के ऊर्जा स्तरों (कक्षाओं) नाभिक को दर्शाया गया है।
- प्रत्येक कक्ष में इलेक्ट्रॉन की संख्या निश्चित होती है। पहले कक्ष में अधिकतम 2 इलेक्ट्रॉन, दूसरे कक्ष में अधिकतम 8 इलेक्ट्रॉन व तीसरे कक्ष में अधिकतम 18 इलेक्ट्रॉन व्यवस्थित किये जा चित्र-किमी पर
प्रश्न 5.
इस अध्याय में दिए गए सभी परमाणु मॉडलों की तुलना कीजिए।
उत्तर:
इस अध्याय में तीन परमाणु मॉडल प्रतिपादित किए गए हैं तथा प्रत्येक मॉडल उससे पहले वाले मॉडल की कमियों को दूर करने के लिए प्रतिपादित किया गया था। इनकी तुलना निम्न प्रकार कर सकते हैं
|
|
टॉमसन का परमाणु मॉडल |
रदरफोर्ड का परमाणु मॉडल |
बोर का परमाणु मॉडल |
|
(i) धन आवेश ( प्रोटॉन) की स्थिति |
परमाणु को धनावेशित गोला माना गया है। |
परमाणु का केन्द्र धनावेशित होता है, इसे नाभिक कहते हैं। परमाणु का सम्पूर्ण द्रव्यमान नाभिक में स्थित होता है। |
धनावेश परमाणु के केन्द्र में स्थित नाभिक में होता है। |
|
(ii) ऋण आवेश (इले क्ट्रॉन ) की स्थिति |
इलेक्ट्रॉन परमाणु के धनावेशित गोले में धँसे रहते हैं, जैसे - तरबूज में बीज।
|
इलेक्ट्रॉन नाभिक के चारों ओर निश्चित कक्षाओं में चक्कर लगाते हैं।
|
इलेक्ट्रॉन नाभिक के चारों ओर विभिन्न कक्षाओं में चक्कर लगाते हैं। इन कक्षाओं को ऊर्जा स्तर कहते हैं तथा इन्हें K, L, M, N या संख्याओं 1,2,3,4..के द्वारा दर्शाया जाता है।
|
प्रश्न 6.
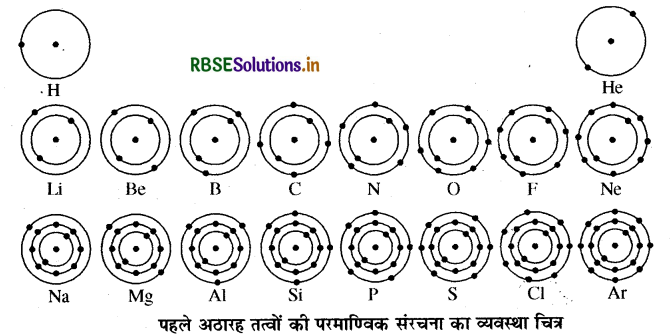
पहले अठारह तत्वों के विभिन्न कक्षों में इलेक्ट्रॉन वितरण के नियम को लिखिए।
उत्तर:
परमाणुओं की विभिन्न कक्षाओं में इलेक्ट्रॉनों के वितरण के लिए बोर और बरी ने निम्न नियम दिए।
(i) किसी कक्षा में उपस्थित इलेक्ट्रॉन की अधिकतम संख्या सूत्र 2n के अनुसार होगी। यहाँ n कक्षा की संख्या या ऊर्जा स्तर है। अत: इलेक्ट्रॉन की अधिकतम संख्या कक्षवार निम्न प्रकार होगी
प्रथम कक्ष या K कोश में 2n2 = 2 x 12 = 2
द्वितीय कक्ष या L कोश में 2n2 = 2 x 22 = 8
तृतीय कक्ष या M कोश में 2n2 = 2 x 32 = 18
चतुर्थ कक्ष या N कोश में 2n2 = 2 x 42 = 32
(ii) सबसे बाहरी कोश में इलेक्ट्रॉनों की अधिकतम संख्या 8 हो सकती है।
(iii) किसी परमाणु के दिए गए कोश में इलेक्ट्रॉन तब तक स्थान नहीं लेते हैं जब तक कि उससे पहले वाले भीतरी कक्ष पूर्ण रूप से भर नहीं जाते। अत: कक्षाएँ क्रमानुसार भरती हैं।
पहले 18 तत्वों की परमाणु संरचना का व्यवस्था चित्र निम्न प्रकार से है।
प्रश्न 7.
सिलिकॉन और ऑक्सीजन का उदाहरण लेते हुए संयोजकता की परिभाषा दीजिए।
उत्तर:
संयोजकता - परमाणु के बाह्यतम कक्ष में इलेक्ट्रॉनों के अष्टक बनाने के लिए, जितनी संख्या में इलेक्ट्रॉनों की साझेदारी या स्थानान्तरण होता है, वही उस तत्त्व की संयोजकता कहलाती है। जैसे
- सिलिकॉन की परमाणु संख्या 14 है, अत: इसका इलेक्ट्रॉनिक विन्यास 2, 8, 4 है। इसके बाह्यतम कक्ष में इलेक्ट्रॉनों की संख्या 4 है। इसलिए सिलिकॉन द्वारा अपना अष्टक पूर्ण करने के लिए 4 इलेक्ट्रॉनों की आवश्यकता है। अतः इसकी संयोजकता 4 होगी।
- ऑक्सीजन की परमाणु संख्या 8 है, अतः इसका इलेक्ट्रॉनिक विन्यास 2, 6 होगा। इसको अष्टक पूर्ण करने के लिए 2 इलेक्ट्रॉन की आवश्यकता है अतः ऑक्सीजन की संयोजकता 2 होगी।

प्रश्न 8.
उदाहरण के साथ व्याख्या कीजिए-परमाणु संख्या, द्रव्यमान संख्या, समस्थानिक और समभारिक। समस्थानिकों के कोई दो उपयोग लिखिए।
उत्तर:
(1) परमाणु संख्या-किसी परमाणु के नाभिक में उपस्थित प्रोटॉनों की संख्या को परमाणु संख्या कहते हैं। इसे 'Z' से प्रदर्शित करते हैं।
उदाहरण:
हाइड्रोजन की परमाणु संख्या 1 है क्योंकि उसके नाभिक में 1 प्रोटॉन होता है। इसी प्रकार कार्बन की परमाणु संख्या 6 होती है, क्योंकि इसके नाभिक में 6 प्रोटॉन होते हैं। अतः परमाणु संख्या (Z) = परमाणु के नाभिक में उपस्थित प्रोटॉनों की कुल संख्या
(2) द्रव्यमान संख्या (A)-किसी परमाणु के नाभिक में उपस्थित प्रोटॉनों और न्यूट्रॉनों की संख्या के योग को द्रव्यमान संख्या कहते हैं। जैसे-कार्बन का द्रव्यमान 12u है क्योंकि इसमें 6 प्रोटॉन और 6 न्यूट्रॉन होते हैं। इसी प्रकार ऐलुमिनियम का द्रव्यमान 27 u है. (13 प्रोटॉन + 14 न्यूट्रॉन)। प्रोटॉन एवं न्यूट्रॉन परमाणु के नाभिक में होते हैं, इसलिए इन्हें 'न्यूक्लिऑन' भी कहते हैं। अतः द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
अथवा द्रव्यमान संख्या = परमाणु संख्या + न्यूट्रॉनों की संख्या
(3) समस्थानिक - एक ही तत्त्व के परमाणु जिनकी परमाणु संख्या समान लेकिन द्रव्यमान संख्या भिन्न - भिन्न होती है, समस्थानिक कहलाते हैं। समस्थानिक का निर्माण न्यूट्रॉन की संख्या परिवर्तन से होता है। इनमें परमाणु संख्या समान होने से इनके रासायनिक गुण भी समान होते हैं।
समस्थानिकों के उदाहरण:
(क) हाइड्रोजन के समस्थानिक: हाइड्रोजन के तीन समस्थानिक होते हैं, जो निम्न प्रकार से हैं।
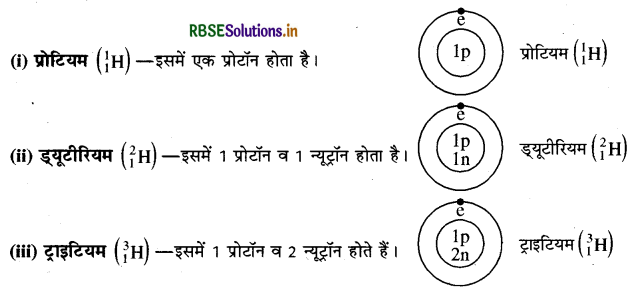
(ख) क्लोरीन के समस्थानिक-क्लोरीन (CI) के दो समस्थानिक होते हैं। 3517Cl और 3517CI:
- 3517Cl इसमें प्रोटॉन 17 और न्यूट्रॉन 18 (35 - 17) होते हैं।
- 3517Cl इसमें प्रोटॉन 17 और न्यूट्रॉन 20 (37 – 17) होते हैं।
(4) समभारिक तत्वों के ऐसे परमाणु, जिनके परमाणु क्रमांक (संख्या) भिन्न-भिन्न लेकिन द्रव्यमान संख्या (न्यूक्लियॉनों की संख्या) समान होती हैं, समभारिक कहलाते हैं। समभारिकों के कुछ प्रमुख उदाहरण निम्न प्रकार हैंआर्गन 18Ar40 पोटेशियम 10K40 तथा कैल्सियम 17Ca40 परस्पर समभारिक हैं।
समस्थानिकों के उपयोग:
- यूरेनियम के एक समस्थानिक का उपयोग परमाणु भट्टी में ईंधन के रूप में होता है।
- कैंसर के उपचार में कोबाल्ट (CO - 60) के समस्थानिक का उपयोग होता है।
- पेंघा रोग के इलाज में आयोडीन (I - 131) के समस्थानिक का उपयोग होता है।
प्रश्न 9.
Na+ के पूरी तरह से भरे हुए K और L कोश होते हैं - व्याख्या कीजिए।
उत्तर:
Na का परमाणु क्रमांक 11 होता है, अत: इसका इलेक्ट्रॉनिक विन्यास 2, 8, 1 है। अपने बाह्यतम कक्ष अर्थात् M - कोश में उपस्थित इलेक्ट्रॉन का त्याग करने पर Na+ आयन बनता है। Na+ आयन का इलेक्ट्रॉनिक विन्यास 2, 8 है अर्थात् इसके K और L कोशों में इलेक्ट्रॉनों की संख्या, इन कोशों में भरे जाने वाले इलेक्ट्रॉनों की अधिकतम संख्या के बराबर है। अत: K और L कोश पूर्णतः भरे हुए हैं।
प्रश्न 10.
अगर ब्रोमीन परमाणु दो समस्थानिकों 7935Br (49.7%) तथा 8135Br (50.3%)] के रूप में है, तो ब्रोमीन परमाणु के औसत परमाणु द्रव्यमान की गणना कीजिए।
उत्तर:
ब्रोमीन का औसत परमाणु द्रव्यमान = \(79 \times \frac{49.7}{100}+81 \times \frac{50.3}{100}\)
\(\begin{aligned} &=\frac{(79 \times 49.7)+(81 \times 50.3)}{100} \\ &=\frac{3926.3+4074.3}{100}=\frac{8000.6}{100} \\ &=80.006 \end{aligned}\)
अतः ब्रोमीन (Br) का परमाणु द्रव्यमान = 80.006u

प्रश्न 11.
एक तत्व X का परमाणु द्रव्यमान संख्या 16.2u है, तो इसके किसी एक नमूने में समस्थानिक 1618X और 188X का प्रतिशत क्या होगा?
उत्तर:
माना नमूने में समस्थानिक की प्रतिशतता = X
अतः समस्थानिक 1618X की प्रतिशतत = 100 - X
188X का औसत परमाणु द्रव्यमान = 16.2u
औसत द्रव्यमान = \(\frac{(16 \times x)+18 \times 100-x}{100}\)
या \(\begin{aligned} &16.2=\frac{16 x}{100}+18-\frac{18 x}{100} \\ &16.2=18-\frac{2 x}{100} \end{aligned}\)
1800 - 2x = 16.2 x 100
1800 - 2x = 1620
2x = 1620 – 1800
2x = 180
\(x=\frac{180}{2}\)
x = 90
तथा 100 - x = 100 - 90 = 10
अतः नमूने में 1618X की प्रतिशतता 90% तथा 188X की प्रतिशतता 10% होगी।
प्रश्न 12.
यदि तत्व का Z = 3 हो, तो तत्व की संयोजकता क्या होगी? तत्व का नाम भी लिखिए।
उत्तर:
यदि तत्व का Z = 3, तब तत्व के परमाणु में 3 इलेक्ट्रॉन हैं और उसका इलेक्ट्रॉनिक विन्यास 2, 1 है। अत: इसकी संयोजकता 1 होगी तथा यह तत्व लिथियम (Li) होगा।
प्रश्न 13.
दो परमाणु स्पीशीज के केन्द्रकों का संघटन नीचे दिया गया है।
|
|
X |
Y |
|
प्रोटॉन |
6 |
6 |
|
न्यूट्रॉन |
6 |
8 |
X और Y की द्रव्यमान संख्या ज्ञात कीजिए। इन दोनों स्पीशीज में क्या सम्बन्ध है?
उत्तर:
द्रव्यमान संख्या = प्रोटॉनों की संख्या + न्यूट्रॉनों की संख्या
X की द्रव्यमान संख्या 6 + 6 = 12
Y की द्रव्यमान संख्या 6 + 8 = 14
X व Y की परमाणु संख्या 6 है अर्थात् दोनों समान हैं किन्तु दोनों की द्रव्यमान संख्या क्रमशः 12 व 14 है जो भिन्न है अतः ये दोनों कार्बन के समस्थानिक 126C तथा 146C हैं।
प्रश्न 14.
निम्नलिखित वक्तव्यों में गलत के लिए F और सही के लिए T लिखें।
(a) जे.जे. टॉमसन ने यह प्रस्तावित किया था कि परमाणु के केन्द्रक में केवल न्यूक्लियॉन्स होते हैं।
(b) एक इलेक्ट्रॉन और प्रोटॉन मिलकर न्यूट्रॉन का निर्माण करते हैं इसलिए यह अनावेशित होता है।
(c) इलेक्ट्रॉन का द्रव्यमान प्रोटॉन से लगभग \(\frac{1}{2000}\) गुना होता है।
(d) आयोडीन के समस्थानिक का इस्तेमाल टिंक्चर आयोडीन बनाने में होता है। इसका उपयोग दवा के रूप में होता है।
उत्तर:
(a) F (b) F (c) T (d) E.
प्रश्न संख्या 15, 16 और 17 में सही के सामने (V) का चिह्न और गलत के सामने (X) का चिह्न लगाएँ।

प्रश्न 15.
रदरफोर्ड का अल्फा कण प्रकीर्णन प्रयोग किसकी खोज के लिए उत्तरदायी था?
(a) परमाणु केन्द्रक
(b) इलेक्ट्रॉन
(c) प्रोटॉन
(d) न्यूट्रॉन
उत्तर:
(a) परमाणु केन्द्रक
प्रश्न 16.
एक तत्व के समस्थानिक में होते हैं।
(a) समान भौतिक गुण।
(b) भिन्न रासायनिक गुण।
(c) न्यूट्रॉनों की अलग - अलग संख्या।
(d) भिन्न परमाणु संख्या
उत्तर:
(c) न्यूट्रॉनों की अलग-अलग संख्या।
प्रश्न 17.
CI- आयन में संयोजकता इलेक्ट्रॉनों की संख्या है।
(a) 16
(c) 17
(d) 18
उत्तर:
(b) 8
प्रश्न 18.
सोडियम का सही इलेक्ट्रॉनिक विन्यास निम्न में कौनसा है?
(a) 2, 8
(b) 8, 2, 1
(c) 2, 1, 8
(d) 2, 8, 1
उत्तर:
(d) 2, 8, 1

प्रश्न 19.
निम्नलिखित सारणी को पूरा कीजिए।
|
परमाणु संख्या |
द्रव्यमान संख्या |
न्यूट्रॉनों की संख्या |
प्रोटॉनों की संख्या |
इलेक्ट्रॉनों की संख्या |
परमाणु स्पीशीज |
|
9 |
- |
10 |
- |
- |
- |
|
16 |
32 |
- |
- |
- |
सल्फर |
|
- |
24 |
- |
12 |
- |
- |
|
- |
2 |
- |
1 |
- |
- |
|
- |
1 |
0 |
1 |
0 |
- |
उत्तर:
|
परमाणु संख्या |
द्रव्यमान संख्या |
न्यूट्रॉनों की संख्या |
प्रोटॉनों की संख्या |
इलेक्ट्रॉनों की संख्या |
परमाणु स्पीशीज |
|
9 |
19 |
10 |
9 |
9 |
फ्लोरीन |
|
16 |
32 |
16 |
16 |
16 |
सल्फर |
|
12 |
24 |
12 |
12 |
12 |
मैग्नीशियम |
|
1 |
2 |
1 |
1 |
1 |
ड्रयूटीरियम |
|
1 |
1 |
0 |
1 |
0 |
हाइड्रोजन |

- RBSE Solutions for Class 9 Science Chapter 1 हमारे आस - पास के पदार्थ
- RBSE Solutions for Class 9 Science in Hindi Medium & English Medium
- RBSE Class 9 Science Important Questions Chapter 8 Motion
- RBSE Class 9 Science Important Questions in Hindi Medium & English Medium
- RBSE Class 9 Science Notes in Hindi & English Medium Pdf Download
- RBSE Solutions for Class 9 Science Chapter 13 Why Do We Fall Ill
- RBSE Solutions for Class 9 Science Chapter 14 प्राकृतिक सम्पदा
- RBSE Class 9 Science Important Questions Chapter 10 गुरुत्वाकर्षण
- RBSE Class 9 Science Important Questions Chapter 8 गति
- RBSE Class 9 Science Important Questions Chapter 9 बल तथा गति के नियम
- RBSE Class 9 Science Important Questions Chapter 13 हम बीमार क्यों होते हैं