RBSE Solutions for Class 12 Chemistry Chapter 7 p-ब्लॉक के तत्व
Rajasthan Board RBSE Solutions for Class 12 Chemistry Chapter 7 p-ब्लॉक के तत्व Textbook Exercise Questions and Answers.
Rajasthan Board RBSE Solutions for Class 12 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 12. Students can also read RBSE Class 12 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 12 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 12 Chemistry Solutions Chapter 7 p-ब्लॉक के तत्व
RBSE Class 12 Chemistry p-ब्लॉक के तत्व InText Questions and Answers
प्रश्न 1.
P, As, Sb तथा Bi के ट्राई-हैलाइडों से पेन्टा-हैलाइड अधिक सह-संयोजी क्यों होते हैं?
उत्तर:
फजॉन के नियम के अनुसार किसी अणु के केन्द्रीय परमाणु की जितनी उच्च धनात्मक ऑक्सीकरण अवस्था होती है, उसकी ध्रुवण क्षमता उतनी ही अधिक होती है। परिणामस्वरूप केन्द्रीय परमाणु और अन्य परमाणु के मध्य बने आबन्ध में सह-संयोजी गुण बढ़ता जाता है।
चूँकि पेन्टा-हैलाइड में केन्द्रीय परमाणु + 5 ऑक्सीकरण अवस्था में होता है, जबकि ट्राई-हैलाइड में यह + 3 ऑक्सीकरण अवस्था में होता है। इसलिये ट्राई-हैलाइडों से ज्यादा सह-संयोजी पेन्टाहैलाइड होते हैं।
प्रश्न 2.
वर्ग 15 के तत्वों के हाई-ड्राइडों में BiH3 सबसे प्रबल अपचायक क्यों हैं?
उत्तर:
वर्ग 15 के तत्वों के हाई-ड्राइडों में BiH3 के प्रबल अपचायक होने का कारण यह है कि इस वर्ग के हाई-ड्राइडों में BiH3 सबसे कम स्थायी होता है।

प्रश्न 3.
N2 कमरे के ताप पर कम क्रियाशील क्यों है?
उत्तर:
N2 कमरे के ताप पर कम क्रियाशील होती है; क्योंकि प्रबल pre - pπ अतिव्यापन के कारण त्रि-आबन्ध N = N बनता है।
प्रश्न 4.
अमोनिया की लब्धि को बढ़ाने के लिए आवश्यक स्थितियों का वर्णन कीजिए।
उत्तर:
अमोनिया का निर्माण हेबर प्रक्रम से किया जाता है। इसकी लब्धि बढ़ाने के लिए ला-शातेलिए सिद्धान्त के अनुसार आवश्यक स्थितियाँ निम्नवत् हैं:
- तापमान = 700K
- उच्च दाब = 200 x 105 Pa (लगभग 200 वायुमण्डल)
- उत्प्रेरक; जैसे - K2O तथा Al2O3 मिश्रित आयरन ऑक्साइड।
प्रश्न 5.
Cu+ आयन के साथ अमोनिया कैसे क्रिया करती है?
उत्तर:
Cu2+ आयन अमोनिया से क्रिया करके गहरे नीले रंग का संकुल बनाते हैं।
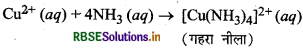
प्रश्न 6.
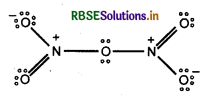
N2O5 में नाइट्रोजन की सह-संयोजकता क्या है?
उत्तर:
सह-संयोजकता, इलेक्ट्रॉनों के सहभाजित युग्मों की संख्या के बराबर होती हैं। चूँकि N2O5 में प्रत्येक नाइट्रोजन पर इलेक्ट्रॉनों के चार सहभाजित युग्म होते हैं अत: N2O5 में नाइट्रोजन की संयोजकता 4 होती है। ऐसा हम चित्र द्वारा भी समझ सकते हैं।
प्रश्न 7.
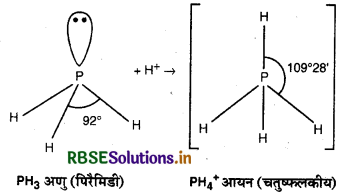
(a) PH3 से PH4+ का आबन्ध अधिक है, क्यों?
(b) जब PH3 नाइट्रिक अम्ल से अभिक्रिया करता है तो क्या बनता है?
उत्तर:
(a) PH3 तथा PH4+ दोनों में फॉस्फोरस (P) का संकरण sp3 होता है। PH4+ में चारों कक्षक आबन्धित होते हैं। जबकि PH3 में P पर एक एकाकी इलेक्ट्रॉन युग्म उपस्थित होता है। इस एकाकी इलेक्ट्रॉन युग्म के कारण प्रतिकर्षण उत्पन्न होता है। यह प्रतिकर्षण ही आबन्ध कोण को कम करता है अर्थात् PH4+ में आबन्ध कोण का मान 109028' होता है जबकि PH3 में इस कोण का मान 92° होता है।
(b) जब PH3 नाइट्रिक अम्ल के सम्पर्क में आने पर जलना शुरू कर देती है।
[2HNO3 → H2O+ 2NO2 + 0] x 8
2PH3 + → P2O5 + 3H2O
2PH3 + 16HNO3 → PO5 + 16NO2 + 11H2O

प्रश्न 8.
क्या होता है जब श्वेत फॉस्फोरस को CO2 के अक्रिय वातावरण में सान्द्र कॉस्टिक सोडा विलयन के साथ गर्म करते हैं?
उत्तर:
श्वेत फॉस्फोरस NaOH से अभिक्रिया करके फॉस्फीन (PH3) बनाता है।

प्रश्न 9.
क्या होता है जब PCI5 को गर्म करते हैं?
उत्तर:
PCI में तीन निरक्षीय (equatorial) [202 pm] तथा दो अक्षीय (axial) [240pm] बन्ध होते हैं। चूँकि अक्षीय बन्ध निरक्षीय बन्धों से दुर्बल होते हैं, इसलिए जब PCI को गर्म किया जाता है तो कम स्थायी अक्षीय बन्ध टूटकर PCl5 बनाते हैं।
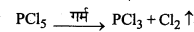
प्रश्न 10.
PCl5 की भारी पानी में जल-अपघटन अभिक्रिया का सन्तुलित समीकरण लिखिए।
उत्तर:
यह भारी जल से अभिक्रिया करके फॉस्फोरस ऑक्सी क्लोराइड (POCl3) तथा ड्यूटीरियम क्लोराइड (DCI) बनाता है।
\(\mathrm{PCl}_5+\mathrm{D}_2 \mathrm{O} \rightarrow \mathrm{POCl}_3+2 \mathrm{DCl}\)
प्रश्न 11.
H3PO4 की क्षारकता क्या है?
उत्तर:
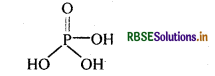
H3PO4 अणु में तीन –OH समूह उपस्थित होते हैं, इसलिए इसकी क्षारकता 3 हैं।
प्रश्न 12.
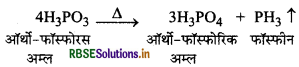
क्या होता है जब H3PO3 को गर्म करते हैं?
उत्तर:
ऑर्थो-फॉस्फोरस अम्ल या फॉस्फोरस अम्ल (H3PO3) गर्म करने पर असमानुपातित होकर ऑर्थो- फॉस्फोरिक अम्ल या फॉस्फोरिक अम्ल तथा फॉस्फीन देता है।
प्रश्न 13.
सल्फर के महत्वपूर्ण स्रोतों को सूचीबद्ध कीजिये।
उत्तर:
सल्फर भू-पर्पटी में लगभग 0.03 - 0.1% की मात्रा में पाया जाता है। संयुक्त अवस्था में यह निम्न रूपों में प्राप्त होता है:
(A) सल्फेट (Sulphates)
- जिप्सम - CaSO4 .2H2O
- एप्सम लवण-MgSO4,.7H2O
- बेराइट-BaSO4
(B) सल्फाइड (Sulphides)
- गैलेना (Pbs)
- जिंक ब्लैण्ड (ZnS)
- पाइराइट (CuFes)
(C) कार्बनिक पदार्थों में जैसे-अण्डे, प्रोटीन, प्याज, लहसुन, बाल, फर, सरसों के तेल आदि में भी सल्फर उपस्थित होता है। ज्वालामुखी में यह सल्फर HS गैस के रूप में उपस्थित होता है।
प्रश्न 14.
वर्ग-16 के तत्वों के हाईड्राइडों के तापीय स्थायित्व के क्रम को लिखिये।
उत्तर:
H2O > H2S > H2Se > H2Te > H2PO
(तापीय स्थायित्व) नीचे जाने पर (वर्ग में) तापीय स्थायित्व कम होता जाता है क्योंकि तत्वों का आकार बढ़ता जाता है फलस्वरूप E - H बन्ध वियोजन ऊर्जा का मान घट जाता है और E - H बन्ध आसानी से टूट जाते हैं।

प्रश्न 14.
वर्ग-16 के तत्वों के हाईड्राइडों के तापीय स्थायित्व के क्रम को लिखिये।
उत्तर:
H2O > H2S > H2Se > H2Te > H2PO
(तापीय स्थायित्व) नीचे जाने पर (वर्ग में) तापीय स्थायित्व कम होता जाता है क्योंकि तत्वों का आकार बढ़ता जाता है फलस्वरूप E - H बन्ध वियोजन ऊर्जा का मान घट जाता है और E - H बन्ध आसानी से टूट जाते हैं।
प्रश्न 15.
HO एक द्रव तथा HS गैस क्यों है ?
उत्तर:
हाइड्रोजन बंध की उपस्थिति के कारण H2O द्रव तथा HAS गैस है। ऑक्सीजन के छोटे आकार एवं उच्च विद्युत ऋणात्मकता के कारण H2O में अन्तराआण्विक बंध उपस्थित रहते हैं जिसके कारण कमरे के ताप पर यह द्रव अवस्था में पाया जाता है। जबकि सल्फर का आकार बड़ा तथा विद्युत ऋणात्मकता कम होने के कारण यह हाइड्रोजन बन्ध नहीं बना पाता है इसके कारण कमरे के ताप पर यह गैस प्रावस्था में पाया जाता है।
प्रश्न 16.
निम्नलिखित में से कौन-सा तत्व ऑक्सीजन के साथ सीधे अभिक्रिया नहीं करता है।
Zn, Ti, Pt, Fe
उत्तर:
Pt, यह एक उत्कृष्ट धातु है तथा इसकी आयनन एन्थैल्पी का मान अधिक होता है अत: यह सीधे ऑक्सीजन से संयोग नहीं करती है। दूसरी ओर, Zn, Ti एवं Fe सक्रिय धातुयें हैं ये ऑक्सीजन से सीधे संयोग करके संगत ऑक्साइड बनाती हैं।
प्रश्न 17.
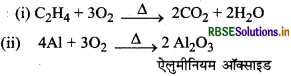
निम्नलिखित अभिक्रियाओं को पूर्ण कीजिये।
(i) CH + O2 →
(ii) AI + O2 →
उत्तर:
प्रश्न 18.
O2 एक प्रबल ऑक्सीकारक की तरह क्यों क्रिया करती है ?
उत्तर:
O2 आसानी से नवजात ऑक्सीजन (Nascent oxygen) उत्पन्न करती है। इसलिये यह प्रबल ऑक्सीकारक की तरह क्रिया 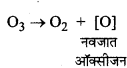
प्रश्न 19.
O3 का मात्रात्मक आकलन कैसे किया जाता है?
उत्तर:
जब ओजोन, बोरेट बफर (उभय प्रतिरोधी) (pH 9.2) युक्त उभय प्रतिरोधित पोटैशियम आयोडाइड विलयन के आधिक्य से अभिक्रिया करती है तो आयोडीन मुक्त होती है जिसका मानक सोडियम थायोसल्फेट विलयन के साथ अनुमापन किया जा सकता है। यह O3 गैस के आकलन की मात्रात्मक विधि है।

प्रश्न 20.
तब क्या होता है जब सल्फर डाइ-ऑक्साइड को Fe(III) लवण के जलीय विलयन में से प्रवाहित करते हैं?
उत्तर:
SO2, आयरन (III) लवण के जलीय विलयन को आयरन (II) लवण में अपचयित कर देता है। यहाँ SO2, अपचायक की भाँति कार्य करता है।
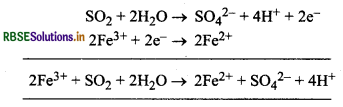
प्रश्न 21.
दो S - 0 आबन्धों की प्रकृति पर टिप्पणी कीजिये जो SO2 अणु बनाते हैं। क्या SO2 अणु के ये दोनों S - 0 आबन्ध समतुल्य हैं?
उत्तर:
SO2 में दोनों S - 0 आबन्ध सह-संयोजक होते हैं तथा SO2 की संरचना में अनुनाद पाया जाता है जिसके कारण SO2, के दोनों S - 0 आबन्ध समतुल्य होते हैं अर्थात् SO2 की अनुनादी संरचना के कारण इसके दोनों S - 0 आबन्ध समान होते हैं।

प्रश्न 22.
SO2 की उपस्थिति का पता कैसे लगाया जा सकता है?
उत्तर:
SO2 की गन्ध तीक्ष्ण होती है तथा निम्न परीक्षणों द्वारा हम इसकी उपस्थिति पता कर सकते हैं।
(i) यह गुलाबी-बैंगनी रंग के अम्लीय KMnO4 विलयन को रंगहीन कर देती है।
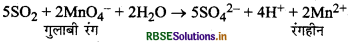
(ii) यह अम्लीकृत नारंगी रंग के K2Cr2O7 विलयन को हरे रंग में परिवर्तित कर देती है।
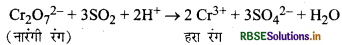
प्रश्न 23.
उन तीन क्षेत्रों का उल्लेख कीजिये जिनमें H2SO4 महत्वपूर्ण भूमिका निभाता है।
उत्तर:
- पेट्रोलियम शोधन में
- सीसा संचायक बैटरियों में
- उर्वरकों जैसे-अमोनियम सल्फेट, सुपर फॉस्फेट आदि के बनाने में।
प्रश्न 24.
संस्पर्श प्रक्रम द्वारा H2SO4 की मात्रा में वृद्धि करने के लिये आवश्यक परिस्थितियों को लिखिये।
उत्तर:
संस्पर्श प्रक्रम द्वारा H2SO4 की मात्रा में वृद्धि करने के लिये आवश्यक परिस्थितियाँ निम्न हैं
चूँकि H2SO4 की अधिक मात्रा बनाने के लिये so, का अधिक मात्रा में उत्पादन जरूरी है। SO3 का उत्पादन निम्न अभिक्रिया द्वारा होता है।
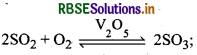
अभिक्रिया ऊष्माक्षेपी एवं उत्क्रमणीय है एवं अग्र अभिक्रिया में आयतन में कमी आती है अतः
- (i) कम ताप अर्थात् 720K उच्च लब्धि के लिये आवश्यक है।
- उच्च दाब अर्थात् 2 बार उच्च लब्धि के लिये आवश्यक है।
- उत्प्रेरक V2O5 की उपस्थिति एवं गैसों का धूल के कणों एवं आर्सेनिक यौगिकों जैसी अन्य अशुद्धियों से मुक्त होना उच्च लब्धि के लिये आवश्यक है।
प्रश्न 25.
जल में H2SO4 के लिये Ka2 << Ka1, क्यों है?
उत्तर:
H2SO4 एक द्विक्षारीय अम्ल है इस कारण यह दो पदों में आयनित होता है एवं इसके दो वियोजन स्थिरांक Ka1 एवं Ka2 होते हैं।
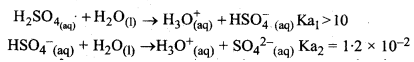
उपर्युक्त वियोजनों में Ka1 का अधिक मान यह दर्शाता है कि H2SO4 जल में एक प्रबल अम्ल है इस कारण यह HSO4- आयन में ज्यादा वियोजित होता है जबकि HSO4- आयन का जल में वियोजन लगभग नगण्य है। अत: Ka2 << Ka1

प्रश्न 26.
आबन्ध वियोजन एन्थैल्पी, इलेक्ट्रॉन लब्धि एन्थैल्पी तथा जलयोजन एग्थैल्पी जैसे प्राचलों को महत्व देते हुये F2 तथा Cl2 की ऑक्सीकारक क्षमता की तुलना कीजिये।
उत्तर:
एक इलेक्ट्रॉन तत्काल प्रतिग्रहण कर लेने की प्रवृत्ति के कारण हैलोजनों की प्रबल ऑक्सीकारक प्रकृति होती है। F2 प्रबलतम ऑक्सीकारक हैलोजन है यह दूसरे हैलाइड आयनों को विलयन में या यहाँ तक कि ठोस, प्रावस्था में भी ऑक्सीकृत कर देती है।
F2 + 2x- → 2F + X2 (X = CI, Br तथा 1)
Cl2 की ऑक्सीकारक क्षमता F2 की तुलना में कम होती है। फ्लोरीन का इलेक्ट्रोड विभव (+ 2.87 V) है जो कि क्लोरीन (+ 1:36 V) की तुलना में उच्च होता है। इसलिये F, प्रबल ऑक्सीकारक है। इलेक्ट्रोड विभव निम्न प्राचलों पर निर्भर करता है:
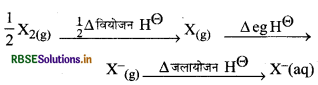
|
|
∆ वियोजन H° |
∆eqH |
∆ जलयोजन H° |
|
फ्लुओरीन |
158.8kJ/mol |
-333 kJ/mol |
515kJ/mol |
|
क्लोरीन |
242.6kJ/mol |
- 349 kJ/mol |
381kJ/mol |
अतः उपरोक्त मानकों से यह सिद्ध होता है कि F2 एक प्रबल ऑक्सीकारक है।
प्रश्न 27.
दो उदाहरणों द्वारा फ्लुओरीन के असामान्य व्यवहार को दर्शाइये।
उत्तर:
फ्लुओरीन का असामान्य व्यवहार निम्न कारणों से होता है:
- लघु आकार
- कम F - F आबन्ध वियोजन एन्थैल्पी
- उच्च विद्युत ऋणात्मकता
- संयोजी कोश में d - कक्षकों की अनुपलब्धता।
असामान्य व्यवहार के उदाहरण:
- HF प्रबल हाइड्रोजन बन्धों की उपस्थिति के कारण द्रव होता है, जबकि अन्य हाइड्रोजन हैलाइड गैस होते हैं।
- फ्लुओरीन केवल एक ऑक्सोअम्ल बनाती है जबकि अन्य अधिक संख्या में ऑक्सोअम्ल बनाते हैं।
प्रश्न 28.
समुद्र कुछ हैलोजनों का मुख्य स्रोत है। टिप्पणी कीजिये।
उत्तर:
समुद्र के जल में मैग्नीशियम, कैल्शियम, सोडियम तथा पोटैशियम के क्लोराइड, ब्रोमाइड एवं आयोडाइड पाए जाते हैं, जिनमें सोडियम क्लोराइड (द्रव्यमान अनुसार 2.50%) प्रमुख है। समुद्री जमाव में सोडियम क्लोराइड तथा कार्नेलाइट KCI MgCl2 6H2O प्रमुख हैं। कुछ समुद्री जीवधारियों के तन्त्र में आयोडीन पाई जाती है। कुछ समुद्री खरपतवारों (लेमिनेरिया प्रजाति) में 0.5% आयोडीन तथा चिली साल्टपीटर में 0.2% सोडियम आयोडेट होता है।

प्रश्न 29.
Cl2 की विरंजक क्रिया का कारण बताइए।
उत्तर:
Cl2 की विरंजक क्रिया ऑक्सीकरण के कारण होती है। नमी अथवा जलीय विलयन की उपस्थिति में Cl2 नवजात ऑक्सीजन मुक्त करती है।

यह नवजात ऑक्सीजन वनस्पतियों तथा कार्बनिक द्रव्यों में उपस्थित रंगीन पदार्थों का ऑक्सीकरण करके रंगहीन पदार्थ देती है।
रंगीन पदार्थ + [0] → रंगहीन पदार्थ
अत: Cl2 की विरंजक क्रिया ऑक्सीकरण के कारण होती है।
प्रश्न 30.
उन दो विषैली गैसों के नाम बताइए जो क्लोरीन गैस से बनाई जाती हैं।
उत्तर:
फॉस्जीन (COCl2) तथा मस्टर्ड गैस
\(\left(\mathrm{ClCH}_2 \mathrm{CH}_2 \mathrm{SCH}_2 \mathrm{CH}_2 \mathrm{Cl}\right) \text { }\)
प्रश्न 31.
I2 से ICI अधिक क्रियाशील क्यों है?
उत्तर:
I2 से ICI अधिक क्रियाशील होता है। क्यों कि 1 - 1 आबन्ध से I - CI आबन्ध दुर्बल होता है। परिणामस्वरूप ICI सरलता से टूटकर हैलोजेन परमाणु देता है जो तीव्रता से अभिक्रिया करते हैं।
प्रश्न 32.
हीलियम को गोताखोरी के उपकरणों में उपयोग क्यों किया जाता है?
उत्तर:
हीलियम की रुधिर में कम विलेयता के कारण इसे गोताखोरी के उपकरणों में उपयोग करते हैं। यह ऑक्सीजन के तनुकारी के रूप में उपयोग की जाती है।
प्रश्न 33.
निम्नलिखित समीकरण को सन्तुलित कीजिये।
XeF6 + H2O → XeO2F2 + HF
उत्तर: XeF6 + 2H2O → XeO2F2 + 4HF

प्रश्न 34.
रेडॉन के रसायन का अध्ययन करना कठिन क्यों था?
उत्तर:
रेडॉन एक रेडियोएक्टिव तत्व है जिसका अर्द्ध-आयु काल अत्यन्त कम होता है। इसलिये रेडॉन के रसायन का अध्ययन करना कठिन था।
RBSE Class 12 Chemistry p-ब्लॉक के तत्व Textbook Questions and Answers
प्रश्न 1.
वर्ग-15 के तत्वों के सामान्य गुणधर्मों की उनके इलेक्ट्रॉनिक विन्यास, ऑक्सीकरण अवस्था, परमाण्विक आकार, आयनन एन्थैल्पी तथा विद्युत ऋणात्मकता के संदर्भ में विवेचना कीजिये।
उत्तर:
इलेक्ट्रॉनिक विन्यास (Electronle Configuration): तत्वों के बाड़ा संयोजी कोश का इलेक्ट्रॉनिक विन्यास ns2np3 होता है। इनके संयोजी कोश में 5 इलेक्ट्रॉन होते हैं।
\(\begin{aligned} &{ }_7 \mathrm{~N} \rightarrow[\mathrm{He}] 2 s^2, 2 p^3 \\ &{ }_{15} \mathrm{P} \rightarrow[\mathrm{Ne}] 3 s^2, 3 p^3 \\ &{ }_{33} \mathrm{As} \rightarrow[\mathrm{Ar}] 3 d^{10}, 4 s^2 4 p^3 \\ &{ }_{51} \mathrm{As} \rightarrow[\mathrm{Kr}] 4 d^{10}, 5 s^2 5 p^3 \\ &{ }_{83} \mathrm{Bi} \rightarrow[\mathrm{Xe}] 4 f^{14}, 5 d^{10}, 6 s^2 6 p^3 \end{aligned}\)
परमाणुएवं आयनिक त्रिज्या (Atomileand IomleRadi): वर्ग में ऊपर से नीचे आने पर अर्थात् परमाणु क्रमांक बढ़ने के साथ-साथ परमाणु त्रिज्या बढ़ती है क्योंकि कोशों की संख्या बढ़ती जाती है।
N < P < As < Sb < Bi (परमाणु त्रिज्या)
समूह -15 के तत्वों की परमाण्वीय त्रिज्या, समूह-14 के संगत तत्वों की अपेक्षा छोटी होती है क्योंकि आवर्त में बायें से दायें जाने पर प्रभावी नाभिकीय आवेश बढ़ता जाता है।
आयनिक त्रिज्या के मान में भी ऊपर से नीचे जाने पर क्रमशः वृद्धि होती है, यह किसी एक विशेष अवस्था में होती है। (अर्थात् या तो सभी धनायन हों या फिर सभी ऋणायन हों) N3- < P3- < As3- < Sb3+ < Bi3- (आयनिक त्रिज्या)
आयनन ऐन्चैल्पी (Ioniantim Enthalpy): समूह-15 के तत्वों की आयनन ऐन्थैल्पी का मान समूह-14 के संगत तत्वों की अपेक्षा अधिक होता है क्योंकि आवर्त सारणी में बायें से दायें जाने पर प्रभावी नाभिकीय आवेश का मान बढ़ता जाता है फलस्वरूप आकार छोटा हो जाता है और बाह्यतम इलेक्ट्रॉन पर नाभिक का आकर्षण बल बढ़ जाता है। इस कारण से आयनन ऐन्थैल्पी का मान बढ़ जाता है।
समूह-15 के तत्वों की प्रथम आयनन ऐन्थैल्पी का मान समूह-16 के संगत तत्वों की अपेक्षा भी अधिक होता है, इसका कारण यह है कि समूह-15 के तत्वों में p-उपकोश आधा भरा होता है (np3) जो कि एक स्थायी विन्यास है, जिसमें इलेक्ट्रॉन निकालने के लिये अधिक ऊर्जा की आवश्यकता होती है।
समूह-14 < समूह-15 > समूह-16 (प्रथम आयनन ऐन्थैल्पी) समूह-15 में, विभिन्न आयनन एन्थैल्पियों का आपेक्षित क्रम निम्न होता है।

विद्युत्-ऋणात्मकता (Electronegativity): समूह में नीचे आने पर विद्युत्-ऋणात्मकता का मान धीरे-धीरे घटता जाता है क्योंकि परमाण्वीय त्रिज्या का मान बढ़ता जाता है।
N > P > As > Sb > Bi(विद्युत्-ऋणात्मकता)
ऑक्सीकरण अवस्थाएँ (Oxidation State): वर्ग-15 के तत्वों की सामान्य ऑक्सीकरण अवस्थाएँ -3, + 3 तथा + 5 हैं। परमाणु आकार तथा धातु गुणों में वृद्धि के कारण वर्ग में नीचे की ओर जाने पर -3 ऑक्सीकरण अवस्था प्रदर्शित करने की प्रवृत्ति घटती है। इसी कारण संभवत Bi का कोई भी ऐसा यौगिक ज्ञात नहीं हैं जिसमें Bi की ऑक्सीकरण अवस्था -3 हो। नाइट्रोजन के छोटे आकार तथा उच्च विधुत ऋणता के कारण यह -3 ऑक्सीकरण अवस्था दर्शाता है। वर्ग में ऊपर से नीचे की ओर जाने पर +5 ऑक्सीकरण अवस्था का स्थायित्व घटता है।
बिस्मथ (V) का एकमात्र यौगिक BiF5 है। वर्ग में नीचे की ओर + 5 ऑक्सीकरण अवस्था के स्थायित्व में कमी तथा + 3 ऑक्सीकरण अवस्था (अक्रिय युगल प्रभाव के कारण) के स्थायित्व में वृद्धि होती है। + 5 ऑक्सीकरण अवस्था के अलावा ऑक्सीकरण के साथ अभिक्रिया करने पर नाइट्रोजन + 1, + 2, + 4 ऑक्सीकरण अवस्थाएँ भी प्रदर्शित करती है। फास्फोरस के कुछ ऑक्सी अम्लों में + 1 तथा + 4 ऑक्सीकरण अवस्था दर्शाता है।
प्रश्न 2.
नाइट्रोजन की क्रियाशीलता फॉस्फोरस से भिन्न क्यों।
उत्तर: नाइट्रोजन अणु द्विपरमाणुक होता है। जिसमें नाइट्रोजन परमाणु त्रिबन्ध द्वारा (N = N) जुड़े रहते हैं। इसकी बन्ध वियोजन ऊर्जा का मान काफी अधिक (941.4 kJ/mol) होता है। इसके कारण नाइट्रोजन अक्रिय अथवा अक्रियाशील होती है। श्वेत अथवा पीला फॉस्फोरस चतुष्परमाण्विक अणु (Pa) होता है। इसमें P - P एकल आबन्ध पाये जाते हैं जिनकी बंध वियोजन ऊर्जा का मान काफी कम होता है। इस कारण फॉस्फोरस नाइट्रोजन से अत्यधिक क्रियाशील होता है।

प्रश्न 3.
वर्ग-15 के तत्वों की रासायनिक क्रियाशीलता की प्रवृत्ति की विवेचना कीजिए।
उत्तर:
विद्युत्-ऋणात्मकता (Electronegativity): समूह में नीचे आने पर विद्युत्-ऋणात्मकता का मान धीरे-धीरे घटता जाता है क्योंकि परमाण्वीय त्रिज्या का मान बढ़ता जाता है।
N > P > As > Sb > Bi(विद्युत्-ऋणात्मकता)
प्रश्न 4.
NH3 हाइड्रोजन बंध बनाती है, परन्तु PH3 नहीं बनाती, क्यों?
उत्तर:
नाइट्रोजन की विद्युत ऋणात्मकता अधिक व आकार छोटा होने के कारण नाइट्रोजन हाइड्रोजन बन्ध बनाती है परन्तु PH3 नहीं बनाती है।
प्रश्न 5.
प्रयोगशाला में नाइट्रोजन कैसे बनाते हैं। अभिक्रिया के रासायनिक समीकरण लिखें।
उत्तर:
प्रयोगशाला विधि (Laboratory Method):
प्रयोगशाला में नाइट्रोजन अमोनियम नाइट्राइट को गर्म करके प्राप्त की जाती है। अमोनियम नाइट्राइट को हम अमोनियम क्लोराइड तथा सोडियम नाइट्राइट के सममोलर विलयन को मिलाकर प्राप्त कर सकते है।
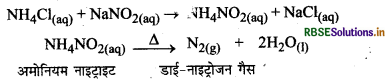
प्रश्न 6.
अमोनिया का उत्पादन कैसे किया जाता है?
उत्तर:
अमोनिया का उत्पादन हेबर प्रक्रम से किया जाता है।
\(\mathrm{N}_{2(\mathrm{~g})}+3 \mathrm{H}_{2(\mathrm{~g})} \rightleftharpoons 2 \mathrm{NH}_{3(\mathrm{~g})}\)
∆f H° = -46.6 KJ/mol
उच्च लब्धि की शर्ते:
- उच्च दाब (200 से 300 वायुमण्डल)
- कम ताप (723 से 773 K तक)
- Al2O3 मिश्रित आयरन उत्प्रेरक की उपस्थिति
- उत्पाद को समय-समय पर निकालते रहना।
प्रश्न 7.
उदाहरण देकर समझाइये कि कॉपर धातु HNO3 के साथ अभिक्रिया करके किस प्रकार भिन्न उत्पाद दे सकती है?
उत्तर:
कॉपर धातु की नाइट्रिक अम्ल से क्रिया:
(i) तनु नाइट्रिक अम्ल से क्रिया
3Cu+ 8HNO → 3Cu (NO3)2 + 4H2O + 2NO↑
तनु
(ii) सान्द्र नाइट्रिक अम्ल से क्रिया
Cu + 4HNO3 → Cu (NO3)2 + 2H2O + 2NOS↑
सान्द्र
प्रश्न 8.
NO2 तथा N2O5 की अनुनादी संरचनाओं को लिखिये।
उत्तर:
(i) NO2 की अनुनादी संरचनायें
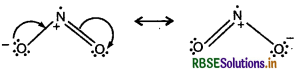
(ii) N2O5 की अनुनादी संरचनायें
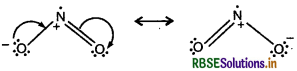
प्रश्न 9.
HNH कोण का मान HPH, HASH, तथा HSbH कोणों की अपेक्षा अधिक क्यों है?
उत्तर:
इन हाइड्राइडों में केन्द्रीय परमाणु sp3 संकरित होता है. जिसमें तीन sp संकरित कक्षकों में से तीन E - H सिग्मा बन्ध का निर्माण करते हैं तथा चौथे sp3 संकरित कक्षक में एक एकाकी इलेक्ट्रॉन युग्म उपस्थित होता है।
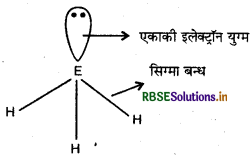
यहाँ बन्धयुग्म-बन्धयुग्म प्रतिकर्षण बल से एकाकी युग्म-बन्धयुग्म प्रतिकर्षण बल अधिक होते हैं। इस कारण NH3 के कोण का मान घटकर 107.8° रह जाता है। समूह में नीचे जाने पर केन्द्रीय परमाणु का आकार बढ़ता है परन्तु विद्युत ऋणात्मकता कम हो जाती है। इस कारण इलेक्ट्रॉन घनत्व पर इकाई आयतन का मान कम होता जाता है तथा प्रतिकर्षण बल के कम हो जाने से बन्ध कोण के मान में भी कमी आ जाती है।
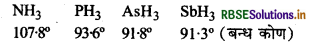
प्रश्न 10.
R3 P = 0 पाया जाता है जबकि R3N = O नहीं, क्यों (R = ऐल्किल समूह)?
उत्तर:
नाइट्रोजन में d - कक्षकों की अनुपस्थिति के कारण यह pπ बहुल बन्ध बनाने में असमर्थ है। इस कारण नाइट्रोजन अपनी सह-संयोजकता का विस्तार चार से अधिक नहीं कर सकता है, परन्तु फॉस्फोरस में dπ कक्षकों की उपस्थिति के कारण यह अपनी सह-संयोजकता को विस्तारित कर सकता है। चूंकि R3N = O में नाइट्रोजन की सह-संयोजकता 5 है अत: यह नहीं पाया जाता है जबकि फॉस्फोरस में d - कक्षकों की उपस्थिति के कारण R3P = O का बनना सम्भव है।
प्रश्न 11.
समझाइये कि क्यों NH3 क्षारकीय है जबकि BH3 केवल दुर्बल क्षारक है।
उत्तर:
नाइट्रोजन का आकार फॉस्फोरस की तुलना में अत्यधिक कम होता है, तथा इसकी विद्युत ऋणात्मकता भी काफी अधिक होती है इस कारण नाइट्रोजन परमाणु पर इलेक्ट्रॉन घनत्व पर इकाई आयतन का मान काफी अधिक होता है। परिणामस्वरूप NH3 में नाइट्रोजन की अपने इलेक्ट्रॉन युग्म को दान देने की प्रवृत्ति बढ़ जाती है और यह ज्यादा क्षारकीय हो जाता है। जबकि BiH3 में Bi पर कम इलेक्ट्रॉन घनत्व पर इकाई आयतन होने के कारण यह दुर्बल क्षारक होता है।
प्रश्न 12.
नाइट्रोजन द्विपरमाणुक अणु के रूप में पाया जाता है तथा फॉस्फोरस P4 के रूप में। क्यों?
उत्तर:
नाइट्रोजन का आकार छोटा तथा विद्युत ऋणात्मकता उच्च होती है। इस कारण यह Pπ - Pπ बहुल बन्ध बनाने में सक्षम होता है और द्विपरमाणुक अणु के रूप में पाया जाता है। जबकि फॉस्फोरस का आकार बड़ा तथा विद्युत ऋणात्मकता कम होती है जिस कारण यह Pπ - Pπ बहुल बन्ध बनाने में असमर्थ होता है और यह P - P एकल बन्ध बनाकर P4 के रूप में पाया जाता है।
प्रश्न 13.
श्वेत फॉस्फोरस तथा लाल फॉस्फोरस के गुणों की मुख्य भिन्नताओं को लिखिए।
उत्तर:
|
गुण |
श्वेत फॉस्फोरस |
लाल फॉस्फोरस |
|
अवस्था |
श्वेत फॉस्फोरस |
लाल फॉस्फोरस |
|
गन्ध |
मोमीय ठोस श्वेत, प्रकाश में रखन पर पीला पड़ जाता है। |
भंगुर पदार्थ |
|
कठोरता |
लहसुन जैसी गन्ध मोम जैसा मृदु तथा चाकू से काटा जा सकता है। |
गन्धहीन कठोर |
|
विषैली |
विषैला |
विषैला नहीं |
|
प्रकृति |
CS2 में विलेय |
होता |
|
विलेयता |
317K |
CS2 में अविलेय 563Kपर कर्वपातित हो जाता है तथा 43 वायु-मण्डलीय दाब एवं 862K पर पिघल जाता है |
|
गलनांक |
1.80 |
2.10 |
|
क्रियाशी |
अति क्रियाशील |
कम क्रियाशील |
|
लता |
क्लोरीन में तीव्रता से जल कर PCl3 तथा PCI3 बनाता है। |
गर्म करने पर केवल Cl2 से जुड़ जाता है |
|
क्लोरीन की क्रिया |
श्वेत फॉस्फोरस |
लाल फॉस्फोरस |
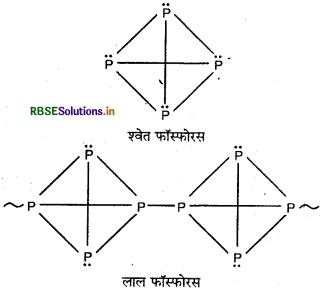
प्रश्न 14.
फॉस्फोरस की तुलना में नाइट्रोजन श्रृंखलन गुणों को कम,प्रदर्शित करती है, क्यों?
उत्तर:
शृंखलन का गुण तत्व की बन्ध ऊर्जा पर निर्भर करता है। जिसकी बन्ध ऊर्जा का मान जितना कम होता है उसमें शृंखलन का गुण उतना ही अधिक होता है। चूंकि P - P बन्ध ऊर्जा का मान N - N बन्ध ऊर्जा की तुलना में कम होता है अतः फॉस्फोरस अधिक शृंखलन प्रदर्शित करता है जबकि नाइट्रोजन कम।

प्रश्न 15.
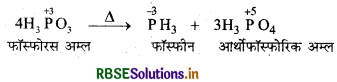
H3PO3 की असमानुपातन अभिक्रिया दीजिये।
उत्तर:
H3PO3 की असमानुपातन अभिक्रिया:
प्रश्न 16.
क्या PCl5 ऑक्सीकारक एवं अपचायक दोनों का कार्य कर सकता है? तर्क दीजिये।
उत्तर:
कोई यौगिक ऑक्सीकारक की तरह तब कार्य करता है जब उसकी ऑक्सीकरण संख्या के मान में कमी आती है अर्थात् वह इलेक्ट्रॉन को ग्रहण कर सके। यौगिक अपचायक की तरह तब कार्य करता है जब उसकी ऑक्सीकरण संख्या के मान में वृद्धि होती है अर्थात् वह इलेक्ट्रॉन का दान कर सके। चूँकि PCl5 में फॉस्फोरस की ऑक्सीकरण संख्या + 5 है एवं इसके संयोजी कोश में 5 इलेक्ट्रॉन होते हैं, इसलिये यह इलेक्ट्रॉन का दान करके अपनी ऑक्सीकरण संख्या को + 5 से अधिक नहीं कर सकता है इस कारण PCl5 अपचायक का कार्य नहीं करता परन्तु यह इलेक्ट्रॉन को ग्रहण करके अपनी ऑक्सीकरण संख्या को + 5 से + 3 कर सकता है अतः यह ऑक्सीकारक का कार्य आसानी से कर सकता है।
उदाहरण: (i) टिन का ऑक्सीकरण
Sn + 2PCl5 → SnCl4 + 2PCl3
(ii) सिल्वर का ऑक्सीकरण
2Ag + PCl5 → 2AgCl + PCl3
प्रश्न 17.
O, S, Se, Te तथा Po को इलेक्ट्रॉनिक विन्यास, ऑक्सीकरण अवस्था तथा हाइडाइड निर्माण के संदर्भ में आवर्त सारणी के एक ही वर्ग में रखने का तर्क दीजिये।
उत्तर:
(i) इलेक्ट्रॉनिक विन्यास (Electronic Configuration): O, S, Se, Te तथ Po सभी का संयोजी कोश का इलेक्ट्रॉनिक विन्यास ns4 np4 होता है। अतः सभी को एक ही वर्ग में रखना तर्क संगत है।
8O → [He] 2s2 2p4
16S → [Ne] 3S2 3p4
34Se → [Ar] 3d10, 4S2, 4p4
52Te → [Kr] 4d10 5S2 5p4
84Po → [Xe] 4f14, 5d10, 6S2 6p4
(ii) ऑक्सीकरण अवस्था (Oxidation State): इन्हें समीपवर्ती अक्रिय गैस विन्यास प्राप्त करने के लिए दो अतिरिक्त इलेक्ट्रॉनों की आवश्यकता पड़ती है, इसलिए इन तत्वों की न्यूनतम ऑक्सीकरण अवस्था-2 होनी चाहिए। ऑक्सीजन विशिष्ट रूप से तथा सल्फर कुछ मात्रा में विद्युतऋणात्मक होने के कारण -2 ऑक्सीकरण अवस्था प्रदर्शित करते हैं। इस वर्ग के अन्य तत्व, O तथा S से कम विद्युत ऋणात्मक होने के कारण ऋणात्मक ऑक्सीकरण अवस्था प्रदर्शित नहीं करते हैं। इन तत्वों के संयोजी कोश में 6 इलेक्ट्रॉन होते हैं। इसलिए ये तत्व अधिकतम + 6 ऑक्सीकरण अवस्था प्रदर्शित कर सकते हैं। इन तत्वों द्वारा प्रदर्शित अन्य धनात्मक ऑक्सीकरण अवस्थाएँ + 2 तथा + 4 हैं। यद्यपि ऑक्सीजन कक्षकों की अनुपस्थिति के कारण + 4 तथा + 6 ऑक्सीकरण अवस्थाएँ प्रदर्शित नहीं करती; अत: न्यूनतम तथा अधि कतम ऑक्सीकरण अवस्थाओं के आधार पर इन तत्वों को समान वर्ग अर्थात् वर्ग 16 में रखा जाना तर्क संगत है।
(iii) हाईड्राइडों का निर्माण (Formation of hydrides): सभी तत्व अपने संयोजी इलेक्ट्रॉनों में से दो इलेक्ट्रॉनों की हाइड्रोजन के 1S- कक्षक के साथ सहभागिता करके अपने-अपने अष्टक पूर्ण कर लेते हैं तथा सामान्य सूत्र EH2 के हाइड्राइड बनाते हैं; जैसे - H2O, H2S, H2Se, H2Te तथा H2PO, इसलिए सामान्य सूत्र EH2 वाले हाइड्राइड बनाने के आधार पर इन तत्वों को समान वर्ग अर्थात् वर्ग 16 में रखा जाना पूर्णतया न्यायोचित है।

प्रश्न 18.
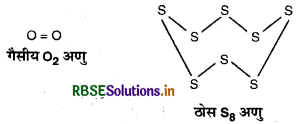
क्यों डाइ-ऑक्सीजन एक गैस है, जबकि सल्फर एक ठोस है?
उत्तर:
ऑक्सीजन का आकार छोटा एवं उच्च विद्यत ऋणात्मकता होने के कारण यह Pπ - Pπ बहुल बन्ध का निर्माण करती है। इस कारण यह द्विपरमाणुक अणु (O2) के रूप में पायी जाती है। चूंकि O2 के अणु परस्पर दुर्बल वाण्डरवाल्स आकर्षण बलों द्वारा जुड़े रहते हैं तथा यह आकर्षण बल सरलता से हट जाता है अत: O2 कमरे के ताप पर गैसीय अवस्था में पायी जाती है।
सल्फर का आकार बड़ा तथा कम विद्युत ऋणात्मकता के कारण यह Pπ - Pπ बहुल बन्ध का निर्माण नहीं करता है तथा अपने d - कक्षकों की सहायता से एकल बन्ध का निर्माण करता है। चूंकि S - S बन्ध ऊर्जा कम होती है इस कारण यह श्रृंखलन करके S8 अणुओं के रूप में ठोस प्रावस्था में पाया जाता है।
प्रश्न 19.
यदि O → O- तथा O → O2- के इलेक्ट्रॉन लब्धि एन्थैल्पी मान पता हो, जो क्रमशः 141 तथा 702 kJ mol-1 है, तो आप कैसे स्पष्ट कर सकते हैं कि 0-स्पीशीज वाले ऑक्साइड अधिक बनते हैं न कि O- वाले?
उत्तर:
ऑक्सीजन के द्वारा किसी धातु से अभिक्रिया करने पर निम्न प्रकार के यौगिकों का निर्माण होता है।
(i) M2O
(ii) MO
(iii) MO2
उपरोक्त यौगिकों के निर्माण में निम्न पद सम्मिलित होते हैं
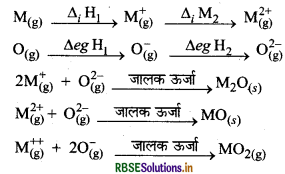
हम जानते हैं कि ∆iH1 की तुलना में ∆iH2 का मान काफी अधिक होता है तथा ∆egH1 की तुलना में ∆egH2 का मान धनात्मक होता है परन्तु जब MO तथा MO2 यौगिकों का निर्माण होता है तो MO के प्रत्येक आयन पर आवेश अधिक होने के कारण इससे प्राप्त होने वाली जालक ऊर्जा MO2 से प्राप्त होने वाली जालक ऊर्जा की तुलना में काफी उच्च होती हैं। अत: ऊष्मीय रूप से MO का निर्माण MO2 से अधिक अनुकूल होता है। इस कारण ऑक्सीजन O2- स्पीशीज वाले ऑक्साइड अधिक बनाता है न कि स्पीशीज वाले ऑक्साइड।
प्रश्न 20.
कौन से एरोसोल्स ओजोन पर्त का क्षय करते हैं?
उत्तर:
फ्रीऑन जैसे-क्लोरोफ्लोरो कार्बन (CFCs) ऐरोसोल्स पराबैंगनी विकिरणों (Ultraviolet rays) की उपस्थिति में CI मुक्त मूलकों का निर्माण करते हैं जो कि ओजोन परत को अवक्षयित कर देते हैं। ये मुक्त मूलक O3 को O2 में परिवर्तित कर देते हैं। यहाँ होने वाली अभिक्रियायें निम्न हैं:
प्रश्न 21.
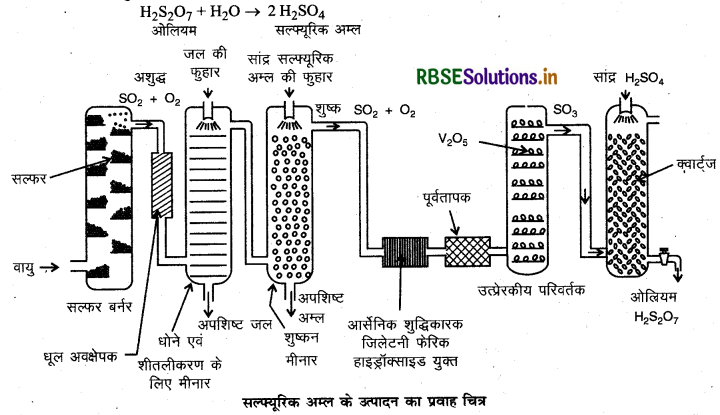
संस्पर्श प्रक्रम द्वारा H2SO4 के उत्पादन का वर्णन कीजिये। उत्तर-संस्पर्श प्रक्रम द्वारा H2SO4 का उत्पादन-इस प्रक्रिया में निम्न पद होते हैं:
(i) सल्फर अथवा सल्फाइड अयस्कों को वायु में जलाकर सल्फर डाई-ऑक्साइड का उत्पादन करना।
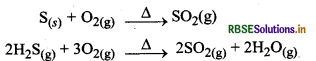
(ii) उत्प्रेरक V2O5 की उपस्थिति में ऑक्सीजन के साथ अभिक्रिया कराकर SO2 का SO3 में परिवर्तन करना।
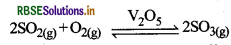
∆rH° = - 196.6 KJ/mol
उपरोक्त अभिक्रिया उष्माक्षेपी एवं उत्क्रमणीय है एवं अग्न अभिक्रिया में आयतन में कमी आती है। अत: कम ताप (720K) तथा उच्च दाब (2 बार) उच्च लब्धि के लिये उपयुक्त स्थितियाँ हैं। इसके अलावा अभिक्रिया V2O5 उत्प्रेरक की उपस्थिति में होती है।
(iii) SO3 को सल्फ्यूरिक अम्ल में अवशोषित करके ओलियम (H2S2O7) प्राप्त करना।
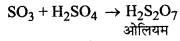
ओलियम जल द्वारा ओलियम का तनुकरण करके वांछित सान्द्रता वाला सल्फ्यूरिक अम्ल प्राप्त कर लिया जाता है।
प्रश्न 22.
SO2 किस प्रकार से एक वायु प्रदूषक है?
उत्तर:
SO2 एक तीखी गंध वाली रंगहीन गैस है। इसका प्रमुख हानिकारक प्रभाव श्वसन तन्त्र पर पड़ता है। यदि इसका स्तर वायु में SO2 तक हो जाये तो इससे त्वचा पर जलन उत्पन्न होती है। धुयें के साथ निकलने वाली SO2 हमारी श्वास नलियों के मार्ग को अवरुद्ध कर देती है जिससे दमा, घुटन, एवं श्वास की बीमारी होने लगती है। यह पौधों के लिये भी हानिकारक होती है। SO2 गैस के अल्प स्तर (0.03Ppm) की उपस्थिति में पत्तियों के ऊतक नष्ट हो जाते हैं तथा पत्तियों के किनारे भी क्षतिग्रस्त हो जाते हैं। SO2 के कारण अम्ल वर्षा होती है जो कि पौधों, नदियों, तालाबों, संगमरमर की इमारतों आदि को नुकसान पहुँचाती है।

प्रश्न 23.
हैलोजन प्रबल ऑक्सीकरण अभिकर्मक क्यों होते हैं?
उत्तर:
हैलोजनों की उच्च विद्युत ऋणात्मकता अधिक ऋणात्मक इलेक्ट्रॉन लब्धि एन्थैल्पी एवं कम आबन्ध वियोजन एन्थैल्पी के कारण इलेक्ट्रॉन ग्रहण कर अपचयित होने की प्रवृत्ति अधिक होती है। ये एक इलेक्ट्रॉन को ग्रहण कर संगत अक्रिय गैसों के इलेक्ट्रॉनिक विन्यास को ग्रहण कर लेते हैं।
X(g) + e- + X-(g)
इलेक्ट्रॉन ग्रहण करने की उच्च प्रवृत्ति के कारण ये प्रबल ऑक्सीकारक या ऑक्सीकरण अभिकर्मक (oxidising agent) होते हैं। इनकी ऑक्सीकरण क्षमता समूह में नीचे जाने पर कम होती है। अत: F2 प्रबलतम एवं I2 दुर्बलतम ऑक्सीकारक होता है।
प्रश्न 24.
स्पष्ट कीजिये कि फ्लुओरीन केवल एक ही ऑक्सोअम्ल HOF क्यों बनाता है?
उत्तर:
फ्लुओरीन की विद्युत ऋणात्मकता अधिक तथा आकार छोटा होने के कारण यह केवल एक ही ऑक्सो अम्ल HOF बना पाता है जबकि अन्य हैलोजन चार प्रकार के ऑक्सो अम्ल बनाते हैं इनके सामान्य सूत्र HOX, HOXO, HOXO2, HOXO3 होते हैं। जिसमें ऑक्सीकरण अवस्थायें + 1, + 3, +5, +7 हैं। फ्लु ओरीन केवल - 1 ऑक्सीकरण अवस्था ही प्रदर्शित करता है इस कारण भी यह केवल एक ऑक्सो अम्ल HOF बनाता है।
प्रश्न 25.
व्याख्या कीजिये कि लगभग एक समान विद्युत ऋणात्मकता होने के पश्चात् भी ऑक्सीजन हाइड्रोजन आबन्ध निर्मित करता है जबकि क्लोरीन नहीं।
उत्तर:
ऑक्सीजन तथा क्लोरीन दोनों की विद्युत ऋणात्मकता समान होने के पश्चात् भी ऑक्सीजन हाइड्रोजन आबन्ध निर्मित करता है, जबकि क्लोरीन नहीं, क्योंकि क्लोरीन का आकार ऑक्सीजन की तुलना में काफी अधिक होता है। फलस्वरूप क्लोरीन के प्रति एकांक आयतन पर इलेक्ट्रॉन घनत्व ऑक्सीजन की तुलना में काफी कम हो जाता है।
प्रश्न 26.
CIO2 के दो उपयोग लिखिये।
उत्तर:
CIO2 के दो उपयोग
- यह एक उत्कृष्ट विरंजक होता है इसका विरंजक चूर्ण क्लोरीन से लगभग 30 गुना अधिक शक्तिशाली होता है।
- यह एक शक्तिशाली ऑक्सीकारक एवं क्लोरीनीकारक होता है। इसका उपयोग वुडपल्प (woodpulp) एवं सेलुलोज के विरंजन में होता है।
प्रश्न 27.
हैलोजन रंगीन क्यों होते हैं?
उत्तर:
सभी हैलोजन रंगीन होते हैं। इसका कारण यह है कि दृश्य प्रक्षेत्र में विकिरणों का अवशोषण होता है तथा बाह्यतम कोश के इलेक्ट्रान उत्तेजित होकर उच्च ऊर्जा स्तर में चले जाते हैं। विकिरण के भिन्न-भिन्न क्वाण्टम अवशोषित करने के कारण वे अलग-अलग रंग प्रदर्शित करते हैं जैसे-फ्लुओरीन पीला, क्लोरीन हरापन लिये हुये पीला, ब्रोमीन लाल तथा आयोडीन बैंगनी रंग का होता है।

प्रश्न 28.
जल के साथ F2 तथ Cl2 की अभिक्रियायें लिखिये।
उत्तर:
(i) F2 प्रबल ऑक्सीकारक होने के कारण H2O को O2 या O3 में ऑक्सीकृत कर देता है।
\(\begin{aligned} &2 \mathrm{~F}_2(g)+2 \mathrm{H}_2 \mathrm{O}(l) \rightarrow 4 \mathrm{H}^{+}(a q)+4 \mathrm{~F}^{-}(a q)+\mathrm{O}_2(g) \\ &3 \mathrm{~F}_2(g)+3 \mathrm{H}_2 \mathrm{O}(l) \rightarrow 6 \mathrm{H}^{+}(a q)+6 \mathrm{~F}^{-}(a \bar{a})+\mathrm{O}_3(g) \end{aligned}\)
(ii) Cl2 जल से अभिक्रिया करके हाइड्रोक्लोरिक अम्ल तथा हाइपोक्लोरस अम्ल बनाती है।

प्रश्न 29.
आप HCI से CI2 तथा Cl2 से HCI को कैसे प्राप्त करेंगे? केवल अभिक्रियाएँ लिखिए।
उत्तर:
HCI को Cl2 में अनेक ऑक्सीकारकों; जैसे - MnO2, KMnO4 तथा K2Cr2O7 द्वारा ऑक्सीकृत किया जा सकता है।
MnO2 + 4HCl → MnCl + Cl2↑ + 2H2O
Cl2 का HCl में अपचयन सूर्य के मन्द प्रकाश में H2 की अभिक्रिया से होता है।

प्रश्न 30.
नील-बार्टलेट Xe तथा PtF6 के बीच अभिक्रिया कराने के लिए कैसे प्रेरित हुए?
उत्तर:
नील बार्टलेट ने प्रेक्षित किया कि PtF6 की अभिक्रिया O2 से होने पर एक आयनिक ठोस O2+ [PtF6]- प्राप्त होता है।
O2(g) + PtF6(g) → O2+ [PtF6] यहाँ O2, PtF6 द्वारा O2+ में ऑक्सीकृत हो जाता है। बार्टलेट ने पाया कि Xe की प्रथम आयनन एन्थैल्पी (1170 kJ mol-1) O2 अणुओं की प्रथम आयनन एन्थैल्पी (1175 J moFI) के समान है, इसलिए PF द्वारा Xe को Xet में ऑक्सीकृत करना चाहिए। इस प्रकार वे Xe तथा PF के बीच अभिक्रिया कराने के लिए प्रेरित हुए। जब Xe तथा PF को मिश्रित किया गया, तब एक तीव्र अभिक्रिया हुई तथा सूत्र xet PtF6 का एक लाल ठोस पदार्थ प्राप्त हुआ।

प्रश्न 31.
निम्नलिखित में फॉस्फोरस की ऑक्सीकरण अवस्थाएँ क्या हैं?
(i) H3PO3
(ii) PCl3
(iii) Ca3P2
(iv) Na3PO4
(v)POF3
उत्तर:
(i) 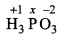
3 x (+1)+ x + 3 x (-2) = 0
+ 3 + x - 6 = 0
x = +3
(ii) 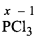
x + 3 x (-1) = 0
x - 3 = 0
x = + 3
(ii) 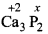
3 x (+2) + 2 x x = 0
+6+ 2x = 0
2x = -6
X = -3
(iv) 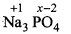 3 x (+1) + x + 4 x (- 2) = 0
3 x (+1) + x + 4 x (- 2) = 0
+ 3 + x - 8 = 0
X - 5 = 0
x = +5
(v) 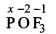
x + (-2) + 3 X (-1) = 0
X - 5 = 0
x = +5
प्रश्न 32.
निम्नलिखित के लिये सन्तुलित समीकरण लिखिये:
(i) जब NaCI को MnO2 की उपस्थिति में सान्द्र सल्फ्यूरिक अम्ल के साथ गर्म किया जाता है।
(ii) जब क्लोरीन गैस को Nal के जलीय विलयन में से प्रवाहित किया जाता है।
उत्तर:
(i) क्लोरीन गैस उत्पन्न होती है।
4NaCl + MnO2 + 4H2SO4 → MnCl2 + 4NaHSO4 + Cl2↑+ 2H2O
(ii) क्लोरीन गैस Nal को I2 में ऑक्सीकृत कर देती है।
Cl2 + 2Nal → 2NaCl + I2
प्रश्न 33.
जीनॉन फ्लु ओराइड XeF2, XeF4, तथा XeF6 कैसे बनाये जाते हैं?
उत्तर:
(i) XeF2 का विरचन (Preparation of XeF2)
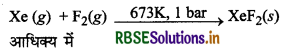
(ii) XeF4 का विरचन (Preparation of XeF4)
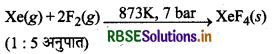
(iii) XeF6 का विचरन (Preparation of XeF6)
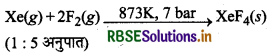
(b) XeF6 को हम XeF4 तथा O2F2 के मध्य क्रिया कराकर भी बना सकते हैं।
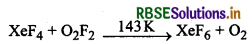
प्रश्न 34.
किस उदासीन अणु के साथ ClO- समइलेक्ट्रॉनी है? क्या यह अणु लूइस क्षारक है?
उत्तर:
CIO- में 17 + 8 + 1 = 26 इलेक्ट्रॉन उपस्थित हैं। 26 इलेक्ट्रॉनों वाला उदासीन अणु CIF = 17 + 9 = 26 इलेक्ट्रॉन हैं। चूँकि यह फ्लु ओरीन से संयोग कर CIF3 बनाता है अतः यह लूइस क्षारक है।
प्रश्न 35.
निम्नलिखित प्रत्येक समुच्चय को सामने लिखे गुणों के अनुसार सही क्रम में व्यवस्थित कीजिये
(क) F2, Cl2, Br2, I- आबंध वियोजन एन्थैल्पी बढ़ते क्रम
(ख) HF, HCl, HBr, HI- अम्ल सामर्थ्य बढ़ते क्रम में
(ग) NH3, PH3 ASH3, SbH3, BiH3, क्षारक सामर्थ्य बढ़ते क्रम
उत्तर:
(क) I2 < F2 < Br2 < Cl (आबंध वियोजन एन्थैल्पी का बढ़ता क्रम)
समूह में नीचे जाने पर आकार बढ़ता है जिसके कारण आबन्ध दूरी बढ़ती है तथा आबन्ध वियोजन एन्थैल्पी कम होती है। इस कारण से CI से I तक आबन्ध वियोजन एन्थैल्पी के मान में कमी आती है। परन्तु F का आकार अत्यधिक छोटा होता है एवं इस पर तीन एकाकी युग्म उपस्थित होते हैं जिनके कारण प्रतिकर्षण बल उत्पन्न होता है और F - F आबन्ध वियोजन एन्थैल्पी का मान कम हो जाता है।
(ख) HF < HCl < HBr < HI (अम्ल सामर्थ्य)
अम्ल सामर्थ्य वियोजन एन्थैल्पी पर निर्भर करता है चूँकि F से I तक परमाणु का आकार बढ़ता जाता है इसके कारण H - X आबन्ध वियोजन एन्थैल्पी घटती जाती है और अम्ल सामर्थ्य बढ़ जाती है क्योंकि H+ आयन विस्थापित करने का गुण बढ़ जाता है।
(ग) BiH < SbHI < ASH3 < PH3 < NH3 (क्षारक सामर्थ्य)
जिस यौगिक की एकाकी इलेक्ट्रॉन युग्म को देने की प्रवृत्ति जितनी ज्यादा होती है उसकी क्षारक सामर्थ्य भी उतनी अधिक होती है। चूंकि समूह में नीचे जाने पर तत्वों का आकार बढ़ जाता है फलस्वरूप इलेक्ट्रॉन घनत्व प्रति एकांक आयतन का मान कम हो जाता है और इलेक्ट्रॉन त्यागने की शक्ति भी कम हो जाती है।
अतः समूह में नीचे जाने पर क्षारक सामर्थ्य कम हो जाती है। NH3 सबसे प्रबलतम क्षार है।

प्रश्न 36.
निम्नलिखित में से कौन-सा एक अस्तित्व में नहीं है?
(a) XeOF4
(b)NeF2
(c) XeF2
(d) XeF6
उत्तर:
NeF2 अस्तित्व में नहीं है क्योंकि Ne की प्रथम एवं द्वितीय आयनन एन्थैल्पियों का मान काफी अधिक होता है।
प्रश्न 37.
उस उत्कृष्ट गैस स्पीशीज का सूत्र देकर संरचना की व्याख्या कीजिये जो कि इनके साथ समसंरचनीय है
(a)ICI4- (b) IBr2- (c) BrO3-
उत्तर:
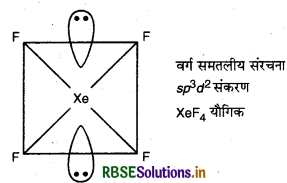
(i) ICL में 36 [7 + (4 x 7) + 1] संयोजी इलेक्ट्रॉन होते हैं तथा इसी प्रकार उत्कृष्ट गैस की एक स्पीशीज XeF4 में भी 36 संयोजी इलेक्ट्रॉन होते हैं। ICI4- में sp3d2 संकरण होता है जो कि XeF4 में भी पाया जाता है। अत: ICI4- के साथ समसंरचनीय उत्कृष्ट गैस स्पीशीज XeF4 है।
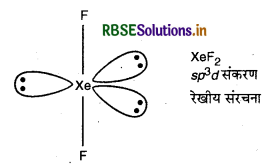
(ii) IBr2- में 22 (7 + (2 x 7) + 1) संयोजी इलेक्ट्रॉन होते हैं तथा इसी प्रकार उत्कृष्ट गैस के XeF2 यौगिक में भी 22 संयोजी इलेक्ट्रॉन होते हैं। XeF2 में sp3d संकरण पाया जाता है। इसी प्रकार IBr2- में भी XeF2 है। इसकी संरचना रेखीय होती है।
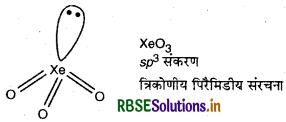
(iii) BrO3- में 26 (7 + (3 x 6) + 1) संयोजी इलेक्ट्रॉन पाये जाते हैं। 26 इलेक्ट्रॉनों वाली उत्कृष्ट गैस स्पीशीज XeO3 होती है। उसी प्रकार XeO3 में भी sp3 संकरण होता है। अत: BrO3- के समसंरचनीय उत्कृट गैस स्पीशीज XeO3 है। इसकी संरचना त्रिकोणीय पिरॅमिडीय होती है।
प्रश्न 38.
उत्कृष्ट गैस के परमाण्विक आकार तुलनात्मक रूप से बड़े क्यों होते हैं?
उत्तर:
उत्कृष्ट गैस के परमाण्विक आकार अर्थात् उनकी परमाण्विक त्रिज्या अपने आवर्त में सर्वाधिक होती है। उत्कृष्ट गैसों की त्रिज्या का अनुमापन वान्डर वाल्स त्रिज्या के द्वारा किया जाता है, उत्कृष्ट गैसें अणु नहीं बनाती हैं। जबकि अन्य तत्वों की त्रिज्या का अनुमापन सह-संयोजक त्रिज्याओं द्वारा किया जाता है। चूँकि वान्डरवाल्स त्रिज्यायें सह-संयोजक त्रिज्याओं की अपेक्षा बड़ी होती हैं अतः उत्कृष्ट गैसों का आकार बड़ा होता है।
प्रश्न 39.
निऑन तथा ऑर्गन गैसों के उपयोग सूचीबद्ध कीजिये।
उत्तर:
निऑन का उपयोग (Uses of Neon):
- निऑन के बल्बों का उपयोग वनस्पति उद्यान (Botanical Garden) तथा ग्रीन हाउस में किया जाता है।
- निऑन का उपयोग विसर्जन ट्यब तथा प्रदीप्त बल्बों में विज्ञापन प्रदर्शन हेतु किया जाता है।
ऑर्गन का उपयोग (Uses of Argon):
- इसका उपयोग विद्युत बल्ब को भरने में करते हैं।
- प्रयोगशाला में इसका उपयोग वायु सुग्राही पदार्थों के प्रबन्धन में भी किया जाता है।
- ऑर्गन का उपयोग उच्च ताप धातुकर्मीय प्रक्रमों में अक्रिय वातावरण उत्पन्न करने के लिये किया जाता है।
- इसका उपयोग धातुओं एवं उपधातुओं की आर्क वेल्डिंग में किया जाता है।

- RBSE Class 12 Chemistry Notes Chapter 16 दैनिक जीवन में रसायन
- RBSE Class 12 Chemistry Notes Chapter 15 बहुलक
- RBSE Class 12 Chemistry Notes Chapter 14 जैव-अणु
- RBSE Class 12 Chemistry Notes Chapter 13 ऐमीन
- RBSE Class 12 Chemistry Notes Chapter 12 ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
- RBSE Class 12 Chemistry Notes Chapter 11 ऐल्कोहॉल, फीनॉल एवं ईथर
- RBSE Class 12 Chemistry Notes Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
- RBSE Class 12 Chemistry Notes Chapter 9 उपसहसंयोजन यौगिक
- RBSE Class 12 Chemistry Notes Chapter 8 d- एवं f-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम