RBSE Solutions for Class 12 Chemistry Chapter 5 पृष्ठ रसायन
Rajasthan Board RBSE Solutions for Class 12 Chemistry Chapter 5 पृष्ठ रसायन Textbook Exercise Questions and Answers.
Rajasthan Board RBSE Solutions for Class 12 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 12. Students can also read RBSE Class 12 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 12 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 12 Chemistry Solutions Chapter 5 पृष्ठ रसायन
RBSE Class 12 Chemistry पृष्ठ रसायन InText Questions and Answers
प्रश्न 1.
रसोवशोषण के दो अभिलक्षण लिखिए।
उत्तर:
रसोवशोषण के दो अभिलक्षण निम्न हैं:
1. उच्च विशिष्टता-यह अत्यन्त विशिष्ट होता है। इसकी उत्पत्ति तभी होती है जब अधिशोषक एवं अधिशोष्य के मध्य रासायनिक बन्ध बनता है।
उदाहरण: H2 गैस का Pt या Pd की सतह पर अधिशोषण।
2. अनुक्रमणीयता (Reversibility): इसकी प्रकृति अनुत्क्रमणीय होती है। रसोवशोषण एक ऊष्माक्षेपी प्रक्रम है परन्तु उच्च सक्रियण ऊर्जा के कारण निम्न तापों पर यह धीमा होता है। ताप बढ़ने पर यह प्रक्रिया बढ़ती है। 'या प्रश्न-जलीय विलयनों के विद्युत - अपघटन में प्रायः प्लैटिनम एवं पैलेडियम जैसे पदार्थ क्यों प्रयुक्त किये जाते हैं?
जलीय विलयनों के विद्युत अपघटन में प्रायः प्लैटिनम एवं पैलेडियम जैसे पदार्थ निम्न कारणों से प्रयुक्त किये जाते हैं:
- Pt तथा Pd की हाइड्रोजन गैस का अधिशोषण करने की क्षमता अत्यधिक होती है। H2 जो कि Pt तथा Pd की सतह पर अधिशोषित होती है, कई अभिक्रियाओं में उत्प्रेरक का कार्य करती हैं।
- Pt तथा Pd रासायनिक दृष्टि से अक्रिय होते हैं।
प्रश्न 2.
ताप बढ़ने पर भौतिक अधिशोषण क्यों घटता है?
उत्तर:
भौतिक अधिशोषण एक ऊष्माक्षेपी प्रक्रम होता है, अतः ताप बढ़ाने पर अधिशोषण घट जाता है। इसके साथ - साथ भौतिक अधिशोषण में अधिशोषक एवं अधिशोष्य के मध्य कमजोर वाण्डर वाल्स बल होते हैं जो कि ताप बढ़ाने पर टूट जाते हैं। अतः ताप बढ़ने पर भौतिक अधिशोषण कम हो जाता है।

प्रश्न 3.
अपने क्रिस्टलीय रूपों की तुलना में चूर्णित पदार्थ अधिक प्रभावी अधिशोषक क्यों होते हैं?
उत्तर:
अधिशोषण एक प्रकार की पृष्ठीय परिघटना है। चूर्णित पदार्थों का पृष्ठीय क्षेत्रफल उनके क्रिस्टलीय रूपों से अधिक होता है। इस कारण से चूर्णित पदार्थों में अधिशोषण क्षमता उनके क्रिस्टलीय रूपों की तुलना में अधिक होती है।
उदाहरण: चूर्णित चारकोल, सिलिका जेल, मिट्टी, सूक्ष्म विभाजित धातुएँ आदि अच्छे अधिशोषक होते हैं।
प्रश्न 4.
अमोनिया प्राप्त करने के लिए हेबर प्रक्रम में CO को हटाना क्यों आवश्यक है?
उत्तर:
अमोनिया प्राप्त करने के लिए हेबर प्रक्रम में CO को हटाना इसलिए आवश्यक है यदि CO हाइड्रोजन गैस के साथ उपस्थित होती है तो वह Fe (लोहा) उत्प्रेरक के लिए विष (Catalytic poison) का कार्य करती है और Fe की क्रियाशीलता को बहुत कम कर देती है।
प्रश्न 5.
एस्टर का जल-अपघटन प्रारम्भ में धीमा एवं कुछ समय पश्चात् तीन क्यों हो जाता है?
उत्तर:
एस्टर के जल-अपघटन की अभिक्रिया निम्न प्रकार है:
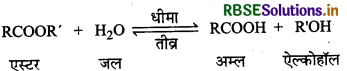
ऐल्कोहॉल उपर्युक्त अभिक्रिया में अम्ल स्वउत्प्रेरक का कार्य करता है। अतः जैसे ही इसका निर्माण होता है वैसे ही अभिक्रिया तीव्र हो जाती है।
प्रश्न 6.
उत्प्रेरण के प्रक्रम में विशोषण की क्या भूमिका है?
उत्तर:
उत्प्रेरण के प्रक्रम में अभिक्रिया उत्प्रेरक की सतह पर पूर्ण होती है। अभिक्रिया के दौरान जो उत्पाद बनते हैं वे विशोषण के परिणामस्वरूप सतह से पृथक्कृत हो जाते हैं। जब उत्पाद उत्प्रेरक की सतह से हट जाते हैं तो सतह फिर से अभिक्रिया के लिए उपलब्ध हो जाती है।

प्रश्न 7.
आप हार्डी-शुल्जे नियम में संशोधन के लिए क्या सुझाव दे सकते हैं?
उत्तर:
हार्डी-शुल्जे नियम में यह संशोधन हो सकता है कि जब ऊर्णन शक्तियों की तलना की जाती है तो कोलॉइडी कणों के आवेश को उदासीन करने वाले आयनों की कोलॉइडी कणों के पृष्ठों पर अधिशोषित होने की प्रवृत्तियों में बहुत अधिक अन्तर नहीं होना चाहिए।
प्रश्न 8.
अवक्षेप का मात्रात्मक आकलन करने से पूर्व जल से धोना आवश्यक क्यों है?
उत्तर:
अवक्षेप को छानते समय कुछ विद्युत-अपघट्य जो कि विलयन में उपस्थित होते हैं, अवक्षेप की सतह पर अधिशोषित हो जाते हैं जो कि मात्रात्मक आकलन करते समय सही आकलन नहीं होने देते, अत: आकलन करने से पूर्व यह अत्यन्त आवश्यक है कि अवक्षेप को जल से धो लिया जाए।
RBSE Class 12 Chemistry पृष्ठ रसायन Textbook Questions and Answers
प्रश्न 1.
अधिशोषण एवं अवशोषण शब्दों (पदों) के तात्पर्य में विभेद कीजिये। प्रत्येक का एक उदाहरण भी दीजिये।
उत्तर:
|
अधिशोषण |
अवशोषण |
|
1. यह एक पृष्ठ पर होने वाला प्रक्रम है जिसमें अधिशोष्य अणु अधिशोषक की सतह पर चिपक जाते हैं। |
1. यह सम्पूर्ण स्थल में होने वाला प्रक्रम है। |
|
2 अधिशोष्य की सान्द्रता, अधिशोषक की सतह पर स्थूल की तुलना में अधिक होती |
2 इस प्रक्रम में पदार्थ ठोस के सम्पूर्ण स्थूल में एकसमान वितरित होता है, अर्थात् सम्पूर्ण स्थूल में पदार्थ की सान्द्रता एकसमान होती है। |
|
3. अधिशोषण की परिघटना प्रारम्भ में तीव्र तथा साम्य प्राप्त होने तक धीमे - धीमे घटती जाती है। |
3. अवशोषण की परिघटना एकसमान दर से अन्त तक होती है। |
|
4. उदाहरण-H, गैस का Pt एवं Pd की सतह पर - अधिशोषण, सिलिका जेल की सतह पर जल- वाष्प का अधिशोषण। |
4. उदाहरण-निर्जलीय CaCl द्वारा जलवाष्प का अवशोषण। |
प्रश्न 2.
भौतिक अधिशोषण एवं रासायनिक अधिशोषण में क्या अन्तर है?
उत्तर:
सर्वप्रथम 1835 में वर्जीलियस ने देखा कि बाह्य पदार्थों की उपस्थिति में रासायनिक अभिक्रियाओं के वेग में परिवर्तन आ जाता है। उदाहरणार्थपोटैशियम क्लोरेट का तापीय अपघटन मैंगनीज डाइ ऑक्साइड की उपस्थिति में कम ताप पर आसानी से हो जाता है लेकिन मैंगनीज डाइ ऑक्साइड अभिक्रिया में भाग नहीं लेता और न ही उसके द्रव्यमान में कोई परिवर्तन होता है। न उत्प्रेरक की अनुपस्थिति

अत: "वे पदार्थ जो रासायनिक अभिक्रिया के वेग को परिवर्तित कर देते हैं तथा अभिक्रिया के अन्त में उनके द्रव्यमान तथा संघटन में कोई अन्तर नहीं आता है, उत्प्रेरक (Catalysts) कहलाते हैं तथा यह क्रिया उप्रेरण (Catalysis) कहलाती है।" वर्धक एवं विषकारक उत्प्रेरक [Catalytic Promoters and Poison or Inhibitor)
उत्प्रेरक वर्धक (Catalytic Promoters): जब कोई बाहरी पदार्थ किसी उत्प्रेरण क्रिया में प्रयुक्त उत्प्रेरक की उत्प्रेरण सक्रियता को बड़ा देते हैं, किन्तु स्वयं अभिक्रिया के लिए उत्प्रेरक नहीं होते हैं, ऐसे पदार्थ उत्प्रेरक उत्साहक या उत्प्रेरक वर्धक कहलाते हैं।
उदाहरण:
(i) हैबर विधि से अमोनिया के निर्माण में आयरन का चूर्ण एक उत्प्रेरक का कार्य करता है जबकि Mo यहाँ उत्प्रेरक वर्धक का कार्य करता है।
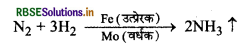
(ii) तेलों के हाइड्रोजनीकरण में Ni एक उत्प्रेरक का कार्य करता है। तथा यदि हम को मिला दें तो यह उत्प्रेरक वर्धक का कार्य करता है।
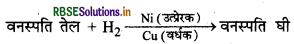
कारण: उत्प्रेरक वर्धक, उत्प्रेरक की सतह पर सक्रिय केन्द्रों की संख्या को बढ़ा देता है जिसके कारण अभिक्रिया द्वारा उत्पाद बनने की दर बढ़ जाती है।
उत्प्रेरक विष (Catalytic Poison or Inhibitor): वे पदार्थ जो उत्प्रेरक की अभिक्रियाशीलता या सक्रियता को कम या नष्ट कर देते हैं, उत्प्रेरक विष (Catalytic Poisons orInhibitors) कहलाते हैं।
उदाहरण:
(i) हैबर विधि में यदि हाइड्रोजन गैस के साथ CO उपस्थित हो| तो ये लोहे की क्रियाशीलता को कम कर देती है अर्थात् Co लोहे के लिए उत्प्रेरक विष का कार्य करती है।
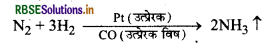
(ii) इसी तरह SO2 के ऑक्सीकरण में आर्सेनिक ऑक्साइड उत्प्रेरक विष का कार्य करते हैं।
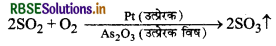
कारण यहाँ पर उत्प्रेरक विष, उत्प्रेरक की सतह पर विद्यमान सक्रिय केन्द्रों पर संयुक्त हो जाते हैं जिसके कारण सतह मुक्त नहीं हो पाती है और अभिकारक, उत्प्रेरक की सतह पर संयुक्त नहीं होते हैं। इस प्रकार अभिकारकों का अधिशोषण कम हो जाता है। इसी कारण उत्प्रेरण क्रिया में प्रयुक्त उत्प्रेरक की क्रियाशीलता नष्ट या बहुत कम हो जाती है। फलस्वरूप अभिक्रिया उत्पाद बनने की दर कम हो जाती है।
उत्प्रेरक के कुछ अन्य प्रकार (Some other Types of Catalyst):
(1) धनात्मक उत्प्रेरक (Positive Catalyst): वे उत्प्रेरक जो रासायनिक अभिक्रिया के वेग को बढ़ा देते हैं, धनात्मक उत्प्रेरक कहलाते
उदाहरण:
(i) पोटैशियम क्लोरेट के तापीय अपघटन में MnO2 धनात्मक उत्प्रेरक का कार्य करता है।
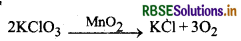
(ii) SO2 के ऑक्सीकरण में Pt धनात्मक उत्प्रेरक का कार्य करता है।
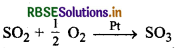
(iii) हेबर प्रक्रम में Fe धनात्मक उत्प्रेरक होता है।
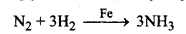
धनात्मक उत्प्रेरक की उपस्थिति में अभिक्रिया की सक्रियण ऊर्जा का मान घट जाता है इस कारण अभिक्रिया का वेग बढ़ जाता है।
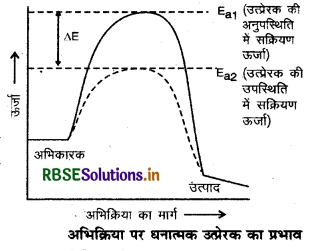
(2) त्राणात्मक उप्रेरक (Negative Catalyst): वे उत्प्रेरक जो रासायनिक अभिक्रिया के वेग को कम कर देते हैं, ऋणात्मक उत्प्रेरक कहलाते हैं।
उदाहरण:
(i) ग्लिसरॉल की उपस्थिति में हाइड्रोजन परॉक्साइड की अपघटन की दर कम हो जाती है। यही कारण है कि HO, को संग्रहीत करने के लिए उसमें कुछ मात्रा में ग्लिसरॉला डाल दिया जाता है।

(ii) सल्फर यौगिकों की बहुत कम मात्रा से बैन्जेल्डिहाइड का स्वतः ऑक्सीकरण रुक जाता है।
(iii) पेट्रोल के अपस्फोटन (Knocking) को कम करने के लिये उसमें प्राय: टेट्राएथिल लैड को मिला दिया जाता है।
(iv) सोडियम सल्फाइट का वायु द्वारा ऑक्सीकरण ग्लिसरीन की उपस्थिति में रुक जाता है। इसमें ग्लिसरीन ऋणात्मक उत्प्रेरक है।
ऋणात्मक उत्प्रेरक की उपस्थिति में सक्रियण ऊर्जा का मान बढ़ जाता है। इस कारण अभिक्रिया का वेग घट जाता है।
(3) स्वतः उत्प्रेरक (Auto catalyst): जब किसी रासायनिक क्रिया में बना उत्पाद स्वयं उस अभिक्रिया के लिये उत्प्रेरक का कार्य करता है अर्थात् अभिक्रिया के वेग को बढ़ा देता है तो वह पदार्थ स्वतः उत्प्रेरक (Auto catalyst) कहलाता है।
उदाहरण:
(i) एस्टर का जल-अपघटन प्रारम्भ में मन्दगति से होता है तथा कुछ समय पश्चात् अपघटन का वेग बढ़ जाता है क्योंकि यहाँ एस्टर के जल-अपघटन से प्राप्त ऐसीटिक अम्ल अभिक्रिया में स्वतः उत्प्रेरक का कार्य करता है।
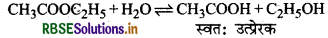
(ii) अम्लीकृत पोटैशियम परमैंगनेट द्वारा ऑक्सेिलिक अम्ल के, ऑक्सीकरण की क्रिया से बने मैंगनीज आयन (Mn1) स्वत: उप्रेरक का कार्य करता है। जैसे-जैसे मैंगनीज आयन बनने जाते हैं वैसे-वैसे अभिक्रिया की दर भी बढ़ती जाती है।
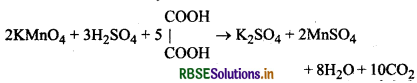
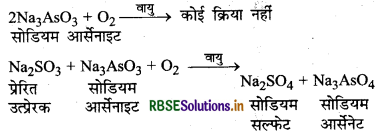
(4) प्रेरित उत्प्रेरक (Induced Catalyst): कुछ अभिक्रियाएँ ऐसी होती हैं जिसमें उत्प्रेरक के रूप में कोई भी पदार्थ नहीं मिलाया जाता है। परन्तु अभिक्रिया का वेग उसके साथ होने वाली दूसरी अभिक्रिया के प्रेरण से तीव्र हो जाता है। इस स्थिति को प्रेरित उत्प्रेरण तथा अभिक्रिया को प्रेरित उत्प्रेरक कहा जाता है।
उदाहरण:
सोडियम सल्फाइट (Na2SO3) वायु में ऑक्सीकृत हो जाता है परन्तु सोडियम आर्सेनाइड (Na2SO3) ऑक्सीकृत नहीं होता है। दोनों को साथ मिलाने पर दोनों ही ऑक्सीकृत हो जाते हैं क्योंकि सोडियम सल्फाइट का ऑक्सीकरण, सोडियम आर्सेनाइट के ऑक्सीकरण को उत्प्रेरित कर देता है। अत: यहाँ सोडियम सल्फाइट प्रेरित उत्प्रेरक का कार्य करता है।


प्रश्न 3.
कारण बताइए कि सूक्ष्म विभाजित पदार्थ अधिक प्रभावी अधिशोषक क्यों होता है?
उत्तर:
अधिशोषण एक पृष्ठ या सतह पर होने वाला प्रक्रम है। चूँकि सूक्ष्म विभाजित पदार्थों का पृष्ठीय क्षेत्रफल अधिक होता है अत: उनकी अधिशोषण क्षमता भी अधिक होती है। इसी कारण अधिशोषण सूक्ष्म विभाजित पदार्थ पर अधिक प्रभावी होता है।
उदाहरणार्थ: चारकोल, मिट्टी, सिलिका जेल, सूक्ष्म विभाजित धातुएँ आदि अच्छी अधिशोषक होती हैं, जब वे चूर्ण रूप में होती हैं।
प्रश्न 4.
किसी ठोस पर गैस के अधिशोषण को प्रभावित करने वाले कारक कौन-से हैं?
उत्तर:
किसी ठोस के पृष्ठ पर गैस के अधिशोषण को निम्नलिखित कारक प्रभावित करते हैं:
- ताप
- दाब
- गैस की प्रकृति
- अधिशोषक का पृष्ठीय क्षेत्रफल
- अधिशोषक की सक्रियता।
प्रश्न 5.
अधिशोषण समतापी वन क्या है? फ्रॉयन्डलिक अधिशोषण समतापी वक्र का वर्णन कीजिए।
उत्तर:
अधिशोषण समतापी वक्र (Adsorption Isotherm Curve): अधिशोषक के प्रति ग्राम में अधिशोषित गैस की मात्रा तथा स्थिर ताप पर अधिशोष्य (गैस) के दाब के मध्य खींचा गया वक्र अधिशोषण समतापी वक्र (Adsorption Isotherm Curve) कहलाता है।
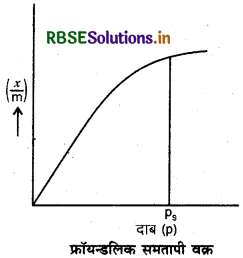
फ्रॉयन्डलिक अधिशोषण समतापी वक्र (FreundlichAdsorption Isotherm Curve): बनाये गये वक्र में 'x' अधिशोषित गैस का द्रव्यमान, 'm' अधिशोषक का द्रव्यमान, 'p' दाब है।
pS वह संतृप्त दाब है जिसके ऊपर दाब बढ़ाने पर भी अधिशोषण का मान नहीं बढ़ता है।
वक्र के अनुसार,
(i) कम दाब पर, \(\frac{x}{m} \propto p^1\)
या
\(\frac{x}{m}=k p^1\) (k = नियतांक)
अर्थात् कम दाब पर, दाब बढ़ाने पर \(\frac{x}{m}\) का मान भी बढ़ता जाता
(ii) अधिक दाब पर,
\(\begin{aligned} &\frac{x}{m} \propto p^0 \\ &\frac{x}{m}=k \end{aligned}\)
अर्थात् अधिक दाब पर \(\frac{x}{m}\) का मान दाब पर निर्भर नहीं करता है।
(ii) मध्यम दाब पर, \(\frac{x}{m}\) जहाँ n > 1
या
\(\frac{x}{m} \alpha p^{1 / n}\)
उपर्युक्त समीकरण का log लेने पर,
log \(\frac{x}{m}\) = logk+ 1/n = log p
यह समीकरण फ्रॉयन्डलिक समतापी वक्र समीकरण कहलाता है। इस समीकरण की वैधता आलेख के द्वारा प्रदर्शित की जा सकती है।
आलेख मैं log को Y - अक्ष (कोटि) एवं logp को x-अक्ष (भुज) पर लेकर प्रमाणित कर सकते हैं।
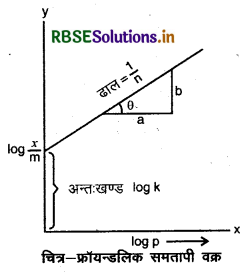
दिया गया वक्र - का मान 0 और 1 के मध्य दर्शाता है और फ्रॉयन्डलिक के समतापी वक्र की व्याख्या करता है।
प्रश्न 6.
अधिशोषक के सक्रियण से आप क्या समझते हैं? यह कैसे प्राप्त किया जा सकता है?
उत्तर:
अधिशोषक की क्षमता को बढ़ाना अधिशोषक का सक्रियण कहलाता है। प्रायः अधिशोषक की क्षमता पृष्टीय क्षेत्रफल को बढ़ाकर बढ़ाई जाती है। पृष्ठीय क्षेत्रफल निम्न विधियों के द्वारा बड़ाया जा सकता
- अधिशोषक को बारीक चूर्ण के रूप में पीसकर।
- अधिशोषक की सतह को खुरदरा बनाकर।
- अधिशोषित गैसों को अधिशोषक की सतह से हटाकर।
प्रश्न 7.
विषमांगी उत्प्रेरण में अधिशोषण की क्या भूमिका है?
उत्तर:
अधिशोषण की भूमिका को हम विषमांगी उत्प्रेरण के अधिशोषण सिद्धान्त द्वारा समझा सकते हैं। इस सिद्धान्त के अनुसार, गैसीय प्रावस्था या विलयन में अभिकारक ठोस उत्प्रेरक के पृष्ठ पर अधिशोषित हो जाता है। जैसे-जैसे अभिकारक की सान्द्रता पृष्ठ या सतह पर बढ़ती जाती है, वैसे-वैसे अभिक्रिया की दर भी बढ़ जाती है। चूंकि अधिशोषण एक प्रकार की ऊष्माक्षेपी अभिक्रिया है अत: अधिशोषण के दौरान मुक्त हुई ऊष्मा अभिक्रिया की दर को बढ़ाने में प्रयुक्त हो जाती है।
उत्प्रेरण की क्रिया उत्प्रेरक की सतह पर सम्पूर्ण होती है, जिसमें निम्न पद सम्मिलित हैं:
- उत्प्रेरक की सतह पर अभिकारकों का विसरण।
- उत्प्रेरक की सतह पर अभिकारक अणुओं का अधिशोषण।
- एक मध्यवर्ती निर्माण के द्वारा उत्प्रेरक की सतह पर रासायनिक अभिक्रिया का होना।
- उत्प्रेरक की सतह से अभिक्रिया उत्पादों का विशोषण।
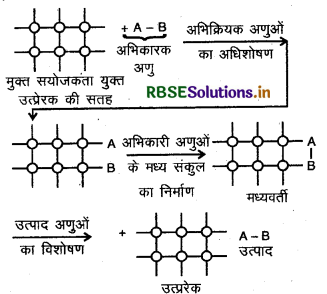
- विशोषण के बाद सतह का दोबारा अधिक अभिक्रिया होने के लिए उपलब्ध होना।
- अभिक्रिया उत्पादों का उत्प्रेरक की सतह से दूर विसरण।
- इस प्रकार हम समझ सकते है कि विषमांगी उत्प्रेरण में अधिशोषण का एक मुख्य स्थान है।
प्रश्न 8.
अधिशोषण हमेशा ऊष्माक्षेपी क्यों होता है?
उत्तर:
अधिशोषण हमेशा एक ऊष्माक्षेपी अभिक्रिया है क्योंकि जब अधिशोषण होता है तब पृष्ठ या सतह के अवशिष्ट बलों में कमी आ जाती है जो कि ऊष्मा या ऊर्जा के रूप में मुक्त होती है। जब कोई गैस अधिशोषित होती है तो इसके अणुओं का संचलन सीमित या कम हो जाता है जिसके कारण एन्ट्रॉपी में कमी आ जाती है अर्थात् ∆s = -ve हो जाता है। हम जानते है कि किसी प्रक्रम के स्वत: प्रवर्तित होने के लिए ∆G का मान -ve होना चाहिए। अत: समीकरण, ∆G = ∆H - T∆S के आधार पर ∆G का मान तभी ऋणात्मक हो सकता है जबकि ∆H का मान T∆S से अधिक हो और ऋणात्मक हो, क्योंकि ∆S के -ve होने के कारण T∆S का मान धनात्मक हो जाता है। यही कारण है कि अधिशोषण हमेशा ऊष्माक्षेपी अभिक्रिया होती है।

प्रश्न 9.
कोलॉइडी विलयनों को परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्थाओं के आधार पर कैसे वर्गीकृत किया जाता है?
उत्तर:
परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्था के आधार पर कोलॉइडी विलयनों को निम्न प्रकार से वर्गीकृत किया जाता है:
|
परिक्षिप्त प्रावस्था |
परिक्षेपण माध्यम |
कोलॉइड का प्रकार |
उदाहरण |
|
ठोस |
ठोस |
ठोस सॉल |
कुछ रंगीन काँच एवं रत्न प्रस्त मिश्र धातु खनिज |
|
ठोस |
द्रव |
सॉल |
प्रलेप (पेंट),कोशिका तरल, |
|
ठोस |
गैस |
ऐरोसॉल जैल |
धुएँ धूल |
|
द्रव |
ठोस |
इमल्शन (पायस) |
पन, मक्खन, जैली, दहीदूध, बालों की क्रीम |
|
द्रव |
गैस |
ऐरोसॉल |
धुन्ध, कोहरा, बादल कीटनाशक स्प्रे |
|
द्रव |
ठोस |
ठोस सॉल |
प्यूमिक पत्थर, फोम रबर फेन, फैंटी गई क्रीम, साबुन के झाग। |
|
गैस |
द्रव |
फोम |
कुछ रंगीन काँच एवं रत्न प्रस्त मिश्र धातु खनिज |
प्रश्न 10.
बोसों द्वारा गैसों के अधिशोषण पर दाब एवं ताप के प्रभाव की विवेचना कीजिए।
उत्तर:
(i) अधिशोषण पर दाब का प्रभाव (Effect of Pressure on Adsorption): स्थिर ताप पर दाब बढ़ाने पर ठोसों पर गैसों का अधिशोषण बढ़ता जाता है। स्थिर ताप पर ठोस में गैस के अधिशोषण के अंश (x/m) तथा गैस के दाब (p) के मध्य खींचा गया ग्राफ अधिशोषण समतापी वन कहलाता है।
\(\begin{aligned} &\frac{x}{m} \propto p^1 \\ &\frac{x}{m}=k p^1 \end{aligned}\)
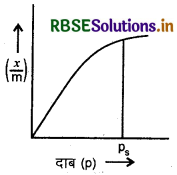
फ्रॉयडलिक समतापी वक्र (Freundlich Isotherm Curve):
(i) न्यूनतम दाब पर,
\(\begin{aligned} &\frac{x}{m} \propto p^0 \\ &\frac{x}{m}=k \end{aligned}\)
अर्थात् कम दाब पर x/m दाब के अनुक्रमानुपाती होता है।
(ii) उच्च दाब पर,
\(\begin{aligned} &\frac{x}{m} \propto p^0 \\ &\frac{x}{m}=k \end{aligned}\)
अर्थात् उच्च दाब पर x/m दाब पर निर्भर नहीं करता है।
(iii) माध्यमिक दाब पर,
\(\begin{aligned} &\frac{x}{m} \propto p^{1 / n} \\ &\frac{x}{m}=k p^{1 / n} \end{aligned}\)
यहाँ > 1 .......... (1)
माध्यमिक दाब के परास में imm का मान दाब की भिन्नात्मक घात के समानुपाती होता है।
समी. (1) का log लेने पर,
\(\log \frac{x}{m}=\log k+\frac{1}{n} \log p\)
(ii) अधिशोषण पर ताप का प्रभाव (Effect of Temperature on Adsorption): जूकि अधिकांश अधिशोषण प्रक्रम ऊष्माक्षेपी होते हैं अतः ताप बढ़ाने पर अधिशोषण घट जाता है।
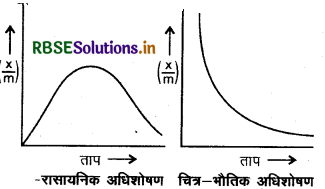
परन्तु रासायनिक अधिशोषण में प्रारम्भ में ताप बढ़ाने पर अधिशोषण बढ़ता है लेकिन एक निश्चित ताप के बाद अधिशोषण कम होना प्रारम्भ हो जाता है।
प्रश्न 11.
द्रवरागी एवं दवविरागी सॉल क्या होते हैं? प्रत्येक का एक-एक उदाहरण दीजिए। दव-विरोधी सॉल आसानी से स्कन्दित क्यों हो जाते हैं?
उत्तर:
द्रवरागी सॉल एवं द्रवविरागी सॉल में अन्तर द्रवरागी सॉल
|
द्रवरागी सॉल (Lyophilic Sol) |
द्रवविरागी सॉल (Lyophobic Sol) |
|
1. इसे परिक्षेपण माध्यम में विलेय मिलाकर सीधे प्राप्त कर सकते है। |
1. इसे विलेय को सीधे पंरिक्षेपण माध्यम में मिलाकर प्राप्त नहीं किया जा सकता है। |
|
2. ये उत्क्रमणीय प्रकृति के होते है। |
2. ये अनुत्क्रमणीय प्रकृति के होते हैं। |
|
3. ये स्थायी होते हैं तथा इन्हें आसानी से स्कन्दित नहीं किया जा सकता है। |
3. ये अस्थायी होते हैं तथा इन्हें स्थायी करने के लिए स्थायी कारकों की आवश्यकता होती है। ये आसानी से स्कन्दित हो सकते हैं। |
|
4. उदाहरण- गोंद, जिलेटिन, स्टार्च, रबर आदि। |
4. उदाहरण: गोल्ड, सिल्वर,FeOH3, AS2 O3 आदि । |
द्रव-विरोधी सॉल का स्कन्दन (Coagulation of Lyophobic Sols): द्रव-विरोधी सॉल का स्थायित्व केवल कोलॉइडी कों पर आवेश की उपस्थिति के कारण होता है। यदि आवेश हटा दिया जाये या फिर किसी विद्युत अपघट्य को अधिक मात्रा में मिला दिया जाये तो कोलॉइडी कण एक-दूसरे के निकट आ जाते है और स्कन्दित हो जाते है। अतः हम आसानी से द्रव-विरोधी सॉल को स्कन्दित कर सकते हैं।

प्रश्न 12.
बहुअणुक एवं वृहदाणुक कोलॉइड में क्या अन्तर है? प्रत्येक का एक-एक उदाहरण दीजिए। सहचारी कोलॉइड इन दोनों प्रकार के कोलॉइडों से कैसे भिन्न है?
उत्तर:
बहुअणुक कोलोड (Multimolecular Colloids): जब किसी पदार्थ के बहुत से परमाणु या लघु अणु एकत्रित होकर विलयन में एक पुंज जैसी स्पीशीज बनाते हैं तथा जिनका आकार लगभग 1 am के बराबर होता हो तो इस प्रकार प्राप्त स्पीशीज को बहुअणुक कोलॉइड कहते हैं।
उदाहरण: गोल्ड सॉल में हजारों की संख्या में भिन्न-भिन्न आकार के कण होते हैं। वहीं सल्फर के सॉल में एक हजार एवं उससे अधिक S के अणु उपस्थित होते हैं।
वहदाणुक कोलॉइड (Macromolecular Colloids): इसमें बड़े आकार के अणु जिनका आकार I nm से 1000 nm के मध्य का होता है, उचित विलायक में मिलाने पर कोलॉइड का निर्माण करते हैं, इन्हें बृहदाणुक कोलॉइड कहा जाता है। ये अत्यधिक स्थायी कोलॉइड होते हैं तथा अनेक अर्थो में यथार्थ विलयनों के समान होते हैं।
उदाहरण: प्राकृतिक रूप से पाये जाने वाले बृहदाण्विक कोलॉइड के उदाहरण हैं-स्टार्च, सेलुलोज, प्रोटीन, एन्जाइम, पॉलीथीन, रबर आदि।
सहचारी कोलॉइड (Associated Colloids or Micelles)बहुअणुक कोलॉइड (Multimolecular colloids) सरल अणुओं, जैसे - Sg Au आदि की अत्यधिक संख्या के पुंजित होने पर बनते हैं, जबकि वृहदाणुक कोलॉइड (Macromolecular colloid) वृहद् आकार, जिनकी सीमा कोलॉइडी सीमा के अन्दर हो, के अणुओं से बनते हैं। जैसे - स्टॉर्च, पॉलीथीन, रबर आदि। यहाँ कुछ पदार्थ ऐसे भी होते हैं जो कम सान्दताओं पर सामान्य प्रबल वैद्युत अपघट्य के समान व्यवहार करते हैं परन्तु उच्च सान्द्रता पर कों का पुंज बनने के कारण कोलॉइड के समान व्यवहार करते हैं।
इस प्रकार बने पुंज को मिसेल (Micelle) कहा जाता है। इन्हें ही सहचारी कोलॉइड (Associated colloid) कहते हैं। मिसेल का निर्माण एक निश्चित ताप से अधिक ताप पर होता है, इस ताप को क्राफ्ट ताप (Kraft Temperature) कहा जाता है। मिसेल का निर्माण एक निश्चित सान्दता से अधिक सान्द्रता पर होता है इसे क्रान्तिक मिसेल सान्द्रता (Critical Micell Concentration - CMC) कहा जाता है। उदाहरण के लिए, साबुन की CMC का मान 104 से 10 mol L-I होता है। मिसेल के निर्माण में 100 या उससे अधिक अणु हो सकते है।
प्रश्न 13.
एन्जाइम क्या होते हैं? एन्जाइम उत्प्रेरण की क्रियाविधि को संक्षेप में लिखिए।
उत्तर:
एन्जाइम (Enzyme): एन्जाइम जटिल नाइट्रोजनी कार्बनिक यौगिक होते है जो कि जीवित पौधों एवं जन्तुओं द्वारा उत्पन्न किये जाते हैं। ये उच्च अणुभार वाले प्रोटीन अणु होते हैं तथा जल में कोलॉइडी विलयन का निर्माण करते हैं। ये प्रभावी उत्प्रेरक हैं जो कि प्राकृतिक प्रक्रमों से सम्बन्धित अभिक्रियाओं को प्रेरित एवं उत्प्रेरित करते हैं। इन्हें जैव-रासायनिक उत्प्रेरक (Biochemical catalyst) भी कहा जाता है।
उदाहरण: इन्वर्टेज, जाइमेज, माल्टेज, डायस्टेज, यूरिएज आदि।
एन्जाइम उत्प्रेरण की क्रियाविधि (Mechanism of Enzyme Catalysis): एन्जाइम के कोलॉइडी कणों की सतह पर बहुत सारे कोटर होते हैं जो कि अभि-लक्षणिक आकृति के होते हैं। इनमें सक्रिय समूह, जैसे - NH2 COOH3 - OH आदि होते हैं। ये सक्रिय केन्द्र का कार्य करते हैं। जिन अभिकारक अणुओं की आकृति परिपूरक होती है वे ही इन कोटरों में एक ताले में चाबी के समान फिट हो जाते हैं। इन सक्रिय समूहों के कारण एक सक्रिषित संकुल बनता है जो विघटित होकर उत्पाद का निर्माण करता है।
एन्जाइम उत्प्रेरित अभिक्रिया निम्न पदों में सम्पूर्ण होती है:
पद 1: सक्रियित संग 7 बनाने के लिए एन्जाइम एवं क्रियाधार परस्पर आबन्धन का निर्माण करते हैं।
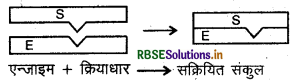
\(\mathrm{E}+\mathrm{S} \longrightarrow \mathrm{ES}\)
पद 2 : अब यह सक्रियित संकुल विघटित होता है और उत्पाद का निर्माण करता है।
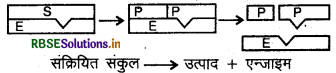
\(E S \longrightarrow E+P\)

प्रश्न 14.
कोलॉइडों को निम्नलिखित आधार पर कैसे वर्गीकृत किया गया है
(क) घटकों की भौतिक अवस्था।
(ख) परिक्षेपण माध्यम की प्रकृति।
(ग) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया।
उत्तर:
(क) घटकों की भौतिक अवस्था के आधार पर वर्गीकरण (Classification on the basis of Physical State): परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम की भौतिक अवस्था के आधार पर कोलॉइडी विलयनों को निम्न प्रकार से वर्गीकृत किया जाता है।
|
परिक्षिप्त प्रावस्था |
परिक्षेपण माध्यम |
कोलॉइड का प्रकार |
उदाहरण |
|
ठोस |
ठोस |
ठोस सॉल |
कुछ रंगीन काँच एवं रत्न प्रस्त मिश्र धातु खनिज |
|
ठोस |
द्रव |
सॉल |
प्रलेप (पेंट),कोशिका तरल, |
|
ठोस |
गैस |
ऐरोसॉल जैल |
धुएँ धूल |
|
द्रव |
ठोस |
इमल्शन (पायस) |
पन, मक्खन, जैली, दहीदूध, बालों की क्रीम |
|
द्रव |
गैस |
ऐरोसॉल |
धुन्ध, कोहरा, बादल कीटनाशक स्प्रे |
|
द्रव |
ठोस |
ठोस सॉल |
प्यूमिक पत्थर, फोम रबर फेन, फैंटी गई क्रीम, साबुन के झाग। |
|
गैस |
द्रव |
फोम |
कुछ रंगीन काँच एवं रत्न प्रस्त मिश्र धातु खनिज |
(ख) परिक्षेपण माध्यम की प्रकृति के आधार पर वर्गीकरण (Classification on the basis of Dispersion Medium)
(ग) परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य अन्योन्यक्रिया के आधार पर वर्गीकरण (Classification on the basis of Interaction between dispersed Phase and Dispersion Medium): इसके आधार पर कोलॉइडी सॉल को दो वर्गों में विभाजित किया गया है:
- द्रवरागी सॉल या द्रव-स्नेही सॉल (Lyophilic Sol): ऐसे कोलॉइडी विलयन जिनमें परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य आकर्षण होता है, द्रवरागी सॉल कहलाते हैं।
- दवविरागी सॉल या दव-विरोधी सॉल (Lyophobic sol): ऐसे कोलॉइडी विलयन जिनमें परिक्षिप्त प्रावस्था एवं परिक्षेपण माध्यम के मध्य प्रतिकर्षण होता है, द्रवविरागी कोलॉइड कहलाते हैं।
- नोट: यदि परिक्षेपण माध्यम जल है तो इसे जलरागी एवं जलविरागी कोलॉइड कहा जाता है।
प्रश्न 15.
निम्नलिखित परिस्थितियों में क्या प्रेक्षण होंगे?
1. जब प्रकाश किरण पुंज कोलॉइडी सॉल माध्यम से गमन करता है।
2. जलयोजित फेरिक ऑक्साइड सॉल में NaCl विद्युत अपघट्य मिलाया जाता है।
3. कोलॉइडी सॉल में विद्युतधारा प्रवाहित की जाती है।
उत्तर:
- जब प्रकाश किरण पुंज कोलॉइडी सॉल माध्यम से गमन करता है तो कोलॉइडी कणों द्वारा प्रकाश का प्रकीर्णन हो जाता है एवं प्रकाश का मार्ग प्रदीप्त हो जाता है। इस परिघटना को टिण्डल प्रभाव कहते हैं।
- जलयोजित फेरिक ऑक्साइड सॉल में NaCl विद्युत अपघट्य मिलाने पर फेरिक ऑक्साइड के धनावेशित कण NaCl द्वारा प्रदत्त ऋणावेशित Cl- आयनों द्वारा स्कन्दित हो जाते हैं अर्थात् यहाँ कोलॉइडी सॉल का स्कन्दन हो जाता है।
- कोलॉइडी सॉल में से विद्युतधारा प्रवाहित करने पर कोलॉइडी कण विपरीत आवेशित इलेक्ट्रोडों की ओर गति करने लगते हैं। इस परिघटना को वैद्युत कण-संचलन (Electrophoresis) कहा जाता है। यदि विद्युत धारा को लम्बे समय तक प्रवाहित किया जाये तो ये अपना आवेश खोकर स्कन्दित हो जाते हैं।
प्रश्न 16.
इमल्शन क्या है? इनके विभिन्न प्रकार क्या हैं? प्रत्येक प्रकार का उदाहरण दीजिए।
उत्तर:
इमल्शन (Emulsion) या पायस-जब किसी कोलॉइडी विलयन में परिक्षेपण माध्यम एवं परिक्षिप्त प्रावस्था दोनों ही द्रव हो तो इस प्रकार के कोलॉइडी सॉल को इमल्शन कहा जाता है। इमल्शन में सामान्यत: दो द्रवों में से एक द्रव जल होता है।
पायस या इमल्शन दो प्रकार का होता है:
- तेल का जल में परिक्षेपण (Oil in water type-ow),
- जल का तेल में परिक्षेपण (Water in oil type-W/O)
- तेल का जल में परिक्षेपण (Oil in Water Type-o/W): इस प्रकार के इमल्शन में जल परिक्षेपण माध्यम होता है एवं तेल की बूंदै इसमें परिक्षिप्त प्रावस्था के रूप में होती हैं।
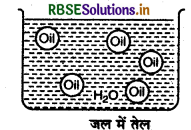
उदाहरण: दूध, वैनीशिंग क्रीम आदि। दूध में द्रव वसा जल में परिक्षिप्त रहती है।
(i) जल का तेल में परिक्षेपण (Water in Oil Type-W/O): इस प्रकार के इमल्शन में तेल परिक्षेपण माध्यम का कार्य करता है तथा जल इसमें परिक्षिप्त प्रावस्था के रूप में रहता है।
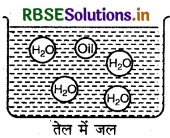
उदाहरण: मक्खन एवं क्रीम।
प्रश्न 17.
पायसीकर्मक पायस को स्थायित्व कैसे देते हैं? दो पायसीकर्मकों के नाम लिखिए।
उत्तर:
तेल एवं जल के पायस अस्थायी होते हैं और कभी-कभी रख देने पर दो परतों में अलग हो जाते हैं। पायस के स्थायित्व के एक. तीसरा घटक मिलाया जाता है जिसे पायसीकर्मक कहते हैं। पायसीकर्मक, माध्यम एवं निलंबित कणों के मध्य एक अंतरापृष्ठीय फिल्म बना लेता है।
- तेल/जल (O/w) पायस के लिए प्रमुख पायसीकर्मक प्रोटीन, गोंद प्राकृतिक एवं संश्लेषित साबुन आदि।
- जल/तेल (W/O) पाय के लिए पायसीकर्मक वसीय अम्लों के भारी धातुओं के लवण, लम्बी श्रृंखला वाले एल्कोहॉल, काजल आदि।
प्रश्न 18.
"साबुन की क्रिया पायसीकरण एवं मिसेल के बनने के कारण होती है।" इस पर टिप्पणी लिखिए।
उत्तर:
साबुन की क्रिया पायसीकरण एवं मिसेल के बनने के कारण होती है। इसे हम निम्न प्रकार समझ सकते हैं साबुन उच्च वसा अम्लों के सोडियम अथवा पोटैशियम लवण होते हैं जो कि पानी में घुलनशील होते हैं। साबुन को हम RCOO- M+ के द्वारा प्रदर्शित करते हैं। साबुन के कुछ उदाहरण-सोडियम स्टिएरेट, सोडियम पामिटेट आदि होते हैं। सोडियम स्टिएरेट (C17 H35 COONa) में दो भाग होते है, जिसमें से एक लम्बी हाइड्रोकार्बन शृंखला होती है जो कि जलविरागी वा जल प्रतिकर्षी होती है, इसे अधुवीय पुच्छ (Nonpolar tail) कहा जाता है तथा दूसरा भाग एक ध्रुवीय समूह (Polar group) COO- Na+ होता है जो कि जलरागी या जल को स्नेह करने वाला होता है, इसे ध्रुवीय आयनिक शीर्ष (Polar ionic head) कहा जाता है।
साबुन का आयन पृष्ठ पर इस प्रकार उपस्थित रहता है कि उसका ध्रुवीय अर्थात् (Polar ionic head) समूह जल में तथा हाइड्रोकार्बन श्रृंखला अर्थात् Non-polar भाग पृष्ठ से दूर रहता है।
अधुवीय पुच्छ धुवीय शीर्ष जलविरागी भाग जलरागी भाग:
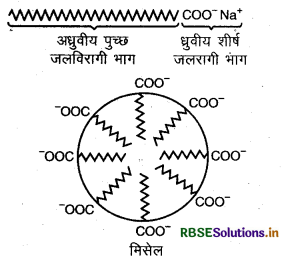
क्रान्तिक मिसेल सान्द्रता (Critical Micelle concentration) पर ऋणायन विलयन के स्थूल में खिंच आते हैं एवं गोलीय आकार में इस प्रकार एकत्रित होते हैं कि हाइड्रोकार्बन श्रृंखला गोले के केन्द्र की ओर इंगित होती है तथा Coo- भाग गोले के पृष्ठ पर रहता है। इस प्रकार लगभग 100 या उससे अधिक आयन एक पुंज बना लेते हैं। जिसे आयनिक मिसेल (Ionic micelle) कहा जाता है।
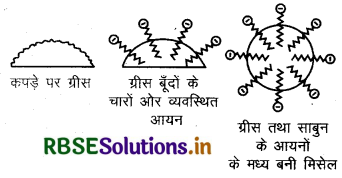
सावन की शोधन किया (Cleansing Action of Soap): इसमें साबुन के अणु तेल की बूंदों के चारों ओर इस प्रकार व्यवस्थित होते हैं कि इसका जलविरागी भाग तेल की बूंदों के अन्दर होता है और जलरागी भाग यूँदों के बाहर। यहाँ जलरागी भाग काँटों की तरह बूंदों से बाहर निकले रहते हैं। जल रागी भाग जो बूंदों के बाहर होते हैं वे ध्रुवीय होते हैं और जल के साथ अन्योन्यक्रिया करते हैं। इस प्रकार जैसे ही ध्रुवीय भाग जल के साथ जाता है तेल की बूंद भी बाहर जल में खिंच जाती है एवं गन्दगी सतह से हट जाती है।
इस प्रकार साबुन तेलों तथा वसाओं का पायसीकरण (Emulsification) करके धुलाई में सहायता करते हैं।
प्रश्न 19.
विषमांगी उप्रेरण के चार उदाहरण दीजिए।
उत्तर:
विषमांगी उत्प्रेरण के चार उदाहरण
(i) हबर प्रक्रम: इस प्रक्रम में सूक्ष्म विभाजित लोहा उत्प्रेरक का कार्य करता है, जो कि ठोस अवस्था में हैं। इसमें H2 तथा N2 अभिकारक तथा NH3 उत्पाद होते हैं जो कि सभी गैस प्रावस्था में होते हैं।

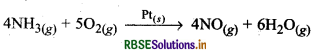
(ii) ओस्टवाल्ड प्रक्रम: इस प्रक्रम में प्लैटिनम गेज उत्प्रेरक का कार्य करता है जो कि ठोस अवस्था में होता है। यहाँ NH3 का ऑक्सीकरण NO (नाइट्रिक ऑक्साइड) में होता है जो सभी गैस प्रावस्था में होते हैं।
(iii) सल्फर डाइ: ऑक्साइड का ऑक्सीकरण इसमें Pt उत्प्रेरक होता है जिसकी प्रावस्था ठोस है। यहाँ SO2 का ऑक्सीकरण SO3 में होता है जो सभी गैस प्रावस्था में होते हैं।
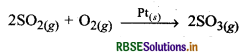
(iv) वनस्पति तेलों का हाइड्रोजनीकरण: इसमें सूक्ष्म विभाजित Ni उत्प्रेरक का कार्य करता है। यहाँ वनस्पति तेलों का हाइड्रोजनीकरण वनस्पति घी के रूप में होता है।
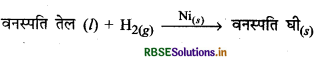

प्रश्न 20.
उत्प्रेरक की सक्रियता एवं वरण क्षमता का क्या अर्थ
उत्तर:
(i) सक्रियता (Activity): उत्प्रेरक द्वारा किसी अभिक्रिया के वेग को तीन्न करने की क्षमता, उत्प्रेरक की सक्रियता कहलाती है। उत्प्रेरक की सक्रियता रसोवशोषण की प्रबलता पर निर्भर करती है। सक्रिय होने के लिए अभिकारक, उत्प्रेरक पर पर्याप्त प्रबलता से अधिशोषित होना चाहिए परन्तु उनकी प्रबलता इतनी नहीं होनी चाहिए कि वे गति न कर सकें।'
उदाहरण के लिए: H2 तथा O2 की क्रिया बिना उत्प्रेरक के सम्भव नहीं है परन्तु Pt की उपस्थिति में अभिक्रिया तीव्र गति से विस्फोट के साथ होती है।

(ii) वरणक्षमता (Selectivity): उत्प्रेरक की अत्यधिक वरणक्षमता होती है। किसी एक अभिक्रिया के लिए उत्प्रेरक का कार्य करने वाला पदार्थ जरूरी नहीं है कि वह दूसरी अभिक्रिया के लिए भी उत्प्रेरक का कार्य करे।
उदाहरणार्थ:
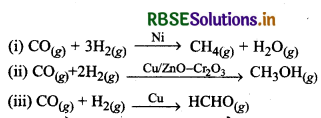
किसी अभिक्रिया में अलग-अलग उत्प्रेरक अलग- अलग उत्पादों के लिये उत्तरदायी होते हैं जैसा कि उपरोक्त उदाहरणों में दिखाया गया।
प्रश्न 21.
जिओलाइटों द्वारा उत्प्रेरण के कुछ लक्षणों का वर्णन कीजिए।
उत्तर:
जिओलाइटों अप्रेरण के लक्षण (Characteristics of Zeolite Catalysis): जिओलाइट (Zeolite) जलयो जित ऐलुमिनो-सिलिकेट होते हैं जिनकी संरचना त्रिविमीय नेटवर्क प्रकार की होती है। जिओलाइट की संरचना मधुमक्खी के छत्ते जैसी होती है अर्थात् इनमें संरन्ध्र उपस्थित होते हैं। संरन्धों का आकार प्राय: 260 pm से 740 pm के मध्य का होता है। जिओलाइट केवल उन अणुओं के लिये उत्प्रेरक का कार्य करते है जिनका आकार इनके संरन्नों के आकार से कम होता है तथा उत्पाद भी इनके संरन्धों के आकार से कम आकार के होने चाहिए। इसी कारण से जिओलाइट आण्विक जाल (Molecular sieves) या आकृति वरणात्मक उत्प्रेरक (Shape selective catalyst) की भाँति कार्य करते हैं।
उदाहरण: इसका प्रयोग पेट्रो रसायन उद्योग में हाइड्रोकार्बन के भंजन एवं समावयन (Cracking and isomerisation) में होता है। ZSM - 5 पेट्रोरसायन के लिए एक महत्वपूर्ण उत्प्रेरक है। ऐल्कोहॉल के निर्जलीकरण के लिए ZSM - 5 का प्रयोग किया जाता है। इस विधि से ऐल्कोहॉल सीधे गैसोलीन अर्थात् पेट्रोल में परिवर्तित होते हैं।

प्रश्न 22.
आकृति वरणात्मक उत्प्रेरण क्या है?
उत्तर:
आकृति बरणात्मक उत्प्रेरण (Shape Selective Catalysis): ऐसा अप्रेरण -जो कि उत्प्रेरण की रन्ध्र संरचना एवं अभिकारक तथा उत्पाद अणुओं के आकार पर निर्भर करे, आकृति वरणात्मक उत्प्रेरण (Shape selective catalysis) कहलाता है। इसका एक बहुत महत्वपूर्ण उदाहरण जिओलाइट है। जिओलाइट में Al - O - Si का त्रिविमीय नेटवर्क होता है तथा इसका आकार मधुमक्खी के छत्ते जैसा होता है।
इसमें संरन्ध्र उपस्थित होते है जिनका आकार 260 pm से लेकर 740 pm के मध्य होता है। जिओलाइट केवल उन अभिकारक एवं उत्पाद के लिए उत्प्रेरक का कार्य करता है जिनका आकार जिओलाइट के संरन्धों के आकार से कम होता है, क्योंकि यदि अभिकारक अणुओं का आकार बहुत बड़ा होगा तो वे जिओलाइट के संरन्द्रों में व्यवस्थित नहीं होंगे और अभिक्रिया नहीं हो पायेगी। दूसरी ओर यदि अभिकारक अणुओं का आकार छोटा होगा तो वे फिसल कर उत्प्रेरक से बाहर निकल जायेंगे।
उदाहरण: ZSM - 5

प्रश्न 23.
निम्नलिखित पदों को समझाइए:
(i) विद्युत कण-संचलन
(ii) स्कन्दन
(iii) अपोहन
(iv) टिण्डल प्रभाव।
उत्तर:
(i) विद्युत कण-संचलन (Electrophoresis): कोलॉइडी कण ऋणात्मक या धनात्मक प्रकृति के होते हैं। जब कोलॉइडी विलयन में से विद्युतधारा को प्रवाहित किया जाता है तो ये कण विद्युत प्रभाव क्षेत्र में विपरीत आवेश वाले इलेक्ट्रोड की ओर अभिगमन करते हैं।
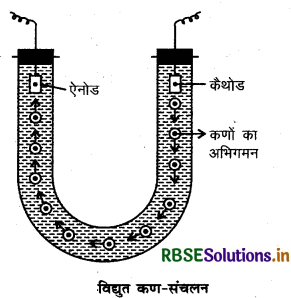
इस प्रकार विद्युत क्षेत्र में कोलॉइडी कणों का विपरीत आवेश वाले इलेक्ट्रोडों की ओर अभिगमन विद्युत कण- संचलन (Electrophoresis) कहलाता है। जब कण कैथोड की ओर गति करते हैं तो इसे धन कण-संचलन (Catuphoresis) कहा जाता है एवं जब कण ऐनोड की तरफ गति करते है तो इसे ऋण कण-संचलन (Anaphoresis) कहा जाता है।
(ii) स्कन्दन (Coagulation): कोलॉइडी सॉल का स्थायित्व कोलॉइडी कर्णों पर आवेश के कारण होता है। यदि किसी प्रकार से आवेश को हटा दिया जाये तो कण एक-दूसरे के समीप आकर पुंजित या स्कंदित हो जायेंगे और गुरुत्वाकर्षण बल के कारण नीचे बैठ जायेंगे।
"कोलॉड्डी कणों के नीचे बैठ जाने का प्रक्रम सॉल का स्कंदन या अवक्षेपण कहलाता है।"
स्कन्दन हम निम्न विधियों के द्वारा कर सकते हैं:
- वैद्युत कण संचलन द्वारा,
- दो विपरीत आवेशित सॉल को मिश्रित करके,
- क्वथनन द्वारा,
- वैद्युत-अपघट्य को मिलाकर।
(iii) अपोहन (Dialysis): यह एक उपयुक्त झिल्ली द्वारा अपोहन करके कोलॉइडी बिलयन में से खुले हुए पदार्थों को निकालने का प्रक्रम है। कोलॉइडी विलयन में उपस्थित वास्तविक विलयन के कण जान्तव झिल्ली, पार्चमेष्ट-पत्र या सेलोफेन शीट से निकल जाते हैं परन्तु कोलॉइडी कण नहीं निकल पाते।
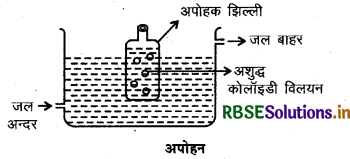
अतः जान्तव झिल्ली या पार्चमेण्ट-पत्र का एक बैग बनाते हैं जिसमें हम अशुद्ध कोलॉइडी विलयन को भर देते हैं तथा इस बैग को बहते हुए पानी में लटका देते हैं। अणु, आयन झिल्ली में से विसरित होकर बाहरी जल में आ जाते हैं और वह जाते हैं। शुद्ध कोलॉइडी विलयन बैग में ही रह जाता है। यह प्रक्रम अपोहन (Dialysis) कहलाता है।
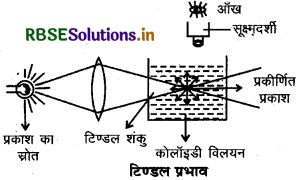
(iv) टिण्डल प्रभाव (Tyndall Effect): कोलॉइडी विलयन में से जब प्रकाश की किरण को गुजारा जाता है एवं विलयन को प्रकाश के पथ की दिशा से समकोण दिशा में देखने पर वे मंद से प्रबल दूधियापन दति हैं अर्थात् प्रकाश किरण पुंज का पारगमन पच नीले प्रकाश से प्रदीप्त हो जाता है। यह प्रभाव सर्वप्रथम फैराडे ने प्रेक्षित किया एवं बाद में इसे टिण्डल ने विस्तृत रूप से परिभाषित किया अतः इसे टिण्डल प्रभाव कहा जाता है। प्रकाश के चमकीले कोन को टिण्डल शंकु कहा जाता है।
जब कोलॉइडी कण, प्रकाश को दिक्-स्थान में सभी दिशाओं में प्रकीर्णित करते हैं तथा प्रकाश का यह प्रकीर्णन कोलॉइडी परिक्षेपण में किरण के पथ को प्रदीप्त करता है तब टिण्डल प्रभाव उत्पन्न होता है। दूसरे शब्दों में, "प्रकाश की किरणों के कोलॉइडी कों पर पड़ने पर कण प्रकाश की ऊर्जा का अवशोषण करके स्वयं आत्मदीप्त (Self illuminate) हो जाते हैं। अवशोषित ऊर्जा के पुनः छोटी तरंगों के प्रकाश के रूप में प्रकीर्णित होने से नीले रंग का जो शंकु दिखता है, उसे टिण्डल शंकु कहते हैं तथा यह परिघटना टिण्डल प्रभाव कहलाती है।"
प्रश्न 24.
इमल्शन (पायस) के चार उपयोग लिखिए।
उत्तर:
इमल्शन के चार उपयोग निम्न प्रकार हैं:
- दूध, जल में वसा का इमल्शन होता है।
- फेन प्लवन प्रक्रम द्वारा सल्फाइड अयस्क का सान्द्रण इमल्शीफिकेशन द्वारा होता है।
- अधिकतर सौन्दर्य प्रसाधन, जैसे-क्रीम, शैम्पू वैनीशिंग क्रीम, डाई आदि अनेक औषधियाँ, लेप आदि इमल्शन के ही रूप है।
- साबुन एवं डिटरजेक्ट की शोधन क्रिया मैल या साबुन के विलयन के मध्य इमल्शन बनने के कारण होती है।

प्रश्न 25.
मिसेल क्या है? मिसेल निकाय का एक उदाहरण दीजिए।
उत्तर:
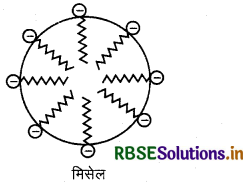
मिसेल (Micelle): सहचारी कोलॉइड ही मिसेल कहलाते हैं। वे पदार्थ जो कि कम सान्द्रता पर विद्युत-अपघट्य की तरह, तथा CMC से उच्च सान्द्रता पर कोलॉइड की तरह व्यवहार करते है, मिसेल का निर्माण करते हैं। जब सान्दता CMC से उच्च होती है तो पदार्थ के कण एकत्र होकर एक पुंज का निर्माण करते हैं। ये पुंज मिसेल कहलाते है।
उदाहरण: मिसेल निकाय का एक उदाहरण साबुन है। साबुन की CMC का मान 10-4 से 10-3 mol/L तक होता है। साबुन का एक मुख्य उदाहरण सोडियम पामिटेट है। परिक्षेपण माध्यम में साबुन के अणुओं के पामिटेट आयन की विभिन्न इकाइयाँ पुंजित होकर मिसेल बनाती हैं। जल में साबुन का सान्द्र विलयन एक मिसेल निकाय कहलाता है।
प्रश्न 26.
निम्नलिखित पदों को उदाहरण सहित समझाइए:
1. ऐल्कोसॉल,
2. ऐरोसॉल,
3. हाइड्रोसॉल।
उत्तर:
- ऐल्कोसॉल (Alcosols): ऐसे कोलॉइडी विलयन जिसमें परिक्षेपण माध्यम ऐल्कोहॉल होता है, ऐल्कोसॉल (Alcosols) कहलाते उदाहरण: एथेनॉल में सेलुलोज नाइट्रेट का कोलॉइडी विलयन, जो कि कोलॉडियन (Collodian) कहलाता है।
- ऐरोसॉल (Aerosols): ऐसे कोलॉइडी विलयन जिसमें परिक्षेपण माध्यम वायु या गैस होता है, ऐरोसॉल (Aerosols) कहलाते हैं। उदाहरण: कोहरा।
- हाइड्रोसॉल (Hydrosols): ऐसे कोलॉइडी विलयन जिसमें परिक्षेपण माध्यम जल होता है, हाइड्रोसॉल (Hydrosols) कहलाते हैं। उदाहरण: स्टार्च सॉल।
प्रश्न 27.
"कोलॉइड एक पदार्थ नहीं पदार्थ की अवस्था है।" इस कथन पर टिप्पणी कीजिए।
उत्तर:
कोलॉइड एक पदार्थ नहीं बल्कि पदार्थ की अवस्था है", यह कथन सत्य है क्योंकि विशेष परिस्थितियों में एक पदार्थ कोलॉइड के रूप में पाया जाता है। वहीं दूसरी परिस्थितियों में वह क्रिस्टलीय पदार्थ के रूप में कार्य करता है। उदाहरण के लिए, NaCI का जल में विलयन बनाने पर यह क्रिस्टलीय पदार्थ की तरह व्यवहार करता है एवं आयनों में विभाजित हो जाता है, जबकि यदि NaCl का बिलयन बेन्जीन में बनाया जाये तो यह कोलॉइड की तरह व्यवहार करता है। कणों का आकार इस बात को निश्चित करता है कि पदार्थ किस अवस्था में होगा। यदि कणों का आकार 1 mm से 1000 nm के मध्य है तो वह कोलॉइडी विलयन का निर्माण करेगा।

- RBSE Class 12 Chemistry Notes Chapter 16 दैनिक जीवन में रसायन
- RBSE Class 12 Chemistry Notes Chapter 15 बहुलक
- RBSE Class 12 Chemistry Notes Chapter 14 जैव-अणु
- RBSE Class 12 Chemistry Notes Chapter 13 ऐमीन
- RBSE Class 12 Chemistry Notes Chapter 12 ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
- RBSE Class 12 Chemistry Notes Chapter 11 ऐल्कोहॉल, फीनॉल एवं ईथर
- RBSE Class 12 Chemistry Notes Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
- RBSE Class 12 Chemistry Notes Chapter 9 उपसहसंयोजन यौगिक
- RBSE Class 12 Chemistry Notes Chapter 8 d- एवं f-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम