RBSE Solutions for Class 12 Chemistry Chapter 1 ठोस अवस्था
Rajasthan Board RBSE Solutions for Class 12 Chemistry Chapter 1 ठोस अवस्था Textbook Exercise Questions and Answers.
Rajasthan Board RBSE Solutions for Class 12 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 12. Students can also read RBSE Class 12 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 12 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 12 Chemistry Solutions Chapter 1 ठोस अवस्था
RBSE Class 12 Chemistry ठोस अवस्था InText Questions and Answers
प्रश्न 1.
ठोस कठोर क्यों होते हैं?
उत्तर:
ठोसों में अवयवी परमाणुओं अथवा अणुओं अथवा आयनों की स्थितियाँ नियत होती हैं, अर्थात् ये गति के लिए स्वतन्त्र नहीं होते हैं। ये केवल अपनी माध्य स्थितियों के चारों ओर दोलन करते हैं। इसका कारण इनके मध्य उपस्थित प्रबल अन्तरापरमाण्वीय अथवा अन्तराअणुक अथवा अन्तराआयनिक बलों की उपस्थिति है। इससे ठोसों की कठोरता स्पष्ट होती है।
प्रश्न 2.
ठोसों का आयतन निश्चित क्यों होता है?
उत्तर:
ठोसों में अवयवी कण अपनी माध्य स्थितियों पर प्रबल संसंजक आकर्षण बलों द्वारा बँधे रहते हैं। नियत ताप पर अन्तरकणीय दूरियाँ अपरिवर्तित रहती हैं जिससे ठोसों का आयतन निश्चित होता है।

प्रश्न 3.
निम्नलिखित को अक्रिस्टलीय तथा क्रिस्टलीय ठोसों में वर्गीकृत कीजिए:
पॉलियूरिथेन, नैफ्थेलीन, बेन्जोइक अम्ल, टेफ्लॉन, पोटैशियम नाइट्रेट, सेलोफेन, पॉलिवाइनिल क्लोराइड, रेशा काँच, ताँबा।
उत्तर:
- अक्रिस्टलीय ठोस (Amorphous solids): पॉलियूरिथेन, टेफ्लॉन, सेलोफेन, पॉलिवाइनिल क्लोराइड तथा रेशा काँच।
- क्रिस्टलीय ठोस (Crystalline solids): नैपथेलीन, बेन्जोइक अम्ल, पोटैशियम नाइट्रेट तथा ताँबा।
प्रश्न 4.
एक ठोस के अपवर्तनांक का सभी दिशाओं में समान मान प्रेक्षित होता है। इस ठोस की प्रकृति पर टिप्पणी कीजिए। क्या यह विदलन गुण प्रदर्शित करेगा?
उत्तर:
ठोस के अपवर्तनांक का सभी दिशाओं में समान मान प्रेक्षित होता है; इसका अर्थ है कि यह समदैशिक (isotropic) है तथा इसलिए यह अक्रिस्टलीय (amorphous) है। अक्रिस्टलीय ठोस होने के कारण तेज धार वाले औजार से काटने पर, यह अनियमित सतहों वाले दो टुकड़ों में कट जाएगा। दूसरे शब्दों में यह स्पष्ट विदलन गण प्रदर्शित नहीं करेगा।
प्रश्न 5.
उपस्थित अन्तराआण्विक बलों की प्रकृति के आधार पर निम्नलिखित ठोसों को विभिन्न संवर्गों में वर्गीकृत कीजिए:
पोटैशियम सल्फेट, टिन, बेन्जीन, यूरिया, अमोनिया, जल, जिंक सल्फाइड, ग्रेफाइट, रूबीडियम, आर्गन, सिलिकॉन कार्बाइड।
उत्तर:
- आण्विक ठोस (Molecular solids): बेन्जीन, यूरिया, अमोनिया, जल, आर्गन।
- आयनिक ठोस (Ionic solids): पोटैशियम सल्फेट, जिंक सल्फाइड।
- धात्विक ठोस (Metallic solids): रूबीडियम, टिन।
- सहसंयोजक अथवा नेटवर्क ठोस (Covalent or Network solids): ग्रेफाइट, सिलिकॉन कार्बाइड।
प्रश्न 6.
ठोस A, अत्यधिक कठोर तथा ठोस एवं गलित दोनों अवस्थाओं में विद्युतरोधी है और अत्यन्त उच्च ताप पर पिघलता है। यह किस प्रकार का ठोस है?
उत्तर:
सहसंयोजक अथवा नेटवर्क ठोस; चूँकि यह गलित अवस्था में भी विद्युत् का चालन नहीं करता है।
प्रश्न 7.
आयनिक ठोस गलित अवस्था में विद्युत् चालक होते हैं परन्तु ठोस अवस्था में नहीं, व्याख्या कीजिए।
उत्तर:
गलित अवस्था में अथवा जल में घोलने पर आयनिक ठोस वियोजित होकर मुक्त आयन देते हैं। इन मुक्त आयनों की गति के कारण विद्युत्-चालन सम्भव होता है। यद्यपि ठोस अवस्था में, चूँकि आयन गति के लिए मुक्त नहीं होते अपितु परस्पर प्रबल विद्युत्स्थैतिक आकर्षण बल द्वारा जुड़े रहते हैं; अत: ठोस अवस्था में ये विद्युत्रोधी होते हैं।
प्रश्न 8.
किस प्रकार के ठोस विद्युत् चालक, आघातवयं और तन्य होते हैं?
उत्तर:
धात्विक ठोस विद्युत् चालक, आघातवर्ध्य और तन्य होते हैं।

प्रश्न 9.
'जालक बिन्दु' से आप क्या समझते हैं?
उत्तर:
प्रत्येक जालक बिन्दु (lattice point) ठोस के एक अवयवी कण को प्रदर्शित करता है। यह अवयवी कण एक परमाणु, अण (परमाणुओं का समूह) अथवा आयन हो सकता है।
प्रश्न 10.
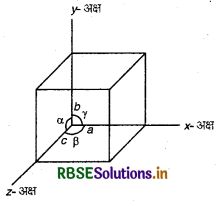
एकक कोष्ठिका को अभिलाक्षणित करने वाले पैरामीटरों के नाम बताइए।
उत्तर:
एकक कोष्ठिका के निम्नलिखित पैरामीटर होते हैं:
- तीनों किनारों की विमाएँ a, b एवं c, जो परस्पर लम्बवत् हो भी सकती हैं और नहीं भी।
- कोरों के मध्य कोण a (b और c के मध्य), ∴ β (a और c के मध्य) और (a और b के मध्य)।
प्रश्न 11.
निम्नलिखित में विभेद कीजिए:
(i) षट्कोणीय और एकनताक्ष एकक कोष्ठिका।
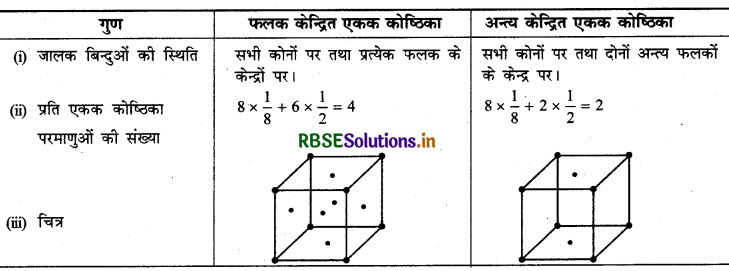
(ii) फलक केन्द्रित और अन्त्य केन्द्रित एकक कोष्ठिका।
उत्तर:
|
गुण |
षट्कोणीय एकक कोष्ठिका |
एकनताक्ष एकक कोष्ठिका |
|
(i) त्रिविम जालकों की संख्या |
1 |
2 |
|
(ii) सम्भव विविधताएँ |
आद्य |
आद्य एवं अन्त्य केन्द्रित |
|
(iii) कोर लम्बाई |
a=b \(\neq\) c |
a \(\neq\) b \(\neq\) c |
|
(iv) अक्षीय कोण |
α = β = 90° γ = 120° |
α = β = 90° β \(\neq\) 120° |
|
(v) उदाहरण |
ग्रेफाइट, ZnO, CdS |
एकनताक्ष गन्धक, Na2SO4 10 H2O |
प्रश्न 12.
स्पष्ट कीजिए कि एक घनीय एकक कोष्ठिका के:
(i) कोने और
(ii) अन्तःकेन्द्र पर उपस्थित परमाणु का कितना भाग सन्निकट कोष्ठिका से सहभाजित होता है ?
उत्तर:
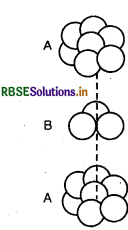
- घनीय एकक कोष्ठिका के कोने का प्रत्येक परमाणु आठ निकटवर्ती एकक कोष्ठिका के मध्य सहभाजित होता है। चार एकक कोष्ठिकाएँ समान परत में और चार एकक कोष्ठिकाएँ ऊपरी (अथवा निचली) परत में होती हैं; अत: एक परमाणु का वाँ भाग एक विशिष्ट एकक कोष्ठिका से सम्बन्धित रह सकता है।
- अन्त:केन्द्र का परमाणु पूर्णतया उस एकक कोष्ठिका से सम्बन्धित होता है जिसमें वह उपस्थित होता है। यह किसी सन्निकट कोष्ठिका से सहभाजित नहीं होता।
प्रश्न 13.
एक अणु की वर्ग निविड संकुलित परत में द्विविमीय उपसहसंयोजन संख्या क्या है?
उत्तर:
द्विविमीय वर्ग निविड संकुलित परत में प्रत्येक परमाणु चार निकटवर्ती परमाणुओं के सम्पर्क में रहता है। अतः इसकी उपसहसंयोजन संख्या 4 है।

प्रश्न 14.
एक यौगिक षट्कोणीय निविड संकुलित संरचना बनाता है। इसके 0 - 5 मोल में कुल रिक्तियों की संख्या कितनी है? उनमें से कितनी रिक्तियाँ चतुष्फलकीय हैं?
उत्तर:
हम जानते हैं कि
यदि निविड संकुलन में परमाणुओं की संख्या = N
तो चतुष्फलकीय रिक्तियों की संख्या = 2N
अष्टफलकीय रिक्तियों की संख्या = N
अतः 0 - 5 मोल में परमाणुओं की संख्या
= 0.5 x 6.022 x 1023
= 3.011 x 1023 परमाणु
अष्टफलकीय रिक्तियों की संख्या
= निविड संकुलन में परमाणुओं की संख्या
= 3.011 x 1023 चतुष्फलकीय रिक्तियों की संख्या
= 2 x निविड संकुलन में परमाणुओं की संख्या
= 2 x 3.011 x 1023
= 6.022 x 1023
कुल रिक्तियों की संख्या
= 3.011 x 1023 + 6.022 x 1023
= 9.033 x 1023 रिक्तियाँ
प्रश्न 15.
एक यौगिक दो तत्वों M और N से बना है। तत्व N, ccp रचना बनाता है और M के परमाणु चतुष्फलकीय रिक्तियों के माग को अध्यासित करते हैं। यौगिक का सूत्र क्या है?
उत्तर:
माना, ccp में परमाणुओं की संख्या = x
चतुष्फलकीय रिक्तियों की संख्या = 2x
अतः तत्व N के परमाणुओं की संख्या = x
चूँकि तत्व M चतुष्फलकीय रिक्तियों का 1/3 वाँ भाग अध्यासित रता है।
अत: उपस्थित M परमाणुओं की संख्या
\(=2 x \times \frac{1}{3}=\frac{2}{3} x\)
M व N का अनुपात,
= M : N
\(=\frac{2 x}{3}: x\)
= 2x : 3x = 2 : 3
यौगिक का सूत्र = M2N3
प्रश्न 16.
निम्नलिखित में से किस जालक में उच्चतम संकलन ममता है?
1. सरल घनीय
2. अन्त:केन्द्रित घन
3. षट्कोणीय निविड संकुलित जालक।
उत्तर:
जालक में संकुलन क्षमताएँ निम्न प्रकार हैं:
- सरल घनीय = 52.4%
- अन्त:केन्द्रित घन = 68%
- षट्कोणीय निविड संकुलन = 74%
अतः षट्कोणीय निविड संकुलन की संकुलन क्षमता उच्चतम है।

प्रश्न 17.
एक तत्व का मोलर द्रव्यमान 2.7 x 10-2 kg mol-1 है, यह 405 pm लम्बाई की भुजा वाली घनीय एकक कोच्तिका बनाता है। यदि उसका घनत्व 2.7 x 10-3 kg m-3 है तो घनीय एकक कोष्ठिका की प्रकृति क्या है?
उत्तर:
घनत्व, d = \(\frac{\mathrm{Z} \times \mathrm{M}}{a^3 \times \mathrm{N}_{\mathrm{A}}}\)
अथवा
\(\mathrm{Z}=\frac{d \times a^3 \times \mathrm{N}_{\mathrm{A}}}{\mathrm{M}}\)
यहाँ, M (तत्व का मोलर द्रव्यमान)
= 2.7 x 10-2 kg mol-1
a (भुजा की लम्बाई) = 405 pm = 405 x 10-12 m
= 4.05 x 10-10m
d (घनत्व) = 2.7 x 103 kgm-3
NA (आवोगाद्रो संख्या) = 6.022 x 1023 mol-
इन मानों को उपर्युक्त व्यंजक में प्रतिस्थापित करने पर,
\(\begin{aligned} &\left(2.7 \times 10^3 \mathrm{~kg} \mathrm{~m}^{-3}\right)\left(4.05 \times 10^{-10} \mathrm{~m}\right)^3\\ &Z=\frac{\left(6.022 \times 10^{23} \mathrm{~mol}^{-1}\right)}{\left(2.7 \times 10^{-2} \mathrm{~kg} \mathrm{~mol}^{-1}\right)} \end{aligned}\)
\(=\frac{(4.05)^3 \times 6.022 \times 10^{-4}}{10^{-2}}\)
= 66.430 x 6.022 x 10-2 = 4
अतः प्रति एकक कोष्ठिका में तत्व के 4 परमाणु उपस्थित हैं। अतः यनीय एकक कोष्ठिका फलक-केन्द्रित (fcc) अथवा घनीय निविड संकुलित (ccp) होनी चाहिए।
प्रश्न 18.
जब एक ठोस को गर्म किया जाता है तो किस प्रकार का दोष उत्पन्न हो सकता है? इससे कौन-से भौतिक गुण प्रभावित होते हैं और किस प्रकार?
उत्तर:
ठोस को गर्म करने पर क्रिस्टल में रिक्तिका दोष (Vacancy defect) उत्पन्न हो जाता है। इसका कारण यह है कि गर्म करने पर कुछ जालक स्थल (lattice sites) रिक्त हो जाते हैं। इस दोष के परिणामस्वरूप पदार्थ का घनत्व कम हो जाता है। क्योंकि कुछ परमाणु अथवा आयन क्रिस्टल को पूर्णतया त्याग देते हैं।
प्रश्न 19.
निम्नलिखित किस प्रकार का स्टॉइकियोमीदी दोष दर्शाते हैं:
1. ZnS
2. AgBr
उत्तर:
- Zns फ्रेंकेल दोष दर्शाता है, क्योंकि इसके आयनों के आकार में बहुत अधिक अन्तर होता है।
- AgBr फ्रेंकेल तथा शॉटकी दोनों प्रकार के दोष दर्शाता है।
प्रश्न 20.
समझाइए कि एक उच्च संयोजी धनायन को अशुद्धि की तरह मिलाने पर आयनिक ठोस में रिक्तिकाएं किस प्रकार प्रविष्ट होती हैं?
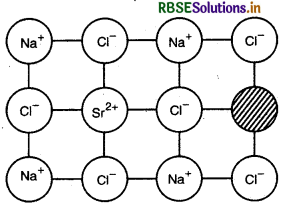
उत्तर: जब एक उच्च संयोजी धनायन को आयनिक ठोस में अशुद्धि की तरह मिलाया जाता है तो वास्तविक धनायन का कुछ स्थल उच्च संयोजी धनायन द्वारा अध्यासित हो जाता है। प्रत्येक उच्च संयोजी धनायन दो या अधिक वास्तविक धनायनों को प्रतिस्थापित करके एक वास्तविक धनायन के स्थल को अध्यासित कर लेता है तथा अन्य स्थल रिक्त ही रहते हैं। अध्यासित धनायनी रिक्तिकाएँ: [उच्च संयोजी धनायनों की संख्या x वास्तविक धनायन तथा उच्च संयोजी धनायन की संयोजकताओं का अन्तर]
उदाहरण: NaCI में SrCl2 को अशुद्धि के रूप में मिलाने पर रिक्तिकाएँ प्रविष्ट हो जाती है तथा एक Sr2+ आयन दो Na+ आयनों को प्रतिस्थापित करता है तथा एक रिक्ति पर Sr2+ अध्यासित हो जाता है जबकि एक रिक्ति बची रहती है।
प्रश्न 21.
जिन आयनिक ठोसों में धातु आधिक्य दोष के कारण ऋणायनिक रिक्तिका होती है। वे रंगीन होते हैं। इसे उपयुक्त उदाहरण की सहायता से समझाइए।
उत्तर:
धातु आधिक्य दोष के कारण ऋणायनिक रिक्तिका वाले ठोस रंगीन होते हैं, क्योंकि येसों की सतह पर धातु के परमाणु जम जाते हैं और आबनन के पश्चात् क्रिस्टल में विसरित हो जाते हैं एवं धातु आवन के साथ प्राप्त इलेक्ट्रॉन ऋणायनिक रिक्तिका को अध्यासित कर लेते हैं। जब इन इलेक्ट्रॉन पर श्वेत प्रकाश पड़ता है तो वे उचित तरंगदैर्ध्य को अवशोषित करके उत्तेजित हो जाते हैं तथा उच्च ऊर्जा स्तर पर पहुँच जाते हैं जिसके परिणामस्वरूप ठोस रंगीन दिखाई देते हैं।
उदाहरण: LICI का गुलाबी होना, NaCl का पीला दिखाई देना, आदि।

प्रश्न 22.
वर्ग 14 के तत्व को -प्रकार के अर्द्धचालक में उपयुक्त अशुद्धि द्वारा अपमिश्रित करके रूपान्तरित करना है। यह अशुद्धि किस वर्ग से सम्बन्धित होनी चाहिए?
उत्तर:
प्रकार के अर्द्धचालक को बनाने के लिए उसमें इलेक्ट्रॉन की अधिकता होनी चाहिए। तभी -प्रकार के अर्द्धचालक बनते है। अत: वर्ग 14 के तत्व को स-प्रकार के अर्द्धचालक में बदलने के लिये वर्ग 15 के तत्वों के साथ अपमिश्रित करना चाहिए।
प्रश्न 23.
किस प्रकार के पदार्थों से अच्छे स्थायी चुम्बक बनाए जा सकते हैं, लौह-चुम्बकीय अथवा फेरीचुम्बकीय ? अपने उत्तर का औचित्य बताइए।
उत्तर:
लौह-चुम्बकीय पदार्थों से अच्छे स्थायी चुम्बक बनाए जा सकते हैं। इसका कारण यह है कि ठोस अवस्था में लौह-चुम्बकीय पदार्थों के धातु आयन खेटे खण्डों में एक साथ समूहित हो जाते हैं, इन्हें डोमेन (Domains) कहा जाता है। इस प्रकार प्रत्येक डोमेन एक छोटे चुम्बक की तरह व्यवहार करता है। लौह-चुम्बकीय पदार्थ के अचुम्बकीय टुकड़े में डोमेन अनियमित रूप से अभिविन्यासित होते हैं और उनका चुम्बकीय आघूर्ण निरस्त हो जाता है। पदार्थ को चुम्बकीय क्षेत्र में रखने पर सभी डोमेन चुम्बकीय क्षेत्र की दिशा में अभिविन्यासित हो जाते हैं और प्रबल चुम्बकीय प्रभाव उत्पन्न होता है। चुम्बकीय क्षेत्र को हटा लेने पर भी डोमेनों का क्रम बना रहता है और लौह-चुम्बकीय पदार्थं स्थायी चुम्बक बन जाते हैं।
RBSE Class 12 Chemistry ठोस अवस्था Textbook Questions and Answers
प्रश्न 1.
अक्रिस्टलीय पद को परिभाषित कीजिए। अक्रिस्टलीय ठोसों के कुछ उदाहरण दीजिए।
उत्तर:
अक्रिस्टलीय ठोस (Amorphous Solid): वे ठोस पदार्थ जिनमें सम्पूर्ण क्रिस्टल में अवयवी कण (परमाणु, अणु या आयन) निश्चित ज्यामिति में व्यवस्थित नहीं होते हैं अक्रिस्टलीय ठोस कहलाते हैं। अक्रिस्टलीय ठोस असमाकृतिक कणों से बने होते हैं। इन ठोसों में अवयवी कणों की व्यवस्था केवल लघु परासी व्यवस्था (short range arrangement) होती है। यहाँ पर व्यवस्था और आवर्ती पुनरावृत पैटर्न केवल अल्प दूरियों तक देखा जाता है। इस प्रकार के ठोसों की संरचना द्रवों के सदृश होती है।
उदाहरण: काँच, रबर, प्लास्टिक आदि।
प्रश्न 2.
काँच, क्वार्ट्स जैसे ठोस से किस प्रकार भिन्न है? किन परिस्थितियों में क्वार्ट्स को काँच में रूपान्तरित किया जा सकता है।
उत्तर:
काँच, अक्रिस्टलीय ठोस है, जिसमें अवयवी कणों की व्यवस्था लघु परास की होती है जबकि क्वार्ट्स, क्रिस्टलीय ठोस है, जिसमें अवयवी कणों की व्यवस्था दीर्घ परासी प्रकार की होती है। क्वार्ट्स को पिघलाकर एवं तुरन्त ठण्डा करने पर यह काँच में परिवर्तित हो जाता है।

प्रश्न 3.
निम्नलिखित ठोसों का वर्गीकरण आयनिक, धात्विक, आण्विक, सहसंयोजक या अक्रिस्टलीय में कीजिए।
(i) टेदाफॉस्फोरस डेकॉक्साइड (P4 O10)
(ii) अमोनियम फॉस्फेट [(NH4)3 PO4]
(iii) SIC
(iv) I2
(V) P4
(vi) प्लास्टिक
(vii) ग्रेफाइट
(viii) पीतल
(ix) Rb
(x) LiBr
(xi) Si
उत्तर:
आयनिक ठोस: [(NH4)3 PO4] तथा LiBr
धात्विक ठोस: पीतल, Rb
आण्विक ठोस: P4 O10 I2 P4
सहसंयोजक ठोस: ग्रेफाइट, SiC, Si
अक्रिस्टलीय: प्लास्टिक।
प्रश्न 4.
(i) उप-सहसंयोजन संख्या का क्या अर्थ है?
(ii) निम्नलिखित परमाणुओं की उप-सहसंयोजन संख्या क्या होती है?
(क) एक घनीय निविड संकलित संरचना।
(ख) एक अन्त:केन्द्रित घनीय संरचना।
उत्तर:
(i) किसी कण के निकटतम गोलों की संख्या को उसकी उप-सहसंयोजन संख्या कहा जाता है। आयनिक क्रिस्टल में किसी आयन की उप-सहसंयोजन संख्या इसके चारों ओर उपस्थित विपरीत आवेशयुक्त आयनों की संख्या होती है।
(ii) (क) एक घनीय निविड संकुलित संरचना में केन्द्रीय परमाणु की उप-सहसंयोजन संख्या 12 होती है।
(ख) एक अन्त:केन्द्रित घनीय संरचना में उप-सहसंयोजन संख्या 8 होती है।
प्रश्न 5.
यदि आपको किसी अज्ञात धातु का घनत्व एवं एकक कोष्ठिका की विमाएँ ज्ञात हैं तो क्या आप उसके परमाण्विक द्रव्यमान की गणना कर सकते हैं? स्पष्ट कीजिए।
उत्तर:

\(=\frac{\mathrm{M} \times \mathrm{Z}}{\mathrm{N}_{\mathrm{A}} \times a^3}\) य \(\mathrm{M}=\frac{d \times \mathrm{N}_{\mathrm{A}} \times a^3}{\mathrm{Z}}\)
किसी अज्ञात धातु का घनत्व एवं एकक कोष्ठिका की विमाएँ ज्ञात होने पर उपर्युक्त सूत्र की सहायता से उसके परमाण्विक द्रव्यमान की गणना की जा सकती है।
प्रश्न 6.
किसी क्रिस्टल की स्थिरता उसके गलनांक के परिमाण द्वारा प्रकट होती है।' टिप्पणी कीजिए। पाठ्य पुस्तक में दिये गए आँकड़ों की सहायता से जल, एथिल ऐल्कोहॉल, डाइएथिल ईथर तथा मेथेन के गलनांक एकत्र कीजिए। इन अणुओं के मध्य अन्तराआण्विक बलों के बारे में आप क्या कह सकते हैं?
उत्तर:
गलनांक उच्च होने पर अवयवी कणों को एक साथ बाँधे रखने वाले बल प्रबल होंगे, परिणामस्वरूप स्थायित्व अधिक होगा।
पाठ्य पुस्तक में दिये गए आंकड़ों के आधार पर इन पदार्थों के गलनांक निम्नलिखित हैं:
जल = 273K,
एथिल ऐल्कोहॉल = 155.7K,
डाइएथिल ईथर = 156.8K,
मेथेन = 90.5K
जल तथा एथिल ऐल्कोहॉल में अन्तराआश्विक बल मुख्यतः हाइड्रोजन बन्ध के कारण होते हैं। ऐल्कोहॉल की तुलना में जल उच्च गलनांक प्रदर्शित करता है, क्योंकि एथिल ऐल्कोहॉल अणुओं में हाइड्रोजन बन्ध जल के समान प्रबल नहीं होता है। डाइएथिल ईथर एक धूवी अणु है। इसमें उपस्थित अन्तराआण्विक बल द्विध्रुव-द्विध्रुव आकर्षण बल है। मेथेन एक अध्रुवी अणु है। इसमें केवल दुर्बल वाण्डर वाल्स बल (लण्डन प्रकीर्णन बल) होते हैं।

प्रश्न 7.
निम्नलिखित युगलों के पदों (शब्दों) में कैसे विभेद करोगे?
(i) षट्कोणीय निविड संकुलन एवं घनीय निविड संकुलन
(ii) क्रिस्टल जालक एवं एकक कोष्ठिका
(iii) चतुष्पलकीय रिक्ति एवं अष्टफलकीय रिक्ति।
उत्तर:
|
षट्कोणीय निविड संकुलन |
घनीय निविड संकुलन |
|
1. इस संकुलन से चतुष्फलकीय रिक्ति का आच्छादन होता है। |
1. इस संकुलन से अष्टफलकीय रिक्ति का आच्छादन होता है। |
|
2. यहाँ तृतीय परत के गोले प्रथम परत के साथ पूर्णत: सरेखित होते हैं तथा चतुर्थ परत के गोले, द्वितीय परत के साथ संरेखित होते हैं। |
2. यहाँ चतुर्थ परत के गोले प्रथम परत तथा पाँचवीं परत के गोले द्वितीय परत के साथ सरेखित होते हैं। |
|
3. यह पैटर्न AB – AB प्रकार का पैटर्न होता है। |
3. यह पैटर्न ABC - ABC प्रकार का होता है। |
|
4. यह व्यवस्था Mg तथा Zn में पायी जाती है।
|
4. यह व्यवस्था Cu, Ag, Au आदि में पायी जाती है। |
(II) क्रिस्टल जालक एवं एकक कोष्ठिका में अन्तर:
|
क्रिस्टल जालक (Crystal Lattice) |
एकक कोष्ठिका (Unit Cell) |
|
क्रिस्टलीय ठोसों का मुख्य अभिलक्षण अवयवी कणों का नियुमित और पुनरावृत पैटर्न है। यदि क्रिस्टल में अवयवी कणों की त्रिविमीय व्यवस्था को आरेख के रूप में निरूपित किया जाए, जिसमें प्रत्येक बिन्दु को चित्रित किया गया हो तो इस व्यवस्था को क्रिस्टल जालक कहते हैं। कुल 14 प्रकार के त्रिविमीय जालक सम्भव हैं। |
यह क्रिस्टल जालक का लघुतम भाग है। जब क्रिस्टल जालक बनाना हो तो एकक कोष्ठिका को विभिन्न, दिशाओं में पुनरावृत किया जाता है। |
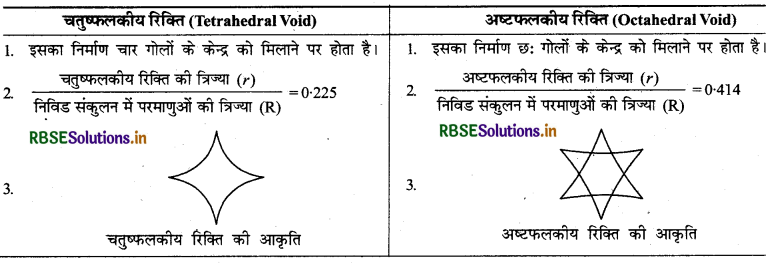
(III) चतुष्फलकीय रिक्ति एवं अष्टफलकीय रिक्ति में अन्तर:
प्रश्न 8.
निम्नलिखित जालकों में से प्रत्येक की एकक कोष्ठिका में कितने जालक बिन्दु होते हैं?
(i) फलक-केन्द्रित घनीय,
(ii) फलक-केन्द्रित चतुष्कोणीय,
(iii) अन्तःकेन्द्रित एकका
उत्तर:
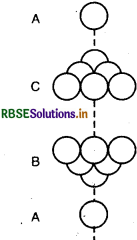
(i) फलक केन्द्रित घनीय (Face centred cubic): फलक केन्द्रित घनीय एकक कोष्ठिका में कुल जालक बिन्दु (lattice point) 14 होते हैं एवं अवयवी कणों या परमाणुओं की संख्या 4 होती है।
8 (कोने पर स्थित परमाणु) x 1/8 (परमाणु प्रति कोना) + 6 (फलक केन्द्रित परमाणु) x 1/2 (परमाणु प्रति फलक) = 8 x 1/8 + 6 x 1/2 = 4 (परमाणु या अवयवी कण)
(ii) फलक केन्द्रित चतुष्कोणीय (Face centred tetragonal)इसमें भी कुल जालक बिन्दु (lattice point) 14 एवं अवयवी कणों की संख्या 4 होती है।
(iii) अन्त:केन्द्रित घनीय (Body centred cubic): इसमें कुल जालक बिन्दुओं की संख्या 10 होती हैं एवं अवयवी कणों की संख्या निम्न प्रकार से है
8 (कोने) x 1/8 (परमाणु प्रति कोना) + 1 (अन्त:केन्द्र) x 1(परमाणु प्रति अन्त केन्द्र) = 1 + 1 - 2 (परमाणु या अवयवी कण)
प्रश्न 9.
समझाइए:
(i) धात्विक एवं आयनिक क्रिस्टलों में समानता एवं विभेद का आधार।
(ii) आयनिक ठोस कठोर एवं भंगुर होते हैं।
उत्तर:
(i) धात्विक एवं आयनिक क्रिस्टलों में समानताएँ (Similarities in metallic and ionic crystals)
(a) दोनों ही क्रिस्टलों में स्थिर विद्युत् आकर्षण बल होता है। आयनिक क्रिस्टलों में यह धनायन एवं ऋणायनों के मध्य होता है जबकि धातुओं में यह संयोजी इलेक्ट्रॉनों (valence electrons) तथा करनेल (Kernels) के मध्य होता है।
(b) दोनों के गलनांक उच्च होते हैं।
(c) दोनों स्थितियों में बन्ध अदैशिक (Non-directional) होता है।
धात्विक एवं आयनिक क्रिस्टलों के मध्य विभेद (Difference between Metallic and Ionic Crystals):
|
धात्विक क्रिस्टल |
आयनिक क्रिस्टल |
|
(i) धातु में संयोजी इलेक्ट्रॉन बँधे नहीं होते, अपितु मुक्त रहते हैं अतः ये ठोस अवस्था में भी विद्युत् का चालन करते हैं। |
(i) इनमें आयन ठोस अवस्था में गति करने के लिए स्वतन्त्र नहीं होते, अतः ये ठोस अवस्था में कुचालक होते हैं। गलित एवं जलीय विलयन में ये विद्युत् का चालन करते हैं क्योंकि इस अवस्था में आयन मुक्त हो जाते हैं। |
|
(ii) इस प्रकार के क्रिस्टल में बन्ध प्रबल व दुर्बल दोनों प्रकार के हो सकते हैं। यह इनमें उपस्थित संयोजी इलेक्ट्रॉन की संख्या एवं करनेल के आकार पर निर्भर करता है। |
(ii) इनमें बन्ध अर्त्यधिक प्रबल होते हैं। |
(ii) आयनिक ठोस कठोर व भंगुर होते हैं क्योंकि इनमें प्रवल स्थिर वैद्युत् आकर्षण बल उपस्थित होता है एवं बंध अदिशात्मक होते हैं।

प्रश्न 10.
निम्नलिखित के लिए धातु के क्रिस्टल में संकुलन क्षमता की गणना कीजिए:
(i) सरल घनीय
(ii) अन्त:केन्द्रित घनीय
(iii) फलक केन्द्रित घनीय।
(यह मानते हुए कि परमाणु एक-दूसरे के सम्पर्क में हैं।)
उत्तर:
जैसा कि हम जानते हैं कि क्रिस्टल जालक में अवसवी कण निविड संकुलित अवस्था में रहते हैं। उस अवस्था में कुछ स्थान खाली रह जाता है, जिसे रिक्ति (void) कहा जाता हैं अर्थात् किसी क्रिस्टल जालक का सम्पूर्ण स्थान अवयवी कणों द्वारा नहीं घेरा जाता है। "किसी भी क्रिस्टल जालक में उपस्थित कण क्रिस्टत्न जालक के कुल आयतन का जितना भाग घेरते हैं, उसे क्रिस्टल जालक की संकुलन क्षमता (packing efficiency) कहा जाता है।" संकुलन क्षमता को हम निम्न सुत्र के द्वारा निकाल सकते हैं।

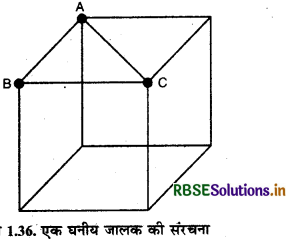
1.7.1. hcp या ccp या fcc संरचनाओं में संकुलन क्षमता (Packing Efficiency in hcp or ccp or fcc Structures):
परमाणु की त्रिज्या = r
एक कोष्ठिका में कोर (edge या किनारे) की लम्बाई = a
एक गोले का आयतन = \(\frac{4}{3}\left(\pi r^3\right)\)
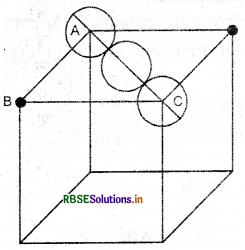
चूंकि fcc संरचना चार गोलों से बनती है अतः चार गोलों का आयतन = \(4 \times \frac{4}{3}\left(\pi r^3\right)=\frac{16}{3}\left(\pi r^3\right)\) \({3}\left(\pi r^3\right)\) ∆ ABC में,
AC2 = AB2 + BC2
= a2 + a2
\(\mathrm{AC}=a \sqrt{2}\)
यदि हम AC को देखें तो इसमें गोलों की व्यवस्था निम्न प्रका होती है:
अतः AC = r
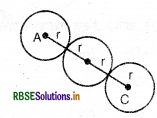
AC का मान समीकरण
(i) में रखने पर,
य \(4r = a\sqrt{2}\)
\(\frac{4 r^r}{\sqrt{2}}=a\)
घन का आयतन = \((a)^3=\left(\frac{4 r}{\sqrt{2}}\right)^3=\frac{64 r^3}{2 \sqrt{2}}\)
अतः % संकुलन क्षमता

\(=\frac{\frac{16}{3} \pi r^3}{\frac{64 r^3}{2 \sqrt{2}}} \times 100=74 \%\)
अर्थात् fcc या ccp या hcp संरचना में गोलों या कणों द्वारा घेरा गया कुल आयतन 74% होता है। जबकि यहाँ पर खाली बचा स्थान अर्थात् कुल रिक्तिका का आयतन 26% होता है।
1.7.2. अन्तः केन्द्रित घनीय संरचनाओं में संकुलन क्षमता (Packing Efficiencyin Body Centred CubicStructure; bcc ):
परमाणु की त्रिज्या = r
एकक कोष्ठिका में कोर की लम्बाई = a
चूंकि bcc संरचना दो गोलों से बनती है अतः
दो गोलों का आयतन = \(=2 \times\left(\frac{4}{3} \pi r^3\right)=\frac{8}{3} \pi r^3\)
∆ ABC में,
AC2 = AB2 + BC2
= a2 + a2
या AC2 = 2a2
∆ ABC में,
AD2 = AC2 + CD2
AD2 = 2a2 + a2
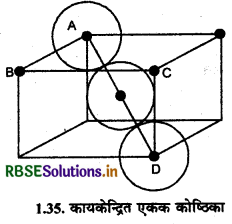
या AD2 = 3a2
या AD = \(\sqrt{3 a^2}\)
∴ AD = \(a \sqrt{3}\) ........(i)
यदि हम AD को देखें तो इसमें गोलों की व्यवस्था निम्न प्रकार से होती है:
अर्थात् AD = 4r
AD का मान समीकरण (i) में रखने पर,
4r = \(a \sqrt{3}\)
या
\(a=\frac{4 r}{\sqrt{3}}\)
घंन का आयतन = (a)3
\(=\left(\frac{4 r}{\sqrt{3}}\right)^3=\frac{64 r^3}{3 \sqrt{3}}\)
अत: % संकुलन क्षमता

\(=\frac{\frac{8}{3} \pi r^3}{\frac{64 r^3}{3 \sqrt{3}}} \times 100=68 \%\)
अर्थात् bcc संरचना में गोलों या कणों द्वारा घेरा गया कुल आयतन 68% होता है। जबकि यहाँ पर खाली बचा स्थान अर्थात् रिक्ति का आयतन 32% होता है।
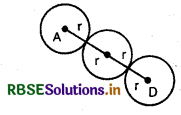
1.7.3. सरल घनीय जालक में संकुलन क्षमता [Packing Efficiency in Simple Cubic Unit Cell (scc)]:
परमाणु की त्रिज्या = r
एकक कोष्ठिका में कोर की लम्बाई = a
चूंकि scc संरचना एक गोले से बनती है, अत:
एक गोले का आयतन = \(\frac{4}{3} \pi r^3\)
एक सरल घनीय जालक में एक परमाणु केवल घन के कोनों पर उपस्थित होते हैं। घन के किनारों पर कण एक-दूसरे के सम्पर्क में होते है।
इसलिए इस व्यवस्था में घन के कोर अथवा भुजा की लम्बाई ' a' तथा प्रत्येक परमाणु की त्रिज्या ' r ' निम्न प्रकार से सम्बन्धित हैं,
a = 2r
घनीय एकक कोष्ठिका का आयतन
= \( (a)^3=(2 r)^3=8 r^3\)
अत:, % संकुलन क्षमता
= 
= \(\frac{\frac{4}{3} \pi r^3}{8 r^3} \times 100=52 \cdot 36 \%\) या 52.4%
अर्थात् scc संरचना में गोलों या कणों द्वारा घेरा गया कुल आयतन 52.4 % होता है। जबकि यहाँ पर खाली बचा स्थान अर्थात् कुल रिक्ति का आयतन 47.6 % होता है।
यह भी जाने:
कोर लम्बाई तथा परमाणु की त्रिज्या (r) में सम्बन्ध (Relation Between Edge Length and Radius (bold symbol) of Atom):
(i) सरल घनीय जालक में,
(ii) कायकेन्द्रित घनीय जालक में,
\(a=\frac{4 r}{\sqrt{3}} \text {}\)
(iii) फलक केन्द्रित घनीय जालक में,
\(a=2 \sqrt{2} r\)
कोर लम्बाई एवं निकटतम परमाणुओं के बीच की दूरी में सम्बन्ध (Relation Between Distance of Nearest Neighbouring Atoms and Edge Length):
(i) सरल घनीय एकक कोष्ठिका के लिये
d = a
(ii) फलक केन्द्रित घनीय एकक कोष्ठिका के लिये
\(d=\frac{a}{\sqrt{2}}\)
(iii) अन्तःकेन्द्रित घनीय एकक कोष्ठिका के लिये,
\(d=\frac{\sqrt{3} a}{2}\)

प्रश्न 11.
चाँदी का क्रिस्टलीकरण fcc जालक में होता है। यदि इसकी कोष्ठिका के कोरों की लम्बाई 4.07 x 10-8 cm तथा घनत्व 10.5 g cm-3 हो तो चाँदी का परमाण्विक द्रव्यमान ज्ञात कीजिए।
उत्तर:
दिया है, fee जालक में प्रति एकक कोष्ठिका में परमाणुओं की संख्या (Z) = 4
कोर की लम्बाई (a) = 4.07 x 10-8 cm
घनत्व (d) = 10.5 g/cm-3
आवोगाद्रो संख्या (NA) = 6.022 x 1023 mol-
परमाण्विक द्रव्यमान (M) = ?
एकक कोष्ठिका का घनत्व, d = \(\frac{\mathrm{Z} \times \mathrm{M}}{a^3 \times \mathrm{N}_{\mathrm{A}}}\)
यहाँ M ठोस का मोलर द्रव्यमान है। 'a' एकक कोष्ठिका के कोर को लम्बाई है।
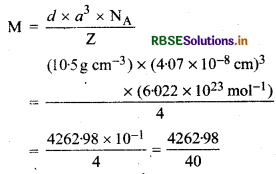
=106.57g mol
प्रश्न 12.
एक घनीय ठोस दो तत्वों P एवं Q से बना है। धन के कोनों पर ए परमाणु एवं अन्त:केन्द्र पर P परमाणु स्थित हैं। इस यौगिक का सूत्र क्या है? P एवं Q की उप-सहसंयोजन संख्या क्या है
उत्तर:
प्रति एकक कोष्ठिका में P परमाणुओं की संख्या
= 1 x 1 = 1
प्रति एकक कोष्ठिका में Q परमाणुओं की संख्या
= 8 x 1/8 = 1
अतः यौगिक का सूत्र PQ है।
P तथा Q प्रत्येक की उप-सहसंयोजन संख्या = 8
प्रश्न 13.
नियोबयम का क्रिस्टलीकरण अन्त:केन्द्रित घनीय संरचना में होता है। यदि इसका घनत्व 8:55 g cm-3 हो तो इसके परमाण्विक द्रव्यमान 93u का प्रयोग करके परमाणु त्रिज्या की गणना कीजिए।
उत्तर:
दिया गया है, bcc जालक में प्रति एकक कोष्ठिका में परमाणुओं की संख्या (Z) = 2
घनत्व 'd = 8:55g/cm3
परमाण्विक द्रव्यमान (M) = 93u
आवोगाद्रो संख्या (N) = 6.022 x 1023 mol-
परमाणु त्रिज्या (r) = ?
\(d=\frac{\mathrm{Z} \times \mathrm{M}}{a^3 \times \mathrm{N}_{\mathrm{A}}}\)
या \(8.55=\frac{2 \times 93}{(a)^3 \times 6.022 \times 10^{23}}\)
या \(a^3=\frac{2 \times 93}{8.55 \times 6.022 \times 10^{23}}\)
= 3.163 × 10-23
या a3 = 36.13 × 10-24
दोनों तरफ log लेने पर
\(\log a^3=\log 36 \cdot 13 \times 10^{-24}\)
या log a3 = log 36.13 + log 10-24
या log a3 = 15.38 - 24
या 3log a = - 22.442
या \(\log a=\frac{-22 \cdot 442}{3}\)
या log a = -7.4806
या a = Antilog (-74806)
या a = 3.304 x 10-8 cm
bcc के लिए \(r=\frac{\sqrt{3} a}{4}\)
\(\begin{aligned} &=\frac{\sqrt{3} \times 3.304 \times 10^{-8}}{4} \\ &=\frac{1.732 \times 3.304}{4} \times 10^{-8} \end{aligned}\)
= 143.06 10-8 cm
परमाणु की त्रिज्या = 143.06 pm
प्रश्न 14.
यदि अष्टफलकीय रिक्ति की त्रिज्या हो तथा निविड संकुलन में परमाणुओं की त्रिज्या R हो तो एवं R में सम्बन्ध स्थापित कीजिए।
उत्तर:
अष्टफलकीय रिक्ति को प्रस्तुत चित्र में गोले के द्वारा दिखाया गया है। रिक्ति के ऊपर तथा नीचे उपस्थित गोले चित्र में नहीं दिखाये गये हैं।
माना परमाणु की त्रिज्या 'R' तथा रिक्ति की त्रिज्या है तथा 'a' कोर की लम्बाई है। यहाँ ABC एक समकोण त्रिभुज है अत: पाइथागोरस सिद्धान्त के अनुसार,
AC2 =AB2 + BC2
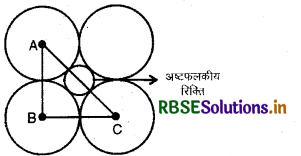
या \(A C=\sqrt{A B^2+B C^2}\)
या \(\mathrm{AC}=\sqrt{a^2+a^2}\)
परन्तु, AC = 2R + 2r
अतः 2R + 2r = \(\sqrt{2 a^2}\)
या 2R + 2r = \(a \sqrt{2}\)
यदि a = 2R
तो \(2 \mathrm{R}+2 r=2 \mathrm{R} \sqrt{2}\)
या \(\frac{2 R}{2 R}+\frac{2 r}{2 R}=\sqrt{2}=1+\frac{r}{R}=1.414\)
\(\frac{r}{\mathrm{R}}=1.414-1\)
\(\frac{r}{\mathrm{R}}=0.414\)
प्रश्न 15.
कॉपर / जालक रूप में क्रिस्टलीकत होता है जिसके कोर की लम्बाई 3.61 x 10-8 cm है। यह दर्शाइए कि गणना किए गए घनत्व के मान तथा मापे गए घनत्व 8.92 g cm-1 में समानता है।
उत्तर:
एकक कोष्ठिका का घनत्व, d = \(\frac{\mathrm{Z} \times \mathrm{M}}{a^3 \times \mathrm{N}_{\mathrm{A}}}\)
कॉपर fcc जालक के लिए, Z = 4,
(आवगादो संख्या ) N = 6.022 x 1023 mol-
कोर की लम्बाई 'a' = 3.61 x 10-8 cm
कॉपर का परमाण्विक
M = 63.5 g mol-

= 8.97 g cm-3
स्पष्ट है कि उपर्युक्त मान मापे गए घनत्व के मान के लगभग समान है।

प्रश्न 16.
विश्लेषण द्वारा ज्ञात हुआ कि निकिल ऑक्साइड का सूत्र Ni 0.98 O1.00है। निकिल आयनों का कितना अंश NI और N+ के रूप में विद्यमान है?
उत्तर:
निकिल ऑक्साइड का सूत्र = Ni 0.98 O1.00
माना कि Ni2+ आयनों की संख्या = x,
अत: Ni2+ पर आवेश = + 2x
तो Ni3+ आयनों की संख्या = 0.98 - x,
अतः Ni3+ पर आवेश = + 3[ 0.98 - x]
ऑक्साइड आयनों पर आवेश = - 2,
चूँकि यौगिक पर कुल आवेश शून्य है अत:
+2 x + 3(0.98 - x) - 2 = 0
2 x + 2.94 - 3 x - 2 = 0
-x = - 0.94
x = 0.94
Ni2+ आयनों का प्रतिशत = = 96%
Ni3+ आयनों का प्रतिशत =100 - 96 = 4%
प्रश्न 17.
अर्द्ध-चालक क्या होते हैं? दो मुख्य अर्द्धचालकों का वर्णन कीजिए एवं उनकी चालकता क्रियाविधि में विभेद कीजिए।
उत्तर:
अर्द्ध-चालक (Semi-conductors): वे ठोस जिनकी चालकता 10-6 से 104 \(\Omega^{-1} \mathrm{~m}^{-1}\) तक के मध्यवर्ती परास में होती है, अर्द्ध-चालक कहलाते हैं। इनमें चालक बैण्ड एवं संयोजक बैण्ड के मध्य ऊर्जा अन्तराल कम होता है। अत: कुछ इलेक्ट्रॉन चालक बैण्ड में जा सकते हैं एवं कुछ नहीं। ताप को बढ़ाने पर इन इलेक्ट्रॉन की ऊर्जा बढ़ जाती है और इलेक्ट्रॉन आसानी से संयोजक बैण्ड में आ-जा सकते हैं अतः ताप बढ़ाने पर अर्द्ध-चालकों की चालकता बढ़ जाती है। सिलिकन एवं जर्मेनियम इस प्रकार का व्यवहार प्रदर्शित करते हैं अतः इन्हें आन्तर-अर्द्ध-चालक (Intrinsic semi-conductor) कहते हैं। इनमें उचित अशुद्धि को उपयुक्त मात्रा में मिलाने से इनकी चालकता बढ़ जाती है। इसे अपमिश्रण (doping) कहते हैं। इससे दो प्रकार के अर्द्ध-चालक बनते हैं।
इनकी चालकता क्रियाविधि निम्नलिखित है:
- n - प्रकार के अर्द्ध-चालक (n - type semicon-ductor)
- p - प्रकार के अर्द्ध-चालक (p - type semicon-ductor)
चालकता के आधार पर ठोसों को तीन वर्गों में वर्गीकृत किया जा सकता है:
- चालक (Conductors),
- रोधक बा विद्युतरोधी (Insulators),
- अर्द्धचालक (Semi-conductors)।
(i) चालक (Conductors): वे ठोस जिनमें से विद्युत् धारा की अधिक मात्रा प्रवाहित होती है, चालक कहलाते है। इनकी चासकत्वा की परास 10-4 से 10-7 ohm-1 m-1 के मध्य होती है। ये दो प्रकार के होते है:
(अ) धात्विक चालक (Metallic eonductors),
(ब) वैद्युत् अपचट्य चालक (Electrolytic conductors)।
धात्विक चालकों में विद्युत् चालकता इलेक्ट्रॉनों की गतिशीलता के कारण होती है। धातु टोस एवं गलित दोनों अवस्थाओं में विद्युत् का चालन करती है। धातुऑं की चालकरा प्रति परमाणु संयोज़ी इलेक्ट्रॉनों की संख्या पर निर्भर करती है। ताप बढ़ाने पर चालकों की चालकता कम हो जाती है। धातु से जब विद्युत् धारा का प्रबाह होता है तो उसमें कोई भी रासायानक परिवर्तन नहीं होता है।
वहीं दूसरी और वैद्युत् अपषट्य चालक टोस अवस्था में बहुत ही कम मात्रा में विद्युत् का चालन करते है वह भी त्रुटि के कारण। वैद्युत अपघट्य गलित अवस्था (Fused state) में तथा अपने विलयन में विद्युत् का चालन करते हैं। विद्युत का चालन आयायनों की गतिशीलता के कारण होता है।
(ii) रोधक (Insulators): खे ठोस जो विद्युत् धारा प्रवाहित नहीं कर सकते, रोधक कहलाते है। इनकी चालकता बहुता कम 10-20 से 10-10 ohm-1 m-1के परास के मध्य होती है। उदाहरणार्थ: सल्फर, फॉस्फोरस, लकड़ी, प्लास्टिक, रबर अदि।
(iii) अर्द्धचालक (Semi-conductors)-वे ऐोस जिनकी चालका चासकों एवं रोधक के मध्य की होती है, अर्द्धचालक कहलाते हैं। इनकी चालकता 10-6 से 104 ohm-1 m-1 के परास के मध्य की होती है। इनकी चालकता अशुद्धि तथा जालक त्रुटियों के कारण होती है तथा ताप के साथ बढ़ती है।

प्रश्न 18.
नॉन-स्टॉइकियोमीटी क्यूप्रस ऑक्साइड, Cuo प्रयोगशाला में बनाया जा सकता है। इसमें कॉपर तथा ऑक्सीजन का अनुपात 2:1 से कुछ कम है। क्या आप इस तथ्य की व्याख्या कर सकते हैं कि यह पदार्थ प्रकार का अर्द्ध-चालक है?
उत्तर:
क्यूप्रस ऑक्साइड (Cu,O) में कॉपर तथा ऑक्सीजन का अनुपात 2 : 1 से कुछ कम होना यह प्रदर्शित करता है कि कुछ क्यूप्रस (Cu") आयन, क्यूपिक (CIN) आयनों से प्रतिस्थापित हो गए हैं। विद्युत् उदासीनता को बनाए रखने के लिए प्रत्येक दो Cu' आयन एक Cu2+ आयन से प्रतिस्थापित होंगे तथा एक छिद्र निर्मित होगा। चूंकि चालन इन धनावेशित छिटों की उपस्थिति के कारण होगा; अत: यह एक p-प्रकार का अर्द्ध-चालक है।
प्रश्न 19.
फेरिक ऑक्साइड, ऑक्साइड आयन के षट्कोणीय निविड संकुलन में क्रिस्टलीकृत होता है जिसकी तीन अष्टफलकीय रिक्तियों में से दो पर फेरिक आयन होते हैं। फेरिक ऑक्साइड का सूत्र ज्ञात कीजिए।
उत्तर:
माना संकुलन में ऑक्साइड आयनों (O-2) की संख्या N है।
∴ अष्टफलकीय रिक्तियों की संख्या = N
चूँकि दो-तिहाई अष्टफलकीय रिक्तियाँ फेरिक आयनों द्वारा अध्यासित हैं, इसलिए उपस्थित फेरिक आयनों की संख्या
\(=\frac{2}{3} \times N=\frac{2 N}{3}\)
∴ Fe3+ तथा O2- का अनुपात,
Fe3+ : O2- = \(\frac{2 \mathrm{~N}}{3}\) : N = 2 : 3
अतः फेरिक ऑक्साइड का सूत्र Fero, है।
प्रश्न 20.
निम्नलिखित को-प्रकार या प्रकार के अर्द्ध-चालकों में वर्गीकृत कीजिए:
(i) In से डोपित Ge,
(ii) P से डोपित Si.
उत्तर:
- Ge आवर्त सारणी के वर्ग 14 से सम्बन्धित है तथा In वर्ग 13 का तत्व है। अत: Ge को In से डोपित करने पर एक इलेक्ट्रॉन-न्यून छिद्र बन जाता है इसलिए यह p- प्रकार का अर्द्ध-चालक है।
- Si वर्ग 14 का तत्व है तथा B वर्ग 13 का तत्व है। B से डोपित Si में एक इलेक्ट्रॉन न्यून छिद्र बन जाता है। अत: यह p-प्रकार का अर्द्ध-चालक है।
प्रश्न 21.
सोना (परमाणु त्रिज्या = 0.144 nm) फलक केन्द्रित एकककोष्ठिका में क्रिस्टलीकृत होता है। इसकी कोष्ठिका के कोर की लम्बाई ज्ञात कीजिए।
उत्तर:
फलक केन्द्रित धनीय (fec) संरचना के लिए, एकक कोष्ठिका के कोर की लम्बाई,
\(a=2 \sqrt{2} r\)
यहाँ r परमाणु त्रिज्या है।
a = \(2 \sqrt{2}\) x (0.144 nm)
= 2 x 1.414 x 0.144
= 0.407 nm

प्रश्न 22.
बैण्ड सिद्धान्त के आधार पर:
(i) चालक एवं रोधी
(ii) चालक एवं अर्द्ध-चालक में क्या अन्तर होता है?
उत्तर:


प्रश्न 23.
उचित उदाहरणों द्वारा निम्नलिखित पदों को परिभाषित कीजिए:
(i) शॉट्की दोष,
(ii) फ्रेंकेल दोष,
(iii) अन्तराकाशी दोष,
(iv) F-केन्द्र।
उत्तर:
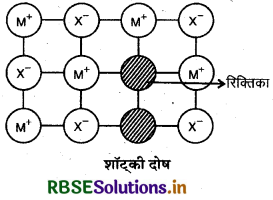
(i) शॉट्की दोष (Schottky defect): इस प्रकार के दोष में धनायन एवं ऋणायन बराबर संख्या में आयनिक ठोसों से लुप्त हो जाते हैं तथा उस स्थान पर रिक्तिका का निर्माण हो जाता है। यह उन पदार्थों द्वारा दिखाया जाता है जिनमें धनायनों एवं ऋणायनों का आकार लगभग समान होता है। इस दोष के कारण ठोसों के घनत्व में कमी आ जाती है एवं इनकी चालकता बढ़ जाती है। उदाहरण: NaCl, KCI, CsCl, AgBr आदि।
(ii) फ्रेंकेल दोष (Frenkel defect): इस प्रकार के दोष में लघुतर आयन अपने स्थान को छोड़कर अन्तराकाशी
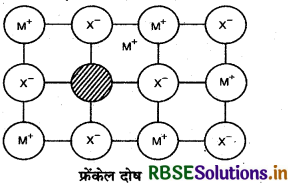
फ्रेंकेल दोष स्थान में आ जाता है। इसे विस्थापन दोष भी कहते हैं। इससे घनत्व परिवर्तित नहीं होता। यह उन ठोसों के द्वारा दिखाया जाता है जिनमें आयनों के आकार में अधिक अन्तर होता है। उदाहरण: ZnS, AgCI, AgBr और AgI आदि।
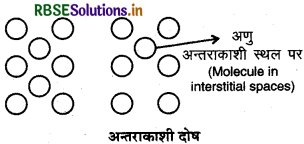
(iii) अन्तराकाशी दोष (Interstitial defect): जब अवयवी कण जैसे परमाणु अथवा अणु बाहर से आकर ठोसों के अन्तराकाशी स्थल को ग्रहण कर लेते हैं तब अन्तराकाशी दोष उत्पन्न होता है। इससे पदार्थ का घनत्व बढ़ जाता है। यह दोष अनआयनिक ठोसों में पाया जाता है।
(iv) F - केन्द (F-centre): निर्मुक्त इलेक्ट्रॉन द्वारा विसरित होकर क्रिस्टल के ऋणायनिक स्थल को अध्यासित करने पर F - केन्द्र बनता है अर्थात् अयुग्मित इलेक्ट्रॉनों द्वारा भरी ऋणायनिक रिक्तिका को F - केन्द्र कहते हैं। यह रंग के लिए उत्तरदायी होता है।
उदाहरण: NaCl का पीला होना, LiCI का गुलाबी होना, KCI का बैंगनी होना आदि।
प्रश्न 24.
ऐलुमिनियम घनीय निविड संकुलित संरचना में क्रिस्टलीकृत होता है। इसका धात्विक अर्द्धव्यास 125 pm है।
(i) एकक कोष्ठिका के कोर की लम्बाई ज्ञात कीजिए।
(ii) 1.0 cm3 ऐलुमिनियम में कितनी एकक कोष्ठिकाएँ होंगी?
उत्तर:
(i) एक fcc एकक कोष्ठिका के लिए \(r=\frac{a}{2 \sqrt{2}}\)
\(a=2 \sqrt{2} r\)
= 2 x 1.414 x 125
= 353.5 pm
(ii) एकक कोष्ठिका का आयतन
= a3
\(\begin{aligned} &=\left(3.535 \times 10^{-8} \mathrm{~cm}\right)^3 \\ &=442 \times 10^{-25} \mathrm{~cm}^3 \end{aligned}\)
= 442 x 10-25 cm3
= 1 एकक कोष्ठिका का आयतन
अत: 1 cm3 आयतन में एकक कोष्ठिकाओं की संख्या
\(=\frac{1}{442 \times 10^{-25}}\)
= 2.26 x 1022

प्रश्न 25.
यदि NaCI को Srci, के 11 मोल % से डोपित किया जाये तो धनायनों की रिक्तियों का सान्द्रण क्या होगा?
उत्तर:
NaCl को SrCl2 के 10-3 मोल % से डोपित करते हैं।
अर्थात् 100 भाग NaCI में = 10-3 मोल SrCl2
1 भाग NaCI में = \(\frac{10^{-3}}{100}\) मोल SrCl2
= 10-5 मोल SrCl2
= 6.022 x 1023 x 10-5 SrCl2
= 6.022 x 1018 SrCl2
चूँकि प्रत्येक Sr2+ आयन एक रिक्ति उत्पन्न करता है, अतः
रिक्तियाँ = 6.022 x 1018
प्रश्न 26.
निम्नलिखित को उचित उदाहरणों से समझाइए:
(i) लोहचुम्बकत्व
(ii) अनुचुम्बकत्व
(iii) फेरी- चुम्बकत्व
(iv) प्रति लोहचुम्बकत्व
(v) 12-16 और 13-15 वर्षों के यौगिक।
उत्तर:
(i), (i), (i) तथा (iv) के उत्तर के लिए कृपया अनुच्छेद 1.10 का अध्ययन करें।
(v) 12 - 16 और 13 - 15 वर्गों के बौगिक-वर्ग 12 के तत्वों और वर्ग 16 के तत्वों से बने यौगिक 12 - 16 यौगिक कहलाते हैं; जैसे - Zns, HgTe आदि। वर्ग 13 के तत्वों और वर्ग 15 के तत्वों से बने यौगिक 13 - 15 यौगिक कहलाते हैं। जैसे - GaAS, AIP आदि।

- RBSE Class 12 Chemistry Notes Chapter 16 दैनिक जीवन में रसायन
- RBSE Class 12 Chemistry Notes Chapter 15 बहुलक
- RBSE Class 12 Chemistry Notes Chapter 14 जैव-अणु
- RBSE Class 12 Chemistry Notes Chapter 13 ऐमीन
- RBSE Class 12 Chemistry Notes Chapter 12 ऐल्डिहाइड, कीटोन एवं कार्बोक्सिलिक अम्ल
- RBSE Class 12 Chemistry Notes Chapter 11 ऐल्कोहॉल, फीनॉल एवं ईथर
- RBSE Class 12 Chemistry Notes Chapter 10 हैलोऐल्केन तथा हैलोऐरीन
- RBSE Class 12 Chemistry Notes Chapter 9 उपसहसंयोजन यौगिक
- RBSE Class 12 Chemistry Notes Chapter 8 d- एवं f-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 7 p-ब्लॉक के तत्व
- RBSE Class 12 Chemistry Notes Chapter 6 तत्वों के निष्कर्षण के सिद्धांत एवं प्रक्रम