RBSE Class 11 Chemistry Notes Chapter 9 हाइड्रोजन
These comprehensive RBSE Class 11 Chemistry Notes Chapter 9 हाइड्रोजन will give a brief overview of all the concepts.
Rajasthan Board RBSE Solutions for Class 11 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 11. Students can also read RBSE Class 11 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 11 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 11 Chemistry Chapter 9 Notes हाइड्रोजन
→ हाइड्रोजन-प्रकृति का सबसे हल्का तत्व जिसे हेनरी कैवेन्डिश ने 1766 में प्रयोगशाला में बनाया तथा 'ज्वलनशील गैस' का नाम दिया।
→ हाइड्रोजन का नाम-सन् 1783 में लेवोशिये ने दिया था, जिसका अर्थ है जल उत्पन्न करने वाली गैस।
→ स्रोत-ब्रह्माण्ड में सूर्य तथा पृथ्वी पर जल और रासायनिक क्रियाओं द्वारा भी हाइड्रोजन प्राप्त होती है। ज्वालामुखी तथा तेल के कुएँ भी हाइड्रोजन गैस के स्रोत हैं।
→ हाइड्रोजन के समस्थानिक-इसके तीन प्रमुख समस्थानिक ज्ञात हैं
- सामान्य हाइड्रोजन या प्रोटियम H,
- भारी हाइड्रोजन H (ड्यूटेरियम),
- अति भारी हाइड्रोजन H (ट्राइटियम)।
→ रेडियोधर्मी हाइड्रोजन-ट्राइटियम है |H जिसकी t1/2 (अर्ध आयु) 12.33 वर्ष है।
→ आवर्त सारणी में हाइड्रोजन का स्थान निश्चित नहीं है क्योंकि यह क्षार धातुओं, हैलोजनों तथा कार्बन से समानता दर्शाता है अतः इसे आवर्त सारणी में अलग से रखा गया है।
→ प्रयोगशाला में हाइड्रोजन का निर्माण-जल, अम्ल अथवा क्षार की धातुओं पर क्रिया द्वारा किया जाता है।
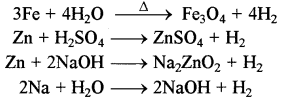

→ औद्योगिक स्तर पर-हाइड्रोजन को जल के विद्युत अपघटन द्वारा तथा ब्राइन के विद्युत अपघटन द्वारा बनाया जाता है।

→ हाइड्रोजन को लेन प्रक्रम, बॉश प्रक्रम तथा हाइड्रोकार्बन द्वारा भी बनाया जाता है।
→ हाइड्रोजन रंगहीन, गंधहीन, स्वादहीन जल में अविलेय गैस है।
→ हाइड्रोजन के दो नाभिकीय चक्रण समावयवी होते हैं जिन्हें आर्थो एवं पैरा हाइड्रोजन कहते हैं।
→ हाइड्रोजन की प्रमुख रासायनिक अभिक्रियाएँ निम्नलिखित
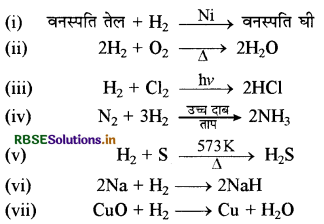
→ हाइड्रोजन के उपयोग-H2 का मुख्य उपयोग NH3 बनाने में, CH3OH बनाने में, वनस्पति तेलों के हाइड्रोजनीकरण में तथा रॉकेट में ईंधन के रूप में किया जाता है।
→ हाइड्राइड्स-हाइड्रोजन के द्विअंगी यौगिक हाइड्राइड कहलाते हैं। इन्हें तीन वर्गों में बाँटा गया है
- आयनिक हाइड्राइड-ये -S- खण्ड के तत्वों द्वारा बनाये जाते हैं। ये क्रियाशील तथा प्रबल अपचायक होते हैं जैसे—NaH, CaH2
- सहसंयोजक हाइड्राइड-ये सामान्यतया p खण्ड के तत्वों द्वारा बनाये जाते हैं। जैसे—CH4, NH3, PH3, HCl इत्यादि।
- अंतराकाशी हाइड्राइड-ये संक्रमण तत्वों द्वारा बनाये जाते हैं। इनमें जो रिक्त स्थान होता है, वह हाइड्रोजन द्वारा भर दिया जाता है।
TiH1.5-1.8, VHo.56
→ जल-(H2O) ऑक्सीजन का प्रमुख हाइड्राइड है। यह उदासीन प्रकृति का होता है तथा यह सार्वभौमिक विलायक है। इसमें ध्रुवीय सहसंयोजक बंध पाया जाता है एवं इसकी आकृति V के आकार की होती है।
→ जल के गुण-अंतराअणुक-हाइड्रोजन बंधन तथा संगुणन के कारण इसका क्वथनांक उच्च (100°C) होता है । यह sp3 संकरित अणु होता है तथा इसमें बंध कोण 104.5° होता है। इसका अधिकतम घनत्व 4°C पर होता है।
→ बर्फ का घनत्व जल से कम होता है अतः यह जल की सतह पर तैरती है।

→ जल की प्रमुख रासायनिक अभिक्रियाएँ-निम्नलिखित
- 2Na + 2H2O → 2NaOH + H2
- C + H2O →CO + H2
- HO + Cl → HCl + HClO
- Na2O + H2O → 2NaOH
- SO3 + H2O → H2SO4
- CaC2 + 2H2O → Ca(OH)2 + CH2
- Na2CO2 + HO → 2NaOH + CO
→ कठोरता-जल में दो प्रकार की कठोरता पायी जाती | है
- अस्थायी कठोरता
- स्थायी कठोरता।
→ अस्थायी कठोरता का कारण हाइड्रोजन कार्बोनेट्स की उपस्थिति है जबकि स्थायी कठोरता का कारण क्लोराइड तथा सल्फेट्स है।
→ जल की अस्थायी कठोरता को उबालकर तथा क्लार्क विधि द्वारा दूर किया जाता है।
→ जल की स्थायी कठोरता निम्नलिखित विधियों द्वारा दूर की जाती है
- धावन सोडा द्वारा
- परम्यूटिट विधि या आयन विनिमय विधि द्वारा
- केलगॉन विधि द्वारा
- आयन विनिमयक संश्लेषित रेजिन्स द्वारा
→ हाइड्रोजन परॉक्साइड बनाने की मुख्य विधियाँ निम्नलिखित हैं
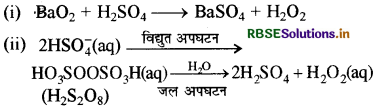
→ H2O2 का औद्योगिक उत्पादन 2 - एथिल - ऐन्थ्राक्विनॉल के स्वतः ऑक्सीकरण द्वारा किया जाता है।
→ H2O2 शीघ्रता से विघटित होता है तथा इसे नीले रंग की बोतल में रखते हैं ।
→ H2O2 की मुख्य रासायनिक अभिक्रियाएँ
(i) अपघटन 2H2O2 → 2H2O + O2
(ii) ऑक्सीकारक गुण
PbS + 4H2O2 → PbSO4 + 4H2O
Mn2++ + H2O2 → Mn4+ + 2OH-
(iii) अपचायक गुण
HOCl + H2O2 → H3O+ + Cl- + O2
2KMnO4 + 3H2SO4 + 5H2O2 → 2MnSO4 + K2SO4 + 8H2O + 5O2
(iv) विरंजक गुण - प्रबल ऑक्सीकारक गुण के कारण यह विरंजक का कार्य करता है ।
→ H2O2 की सान्द्रता को आयतन सान्द्रता में व्यक्त किया जाता है।
→ H2O2 की संरचना खुली किताब की तरह तथा असमतलीय होती है ।

→ भारी जल (D2O) – इसे 'यूरे' (Urey) ने खोजा था तथा यह सामान्य जल के 6000 भाग में 1 भाग होता है तथा उपयोग परमाणु भट्टियों में मंदक (Moderator) के रूप में किया जाता है
→ हाइड्रोजन भविष्य का ईंधन है ।

- RBSE Class 11 Chemistry Important Questions Chapter 2 Structure of Atom
- RBSE Solutions for Class 11 Chemistry Chapter 14 Environmental Chemistry
- RBSE Solutions for Class 11 Chemistry Chapter 13 Hydrocarbons
- RBSE Solutions for Class 11 Chemistry Chapter 12 Organic Chemistry - Some Basic Principles and Techniques
- RBSE Solutions for Class 11 Chemistry Chapter 11 The p-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 10 The s-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 9 Hydrogen
- RBSE Solutions for Class 11 Chemistry Chapter 8 Redox Reactions
- RBSE Solutions for Class 11 Chemistry Chapter 7 Equilibrium
- RBSE Solutions for Class 11 Chemistry Chapter 6 Thermodynamics
- RBSE Solutions for Class 11 Chemistry Chapter 5 States of Matter