RBSE Class 11 Chemistry Notes Chapter 7 साम्यावस्था
These comprehensive RBSE Class 11 Chemistry Notes Chapter 7 साम्यावस्था will give a brief overview of all the concepts.
Rajasthan Board RBSE Solutions for Class 11 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 11. Students can also read RBSE Class 11 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 11 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 11 Chemistry Chapter 7 Notes साम्यावस्था
→ अभिक्रियाएँ मुख्यतः दो प्रकार की होती हैं - अनुत्क्रमणीय तथा उत्क्रमणीय ।
→ साम्यावस्था–किसी उत्क्रमणीय अभिक्रिया में जब अग्र अभिक्रिया का वेग, प्रतीप अभिक्रिया के वेग के बराबर हो जाता है तो इस स्थिति को साम्यावस्था कहते हैं ।
→ साम्य गतिक होता है ।
→ साम्य पर निकाय के सभी मापनीय गुण, जैसे- सान्द्रता, दाब इत्यादि स्थिर रहते हैं ।
→ साम्य, अभिक्रिया के प्रकार के आधार पर भौतिक, रासायनिक या आयनिक हो सकता है।
→ भौतिक साम्यों के उदाहरण निम्न हैं
- ठोस ⇌ द्रव
- द्रव ⇌ गैस
- गैस ⇌ ठोस
→ एक वायुमण्डलीय दाब पर किसी शुद्ध पदार्थ का वह ताप जिस पर उसकी ठोस एवं द्रव प्रावस्थाएँ साम्यावस्था में होती हैं, उसे पदार्थ का मानक गलनांक कहते हैं ।
→ एक वायुमण्डलीय दाब पर किसी शुद्ध द्रव का वह ताप जिस पर द्रव तथा उसकी वाष्प साम्यावस्था में होते हैं, उसे द्रव का क्वथनांक कहते हैं। हेनरी का नियम-निश्चित ताप पर, विलायक की दी गई मात्रा में घुली हुई गैस की मात्रा, विलायक के ऊपर गैस के दाब के समानुपाती होती है।
→ द्रव्यअनुपाती क्रिया का नियम-एक रासायनिक अभिक्रिया में किसी अभिकारक की क्रिया करने की दर उसके सक्रिय द्रव्यमान (मोलर सान्द्रता) के समानुपाती होती है तथा अभिक्रिया की दर इसके सभी अभिकारकों के सक्रिय द्रव्यमानों के गुणनफल के समानुपाती होती है।

→ किसी पदार्थ के एक लीटर आयतन में उपस्थित मोलों की संख्या को उसका सक्रिय द्रव्यमान या मोलरता कहते हैं।
→ समांगी अभिक्रिया aA + bB ⇌ cc + dD के लिए Kc = \(\frac{[\mathrm{C}]^{\mathrm{c}}[\mathrm{D}]^{\mathrm{d}}}{[\mathrm{A}]^{\mathrm{a}}[\mathrm{B}]^{\mathrm{b}}}\)
Kc = साम्य स्थिरांक तथा दायीं ओर का व्यंजक - साम्य स्थिरांक व्यंजक कहलाता है।
→ उत्क्रम (विपरीत) अभिक्रिया का साम्यावस्था स्थिरांक अग्र अभिक्रिया के साम्यावस्था स्थिरांक का व्युत्क्रम होता है। Kc1 = \(\frac{1}{K_c}\)
→ पदार्थों की भौतिक अवस्था के आधार पर अभिक्रियाओं को दो भागों में वर्गीकृत किया जाता है
- समांगी अभिक्रिया
- विषमांगी अभिक्रिया।
→ गैसीय अभिक्रिया के लिए साम्य स्थिरांक Kc के साथ Kp भी प्रयुक्त करते हैं जिसके लिए सान्द्रता के स्थान पर आंशिक दाब प्रयुक्त करते हैं।
→ Kp तथा Kc में निम्न सम्बन्ध होता है- Kp = Kc(RT)Δn
यहाँ R = गैस स्थिरांक, T = परम ताप तथा Δn = गैसीय उत्पादों के कुल मोल – गैसोय अभिकारकों के कुल मोल।
→ K. का मात्रक (mol L-1)Δn तथा K, का मात्रक (bar)Δn या (P)Δn या (atm)Δn होता है।
→ विषमांगी साम्य के लिए साम्य स्थिरांक लिखते समय शुद्ध ठोस तथा द्रव को छोड़ दिया जाता है क्योंकि इनकी मोलर सान्द्रता स्थिर (इकाई) मानी जाती है।
→ साम्यावस्था स्थिरांक अभिकारकों की प्रकृति, अभिक्रिया की रससमीकरणमिति तथा ताप पर निर्भर करता है।
→ K. का मान अधिक होने पर साम्य पर उत्पादों की सान्द्रता, अभिकारकों की सान्द्रता से अधिक होगी।
→ अभिक्रिया भागफल (Qc) की तुलना Kc से करके अभिक्रिया की दिशा ज्ञात की जा सकती है।
- Qc = Kc (साम्य)
- Qc > Kc पश्च अभिक्रिया होगी तथा
- Qc < Kc तो अग्र अभिक्रिया होगी।
→ Kc Qc तथा G में निम्न सम्बन्ध होता है
ΔG = ΔGR + RT InQc
साम्य पर ΔG = 0 Qc = Kc
0 = ΔG° + RT InKc
ΔG° = - RT InKc
→ ला-शातेलिए का सिद्धान्त—किसी साम्य पर सान्द्रण, दाब एवं ताप में परिवर्तन करने पर, साम्यावस्था उस दिशा में विस्थापित होती है जिससे निकाय पर लगाया हुआ प्रभाव कम अथवा समाप्त हो जाए।
→ साम्य अवस्था को प्रभावित करने वाले कारक निम्न हैं
- सान्द्रता
- दाब
- ताप
- अक्रिय गैस
- उत्प्रेरक।
→ अभिकारकों की सान्द्रता में वृद्धि अथवा उत्पादों की सान्द्रता कम करने पर साम्यावस्था अग्र दिशा में विस्थापित होती है तथा अभिकारकों की सान्द्रता कम या उत्पादों की सान्द्रता में वृद्धि करने पर साम्यावस्था पश्च दिशा में विस्थापित होती है।
→ दाब में वृद्धि करने पर गैसीय अभिक्रियाओं में साम्यावस्था उस दिशा में विस्थापित होती है जिधर गैस के मोलों की संख्या कम होती है।
→ ऊष्माक्षेपी अभिक्रिया में ताप बढ़ाने पर पश्च अभिक्रिया का वेग बढ़ता है अत: K. का मान कम होगा तथा ऊष्माशोषी अभिक्रियाओं में ताप बढ़ाने पर अग्र अभिक्रिया का वेग बढ़ता है अत: K. का मान भी बढ़ेगा।
→ उत्प्रेरक साम्यावस्था संगठन को प्रभावित नहीं करता किन्तु अभिक्रिया की गति को बढ़ाता है।
→ पदार्थ दो प्रकार के होते हैं
- विद्युत अनअपघट्य तथा
- विद्युत अपघट्य ।
→ वे पदार्थ जो गलित अवस्था तथा जलीय विलयन में विद्युत का चालन करते हैं उन्हें विद्युत अपघट्य कहते हैं। जैसे-अम्ल, क्षारक तथा लवण।
→ प्रबल विद्युत अपघट्यों का वियोजन पूर्ण होता है जबकि दुर्बल विद्युत अपघट्यों में आयनित एवं अनआयनित रूपों के मध्य साम्य होता है।
→ प्रारम्भ में लिए गए विद्युत अपघट्य का जितना अंश (%) साम्य पर आयनित हो जाता है उसे आयनन की मात्रा कहते हैं।
→ आरेनियस के अनुसार, अम्ल, जलीय विलयन में हाइड्रोजन आयन (H+) तथा क्षारक, हाइड्रॉक्सिल (OH-) आयन देते हैं।
→ ब्रन्स्टेद-लौरी के अनुसार, अम्ल वे पदार्थ हैं जो प्रोटॉन देते हैं तथा क्षार वे पदार्थ हैं जो प्रोटॉन ग्रहण करते हैं।

→ एक ब्रन्स्टेद-लौरी अम्ल जब एक क्षारक से क्रिया करता है तो इसका संगत संयुग्मी क्षारक बनता है तथा क्रिया करने वाले क्षारक के संगत संयुग्मी अम्ल बनता है।
→ लूइस के अनुसार, अम्ल इलेक्ट्रॉन युग्म ग्राही तथा क्षारक इलेक्ट्रॉन युग्म दाता होते हैं।
→ अम्ल वियोजन स्थिरांक [Ka] के ऋणात्मक लॉग को pKa कहते हैं।
pK, = - log Ka, इसी प्रकार pKb = - log Kb (Kb = क्षार वियोजन स्थिरांक)
→ जल का आयनिक गुणनफल (Kw) = [H3O+] [OH] अतः (pKw = pH + pOH) = 14 39.
→ 298 K पर K. का मान = 1 × 10-14 M2 होता है।
→ शुद्ध जल की मोलरता = 55.55 M होती है।
→ वियोजित तथा अवियोजित जल का अनुपात लगभग 2 × 10-9 होता है।
→ जल का आयनन स्थिरांक (K) = \(\frac{\mathrm{K}_{\mathrm{w}}}{\left[\mathrm{H}_2 \mathrm{O}\right]}\) = 1.8 × 10-16 होता है।
→ pH—हाइड्रोजन आयन सान्द्रता (सक्रियता) के ऋणात्मक लघुगणक (लॉग) को pH कहते हैं।
pH = - log [H+] = - log [H3O+]
→ अम्लीय विलयन की pH < 7, क्षारीय विलयन की pH > 7 तथा उदासीन विलयन की pH = 7 होती है।
→ अम्ल की प्रबलता ∝ Ka ∝ \(\frac{1}{\mathrm{pK}_{\mathrm{a}}}\)
तथा क्षार की प्रबलता ∝ Kb ∝ \(\frac{1}{\mathrm{pK}_{\mathrm{b}}}\).
→ किसी दुर्बल अम्ल के लिए Ka = \(\frac{\mathrm{C} \alpha^2}{1-\alpha}\) (C = सान्द्रता)
(α = आयनन की मात्रा)
- α = \(\sqrt{\frac{\mathrm{K}_{\mathrm{a}}}{\mathrm{C}}}\)
- [H3O+] = Cα
- [H3O+] = \(\sqrt{{C . K}_{\mathrm{a}}}\)
→ किसी दुर्बल क्षार के लिए Kb = \(\frac{C \alpha^2}{1-\alpha}\)
- α = \(\sqrt{\frac{\mathrm{K}_{\mathrm{b}}}{\mathrm{C}}}\)
- [OH-] = Cα
- [OH-] = \(\sqrt{\mathrm{CK}_{\mathrm{b}}}\)
→ ओस्टवाल्ड का तनुता नियम-किसी दुर्बल विद्युत अपघट्य के आयनन की मात्रा आयतन के वर्गमूल के समानुपाती होती है।
→ दुर्बल अम्लों तथा दुर्बल क्षारों की आपेक्षिक प्रबलता निम्न सूत्रों से ज्ञात की जा सकती है[H],
- \(\frac{\alpha_1}{\alpha_2}=\sqrt{\frac{\mathrm{K}_{\mathrm{a}_1}}{\mathrm{~K}_{\mathrm{a}_2}}}=\frac{\left[\mathrm{H}^{+}\right]_1}{\left[\mathrm{H}^{+}\right]_2}\)
- \(\frac{\alpha_1}{\alpha_2}=\sqrt{\frac{\mathrm{K}_{\mathrm{b}_1}}{\mathrm{~K}_{\mathrm{b}_2}}}=\frac{\left[\mathrm{OH}^{-}\right]_1}{\left[\mathrm{OH}^{-}\right]_2}\)
→ किसी संयुग्मी अम्ल क्षार युग्म के लिए Ka × Kb = Kw
तथा pKa + pKb = pKw = 14
→ दो या दो से अधिक अभिक्रियाओं को जोड़ने पर उनकी परिणामी अभिक्रिया का साम्यावस्था स्थिरांक प्रत्येक अभिक्रिया के साम्यावस्था स्थिरांक के गुणनफल के बराबर होता है।
Kपरिणामी (Kनेट) = K1 × K2 × K3 ...........
→ बहुक्षारकी अम्लों के लिए Ka1 > Ka2 > Ka3 तथा बहुअम्लीय क्षारकों के लिए Kb1 >Kb2 > Kb3
→ अम्लीय गुण का बढ़ता क्रम
- HF < HCl < HBr < HI
- CH4 < NH3 < H2O < HF

→ समआयन प्रभाव—किसी दुर्बल विद्युत अपघट्य के विलयन में समआयन युक्त, प्रबल विद्युत अपघट्य मिलाने पर दुर्बल विद्युत अपघट्य की वियोजन की मात्रा कम हो जाती है, इसे सम- आयन प्रभाव कहते हैं।
→ लवण जल अपघटन—किसी लवण की जल से क्रिया होने पर विलयन की pH में परिवर्तन होता है, इस प्रक्रम को लवण जल अपघटन कहते हैं।
→ लवण चार प्रकार के होते हैं—
- प्रबल अम्ल तथा प्रबल क्षार (SA + SB) से बना लवण-pH = 7 उदासीन विलयन
- प्रबल अम्ल तथा दुर्बल क्षार (SA + WB) से बना लवण-pH <7 (अम्लीय विलयन)
- दुर्बल अम्ल तथा प्रबल क्षार (WA + SB) से बना लवण pH > 7 (क्षारीय विलयन)
- दुर्बल अम्ल तथा दुर्बल क्षार (WA + WB) से बना लवण
- pH = 7 विलयन उदासीन (जब Ka = Kb)
- pH <7 हल्का अम्लीय (Ka > Kb)
- pH > 7 हल्का क्षारीय हो सकता है। (Ka < Kb)
→ WA + SB से बने लवण के लिए
- Kh = \(\frac{\mathrm{K}_{\mathrm{w}}}{\mathrm{K}_{\mathrm{a}}}\) (Kh = जल अपघटन स्थिरांक)
- जल अपघटन की मात्रा h = \(\sqrt{\frac{\mathrm{K}_{\mathrm{h}}}{\mathrm{c}}}\)
- विलयन की pH = 7 + \(\frac{1}{2}\)pKa + \(\frac{1}{2}\)log C
→ SA + WB से बने लवण के लिए
- Kh = \(\frac{K_w}{K_b}\)
- h = \(\sqrt{\frac{\mathrm{K}_{\mathrm{h}}}{\mathrm{c}}}\)
- pH = 7 - \(\frac{1}{2}\)pKa - \(\frac{1}{2}\)log C
→ WA + WB से बने लवण के लिए
- Kh = \(\frac{\mathrm{K}_{\mathrm{w}}}{\mathrm{K}_{\mathrm{a}} \times \mathrm{K}_{\mathrm{b}}}\)
- h = \(\sqrt{\mathrm{K}_{\mathrm{h}}}\)
- pH = 7 + \(\frac{1}{2}\)(pKa - pKb)
अतः दुर्बल अम्ल तथा दुर्बल क्षार से बने लवण की जल अपघटन की मात्रा (h) तथा इसके विलयन की pH, सान्द्रता (या आयतन) पर निर्भर नहीं करती है।
→ बफर विलयन—वह विलयन, जिसको तनु करने पर या जिसमें अम्ल या क्षारक की कुछ मात्रा मिलाने पर उसका pH अपरिवर्तित रहता है उसे बफर विलयन कहते हैं। इसमें समआयन प्रभाव का सिद्धान्त लगता है।
→ बफर दो प्रकार के होते हैं
- मिश्रित बफर
(a) अम्लीय बफर-दुर्बल अम्ल तथा इसका किसी प्रबल क्षार से बने लवण का मिश्रण। उदाहरण-CH3COOH + CH3COONa
(b) क्षारीय बफर-दुर्बल क्षार तथ इसका किसी प्रबल अम्ल से बने लवण का मिश्रण। उदाहरण-NH4OH + NH4Cl - सरल बफर-दुर्बल अम्ल तथा दुर्बल क्षार से बने लवण का विलयन उदाहरण CH3COONH4
→ अम्लीय बफर विलयन की
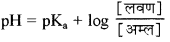
→ जब [लवण] = अम्ल तो pH = pKa, इस स्थिति में बफर क्रिया अधिकतम होती है।

→ अम्लीय बफर की pH परास = pKa + 1
→ क्षारीय बफर विलयन की
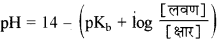
→ विलेयता (s)-निश्चित ताप पर किसी पदार्थ के संतृप्त विलयन में घुली हुई विलेय की अधिकतम मात्रा को उसकी विलेयता कहते हैं।
→ विलेयता गुणनफल (Ksp) -किसी विद्युत अपघट्य के संतृप्त विलयन में उपस्थित धनायनों तथा ऋणायनों की सान्द्रताओं के गुणनफल को विलेयता गुणनफल कहते हैं।
→ किसी लवण MxXy के लिए विलेयता (s) तथा विलेयता गुणनफल में सम्बन्ध
MxXy == xM* + yX:-
Ksp = xx.yy.s(x+y)
- एक-एकसंयोजी, द्वि-द्विसंयोजी तथा त्रि-त्रिसंयोजी विद्युत अपघट्य के लिए-Ksp = s2 (उदाहरण AgCl)
- एक द्विसंयोजी विद्युत अपघट्य के लिए-Ksp = 4s3 (उदाहरण Fe(OH)2)
- एक त्रिसंयोजी विद्युत अपघट्य के लिए-Ksp = 27s4 (उदाहरण Fe(OH)3)
- द्वि-त्रिसंयोजी विद्युत अपघट्य के लिए-Ksp = 108s5 (उदाहरण Ca(PO)2)
→ अवक्षेपण की शर्त-किसी पदार्थ (विद्युत अपघट्य) के अवक्षेपण के लिए उसके आयनिक गुणनफल (Qsp) का मान, विलेयता गुणनफल (Ksp) से अधिक होना चाहिए।
→ किसी विद्युत अपघट्य के लिए जब Ksp < Qsp तो यह विद्युत अपघट्य विलेय होगा।
→ साम्यावस्था पर विद्युत अपघट्य के लिए Ksp = Qsp
→ आयनिक लवणों में समआयन मिलाने पर उनकी विलेयता कम हो जाती है।
→ दुर्बल अम्लों के लवणों के विलयन की pH होने पर लवण की विलेयता बढ़ती है।
→ क्षारीय मूलकों के II समूह में अम्लीय माध्यम तथा IV समूह में क्षारीय माध्यम का प्रयोग किया जाता है।
→ क्षारीय मूलकों के III समूह में NH4OH के साथ थोड़ा-सा NH4Cl मिलाया जाता है तथा कुछ बूंदें सान्द्र HNO3 की भी प्रयुक्त की जाती हैं।
→ विलेयता गुणनफल के प्रयोग से नमक का शोधन तथा साबुन का लवणन किया जाता है।

- RBSE Class 11 Chemistry Important Questions Chapter 2 Structure of Atom
- RBSE Solutions for Class 11 Chemistry Chapter 14 Environmental Chemistry
- RBSE Solutions for Class 11 Chemistry Chapter 13 Hydrocarbons
- RBSE Solutions for Class 11 Chemistry Chapter 12 Organic Chemistry - Some Basic Principles and Techniques
- RBSE Solutions for Class 11 Chemistry Chapter 11 The p-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 10 The s-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 9 Hydrogen
- RBSE Solutions for Class 11 Chemistry Chapter 8 Redox Reactions
- RBSE Solutions for Class 11 Chemistry Chapter 7 Equilibrium
- RBSE Solutions for Class 11 Chemistry Chapter 6 Thermodynamics
- RBSE Solutions for Class 11 Chemistry Chapter 5 States of Matter