RBSE Class 11 Chemistry Notes Chapter 12 कार्बनिक रसायन : कुछ आधारभूत सिद्धांत तथा तकनीकें
These comprehensive RBSE Class 11 Chemistry Notes Chapter 12 कार्बनिक रसायन : कुछ आधारभूत सिद्धांत तथा तकनीकें will give a brief overview of all the concepts.
Rajasthan Board RBSE Solutions for Class 11 Chemistry in Hindi Medium & English Medium are part of RBSE Solutions for Class 11. Students can also read RBSE Class 11 Chemistry Important Questions for exam preparation. Students can also go through RBSE Class 11 Chemistry Notes to understand and remember the concepts easily.
RBSE Class 11 Chemistry Chapter 12 Notes कार्बनिक रसायन : कुछ आधारभूत सिद्धांत तथा तकनीकें
→ कार्बनिक रसायन-कार्बनिक रसायन के अन्तर्गत कार्बन के यौगिकों का अध्ययन किया जाता है। लेकिन आधुनिक परिभाषा के अनुसार कार्बनिक रसायन, रसायन विज्ञान की वह शाखाहै जिसके अन्तर्गत हाइड्रोकार्बन तथा इनके व्युत्पन्नों का अध्ययन किया जाता है।
→ कार्बनिक यौगिकों के स्रोत-जीव-जन्तु, पेड़-पौधे, - कोलतार तथा पेट्रोलियम इत्यादि कार्बनिक यौगिकों के स्रोत हैं।
→ कार्बनिक यौगिकों का महत्व-भोजन, कपड़ा, ईंधन, औषधियाँ, यातायात, घरेलू उपयोग की वस्तुएँ इत्यादि सभी पदार्थों का सम्बन्ध कार्बनिक यौगिकों से ही होता है।
→ केकुले के अनुसार कार्बन परमाणु चतुर्संयोजी होता है तथा इसमें शृंखलन का गुण पाया जाता है।
→ लेबेल तथा वान्ट हॉफ के अनुसार कार्बन की चारों संयोजकताएँ एक समचतुष्फलक के चारों कोनों की ओर निर्देशित होती हैं तथा कार्बन परमाणु इस चतुष्फलक के केन्द्र पर स्थिर होता
→ संकरण में s गुण बढ़ने पर परमाणु की विद्युतऋणता बढ़ती है लेकिन बन्ध लम्बाई कम होती है।

→ संरचनात्मक सूत्र-अणु में उपस्थित परमाणुओं के मध्य सभी बन्धों को दर्शाता है।
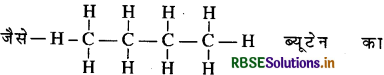
संरचनात्मक सूत्र है।
→ संघनित संरचनात्मक सूत्र-यह अणु में उपस्थित समूहों को दर्शाता है। जैसे CH3(CH2)2CH3, ब्यूटेन का संघनित संरचनात्मक सूत्र है।
→ आबन्ध रेखा संरचनात्मक सूत्र-यह केवल रेखाओं द्वारा प्रदर्शित संरचनात्मक सूत्र होता है, जैसे- ब्यूटेन।
→ त्रिविमीय सूत्र-किसी अणु के पेपर पर प्रदर्शित त्रिविमीय रूप को त्रिविमीय सूत्र कहते हैं।
→ विवृत श्रृंखला यौगिक-ये खुली श्रृंखला वाले | यौगिक होते हैं तथा इन्हें ऐलीफैटिक यौगिक भी कहा जाता है।
→ संवृत श्रृंखला यौगिक-इन यौगिकों में बन्द श्रृंखला होती है। वलय में केवल कार्बन परमाणुयुक्त यौगिकों को समचक्रीय तथा कम से कम एक अन्य परमाणु (कार्बन के अतिरिक्त) युक्त यौगिकों को विषमचक्रीय यौगिक कहते हैं।
→ क्रियात्मक समूह-कार्बनिक यौगिक का वह भाग (परमाणु या परमाणुओं का समूह) जो उस यौगिक के विशिष्ट रासायनिक गुणों के लिए उत्तरदायी होता है उसे क्रियात्मक समूह कहते हैं। जैसे हाइड्रॉक्सिल समूह (-OH), ऐल्डिहाइड समूह (CHO) इत्यादि।
→ सजातीय श्रेणी-कार्बनिक यौगिकों की ऐसी श्रेणी जिसमें एक विशिष्ट क्रियात्मक समूह उपस्थित होता है तथा इस श्रेणी के सभी यौगिकों के रासायनिक गुण समान होते हैं एवं इनके अणु सूत्रों में एक या अधिक >CH2. का अन्तर होता है, इसे सजातीय श्रेणी कहते हैं तथा इस श्रेणी के सदस्यों को एक दूसरे के सजात कहते हैं।
→ कार्बन परमाणु चार प्रकार के होते हैं-प्राथमिक (1), द्वितीयक (2), तृतीयक (3) तथा चतुष्क (4) लेकिन हाइड्रोजन परमाणु केवल तीन प्रकार के ही होते हैं-1 , 2 तथा 3
→ कार्बनिक यौगिकों के नामकरण की तीन पद्धतियाँ होती हैं
- रूढ़ पद्धति या सामान्य नाम पद्धति,
- व्युत्पन्न पद्धति,
- आई.यू.पी.ए.सी. पद्धति।
→ रूढ़ पद्धति में यौगिक का नाम उसके स्रोत, विशिष्ट गुण तथा उपयोग इत्यादि के आधार पर दिया जाता है।
→ ऐल्केन के एक संयोजी मूलक ऐल्किल कहलाते हैं।
→ व्युत्पन्न पद्धति में यौगिक का नाम उस सजातीय श्रेणी के जनक यौगिक के व्युत्पन्न के रूप में दिया जाता है।
→ कार्बनिक यौगिकों के नामकरण की IUPAC पद्धति निम्नलिखित मुख्य नियमों पर आधारित है
- सर्वाधिक कार्बन परमाणुओं से बनी मूल श्रृंखला का चयन करना।
- जब यौगिकों में क्रियात्मक समूह उपस्थित होता है तो ऐसी सबसे लम्बी कार्बन श्रृंखला का चयन करना जिसके किसी कार्बन से क्रियात्मक समूह जुड़ा होता है।
- श्रृंखला के कार्बन परमाणुओं का अंकन उस सिरे से प्रारम्भ करना जिधर से क्रियात्मक समूह या प्रतिस्थापी निकटतम है।
- मूल श्रृंखला में विद्यमान कार्बन परमाणुओं की संख्या के आधार पर यह निश्चित करना कि दिया हुआ यौगिक किस हाइड्रोकार्बन का व्युत्पन्न है।
- मुख्य क्रियात्मक समूह को अनुलग्न के द्वारा तथा अन्य समूहों और प्रतिस्थापियों को पूर्वलग्न के द्वारा प्रदर्शित करना। मुख्य क्रियात्मक समूह के अतिरिक्त अन्य समूहों को भी प्रतिस्थापी ही माना जाता है।
- यौगिक का नाम लिखते समय सर्वप्रथम प्रतिस्थापियों को अंग्रेजी वर्णमाला क्रम में फिर जनक हाइड्रोकार्बन और अन्त में मुख्य क्रियात्मक समूह का अनुलग्न लिखा जाता है।
- दो अंकों के बीच में अर्द्ध विराम (,) तथा अंक और नाम के बीच में हाइफन (-) लगाते हैं, जैसे-2-क्लोरो-3, 4डाइमेथिलहेक्सेन-1-ऑल।
- चक्रीय यौगिकों के नाम में साइक्लो शब्द प्रयुक्त किया जाता है। एरोमैटिक यौगिकों जैसे-बेन्जीन तथा इसके व्युत्पन्नों के नाम से पहले बेन्जीन वलय से जुड़े प्रतिस्थापी का नाम, पूर्वलग्न के रूप में तथा इसके पश्चात् बेन्जीन लिखा जाता है, लेकिन यौगिकों के रूढ़ नाम भी प्रचलन में हैं।

→ समावयवता-दो या दो से अधिक यौगिक जिनके अणु सूत्र समान होते हैं लेकिन उनके गुणों में भिन्नता होती है उन्हें एकदूसरे के समावयवी कहते हैं तथा इस गुण को समावयवता कहा जाता
→ समावयवता मुख्यतः दो प्रकार की होती है-संरचनात्मक समावयवता तथा त्रिविम समावयवता।
→ संरचनात्मक समावयवता-अणु सूत्रों की संरचना में भिन्नता के कारण उत्पन्न समावयवता संरचनात्मक समावयवता कहलाती है। यह श्रृंखला, स्थिति, क्रियात्मक समूह, मध्यावयवता एवं चलावयवता में वर्गीकृत की जाती है।
→ सहसंयोजक बन्ध का विदलन (विखण्डन) दो प्रकार से होता है, समांश तथा विषमांश। समांश विदलन में सहभाजित इलेक्ट्रान युग्म का एक-एक इलेक्ट्रॉन उन दोनों परमाणुओं पर चला जाता है जो यौगिक में परस्पर आबंधित होते हैं तथा इससे मुक्त मूलकों का निर्माण होता है। विषमांश विदलन में विदलित होने वाले आबन्ध के दोनों इलेक्ट्रॉन किसी एक परमाणु पर चले जाते हैं तथा इससे धनायन व ऋणायन बनते हैं।
→ कार्बधनायन (कार्बोकेटायन)-वे अस्थायी स्पीशीज हैं जिनमें कार्बन परमाणु पर धनावेश होता है। धनावेशित कार्बन के बाह्यतम कोश में छः इलेक्ट्रॉन होते हैं। ये सहसंयोजक बन्ध के विषमांश विखण्डन से बनते हैं । ये तीन प्रकार के होते हैं-प्राथमिक, द्वितीयक व तृतीयक। इनके स्थायित्व का क्रम निम्नलिखित हैतृतीयक > द्वितीयक > प्राथमिक। जैसे
(CH)3C+ > (CH)2C+H > C+H3CH2
धनावेशित कार्बन पर sp संकरण के कारण कार्बधनायन की ज्यामिति त्रिकोणीय समतल होती है। ये अत्यन्त क्रियाशील होते हैं एवं आयनिक अभिक्रियाओं में मध्यवर्ती के रूप में बनते हैं।
→ कार्बऋणायन (कार्बेनियन)-वे स्पीशीज हैं जिनमें कार्बन परमाणु पर ऋण आवेश होता है। ये भी सहसंयोजक आबन्ध के विषमांश विखण्डन से उत्पन्न होते हैं। ये प्राथमिक, द्वितीयक एवं तृतीयक तीन प्रकार के होते हैं तथा इनके स्थायित्व का क्रम प्राथमिक > द्वितीयक > तृतीयक होता है। जैसे-CH3CH2 > (CH3)2CH > (CH3)3C। ऋणावेशित कार्बन पर sp3 संकरण के कारण ये पिरामिडीय ज्यामिति होते हैं। ये अत्यन्त क्रियाशील होते हैं तथा अनेक अभिक्रियाओं में मध्यवर्ती के रूप में बनते हैं। इनमें ऋणावेशित कार्बन के बाह्यतम कोश में आठ इलेक्ट्रॉन होते हैं।
→ मुक्त मूलक-उदासीन परमाणु या परमाणुओं का ऐसा समूह जिनके पास अपना साझे का इलेक्ट्रॉन होता है, उन्हें मुक्त मूलक कहते हैं। इन्हें विषम इलेक्ट्रॉन स्पीशीज भी कहते हैं, जैसेCH, (CH3)3CH, Cl इत्यादि। ये अत्यधिक अस्थायी होते हैं। मुक्त मूलकों के स्थायित्व का क्रम भी कार्बधनायन के समान ही होता है।
- इलेक्ट्रॉनस्नेही-अभिक्रिया में इलेक्ट्रॉन युग्म ग्रहण करने वाले अभिकर्मक इलेक्ट्रॉनस्नेही कहलाते हैं। धनायन या उदासीन अणु जिनमें अपूर्ण अष्टक अथवा अष्टक का प्रसार होता है, इलेक्ट्रॉनस्नेही होते हैं; जैसे-CH3, NO2, X+, AlCl3, PCl5 इत्यादि।
- नाभिकस्नेही-अभिक्रिया में इलेक्ट्रॉन युग्म दान करने वाला अभिकर्मक नाभिकस्नेही कहलाता है। ऋणायन (ऐनायन) या उदासीन अणु जिनके पास दान करने के लिये एकाकी इलेक्ट्रॉन युग्म होता है, नाभिक स्नेही होते हैं; जैसेOH, R3C:, H2O, NH3, :NH2, इत्यादि।
→ प्रेरणिक प्रभाव-किसी सहसंयोजक यौगिक की कार्बन श्रृंखला में कार्बन से भिन्न विद्युत ऋणात्मक परमाणु या समूह की उपस्थिति के कारण कार्बन श्रृंखला में होने वाला इलेक्ट्रॉन विस्थापन प्रेरणिक प्रभाव कहलाता है। समूह या परमाणु जो कार्बन | से अधिक विद्युत ऋणात्मक होते हैं वे - I प्रभाव (इलेक्ट्रॉन आकर्षी) तथा जो कम ऋण विद्युती होते हैं वे + I प्रभाव (इलेक्ट्रॉन प्रतिकर्षी) दर्शाते हैं।
→ ऐल्किल समूह +I प्रभाव दर्शाते हैं जबकि -NO2; - CN, COOH, –X इत्यादि -I प्रभाव दर्शाते हैं।
→ सामान्यतः +I प्रभाव बढ़ने पर कार्बोक्सिलिक अम्लों की अम्लीय प्रबलता कम होती है जबकि –I प्रभाव बढ़ने पर अम्लीय प्रबलता बढ़ती है।
→ अनुनाद-यदि किसी यौगिक की एक से अधिक संरचनाएँ संभव हैं तो उनमें से किसी एक संरचना द्वारा उस यौगिक के सभी गुणों को नहीं समझाया जा सकता है तो इन संरचनाओं को अनुनादी संरचनाएँ या केनोनिकल रूप कहते हैं तथा वास्तविक यौगिक इन सभी संरचनाओं के मिश्रित रूप (अनुनाद संकर) के समान व्यवहार करता है तो इस गुण को अनुनाद कहते हैं। अनुनाद के लिए यौगिक में संयुग्मित निकाय का होना आवश्यक है।
→ संयुग्मित निकाय-एकान्तर एकल बन्ध तथा द्वि-बन्ध युक्त निकाय या ऐसा निकाय जिसमें एकाकी इलेक्ट्रॉन युग्म युक्त परमाणु एक द्विबन्ध से बन्धित परमाणु के साथ जुड़ा होता है, तो इसे संयुग्मित निकाय कहते हैं; जैसे
CH2 = CH - CH = CH2, :Cl-CH = CH2,
→ अनुनाद प्रभाव या मेसोमरी प्रभाव-दो 7 आबंधों की अन्योन्य क्रिया अथवा बन्ध एवं समीप के परमाणु पर उपस्थित एकाकी इलेक्ट्रॉन युग्म के मध्य अन्योन्य क्रिया के कारण किसी अणु में उत्पन्न ध्रुवता को अनुनाद प्रभाव या मेसोमरी प्रभाव कहते हैं। यह दो प्रकार का होता है
- + M या + R प्रभाव तथा
- -M या – R प्रभाव
→ इलेक्ट्रोमरी प्रभाव-आक्रमणकारी अभिकर्मक की मांग पर साझित π इलेक्ट्रॉन युग्म का बहुबंध से बंधित एक परमाणु पर पूर्ण रूप से विस्थापित होना इलेक्ट्रोमरी प्रभाव कहलाता है। यह एक अस्थायी प्रभावी है।
→ अतिसंयुग्मन-अतिसंयुग्मन में किसी असंतृप्त निकाय के परमाणु से सीधे बंधित ऐल्किल समूह के C-H आबंध अथवा असहभाजित p-कक्षक वाले परमाणु के ० इलेक्ट्रानों का विस्थानीकरण होता है अतः इसे बन्ध अनुनाद भी कहा जाता है। यह एक स्थायी प्रभाव है।
→ कार्बनिक अभिक्रियाएँ मुख्यतः चार प्रकार की होती हैं
- प्रतिस्थापन अभिक्रियाएँ
- संकलन या योगात्मक अभिक्रियाएँ
- विलोपन अभिक्रियाएँ तथा
- पुनर्विन्यास अभिक्रियाएँ।

→ प्रतिस्थापन अभिक्रिया-वह अभिक्रिया जिसमें किसी यौगिक का एक या अधिक परमाणु या समूह किसी अन्य परमाणु या समूह से प्रतिस्थापित होते हैं उसे प्रतिस्थापन अभिक्रिया कहते हैं। यह अभिक्रिया मुक्त मूलक, इलेक्ट्रॉनस्नेही या नाभिकस्नेही के द्वारा होती है।
→ योगात्मक अभिक्रिया-वह अभिक्रिया जिसमें असंतप्त यौगिकों में एक या अधिक अणु का योग होता है उसे योगात्मक अभिक्रिया कहते हैं। यह इलेक्ट्रॉनस्नेही, नाभिकस्नेही और मुक्तमूलक के आक्रमण द्वारा होती है। जैसे-ऐल्कीन तथा ऐल्काइन पर ब्रोमीन का योग।
→ विलोपन अभिक्रिया-वह अभिक्रिया जिसमें किसी अणु में से परमाणुओं या समूहों का विलोपन होकर अतिरिक्त बन्ध बनते हैं उसे विलोपन अभिक्रिया कहते हैं। जैसे-ऐल्कोहॉल का अम्ल उत्प्रेरित निर्जलन और ऐल्किल हैलाइड का क्षारक उत्प्रेरित विहाइड्रोहैलोजनीकरण।
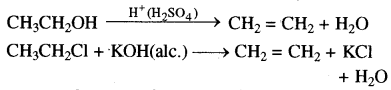
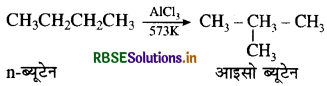
→ आण्विक पुनर्विन्यास-पुनर्विन्यास वह अभिक्रिया है जिसमें कोई परमाणु या समूह एक अणु के अन्दर ही एक स्थान से दूसरे स्थान पर अभिगमन कर जाता है तथा नए यौगिक का निर्माण होता है। जैसे
→ कार्बनिक यौगिकों का शोधन विभिन्न विधियों द्वारा किया जाता है। जैसे-ऊर्ध्वपातन, क्रिस्टलन, आसवन, विभेदी निष्कर्षण तथा वर्णलेखन।
→ ऊर्ध्वपातन-किसी ठोस पदार्थ को शीघ्रता से गर्म करने पर उसका सीधे ही वाष्प अवस्था में परिवर्तन ऊर्ध्वपातन कहलाता
→ क्रिस्टलन-किसी अशुद्ध पदार्थ के गर्म तथा संतृप्त विलयन को ठण्डा करके शुद्ध पदार्थ के क्रिस्टल प्राप्त करना क्रिस्टलन कहलाता है।
→ प्रभाजी क्रिस्टलन-एक ही विलायक में भिन्न-भिन्न विलेयता वाले दो या दो से अधिक पदार्थों के मिश्रण के गर्म तथा संतृप्त विलयन को ठण्डा करके बारी-बारी से शुद्ध अवयवी पदार्थों के क्रिस्टल प्राप्त करना प्रभाजी क्रिस्टलन कहलाता है। इसमें पहले कम विलेयशील तथा फिर अधिक विलेयशील पदार्थ के क्रिस्टल प्राप्त होते हैं।
→ आसवन-किसी अशुद्ध द्रव के वाष्पन तथा वाष्प के संघनन की प्रक्रिया द्वारा शुद्ध पदार्थ प्राप्त करने की प्रक्रिया को आसवन कहते हैं।
→ प्रभाजी आसवन-भिन्न-भिन्न क्वथनांक वाले द्रवों के मिश्रण के आसवन द्वारा अवयवी द्रवों को पृथक् करना प्रभाजी आसवन कहलाता है। इसमें पहले कम क्वथनांक वाला तथा बाद में अधिक क्वथनांक वाला द्रव पृथक् होता है।
→ कम दाब पर (निर्वात) आसवन-निर्वात द्वारा उपकरण का दाब कम करके आसवन करना निर्वात आसवन कहलाता है। यह ऐसे द्रवों का शोधन करने की विधि है जो अपने क्वथनांक से पहले अपघटित हो जाते हैं।
→ भाप आसवन-ज़ल में अविलेय तथा भाप में वाष्पशील पदार्थों को भाप के द्वारा गर्म करके आसवित करने की विधि को भाप आसवन कहते हैं। इसमें शुद्ध पदार्थ, आसुत में जल के साथ पृथक् परत बनाता है।
→ विलायक निष्कर्षण-किसी उपयुक्त विलायक के द्वारा. अशुद्ध पदार्थ में से शुद्ध पदार्थ को पृथक् करना विलायक निष्कर्षण या विभेदी निष्कर्षण कहलाता है।
→ कोमैटोग्रैफी (वर्णलेखन)-भिन्न-भिन्न अधिशोषकता वाले पदार्थों को स्थिर व गतिशील प्रावस्थाओं के मध्य वितरित करके पृथक् करने की विधि को वर्णलेखन कहते हैं।
→ कार्बनिक यौगिकों के गुणात्मक विश्लेषण के अन्तर्गत किसी यौगिक में उपस्थित विभिन्न तत्वों के परीक्षण द्वारा उनकी पहचान की जाती है। इसके लिए लैसें विलयन बनाया जाता है।

→ लैसें विलयन बनाना-कार्बनिक पदार्थ व सोडियम को गलाकर आसुत जल में घोलकर, उबालकर व छानकर निष्कर्ष प्राप्त करते हैं । इसे लैसें विलयन कहते हैं।
→ कार्बन व हाइड्रोजन का परीक्षण-पदार्थ को CuO के साथ गर्म करके उत्पन्न CO2, व H20 की पहचान की जाती है। CO2 की पहचान चूने के पानी से और H2O की पहचान निर्जल CuSO4 से करते हैं।
→ नाइट्रोजन का परीक्षण-लैसें विलयन + FeSO4 + एक बूंद सान्द्र H2SO4 → फेरि-फेरोसायनाइड का प्रशियन ब्लू विलयन।
→ सल्फर का परीक्षण-लैसें विलयन + सोडियम नाइट्रोपुसाइड → सोडियम थायोनाइट्रोप्साइड का बैंगनी विलयन।
→ हैलोजन का परीक्षण-लैसें विलयन + HNO3 + AgNO3 → Agx का श्वेत अवक्षेप जो NH4OH में विलेय है तो क्लोरीन, हल्का पीला अवक्षेप जो NH4OH में अल्प विलेय है तो ब्रोमीन तथा पीला अवक्षेप जो NH4OH में अविलेय है तो आयोडीन की उपस्थिति दर्शाता है।
→ फॉस्फोरस का परीक्षण-कार्बनिक यौगिक को किसी ऑक्सीकारक Na2O2, (सोडियम पराक्साइड) के साथ गर्म करके, । उसे सान्द्र नाइट्रिक अम्ल के साथ उबालकर छानते हैं। छनित में अमोनियम मॉलिब्डेट विलयन डालने पर अमोनियम फॉस्फोमॉलिब्डेट का पीला अवक्षेप प्राप्त होता है।
→ कार्बनिक यौगिकों के मात्रात्मक विश्लेषण में उसमें उपस्थित विभिन्न तत्वों की प्रतिशत मात्रा का निर्धारण किया जाता है। इसे उस तत्व का आकलन भी कहा जाता है।
→ कार्बन व हाइड्रोजन का आकलन-यौगिक की तुली हुई मात्रा को Cu0 तथा O2 के साथ गर्म करके उत्पन्न हुई CO2 व H2O की मात्रा ज्ञात करते हैं। सूत्र द्वारा प्रतिशत मात्रा की गणना कर लेते हैं।
→ नाइट्रोजन का आकलन
- ड्यूमा विधि-यौगिक की सूक्ष्म मात्रा को Cuo के साथ गरम करने पर उत्पन्न गैसीय मिश्रण को कॉपर के सम्पर्क में लाकर पदार्थ की समस्त नाइट्रोजन को गैसीय अवस्था में परिवर्तित करके एकत्रित कर लेते हैं। इसके आयतन को नापकर नाइट्रोजन की प्रतिशत मात्रा की गणना कर ली जाती है।
- कैल्डॉल विधि-कार्बनिक यौगिक में उपस्थित नाइट्रोजन को अमोनिया के रूप में परिवर्तित करके इसकी मात्रा से नाइट्रोजन की प्रतिशतता की गणना करते हैं।
→ हैलोजन के आकलन की कैरियस विधि-यौगिक को ठोस AgNO3, की उपस्थिति में HNO, के साथ गर्म करके समस्त हैलोजन को Agx के रूप में परिवर्तित कर लेते हैं। AgX की मात्रा ज्ञात करके हैलोजन की प्रतिशतता की गणना करते हैं।
→ सल्फर के आकलन की कैरियस विधि-यौगिक को सान्द्र नाइट्रिक अम्ल के साथ गर्म करके पदार्थ में उपस्थित सल्फर को H2SO4 के रूप में परिवर्तित करते हैं और फिर उसमें BaCl2, डालकर BaSO4 प्राप्त किया जाता है। इसकी मात्रा ज्ञात करके सल्फर की प्रतिशतता की गणना की जाती है।

→ फॉस्फोरस का आकलन-कार्बनिक यौगिक की ज्ञात मात्रा को सधूम HNO3 के साथ गर्म करके उसमें उपस्थित फॉस्फोरस को फॉस्फोरिक अम्ल में ऑक्सीकृत कर लिया जाता है। इसमें अमोनिया तथा अमोनियम मॉलिब्डेट मिलाकर अमोनियम फॉस्फोमॉलिब्डेट का अवक्षेप प्राप्त किया जाता है। इससे फॉस्फोरस की प्रतिशतता की गणना की जाती है।
→ ऑक्सीजन का आकलन-सामान्यतः किसी कार्बनिक यौगिक में ऑक्सीजन की प्रतिशतता की गणना कुल प्रतिशतता (100) में से अन्य तत्वों की प्रतिशतताओं के योग को घटाकर की जाती है। लेकिन इसका प्रत्यक्ष आकलन भी किया जा सकता है।

- RBSE Class 11 Chemistry Important Questions Chapter 2 Structure of Atom
- RBSE Solutions for Class 11 Chemistry Chapter 14 Environmental Chemistry
- RBSE Solutions for Class 11 Chemistry Chapter 13 Hydrocarbons
- RBSE Solutions for Class 11 Chemistry Chapter 12 Organic Chemistry - Some Basic Principles and Techniques
- RBSE Solutions for Class 11 Chemistry Chapter 11 The p-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 10 The s-Block Elements
- RBSE Solutions for Class 11 Chemistry Chapter 9 Hydrogen
- RBSE Solutions for Class 11 Chemistry Chapter 8 Redox Reactions
- RBSE Solutions for Class 11 Chemistry Chapter 7 Equilibrium
- RBSE Solutions for Class 11 Chemistry Chapter 6 Thermodynamics
- RBSE Solutions for Class 11 Chemistry Chapter 5 States of Matter